-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hygiena dýchacích cest u pacientů s Parkinsonovou nemocí – přehled problematiky a možnosti fyzioterapeutické intervence
Airway clearance in patients with Parkinson‘s disease – overview and possibilities of physiotherapeutic intervention
Up to 40% of patients with Parkinson‘s disease die due to pneumonia. In Parkinson‘s disease patients, the ability to maintain airway hygiene is often overlooked and not routinely assessed. Respiratory physiotherapy techniques can be used to make expectoration easier and more effective in these patients. The algorithm of choice of these techniques is governed by the results of cough efficiency and respiratory muscle strength examination.
Keywords:
Parkinson‘s disease – cough – peak cough fl ow – respiratory muscle strength – airway clearance techniques
Autoři: M. Srp; O. Gál; R. Korteová; R. Jech; E. Růžička; M. Hoskovcová
Působiště autorů: Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(4): 375-381
Kategorie: Přehledný referát
doi: https://doi.org/10.14735/amcsnn2020375Souhrn
Téměř 40 % pacientů s Parkinsonovou nemocí umírá v důsledku pneumonie. Schopnost zajištění hygieny dýchacích cest je u těchto pacientů často přehlížena a není objektivně vyšetřována. K usnadnění a zefektivnění expektorace u pacientů s Parkinsonovou nemocí lze využít vybrané techniky respirační fyzioterapie. Algoritmus volby těchto technik se řídí výsledky vyšetření efektivity expektorace a síly respiračního svalstva.
Klíčová slova:
Parkinsonova nemoc – expektorace – vrcholový průtok při kašli – síla dýchacích svalů – techniky hygieny dýchacích cest
Úvod
Parkinsonova nemoc (PN) je chronicko-progresivní neurodegenerativní onemocnění s typickým počátkem mezi 55. a 65. rokem života. Vzhledem k časté incidenci dysfagických obtíží (až 80 %) [1] a ke snížené efektivitě kašle [2] patří pneumonie mezi hlavní příčiny úmrtí pacientů s PN [3]. Díky stále se prodlužující době přežití a časnějšímu záchytu má prevalence pneumonie u těchto pacientů vzrůstající tendenci [4]. Za období od roku 1979 do 2010 se počet pacientů hospitalizovaných pro aspirační pneumonii 10× zvýšil [4].
Techniky hygieny dýchacích cest, které řadíme mezi postupy respirační fyzioterapie, napomáhají mobilizaci bronchiálního sekretu z periferních dýchacích cest směrem do centrálních a následnému odstranění. Díky těmto technikám lze pacientům s PN usnadnit a zefektivnit expektoraci. Efektivní expektorace působí preventivně i proti tvorbě hlenových zátek [5].
Zhodnocení efektivity expektorace je nutným předpokladem pro objektivizaci schopnosti zajistit hygienu dýchacích cest a nastavení optimální terapie. Ke změně proudění vzduchu nebo k vyvolání kašle nebo účinku podobného kašli lze použít různé dechové manévry, manuální techniky nebo mechanická zařízení. Přesto nejsou tyto techniky v praxi dostatečně využívány. Pouze malá část fyzioterapeutů v ČR nabízí pacientům s PN některou z metod respirační fyzioterapie [6].
Fyziologie expektorace
Kašel je ochranný mechanizmus sloužící k odstranění hlenu a cizích částic z dýchacích cest za využití vysokého výdechového proudu vzduchu [7]. Lze jej iniciovat volně nebo vybavit reflexně [8]. Reflexní expektorace je podmíněna stimulací mechanoreceptorů nebo chemoreceptorů inervovaných prostřednictvím n. vagus uložených v laryngu a trachei [9]. Informace z těchto receptorů míří do ventrolaterálních oblastí prodloužené míchy, kde se pravděpodobně nachází centrum pro regulaci kašle [10]. Tato oblast spolupracuje s nucleus raphe. Společně kontrolují délku jednotlivých fází kašle (viz dále) a určují míru aktivity respiračního svalstva participujícího na expektoraci [11].
Reflexní expektorace je podobně jako polykání, močení a defekace unikátní v tom, že je řízena subkortikálně i kortikálně. Lze ji tedy ovlivnit vůlí, např. na určitou dobu potlačit [11]. Druhou možností je iniciovat kašel volně, bez reflexní složky. V tomto případě jsou motoneurony respiračního a laryngeálního svalstva aktivovány přímo z kortikálních motorických a premotorických oblastí kůry a mozečku. Nedochází tak k aktivaci centra expektorace v mozkovém kmeni [11].
Kašel můžeme rozdělit na tři fáze:
- Nádechová fáze – dochází k rychlé (0,65 s) inspiraci vzduchu při otevřené glottis [12]. Nádech dostatečného množství vzduchu je zásadní pro generování adekvátní síly při expektoraci. Množství vdechovaného vzduchu se mění dle požadavků na sílu expektorace. Obecně se pohybuje od 50 % [9] do 90 % [13] vitální kapacity.
- Kompresní fáze – glottis se uzavírá za současné kontrakce exspiračního svalstva hrudníku a břicha. Celá fáze trvá přibližně 0,2 s a intrathorakální tlak při ní naroste až k hodnotám 200 cm H20 [8].
- .Výdechová fáze – při otevření glottis dochází k explozivnímu úniku vzduchu z plic ven za typického zvukového doprovodu [9]. Během této fáze, která zpravidla trvá 0,5 s, je vydechnuto okolo 2,5 l vzduchu při vrcholovém průtokovém objemu (peak cough flow; PCF) 360–1 200 l/min. V důsledku dynamického kolapsu trachey a zúžení jejího průsvitu až na jednu pětinu dosahuje rychlost vzduchu v této části expektorace hodnot až 0,6 rychlosti zvuku [8]. Díky tomu je dosaženo dostatečných střižných sil pro přerušení vazby hlenu a sliznice v dýchacích cestách [14].
Expektorace u pacientů s PN
Pacienti s PN obecně vykazují nižší svalovou sílu končetin oproti zdravým osobám [15,16]. Toto se týká i síly respiračního svalstva [2,17,18]. Signifikantní rozdíl v síle respiračního svalstva oproti kontrolní skupině lze pozorovat již u pacientů ve stadiu I podle Hoehnové a Yahra [19,20]. S progresí nemoci dochází k dalšímu snižování síly [19,21–23], a to mimo jiné i v důsledku nízké míry fyzické aktivity [24,25]. V porovnání se zdravými vrstevníky jsou osoby s PN asi o třetinu méně fyzicky aktivní [26,27]. Příčinou jsou zřejmě nativní příznaky PN, zejména rigidita hrudníku, bradykineze dýchacích pohybů a posturální deformity trupu [19]. Kromě snížení síly je porušen i rychlý nábor svalstva při kontrakci. Příčinou je atrofie a redukce svalových vláken typu II (rychlá svalová vlákna) ve prospěch svalových vláken typu I (pomalá svalová vlákna) na podkladě rigidity a bradykineze [28]. Největší podíl atrofie (až 60 %) byl zaznamenán u pacientů s těžkou akinezí a dlouhou dobou trvání nemoci [29]. Nedostatečně rychlý nábor svalstva negativně ovlivňuje kompresní fázi, která je oproti zdravým vrstevníkům u PN významně prodloužená, a dále generování vrcholového proudu vzduchu při kašli [2]. Hlen tak stagnuje v dýchacích cestách a pacient je ohrožen vznikem respiračního infektu [30]. Podle nové nomenklatury označujeme potíže s expektorací slovem dystussie [2]. Vedle motorické dysfunkce se u pacientů s PN popisuje i porucha aferentní části kašlacího reflexu (tzv. senzorická dysfunkce) [21,31], při které dochází ke zvýšení prahu pro vyvolání reflexního kašle. Existují však i studie, které senzorickou dysfunkci u pacientů s PN zpochybňují [22,32]. Efekt dopaminergní medikace na sílu nádechového a výdechového svalstva nebyl prokázán [33,34] a studie zjišťující efekt na sílu kašle dosud nebyly provedeny.
Efektivita expektorace není obecně podmíněna jen dostatečnou silou respiračního svalstva. U pacientů s nervosvalovým onemocněním, kteří mají normální sílu nádechových i výdechových svalů, může být expektorace narušena také svalovou únavou. Pacient pak není schopen opakovaně generovat dostatečnou sílu. V klinické praxi se však s těmito obtížemi u pacientů s PN nesetkáváme a literatura neuvádí únavu jako relevantní příčinu poruchy expektorace u PN.
Objektivizace efektivity kašle a síly respiračního svalstva
Mezi nejčastější a nejdostupnější hodnocení efektivity expektorace se v praxi využívá vyšetření síly kašle. Sílu kašle lze vyšetřit dvěma způsoby. První možností je vyšetření reflexního kašle navozeného inhalací, např. aerosolové směsi kyseliny citrónové nebo kapsaicinu. Kromě maximálního vrcholového průtoku vzduchu při kašli lze takto stanovit i práh pro vyvolání kašle („cough threshold“). Jedná se však o relativně složitou metodu náročnou na přístrojové vybavení, která se v klinické praxi využívá velmi málo. Detaily jsou uvedeny v doporučených postupech pro vyšetření reflexního kašle [35].
Druhou, jednodušší možností je vyšetření síly vědomě navozeného usilovného kašle, při kterém hodnotíme PCF. Zlatým standardem je jeho vyšetření pneumotachografem [36]. Existují však i levnější a dostupnější digitální či analogové přenosné skríningové přístroje (peak-flow metry), jejichž přesnost je v porovnání s výsledky pneumotachografie dostatečná (zkreslení hodnoty menší než 3,3 %) [36]. Alternativou peak-flow metrů je vyšetření síly kašle nepřímo přes akustickou analýzu. Ukázalo se, že síla zvuku produkovaná při kašli s PCF silně koreluje [37] a je proto další alternativou skríningového vyšetření. Umayahara et al toto téma v roce 2008 rozpracovali a vytvořili aplikaci do mobilního telefonu, která je využitelná v klinické praxi [38].
Pro zhodnocení efektivity kašle a případnou volbu technik hygieny dýchacích cest je potřeba vyšetřit maximální sílu respiračního svalstva. Maximální síla respiračního svalstva se obvykle vyšetřuje přístrojem pro detekci maximálního nádechového (maximal inspiratory pressure; MIP) a maximálního výdechového (maximal expiratory pressure; MEP) ústního tlaku. Zatímco MIP odráží sílu bránice a ostatních nádechových svalů, MEP odráží sílu břišního svalstva a ostatních výdechových svalů. U pacientů s nedostatečným retním uzávěrem je doporučováno vyšetření nádechového nosního tlaku. Metodologie vyšetření síly nádechového a výdechového svalstva je detailně popsána v doporučeních postupech Americké hrudní společnosti (American Thoracic Society; ATS) a Evropské respirační společnosti (European Respiratory Society; ERS) [39] a v literatuře jsou také dostupné věkově a pohlavně vázané referenční hodnoty [40].
V případě, že jsou hodnoty PCF i MIP/MEP v normě a pacient přesto udává subjektivní obtíže s expektorací, je vhodné vyšetření doplnit o vytrvalostní parametry práce respiračního svalstva. Jak jsme však uvedli výše, nejde o typické obtíže u pacientů s PN. Ohledně optimální metodiky pro vyšetření vytrvalostní síly respiračního svalstva neexistuje jednotný konsensus [39]. Pro potřeby vyšetření schopnosti opakovaně generovat dostatečnou sílu při expektoraci (hlavně u výdechových svalů) využíváme vyšetření opakovaných maximálních výdechových/nádechových ústních tlaků (repeated maximum inspiratory/expiratory pressures). Metodologie vyšetření a normativní hodnoty jsou popsány v doporučených postupech ATS/ERS [39].
Možnosti fyzioterapeutické intervence pro usnadnění a zefektivnění hygieny dýchacích cest
Pro výběr vhodné fyzioterapie na podporu expektorace je klíčové zjistit subjektivní obtíže pacienta vč. objektivního vyšetření síly kašle a respiračního svalstva. Bez těchto znalostí nelze fyzioterapii správně doporučit. Pro zlepšení hygieny dýchacích cest využíváme následující techniky.
Techniky hygieny dýchacích cest s využitím vibračních pomůcek
Jedná se o techniky, které využíváme k usnadnění transportu sputa do centrálních dýchacích cest. Ten je fyziologicky zajišťován tzv. mukociliárním transportem. V některých případech, např. při nedostatečném pitném režimu, může dojít k reologickým změnám sputa, které se stává viskóznější a je obtížné je spontánně vykašlat [41,42]. V tomto případě využíváme techniky pro optimalizaci jeho reologických vlastností. Výzkum prokázal, že vibrace o frekvenci vyšší než 13 Hz v délce alespoň 15 min snižují vazkost sputa a napomáhají tak mukociliárnímu transportu [42,43]. Těchto frekvencí lze dosáhnout za využití oscilačních pomůcek, např. Acapella (Asker, Trutnov, ČR), PARI-O-PEP (PARI GmbH, Starnberg, Německo) či vibračních vest. Vzhledem k tomu, že frekvence manuálně vyvolaných vibrací se pohybují mezi 5 a 6,5 Hz [44,45] a že požadované trvání 15 min je v praxi obtížně dosažitelné, jsou manuální techniky obecně považovány za málo efektivní. Účinek těchto technik však nebyl u pacientů s PN doposud uspokojivě prozkoumán.
Rezistentní trénink dýchacích svalů
Rezistentní trénink nádechového a/nebo výdechového svalstva zaměřený na zvýšení maximální síly volíme pro podporu adekvátního PCF. Tento typ tréninku je vhodný především pro podporu rychlých svalových vláken typu II, kdy zlepšuje aktivaci a synchronizaci motorických jednotek a zvyšuje maximální sílu kontrakce [46]. Při správně zvolených parametrech rezistentního tréninku můžeme očekávat signifikantní změny již za 2–4 týdny od začátku cvičení [2]. První využití rezistentního tréninku výdechového svalstva u pacientů s PN popsali Saleem et al v roce 2005 na případu pacienta v časném stadiu, který po dobu 20 týdnů prováděl rezistentní trénink výdechového svalstva. Výsledkem bylo zvýšení síly o 158 % [47]. Na tuto práci navázali Pitts et al v roce 2009 zjištěním, že rezistentní trénink výdechového svalstva ovlivňuje sílu kašle. Studie prokázala, že čtyřtýdenní trénink výdechového svalstva proti odporu se při kašli projevil významným zkrácením kompresní fáze a zvýšením vrcholového průtokového objemu vzduchu při kašli [30]. Tento výsledek později potvrdila i řada dalších studií, které u PN prokázaly zvýšení síly reflexního i vědomě navozeného kašle [48–51]. Přehled studií sledujících efekt rezistentního tréninku na sílu výdechového svalstva a kašle u PN shrnuje tab. 1. Efekt tréninku maximální síly nádechového svalstva u pacientů s PN zjišťovala doposud pouze jedna studie, která v porovnání s kontrolní skupinou sledovala, zda je účinnější rezistentní trénink nádechového či výdechového svalstva [50]. Výsledky hovořily ve prospěch tréninku výdechového svalstva. Pozitivní výsledky těchto studií se odrazily v Evropských doporučených postupech pro fyzioterapeutickou léčbu PN, které pro ovlivnění síly kašle doporučují využívat především rezistentní trénink výdechového svalstva [52]. Rezistentní trénink volíme i tehdy, když má pacient problémy opakovaně generovat dostatečnou sílu při expektoraci.
Tab. 1. Přehled studií sledujících efekt rezistentního tréninku na sílu výdechového svalstva a kašle u pacientů s Parkinsonovou nemocí 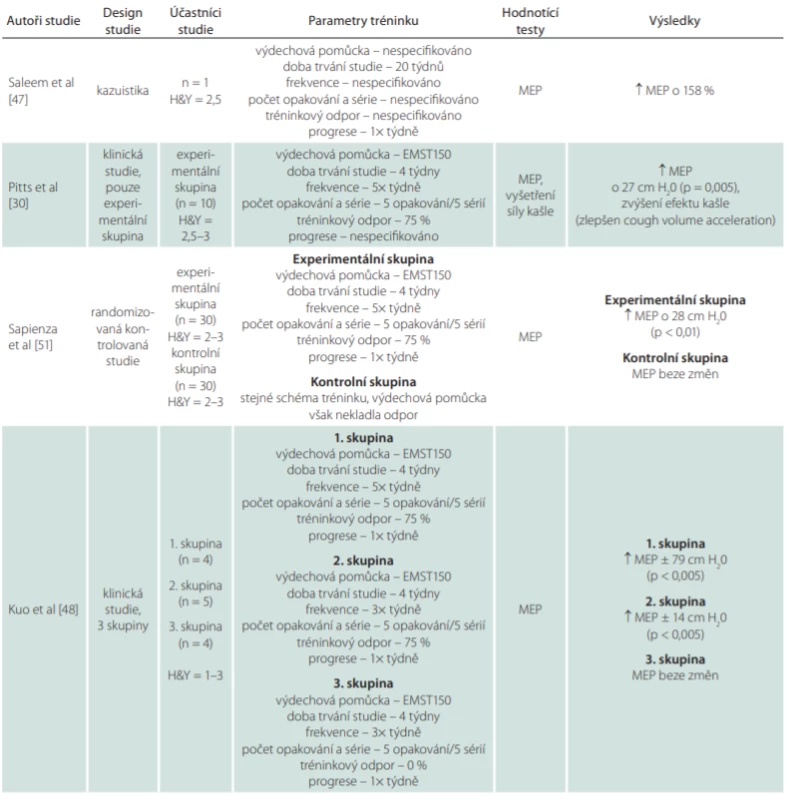
H&Y – stadium dle Hoehna a Yahra; MEP – maximální výdechový tlak (maximal expiratory pressure); n – počet; PCF – vrcholový průtokový objem (peak cough fl ow) Tab. 1 – pokračování. Přehled studií sledujících efekt rezistentního tréninku na sílu výdechového svalstva a kašle u pacientů s Parkinsonovou nemocí. 
H&Y – stadium dle Hoehna a Yahra; MEP – maximální výdechový tlak (maximal expiratory pressure); n – počet; PCF – vrcholový průtokový objem (peak cough fl ow) Pro dostatečný úspěch tréninku je nutné zajistit adekvátní odpor a jeho postupné navyšování v čase. Vzhledem k rychlé svalové adaptaci je u každého pacienta doporučováno po 2–4 týdnech cvičení MIP/MEP opět změřit a odpor upravit. Progrese je totiž nutnou podmínkou dalšího zvyšování maximální síly. U neurodegenerativních onemocnění je vhodné maximální sílu výdechového svalstva trénovat pět dní v týdnu v pěti sériích s pěti opakováními proti odporu 75 % MEP a trénink nádechového svalstva provádět alespoň 6 dní v týdnu s 30 opakováními při odporu 30 % MIP [53]. Doporučené parametry případného vytrvalostního tréninku zaměřeného na opakované generování dostatečné síly jsou 2–3× v týdnu, 3–5 sérií s devíti opakováními při odporu 60–65 % MEP/MIP [54]
Rezistentní trénink výdechového svalstva lze s výhodou kombinovat s technikami pro podporu nádechové a výdechové fáze kašle. Jedná se o techniky maximální insuflační kapacity (air stacking) a manuálně asistovaného kašle. Při správném zaučení jsou tyto techniky u pacientů s oslabením respiračního svalstva schopny jednorázově signifikantně zvýšit PCF [55]. Skupina pacientů s PN, kteří podstoupili rezistentní trénink výdechového svalstva v kombinaci s technikou air stacking, při které dochází postupnými nádechy ke zvyšování objemu vzduchu v plicích před výdechem, dosáhla oproti pacientům s výhradně rezistentním tréninkem významně většího zvýšení PCF [49]. Manuálně asistovaný kašel se využívá jako technika pro podporu výdechové fáze, kdy terapeut (či pacient pomocí polštáře) prudce zatlačí na hrudník, břicho nebo obě oblasti zároveň, a podpoří tak efekt pacientova kašle. Obě techniky se s výhodou kombinují [55].
Mechanická insuflace a exsuflace
U pacientů s oslabeným respiračním svalstvem, kteří mají výrazně snížené PCF (< 160 l/min), je vysoké riziko vzniku respiračního infektu [13]. Proto se u nich kromě rezistentního tréninku doporučuje i mechanická podpora kašle [13,52,56]. Jedná se o metodu mechanicky asistovaného kašle, kdy přístroj přetlakem „vpraví“ atmosférický vzduch do plic přes obličejovou masku (popř. přes tracheostomii), a následně podtlakem dopomáhá ke zvýšení vrcholového proudu vzduchu v exspirační fázi kašle. Kombinace přetlaku a následného podtlaku zvyšuje efektivitu vykašlávání, kterou lze umocnit zapnutím režimu oscilací v nádechové i výdechové fázi. Aktuálně je v ČR pro mechanické usnadnění expektorace využíván přístroj CoughAssist (Philips, Amsterdam, Nizozemsko). Od konce roku 2019 je po schválení revizním lékařem pronájem přístroje plně hrazen všemi zdravotními pojišťovnami. Využívání přístroje CoughAssist v klinické praxi je dosud velmi limitované, přestože je v ČR dostupný od roku 2009. Ohledně indikace odkazujeme na doporučené postupy České pneumologické a ftizeologické společnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist [57].
Algoritmus volby fyzioterapeutické intervence
Algoritmus zahájení fyzioterapeutické intervence pro usnadnění a zefektivnění hygieny dýchacích cest a doporučení pro volbu vhodné techniky je v neurologii k dispozici pouze u pacientů s nervosvalovými onemocněními [12]. Výběr vhodné terapie je odvozen od naměřené hodnoty PCF. Při hodnotách PCF < 270 l/min volíme techniky pro podporu nádechové a výdechové fáze kašle, tzn. trénink maximální insuflační kapacity a manuálně asistovaný kašel. Při hodnotách PCF < 160 l/min využíváme mechanickou insuflaci a exsuflaci. Vzhledem k tomu, že podmínky nutné pro efektivní expektoraci jsou u pacientů s PN obdobné jako u pacientů s nervosvalovými onemocněními, lze tento algoritmus uplatnit i u nich. Je však třeba jej doplnit o rezistentní trénink výdechového svalstva, který se pro podporu kašle u pacientů s PN ukázal jako efektivní [48–51]. Správnost takto upraveného algoritmu volby fyzioterapeutické intervence u PN (tab. 2) v současné době ověřujeme. Je však potřeba zdůraznit, že pacient nemusí být vždy schopen uvedená vyšetření provést, např. při těžkém kognitivním deficitu. I tak je možné některé fyzioterapeutické postupy pro usnadnění expektorace aplikovat. např. využití CoughAssistu u nespolupracujících pacientů s PN vedených v paliativním režimu.
Tab. 2. Algoritmus volby fyzioterapeutické intervence pro usnadnění a zefektivnění hygieny dýchacích cest. 
MEP – maximální výdechový tlak (maximal expiratory pressure); n – počet; PCF – vrcholový průtokový objem (peak cough fl ow) Pro optimalizaci vyšetření a indikace rehabilitace u pacientů s PN jsme na našem pracovišti vytvořili dotazník, který pacienti vyplňují před návštěvou ošetřujícího neurologa. Kromě klíčových dotazů zaměřených na fyzioterapii [52], ergoterapii [58] a neuropsychologii obsahuje i dvě otázky cílené na potřebu respirační fyzioterapie [59]: „Když Vám zaskočí, máte problém si snadno a rychle odkašlat? A „Platí pro Vás, že nedokážete na jeden nádech napočítat nahlas do třiceti?“ Pokud je odpověď alespoň na jednu z těchto otázek kladná, je indikováno cílené vyšetření síly kašle a respiračních svalů fyzioterapeutem. Podle výsledků je nastavena vhodná intervence dle výše uvedeného algoritmu.
Závěr
Pacienti s PN mají obtíže s generováním adekvátního vrcholového proudu vzduchu při kašli, čímž se u nich zvyšuje riziko vzniku respiračního infektu. Hodnocení síly expektorace a využití technik respirační fyzioterapie bývá přitom u těchto pacientů opomíjeno. Do klinické praxe proto doporučujeme zařadit časově nenáročné vyplnění dotazníku cíleného na respirační obtíže a dle výsledku vyšetření hygieny dýchacích cest v kombinaci s vhodným respiračním cvičením.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 19. 2. 2020
Přijato do tisku: 29. 7. 2020
Mgr. Martin Srp
Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze
Kateřinská 30
128 21 Praha
e-mail: martin.srp@vfn.cz
Zdroje
1. Suttrup I, Warnecke T. Dysphagia in Parkinson’s disease. Dysphagia 2016; 31 (1): 24–32. doi: 10.1007/s00455-015-9671-9.
2. Huff A, Smith B, Brown A et al. Mechanisms for successful rehabilitation of cough in Parkinson‘s disease using expiratory muscle strength training. Perspectives of the ASHA Special Interest Groups 2017; 2 (13): 93–102. doi: 10.1044/persp2.SIG13.93.
3. Fall A, Saleh A, Fredrickson M. Survival time, mortality, and cause of death in elderly patients with Parkinson‘s disease: a 9-year follow-up. Mov Disord 2003; 18 (11): 1312–1316. doi: 10.1002/mds.10537.
4. Akbar U, Dham B, He Y et al. Incidence and mortality trends of aspiration pneumonia in Parkinson‘s disease in the United States 1979–2010. Parkinsonism Relat Disord 2015; 21 (9): 1082–1086. doi: 10.1016/j.parkreldis.2015.06.020.
5. Neumannová K, Kolek V (eds). Asthma bronchiale a chronická obstrukční plicní nemoc: možnosti komplexní léčby z pohledu fyzioterapeuta. Praha: Mladá fronta 2012.
6. Gal O, Srp M, Konvalinková R et al. Physiotherapy in Parkinson’s disease: building ParkinsonNet in Czechia. Parkinsons Dis 2017; 2017 : 8921932. doi: 10.1155/2017/892 1932.
7. Evans JN, Jaeger MJ. Mechanical aspects of coughing. Pneumonologie 1975; 152 (4): 253–257. doi: 10.1007/BF02094938.
8. Leith DE. The development of cough. Am Rev Respir Dis 1985; 131 (5): S39–S42. doi: 10.1164/arrd.1985.131.S5.S39.
9. Francesco A, Aiello M, Bertorelli G et al. Cough, a vital reflex. mechanisms, determinants and measurements. Acta Biomed 2019; 89 (4): 477–480. doi: 10.23750/abm.v89i4.6182.
10. Shannon R, Baekey DM, Morris KF et al. Ventrolateral medullary respiratory network and a model of cough motor pattern generation. J Appl Physiol 1998; 84 (6): 2020–2035. doi: 10.1152/jappl.1998.84.6.2020.
11. Canning BJ, Chang AB, Bolser DC et al. Anatomy and neurophysiology of cough: CHEST Guideline and Expert Panel report. Chest 2014; 146 (6): 1633–1648. doi: 10.1378/chest.14-1481.
12. Ross BB, Gramiak R, Rahn H. Physical dynamics of the cough mechanism. J Appl Physiol 1955; 8 (3): 264–268. doi: 10.1152/jappl.1955.8.3.264.
13. Chatwin M. Mechanical aids for secretion clearance. Int J Respir Care 2009; 5 (2): 50–54.
14. Button B, Goodell HP, Atieh E et al. Roles of mucus adhesion and cohesion in cough clearance. Proc Natl Acad Sci U S A 2018; 115 (49): 12501–12506. doi: 10.1073/pnas.1811787115.
15. Allen NE, Canning CG, Sherrington C et al. Bradykinesia, muscle weakness and reduced muscle power in Parkinson‘s disease. Mov Disord 2009; 24 (9): 1344–1351. doi: 10.1002/mds.22609.
16. Skinner JW, Christou EA, Hass CJ. Lower extremity muscle strength and force variability in persons with Parkinson disease. J Neurol Phys Ther 2019; 43 (1): 56–62. doi: 10.1097/NPT.0000000000000244.
17. Hegland KW, Okun MS, Troche MS. Sequential voluntary cough and aspiration or aspiration risk in Parkinson’s disease. Lung 2014; 192 (4): 601–608. doi: 10.1007/s00408-014-9584-7.
18. Hegland KW, Troche MS, Brandimore AE et al. Comparison of voluntary and reflex cough effectiveness in Parkinson‘s disease. Parkinsonism Relat Disord 2014; 20 (11): 1226–1230. doi: 10.1016/j.parkreldis.2014.09.010.
19. Santos RB, Fraga AS, Coriolano M et al. Respiratory muscle strength and lung function in the stages of Parkinson’s disease. J Bras Pneumol 2019; 45 (6): e20180148. doi: 10.1590/1806-3713/e20180148.
20. Zhang W, Zhang L, Zhou N et al. Dysregulation of respiratory center drive (P0. 1) and muscle strength in patients with early stage idiopathic Parkinson’s disease. Front Neurol 2019; 10 : 724. doi: 10.3389/fneur.2019.00 724.
21. Ebihara S, Saito H, Kanda A et al. Impaired efficacy of cough in patients with Parkinson disease. Chest 2003; 124 (3): 1009–1015. doi: 10.1378/chest.124.3.1009.
22. Fontana GA, Pantaleo T, Lavorini F et al. Defective motor control of coughing in Parkinson‘s disease. Am J Respir Crit Care Med 1998; 158 (2): 458–464. doi: 10.1164/ajrccm.158.2.9705094.
23. Silverman E, Carnaby G, Singletary F et al. Measurement of voluntary cough production and airway protection in parkinson disease. Arch Phys Med Rehabil 2016; 97 (3): 413–420. doi: 10.1016/j.apmr.2015.10.098.
24. Hainaut K, Duchateau J. Muscle fatigue, effects of training and disuse. Muscle Nerve 1989; 12 (8): 660–669. doi: 10.1002/mus.880120807.
25. Karpati G, Engel WK. Correlative histochemical study of skeletal muscle after suprasegmental denervation, peripheral nerve section, and skeletal fixation. Neurology 1968; 18 (7): 681–681. doi: 10.1212/wnl.18.7.681.
26. Fertl E, Doppelbauer A, Auff E. Physical activity and sports in patients suffering from Parkinson‘s disease in comparison with healthy seniors. J Neural Transm Park Dis Dement Sect 1993; 5 (2): 157–161. doi: 10.1007/BF02251206.
27. van Nimwegen M, Speelman AD, Hofman-van Rossum EJ et al. Physical inactivity in Parkinson’s disease. J Neurol 2011; 258 (12): 2214–2221. doi: 10.1007/s00415-011-6097-7.
28. Mu L, Sobotka S, Chen J et al. Altered pharyngeal muscles in Parkinson disease. J Neuropathol Exp Neurol 2012; 71 (6): 520–530. doi: 10.1097/NEN.0b013e318258381b.
29. Rossi B, Siciliano G, Carboncini MC et al. Muscle modifications in Parkinson‘s disease: myoelectric manifestations. Electroencephalogr Clin Neurophysiol 1996; 101 (3): 211–218. doi: 10.1016/0924-980x (96) 94672-x.
30. Pitts T, Bolser D, Rosenbek J et al. Impact of expiratory muscle strength training on voluntary cough and swallow function in Parkinson disease. Chest 2009; 135 (5): 1301–1308. doi: 10.1378/chest.08-1389.
31. Troche MS, Brandimore AE, Okun MS et al. Decreased cough sensitivity and aspiration in Parkinson disease. Chest 2014; 146 (5): 1294–1299. doi: 10.1378/chest.14-0066.
32. Leow L, Beckert L, Anderson T et al. Changes in chemosensitivity and mechanosensitivity in aging and Parkinson’s disease. Dysphagia 2012; 27 (1): 106–114. doi: 10.1007/s00455-011-9347-z.
33. Sawan T, Harris ML, Kobylecki C et al. Lung function testing on and off dopaminergic medication in Parkinson‘s disease patients with and without dysphagia. Mov Disord Clin Pract 2016; 3 (2): 146–150. doi: 10.1002/mdc3.12251.
34. Weiner P, Inzelberg R, Dividovich A et al. Respiratory muscle performance and the perception of dyspnea in Parkinson‘s disease. Can J Neurol Sci 2002; 29 (1): 68–72. doi: 10.1017/s031716710000175x.
35. Morice A, Fontana GA, Belvisi MG et al. ERS guidelines on the assessment of cough. Eur Respir J 2007; 29 (6): 1256–1276.
36. Silverman EP, Carnaby-Mann G, Pitts T et al. Concordance and discriminatory power of cough measurement devices for individuals with Parkinson disease. Chest 2014; 145 (5): 1089–1096.
37. Lee KK, Matos S, Ward K et al. Sound: a non-invasive measure of cough intensity. BMJ Open Respir Res 2017; 4 (1): e000178. doi: 10.1136/bmjresp-2017-000178.
38. Umayahara Y, Soh Z, Sekikawa K et al. A mobile cough strength evaluation device using cough sounds. Sensors 2018; 18 (11): 3810. doi: 10.3390/s18113810.
39. American Thoracic Society/European Respiratory Society. ATS/ERS Statement on respiratory muscle testing. Am J Respir Crit Care Med 2002; 166 (4): 518. doi: 10.1164/rccm.166.4.518.
40. Evans JA, Whitelaw WA. The assessment of maximal respiratory mouth pressures in adults. Respir Care 2009; 54 (10): 1348–1359.
41. Hough A. Hough‘s cardiorespiratory care. 5th ed. Amsterdam: Elsevier 2018.
42. Tomkiewicz R, Biviji A, King M. Effects of oscillating air flow on the rheological properties and clearability of mucous gel simulants. Biorheology 1994; 31 (5): 511–520. doi: 10.3233/bir-1994-31501.
43. Pieterse A, Hanekom SD. Criteria for enhancing mucus transport: a systematic scoping review. Multidiscip Respir Med 2018; 13 (1): 22. doi: 10.1186/s40248-018-0127-6.
44. Li S, Silva Y. Investigation of the frequency and force of chest vibration performed by physiotherapists. Physiother Can 2008; 60 (4): 341–348. doi: 10.3138/physio.60.4.341.
45. McCarren B, Alison JA, Herbert RD. Vibration and its effect on the respiratory system. Aust J Physiother 2006; 52 (1): 39–43. doi: 10.1016/s0004-9514 (06) 70060-5.
46. Kisner C, Colby LA, Borstad J. Therapeutic exercise: foundations and techniques. 7th ed. Philadelphia, USA: F.A. Davis Company 2017.
47. Saleem AF, Sapienza CM, Okun MS. Respiratory muscle strength training: treatment and response duration in a patient with early idiopathic Parkinson‘s disease. NeuroRehabilitation 2005; 20 (4): 323–333.
48. Kuo YC, Chan J, Wu YP et al. Effect of expiratory muscle strength training intervention on the maximum expiratory pressure and quality of life of patients with Parkinson disease. NeuroRehabilitation 2017; 41 (1): 219–226. doi: 10.3233/NRE-171474.
49. Reyes A, Castillo A, Castillo J. Effects of expiratory muscle training and air stacking on peak cough flow in individuals with Parkinson’s disease. Lung 2020; 198 (1): 207–211. doi: 10.1007/s00408-019-00291-8.
50. Reyes A, Castillo A, Castillo J et al. The effects of respiratory muscle training on peak cough flow in patients with Parkinson’s disease: a randomized controlled study. Clin Rehabil 2018; 32 (10): 1317–1327. doi: 10.1177/0269215518774832.
51. Sapienza C, Pitts T, Troche MS et al. Respiratory strength training: concept and intervention outcomes. Semin Speech Language 2011; 32 (1): 21–30. doi: 10.1055/s-0031-1271972.
52. Keus S, Munneke M, Graziano M et al. European physiotherapy guideline for Parkinson’s disease. Netherlands: KNGF/ParkinsonNet 2014.
53. Reyes A, Ziman M, Nosaka K. Respiratory muscle training for respiratory deficits in neurodegenerative disorders: a systematic review. Chest 2013; 143 (5): 1386–1394. doi: 10.1378/chest.12-1442.
54. Natera AO, Cardinale M, Keogh JW, The effect of high volume power training on repeated high-intensity performance and the assessment of repeat power ability: a systematic review. Sports Med 2020; 50 (7): 1317–1339. doi: 10.1007/s40279-020-01273-0.
55. Sivasothy P, Brown L, Smith IE et al. Effect of manually assisted cough and mechanical insufflation on cough flow of normal subjects, patients with chronic obstructive pulmonary disease (COPD), and patients with respiratory muscle weakness. Thorax 2001; 56 (6): 438–444. doi: 10.1136/thorax.56.6.438.
56. Chatwin M, Ross E, Hart N et al. Cough augmentation with mechanical insufflation/exsufflation in patients with neuromuscular weakness. Eur Respir J 2003; 21 (3): 502–508. doi: 10.1183/09031936.03.00048102.
57. Neumannová K, Doušová T, Sedlák V et al. The Czech Pneumological and Physiological Society and the Czech Society for Paediatric Pulmonology Guidelines for Long-term Home Treatment Using the CoughAssist Machine in Patients with Serious Cough Disorders. Cesk Slov Neurol N 2017; 80/113 (4): 480–484. doi: 10.14735/amcsnn2017480.
58. Sturkenboom I, Thijssen M, Gons-van Elsacker J et al. Guidelines for occupational therapy in Parkinson‘s disease rehabilitation. [oline]. Available from URL: https: //www.parkinsonnet.nl/app/uploads/sites/3/2019/11/ot_guidelines_final-npf__3_.pdf.
59. Smeltzer SC, Skurnick JH, Troiano R et al. Respiratory function in multiple sclerosis: utility of clinical assessment of respiratory muscle function. Chest 1992; 101 (2): 479–484. doi: 10.1378/chest.101.2.479.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek EditorialČlánek Recenze knih
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Editorial
- Cytotoxické léze corpus callosum (CLOCCs)
- Poranění radiálního nervu při zlomeninách diafýzy pažní kosti
- Je jasné, kdy operovat výhřez bederní meziobratlové ploténky?
- Současná diagnostika sekundárně progresivní formy roztroušené sklerózy a léčba siponimodem
- Roztroušená skleróza – odhalené tajemství imunity
- Hygiena dýchacích cest u pacientů s Parkinsonovou nemocí – přehled problematiky a možnosti fyzioterapeutické intervence
- Klinické a sociální prediktory kvality života u dětí a mladších dospělých s poruchou autistického spektra
- Bezpečnost karotické endarterektomie s ohledem na její načasování po ischemické cévní mozkové příhodě
- Glatiramer acetát – léčba roztroušené sklerózy monitorovaná v registru ReMuS
- Intenzivní rehabilitace kognitivních funkcí u osob s roztroušenou sklerózou – výsledky 12týdenní randomizované studie hodnocené počítačovým programem
- Účinnost a bezpečnost urgentní mikrochirurgické embolektomie při selhání intravenózní trombolýzy a mechanické trombektomie u pacientů s akutním ischemickým iktem – protokol systematického review
- Vliv pandemie COVID-19 na spánkovou medicínu v České republice a na Slovensku
- Prevalence a charakteristika epilepsie u pacientů s relabující-remitující formou roztroušené sklerózy léčených imunomodulační terapií
- Syndrom moyamoya doprovázený polycystickou chorobou ledvin – kazuistika vzácného onemocnění a přehled literatury
- Souběh dvou oportunních infekcí jako první projev HIV
- Dropped head syndrom u pacientky s progredující bulbární paralýzou
- Karotický paragangliom, velmi vzácný nádor v dětském věku
- Využití kvantitativní MR venografie v indikaci stentingu stenózy žilního splavu
- Transvenózna embolizácia prasknutej piálnej arteriovenóznej malformácie
- CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
- Recenze knih
- 2020 AAN Highlights Dlouhodobá data o účinnosti deplece CD20+ B-buněk v léčbě RS
- 2020 AAN Highlights Jak mění malá molekula průběh spinální svalové atrofie?
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Je jasné, kdy operovat výhřez bederní meziobratlové ploténky?
- CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
- Cytotoxické léze corpus callosum (CLOCCs)
- Dropped head syndrom u pacientky s progredující bulbární paralýzou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



