-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cytotoxické léze corpus callosum (CLOCCs)
Cytotoxic lesions of the corpus callosum (CLOCCs)
Cytotoxic lesions of the corpus callosum (CLOCCs) represent a group of conditions that cause MRI signal intensity changes in the corpus callosum. Etiology of this phenomenon is very heterogenous. CLOCCs are associated with a spectrum of metabolic disorders, drug therapy, infections, epileptic seizures and many other causes. It appears that these lesions result from a stereotyped inflammatory cascade which leads to a massive increase in levels of extracellular glutamate. The final result is development of cytotoxic edema. The range of clinical features is very wide. Neurological symptoms include motor and/or sensory involvement, cognitive decline, behavioral changes, dizziness, loss of consciousness and others. The main diagnostic tool is MRI, especially diffusion-weighted images, where CLOCCs manifest as regions of restricted diffusion. CLOCCs are reversible in most cases. Prognosis and treatment generally depend on the etiology, but clinical outcome is usually favorable. Physicians should be familiar with this recently named diagnosis, primarily because most of the underlying causes are treatable. In this article, we summarize the current knowledge and describe five cases of CLOCCs.
Keywords:
Corpus callosum – magnetic resonance imaging – reversible lesions – cytotoxic edema – restricted diff usion
Autoři: J. Mračková 1; R. Tupý 2; V. Rohan 1; J. Mraček 3; P. Ševčík 1
Působiště autorů: Neurologická klinika LF UK a FN Plzeň 1; Klinika zobrazovacích metod LF UK a FN Plzeň 2; Neurochirurgická klinika LF UK a FN Plzeň 3
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(4): 347-352
Kategorie: Přehledný referát
doi: https://doi.org/10.14735/amcsnn2020347Souhrn
Cytotoxické léze corpus callosum (cytotoxic lesions of the corpus callosum; CLOCCs) reprezentují skupinu stavů, které způsobují změny intenzity signálu v corpus callosum na MR. Etiologie tohoto jevu je velmi heterogenní. CLOCCs jsou asociovány se spektrem metabolických chorob, lékovou terapií, infekcemi, epileptickými záchvaty a mnoha jinými příčinami. Zdá se, že tyto léze jsou důsledkem stereotypní zánětlivé kaskády, která vede k masivnímu zvýšení hladin extracelulárního glutamátu. Konečným výsledkem je rozvoj cytotoxického edému. Škála klinických projevů je velmi rozmanitá. Neurologické symptomy zahrnují postižení hybnosti a/nebo citlivosti, kognitivní deficit, změny chování, závratě, poruchu vědomí a další. Hlavní diagnostickou metodou je MR, především difuzívážené zobrazení, na kterém se CLOCCs manifestují jako oblasti s restrikcí difuze. CLOCCs jsou ve většině případů reverzibilní. Prognóza a léčba obvykle závisí na etiologii, ale výsledný klinický stav bývá příznivý. Lékaři by měli být s touto nedávnou pojmenovanou diagnózou obeznámeni, především proto, že většina vyvolávajících příčin je léčitelná. V tomto sdělení shrnujeme dosavadní poznatky a prezentujeme pět případů CLOCCs.
Klíčová slova:
corpus callosum – reverzibilní léze – cytotoxický edém – magnetická rezonance – restrikce difuze
Úvod
Cytotoxické léze corpus callosum (cytotoxic lesions of the corpus callosum; CLOCCs) jsou poměrně novou klinickou a radiologickou jednotkou. Jako jedni z prvních s tímto označením přicházejí Starkey et al v roce 2017 [1]. Jedná se o skupinu sekundárně vzniklých stavů vyvolanou řadou různých příčin – metabolickými poruchami, epileptickými záchvaty, traumaty, farmaky a mnoha dalšími. Společným je pro ně nález signálních změn v corpus callosum (CC) při zobrazení MR.
Termín CLOCCs vznikl jako více popisné označení fenoménu dříve označovaného jako přechodná léze splenia corporis callosi, mírná encefalitida/encefalopatie s reverzibilní izolovanou lézí splenia corporis callosi (mild encephalitis/encephalopathy with a reversible splenial lesion; MERS) a syn - drom reverzibilní léze splenia (reversible splenial lesion syndrome; RESLES) [2,3]. Nový název odráží především skutečnost, že léze nemusejí být omezené pouze na oblast splenia a nemusejí být vždy plně reverzibilní [4,5]. Dále také toto pojmenování poukazuje na fakt, že příznaky encefalopatie nemusejí být vždy mírné, jak se dříve soudilo, ale mohou být velmi těžké, nebo naopak mohou zcela chybět [6].
Cílem tohoto sdělení je přehledně shrnout dosavadní poznatky o CLOCCs, přiblížit se pochopení jejich příčin a popsat klinické a radiologické nálezy s těmito lézemi spojené. Zároveň dokumentujeme pět případů CLOCCs, s nimiž jsme se setkali na našem pracovišti.
Etiologie
Ač je etiologie CLOCCS velmi různorodá, jako hlavní spouštěče se udávají epileptické záchvaty, užívání antiepileptické medikace a také poměrně široká škála metabolických onemocnění. Někteří autoři usuzují, že velká část případů je zapříčiněná infekcí [7]. Dalšími možnými příčinami jsou např. subarachnoidální krvácení, malignity CNS i jiné, trauma CNS, působení některých farmak či toxinů a další. Ojediněle je popsán výskyt CLOCCs u jedinců užívajících termogenní doplňky stravy („spalovače tuků“) [8]. Objevil se také jeden případ nemocného s obsedantně kompulzivní poruchou, u kterého vznikla CLOCC v souvislosti s intrakraniální infekcí po hluboké mozkové stimulaci [9]. Někdy se ovšem navzdory extenzivnímu vyšetření etiologii ozřejmit nepodaří.
Podrobný přehled možných příčin CLOCCs je uveden v tab. 1.
Tab. 1. Příčiny cytotoxických lézí corpus callosum. 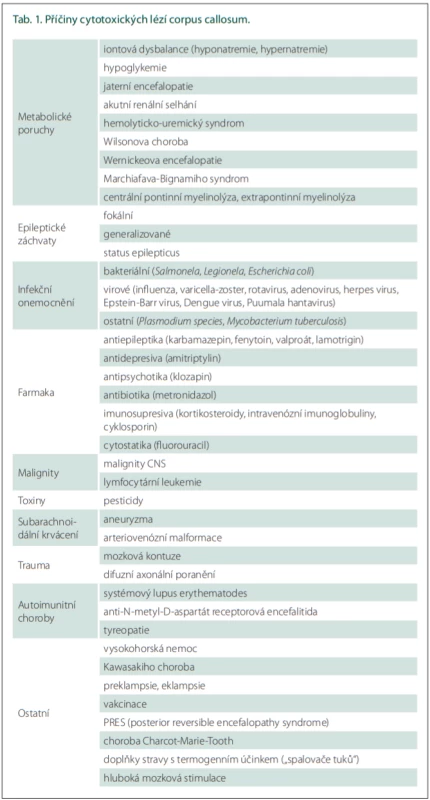
Ačkoli se většina dokumentovaných případů týká dospělých (často mladších), reverzibilní léze CC byly pozorovány i u dětí, jak uvádějí např. Le Bras et al na skupině sedmi kavkazských dětí [10].
Na našem pracovišti jsme se setkali s pěti případy CLOCCs u dospělých nemocných. Ve dvou případech byla vyvolávajícím mechanizmem virová infekce (virus influenzy, adenovirus) (obr. 1, 2), jedenkrát kraniotrauma (obr. 3), v jednom případě se jednalo o nemocnou s generalizovanou malignitou podstupující chemoterapii (obr. 4) a v jednom případě příčina nebyla zjištěna (obr. 5).
Obr. 1. 24letá žena s chřipkou A. Šipkou je označeno symetrické hyperintenzní ložisko ve splenium corporis callosi v T2-váženém zobrazení (a), FLAIR (b), difuzí vážených obrazech (d), hypointenzní v T1-váženém zobrazení (c) a na mapách ADC (e), hodnota ADC léze 0,295 × 10–3 mm2 /s. Ve druhém řádku je kontrola po 2 měsících ve shodných zobrazeních (f–j), ložisko vymizelo.
Fig. 1. 24-year-old female with infl uenza A. The arrow indicates a symmetrical hyperintense lesion in the splenium corporis cal losi in T2-weighted imaging (a), FLAIR (b), diff usion weighted imaging (d), hypointensive in T1-weighted imaging (c) and on ADC maps (e), the ADC value of the lesion was 0.295 × 10–3 mm2 /s. In the lower row, after 2 months of the same imaging (f–j), the lesion disappeared.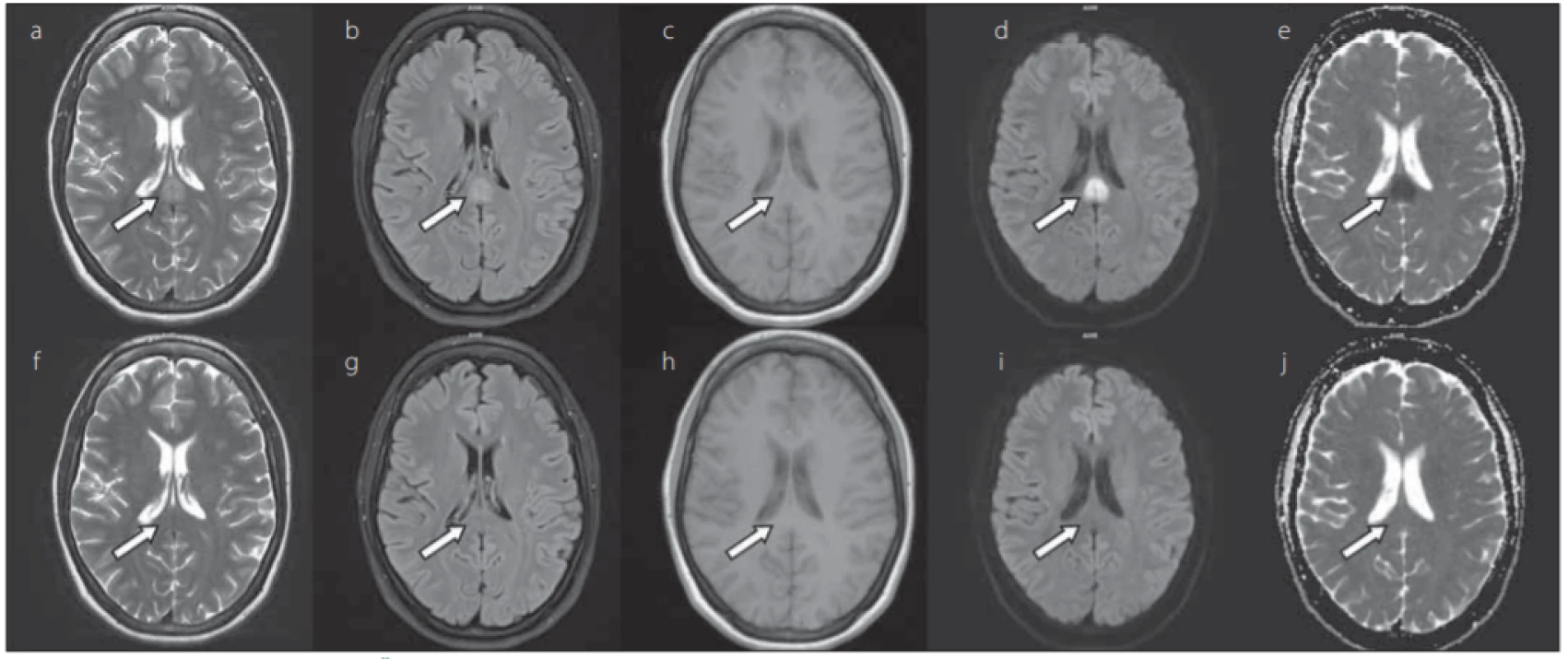
ADC – apparent diff usion coeffi cient; FLAIR – fl uid attenuated inversion recovery
ADC – apparent diff usion coeffi cient; FLAIR – fl uid attenuated inversion recoveryObr. 2. 35letý muž s adenovirovou gastroenteritidou. Šipkou je označeno symetrické hyperintenzní ložisko ve splenium corporis callosi v T2-váženém zobrazení (a), FLAIR (b), difuzí vážených obrazech (c), hypointenzní na mapách ADC (d), hodnota ADC léze 0,415 × 10–3 mm2 /s.
Fig. 2. 35-year-old male with adenoviral gastroenteritis. The arrow indicates a symmetrical hyperintense lesion in the splenium corporis callosi in a T2-weighted image (a), FLAIR (b), diff usion weighted imaging (c), hypointense on ADC maps (d), ADC value of the lesion was 0.415 × 10–3 mm2 /s.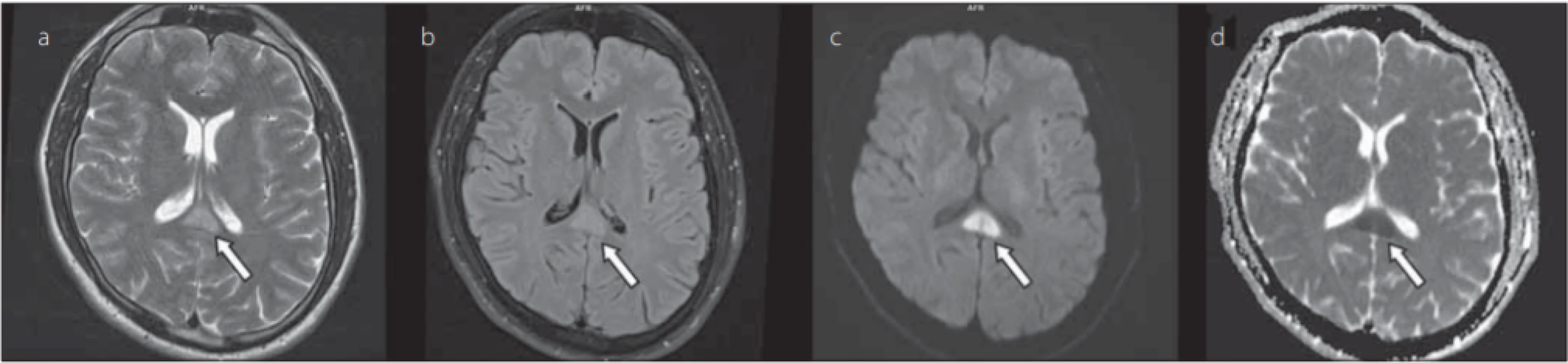
ADC – apparent diff usion coeffi cient; FLAIR – fl uid attenuated inversion recovery
ADC – apparent diff usion coeffi cient; FLAIR – fl uid attenuated inversion recoveryObr. 3. 23letý muž s kraniotraumatem po autonehodě. Šipkou je označeno symetrické hyperintenzní ložisko ve splenium corporis callosi v T2 váženém zobrazení (a), FLAIR (b), difuzí vážených obrazech (c), hypointenzní na mapách ADC (d), hodnota ADC léze 0,276 × 10–3 mm2 /s.
Fig. 3. 23-year-old male after car accident with craniotrauma. The arrow indicates a symmetrical hyperintense lesion in the splenium corporis callosi in a T2-weighted image (a), FLAIR (b), diff usion weighted imaging (c), hypointense on ADC maps (d), ADC value of the lesion was 0.276 × 10–3 mm2 /s.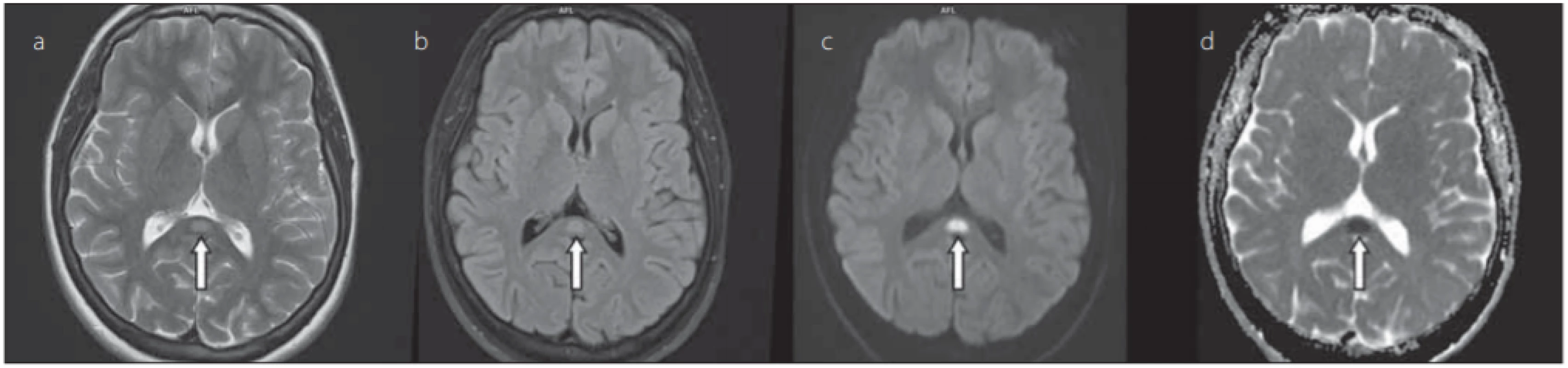
ADC – apparent diff usion coeffi cient; FLAIR – fl uid attenuated inversion recovery
ADC – apparent diff usion coeffi cient; FLAIR – fl uid attenuated inversion recoveryObr. 4. 66letá žena s generalizovaným karcinomem prsu. Šipkou je označeno asymetricky vpravo uložené hyperintenzní ložisko ve splenium corporis callosi v T2-váženém zobrazení (a), FLAIR (b), difuzí vážených obrazech (c), hypointenzní na mapách ADC (d), hodnota ADC léze 0,423 × 10–3 mm2 /s.
Fig. 4. 66-year-old female with generalized breast cancer. The arrow indicates asymmetrically on the right side localized hyperintense lesion in the splenium corporis callosi in a T2-weighted image (a), FLAIR (b), diff usion weighted imaging (c), hypointense on ADC maps (d), ADC value of the lesion was 0.423 × 10–3 mm2 /s.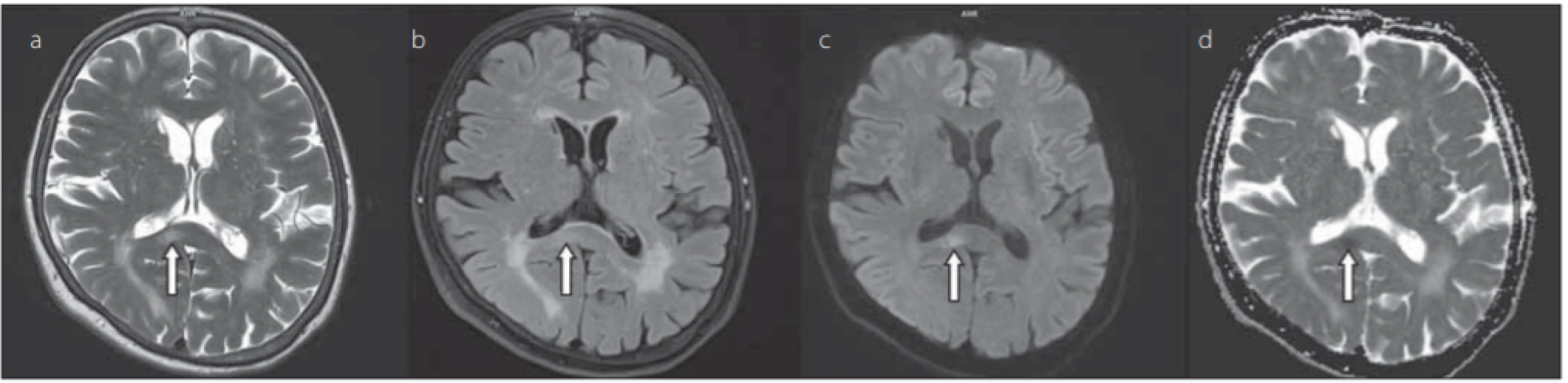
ADC – apparent diff usion coeffi cient; FLAIR – fl uid attenuated inversion recovery
ADC – apparent diff usion coeffi cient; FLAIR – fl uid attenuated inversion recoveryObr. 5. 37letý muž s CLOCC neznámé příčiny. Šipkou je označeno mírně asymetrické hyperintenzní ložisko ve splenium corporis callosi v T2-váženém zobrazení (a), FLAIR (b), difuzí vážených obrazech (c), hypointenzní na mapách ADC (d), hodnota ADC léze 0,261 × 10–3 mm2 /s.
Fig. 5. 37-year-old male with CLOCC of unknown cause. The arrow indicates a slightly asymmetric hyperintense lesion in the splenium corporis callosi in a T2-weighted image (a), FLAIR (b), diff usion weighted imaging (c), hypointense on ADC maps (d), ADC value of the lesion was 0.261 × 10–3 mm2 /s.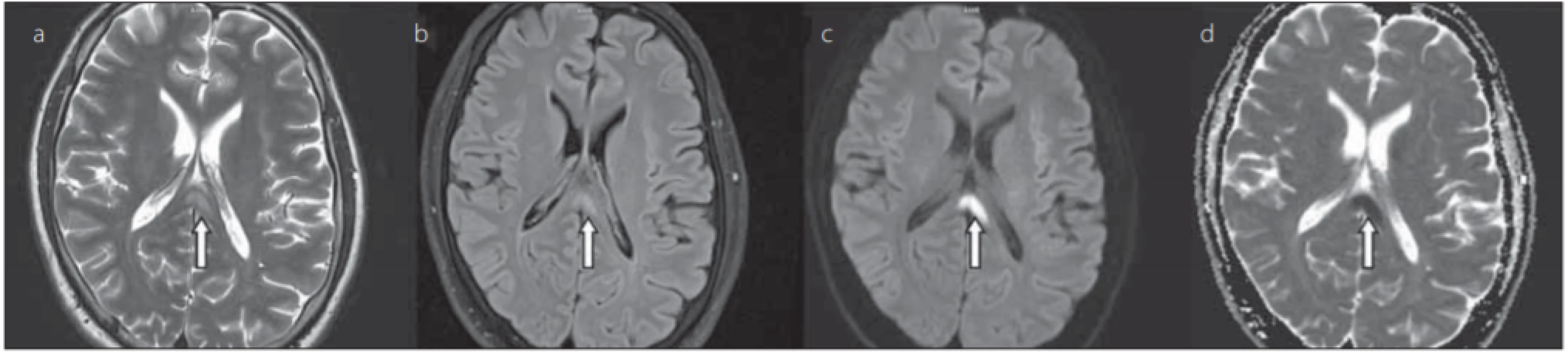
ADC – apparent diff usion coeffi cient; FLAIR – fl uid attenuated inversion recovery
ADC – apparent diff usion coeffi cient; FLAIR – fl uid attenuated inversion recoveryAnatomie corpus callosum
Corpus callosum představuje hlavní a největší mozkovou komisuru. Sestává přibližně z 200–300 milionů myelinizovaných nervových vláken, která spojují obě mozkové hemisféry (oblasti neokortexu). Vlákna CC vytvářejí v hemisférách radiationes corporis callosi. Velikost jednotlivých vláken se v různých oblastech liší [11]. Čtyři hlavní části CC jsou: genu, rostrum, tělo, splenium. Spojuje frontální, parietální a okcipitální laloky hemisfér, v temporálních lalocích spojuje pouze sluchové korové oblasti. Četné komisurální spoje mají asociační korové oblasti, premotorická a suplementární motorická oblast, stejně tak i zraková korová oblast pro střed zorného pole. Komisurální vlákna naopak chybějí v motorických a senzitivních okrscích kůry pro distální části horních a dolních končetin a v části zrakové korové oblasti určené pro periferii zorného pole.
Počátky vývoje CC lze pozorovat mezi 8. a 16. týdnem prenatálního vývoje. Jako poslední část CC se vyvíjí rostrum – zhruba mezi 18. a 20. týdnem gestace [12]. Po narození dochází k jeho rychlému růstu. Ve 3.–4. měsíci věku dochází při vyšetření MR ke zvýšení intenzity signálu v oblasti splenia [13]. V 7.–8. měsíci je již patrná myelinizace celého CC (zvýšená intenzita signálu v T1-váženém obrazu oproti ostatní mozkové tkáni), ale velikostí ještě neodpovídá dospělým jedincům. Podle některých autorů dosahuje v 8. měsíci oblast splenia zhruba 55 % průměrné velikosti splenia dospělého [14]. Mezi 9. a 12. měsícem věku je vývoj tvaru i intenzity signálu v obraze MR ukončen [15].
Cévní zásobení CC je poměrně bohaté, proto je tato oblast zřídka postižena infarkty. Hlavní přívod krve zajišťuje arteria pericallosa, u většiny jedinců se podílejí také větve arteria communicans anterior a terminální a choroidální větve arteria cerebri posterior. Žilní drenáž obvykle zajišťují venae callosae a venae callosocingulatae [16].
Patofyziologie
Mechanizmy vedoucí ke vzniku reverzibilních signálních změn v CC nejsou dosud přesně pochopeny. Podstatou těchto patofyziologických dějů je s největší pravděpodobností aktivace stereotypní kaskády cytokinů a jimi stimulovaných buněk, což v konečném výsledku vede k masivnímu zvýšení hladiny glutamátu v extracelulární tekutině. Následná interakce s receptory buněčné membrány vede k influxu vody do astrocytů a neuronů, který se makroskopicky projevuje jako cytotoxický edém. Hypotéz je ale více. Podle některých autorů se jedná o autoimunitní proces [17], podle jiných hrají hlavní roli oxidační stres [18] či např. hyponatremie [19] a jiné. Jedná se o společné mechanizmy, které mají různé příčiny, ale vedou ke stejnému výsledku.
Hladiny cytokinů a také glutamátu v mozku jsou regulovány komplexními vzájemně propojenými mechanizmy [20]. Za patologické situace, jako jsou např. zánět či trauma, dochází k aktivaci makrofágů, které následně uvolňují prozánětlivé cytokiny interleukin-1 a interleukin-6. Tím začíná kaskáda vedoucí k cytokinopatii (vč. náboru T-lymfocytů). Mnoho z těchto vztahů mezi buňkami a cytokiny zahrnuje zpětnovazební smyčky. Působením T-lymfocytů dochází ke snížení těsnosti endoteliálních buněk a tím ke zvýšení propustnosti hematoencefalické bariéry. T-lymfocyty také stimulují endoteliální buňky k produkci tumor nekrotizujícího faktoru alfa [21–23]. Interleukin-1 stimuluje astrocyty k uvolňování glutamátu a zároveň k tomu, aby blokovaly zpětné vychytávání glutamátu. Tím se hladina glutamátu v extracelulární tekutině exponenciálně zvyšuje [24]. Glutamát interaguje s řadou receptorů buněčné membrány (N-methyl-D-aspartát receptory [NMDA], alfa-amino-3-hydroxy-5-methyl-4-isoxazole-propionát receptory [AMPA]), se sodíkovou pumpou a aquaporiny. To zapříčiní přesun vody do astrocytů a neuronů a manifestaci cytotoxického edému.
Corpus callosum obecně – a zejména splenium – je výrazně citlivé vůči působení cytokinů. Ve srovnání s jinými mají tyto oblasti mozku vysokou hustotu oligodendrocytů exprimujících velké množství receptorů ovlivněných glutamátem.
Předpokládá se, že cytotoxický edém zapříčiní ireverzibilní lézi a buněčnou smrt. To je v rozporu s jednou ze základních charakteristik CLOCCs, nicméně podle některých autorů může být poškození v menším počtu případů skutečně nevratné [6]. Zatímco např. u ischemií bývá obnovena funkce neuronů, pokud dojde ke zlepšení perfuze během několika hodin, v případě cytotoxického edému způsobeného uvolněním cytokinů trvá tento proces déle.
Klinický obraz
Klinická manifestace závisí do jisté míry na vyvolávající patologii více než na samotné lézi CC. Proto je spektrum příznaků poměrně široké, což činí diagnózu obtížnou. Přímé poškození tkáně CC se projevuje neurologickými příznaky, jakými jsou porucha řeči (afázie, dysartrie), porucha hybnosti a/nebo citlivosti (často distální parestezie), tremor, ataxie, porucha zraku. Časté jsou také kognitivní postižení, změny osobnosti a chování, závratě, poruchy vědomí od somnolence až po kóma. Těžká porucha vědomí je přitom považována za nepříznivý prognostický faktor [6]. Někteří autoři popisují také gastrointestinální příznaky (zvracení, průjem) [25] či akutní retenci moči [26].
Velká část nemocných ovšem vykazuje jen nespecifické symptomy [27], mezi nimi především bolesti hlavy [8]. Nejčastějším prodromálním jevem bývá horečka, která může ostatním potížím předcházet nebo je doprovází, převážně u jedinců, u nichž je příčinou CLOCC infekční onemocnění. Někteří nemocní mohou mít dokonce pouze horečku, případně spojenou s bolestí hlavy, bez neurologického postižení [28]. CLOCC se na rozdíl od jiných lézí CC obvykle neprojevuje známkami hemisferální diskonekce, jakými je např. pseudoneglect, alien hand syndrom, apraxie levé ruky, alexie, agrafie či vizuální apraxie [29].
Diagnostika
Klíčovou vyšetřovací metodou v diagnostice CLOCCs je MR. Typický je nález lézí, které jsou hyperintenzní v T2 vážených obrazech, v sekvencích T2-FLAIR (fluid attenuated inversion recovery) a v difuzně vážených obrazech (diffusion weighted imaging; DWI) a hypointenzní v T1 vážených obrazech [30].
Nejcharakterističtější pro ložiska je však výrazná restrikce difuze, tedy hypointenzita na mapách ADC (apparent diffusion coefficient) s průměrnými hodnotami ADC kolem 0,31 × 10–3 mm2/s [31,32]. Difuze je definována jako náhodný neuspořádaný translační pohyb molekul, jehož zdrojem je tepelná energie [33]. DWI zobrazují velikost difuze v biologických tkáních pomocí aplikace silných gradientů magnetického pole [15]. Pokud se jedná o restrikci difuze, musí mít hypersignální oblast na DWI s vysokým tzv. b faktorem (> 800 s/mm2) hyposignální korelát na odvozených mapách ADC [33]. Podkladem restrikce difuze může být cytotoxický edém a zvýšená celularita.
Popisovány jsou 3 různé podoby lézí: 1. malé, dobře ohraničené ovoidní léze ve střední části splenia (nejčastější typ); 2. rozsáhlejší, hůře ohraničené, nepravidelné léze ve spleniu zasahující až do přilehlých částí hemisfér („boomerang sign“); 3. rozsáhlejší léze zasahující dopředu do těla CC. Velikost lézí zřejmě závisí i na etiologii – menší léze jsou vídány především u pacientů s epileptickými záchvaty (častěji při změně antiepileptické terapie), zatímco větší léze bývají spjaty spíše s jinými příčinami.
Ložiska jsou na MR detekovatelná v řádech týdnů až měsíců. Některé studie uvádějí, že mizí cca jeden týden po odeznění neurologických příznaků, takové příznaky však nemusejí být vždy vyjádřeny, jak uvádíme výše.
Diferenciální diagnostika
Diferenciálně diagnosticky je nutno zvažovat především ischemickou CMP způsobenou infarktem v oblasti CC (která je nicméně velmi vzácná), dále pak demyelinizační onemocnění typu RS či akutní diseminované encefalomyelitidy. Do jisté míry mohou obrazu CLOCCs odpovídat také tumory CNS (především gliom či lymfom), traumata či syndrom zadní reverzibilní encefalopatie (posterior reversible encephalopathy syndrome; PRES). Zajímavé je, že např. tyto poslední tři zmiňované jednotky CLOCCs nejen napodobují, ale podle některých autorů i způsobují.
Vždy je samozřejmě nutné pro přesnou diagnostiku posuzovat komplexně celý nález radiologický i klinický. Např. u RS je izolované postižení CC méně pravděpodobné, obvykle vídáme další léze, typicky periventrikulárně v bílé hmotě. Někdy však definitivní stanovení diagnózy umožní až opakované vyšetření MR.
Léčba a prognóza
Specifická terapie není známa, klíčová je léčba vyvolávající příčiny. Prognóza je většinou velmi dobrá, zejména u CLOCCs zapříčiněných epileptickými záchvaty či užíváním antiepileptik.
Závěr
Cytotoxické léze CC jsou léze sekundárně vzniklé v souvislosti s celou řadou rozličných příčin, především s metabolickými chorobami, epileptickými záchvaty, infekčními onemocněními a působením farmak.
Patofyziologické děje vedoucí ke vzniku signálních změn v CC nejsou dosud zcela přesně pochopeny a popsány. Pravděpodobně se jedná o výsledek kaskády komplexních mechanizmů, především zánětlivých změn a zvýšení extracelulární hladiny glutamátu v mozku, manifestujících se ve výsledku jako cytotoxický edém.
Klinické projevy jsou velmi variabilní. Neurologické postižení kolísá od lehkého po těžké, může však také zcela chybět. Z nespecifických příznaků jsou nejčastější bolesti hlavy, případně horečka.
Hlavní vyšetřovací metodou je MR s typickým nálezem restrikce difuze s korelátem na mapách ADC.
Klíčem k úspěšné terapii je identifikace a léčba příčiny. Léze jsou ve většině případů reverzibilní, a prognóza je tak velmi dobrá, rovněž ale v závislosti na vyvolávající patologii.
S tím, jak se v posledních letech zlepšuje dostupnost MR a vzrůstá počet vyšetření, se také množí počet nálezů, které můžeme označit jako cytotoxické léze CC. Do budoucna bude tento trend jistě pokračovat, což při větším počtu nemocných umožní další pochopení příčin, vzniku, projevů a dalších dosud nepopsaných mechanizmů CLOCCs.
Grantová podpora
Podpořeno projektem institucionálního výzkumu MZČR-FNPl 00669806 a SVV Univerzity Karlovy, Lékařské fakulty v Plzni 260 390.
Konflikt zájmů
Autoři prohlašují, že v souvislosti s předmětem práce nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 22. 4. 2020
Přijato do tisku: 2. 7. 2020
MUDr. Jolana Mračková, Ph.D.
Neurologická klinika LF UK a FN Plzeň
Alej Svobody 923/80
323 00 Plzeň
e-mail: mrackovaj@fnplzen.cz
Zdroje
1. Starkey J, Kobayashi N, Numaguchi Y et al. Cytotoxic lesions of the corpus callosum that show restricted diffusion: mechanisms, causes, and manifestations. Radiographics 2017; 37 (2): 562–576. doi: 10.1148/rg.2017160085.
2. Conti M, Salis A, Urigo C et al. Transient focal lesion in the splenium of the corpus callosum: MR imaging with an attempt to clinical-physiopathological explanation and review of the literature. Radiol Med 2007; 112 (6): 921–935. doi: 10.1007/s11547-007-0197-9.
3. Fujiki Y, Nakajima H, Ito T et al. A case of clinically mild encephalitis/encephalopathy with a reversible splenial lesion associated with anti-glutamate receptor antibody [in Japanese]. Rinsho Shinkeigaku 2011; 51 (7): 510–513. doi: 10.5692/clinicalneurol.51.510.
4. Böttcher J, Kunze A, Kurrat C et al. Localized reversible reduction of apparent diffusion coefficient in transient hypoglycemia-induced hemiparesis. Stroke 2005; 36 (3): e20–e22. doi: 10.1161/01.STR.0000155733.65215.c2.
5. Kazi AZ, Joshi PC, Kelkar AB et al. MRI evaluation of pathologies affecting the corpus callosum: a pictorial essay. Indian J Radiol Imaging 2013; 23 (4): 321–332. doi: 10.4103/0971-3026.125604.
6. Doherty MJ, Jayadev S, Watson NF et al. Clinical implications of splenium magnetic resonance imaging signal changes. Arch Neurol 2005; 62 (3): 433–437. doi: 10.1001/archneur.62.3.433.
7. Garcia-Monco JC, Cortina IE, Ferreira E et al. Reversible splenial lesion syndrome (RESLES): What‘s in a name? J Neuroimaging 2011; 21 (2): e1–e14. doi: 10.1111/j.1552-6569.2008.00279.x.
8. Galnares-Olalde JA, Vázquez-Mézquita AJ, Gómez-Garza G et al. Cytotoxic lesions of the corpus callosum caused by thermogenic dietary supplements. AJNR Am J Neuroradiol 2019; 40 (8): 1304–1308. doi: 10.3174/ajnr.A6116.
9. Bagatti D, Messina G. Cytotoxic lesion in the splenium of corpus callosum associated with intracranial infection after deep brain stimulation. World Neurosurg 2020; 135 : 306–307. doi: 10.1016/j.wneu.2019.12.114.
10. Le Bras A, Proisy M, Kuchenbuch M et al. Reversible lesions of the corpus callosum with initially restricted diffusion in a series of Caucasian children. Pediatr Radiol 2018; 48 (7): 999–1007. doi: 10.1007/s00247-018-4124-x.
11. Knyazeva MG. Splenium of corpus callosum: Patterns of interhemispheric interaction in children and adults. Neural Plasticity 2013; 2013 : 639430. doi: 10.1155/2013/639430.
12. Rakic P, Yakovlev PI. Development of the corpus callosum and cavum septi in man. J Comp Neurol 1968; 132 (1): 45–72. doi: 10.1002/cne.901320103.
13. Deoni SC, Mercure E, Blasi A et al. Mapping infant brain myelination with magnetic resonance imaging. J Neurosci 2011; 31 (2): 784–791. doi: 10.1523/JNEUROSCI.2106-10.2011.
14. Blaauw J, Meiners LC. The splenium of the corpus callosum: embryology, anatomy, function and imaging with pathophysiological hypothesis. Neuroradiology 2020; 62 (5): 563–585. doi: 10.1007/s00234-019-02357-z.
15. Seidl Z, Vaněčková M. Diagnostická radiologie: neuroradiologie. 1. vyd. Praha: Grada Publishing 2014: 12–15.
16. Kakou M, Velut S, Destrieux C. Arterial and venous vascularization of the corpus callosum. Neurochirurgie 1998; 44 (1 Suppl): 31–37.
17. Kaminski JA, Prüss H. N-methyl-d-aspartate receptor encephalitis with a reversible splenial lesion. Eur J Neurol 2019; 26 (6): e68–e69. doi: 10.1111/ene.13900.
18. Miyata R, Tanuma N, Hayashi M et al. Oxidative stress in patients with clinically mild encephalitis/encephalopathy with a reversible splenial lesion (MERS). Brain Dev 2012; 34 (2): 124–127. doi: 10.1016/j.braindev.2011.04.004.
19. Takanashi J, Tada H, Maeda M et al. Encephalopathy with a reversible splenial lesion is associated with hyponatremia. Brain Dev 2009; 31 (3): 217–220. doi: 10.1016/j.braindev.2008.04.002.
20. Phelps C, Korneva E (eds). Neuroimmune biology. Vol 6, Cytokines and the brain. Amsterdam, Netherlands: Elsevier 2008.
21. Leonoudakis D, Braithwaite SP, Beattie MS et al. TNFa-induced AMPA-receptor trafficking in CNS neurons: relevance to excitotoxicity? Neuron Glia Biol 2004; 1 (3): 263–273. doi: 10.1017/S1740925X05000608.
22. Kim YS, Honkaniemi J, Sharp FR et al. Expression of proinflammatory cytokines tumor necrosis factor-a and interleukin-1b in the brain during experimental group B streptococcal meningitis. Brain Res Mol Brain Res 2004; 128 (1): 95–102. doi: 10.1016/j.molbrainres.2004. 06.009.
23. Kita T, Tanaka T, Tanaka N et al. The role of tumor necrosis factor-a in diffuse axonal injury following fluid-percussive brain injury in rats. Int J Legal Med 2000; 113 (4): 221–228. doi: 10.1007/s004149900095.
24. Prow NA, Irani DN. The inflammatory cytokine, interleukin-1 beta, mediates loss of astroglial glutamate transport and drives excitotoxic motor neuron injury in the spinal cord during acute viral encephalomyelitis. J Neurochem 2008; 105 (4): 1276–1286. doi: 10.1111/j.1471-4159.2008.05230.x.
25. Takanashi J, Barkovich AJ, Shiihara T et al. Widening spectrum of a reversible splenial lesion with transiently reduced diffusion. Am J Neuroradiol 2006; 27 (4): 836–838.
26. Yuan ZF, Shen, J, Mao SS et al. Clinically mild encephalitis/encephalopathy with a reversible splenial lesion associated with Mycoplasma pneumoniae infection. BMC Infect Dis 2016; 26 (16): 230. doi: 10.1186/s12879-016-1690-0.
27. Li S, Sun X, Bai YM et al. Infarction of the corpus callosum: a retrospective clinical investigation. PLoS ONE; 10 (3): e0120409. doi: 10.1371/journal.pone.0120409
28. Tsuji M, Yoshida T, Miyakoshi C et al. Is a reversible splenial lesion a sign of encephalopathy? Pediatr Neurol 2009; 41 (2): 143–145. doi: 10.1016/j.pediatrneurol. 2009.02.019.
29. Malhotra HS, Garg RK, Vidhate MR et al. Boomerang sign: clinical significance of transient lesion in splenium of corpus callosum. Ann Indian Acad Neurol 2012; 15 (2): 151–157. doi: 10.4103/0972-2327.95005.
30. Tada H, Takanashi J, Barkovich AJ et al. Clinically mild encephalitis/encephalopathy with a reversible splenial lesion. Neurology 2004; 63 (10): 1854–1858. doi: 10.1212/01.wnl.0000144274.12174.cb.
31. Hoshino A, Saitoh M, Oka A et al. Epidemiology of acute encephalopathy in Japan, with emphasis on the association of viruses and syndromes. Brain Dev 2012; 34 (5): 337–343. doi: 10.1016/j.braindev.2011.07.012.
32. Maeda M, Tsukahara H, Terada H et al. Reversible splenial lesion with restricted diffusion in a wide spectrum of diseases and conditions. J Neuroradiol 2006; 33 (4): 229–236. doi: 10.1016/s0150-9861 (06) 77268-6.
33. Sedláčková Z, Dorňák T, Čecháková E et al. Přehled onemocnění s obrazem restrikce difuze na magnetické rezonanci mozku. Cesk Slov Neurol N 2018; 81/114 (5): 539–545. doi: 10.14735/amcsnn2018539.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek EditorialČlánek Recenze knih
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Editorial
- Cytotoxické léze corpus callosum (CLOCCs)
- Poranění radiálního nervu při zlomeninách diafýzy pažní kosti
- Je jasné, kdy operovat výhřez bederní meziobratlové ploténky?
- Současná diagnostika sekundárně progresivní formy roztroušené sklerózy a léčba siponimodem
- Roztroušená skleróza – odhalené tajemství imunity
- Hygiena dýchacích cest u pacientů s Parkinsonovou nemocí – přehled problematiky a možnosti fyzioterapeutické intervence
- Klinické a sociální prediktory kvality života u dětí a mladších dospělých s poruchou autistického spektra
- Bezpečnost karotické endarterektomie s ohledem na její načasování po ischemické cévní mozkové příhodě
- Glatiramer acetát – léčba roztroušené sklerózy monitorovaná v registru ReMuS
- Intenzivní rehabilitace kognitivních funkcí u osob s roztroušenou sklerózou – výsledky 12týdenní randomizované studie hodnocené počítačovým programem
- Účinnost a bezpečnost urgentní mikrochirurgické embolektomie při selhání intravenózní trombolýzy a mechanické trombektomie u pacientů s akutním ischemickým iktem – protokol systematického review
- Vliv pandemie COVID-19 na spánkovou medicínu v České republice a na Slovensku
- Prevalence a charakteristika epilepsie u pacientů s relabující-remitující formou roztroušené sklerózy léčených imunomodulační terapií
- Syndrom moyamoya doprovázený polycystickou chorobou ledvin – kazuistika vzácného onemocnění a přehled literatury
- Souběh dvou oportunních infekcí jako první projev HIV
- Dropped head syndrom u pacientky s progredující bulbární paralýzou
- Karotický paragangliom, velmi vzácný nádor v dětském věku
- Využití kvantitativní MR venografie v indikaci stentingu stenózy žilního splavu
- Transvenózna embolizácia prasknutej piálnej arteriovenóznej malformácie
- CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
- Recenze knih
- 2020 AAN Highlights Dlouhodobá data o účinnosti deplece CD20+ B-buněk v léčbě RS
- 2020 AAN Highlights Jak mění malá molekula průběh spinální svalové atrofie?
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Je jasné, kdy operovat výhřez bederní meziobratlové ploténky?
- CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
- Cytotoxické léze corpus callosum (CLOCCs)
- Dropped head syndrom u pacientky s progredující bulbární paralýzou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



