-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Bezpečnost karotické endarterektomie s ohledem na její načasování po ischemické cévní mozkové příhodě
Safety of carotid endarterectomy in relation to the timing after ischemic stroke
Aim: To assess the procedural risk of carotid endarterectomy (CEA) in relation to its timing after ischemic stroke and to define the reasons that delay surgery beyond the recommended time interval.
Materials and methods: A retrospective analysis was performed using prospectively collected data from all consecutive patients with symptomatic internal carotid artery stenosis who underwent CEA during the period from January 2013 to August 2019. The patients were divided into four groups according to the timing of CEA: group 1 – CEA within 2 days; group 2 – CEA between 3–7 days; group 3 – CEA between 8–14 days; and group 4 – CEA between 15–180 days. The primary outcome measure was the combined perioperative rate of any stroke or death within 30 days.
Results: A total of 246 patients were included in the study. The median time interval between stroke and CEA was 8 days. A total of 191 patients (77.6%) underwent CEA within the recommended 14-day period from ischemic stroke, whereas 55 patients (22.4%) underwent CEA more than 14 days after stroke. Medical reasons were the cause of CEA delay in only 18 out of these 55 patients. For the entire cohort, the overall 30-day rate of any stroke or death was 3.7% (9 patients out of 246). The procedural risk was 5.9% (3 patients out of 51) in group 1, 1.5% (1 patient of 68) in group 2, 5.6% (4 patients out of 72) in group 3, and 1.8% (1 patient out of 55) in group 4 (P = 0.477).
Conclusion: In this study, the time interval between the stroke and CEA was not associated with significant increase of procedural risk of any stroke or death.
Keywords:
carotid endarterectomy – stroke – emergent – periprocedural complications
Autoři: I. Guňka 1; D. Krajíčková 2; M. Leško 1; S. Jiška 1; J. Raupach 3; V. Chovanec 3; Miroslav Lojík 3
; A. Hudák 1; O. Renc 3
; R. Malý 4
Působiště autorů: Chirurgická klinika LF UK a FN Hradec Králové 1; Neurologická klinika LF UK a FN Hradec Králové 2; Radiologická klinika LF UK a FN Hradec Králové 3; I. interní kardioangiologická klinika LF UK a FN Hradec Králové 4
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(4): 394-399
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn2020394Souhrn
Cíl: Analyzovat procedurální rizika karotické endarterektomie (carotid endarterectomy; CEA) ve vztahu k jejímu načasování po ischemické CMP a definovat příčiny, které vedou k odkladu operace mimo doporučovaný časový interval.
Materiál a metodika: Byla provedena retrospektivní analýza prospektivně sbíraných dat všech pacientů, kteří v období od ledna 2013 do srpna 2019 podstoupili CEA pro symptomatickou stenózu vnitřní krkavice. Pacienti byli rozděleni do 4 skupin podle načasování CEA: skupina 1 – CEA do 2 dnů; skupina 2 – CEA mezi 3. a 7. dnem; skupina 3 – CEA mezi 8. a 14. dnem; skupina 4 – CEA mezi 15. a 180. dnem. Primárním sledovaným cílem bylo 30denní riziko jakékoliv CMP nebo smrti.
Výsledky: Do studie bylo zařazeno celkem 246 pacientů. Střední doba mezi CMP a CEA byla 8 dnů. V doporučovaném časovém intervalu 14 dnů od ischemické CMP bylo operováno celkem 191 pacientů (77,6 %), 55 pacientů (22,4 %) podstoupilo CEA za více než 14 dnů od CMP, přičemž medicínské důvody byly příčinou odkladu operace pouze u 18 (32,7 %) z těchto 55 pacientů. Pro celou kohortu pacientů bylo 30denní riziko jakékoliv CMP nebo smrti 3,7 % (9 pacientů z 246). Toto riziko dosáhlo 5,9 % (3 pacienti z 51) ve skupině 1, 1,5 % (1 pacient z 68) ve skupině 2, 5,6 % (4 pacienti ze 72) ve skupině 3 a 1,8 % (1 pacient z 55) ve skupině 4 (p = 0,477).
Závěr: Tato studie prokázala, že časový interval mezi CMP a CEA není spojen se signifikantním nárůstem periprocedurálního rizika jakéhokoliv iktu nebo smrti.
Klíčová slova:
cévní mozková příhoda – karotická endarterektomie – urgentní – periprocedurální komplikace
Úvod
Karotická endarterektomie (carotid endarterectomy; CEA) má v rámci sekundární prevence ischemického iktu u pacientů se symptomatickou 50–99% stenózou vnitřní krkavice (arteria carotis interna; ACI) své jasně definované místo [1,2]. Výsledky metaanalýzy studií NASCET (North American Symptomatic Carotid Surgery Trial) a ECST (European Carotid Surgery Trial) jednoznačně prokázaly, že největší benefit CEA přináší, pokud je provedena do 14 dnů od posledních klinických symptomů cerebrální ischémie a že s rostoucím časovým odstupem její preventivní význam signifikantně klesá [3]. Operační výkony byly nicméně donedávna odkládány za 4–6 týdnů po ischemické CMP (iCMP), a to zejména z obavy rizika hemoragické transformace akutního cerebrálního infarktu a z důvodu, že časná CEA byla spojována s významným zvýšením periprocedurálních rizik.
I přes aktuální doporučení není zatím časná CEA optimálně implementována do běžné klinické praxe. Data z několika národních registrů ukazují, že 28–47,5 % pacientů je stále operováno mimo doporučený 14denní časový interval [4–7]. Navíc urgentní endarterektomie provedená v průběhu prvních 48 h je i dnes považována za silně kontroverzní, neboť tyto velmi časné výkony jsou spojovány se signifikantním nárůstem operačních rizik, které mohou převážit protektivní efekt operace [4,8,9].
Cílem této studie bylo analyzovat rizika CEA ve vztahu k jejímu načasování po iCMP a definovat příčiny, které vedou k odkladu operace mimo doporučovaný časový interval.
Materiál a metodika
Provedli jsme retrospektivní analýzu prospektivně sbíraných dat všech pacientů, kteří v období od ledna 2013 do srpna 2019 podstoupili CEA. Do prezentované studie pak byli zařazeni všichni pacienti se symptomatickou 50–99% stenózou ACI, která se klinicky manifestovala jak retinálními (amaurosis fugax, retinální infarkt), tak hemisferálními příznaky (tranzitorní ischemická ataka [TIA], crescendo TIA, dokončený malý nebo střední iktus). Crescendo TIA byla definována jako alespoň dvě epizody tranzitorní fokální neurologické dysfunkce v průběhu 24 h nebo tři takové epizody v průběhu 3 dnů bez průkazu akutního cerebrálního infarktu. Vzhledem k tomu, že problematika CEA u neurologicky nestabilních pacientů s progredujícím iktem (stroke in evolution; SIE) je odlišná a operace zde nemá sekundárně preventivní, ale spíše kurativní smysl, byli tito nemocní ve snaze o vytvoření co nejhomogennějšího souboru pacientů ze studie vyloučeni (obr. 1).
Obr. 1. Vývojový diagram výběru pacientů do studie.
Fig. 1. Flow-chart of patients selection for the study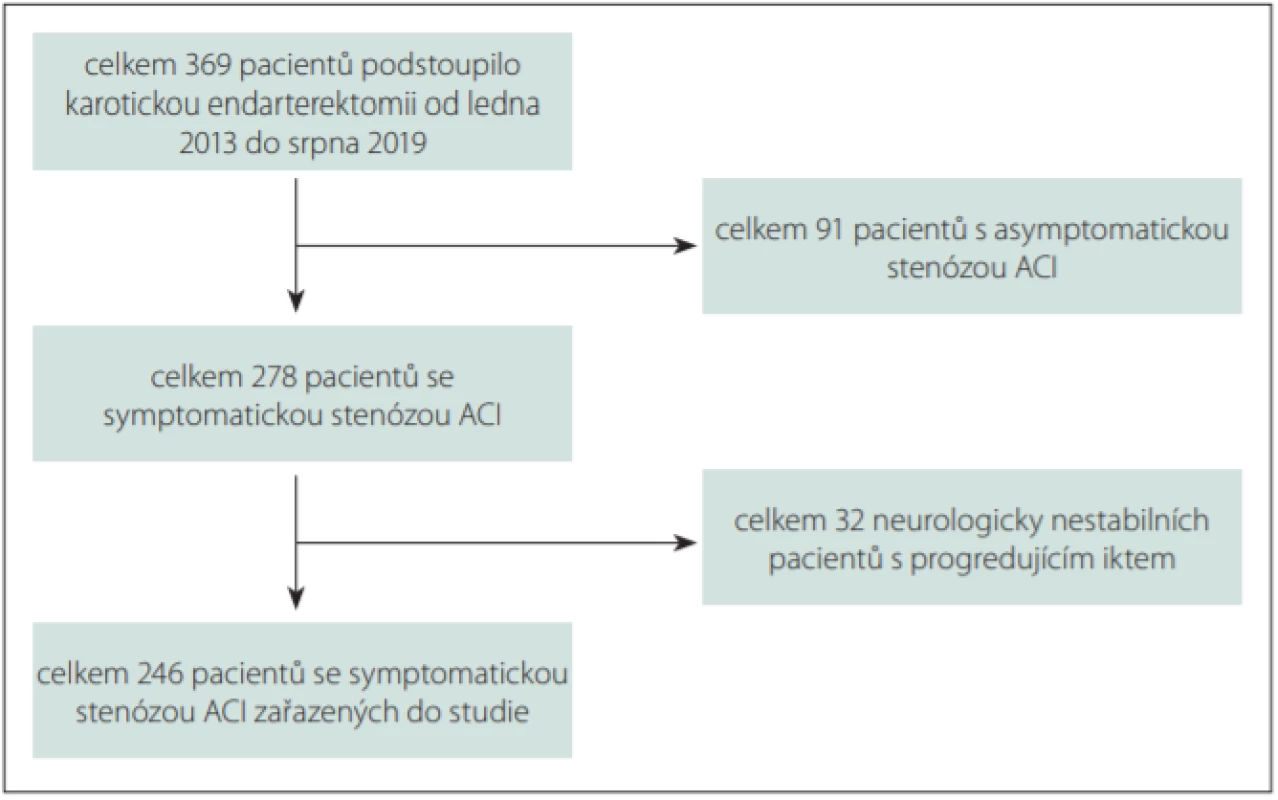
ACI – arteria carotis interna
ACI – internal carotid arteryPro účely analýzy rizik CEA s ohledem na její načasování po iCMP byli pacienti rozděleni do 4 skupin: skupina 1 – CEA do 2 dnů (urgentní CEA); skupina 2 – CEA mezi 3. a 7. dnem; skupina 3 – CEA mezi 8. a 14. dnem (skupina 2 a 3 časná CEA); skupina 4 – CEA mezi 15. a 180. dnem (odložená CEA). V případě recidivující symptomatologie byl čas do operace počítán od okamžiku poslední neurologické symptomatologie. Pacienti, kteří podstoupili CEA za více než 180 dnů od CMP, byli již považováni za asymptomatické a byli z analýzy vyloučeni.
Předoperačně byly u všech pacientů provedeny klinické vyšetření neurologem a následně cévním chirurgem, dále základní laboratorní a elektrokardiografické vyšetření a všichni pacienti podstoupili nativní CT mozku a CTA. Klinická závažnost iktu byla hodnocena podle klasifikace National Institutes of Health Stroke Scale (NIHSS); NIHSS 1–4 malý iktus, NIHSS 4–15 středně těžký iktus.
Operační výkony byly výhradně prováděny v regionální anestézii. Celková anestézie byla použita v případě nutnosti konverze regionální anestézie u neklidných nebo obtížně spolupracujících pacientů. U výkonu v celkové anestézii byl během CEA rutinně zaváděn shunt. CEA byla prováděna jak everzní, tak konvenční technikou, přičemž volba záležela na aktuálních anatomických poměrech a rozhodnutí operatéra.
Pooperačně byli všichni pacienti 24–48 h monitorováni na jednotce intenzivní péče. V případě jakékoliv deteriorace neurologického stavu byly okamžitě provedeny kontrolní nativní CT mozku a CTA. Před propuštěním pacienti standardně absolvovali klinické neurologické vyšetření a duplexní sonografii operované krkavice.
U všech pacientů byla sledována následující data: základní demografické charakteristiky, vaskulární rizikové faktory a komorbidity, typ a závažnost cévní mozkové příhody, stupeň stenózy ipsilaterální a kontralaterální ACI, forma antitrombotické medikace a případné použití intravenózní trombolýzy, perioperační data zahrnující typ anestézie, chirurgickou techniku, použití karotického shuntu, délku operace a délku karotického klampu. Primárním sledovaným cílem bylo 30denní riziko jakékoliv CMP nebo smrti. Za periprocedurální CMP byl považován vznik nového neurologického deficitu nebo jeho zhoršení v porovnání s předoperačním stavem. Sekundárním sledovaným cílem byl výskyt symptomatické intracerebrální hemoragie (ICH), infarktu myokardu a krvácení v operační ráně, které si vyžádalo reoperaci. Dalším sekundárním sledovaným cílem byla analýza příčin odkladu CEA za více než 14 dní od CMP. V tomto ohledu byly důvody odkladu operace rozděleny na medicínské a organizační.
Pro statistické zpracování dat byly použity metody popisné statistiky. Kontinuální proměnné s normálním rozložením jsou prezentovány jako průměr ± směrodatná odchylka (standard deviation; SD) a pro jejich srovnání byla použita analýza rozptylu (analysis of variance). Kontinuální data s nenormální distribucí jsou prezentována ve formě mediánu a 25.–75. percentilu (interquartile range; IQR). Kategoriální data jsou uvedena v absolutních číslech a procentech a byla analyzována s využitím chí-kvadrátu, případně Fisherova exaktního testu. Hladina významnosti byla stanovena jako p < 0,05. Použitým statistickým programem byl IBM SPSS Statistics pro Windows, verze 20 (IBM Corp., Armonk, NY, USA).
Výsledky
Do studie bylo zařazeno celkem 246 pacientů. Střední doba mezi CMP a CEA byla pro celou kohortu pacientů 8 dnů (IQR: 4–14 dní). V doporučovaném časovém intervalu 14 dní od iCMP bylo operováno celkem 191 pacientů (77,6 %), přičemž 51 pacientů (20,7 %) podstoupilo urgentní operaci v průběhu 48 h od iktu (tab. 1).
Tab. 1. Základní demografi cká data, vaskulární rizikové faktory a komorbidity. 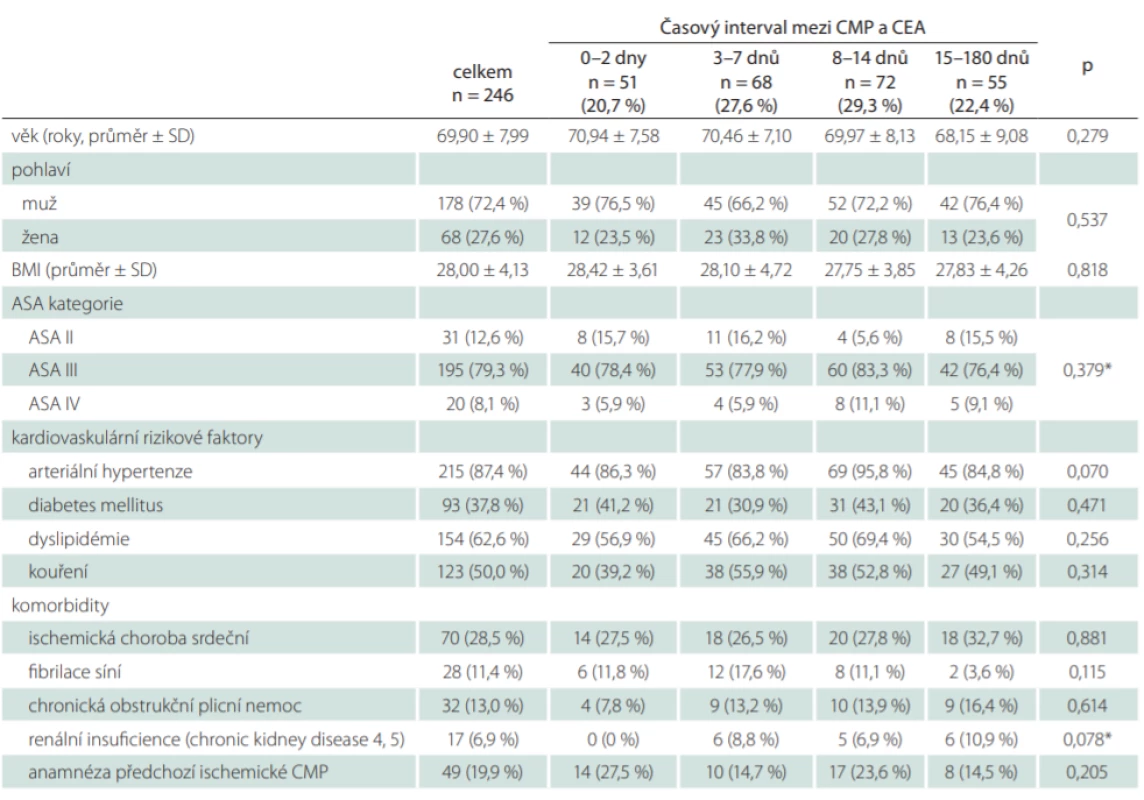
*Fisherův exaktní test ASA – American Society of Anesthesiologists; BMI – body mass index; CEA – karotická endarterektomie; n – počet; SD – směrodatná odchylka Základní demografická data, vaskulární rizikové faktory a komorbidity jsou uvedeny v tab. 1. Nebyla nalezena statisticky významná asociace mezi demografickými charakteristikami, rizikovými faktory, komorbiditami a studovanými skupinami pacientů. Klinické charakteristiky týkající se typu a závažnosti iCMP, stupně stenózy ipsilaterální a kontralaterální ACI, předoperačně použité formy antitrombotické medikace a případného použití intravenózní trombolýzy jsou prezentovány v tab. 2. Crescendo TIA byla signifikantně častěji spojena s urgentní operací do 2 dnů, naopak dokončený iktus s časnými a odloženými operacemi (p < 0,001).
Tab. 2. Klinické charakteristiky pacientů ve vztahu k načasování karotické endarterektomie. 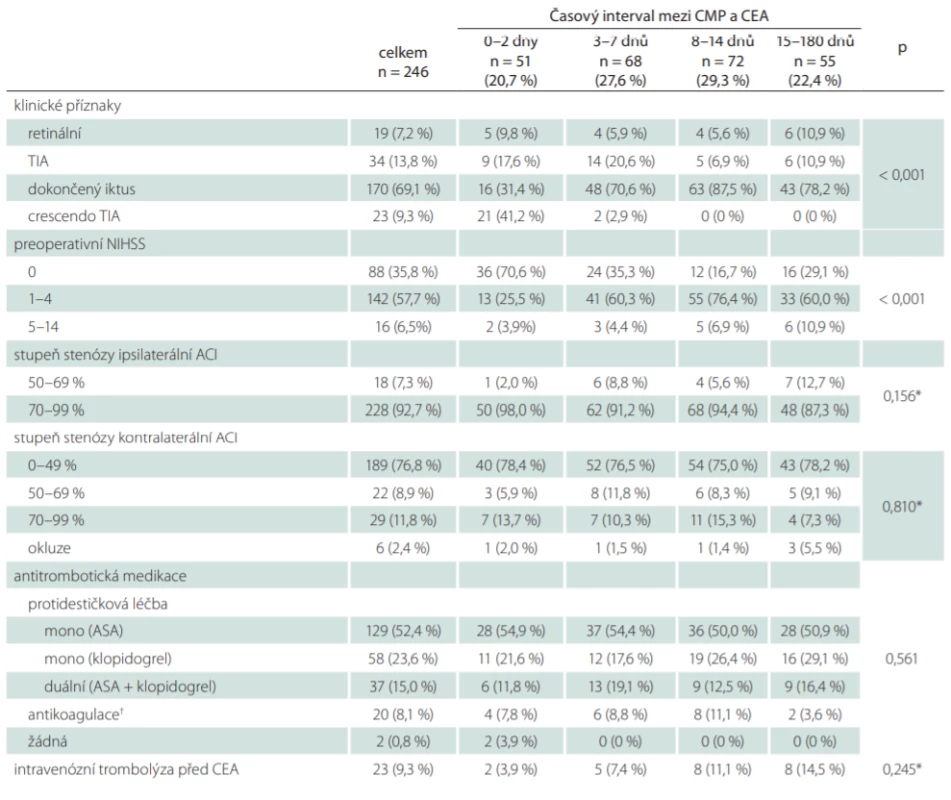
*Fisherův exaktní test; † nízkomolekulární heparin + ASA nebo klopidogrel ACi –arteria carotis interna; ASA – kyselina acetylsalicylová; CEA – karotická endarterektomie; n – počet; NIHSS – National Institutes of Health Stroke Scale; TIA – tranzitorní ischemická ataka Data týkající se chirurgického výkonu jsou shrnuta v tab. 3. Operační výkony byly výhradně prováděny v regionální anestézii (95,1 %), nejčastěji používanou technikou byla everzní CEA (72,7 %), primární či sekundární použití karotického shuntu bylo potřebné u 10,6 % pacientů. Nebyla nalezena statisticky významná asociace mezi uvedenými perioperačními faktory a jednotlivými skupinami pacientů, stejně tak nebyly nalezeny významné rozdíly s ohledem na délku karotického klampu a délku operačního výkonu.
Tab. 3. Perioperační data. 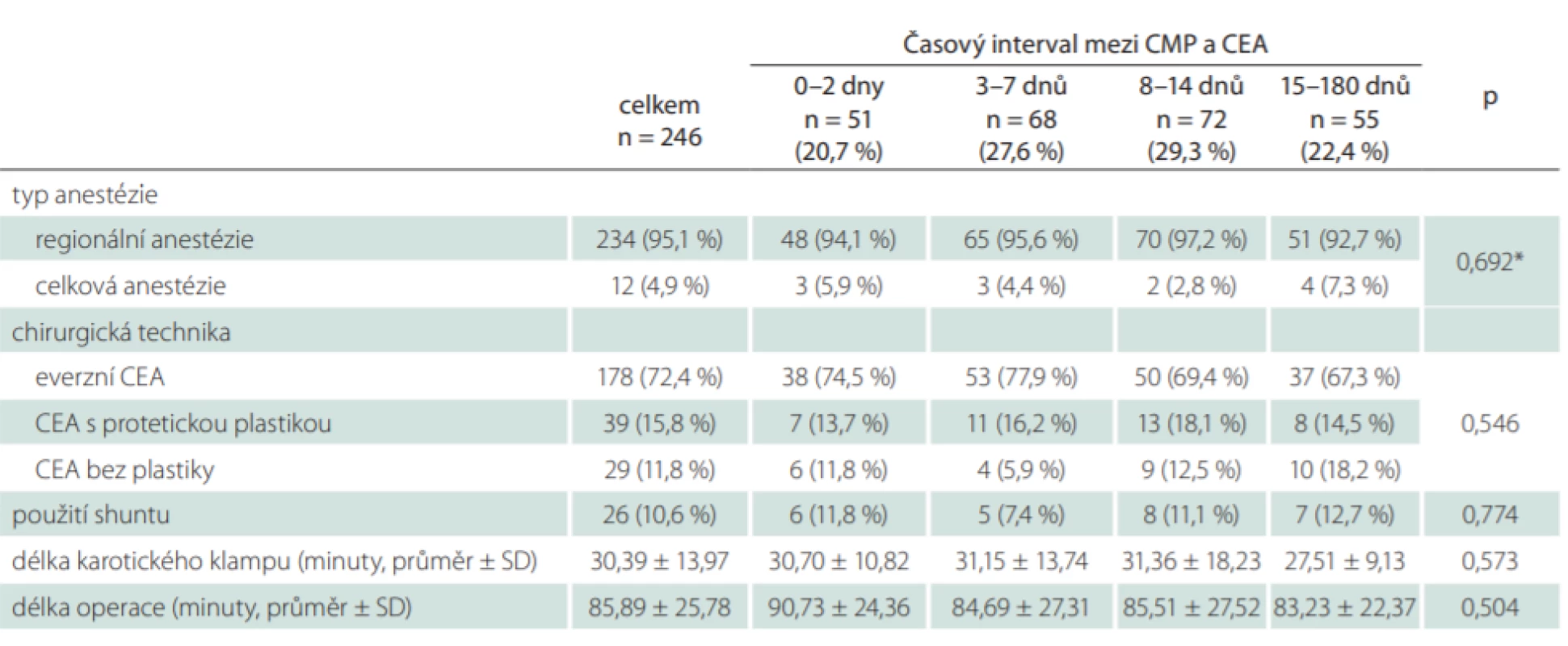
*Fisherův exaktní test CEA – karotická endarterektomie; n – počet; SD – směrodatná odchylka Pro celou kohortu pacientů bylo 30denní riziko jakékoliv CMP nebo smrti 3,7 % (9 pacientů z 246). Ve skupině urgentních operací do 48 h toto riziko dosáhlo 5,9 % (3 pacienti z 51), nicméně nebyla nalezena statisticky významná asociace mezi periprocedurálními riziky iktu či smrti a studovanými časovými intervaly (p = 0,477; tab. 4). Všechny periprocedurální ikty ve skupině urgentních operací byly u pacientů, kteří se klinicky manifestovali jako crescendo TIA (3 pacienti z 21; 14,3 %). 30denní mortalita pro celou kohortu byla 0,4 %. Jediné úmrtí bylo zaznamenáno ve skupině 3 a vzniklo v příčinné souvislosti s periprocedurálním iktem. Symptomatická ICH byla zaznamenána u celkem 4 pacientů (1,6 %) a ranné krvácení vyžadující reintervenci se vyskytlo u 7 pacientů (2,8 %). Jak u symptomatické ICH, tak i v případě ranného krvácení nebyla zjištěna statisticky významná spojitost se studovanými časovými intervaly. U žádného pacienta nebyl dokumentován perioperační infarkt myokardu.
Tab. 4. Periprocedurální komplikace ve vztahu k načasování karotické endarterektomie. 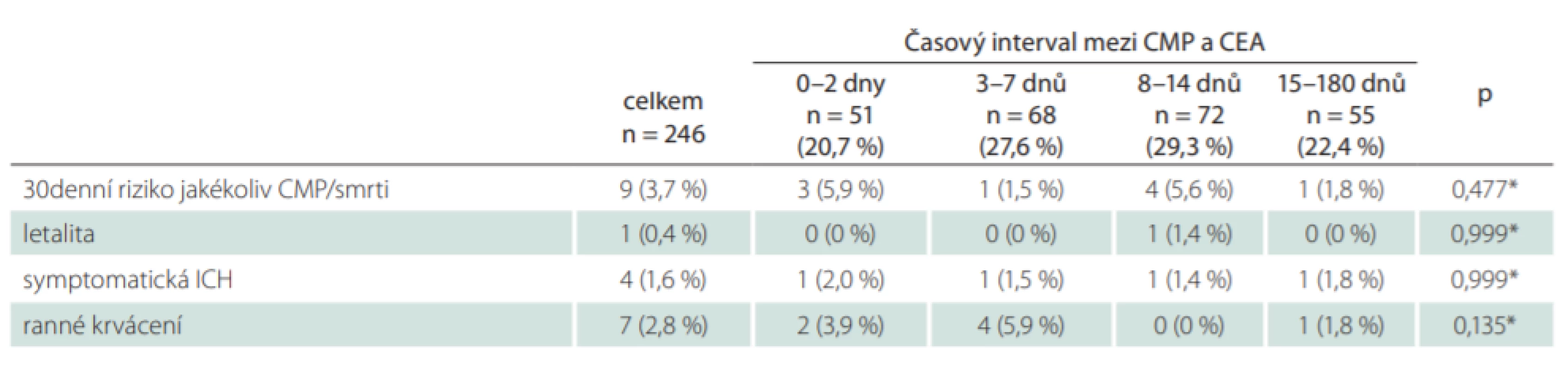
*Fisherův exaktní test CEA – karotická endarterektomie; ICH – intracerebrální hemoragie; n – počet; SD Celkem 55 pacientů (22,4 %) podstoupilo CEA za více než 14 dní od CMP. Z medicínských důvodů byla operace cíleně odložena v 18 případech, a to v důsledku iniciálně velkého infarktového ložiska na CT mozku nebo vstupně těžkého neurologického deficitu, u kterého se čekalo na jeho případnou regresi. Organizační důvody byly příčinou odkladu operace ve 24 případech (14 pacientů pozdní odeslání ze spádové neurologie, 10 pacientů čekání na volnou kapacitu operačního sálu). Celkem 6 pacientů s velmi lehkou tranzitorní symptomatologií (4 pacienti s amaurosis fugax, 2 pacienti s TIA) primárně vyhledalo lékařské vyšetření pozdě, a to již mimo doporučený časový interval ke karotické intervenci. U 7 pacientů nebyly důvody odkladu CEA v institucionálním registru zaznamenány.
Diskuze
Optimální načasování CEA po CMP má zcela zásadní klinický význam. Jak ukazují data z recentního systematického přehledu, riziko recidivy cerebrovaskulární příhody dosahuje u pacientů se symptomatickou stenózou ACI v průběhu prvních 2–3 dnů 6,4 % (1,5–23,8 %), během 7 dnů 19,5 % (12,7–28,7 %) a v průběhu 14 dnů až 26,1 % (20,6–32,5 %) [10]. Tyto údaje jednoznačně podporují aktuální doporučení provádět CEA u symptomatických pacientů co nejdříve. I když v poslední době objektivně dochází ke zkracování doby do provedení CEA, podstatná část pacientů není operována v průběhu doporučeného časového okna [5,6,11]. Důvody odkladu CEA bývají zpravidla multifaktoriální, přičemž kombinují jak aspekty organizační (zdlouhavý diagnostický proces, pozdní odeslání pacienta k operaci, dlouhé čekací doby na volnou kapacitu operačního sálu), tak i medicínské (vstupně těžký neurologický deficit, u kterého se čeká na další vývoj klinického stavu, nebo rozsáhlé ložisko dokonaného mozkové infarktu, protrahovaná příprava k operaci s ohledem na pacientovy komorbidity). Významnou roli ve vztahu k délce diagnostického a následného léčebně preventivního procesu má také informovanost široké veřejnosti o klinických příznacích CMP. Zejména velmi lehké a tranzitorní iniciální příznaky často nebývají pacienty adekvátně vyhodnoceny a včas dány do možné souvislosti s CMP [12]. I když podíl pacientů v naší studii, kteří podstoupili CEA v průběhu 14 dnů, je relativně vysoký (77,6 %), stále téměř polovina z odložených operací mohla být potenciálně provedena v časném režimu. Včasné odeslání pacientů z neurologických pracovišť a jejich neodkladné zařazování do operačních programů představují jistě potenciál ke zlepšení a zefektivnění péče o nemocné se symptomatickou stenózou ACI.
Nejvíce kontroverzním tématem ve vztahu k načasování CEA zůstává zejména problematika urgentních operací provedených v průběhu 48 h od iktu, protože tyto výkony mohou být zatíženy vyššími periprocedurálními riziky. Studie vycházející z dat švédského vaskulárního registru (Swedvasc) prokázala, že urgentní operace jsou spojeny s více než 4násobným rizikem iktu nebo smrti v porovnání s výkony provedenými mezi 3. a 7. dnem [4]. K obdobným výsledkům dospěla i prospektivní nerandomizovaná studie ze dvou švédských center. U pacientů, kteří podstoupili CEA v průběhu 48 h, dosáhlo 30denní operační riziko jakéhokoliv iktu nebo smrti 8,0 % v porovnání s 2,9 %, pokud byli operováni mezi 3. a 14. dnem [8]. V recentní metaanalýze Milgrom et al demonstrovali, že urgentní CEA má 2,35× vyšší riziko perioperačního iktu, nicméně není spojena s nárůstem letality [9]. Na druhou stranu řada dalších studií prokázala, že 30denní riziko iktu nebo smrti u CEA provedené do 48 h se pohybuje v rozmezí 2,4 a 4,4 %, a to bez statisticky významných rozdílů v porovnání s výkony provedenými později [13–16]. Tyto výsledky jsou pak zcela ve shodě se závěry studií, které vycházejí z národních vaskulárních registrů. Tsantilas et al v analýze německých dat zjistili, že hospitalizační riziko iktu nebo smrti je po urgentní CEA 3,0 % [6]. V daleko menší norské studii nebyl dokonce zaznamenán žádný iktus nebo úmrtí v souvislosti s urgentní CEA [7]. Povzbudivé výsledky pocházejí rovněž z Velké Británie. Výsledné 30denní riziko iktu a smrti po urgentní CEA sice bylo statisticky signifikantně vyšší v porovnání s časnými výkony mezi 3. a 7. dnem (3,1 vs. 2,0 %), ale stále bezpečně pod literárně přípustnou hranicí 6 % [5]. Jedním z možných vysvětlení rozdílných výsledků urgentních CEA mezi jednotlivými publikacemi může být selekce pacientů. V tomto ohledu lze za nejrizikovější považovat neurologicky nestabilní pacienty. Urgentní CEA u pacientů s crescendo TIA má periprocedurální riziko iktu nebo smrti až 11,4 %, a to se dále zvyšuje až na 20,2 % u pacientů se SIE [17]. Studie, které tyto pacienty do analýzy zahrnuly, pak logicky uvádějí horší výsledky urgentních CEA než studie, které tuto rizikovou skupinu nemocných primárně vyloučily. V našem souboru pacientů jsme měli relativně vysoký podíl pacientů s crescendo TIA, kteří podstoupili urgentní CEA do 48 h (21 pacientů z 51, 41,2%), a všechny tři ikty zaznamenané v této skupině se vyskytly právě u těchto nemocných. I přes objektivně dokumentovaná vyšší periprocedurální rizika provažujeme urgentní CEA u neurologicky nestabilních pacientů s crescendo TIA nebo SIE za indikovanou, a to vzhledem k nepříznivému přirozenému vývoji, kdy bez intervence 30–70 % pacientů končí invalidizujícím nebo fatálním iktem [18,19].
I když tato studie neprokázala statisticky významnou spojitost mezi načasováním CEA a 30denním rizikem periprocedurálního iktu a smrti, její výsledky musí být interpretovány s přihlédnutím k několika limitacím:
- jedná se o retrospektivní analýzu;
- pacienti nebyli do jednotlivých časových skupin randomizováni. Aktuálně jedinou probíhající randomizovanou studií, která sleduje bezpečnost urgentní CEA a důsledky odkladu CEA na riziko recidivy CMP, je italská SPREAD-STACI trial [20];
- velikost souboru je stále relativně malá neumožňující zachytit statisticky významné rozdíly mezi studovanými skupinami pacientů;
- vzhledem k tomu, že nebyla rutinně u všech pacientů prováděna kontrolní CT mozku, někteří pacienti, kteří jsou klasifikováni jako TIA, mohli mít ve skutečnosti dokončený iktus, protože v okamžiku iniciální CT nemuselo být případné ložisko cerebrálního infarktu ještě zachytitelné;
- vzhledem k metodologickým rozdílům jednotlivých studií, zabývajících se riziky CEA ve vztahu k jejímu načasování, není možné objektivní srovnání výsledků.
S vědomím výše uvedených limitací tato studie neprokázala, že by urgentní CEA byla spojena se signifikantním nárůstem rizika periprocedurálního iktu nebo smrti. Za nejrizikovější kohortu pacientů je v tomto ohledu nicméně nezbytné považovat nemocné s nestabilní neurologickou symptomatologií. Bohužel část pacientů se symptomatickou stenózou ACI stále podstupuje CEA pozdě, a to z nemedicínských důvodů.
Etické aspekty
Všichni pacienti podepsali informovaný souhlas se studií a studie byla schválena lokální etickou komisí (201911 S16P).
Grantová podpora
Podpořeno MZ ČR – RVO (FNHK, 00179906).
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 19. 3. 2020
Přijato do tisku: 28. 5. 2020
MUDr. Igor Guňka, Ph.D.
Chirurgická klinika LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: gunka@email.cz
Zdroje
1. Naylor AR, Ricco JB, de Borst GJ et al. Management of atherosclerotic carotid and vertebral artery disease: 2017 Clinical practice guidelines of the European Society for Vascular Surgery (ESVS). Eur J Vasc Endovasc Surg 2018; 55 (1): 3–81. doi: 10.1016/j.ejvs.2017.06.021.
2. Škoda O, Herzig R, Mikulík R et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016. Cesk Slov Neurol N 2016; 112/79 (3): 351–363. doi: 10.14735/amcsnn2016351.
3. Rothwell PM, Eliasziw M, Gutnikov SA et al. Carotid endarterectomy trialists collaboration. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet 2004; 363 (9413): 915–924.
4. Strömberg S, Gelin J, Osterberg T et al. Very urgent carotid endarterectomy confers increased procedural risk. Stroke 2012; 43 (5): 1331–1335. doi: 10.1161/STROKEAHA. 111.639344.
5. Loftus IM, Paraskevas KI, Johal A et al. Delays to surgery and procedural risks following carotid endarterectomy in the UK national vascular registry. Eur J Vasc Endovasc Surg 2016; 52 (4): 438–443. doi: 10.1016/j.ejvs.2016. 05.031.
6. Tsantilas P, Kuehnl A, König T et al. Short time interval between neurologic event and carotid surgery is not associated with an increased procedural risk. Stroke 2016; 47 (11): 2783–2790. doi: 10.1161/STROKEAHA.116.014058.
7. Kjørstad KE, Baksaas ST, Bundgaard D et al. The National Norwegian Carotid Study: time from symptom onset to surgery is too long, resulting in additional neurological events. Eur J Vasc Endovasc Surg 2017; 54 (4): 415–422. doi: 10.1016/j.ejvs.2017.07.013.
8. Nordanstig A, Rosengren L, Strömberg S et al. Very urgent carotid endarterectomy is associated with an increased procedural risk: The Carotid Alarm Study. Eur J Vasc Endovasc Surg 2017; 54 (3): 278–286. doi: 10.1016/j.ejvs.2017.06.017.
9. Milgrom D, Hajibandeh S, Hajibandeh S et al. Systematic review and meta-analysis of very urgent carotid intervention for symptomatic carotid disease. Eur J Vasc Endovasc Surg 2018; 56 (5): 622–631. doi: 10.1016/j.ejvs.2018.07.015.
10. Tsantilas P, Kühnl A, Kallmayer M et al. Stroke risk in the early period after carotid related symptoms: a systematic review. J Cardiovasc Surg (Torino) 2015; 56 (6): 845–852.
11. Reznik M, Kamel H, Gialdini G et al. Timing of carotid revascularization procedures after ischemic stroke. Stroke 2017; 48 (1): 225–228. doi: 10.1161/STROKEAHA.116.015766.
12. Hurst K, Lee R, Sideso E et al. Delays in the presentation to stroke services of patients with transient ischaemic attack and minor stroke. Br J Surg 2016; 103 (11): 1462–1466. doi: 10.1002/bjs.10199.
13. Sharpe R, Sayers RD, London NJ et al. Procedural risk following carotid endarterectomy in the hyperacute period after onset of symptoms. Eur J Vasc Endovasc Surg 2013; 46 (5): 519–524. doi: 10.1016/j.ejvs.2013.08.014.
14. Rantner B, Schmidauer C, Knoflach M et al. Very urgent carotid endarterectomy does not increase the procedural risk. Eur J Vasc Endovasc Surg 2015; 49 (2): 129–136. doi: 10.1016/j.ejvs.2014.09.006.
15. Tsantilas P, Kühnl A, Kallmayer M et al. A short time interval between the neurologic index event and carotid endarterectomy is not a risk factor for carotid surgery. J Vasc Surg 2017; 65 (1): 12–20. doi: 10.1016/j.jvs.2016.07.116.
16. Tsivgoulis G, Krogias C, Georgiadis GS, et al. Safety of early endarterectomy in patients with symptomatic carotid artery stenosis: an international multicenter study. Eur J Neurol 2014; 21 (10): 1251–1257. doi: 10.1111/ene.12461.
17. Rerkasem K, Rothwell PM. Systematic review of the operative risks of carotid endarterectomy for recently symptomatic stenosis in relation to the timing of surgery. Stroke 2009; 40 (10): e564–e572. doi: 10.1161/STROKEAHA.109.558528.
18. Bruls S, Van Damme H, Defraigne JO. Timing of carotid endarterectomy: a comprehensive review. Acta Chir Belg 2012; 112 (1): 3–7. doi: 10.1080/00015458.2012.11680787.
19. Mracek J, Holeckova I, Mork J et al. The timing of carotid endarteretomy. Cesk Slov Neurol N 2008; 104/71 (4): 414–421.
20. Lanza G, Ricci S, Speziale F et al. SPREAD-STACI study: a protocol for a randomized multicenter clinical trial comparing urgent with delayed endarterectomy in symptomatic carotid artery stenosis. Int J Stroke 2012; 7 (1): 81–85. doi: 10.1111/j.1747-4949.2011.00699.x.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek EditorialČlánek Recenze knih
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Editorial
- Cytotoxické léze corpus callosum (CLOCCs)
- Poranění radiálního nervu při zlomeninách diafýzy pažní kosti
- Je jasné, kdy operovat výhřez bederní meziobratlové ploténky?
- Současná diagnostika sekundárně progresivní formy roztroušené sklerózy a léčba siponimodem
- Roztroušená skleróza – odhalené tajemství imunity
- Hygiena dýchacích cest u pacientů s Parkinsonovou nemocí – přehled problematiky a možnosti fyzioterapeutické intervence
- Klinické a sociální prediktory kvality života u dětí a mladších dospělých s poruchou autistického spektra
- Bezpečnost karotické endarterektomie s ohledem na její načasování po ischemické cévní mozkové příhodě
- Glatiramer acetát – léčba roztroušené sklerózy monitorovaná v registru ReMuS
- Intenzivní rehabilitace kognitivních funkcí u osob s roztroušenou sklerózou – výsledky 12týdenní randomizované studie hodnocené počítačovým programem
- Účinnost a bezpečnost urgentní mikrochirurgické embolektomie při selhání intravenózní trombolýzy a mechanické trombektomie u pacientů s akutním ischemickým iktem – protokol systematického review
- Vliv pandemie COVID-19 na spánkovou medicínu v České republice a na Slovensku
- Prevalence a charakteristika epilepsie u pacientů s relabující-remitující formou roztroušené sklerózy léčených imunomodulační terapií
- Syndrom moyamoya doprovázený polycystickou chorobou ledvin – kazuistika vzácného onemocnění a přehled literatury
- Souběh dvou oportunních infekcí jako první projev HIV
- Dropped head syndrom u pacientky s progredující bulbární paralýzou
- Karotický paragangliom, velmi vzácný nádor v dětském věku
- Využití kvantitativní MR venografie v indikaci stentingu stenózy žilního splavu
- Transvenózna embolizácia prasknutej piálnej arteriovenóznej malformácie
- CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
- Recenze knih
- 2020 AAN Highlights Dlouhodobá data o účinnosti deplece CD20+ B-buněk v léčbě RS
- 2020 AAN Highlights Jak mění malá molekula průběh spinální svalové atrofie?
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Je jasné, kdy operovat výhřez bederní meziobratlové ploténky?
- CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
- Cytotoxické léze corpus callosum (CLOCCs)
- Dropped head syndrom u pacientky s progredující bulbární paralýzou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



