-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
CGRP monoclonal antibodies in the treatment of migraine – indication criteria and therapeutic recommendations for the Czech Republic
Current prophylactic treatment of frequent episodic and chronic migraine is often unsuccessful or associated with adverse events. Calcitonin gene-related peptide (CGRP) is a key peripheral and central patophysiological agent in migraine. Data emerging from trials with monoclonal antibodies suggest that specific blockade of the CGRP pathway may provide an effective and treatment in migraine. At present, precise indication criteria for the administration of these antibodies, required duration of their administration and methods of evaluating their effect, especially on the quality of life, are being determined.
Keywords:
Migraine – prophylactic treatment – antibodies CGRP – guidelines
Autoři: T. Nežádal- 1 4; J. Marková 4,5; A. Bártková 4,6; L. Klečka- 4 7
Působiště autorů: Neurologické oddělení, ÚVN-VFN Praha 1; Institut neuropsychiatrické péče, Praha 2; Neurochirurgická klinika, 1. LF UK, Praha 3; Sekce pro diagnostiku a léčbu bolesti, hlavy ČNS ČLS JEP 4; Neurologická klinika 3. LF UK, a Thomayerovy nemocnice, Praha 5; Neurologická klinika LF UP, a FN Olomouc 6; Neurologické oddělení, Městská nemocnice Ostrava 7
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(4): 445-451
Kategorie: Doporučené postupy
doi: https://doi.org/10.14735/amcsnn2020445Souhrn
Stávající perorální profylaktická léčba frekventní epizodické a chronické migrény je velmi často neúčinná nebo je spojena s nežádoucími účinky. Klíčovým periferním i centrálním působkem v patofyziologii migrény je calcitonin gene-related peptid (CGRP). Specifická blokáda CGRP nebo jeho receptoru monoklonálními protilátkami byla prokázána jako účinná a bezpečná léčba migrény. V současné době jsou stanovována přesná indikační kritéria pro podání těchto protilátek, potřebná délka jejich podávání a způsob hodnocení jejich efektu, zejména na kvalitu života pacientů.
Klíčová slova:
migréna – profylaktická terapie – protilátky CGRP – terapeutická doporučení
Možnosti a limity současné perorální profylaktické léčby migrény
Migréna je jedním z nejčastějších neurologických onemocnění. Její dopady na kvalitu života jsou vzhledem k přechodnému charakteru obtíží podceňovány [1]. Ale navzdory tomuto názoru je migréna (spolu s vertebrogenními syndromy, ztrátou sluchu, depresí a sideropenickou anemií) jednou z pěti nejčastějších důvodů života s postižením (years of life lived with disability; YLDs) podle analýzy Global Burden of Diseases, Injuries and Risk Factors (GBD) z roku 2016 [2,3]. Diagnóza migrény byla stanovena u 1,04 miliardy lidí, s následkem 45,12 milionů YLDs s nejvyšší prevalencí u žen mezi 15 a 49 lety, s maximem mezi 35 a 39 lety. Např. u Parkinsonovy choroby činí YLDs 706 tisíc a u RS 584 tisíc celosvětově. V ČR byla stanovena prevalence migrény na 1,72 milionu s 81,41 tisíc YLDs, kdy byl zaznamenán pokles o nepatrných 0,9 % proti roku 1990 [2]. Bolest hlavy z nadužívání akutní medikace (medication overuse headeache; MOH), ač není separátní součástí studie GBD, může tvořit až 70% podíl na rezistentních bolestech hlavy. Tato přidružená diagnóza vysvětluje nárůst YLDs globálně v roce 2016, vedoucí až k hodnocení migrény jako druhé nejčastější invalidizující diagnózy.
Uvedené statistiky jednoznačně svědčí pro nutnost profylaktické terapie, resp. pro její aktualizaci, neboť v hodnocení byla její současná podoba již zachycena. V případě nízkofrekventní epizodické migrény (EM), tzn. do 4 dní s migrénou v měsíci (MMD), pacienti zpravidla ani nevyhledávají odbornou péči, užívají běžná analgetika nebo triptany. K profylaktické terapii migrény přistupujeme při frekvenci MMD ≥ 4/měsíc, zejména při výrazné interferenci s denními aktivitami, při neefektivitě akutní léčby, závažných nežádoucích účincích (NÚ) nebo kontraindikaci akutní terapie. Časná profylaxe je indikována i v některých specifických případech: u hemiplegické nebo kmenové migrény, při prolongovaných aurách a jednotce „visual snow“ nebo při anamnéze migrenózního infarktu. Vždy musíme zvážit přínos a potenciální rizika každodenního užívání perorální léčby. Zásadní je pak preventivní léčba u chronické migrény (chronic migraine; CM) (MMD ≥ 15/měsíc), která tvoří kolem 1 % případů [4]. V tab. 1 je uvedena stávající efektivní evidence-based profylaktická terapie, jak ji uvádějí světová doporučení [5–9]. Česká modifikace skupin evidence-based perorální profylaktické medikace, jak je uvedena v souhrnu údajů o léčivém přípravku (summary of product characteristics; SPC) protilátek CGRP (calcitonin gene-related peptid), je uvedena v tab. 2 a vychází z ní i současná česká indikační doporučení.
Tab. 1. Profylaktická léčba migrény (podle světových doporučení). 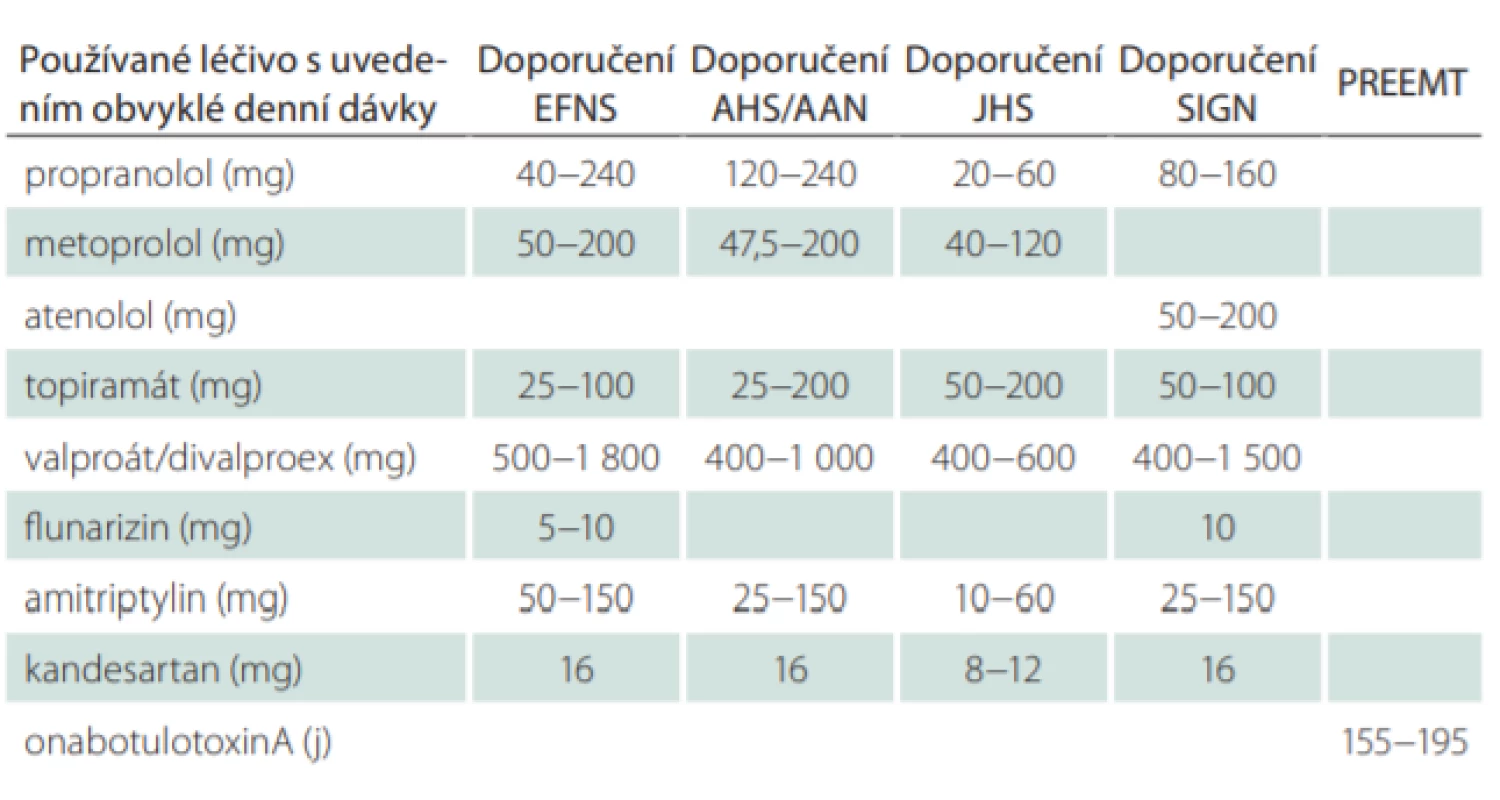
AHS/AAN – American Headache Society/American Academy of Neurology; EFNS – European Federation of the Neurological Societies; JHS – Japanese Headache Society; SIGN – Scottish Intercollegiate Guidelines Network; PREEMT – Phase III REsearch Evaluating Migraine Prophylaxis Therapy Tab. 2. Skupiny profylaktické léčby v ČR (podle údajů v souhrnu o léčivém přípravku). 
* kontraindikován u dívek a žen ve fertilním věku; § léky neregistrované k léčbě migrény, ale s prokázanou účinností; # dříve registrovaný v ČR pro terapii migrény Stávající perorální profylaktická léčba má svá úskalí. Počet respondérů, tedy pacientů s 50% redukcí MMD, pro všechna perorální profylaktika se pohybuje ve velkém vzorku pacientů (n = 8 688) kolem 45 % [10]. Ovšem pravděpodobnost, že pacient vydrží na terapii, je vlivem malého efektu, dlouhé doby jeho nástupu, NÚ nebo incompliance nízká. Po 6 měsících tak v uvedené studii užívá profylaxi 26–29 % a po 12 měsících jen 17–20 % pacientů [10]. U CM je k dispozici po selhání perorální medikace i aplikace onabotuloxinu A v 3měsíčních intervalech podle protokolu PREEMT [9,11] a neurostimulační léčba. Naopak u pacientů s vysoce frekventní EM s 8–14 MMD, kde je disabilita obdobná, není po selhání perorální medikace tato další léčba v současné době indikována [12].
CGRP v patofyziologii migrény
Již od 80. let minulého století se do centra zájmu ve studiích patofyziologie migrény dostává CGRP, neuropeptid složený z 37 aminokyselin, u kterého byl zjištěn přímý vztah k aktuálnímu záchvatu migrény. Přelomová práce z roku 1990 prokázala zvýšení hladin CGRP při záchvatu migrény v séru z vena jugularis [13]. Jeho klíčová role pak byla potvrzena stimulací ganglion trigeminale se vzestupem hladin CGRP v kraniální cirkulaci a tyto hladiny byly významně sníženy podáním sumatriptanu a dihydroergotaminu. Naopak intravenózní podání CGRP vyvolalo bolest hlavy u migreniků a ne u zdravých dobrovolníků. Přesný mechanizmus této zvýšené citlivosti k CGRP zůstává nejasný [14]. Ze skríningového hlediska je perspektivní nový průkaz CGRP v slzách, kde je přítomna přibližně 140× vyšší koncentrace než v plazmě. Vyšší hladina u nemocných s migrénou byla zjištěna již v interiktálním období a toto zvýšení bylo shodné u pacientů s EM i CM. Iktální koncentrace byla vyšší než interiktální u neléčené ataky, zatímco při akutní léčbě (převážně triptany, ale i nesteroidními analgetiky) byla hladina nižší i než u kontrolní skupiny [15]. Význam CGRP v patogenezi migrény a jeho historie byly recentně revidovány [16]. V oblasti trigeminálního ganglia je CGRP exprimován v C-vláknech a jeho receptor je v Ad-vláknech, která se účastní různých aspektů percepce bolesti. Ganglion trigeminale je centrálním bodem trigeminovaskulárního reflexu, který je aktivován jako ochrana proti vazokonstrikci a tato aktivace vede u pacientů s migrénou k percepci bolesti. Protrahovaná aktivace trigeminálních drah CGRP pak může způsobovat centrální senzitizaci cestou neuronů druhého řádu [17], a tedy potenciálně vést i k transformaci EM do CM. Trigeminální ganglion a dura mater nejsou za hematoencefalickou bariérou (HEB) a mohou tak být cílem působení malých anti-CGRP molekul – gepantů a monoklonálních protilátek (monoclonal antibodies; mAb).
Monoklonální protilátky CGRP
Vzhledem k tomu, že se receptory CGRP nachází mimo HEB a dříve testované antagonizující látky [18] a gepanty zde prokázaly svou účinnost, začaly být pro léčbu migrény testovány i mAb s vysokou molekulovou hmotností (kolem 145–16 000 Daltonů). Monoklonální protilátky mají některé významné přednosti oproti gepantům, zejména v chronických indikacích:
- mají dlouhý poločas cirkulace v plazmě (20–45 dní) vedoucí převážně k měsíčnímu podání se zlepšenou adherencí;
- na rozdíl od malých molekul nemají aktivní a potenciálně toxické metabolity, neboť nejsou metabolizovány v játrech, ale jsou retikuloendoteliálním systémem pozvolna štěpeny na aminokyseliny;
- s tím souvisí i absence interakcí s jinými léčivy;
- jejich výrazná cílová selektivita minimalizuje jiné vlivy léčby a zlepšuje tak jejich tolerabilitu nezávislou na mechanizmu účinku [19].
Humanizace mAb významně redukovala jejich imunogenní potenciál. V současnosti prochází klinickými studiemi v profylaxi migrény čtyři mAb a tři jsou již registrovány (tab. 3). Humánní erenumab je kompetitivní inhibitor receptoru CGRP a humanizované mAb fremanezumab, galcanezumab a eptinezumab se váží přímo na CGRP. Anti-CGRP mAbs (tedy eptinezumab, galcanezumab a fremanezumab) redukují nadbytek CGRP na trigeminálních senzorických vláknech. Rychlost vazby na peptid a následné disociace se u uvedených tří mAb liší, klinický význam však zatím není zřejmý [20]. V současnosti stále probíhají studie fáze III a IV u pacientů s EM a CM.
Tab. 3. Monoklonální protilátky CGRP v profylaxi migrény 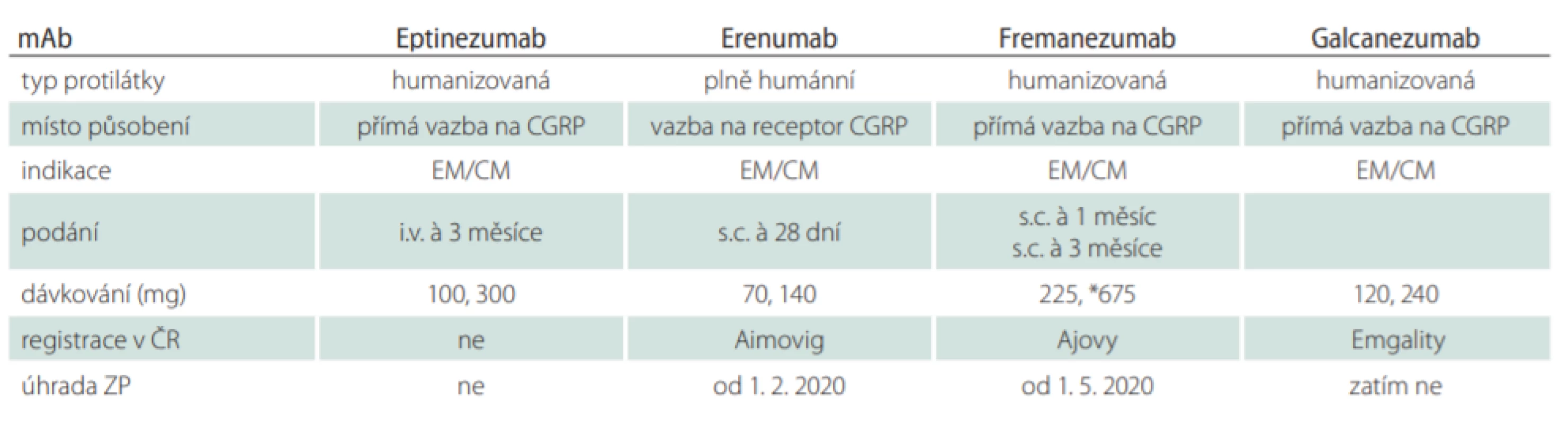
* v podání à 3 měsíce CGRP – calcitonin gene-related peptide; EM/CM – epizodická/chronická migréna; i.v. – intravenózně; mAb – monoklonální protilátka; s.c. – subkutánně Erenumab
Ve studii s erenumabem u EM (STRIVE) bylo randomizováno celkem 955 pacientů. Počet MMD byl redukován o 3,2 ve skupině s dávkou 70 mg, o 3,7 u dávky 140 mg a jen o 1,8 při podávání placeba (p < 0,001). Redukce počtu dní s migrénou o 50 % a více bylo dosaženo u 43,3 % pacientů [21]. Zlepšení hodnocení v dotaznících bolestí hlavy a kvality života bylo klinicky významné u středně těžké a těžké migrény a výraznější v rameni s dávkou 140 mg erenumabu. V klinické studii u CM (n = 667) bylo rozložení pacientů obdobné a bylo dosaženo redukce počtu dní s migrénou (–6,6 dne při podávání 70 mg a 140 mg vs. –4,2 dne ve skupině s placebem). Významné zlepšení bylo pozorováno i v dotaznících (MIDAS [Migraine Disability Assessment Test], HIT-6TM [Head Impact Test], MSQ [Migraine-specific Quality of Life Questionnaire]) [22]. NÚ byly zjištěny u 45 % pacientů v aktivních skupinách a nejčastěji to byly bolesti v místě vpichu, respirační infekty a nauzea. Vedly k vysazení léčby jen u čtyř pacientů, a to v případě dvou z nich v placebové skupině a dvou ve větvi s dávkou 70 mg. Erenumab prokázal též konzistentní účinnost u pacientů s CM po selhání 1−2 profylaktických terapií a u pacientů s MOH. Efekt terapie trval i po 52 týdnech od počátku studie. V následné letošní práci z výše uvedeného souboru pacientů s CM doplňují autoři, že aktuální zlepšení, tzn. redukce MMD, bylo u respondérů téměř dvojnásobné oproti celkové studijní populaci [23]. Placebem kontrolovaná studie LIBERTY (n = 246) u pacientů s EM, u kterých selhaly 2–4 perorální profylaxe, prokázala u 30 % pacientů redukci počtu MMD o ≥ 50 % ve srovnání se 14 % ve skupině placeba. Nejčastějším NÚ byla reakce v místě vpichu (6 %) v obou skupinách. V současné době končí 2letá otevřená extenze této studie [24]. Italská multicentrická observační studie sledovala efekt šesti dávek erenumabu u 89 pacientů s EM a CM v roce 2019. U všech nemocných bylo prokázáno selhání účinnosti ≥ 2 perorálních profylaxí. Celkem 69,7 % pacientů bylo zlepšeno o ≥ 50 % během prvních 3 měsíců se zaznamenáním poklesu MMD z 19 na 4 dny a 71,9 % vysadilo nadužívanou akutní medikaci. Průměrné měsíční užití analgetik pokleslo z deseti na dvě a u triptanů z pěti na jedno. Nejčastějším NÚ byla obstipace ve 13,5 %. Alergická reakce se vyskytla u jednoho pacienta [25].
Fremanezumab
Fremanezumab byl hodnocen ve studii HALO u 875 pacientů s EM rozdělených do tří skupin:
- skupina s vyšší dávkou frenamezumabu 625 mg podanou jednorázově;
- skupina s dávkou 225 mg podanou v intervalu 4 týdnů;
- placebová skupina.
Po 12 týdnech podávání poklesl průměrný počet MMD z 8,9 na 4,9 ve skupině s podáváním injekcí jednou měsíčně a z 9,3 na 5,3 při jednorázovém podání vyšší dávky. Nejčastějšími NÚ vedoucími k vysazení léčby byly erytém nebo otok v místě aplikace (n = 3), průjem (n = 2), úzkost (n = 2) a deprese (n = 2) [26]. V letošním roce byla doplněna data o efektu terapie na přidružené symptomy (nauzea, zvracení, fono - a fotofobie) a redukci užití akutní medikace ve srovnání s placebem [27]. U vysoce frekventní EM a CM (n = 1 130) bylo dosaženo významného zlepšení ve dnech s migrénou, o 4,3 dne při kvartálním podání 625 mg, 4,6 při aplikaci 225 mg jednou měsíčně a 2,5 dne na placebu. Počet respondérů při výše uvedených dávkovacích schématech činil 38, 41, resp. 18 % při podání placeba (p < 0,001 v obou případech). Ve studii byla zjištěna elevace jaterních enzymů u pěti pacientů (1 %) v obou aktivních skupinách a u tří pacientů (< 1 %) na placebu [28]. Bezpečností a tolerabilitou fremanezumabu se zabývala analýza čtyř předchozích studií z roku 2019 (n = 2 556), kdy nebyly zjištěny významné rozdíly ve výskytu NÚ oproti placebu, kdy opět nejčastější byly nezávažné lokální reakce [29]. Z hlediska kvality života bylo u pacientů s EM i CM při podání fremanezumabu ve srovnání s placebem dosaženo zvýšení počtu dní bez bolestí hlavy s normálním fungováním v práci/ve škole/v domácnosti a zlepšení koncentrace na denní činnosti (vše p < 0,005) [30]. Studie FOCUS (n = 838) zkoumala 329 (39 %) pacientů s EM a 509 (61 %) s CM, kteří selhali na 2–4 perorálních profylaxích v posledních 10 letech, randomizovaných na placeb (n = 279), fremanezumab čtvrtletně (n = 276) nebo měsíčně (n = 283). Redukce MMD po 12 týdnech léčby byla obdobná u podání kvartálně i měsíčně (p < 0,0001). NÚ stejně časté (1 %) u fremanezumabu jako u placeba [31].
Galcanezumab
Studie EVOLVE-1 (n = 1 671) prokázala významné snížení počtu MMD u pacientů s EM, u 120 mg i u 240 mg o 4,7 dne (p < 0,001) v porovnání s placebem (2,8 dne). Zaznamenaným NÚ byl pouze erytém v místě vpichu jako u předchozích protilátek (v 5 % případů) [32]. Ve studii EVOLVE-2 byla redukce MMD obdobná: 4,3 (120 mg), 4,2 (240 mg), 2,3 (placebo) [33]. V dlouhodobé (12měsíční) otevřené studii fáze III (n = 135) u EM po podání glacanezumabu poklesla četnost MMD o 5,6 (120 mg) nebo 6,5 dne (240 mg) a bylo rovněž dosaženo zlepšení v dotaznících kvality života. Celkem 4,8 % pacientů přerušilo studii pro NÚ pro převážně lokální reakce. EKG, laboratorní a vitální známky byly v normě [34]. Denní analýza prokázala efekt již od prvního dne a v 1. týdnu po aplikaci byl počet respondérů v EVOLVE-1 54,3 % a v EVOLVE-2 59,4 % [35]. Redukce MMD pak byla obdobná i u pacientů, kteří selhali na ≥ 1 a na ≥ 2 profylaxích [36]. Randomizovaná studie fáze III u pacientů s galcanezumabem u CM (REGAIN) zahrnovala 3měsíční dvojitě slepou fázi a 9měsíční otevřenou fázi s poměrem aplikace 2 : 1: 1 (placebo: 120 mg: 140 mg) subkutánně. Z průměrného počtu 19,4 na začátku studie byly MMD redukovány o 2,7 : 4,6 : 4,8 dne (p < 0,001). Tolerabilita byla obdobná jako u placeba, lokální reakce pak byly četnější u galcanezumabu 240 mg (p < 0,001) [37]. Post hoc analýza pacientů tří uvedených studií, kteří dříve selhali při léčbě onabotulotoxinem A (n = 129), prokázala redukci MMD u 120 mg (3,91) a 240 mg (5,27) galcanezumabu oproti placebu (0,88) a počet respondérů 41,3, resp. 47,5 vs. 9,4 % [38].
U galcanezumabu jako jediné mAb v současnosti byl prokázán efekt u epizodické formy cluster headache. Při podávání 300 mg s.c. jednou měsíčně došlo ke klinicky významné redukci atak ve srovnání s placebem [39].
Eptinezumab
Eptinezumab je humanizovaná protilátka, na rozdíl od předchozích protilátek podávaná intravenózně (i.v.) jednou za 3 měsíce [40]. U pacientů s EM byly provedeny studie PROMISE (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy) –1 a 2. Největší efekt byl zjištěn u dávky 300 mg, kdy bylo ≥ 50% redukce MMD dosaženo u 56,3, resp. 61 % pacientů (p < 0,001), výsledky u dalších dávek (30 a 100 mg) byly méně významné. Již druhý den po podání i.v. infuze byla pravděpodobnost záchvatu migrény redukována o 45, resp. 50 %. Efekt terapie byl stabilní po celou dobu 3 měsíců od podání infuze. Bezpečnostní profil je obdobný jako u placeba [41,42]. V případě sledování účinnosti eptinezumabu u CM (fáze IIb) po dobu 1 roku v poměru 1 : 1: 1 : 1: 1 (300 : 100 : 30 : 10 mg: placebu) byl zjištěn 75% pokles MMD u 33,3 % (p = 0,033): 31,4 %: 28,2 %: 26,8 % vs. 20,7 % u placeba [43].
Potenciální kardiovaskulární riziko protilátek CGRP
Potenciální vliv erenumabu na prokrvení myokardu byl sledován v zaslepené studii u pacientů se stabilní anginou pectoris. Čas do vzniku anginózní bolesti a ST deprese po i.v. podání erenumabu 140 mg nebo placeba byl v obou skupinách obdobný (500 vs. 508 s, resp. 407 vs. 420 s), tedy u rizikové skupiny pacientů nebyl prokázán negativní vliv [44]. Erenumab byl ve studiích podáván celkem 1 400 pacientům a placebo 1 043. Incidence vaskulárních NÚ, po vyloučení těchto potíží v anamnéze, byla obdobná v obou skupinách: např. arteriální hypertenze v 0,9 % u placeba, v 0,8 % u erenumabu 70 mg a v 0,2 % u 140 mg. Celkem čtyři kardiovaskulární příhody se objevily v otevřené fázi studie, dvě smrtelné [45]. Fremanezumab také není spojen s vyšším rizikem hemodynamických nebo EKG změn u žen i mužů do 65 let, při užití u CM za současného intermitentního podávání triptanů [46,47]. Ve studiích byly 1 435 pacientům aplikovány galcanezumab a 1 451 placebo. Změny krevního tlaku, pulzu a intervalu QT se nelišily mezi jednotlivými skupinami, ≥ 1 kardiovaskulární NÚ byl zaznamenán obdobně u 120 mg ve 2,6 %, u 240 mg ve 3,3 % (závažné: plicní embolie, tranzitorní ischemická ataka a infarkt myokardu) a u placeba ve 2,9 % (závažné: plicní embolie, hluboká žilní trombóza a infarkt myokardu). Závažné NÚ nebyly shledány jako související s léčbou [48]. Dlouhodobé sledování je namístě u všech mAb.
Protilátky CGRP – aktuální situace v ČR
V ČR jsou registrovány erenumab, fremanezumab a galcanezumab. V roce 2020 byla schválena úhrada u erenumabu a fremanezumabu. Úhrada protilátek CGRP je vázána na centra pro diagnostiku a léčbu bolestí hlavy certifikovaná Sekcí pro diagnostiku a léčbu bolestí hlavy (Czech Headache Society; CHS) České neurologické společnosti ČLS JEP. Jednotlivá centra však nemají automaticky zaručeny smlouvy se zdravotními pojišťovnami a je třeba dalších jednání.
Obecná doporučení k nasazení a vysazení protilátek CGRP podle European Headache Federation a American Headache Society
Podle evropských a amerických doporučení [49,50] je doporučeno nasazení protilátek CGRP v případě EM, CM, popřípadě migrény s přítomností MOH při selhání efektu nebo potvrzené intolerance dvou a více předchozích perorálních terapií různých skupin s prokázanou účinností podle tab. 1, podávaných nejméně 6 týdnů, nebo onabotulotoxinu A u CM. Protilátky CGRP jsou doporučeny u frekvence migrén, kdy je zvažována jakákoli profylaxe, to znamená u nejméně čtyř MMD. American Headache Society (AHS) ještě rozděluje EM podle počtu MMD na:
- 4–7 MMD s alespoň střední disabilitou (MIDAS > 11 a HIT-6 > 50);
- 8–14 MMD bez nutnosti vyššího skóre MIDAS a HIT-6.
Účinnost protilátek CGRP je přehodnocována podle European Headache Federation (EHF) po 6–12 měsících a podle AHS po 3 měsících. V případě alespoň 50% efektu se v léčbě pokračuje. V doporučení AHS je sledován též dopad migrén pomocí dotazníků HIT-6, MIDAS nebo MPFID, kde by měl být zaznamenán pokles o ≥ 5 bodů. V současné době není ze studií známá (a tedy v doporučeních se neuvádí) doba podávání nutná k udržení efektu terapie. Je na zvážení přehodnocení efektu terapie po 12 měsících podávání.
Doporučení k nasazení a vysazení protilátek CGRP v ČR
V našem návrhu (tab. 4) vycházíme z kombinace obou doporučení a SPC SÚKL (Státní ústav pro kontrolu léčiv). Pacienti musí splňovat diagnostická kritéria EM nebo CM zařazených podle ICHD-3 (1.1, 1.2, 1.3) [51] a v dokumentaci podle MKN-10 (G430, G431, G433, G438, G439). Počet MMD je ≥ 4. Centra mohou preferovat nasazení mAb v první řadě u pacientů s větším počtem MMD (např. ≥ 8 MMD) a s těžším průběhem záchvatu migrény. Léčba je indikována při selhání ≥ 2 perorálních profylaxí různých skupin uvedených v tab. 2. Každý pacient by měl v profylaxi užívat alespoň jedno antiepileptikum (topiramát nebo valproát). Selhání účinku léku je hodnoceno nejméně po 3 měsících užívání. Je doporučeno, aby u nejméně jednoho léku selhal účinek. U dalších může být prokázána intolerance. U EM je neúčinná profylaktická terapie zpravidla vysazena před podáním mAb. Při částečném účinku perorální profylaxe, spíše u CM a MOH, lze tuto profylaxi ponechat a vysadit ji až podle efektu mAb. Aplikace onabotulotoxinu A je před nasazením protilátek přerušena. Efekt terapie protilátkou je sledován po dobu 3 měsíců. V léčbě se pokračuje při dosažení alespoň 50% zlepšení po 3. měsíci užívání. V dalším průběhu je léčba vysazena při poklesu efektu pod 50 % ve 3 po sobě jdoucích měsících. Je-li dosaženo pouze částečného zlepšení (ale ≥ 50 %), lze zvážit přidání nové perorální profylaxe. Celková délka podávání mAb není v současnosti určena, lze v něm pokračovat podle efektu a tolerance. Sporné případy v indikaci by měly být řešeny revizními lékaři ve spolupráci s CHS.
Tab. 4. Doporučení k nasazení a pokračování v terapii protilátkami CGRP v ČR. 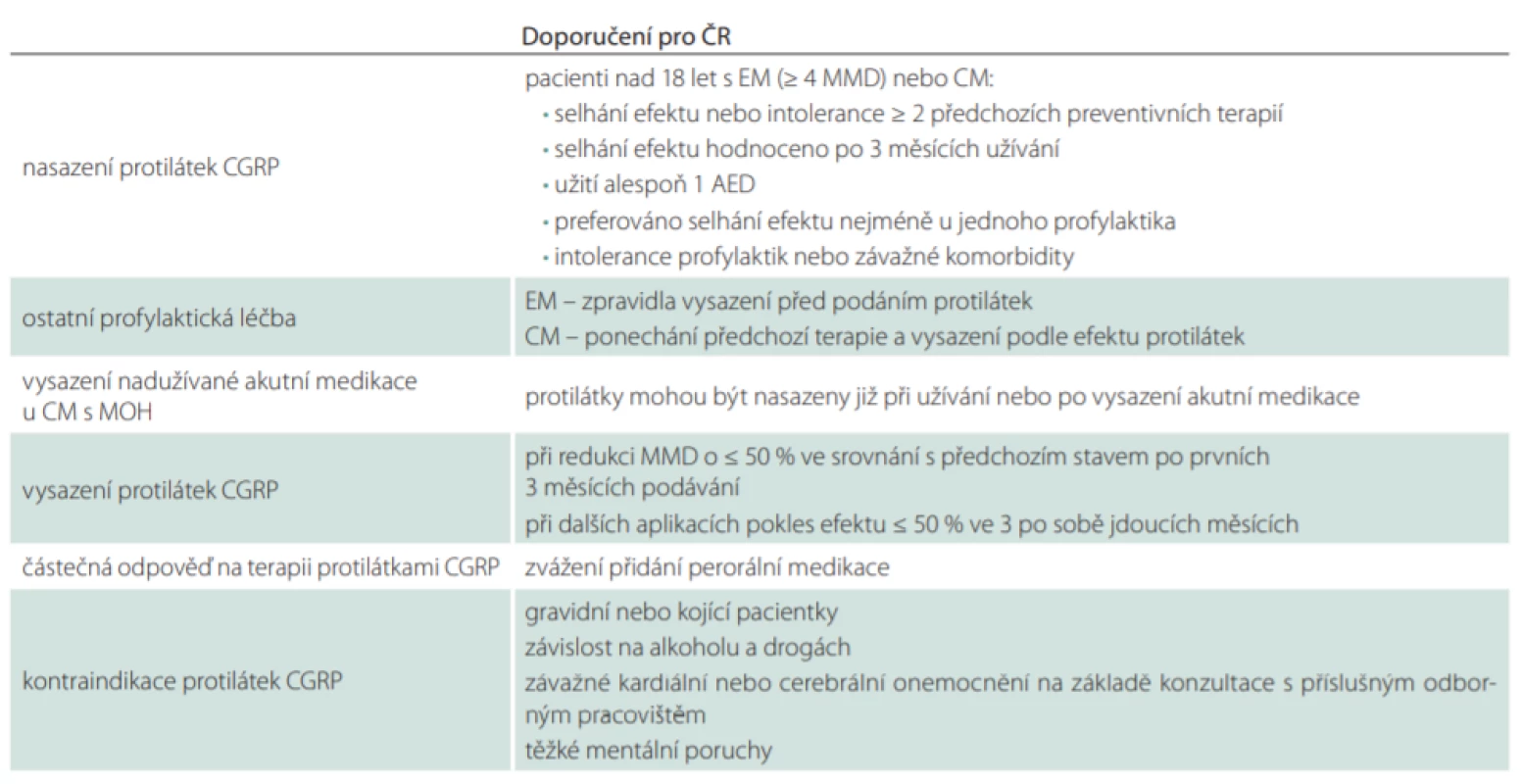
AED – automatizovaný externí defi brilátor; CGRP – calcitonin gene-related peptide; CM – chronická migréna; EM – epizodická migréna; MMD – počet dní s migrénou za 1 měsíc; MOH – bolest hlavy z nadužívání medikace Možné budoucí modifikace indikace podávání protilátek CGRP
U některých pacientů přetrvává efekt dlouhodobě i po přerušení léčby, u dalších v tomto případě dochází opět k nárůstu MMD. K posouzení bude tedy – podle našich celosvětových zkušeností – možnost po 12měsíčním podávání léčbu po dohodě s pacientem na maximálně 6 měsíců přerušit (obdobně jako u biologické léčby u RS) a podle stavu se k ní vrátit. Při nedostatečném efektu protilátky CGRP by bylo logické zvážit nasazení látky jiného mechanizmu účinku (receptor vs. přímý vliv) – „switch“. Tuto možnost zatím podporují jen kazuistická sdělení, zatím bez soustavného výzkumu [52]. Nad rámcem doporučení pro ČR vč. SPC stojí užití dotazníků k ověření vlivu terapie protilátkami CGRP na tíži bolestí hlavy nebo kvalitu života pacientů. Ty však budou nedílnou součástí vznikajícího celorepublikového registru mAb CGRP v léčbě migrény.
Závěr
Monoklonální protilátky CGRP jsou specifickou profylaxí založenou na znalostech patofyziologie migrény. Ve studiích i praxi byla prokázána jejich velmi dobrá účinnost u EM, CM i CM s nadužíváním akutní terapie. Nespornou výhodou je frekvence aplikace mAb jednou měsíčně nebo čtvrtletně. Nemají interakce s jinými terapeutiky. Nebyly popsány závažné NÚ a dlouhodobá tolerance je také dobrá. Podle současných znalostí nevedou k tvorbě autoprotilátek a ani jinak neovlivňují imunitní systém. Zatím neznáme nutnou délku podávání nebo možnost vysazení mAb při zachování trvalého efektu. Limitací je cena mAb. Indikační kritéria jsou nezbytnou součástí správného podávání a úhrady CGRP protilátek v centrech pro diagnostiku a léčbu bolestí hlavy.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 25. 5. 2020
Přijato do tisku: 28. 5. 2020
MUDr. Tomáš Nežádal, Ph.D.
Neurologické oddělení ÚVN-VFN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: tomas.nezadal@uvn.cz
Zdroje
1. Dodick DW. Migraine. Lancet 2018; 391 (10127): 1315–1330. doi: 10.1016/S0140-6736 (18) 30478-1.
2. GBD 2016 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet 2017; 390 (10100): 1211–1159. doi: 10.1016/S0140-6736 (17) 32154-2.
3. GBD 2016 Headache Collaborators. Global, regional, and national burden of migraine and tension-type headache, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016; Lancet Neurol 2018; 17 : 954–976.
4. Buse DC, Manack AN, Fanning KM et al. Chronic migraine prevalence, disability, and sociodemographic factors: results from the American Migraine Prevalence and Prevention Study. Headache 2012; 52 (10): 1456–1470. doi: 10.1111/j.1526-4610.2012.02223.x.
5. Evers S, Afra J, Frese A et al. EFNS guideline on the drug treatment of migraine-revised report of an EFNS task force. Eur J Neurol 2009; 16 (9): 968–981. doi: 10.1111/j.1468-1331.2009.02748.x.
6. Silberstein SD, Holland S, Freitag F et al. Evidence-based guideline update: pharmacologic treatment for episodic migraine prevention in adults: report of the Quality Standards Subcommittee of the American Academy of Neurology and the American Headache Society. Neurology 2012; 78 (17): 1337–1345. doi: 10.1212/WNL.0b013e3182535d20.
7. Araki N, Takeshima T, Igarashi H et al. Clinical practice guideline for chronic headache 2013. Neurol Clin Neurosci 2019; 7 (5): 231–259. doi: 10.1111/ncn3.12322.
8. Duncan C, Carod Artal FJ, Coulson A et al. Publication 155. Pharmacological management of migraine. A national clinical guideline. Edinburg, UK: SIGN 2018.
9. Dodick DW, Turkel CC, DeGryse RE et al. OnabotulinumtoxinA for treatment of chronic migraine: pooled results from the double-blind, randomized, placebo--controlled phases of the PREEMPT clinical program. Headache 2010; 50 (6): 921–936. doi: 10.1111/j.1526-4610.2010.01678.x.
10. Hepp, Z, Dodick DW, Varon SF et al. Adherence to oral migraine-preventive medications among patients with chronic migraine. Cephalalgia 2015; 35 (6): 478–488. doi: 10.1177/0333102414547138. J Headache Pain 2018; 19 (1): 13.
11. Blumenfeld AM, Stark RJ, Freeman MC et al. Long term study of the efficacy and safety of OnabotulinumtoxinA for the prevention of chronic migraine: COMPEL study.
12. Blumenfeld AM, Stark RJ, Freeman MC et al. Complicated decisions on new migraine-prevention therapies. Lancet Neurol 2018; 19 (1): 13. doi: 10.1186/s10194-018-0840-8.
13. Goadsby PJ, Edvinsson L, Ekman R. Vasoactive peptide release in the extracerebral circulation of humans during migraine headache. Ann Neurol 1990; 28 (2): 183–187. doi: 10.1002/ana.410280213.
14. Edvinsson L. The CGRP pathway in migraine as a viable target for therapies. Headache 2018; 58 (Suppl 1): 33–47. doi: 10.1111/head.13305.
15. Kamm K, Straube A, Ruscheweyh R. Calcitonin gene - -related peptide levels in tear fluid are elevated in migraine patients compared to healthy controls. Cephalalgia 2019; 39 (12): 1535–1543. doi: 10.1177/0333102419856640.
16. Edvinsson L, Haanes KA, Warfvinge K et al. CGRP as the target of new migraine therapies – successful translation from bench to clinic. Nat Rev Neurol 2018; 14 (6): 338–350. doi: 10.1038/s41582-018-0003-1.
17. Iyengar S, Ossipov MH, Johnson KW. The role of calcitonin gene-related peptide in peripheral and central pain mechanisms including migraine. Pain 2017; 158 (4): 543–559. doi: 10.1097/j.pain.0000000000000831.
18. Yu LC, Hansson P, Lundeberg T. The calcitonin gene--related peptide antagonist CGRP8-37 increases the latency to withdrawal responses in rats. Brain Res 1994; 653 (1–2): 223–230. doi: 10.1016/0006-8993 (94) 90393-x.
19. Hargreaves R, Olesen J. Calcitonin gene-related peptide modulators – the history and renaissance of a new migraine drug class. Headache 2019; 59 (6): 951–970. doi: 10.1111/head.13510.
20. Nežádal T. CGRP monoklonální protilátky v profylaktické léčbě migrény. Neurol praxi 2019; 20 (5): 356–360.
21. Goadsby PJ, Reuter U, Hallström Y et al. A controlled trial of erenumab for episodic migraine. N Engl J Med 2017; 377 : 2123−2132. doi: 10.1056/NEJMoa1705 848.
22. Tepper S, Ashina M, Reuter U et al. Safety and efficacy of erenumab for preventive treatment of chronic migraine: a randomised, double-blind, placebo-controlled phase 2 trial. Lancet Neurol 2017; 16 (6): 425–434. doi: 10.1016/S1474-4422 (17) 30083-2.
23. Brandes JL, Diener HC, Dolezil D et al. The spectrum of response to erenumab in patients with chronic migraine and subgroup analysis of patients achieving ≥50%, ≥75%, and 100% response. Cephalalgia 2020; 40 (1): 28–38. doi: 10.1177/0333102419894559.
24. Reuter U, Goadsby PJ, Lanteri-Minet M et al. Efficacy and tolerability of erenumab in patients with episodic migraine in whom two-to-four previous preventive treatments were unsuccessful: a randomised, double-blind, placebo-controlled, phase 3b study. Lancet 2018; 392 (10161): 2280–2287. doi: 10.1016/S0140-6736 (18) 32534-0.
25. Ornello R, Casalena A, Frattale I et al. Real-life data on the efficacy and safety of erenumab in the Abruzzo region, central Italy. J Headache Pain 2020; 21 (1): 32. doi: 10.1186/s10194-020-01102-9.
26. Dodick DW, Silberstein SD, Bigal ME et al. Effect of fremanezumab compared with placebo for prevention of episodic migraine: a randomized clinical trial. JAMA 2018; 319 (19): 1999−2008. doi: 10.1001/jama.2018.4853.
27. Brandes JL, Kudrow D, Yeung PP et al. Effects of fremanezumab on the use of acute headache medication and associated symptoms of migraine in patients with episodic migraine. Cephalalgia 2020; 40 (5): 470–477. doi: 10.1177/0333102419885905.
28. Silberstein SD, Dodick DW, Bigal ME et al. Fremanezumab for the preventive treatment of chronic migraine. N Engl J Med 2017; 377 (22): 2113–2122. doi: 10.1056/NEJMoa1709038.
29. Silberstein SD, McAllister P, Ning X et al. Safety and tolerability of fremanezumab for the prevention of migraine: a pooled analysis of phases 2b and 3 clinical trials. Headache 2019; 59 (6): 880–890. doi: 10.1111/head.13534.
30. VanderPluym J, Dodick DW, Lipton RB et al. Fremanezumab for preventive treatment of migraine: functional status on headache-free days. Neurology 2018; 91 (12): e1152–e1165. doi: 10.1212/01.wnl.0000544321.19316.40.
31. Ferrari MD, Diener HC, Ning X et al. Fremanezumab versus placebo for migraine prevention in patients with documented failure to up to four migraine preventive medication classes (FOCUS): a randomised, double-blind, placebo-controlled, phase 3b trial. Lancet 2019; 394 (10203): 1030–1040. doi: 10.1016/S0140-6736 (19) 31946-4.
32. Stauffer VL, Dodick DW, Zhang Q et al. Evaluation of galcanezumab for the prevention of episodic migraine: the EVOLVE-1 randomized clinical trial. JAMA Neurol 2018; 75 (9): 1080–1088. doi: 10.1001/jamaneurol.2018.1212.
33. Skljarevski V, Matharu, M, Millen, BA et al. Efficacy and safety of galcanezumab for the prevention of episodic migraine: results of the EVOLVE-2 Phase 3 randomized controlled clinical trial. Cephalalgia 2018; 38 (8): 1442–1454. doi: 10.1177/0333102418779543.
34. Camporeale A, Kudrow D, Sides R et al. A phase 3, long-term, open-label safety study of galcanezumab in patients with migraine. BMC Neurol 2018; 18 (1): 188. doi: 10.1186/s12883-018-1193-2.
35. Detke HC, Millen BA, Zhang Q et al. Rapid Onset of effect of galcanezumab for the prevention of episodic migraine: analysis of the EVOLVE studies. Headache 2020; 60 (2): 348–359. doi: 10.1111/head.13691.
36. Ruff DD, Ford JH, Tockhorn-Heidenreich A et al. Efficacy of galcanezumab in patients with episodic migraine and a history of preventive treatment failure: results from two global randomized clinical trials. Eur J Neurol 2020; 27 (4): 609–618. doi: 10.1111/ene.14114.
37. Detke HC, Goadsby PJ, Wang S et al. Galcanezumab in chronic migraine. The randomized, double-blind, placebo-controlled REGAIN study. Neurology 2018; 91 (24): e2211–e2221. doi: 10.1212/WNL.0000000000006640.
38. Ailani J, Pearlman E, Zhang Q et al. Positive response to galcanezumab following treatment failure to onabotulinumtoxinA in patients with migraine: post hoc analyses of three randomized double-blind studies. Eur J Neurol 2020; 27 (3): 542–549. doi: 10.1111/ene.14102.
39. Goadsby PJ, Dodick DW, Leone M et al. Trial of galcanezumab in prevention of episodic cluster headache. N Engl J Med 2019; 381 (2): 132–141. doi: 10.1056/NEJMoa1813440.
40. Baker B, Schaeffler B, Cady R et al. Rational design of a monoclonal antibody inhibiting calcitonin gene-related peptide, ALD403 (eptinezumab), to provide early onset, high efficacy, extended duration of action, and desired safety for the prevention of migraine. Cephalalgia 2017; 37 (Suppl 1): 109.
41. Saper J, Lipton RB, Kudrow DB et al. A phase 3, randomized, double-blind, placebo-controlled study to evaluate the efficacy and safety of eptinezumab in frequent episodic migraine prevention: primary results of the PROMISE-1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy–1) trial. Cephalalgia 2017; 37 (Suppl 1): 337.
42. Lipton RB, Goadsby PJ, Smith J et al. Efficacy and safety of eptinezumab in patients with chronic migraine: PROMISE-2. Neurology 2020; 94 (13): e1365–e1377. doi: 10.1212/WNL.0000000000009169.
43. Dodick DW, Lipton RB, Silberstein S et al. Eptinezumab for prevention of chronic migraine: a randomized phase 2b clinical trial. Cephalalgia 2019; 39 (9): 1075–1085. doi: 10.1177/0333102419858355.
44. Depre C, Antalik L, Starling A et al. A Randomized, double-blind, placebo-controlled study to evaluate the effect of erenumab on exercise time during a treadmill test in patients with stable angina. Headache 2018; 58 (5): 715–723. doi: 10.1111/head.13316.
45. Kudrow D, Pascual J, Winner PK et al. Vascular safety of erenumab for migraine prevention. Neurology 2020; 94 (5): e497–e510. doi: 10.1212/WNL.0000000000008743.
46. Bigal ME, Walter S, Bronson M et al. Cardiovascular and hemodynamic parameters in women following prolonged CGRP inhibition using LBR-101, a monoclonal antibody against CGRP. Cephalalgia 2014; 34 : 968–976. doi: 10.1177/0333102414527646.
47. Hargreaves R, Olesen J. Calcitonin gene-related peptide modulators – the history and renaissance of a new migraine drug class. Headache 2019; 59 (6): 951–970. doi: 10.1111/head.13510.
48. Oakes TM, Kovacs R, Rosen N et al. Evaluation of cardiovascular outcomes in adult patients with episodic or chronic migraine treated with galcanezumab: data from three phase 3, randomized, double-blind, placebo--controlled EVOLVE-1, EVOLVE-2, and REGAIN studies. Headache 2020; 60 (1): 110–123. doi: 10.1111/head.13684.
49. Sacco S, Bendtsen L, Ashina M et al. European headache federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention. J Headache Pain 2019; 20 (1): 6. doi: 10.1186/s10194-018 - 0955-y.
50. American Headache Society. The American Headache Society position statement on integrating new migraine treatments into clinical practise. Headache 2019; 59 (1): 1–18. doi: 10.1111/head.13456.
51. Nežádal T, Marková J, Bártková A et al. Mezinárodní klasifikace bolestí hlavy (ICHD-3) – oficiální český překlad. Cesk Slov Neurol N 2020; 83/116 (2): 145–152. doi: 10.14735/amcsnn2020145.
52. Ziegeler C, May A. Non-responders to treatment with antibodies to the CGRP-receptor may profit from a switch of antibody class. Headache 2020; 60 (2): 469–470. doi: 10.1111/head.13729.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek EditorialČlánek Recenze knih
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Editorial
- Cytotoxické léze corpus callosum (CLOCCs)
- Poranění radiálního nervu při zlomeninách diafýzy pažní kosti
- Je jasné, kdy operovat výhřez bederní meziobratlové ploténky?
- Současná diagnostika sekundárně progresivní formy roztroušené sklerózy a léčba siponimodem
- Roztroušená skleróza – odhalené tajemství imunity
- Hygiena dýchacích cest u pacientů s Parkinsonovou nemocí – přehled problematiky a možnosti fyzioterapeutické intervence
- Klinické a sociální prediktory kvality života u dětí a mladších dospělých s poruchou autistického spektra
- Bezpečnost karotické endarterektomie s ohledem na její načasování po ischemické cévní mozkové příhodě
- Glatiramer acetát – léčba roztroušené sklerózy monitorovaná v registru ReMuS
- Intenzivní rehabilitace kognitivních funkcí u osob s roztroušenou sklerózou – výsledky 12týdenní randomizované studie hodnocené počítačovým programem
- Účinnost a bezpečnost urgentní mikrochirurgické embolektomie při selhání intravenózní trombolýzy a mechanické trombektomie u pacientů s akutním ischemickým iktem – protokol systematického review
- Vliv pandemie COVID-19 na spánkovou medicínu v České republice a na Slovensku
- Prevalence a charakteristika epilepsie u pacientů s relabující-remitující formou roztroušené sklerózy léčených imunomodulační terapií
- Syndrom moyamoya doprovázený polycystickou chorobou ledvin – kazuistika vzácného onemocnění a přehled literatury
- Souběh dvou oportunních infekcí jako první projev HIV
- Dropped head syndrom u pacientky s progredující bulbární paralýzou
- Karotický paragangliom, velmi vzácný nádor v dětském věku
- Využití kvantitativní MR venografie v indikaci stentingu stenózy žilního splavu
- Transvenózna embolizácia prasknutej piálnej arteriovenóznej malformácie
- CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
- Recenze knih
- 2020 AAN Highlights Dlouhodobá data o účinnosti deplece CD20+ B-buněk v léčbě RS
- 2020 AAN Highlights Jak mění malá molekula průběh spinální svalové atrofie?
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Je jasné, kdy operovat výhřez bederní meziobratlové ploténky?
- CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
- Cytotoxické léze corpus callosum (CLOCCs)
- Dropped head syndrom u pacientky s progredující bulbární paralýzou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



