-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Glatiramer acetát – léčba roztroušené sklerózy monitorovaná v registru ReMuS
Glatirameracetate – the treatment of multiple sclerosis monitored in the ReMuS Registry
The data of patients with MS treated in the Czech Republic with glatirameracetate (GA) entered in both etrospectively and prospectively the Registry of Multiple Sclerosis (ReMuS) registry are presented. Outputs from the registry were processed over the period from its foundation on January 1, 2013 to June 30, 2018 focusing on patients treated daily with subcutaneous 20 mg/ml of GA (GA20) or subcutaneous 40 mg/ml (GA40) 3 times per week. Data of a total of 3,527 patients who were treated with GA20 or GA40 during the period monitored were analysed. 868 patients (24.6%) were treated during the entire monitored period and treatment in this period was started in 1,929 patients (54.6%). At the end of the reference period, a total of 2,190 (62.1%) patients were treated with GA. In this subgroup, 205 patients (9.4%) were treated with GA 20 and 1,985 patients (90.6%) with GA 40. Treatment with GA was finished in 634 (32.9%) patients, out of whom 521 (82.2%) were included for treatment escalation and 113 patients (17.8%) discontinued immunomodulatory therapy.
Keywords:
Multiple sclerosis – clinically isolated syndrome – glatirameracetate
Autoři: R. Taláb 1; M. Talábová 2
Působiště autorů: Neurologická klinika LF UK a FN Plzeň 1; Neurologická klinika LF UK a FN Hradec Králové 2
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(4): 401-407
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn2020401Souhrn
V práci jsou prezentována data pacientů s RS léčených v ČR glatiramer acetátem (GA) zadaná do registru Registry of Multiple Sclerosis (ReMuS) retrospektivně i prospektivně. Výstupy z registru byly zpracovány za období od jeho založení 1. 1. 2013 do 30. 6. 2018 se zaměřením na data pacientů léčených přípravkem GA 20 mg/ml (GA20) subkutánně denně nebo 40 mg/ml (GA40) subkutánně 3× týdně. Byla provedena analýza celkem 3 527 pacientů, kteří byli ve sledovaném období léčeni přípravkem GA20 či GA40. Celé sledované období bylo léčeno 868 pacientů (24,6 %) a léčbu v tomto období zahájilo 1 929 pacientů (54,6 %). Na konci sledovaného období, bylo léčeno GA celkem 2 190 pacientů (62,1 %). V této podskupině bylo 205 pacientů (9,4 %) léčeno GA20 a 1 985 pacientů (90,6 %) GA40. Léčbu GA ukončilo 634 (32,9 %) pacientů, z toho 521 (82,2 %) z důvodu eskalace léčby a 113 pacientů (17,8 %) již dále nepokračovalo v imunomodulační léčbě.
Klíčová slova:
glatiramer acetát – klinicky izolovaný syndrom – roztroušená skleróza
Úvod
Více než 23 let jsou pacienti s atakovitou formou RS (relaps remitentní forma RS; RRRS) ve světě i v ČR léčeni glatiramer acetátem (GA) nejprve denně subkutánně 20 mg/ml (GA20) a v posledních letech převážně 3× týdně 40 mg/ml subkutánně (GA40). Výsledky prvních klinických kontrolovaných studií poskytly nejen první data o účinnosti, bezpečnosti a snášenlivosti léčby, ale prokázaly význam účinnosti podmíněný časným zahájením léčby a determinovaly indikaci léčby již po první demyelinizační atace – klinicky izolovaném syndromu (clinically isolated syndrome; CIS). Rozdíly mezi výsledky kontrolovaných klinických studií a novými poznatky z dlouhodobého monitorování v klinické praxi determinovaly organizaci observačních studií a monitorování pacientů s RS v národních a nadnárodních registrech, zejména v Evropě, Kanadě a USA [1]. V českých podmínkách byl takovou observační studií neintervenční, multicentrický, národní, prospektivní observační projekt léčby GA u pacientů s RRRS v podmínkách běžné klinické praxe [2]. Nadnárodní platformou se stala australská MS Base, která je celosvětovým registrem pro získávání dat nejen o léčbě RS, ale i databankou klinických poznatků a zkušeností o tomto dosud kauzálně neléčitelném zánětlivém autoimunitním a neurodegenerativním onemocnění CNS. Možnost propojení center pro diagnostiku a léčbu RS (Multiple Sclerosis Center; MSC) s MS Base využívají již některá MSC v ČR.
V ČR jsou od roku 2013 v součinnosti všech MSC shromažďována data pacientů léčených léky ovlivňujícími nemoc (disease modifying drugs; DMDs) v registru pacientů s diagnózou RS (Registry of Multiple Sclerosis; ReMuS). Aktuálně jsou odborné veřejnosti předkládána data nemocných léčených v ČR GA, oficiálně poskytnutá firmou Teva Pharmaceuticals CR, s. r. o., která je získala po projednání a schválení Nadačním fondem IMPULS a Sekcí klinické neuroimunologie a likvorologie (SKNIL) České neurologické společnosti (ČNS) ČLS JEP z registru ReMuS. Výstupy z registru byly zpracovány za období od 1. 1. 2013 do 30. 6. 2018 se zaměřením na data pacientů léčených GA20 nebo GA40 zadaných dlouhodobě retrospektivně i prospektivně.
Cíle analýzy
Cílem detailní analýzy dat v registru ReMuS byla podskupina dlouhodobě léčených pacientů, kteří ve sledovaném období zahájili léčbu, a těch, kteří byli přípravkem GA léčeni celé sledované období.
Dalším cílem byl popis podskupiny pacientů, kteří byli GA léčeni na konci sledovaného období. U těchto pacientů bylo cílem provést analýzu účinnosti léčby podle varianty léku, kterou užívají (20 mg/ml nebo 40 mg/ml).
Posledním cílem byla analýza léčby podskupiny pacientů, kteří ukončili léčbu GA v průběhu jednoho zvoleného roku (2016), vč. analýzy léčby následující po ukončení užívání GA.
Metodika
Registr ReMuS byl založen Nadačním fondem IMPULS v roce 2013 za odborné podpory SKNIL ČNS ČLS JEP s cílem získávat kvalitní a reprezentativní údaje o pacientech s diagnózou RS v ČR. Od konce roku 2016 je v registru ReMuS zapojeno všech 15 MSC ČR.
Do registru ReMuS bylo zařazeno k 30. 6. 2018 celkem 13 850 pacientů s diagnózou RS, kteří jsou léčeni v jednom z 15 MSC. Vzhledem k cíli této analýzy z nich byla vybrána podskupina 3 527 pacientů, kteří byli kdykoli ve sledovaném období od 1. 1. 2013 do 30. 6. 2018 léčeni GA20 či GA40. V rámci analýzy jsou popisovány základní parametry z registru ReMuS – věk, pohlaví, zaměstnanost, sociální dávky, délka trvání onemocnění, Expanded Disability Status Scale (EDSS) a relapsy. Sledované parametry jsou přesně definovány. EDSS vyjadřující stupeň invalidity nabývá hodnot od 0 do 10, kdy 0 znamená zdravý pacient bez potíží, stupeň 5 představuje značné postižení, schopnost samostatné chůze na vzdálenost do 200 m, stupeň 10 znamená úmrtí v důsledku RS. Vzhledem k tomu, že každý pacient je sledován různě dlouhou dobu, je potřeba změnu EDSS normovat na 1 rok. Nejedná se o hodnotu EDSS jako takovou, ale o změnu EDSS za 1 rok. Změna EDSS na 1 rok je rozdíl EDSS mezi první a poslední dostupnou návštěvou popsaných pacientů ve sledovaném období dělený délkou období mezi těmito návštěvami a vynásobený počtem dní v roce (365,25). Tato metodika předpokládá převážně monotónní průběh změn EDSS a zanedbává nelinearitu postupného zhoršování EDSS v čase.
Relaps neboli ataka je, akutní období zhoršení onemocnění trvající minimálně 24 h. Počet relapsů na rok – počet relapsů ve sledovaném období normovaný na jeden rok je ARR (annualised relapse rate) – dělený počtem dní sledovaného období a vynásobený 365,25.
Pro popis dat z registru ReMuS byla použita popisná statistika. Kategoriální proměnné jsou popsány pomocí četností pacientů v jednotlivých kategoriích a procentuálního zastoupení. Spojité proměnné jsou popsány prostřednictvím průměru, směrodatné odchylky, mediánu, minima, maxima a počtu zpracovávaných hodnot. Pro analýzu pacientů s CIS byla uplatněna již méně používaná definice – pacienti pouze s relapsem v období začátku onemocnění. Z této analýzy byli vyřazeni pacienti s primární progresí, pacienti bez udání doby začátku onemocnění a pacienti s chybně zadanou dobou začátku onemocnění. Pro účely vymezení období začátku onemocnění bylo uvažováno 30 dní před datem a 30 dní po datu začátku onemocnění.
Výsledky
Celkový počet pacientů, kteří jsou v registru ReMuS a byli ve sledovaném období od 1. 1. 2013 do 30. 6. 2018 léčeni přípravkem GA, je 3 527. Celkem 1 929 naivních pacientů (54,6 %) zahájilo svou první léčbu GA (tab. 1). Z těchto 1 929 pacientů ukončilo léčbu GA celkem 634 pacientů (32,9 %). Průměrná délka léčby těchto pacientů byla 540 dní, což je přibližně 1,5 roku. Celkem 1 295 pacientů (67,1 %) pokračovalo v léčbě GA do 30. 6. 2018 a průměrná délka jejich léčby byla 905 dní, což odpovídá přibližně 2,5 roku (tab. 2). Z 634 pacientů, kteří ukončili léčbu, již dále nepokračovalo v léčbě DMD 113 pacientů (17,8 %). Celkem 521 pacientů (82,2 %) zahájilo ve sledovaném období další léčbu DMD, nejčastěji se jednalo o eskalaci léčby na léčivý přípravky Tecfidera (Biogen, Cambrigde, MA, USA) (22,7 %) a Gilenya (Novartis, Basilej, Švýcarko) (19,4 %). Podrobnější přehled změny léčby ukazuje tab. 3, ve které jsou ve skupině „Ostatní“ souhrnně uvedeny jednotlivé případy pacientů převedených na léčivé přípravky (LP): Lemtrada (Sanofi, Paříž, Francie), Betaferon (Bayer, Leverkusen, Německo), Extavia (Novartis, Basilej, Švýcarsko), Mabthera (Roche, Basilej, Švýcarsko) a Ocrevus (Roche, Basilej, Švýcarsko) (tab. 3).
Tab. 1. Počet pacientů léčených LP GA ve sledovaném období od 1. 1. 2013 do 30. 6. 2018. 
GA – glatiramer acetát; LP – léčivý přípravek Tab. 2. Délka léčby GA. 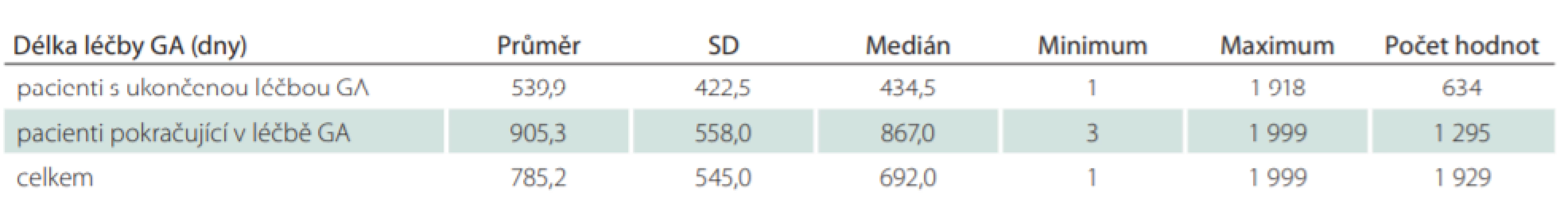
GA – glatiramer acetát; SD – směrodatná odchylka Tab. 3. Následující léčba DMD po ukončení léčby glatiramer acetátem. 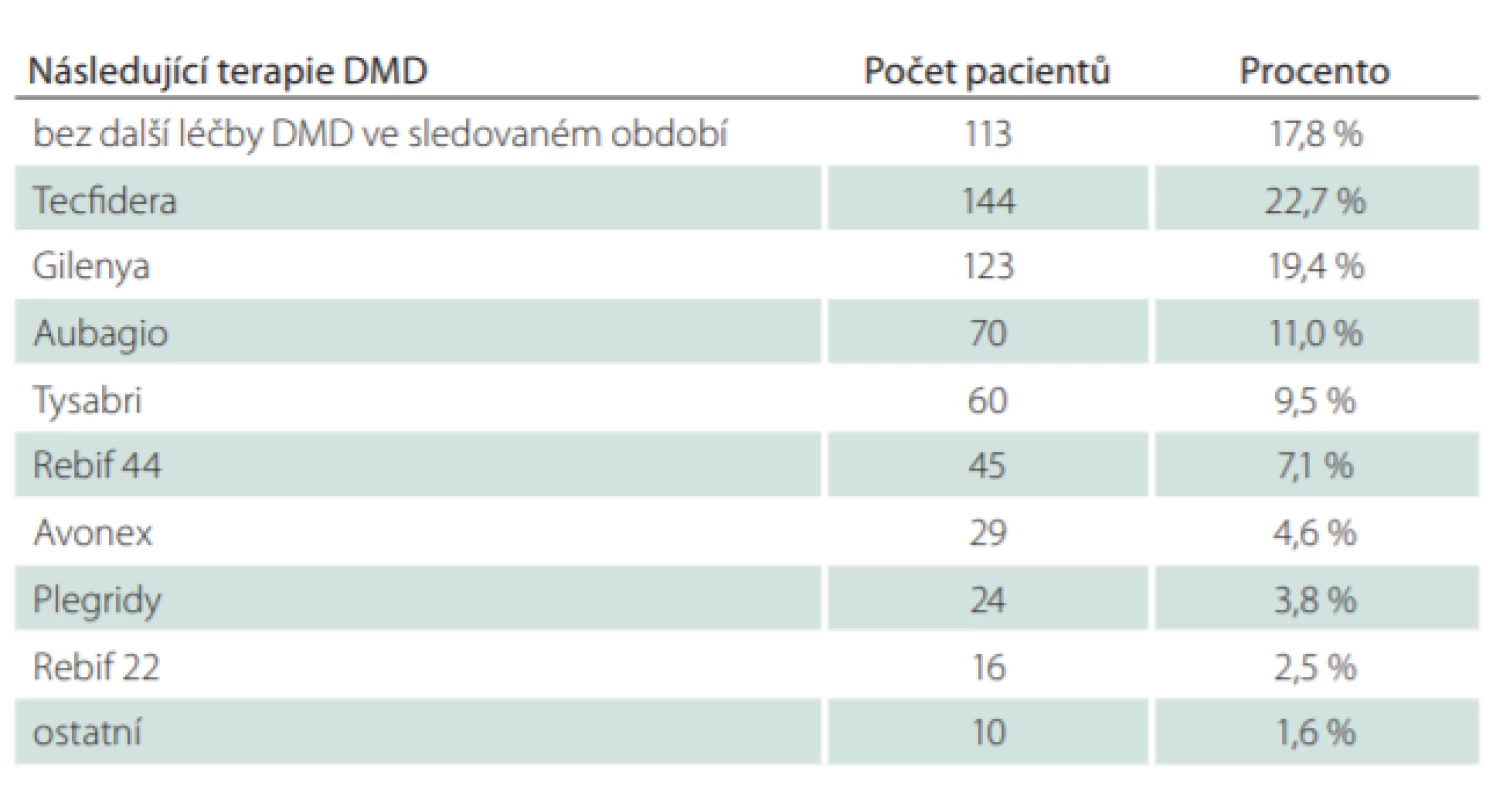
DMD – léky ovlivňující nemoc Analýza pacientů léčených GA po celé sledované období
Pacientů léčených GA20 nebo GA40 po celé sledované období, bylo celkem 868 (24,6 %) (tab. 1). Průměrná doba mezi první a poslední návštěvou ve sledovaném období byla 1 670,7 dne, což odpovídá 4,6 roku. V průměru u všech 868 pacientů došlo ke zhoršení EDSS o 0,04 stupně na rok. Celkově se zlepšilo 12,7 % dlouhodobě léčených pacientů ve sledovaném období a 55,8 % pacientů mělo na konci sledovaného období stejné EDSS jako na začátku. Pouze u 31,6 % pacientů se zvýšil stupeň EDSS v průměru o 0,20 stupně EDSS za 1 rok (tab. 4). Počet relapsů byl analyzován za celé sledované období. U každého pacienta byl počet relapsů v daném období počítán na jeden rok (ARR). ARR u dlouhodobě léčených pacientů byl 0,11. Pacienti, kteří vyvinuli relaps ve sledovaném období (38,1 %), měli ARR 0,28 (tab. 5).
Tab. 4. Vývoj EDSS ve sledovaném období. 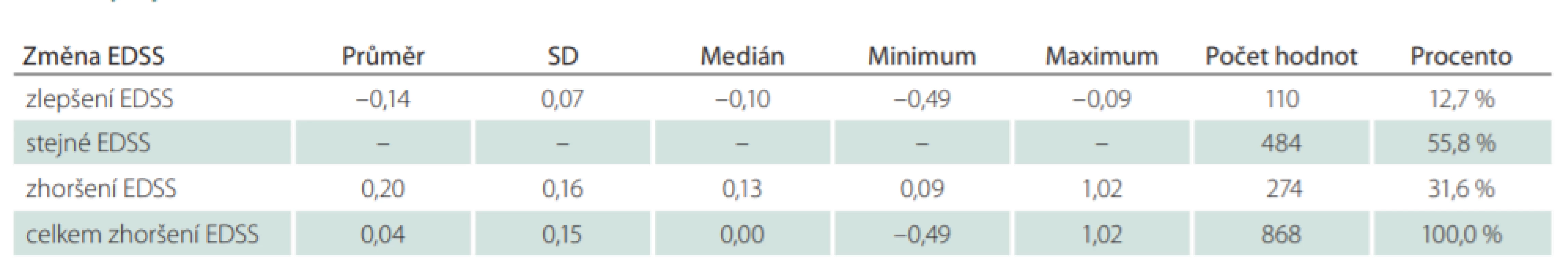
EDSS – Expanded Disability Status Scale; SD – směrodatná odchylka Tab. 5. Počet relapsů na pacienta na rok ve sledovaném období. 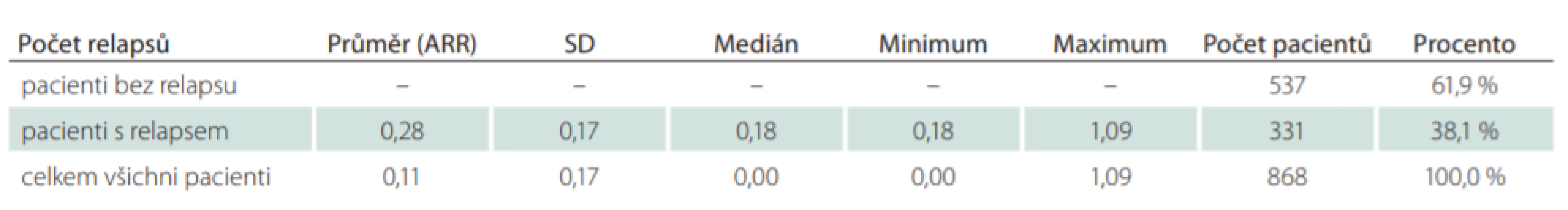
ARR – počet relapsů ve sledovaném období normovaný na jeden rok; SD – směrodatná odchylka Analýzy pacientů léčených GA k datu výstupu z registru
K 30. 6. 2018 bylo GA celkem léčeno 2 190 pacientů (62,1 %), z nich 205 (9,4 %) GA20 a 1 985 pacientů (90,6 %) GA40 (tab. 6). V uvedené podskupině 2 190 pacientů bylo na konci sledovaného období 74,9 % žen a 25,1 % mužů. Průměrný věk pacientů v době poslední návštěvy byl 41,6 let. Největší podíl pacientů byl ve věkovém rozmezí 40–50 let (31,4 %) a 30–40 let (30,3 %). V analyzované podskupině pacientů nebyli pacienti mladší než 10 let (obr. 1). Průměrný věk v době začátku onemocnění byl 32,1 let. U pacientů užívajících GA40 byl průměrný věk přibližně o 1,5 roku vyšší než u pacientů užívajících GA20. Průměrný věk byl v době zahájení první léčby GA 36,5 let. Průměrná doba trvání RS byla 9,6 let. U pacientů užívajících GA20 byla průměrná doba trvání RS přibližně o 1,5 roku delší než u pacientů užívajících GA40. Stupeň invalidity byl standardně hodnocen na každé návštěvě pomocí EDSS. Analýza stupně invalidity byla provedena z EDSS z poslední dostupné návštěvy pacienta ve sledovaném období. Medián hodnoty EDSS byl 2,0. Nejvíce pacientů mělo EDSS mezi 1,5 a 2 (obr. 2). Medián hodnoty EDSS byl shodný u pacientů užívajících GA20 a GA40.
Tab. 6. Počet pacientů léčených GA ve sledovaném období od 1. 1. 2013 do 30. 6. 2018. 
GA – glatiramer acetát; GA20 – glatiramer acetát 20 mg/ml; GA40 – glatiramer acetát 40 mg/ml Obr. 1. Počet pacientů léčených přípravkem glatiramer acetát v jednotlivých dekádách věku v době poslední návštěvy.
Fig. 1. The number of patients treated with glatiramer acetate in each decade of age at the time of the last visit.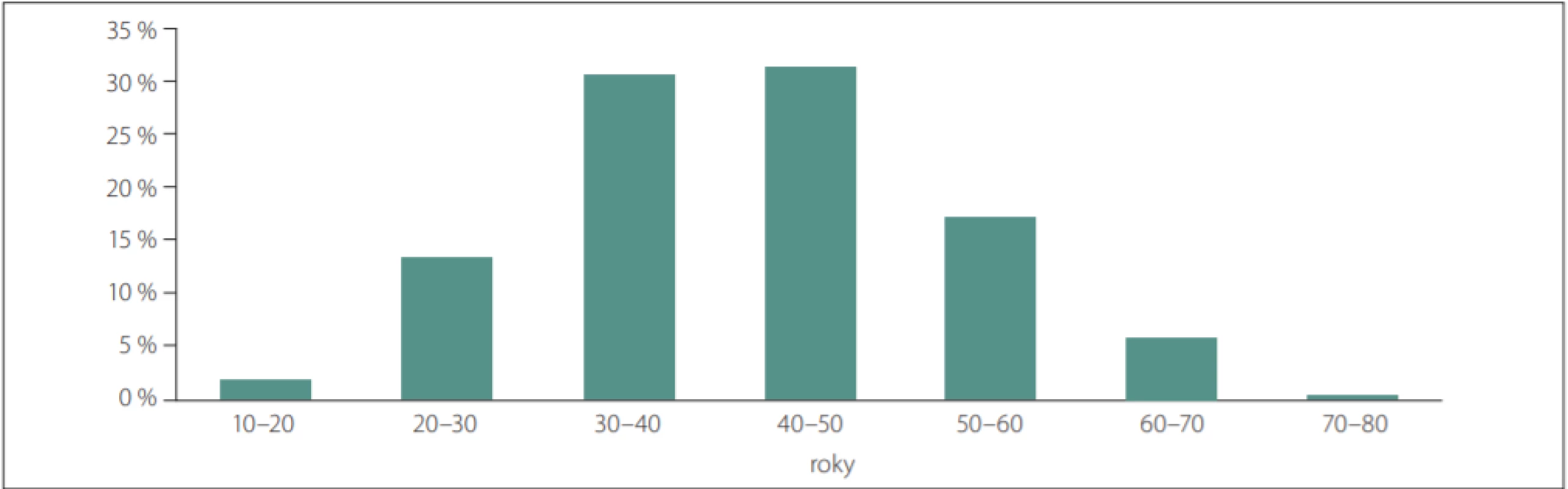
Obr. 2. Rozložení všech analyzovaných pacientů podle stupně Expanded Disability Status Scale.
Fig. 2. Distribution of all patients analysed by Expanded Disability Status Scale grade.
Mezi základní parametry hodnocení účinnosti GA řadíme vedle stupně disability počet relapsů. Z pacientů, kteří jsou v současné době léčeni GA, mělo 42,7 % pacientů v registru zaznamenán pouze jeden relaps v době počátku onemocnění (CIS). Zbylých 57,3 % pacientů mělo alespoň dva relapsy (RRRS). Za posledních 6 měsíců do 30. 6. 2018 mělo 6,3 % pacientů relaps, za 12 měsíců to bylo 14,9 % a za 24 měsíců to bylo 33,1 %. ARR za poslední 2 roky sledování byl 0,17.
Dalším analyzovaným parametrem byla forma léčby relapsu – ambulantně vs. za hospitalizace. Většina relapsů (83,3 % v posledních 6 měsících a 76,4 % v posledních 12 měsících) byla léčena ambulantně. Zaznamenané relapsy byly většinou léčeny metylprednisolonem intravenózně (Solu-medrol infuze). Průměrná celková dávka byla v posledních 6 měsících 2 828,0 mg, medián byl 3 000 mg. Za posledních 12 měsíců byla průměrná celková dávka 2 912,3 mg a medián opět 3 000 mg.
Dalším parametrem účinnosti léčby GA je nepochybně hodnocení zaměstnanosti a stupně invalidy. Zaměstnanost a pobírání sociálních dávek bylo vyhodnoceno z údajů poslední návštěvy před koncem sledovaného období (tj. před 30. 6. 2018). Celkem 1 343 pacientů (61,3 %) pracuje na plný úvazek a dalších 300 pacientů (13,7 %) pracuje na částečný úvazek. Dohromady 450 pacientů (20,5 %) nepracuje (obr 3). U pacientů užívajících GA20 je pacientů pracujících na plný úvazek celkem 57,6 % a u pacientů, kteří užívají GA40, je to 61,7 %. Celkem 1 339 pacientů (61,1 %) nepobírá žádné sociální dávky. Z pacientů, kteří užívají GA20, to bylo 59,0 % pacientů a GA40 to bylo 61,4 % pacientů (obr. 4).
Obr. 3. Rozložení všech analyzovaných pacientů podle zaměstnanosti.
Fig. 3. Distribution of all patients analysed by employment.
Obr. 4. Rozložení všech analyzovaných pacientů podle sociálních dávek.
Fig. 4. Distribution of all patients analysed by social benefi ts.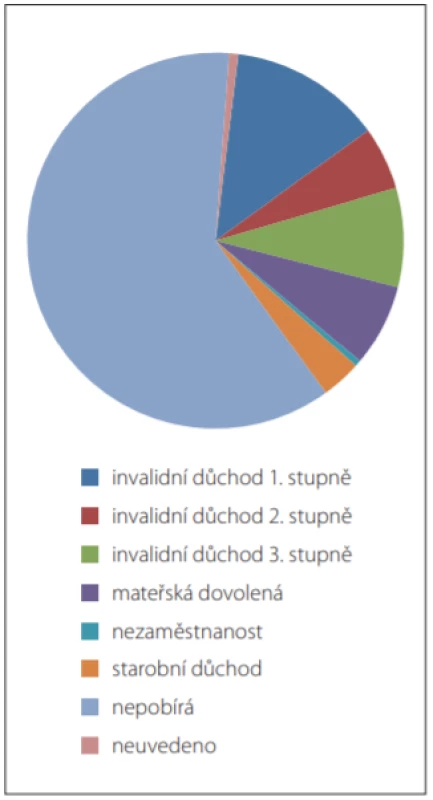
Celkem pro 72,6 % pacientů, kteří byli na poslední návštěvě v období do 30. 6. 2018, byl GA první léčivý přípravek ze skupiny DMD (tj. užívali GA v tzv. první linii léčby). Zbylých 27,4 % pacientů užívalo GA jako druhou nebo další léčebnou volbu, na kterou byli převedeni z jiného DMD přípravku. Nejčastěji se jednalo o interferon beta (Betaferon [Bayer, Leverkusen, Německo] [22,7 % převedených pacientů], Rebif 44 [Merck, Darmstadt, Německo] [22,0 % převedených pacientů] a Avonex [Biogen, Cambrigde, MA, USA] [21,2 % převedených pacientů]) (tab. 7).
Tab. 7. Předchozí terapie DMD u pacientů s glatiramer acetátem. 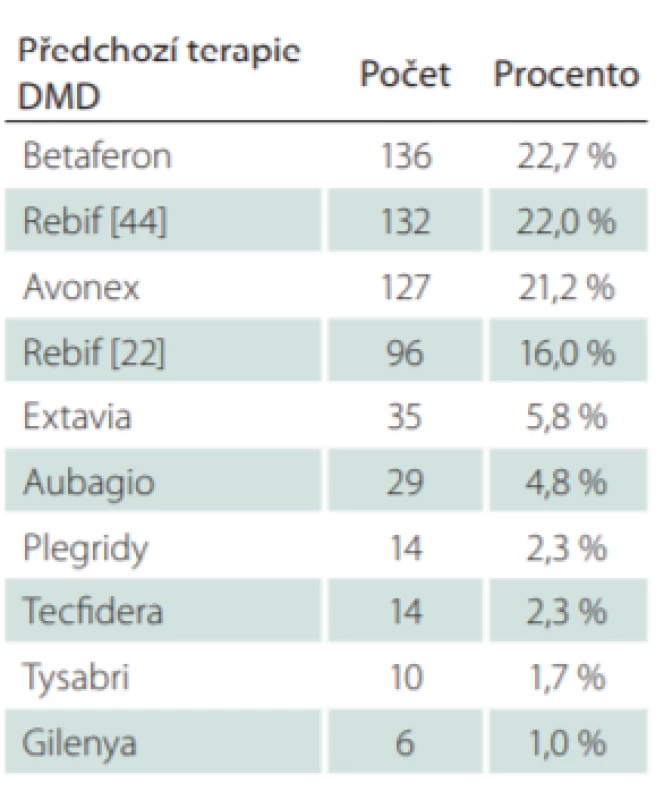
DMD – léky ovlivňující nemoc Jednoroční analýza účinnosti léčby GA
Jako modelový byl zvolen k jednoroční analýze rok 2016. Z celkového počtu 3 527 pacientů, kteří byli ve sledovaném období léčeni přípravkem GA, bylo analyzováno 285 pacientů (8,1 %), kteří ukončili léčbu v průběhu roku 2016. Celkem u 190 pacientů (66,7 %) byly po ukončení léčby GA provedeny switch nebo eskalace na jinou léčbu DMD a u 95 pacientů (33,3 %) byla léčba DMD ukončena nebo přerušena např. z důvodu plánovaného těhotenství (tab. 8). Důvodem eskalace léčby byly u 179 pacientů ze 190 (94,2 %) dva nebo více relapsů a u 11 pacientů (5,8 %) pouze jeden relaps. V průměru došlo ve zvoleném roce 2016 u všech 179 pacientů ke zhoršení EDSS o 0,35 stupně na rok. Pouze 5,3 % pacientů se ve sledovaném období celkově zlepšilo a 39,2 % pacientů mělo na konci sledovaného období totožnou hodnotu EDSS jako na začátku. V 55,6 % se pacientům hodnota EDSS zhoršila v průměru o 0,72 stupně na rok (tab. 9). Medián hodnoty EDSS na poslední návštěvě před ukončením léčby GA byl 3,0. Nejčastější volbou eskalace léčby byly Tecfidera cps 240 mg (24,9 %) a Gilenya tbl. 0,5 mg (19,3 %) (tab. 10). V rámci hodnocení účinnosti eskalace léčby byla analyzována průměrná změna EDSS a ARR. V průměru došlo u 188 pacientů s dostupnými údaji o EDSS ke zlepšení EDSS o 0,04 stupně na rok. Celkem 17,0 % pacientů se ve sledovaném období celkově zlepšilo, 67,6 % pacientů mělo na konci sledovaného období totožnou hodnotu EDSS jako na začátku a u 15,4 % pacientů se EDSS zvýšilo o 1,19 stupně na rok. Průměrná hodnota ARR byla 0,35. U pacientů, kteří ve sledovaném období vyvinuli relaps (25,3 %), byl ARR v daném období 1,38 (tab. 11). Průměrná doba mezi první a poslední dostupnou návštěvou ve sledovaném období jednoho roku po eskalaci léčby byla 280,6 dne, což odpovídá 0,8 roku.
Tab. 8. Počet pacientů léčených GA ve sledovaném období od 1. 1. 2013 do 30. 6. 2018 – ukončení léčby 
DMD – léky ovlivňující nemoc; GA – glatiramer acetát Tab. 9. Vývoj EDSS ve sledovaném období léčby glatiramer acetátem. 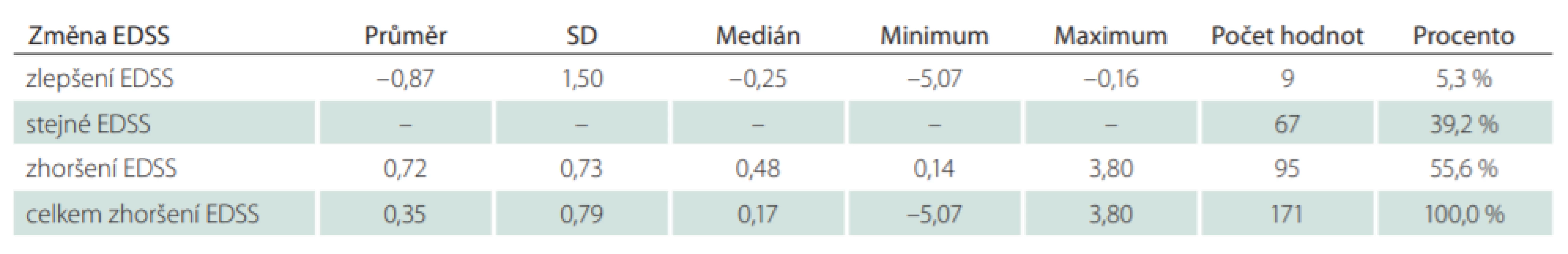
EDSS – Expanded Disability Status Scale; SD – směrodatná odchylka Tab. 10. Následující po ukončení léčby glatiramer acetátem. 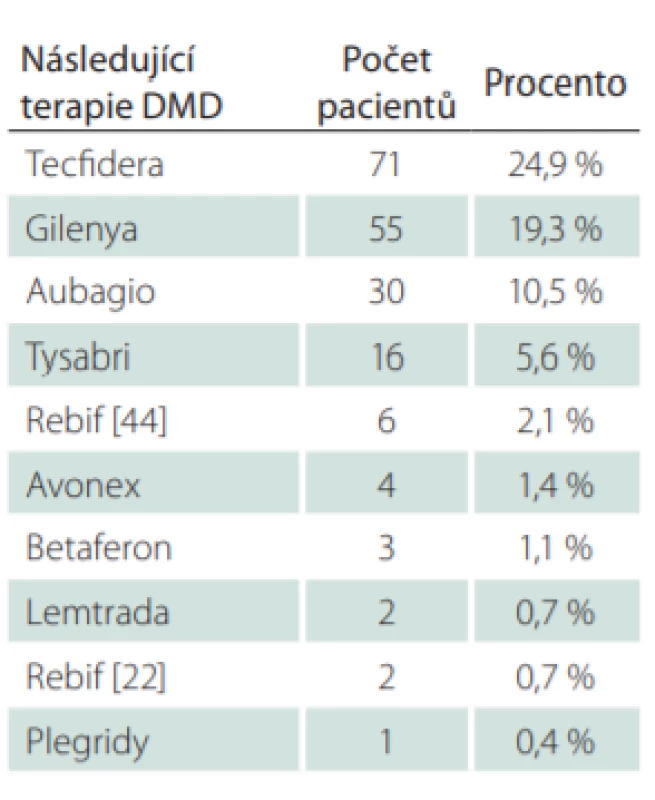
DMD – léky ovlivňující nemoc Tab. 11. Počet relapsů na pacienta na rok ve sledovaném období po ukončení léčby glatiramer acetátem. 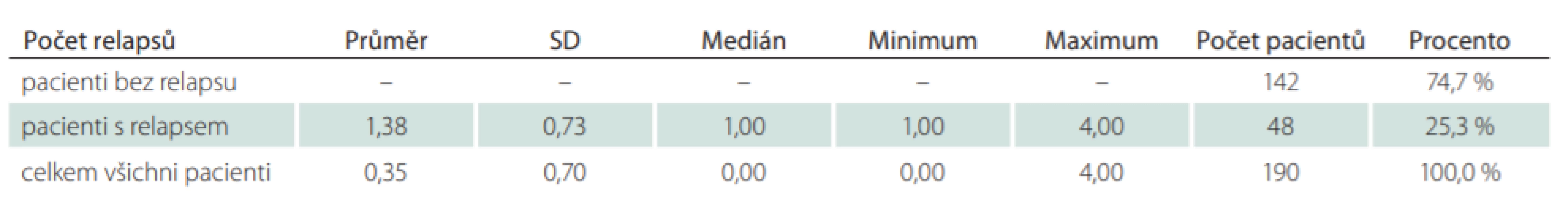
SD – směrodatná odchylka Diskuze
Účinnost GA20 v léčbě RRRS byla ověřena prvními klinickými studiemi zveřejněnými již v roce 1995 [3–5] a publikována s výsledky následné otevřené fáze, kde ARR pacientů, kteří byli randomizováni a přestoupili do otevřené fáze, byl 0,42 a v hodnocení za celých 6 let klinické studie 0,23. EDSS bylo u 69,3 % pacientů stabilní jako na začátku léčby nebo zlepšeno až o 1 stupeň [6]. Prezentované výsledky ARR a EDSS hodnocené v registru ReMuS korespondují s výsledky studií a vykazují příznivější trendy.
V následujících letech proběhly srovnávací studie s GA a interferonem beta v různém dávkování. Z jejich závěrů vyplynulo, že není významný rozdíl mezi podáváním vysokých dávek interferonu beta a GA v redukci počtu atak. Nejen výsledky kontrolovaných klinických studií, observační studie, ale také 23letá klinická praxe potvrdila účinnost, bezpečnost a pozici GA v první linií léčby RRRS a CIS. Ve studii PreCISe byla sledována účinnost GA v indikaci CIS na oddálení vzniku druhé ataky. Výsledkem bylo signifikantní oddálení druhé ataky o 386 dní ve srovnání s neléčenou skupinou, rovněž tak o 58 % méně nových T2 vážených lézí na MR a jejich menší objem. Po odslepení studie PreCISE následovala otevřená fáze studie, která prokázala oddálení rizika konverze do RRRS o 41 % (HR: 0,59; 95% CI: 0,44–0,80; p = 0,0005) v porovnání s placebovou skupinou, oddálila konverzi CIS do RRRS o 972 dní, snížila mozkovou atrofii (–28 %; p = 0,0209), omezila počet nových T2 vážených lézí na MR v průběhu 1 roku (–42 %; p < 0,0001) a zmenšila objem T2 vážených lézí na MR o 22 % (p = 0,0005) [7].
Z celkového počtu 13 850 pacientů v registru ReMuS k 30. 6. 2018 bylo celkem 3 527 (25,5 %) pacientů léčeno ve sledovaném období GA. K aktuálnímu datu hodnocení 30. 6. 2018 bylo aktivně léčeno 2 190 pacientů (62,1 %). ReMuS poskytuje informaci o profilu indikace GA jako první léčebné volby nebo druhé volby, ať už z důvodu intolerance nebo neúčinnosti jiné léčby první linie. ReMuS neposkytuje informace o deeskalaci léčby RS, kde by mohl být GA indikován. Takový léčebný protokol nejprve indukční terapie s následnou deeskalací léčby např. GA by pravděpodobně zvýšil procento pacientů léčených GA. Naopak velmi detailní informace poskytuje ReMus u pacientů, u kterých byl GA první volbou, celkem 1 929 pacientů. Ve sledovaném období z nich 634 (32,9 %) léčbu GA ukončilo a 1 295 pacientů (67,1 %) pokračuje v léčbě. Z celkem 634 pacientů, kteří ve sledovaném období zahájili a ukončili léčbu GA, již 113 pacientů (17,8 %) nepokračovalo v léčbě DMD. Trvalé ukončení léčby GA nebo jako nízká účinnost eskalace v jednoroční analýze naznačují absenci včasné eskalace léčby GA, která byla také hodnocena ve studii PreCISe.
V analyzovaném souboru 634 pacientů, kteří ukončili léčbu GA, se u 82 % jednalo o eskalaci léčby, méně o switch v rámci první linie léčby RS (tab. 3). Převažovala eskalace na dimetyl fumarát (Tecfidera cps. 240 mg [22,7 %]) a fingolimod (Gilenya tbl. 0,5 mg [19,4 %]), tedy pacienti spolu s lékaři preferovali v rámci eskalace tabletovou formu léčby a pouze v 11,1 % byla míra aktivity RS jasným indikátorem eskalace léčby na infuzní lékovou formu natalizumabu nebo v tabulce uvedené „ostatní“ (alemtuzumab, rituximab, ocrelizumab).
Překvapivý je vysoký průměrný věk (36,5 roku) pacientů v době zahájení první volby léčby GA. V porovnání s analýzou k 31. 12. 2015, kdy byl průměrný věk 35,0 let [8], je paradoxně tendence k nárůstu. Při existenci stále časnějšího stanovení diagnózy CIS nebo RRRS tato data evokují řadu otázek, zda skutečně převažují pacienti primárně léčení GA v této věkové kategorii, zda vzrůstá počet pacientů bez nutnosti eskalace, nebo se jedná o pozdní eskalaci léčby, nebo se jedná o jiné faktory ovlivňující tento údaj, jako jsou interval mezi stanovením diagnózy RS a zahájením léčby nebo problém v zadávání dat do registru a jejich analýze.
Registr ReMuS při hodnocení dlouhodobé účinnosti GA (kohorta 868 pacientů léčených po celé hodnocené období) v porovnání s kontrolovanými klinickým studiemi v této kohortě pacientů vykazuje více než u 50 % pacientů v celém 5leté období stav bez progrese invalidity a bez relapsů.
S cílem získat aktuální data o účinnosti léčby GA byla provedena analýza všech pacientů léčených GA k datu 30. 6. 2018 s hodnocením zpětně za 6 a 12 měsíců a 2 roky od tohoto data. Celkem 61,3 % pacientů v době poslední návštěvy pracovalo na plný úvazek a korespondujících 61,1 % nepobíralo žádné sociální dávky. Celkem 72,6 % pacientů, kteří byli na poslední návštěvě v období do 30. 6. 2018 léčeni GA, užívalo GA jako první léčebnou volbu. V posledních 12 měsících nově zahájilo léčbu GA 8,6 % pacientů jako léčbu první volby a 3,8 % jako switch z jiné DMD léčby.
Absence závažných nežádoucích reakcí a nízký výskyt známých lokálních reakcí v místě vpichu (erytém, zduření, pruritus, otoky) byly v korelaci s literární četností, rovněž tak bezprostřední komplikace po injekci GA (dušnost, vazodilatace, bolest na hrudi a palpitace). Celkově je hodnocen výskyt postinjekčních komplikací jako nízký. Nebyly zaznamenány žádné případy kardiovaskulární či jiné systémové komplikace ani žádné případy oportunních infekcí vč. progresivní multifokální encefalopatie [9].
Aktuální data hodnocené kohorty potvrdila oprávněnost změny léčby z GA20 na GA40. Aktuálně 90,6 % pacientů léčených GA40 lze v klinických parametrech srovnávat s výsledky analýzy studie GALA (Glatiramer Acetace Low-Frequency Administration). V této dvojitě slepé, placebem kontrolované studii III. fáze byla hodnocena účinnost a bezpečnost G40 u pacientů s RRRS v průběhu 1 roku. Při hodnocení primárního cíle studie prokázala redukci ARR o 34,4 % ve skupině pacientů léčených G40 proti placebu (p < 0,0001) a signifikantní redukci 44,8 % (p < 0,0001) kumulativního počtu gadolinium enhancujících T1 lézi na MR a redukci 34,7 % (p < 0,0001) nových nebo zvětšených T2 lézí. Ze studie vyplynulo, že GA40 vykazuje časný klinický účinek již po dvou měsících od zahájení léčby. Studie GALA prokázala redukovaný výskyt nežádoucích reakcí vyplývajících z injekční aplikace GA a rovněž tak lokálních reakcí v místě vpichu a současně zdůvodňuje switch pacientů z G20 na G40 [10].
Závěr
Byl analyzován soubor 3 527 pacientů, kteří byli v období od 1. 1. 2013 do 30. 6. 2018 léčeni GA. Z analýzy vyplynuly dlouhodobé výsledky účinnosti a bezpečnosti GA v reálné klinické praxi. Vykazují více než 50 % pacientů, kteří po celé více než 5leté období byli bez progrese invalidity a bez relapsů a podtrhují oprávněnost pokračování léčby GA. Na druhé straně však vysoké procento pacientů, kteří ukončili léčbu GA (32,9 %), deklaruje nezbytnost včasné eskalace léčby. V porovnání s klinickými studiemi byl prokázán větší benefit z dlouhodobé léčby GA u pacientů z registru ReMuS. GA40 je nejen pro rychlejší nástup účinnosti, ale i pro nízký výskyt nežádoucích reakcí injekční léčby preferován před G20.
Etické principy
Studie byla provedena ve shodě s Helsinskou deklaraci z roku 1975 (a jejími revizemi z let 2004 a 2008). Studie nepodléhá schválení etickou komisi.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 21. 7. 2019
Přijato do tisku: 25. 6. 2020
doc. MUDr. Radomír Taláb, CSc.
Neurologická klinika LF UK a FN Plzeň
Alej Svobody 923/80
323 00 Plzeň
e-mail: talabr@fnplzen.cz
Zdroje
1. Lebrun-Frenay C, Moulingnier A, Pierrot-Deseilligny C et al. Five-year outcome in the copaxone observatory: a nationwide cohort of patients with multiple sclerosis starting treatment with glatiramer acetate in France. J Neurol 2019; 266 (4): 888–901. doi: 10.1007/s00415-019-09211-5.
2. Štourač P, Praksová P, Kontrová I et al. Glatiramer acetát (Copaxone) v léčbě atakovité forma roztroušené sklerózy mozkomíšní – klinická účinnost a bezpečnostní profil. Cesk Slov Neurol N 2011; 74/107 (4): 447–454.
3. Weber MS, Hohlfeld R, Zamvil SS. Mechanism of action of glatiramer acetate in treatment of multiple sclerosis. Neurotherapeutics 2007; 4 (4): 647–653. doi: 10.1016/j.nurt.2007.08.002.
4. Krejsek J. Glatiramer acetát – protizánětlivé a neuroprotektivní mechanismy účinku. REMEDIA 2014; 6 : 464–467.
5. Arnon R, Aharoni R. Neurogenesis and neuroprotection in the CNS – funfamental elements in the effect of glatiramer acetate on treatment of autoimmune neurological disorders. Mol Neurobiol 2007; 36 (3): 245–253. doi: 10.1007/s12035-007-8002-z.
6. Johnson KP, Brooks BR, Ford CC et al. Sustained clilnical benefits of glatiramer acetate in relapsing multiple sclerosis patients observed for 6 years. Multiple Sclerosis 2000; 6 (4): 255–266. doi: 10.1177/135245850000600407.
7. Comi G, Martinelli V, Rodegher M et al. Effect of early treatment with glatiramer acetate in patients with clinically isolated syndrome. Mult Scler 2013; 19 (8): 1074–1083. doi: 10.1177/1352458512469695.
8. Taláb R. Glatiramer acetát v České republice – výstupy z registru ReMuS. REMEDIA 2017; 27 : 46–52.
9. Ziemssen T, Ashtamker N, Rubinchick S et al. Long--term safety and tolerability of glatiramer acetate 20mg/ml in the tratment of relapsing forms of multiple sclerosis. Expert Opin Drug Saf 2017; 16 (2): 247–255. doi: 10.1080/14740338.2017.1274728.
10. Davis MD, Ashtamker N, Steinerman JR et al. Time course of glatiramer acetate efficacy in patients with relapsing-remitting multiple sclerosis (RRMS) in the Glatiramer Acetate Low-frequency Administration (GALA) study. Neurol Neuroimmunol Neuroinflamm 2017; 4 (2): e327. doi: 10.1212/NXI.0000000000000327.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek EditorialČlánek Recenze knih
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Editorial
- Cytotoxické léze corpus callosum (CLOCCs)
- Poranění radiálního nervu při zlomeninách diafýzy pažní kosti
- Je jasné, kdy operovat výhřez bederní meziobratlové ploténky?
- Současná diagnostika sekundárně progresivní formy roztroušené sklerózy a léčba siponimodem
- Roztroušená skleróza – odhalené tajemství imunity
- Hygiena dýchacích cest u pacientů s Parkinsonovou nemocí – přehled problematiky a možnosti fyzioterapeutické intervence
- Klinické a sociální prediktory kvality života u dětí a mladších dospělých s poruchou autistického spektra
- Bezpečnost karotické endarterektomie s ohledem na její načasování po ischemické cévní mozkové příhodě
- Glatiramer acetát – léčba roztroušené sklerózy monitorovaná v registru ReMuS
- Intenzivní rehabilitace kognitivních funkcí u osob s roztroušenou sklerózou – výsledky 12týdenní randomizované studie hodnocené počítačovým programem
- Účinnost a bezpečnost urgentní mikrochirurgické embolektomie při selhání intravenózní trombolýzy a mechanické trombektomie u pacientů s akutním ischemickým iktem – protokol systematického review
- Vliv pandemie COVID-19 na spánkovou medicínu v České republice a na Slovensku
- Prevalence a charakteristika epilepsie u pacientů s relabující-remitující formou roztroušené sklerózy léčených imunomodulační terapií
- Syndrom moyamoya doprovázený polycystickou chorobou ledvin – kazuistika vzácného onemocnění a přehled literatury
- Souběh dvou oportunních infekcí jako první projev HIV
- Dropped head syndrom u pacientky s progredující bulbární paralýzou
- Karotický paragangliom, velmi vzácný nádor v dětském věku
- Využití kvantitativní MR venografie v indikaci stentingu stenózy žilního splavu
- Transvenózna embolizácia prasknutej piálnej arteriovenóznej malformácie
- CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
- Recenze knih
- 2020 AAN Highlights Dlouhodobá data o účinnosti deplece CD20+ B-buněk v léčbě RS
- 2020 AAN Highlights Jak mění malá molekula průběh spinální svalové atrofie?
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Je jasné, kdy operovat výhřez bederní meziobratlové ploténky?
- CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku
- Cytotoxické léze corpus callosum (CLOCCs)
- Dropped head syndrom u pacientky s progredující bulbární paralýzou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



