-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Simultánní výskyt leptomeningeálních a intramedulárních metastáz glioblastoma multiforme – kazuistika
Glioblastoma Multiforme with Simultaneous Leptomeningeal and Intramedulary Metastases – a Case Study
Glioblastoma multiforme is known for its infiltrative growth into surrounding tissues as well as for dissemination of tumor cells into distant nerve structures via cerebrospinal fluid. Unlike primary brain tumors, clinical presentation of metastasis is sporadic or rare. We present a young man, who developed a clinical manifestation of a rare variant of simultaneous metastasis.
Key words:
glioblastoma multiforme – leptomeningeal metastasis – intramedullary metastasis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: J. Kasík 1; L. Loudová 1; M. Tinková 1; F. Charvát 2; P. Hrabal 3
Působiště autorů: ÚVN – Vojenská FN Praha Neurologické oddělení 1; ÚVN – Vojenská FN Praha Radiologické oddělení 2; ÚVN – Vojenská FN Praha Patologicko-anatomické oddělení 3
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(3): 368-372
Kategorie: Kazuistika
Souhrn
Pro glioblastoma multiforme je typický nejen infiltrativní růst do blízkého okolí, ale i masivní rozsev nádorových buněk mozkomíšním mokem do vzdálenějších nervových struktur s tvorbou metastatických ložisek. Na rozdíl od primárního nádoru je jejich klinická manifestace sporadická, u některých forem vzácná. Představujeme případ mladého muže s multiformním glioblastomem, u kterého došlo ke klinickým projevům vzácné varianty simultánních metastáz.
Klíčová slova:
glioblastoma multiforme – lepto-meningeální metastázy – intramedulární metastázyÚvod
Glioblastoma multiforme (GBM) je nejzhoubnější primární nádor mozku u dospělých. Podle WHO klasifikace je zařazen mezi gliomy grade IV. Nádor je charakterizován rychlým a infiltrativním růstem v mozkové tkáni, takže při prvních klinických projevech zpravidla dosahuje již značných rozměrů. Jeho prognóza je velmi špatná. Může se objevit v každém věku, ale převážně postihuje dospělé mezi 45. až 75. rokem života. Incidence onemocnění se celosvětově pohybuje mezi třemi až čtyřmi případy na 100 000 obyvatel za rok. V ČR je ročně diagnostikováno 500 – 550 gliomů s vysokým stupněm malignity [1].
Je známo, že GBM metastazuje nejen do okolních mozkových struktur, ale i do vzdálenějších oddílů nervového systému. Výskyt symptomatických metastáz je v porovnání s histopatologickými nálezy při nekropsiích sporadický, u některý typů vzácný [2]. Jsou popsány i extraneurální metastázy do plic, pleury, lymfatických uzlin, kostí a jater [3].
V kazuistice uvádíme případ mladého muže po léčbě GBM s následnou klinickou manifestací simultánního výskytu leptomeningeálních a intramedulárních metastáz.
Kazuistika
Dvaatřicetiletý muž s bezvýznamnou anamnézou do července roku 2010, kdy se objevily první příznaky nitrolební hypertenze s parézou nervus abducens vpravo. Zobrazení mozku magnetickou rezonancí (MR) s gadoliniem ukázalo expanzivně se chovající ložisko charakteru gliomu vyššího stupně malignity frontálně vpravo o velikosti 62 × 49 × 50 mm (obr. 1). V srpnu 2010 byla provedena subtotální resekce nádoru. Chirurgický výkon komplikován epidurálním hematomem parietálně vpravo, který byl následně evakuován. Po operaci pacient zcela bez potíží, neurologický nález upraven. Histologické vyšetření potvrdilo diagnózu glioblastoma multiforme. S výstupním skóre Karnofsky 100 byla doporučena onkologická léčba a v následujících měsících pacient absolvoval aktinoterapii do celkové dávky 60 Gy. Navazující chemoterapie temozolomidem byla předčasně ukončena pro projevy hematotoxicity IV. stupně a nahrazena chemoterapií II. linie s lomustinem v redukované dávce, kterou pacient dobře toleroval. Léčba byla ukončena v červenci 2011.
Obr. 1. MR mozku v T1W obraze, axiální rovina, po podání k. l. 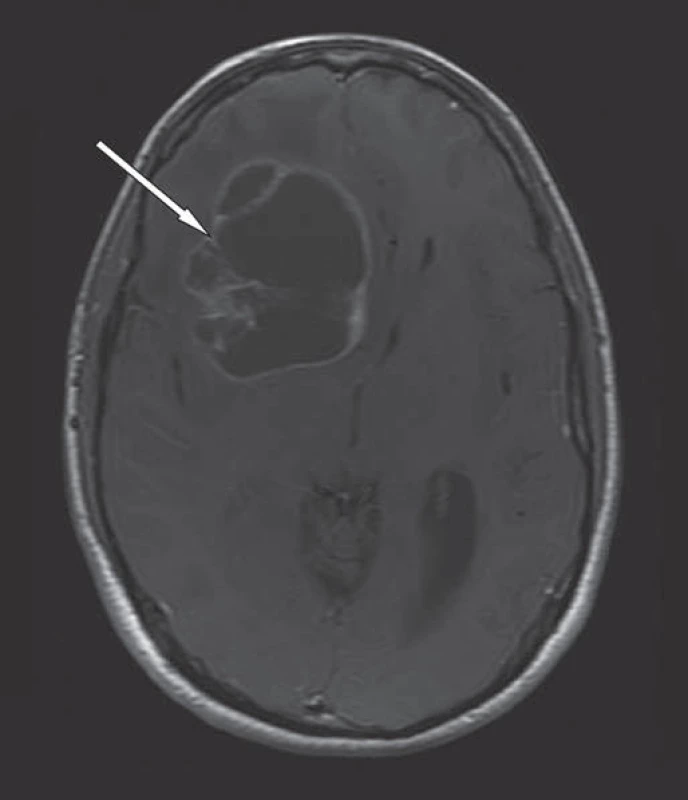
Cystický glioblastoma multiforme frontálně vpravo s dosycujícím se lemem, centrální nekrózou a perifokálním edémem (bílá šipka). Přetlak střední čáry. Začátkem října se pacient dostavil k plánovanému kontrolnímu vyšetření mozku magnetickou rezonancí. Vyšetření ukázalo pooperační změny frontálně vpravo a postkontrastní sycení nových ložisek tumorózní tkáně při předních a zadních rozích obou postranních komor a v corpus callosum (obr. 2). Při následném ambulantním vyšetření pacient udával zhoršující se slabost dolních končetin s pády v trvání dvou až tří týdnů. Pro příznaky lehké chabé paraparézy bylo provedeno urgentní vyšetření všech úseků páteře magnetickou rezonancí, které potvrdilo podezření na metastatický proces. V T2W obrazech nalezena nesčetná intramedulární metastatická ložiska různé velikosti a nekonstantní rozšíření kořenů kaudy leptomeningeálním nádorovým procesem (obr. 3, 4).
Obr. 2. Kontrolní MR mozku v T1W obraze, axiální rovina, po podání k. l. 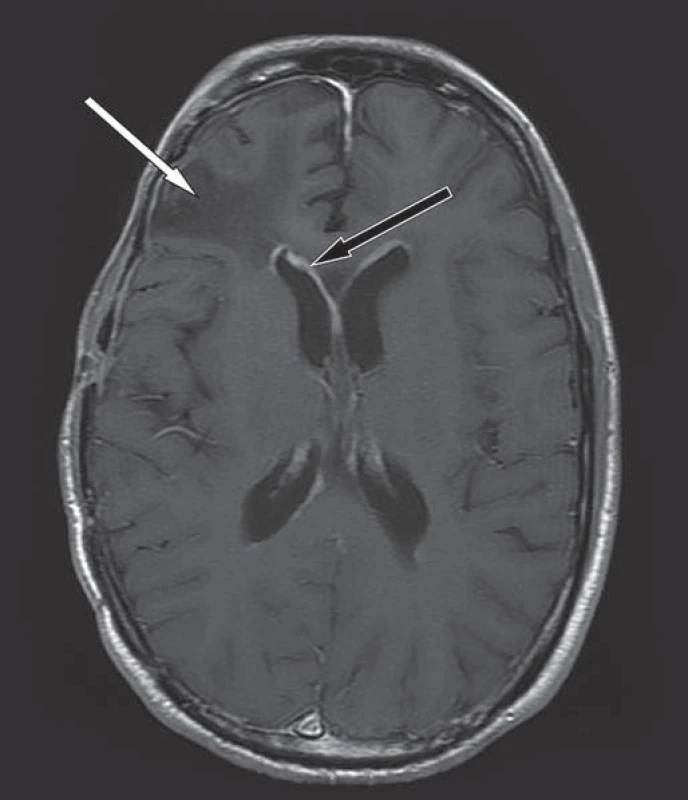
Dosycování ependymu v obou postranních komorách svědčí pro šíření nádoru mozkomíšním mokem (černá šipka), pooperační změny frontálně vpravo bez známek recidivy nádoru (bílá šipka). Obr. 3. MR hrudní páteře v T2W obraze, sagitální rovina. 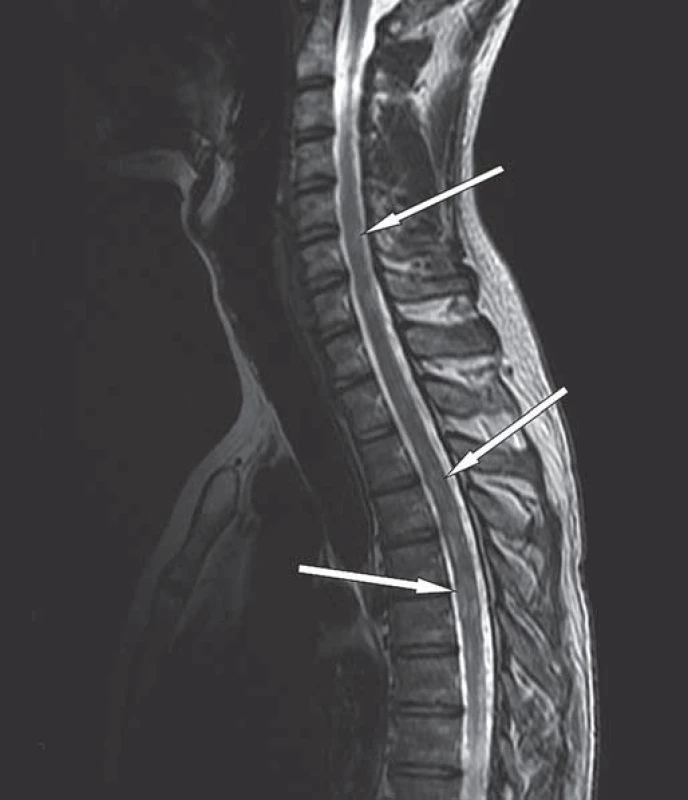
Rozšíření hrudní míchy s mnohočetnými intramedulárními ložisky, ojedinělá ložiska i v oblasti dolní krční míchy (bílé šipky). Obr. 4. MR bederní páteře v T2W obraze, sagitální rovina. 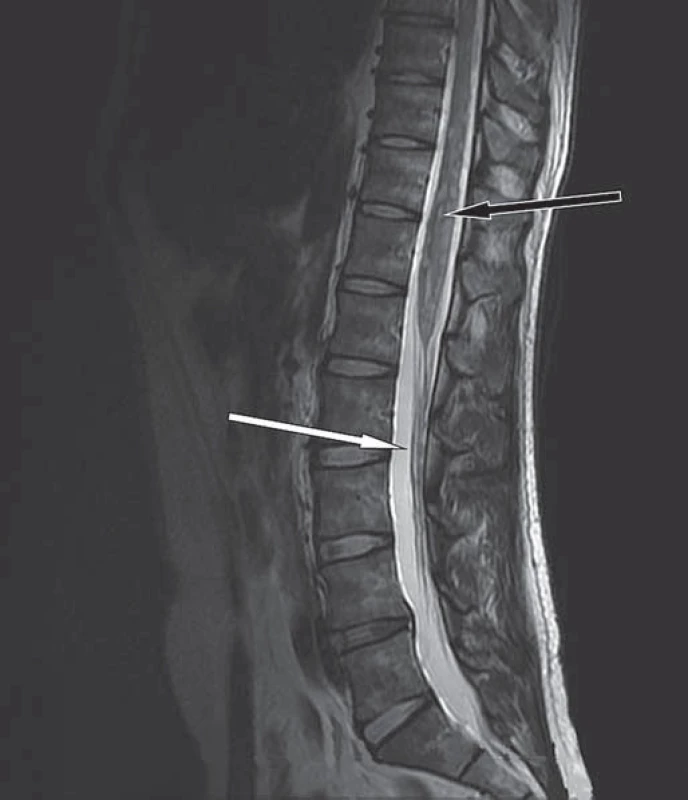
Mírné rozšíření míchy s mnohočetnými hyperintenzními intramedulárními ložisky (černá šipka). Na kořenech kaudy jsou patrná drobná ložiska svědčící pro leptomeningeální rozsev (bílá šipka). Dne 13. 10. 2011 pacient hospitalizován na neurologickém oddělení. Při přijetí bez bolestí, neschopen samostatné chůze, udával poruchy sfinkterů. Neurologické vyšetření prokázalo normální nález na hlavových nervech, zachovalou hybnost s hyperreflexií C5/ 8 na horních končetinách, chabou paraplegii dolních končetin s poruchu čití od Th 7 – 8 distálně. Byla započata antiedematózní léčba dexametazonem.
V laboratorních testech nalezena trombocytopenie (47 × 109/ l). Vyšetření mozkomíšního moku potvrdilo tumorózní oligocytózu splňující kritéria malignity (počet elementů 2/ ul) a zvýšenou celkovou bílkovinu (6,2 g/ l). V humorálních zánětlivých parametrech byla zjištěna výrazná elevace jak proteinů akutní fáze, tak i cytokinů, zejména chemokinu Il ‑ 8 (4 224 pg/ l, norma do 62 pg/ l), jako důsledek aktivace imunitního systému. Výrazná elevace specifických markerů tkáňové destrukce svědčící o enormní tkáňové lézi – neuron specifická enoláza (370 ug/ l, norma do 24 ug/ l), S100 protein (3,88 ug/ l, norma až do 1 ug/ l) podpořila likvorologický obraz typický pro maligní infiltraci. Sérologie likvoru byla bez patologického nálezu.
Od 17. 10. pacient udává bolesti při polykání, při vyšetření patrný na jazyku rozsáhlý soor. Ukončena neúčinná antiedematózní léčba dexametazonem, podán clotrimazol. Pacient nadále optimistický a spolupracující. V krevním obraze další pokles trombocytů (30 × 109/ l). Během několika dnů je stav pacienta komplikován herpetickým výsevem v oblasti třetí větve nervus trigeminus vpravo. Započato s infuzní léčbou acyklovirem po dobu 14 dnů. Od 22. 10. si pacient začíná stěžovat na bolesti v oblasti šíje a zad. Podána běžná analgetika, později účinnější opiátové náplasti s fentanylem. Zahájená podpůrná psychologická péče. Od 5. 11. patrné oslabení svalové síly na horních končetinách více vlevo a taktilní hypestezie od Th4 distálně. Následující den u pacienta projevy anxiety a strachu ze smrti, zahájeno podávání morfinu v lineárním dávkovači. Pacient bez bolestí, přechodně euforický. V posledním týdnu života opakovaně febrilní stavy, dochází k další progresi poruchy hybnosti na horních končetinách. Kvadruplegický pacient s prohlubující se poruchou vědomí a nepravidelnou dechovou aktivitou umírá v posledním týdnu listopadu 2011, 16 měsíců od prvních příznaků primárního nádoru.
Pitva formolem fixovaného mozku byla provedena standardně v 1 cm širokých sériových frontálních řezech. Na spodině pravého frontálního laloku patrná dutina po předchozí resekci. Vnitřní povrch dutiny zrnitý, šedobělavý, místy okrově žlutě pigmentovaný. Povrch postranních komor, třetí i čtvrté komory nerovný, hrbolatý, místy tvořený splývající šedorůžově zbarvenou měkkou nádorovou hmotou, která invazivně vrůstá na krátkou vzdálenost i do přiléhající mozkové tkáně (obr. 5). Drobná ložiska této tkáně jsou přítomna i na řezech z corpus callosum.
Obr. 5. Histologický řez mozkem. 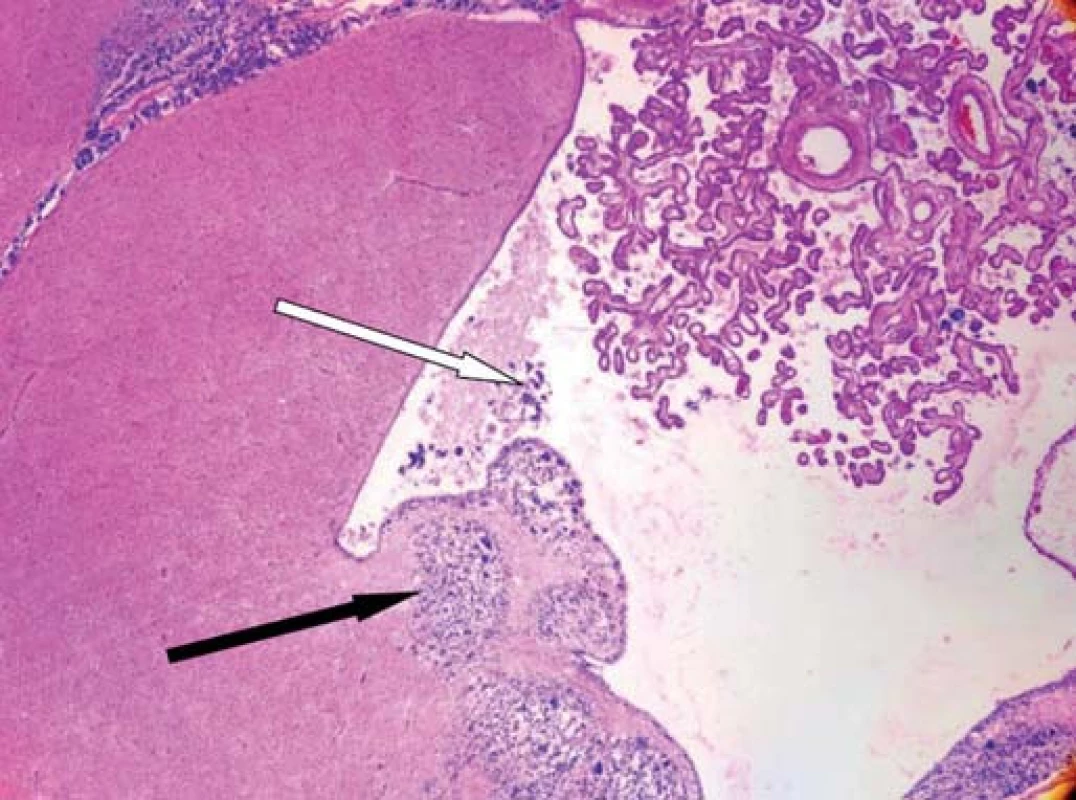
Nádorová infiltrace stěny postranní komory (černá šipka), nádorové buňky ve zbytku mozkomíšního moku potvrzující šíření nádoru (bílá šipka). Při histologickém vyšetření zastiženy struktury silně buněčného infiltrativně rostoucího gliového nádoru, jehož nádorové buňky jeví výrazné polymorfie až monstrozity s vysokou mitotickou aktivitou včetně výskytu atypických mitóz. Charakter nádoru odpovídá glioblastomu grade IV. Nádorové hmoty ložiskově infiltrují okraje resekční dutiny, povrch mozkových komor, tělo corpus callosum a subarachnoidální prostor.
Za stejných podmínek (fixace formolem) byla provedena pitva míchy v sériových řezech o šíři 3 až 5 mm v celém jejím rozsahu. Po celém obvodu míchy a v její celé délce zastižen infiltrát různé šíře tvořený měkkou šedorůžovou homogenní hmotou utlačující v různém rozsahu vlastní míchu.
Histologicky mícha vyšetřena z četných transverzálních řezů z krčního, hrudního, bederního úseku a z oblasti fillum terminale. Zastižená nádorová infiltrace, stejné histologické struktury jako v mozku, obrůstá míchu a nervové kořeny ze strany míšních obalů subarachnoidálně. V míše nalezena infiltrativně rostoucí nádorová ložiska, vlastní míšní tkáň je zachována pouze v podobě ostrůvků s četnými malatickými změnami (obr. 6).
Obr. 6. Histologický řez míchou. 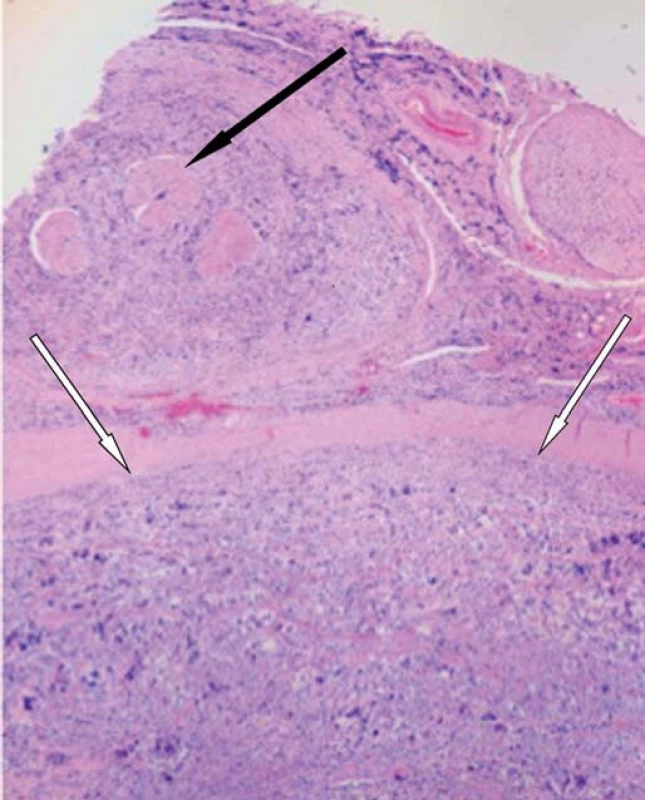
Intramedulární ložisko (bílé šipky), šíření nádoru kolem míšních kořenů (černá šipka). Diskuze
První informace o přítomnosti metastáz maligních gliomů mozku ve spinálních strukturách pocházejí již z roku 1926, kdy Bailey a Cushing popsali leptomeningeální metastázy [4]. Další významné práce té doby jsou jednak od Caimse a Russela z roku 1931 [5], stejně tak o několik let později od Edena [6]. Autoři zdokumentovali výskyt nádorových buněk v míšních strukturách post mortem u více než třetiny pacientů s glioblastomem.
Výsledky řady nedávných histopatologických studií ukazují, že k rozsevu nádorových buněk mozkomíšním mokem dochází u 15 – 25 % supratentoriálních GBM, u infratentoriálních lokalizací ve více než 60 % případů [7]. Přesná incidence není známa, poněvadž nekropsie míchy nepatří do standardního pitevního postupu. Ve srovnání s těmito nálezy je četnost případů s klinickou manifestací metastáz sporadická, podle některých autorů dosahuje 2 – 5 %. Nejčastěji se prezentují metastázy v leptomeningeálních prostorech, naopak manifestace izolovaných intramedulárních nebo simultánních metastáz je vzácná [2,8]. Na základě dostupných informací bylo v literatuře do-sud popsáno pouze šest případů klinicky manifestních simultánních metastáz [9,10].
Předpokládá se, že zvýšená frekvence výskytu symptomatických metastáz GBM je výsledkem zlepšené diagnostiky i současných léčebných postupů.
V diagnostice gliomů a jejich metastáz má dominantní postavení vyšetření magnetickou rezonancí. MR zobrazení (s gadoliniem) poskytuje informace nejen o intrakraniálním nádoru a jeho šíření do okolních struktur, ale také o postižení vzdálených nervových struktur páteřního kanálu.
Naopak vyšetření mozkomíšního moku nepatří mezi rutinní testy a navíc při lumbálních odběrech je popisován vysoký záchyt falešně negativních výsledků. Pro onemocnění typický likvorologický nález zahrnuje výskyt atypických nádorových buněk, proteinocytologickou asociaci, známky tkáňové destrukce a aktivaci imunitního systému [11].
Podmínkou pro rozsev nádorových buněk do vzdálených struktur je jejich přítomnost v mozkomíšním moku. Předpokládá se existence několika mechanizmů šíření buněk do likvoru v závislosti na lokalizaci primárního nádoru. Jednou z variant je přímá invaze nádorových buněk do likvorových cest přes ependym a chorioidální plexus u nádorů rostoucích subependymálně v okolí komorového systému [12].
U kortiko ‑ subkortikálních lokalizací primárních nádorů dochází k subpiálnímu šíření nádorových buněk a prostřednictvím perivaskulárních prostor k dalšímu subarachnoidálnímu rozsevu. Významnou roli zde hrají drobné cévy traverzující leptomeningeální prostory [13]. U lokalizací vzdálených od likvorových cest se předpokládá šíření buněk podél traktů v bílé hmotě mozkové [14]. Zatím nebyla potvrzena hypotéza, že zvýšený počet nádorových buněk v likvoru zvyšuje riziko založení metastáz [15].
Mechanizmy šíření nádorových buněk podporuje řada faktorů, mezi které lze zařadit chirurgickou manipulaci s nádorem, ventrikulostomii, opakovanou resekci, vývoj sekundárního hydrocefalu s poškozením komorového ependymu a onkologickou léčbou navozenou imunosupresi. Naopak rozsev může být omezen krátkou dobou přežití pacientů nebo lokalizací nádoru v hlubokých strukturách mimo dosah likvorových cest (meziotemporální oblast) [16].
Predilekční lokalizací leptomeningeálních metastáz je dolní hrudní, horní bederní a lumbosakrální oblast [17]. Lokalizace vzácných intramedulárních metastáz není v literatuře blíže specifikována, v publikovaných případech simultánního výskytu jsou intramedulární léze lokalizované v úrovni Th11 a L1 [9,10]. U námi prezentovaného pacienta byla nalezena mnohočetná intramedulární ložiska v celém rozsahu hrudní a bederní míchy, ojedinělá i v krčním úseku.
První klinické příznaky metastatického rozsevu se zpravidla objevují mezi 8. a 14. měsícem od stanovení diagnózy primárního nádoru [18]. Pro leptomeningeální rozsev jsou typické kořenové bolesti z postižení míšních kořenů a pochev. U intramedulárních lokalizací metastáz, bez ohledu na současný výskyt metastáz v míšních obalech, dominují poruchy hybnosti končetin a poruchy sfinkterů. U našeho pacienta jsme v počátečním období vývoje paraparézy, tj. v průběhu 14. měsíce od stanovení diagnózy GBM, zaregistrovali i poruchu taktilní citlivosti od Th7 – 8 distálně. První bolestivé projevy (oblast šíje a ramenních pletenců) se objevily až při postižení hybnosti horních končetin koncem 16. měsíce od diagnostiky primárního nádoru a třetího měsíce trvání míšních příznaků. Několik dní poté pacient umírá.
V současné době je léčba GBM ve většině případů kombinovaná. Po subtotální resekci primárního nádoru, pokud je uložen v přístupné oblasti, následuje adjuvantní konkomitantní kúra aktinoterapie do celkové dávky 60 Gy a chemoterapie temozolomidem. Toto léčebné schéma bylo započato i u našeho pacienta. Jen v období chemoterapie se objevily hematotoxické komplikace, pro které byl temozolomid nahrazen lomustinem.
Standardní léčebný postup ve většině případů oddaluje pouze nepříznivou prognózu onemocnění o několik měsíců. Medián celkového přežití se pohybuje kolem 12 měsíců a jen přibližně 5 % pacientů přežívá více než tři roky [1]. Při klinické manifestaci vzdálených metastáz jsou již léčebné možnosti vyčerpány a postižení umírají v rozmezí dvou až tří měsíců po objevení prvních symptomů [15,18].
Závěr
Agresivita GBM a omezené léčebné možnosti vytvářejí předpoklady pro rozsev nádorových buněk a tvorbu metastáz, což potvrzují četné histopatologické studie. Naopak rychlý průběh onemocnění s krátkou dobou přežití limituje možnost jejich klinické manifestace. Proto je v klinické praxi záchyt symptomatických metastáz sporadický nebo vzácný.
Případ mladého muže prezentovaný v kazuistice je naší první zkušeností s klinickým obrazem metastáz GBM. Byli jsme překvapeni nejen vzácnou variantou, ale i rozsahem postižení nervových struktur páteřního kanálu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prim. plk. MUDr. Jiří Kasík, Ph.D.
Neurologické oddělení
ÚVN – Vojenská FN
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: jiri.kasik@uvn.cz
Přijato k recenzi: 26. 3. 2013
Přijato do tisku: 4. 11. 2013
Zdroje
1. Lakomý R, Burkoň P, Burkoňová D, Jančálek R. Nové možnosti léčby glioblastoma multiforme. Klin Onkol 2010; 23 (6): 381 – 387.
2. Stark AM, Nabavi A, Mehdorn HM, Blömer U. Glioblastoma multiforme ‑ report of 267 cases treated at a single institution. Surg Neurol 2005; 63(2): 162 – 169.
3. Didelot A, Taillandier L, Grignon Y, Vespignani H, Beauchesne P. Concomitant bone marrow metastasis of a glioblastoma multiforme revealed at the diagnosis. Acta Neurochir (Wien) 2006; 148(9): 997 – 1000.
4. Bailey P, Cusching H. Tumor of the glioma group. Philadelphia: JB Lippincott 1926.
5. Caims H, Russell DS (eds). Intracranial and spinal metastases in gliomas of the brain. Brain 1931; 54 : 377 – 420.
6. Eden KC. Dissemination of a glioma of the spinal cord in the leptomeninges. Brain 1938; 61 : 289 – 310.
7. Arita N, Taneda M, Hayakawa T. Leptomeningeal dissemination of malignant gliomas. Incidence, diagnosis and outcome. Acta Neurochir (Wien) 1994; 126(2 – 4): 84 – 92.
8. Hübner F, Braun V, Richter HP. Case reports of symptomatic metastasis in four pacients with primary intracranial gliomas. Acta Neurochir (Wien) 2001; 143 : 25 – 29.
9. Karaca M, Andrieu MN, Hicsonmez A, Guney Y, Kurtman C. Cases of glioblastoma multiforme metastasizing to spinal cord. Neurol India 2006; 54(4): 428 – 430.
10. Scoccianti S, Detti B, Meattini I, Iannalfi A, Sardaro A, Leonulli BG et al. Symptomatic leptomeningeal and intramedullary metastases from intracranial glioblastoma multiforme: a case report. Tumori 2008; 94(6): 877 – 881.
11. Balhuizen JC, Bots GT, Schaberg A, Bosman FT. Value of cerebrospinal fluid cytology for the diagnosis of malignancies in the central nervous system. J Neurosurg 1978; 48(5): 747 – 753.
12. Giese A, Westphal M. Glioma invasion in the central nervous system. Neurosurg 1996; 39(2): 235 – 252.
13. Krisch B, Leonhard H, Okshe A. Compartments and perivascular arrangement of the meninges covering the cerebral cortex of the rat. Cell Tissue Res 1984; 238(3): 459 – 474.
14. Kumar R, Jain R, Tandon V. Thalamic glioblastoma with cerebrospinal fluid dissemination in the peritoneal cavity. Pediatr Neurosurg 1999; 31(5): 242 – 245.
15. Grabb PA, Albright AL, Pang D. Dissemination of supratentorial malignant gliomas via the cerebrospinal fluid in children. Neurosurg 1992; 30(1): 64 – 71.
16. Fakhrai N, Czech T, Diekmann K, Dörner BF, Birner P, Hainfellner JA et al. Glioblastoma with spinal seeding. Strahlenther Onkol 2004; 180(7): 455 – 457.
17. Choi PP, Shapera S. What’s your call? Drop metastases. CMAJ 2006; 175(5): 475 – 477.
18. Vertosick FT jr, Selker RG. Brain stem and spinal metastases of supratentorial glioblastoma multiforme: a clinical series. Neurosurgery 1990; 27(4): 516 – 521.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2014 Číslo 3- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
-
Komentář ke článku autorů Kotase a Polívky
Přehled méně častých primárních bolestí hlavy - Spasticita po iktu jako projev maladaptivní plasticity a její ovlivnění botulotoxinem
- Méně obvyklé indikace hluboké mozkové stimulace
- Projekt ncRNAPain
- Fluorescencí navigovaná resekce vysokostupňových gliomů mozku
- Neurologické hypotézy u panické poruchy
- Účinky intoxikace metanolem na kognitivní funkce
- Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení
-
Komentář ke článku autorů Mrliana, Ďuriše, Neumana, Vybíhala a Smrčky
Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení - Pupilární reakce na barevné podněty
- Klíšťová encefalitida, průběh a komplikace – naše poznatky z let 2009– 2012
- Naše zkušenosti s mobilní náhradou krčního disku Mobi‑ C – výsledky studie s intervalem sledování pět let
- Neuromodulace sakrálních nervů při řešení inkontinence stolice
- Kombinovaný paramediánní supracerebellární‑ transtentoriální a miniinvazivní subokcipitální přístup při resekci gliomu celé délky mediobazální temporální oblasti
- Selektivní denervace karpu při řešení artrotického postižení zápěstí
- Flekční cervikální myelopatie (Hirayamova choroba) – skutečnost, nebo mýtus? Dvě kazuistiky
- Simultánní výskyt leptomeningeálních a intramedulárních metastáz glioblastoma multiforme – kazuistika
- Blister aneuryzma arteria carotis interna – kazuistika a přehled literatury
- Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014
- Prof. Josef Vymazal starší – in memoriam
- Webové okénko
- Recenze knih
-
Analýza dat v neurologii
XLV. Grafy usnadňující studium zavádějících faktorů v asociačních studiích – III. Spojitá data
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
- Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014
- Neurologické hypotézy u panické poruchy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



