-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Účinky intoxikace metanolem na kognitivní funkce
Sequelae of Methanol Poisoning for Cognition
Objective:
To identify possible cognitive deficit due to methanol intoxication.Introduction:
Methanol poisoning leads to lesions in typical areas of the central nervous system, especially in basal ganglia (BG), to subcortical white matter lesions and to demyelination or even atrophy of the optic nerve. However, information regarding cognitive deficit on a population-based level in larger samples is lacking. Our goal was to identify whether BG dysfunction may lead to cognitive deficits.Methods:
A sample of 50 patients 3 to 8 months after methanol intoxication (METH) and 39 controls (KS) were administered a neuropsychological battery and underwent magnetic resonance imaging (MRI). A combination of three laboratory-based metabolic markers of alcohol abuse led to selection of 28 post-methanol intoxication subjects who were unlikely to abuse alcohol (METHna). These were matched to 28 controls (KSp) for age, education, premorbid intelligence level, global cognitive performance and level of depressive symptoms.Results:
There were significant differences in the FAB total score (METHna, Md = 16, KSp, Md = 17, p = 0.001) and in three of the FAB subscores (Conceptualization, Mental flexibility, Motor programming; all p values < 0.050). Overall, there was a positive trend towards significance and a weak association between BG lesions on MRI and Mental flexibility from the FAB (rho = –282, p = 0.054).Conclusion:
Our findings suggest that methanol poisoning is probably associated with cognitive deficits of the frontal type due to BG dysfunction.Key words:
methanol intoxication – cognitive deficit – neuropsychological assessment
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: O. Bezdíček 1; J. Klempíř 1; I. Lišková 1; J. Michalec 2; M. Vaněčková 3; Z. Seidl 3; B. Janíková 4; M. Miovský 4; J. A. Hubáček 5; P. Diblík 6; P. Kuthan 6; A. Pilin 7; I. Kurcová 7; Z. Fenclová 8; V. Petrik 8; T. Navrátil 9,10; D. Pelclová 8; E. Růžička 1; S. Zakharov 8
Působiště autorů: Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze 1; Psychiatrická klinika 1. LF UK a VFN v Praze 2; Oddělení MR, Radiodiagnostická klinika 1. LF UK a VFN v Praze 3; Klinika adiktologie 1. LF UK a VFN v Praze 4; Centrum experimentální medicíny, IKEM, Praha 5; Oční klinika 1. LF UK a VFN v Praze 6; Ústav soudního lékařství a toxikologie 1. LF UK a VFN v Praze 7; Klinika pracovního lékařství 1. LF UK a VFN v Praze 8; Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN v Praze 9; Ústav fyzikální chemie J. Heyrovského AV ČR, v. v. i., Praha 10
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(3): 320-325
Kategorie: Původní práce
Souhrn
Cíl:
Identifikace kognitivního deficitu u osob intoxikovaných metanolem.Úvod:
Intoxikace metanolem může vést k různému poškození oblastí centrální nervové soustavy, zejména systému bazálních ganglií (BG), k subkortikálním lézím v bílé hmotě a k demyelinizaci až atrofii nervus opticus. Údaje o míře kognitivního deficitu a postižení konkrétních psychických funkcí na skupinové úrovni zatím nejsou známé. Cílem této práce bylo prokázat, zda poškození BG v důsledku intoxikace metanolem může mít vliv na kognitivní funkce.Metodika:
Soubor 50 pacientů 3 – 8 měsíců po intoxikaci metanolem (METH) a 39 kontrolních osob (KS) byl vyšetřen neuropsychologickou baterií a magnetickou rezonancí (MR). Z tohoto souboru jsme pomocí kombinace tří laboratorních markerů abúzu alkoholu selektovali skupinu 28 intoxikovaných metanolem bez rizikového užívání alkoholu (METHna) a k nim přiřadili kontrolní skupinu 28 osob (KSp). Obě skupiny byly porovnatelné dle demografických proměnných, premorbidní inteligenční úrovně, celkového kognitivního deficitu a úrovně depresivních projevů.Výsledky:
Skupiny METHna a KSp se lišily ve Škále frontálního chování (FAB; celkový skór METHna, Md = 16, KSp, Md = 17, p = 0,001) a v řadě subskórů FAB: Konceptualizace, Duševní flexibilita a Programování činnosti (všechna p < 0,050). Dále jsme zaznamenali na celém souboru METH trend k významnosti slabé asociace mezi postižením BG na MR a subskórem Duševní flexibilita ve FAB (rho = – 282, p = 0,054).Závěr:
Naše výsledky ukazují na skupinové úrovni, že krátkodobá intoxikace metanolem pravděpodobně vede ke kognitivnímu deficitu frontálního typu v důsledku narušení systému BG v mozku.Klíčová slova:
intoxikace metanolem – kognitivní deficit – neuropsychologické vyšetřeníÚvod
Intoxikace metanolem se v neuropsychologii klasifikuje do skupiny onemocnění vlivem tzv. toxických podmínek [1]. Patofyziologický mechanizmus působení metanolu na CNS je znám [2], vede často k poškození některých oblastí centrální nervové soustavy (CNS). Jeho vliv na kognitivní funkce na skupinové úrovni však není vzhledem k nízké incidenci a vysoké letalitě těchto otrav systematicky prozkoumán [3]. Je prokázáno, že metabolizmus metanolu vede k akumulaci kyseliny mravenčí, která je toxická k retině. Důsledkem je různá míra poškození zraku až slepota a atrofie nervus opticus či demyelinizace. Vede k bilaterální nekróze putamen v systému bazálních ganglií (BG) a k subkortikálním lézím v bílé hmotě, dále i v mozečku a mozkovém kmeni [4 – 9]. Vzhledem k patologickému nálezu v oblasti BG na zobrazovacích metodách se dá předpokládat poškození funkčních okruhů systému bazálních ganglií (BG), resp. poškození zpětnovazebných mechanizmů mezi frontálním kortexem, BG a thalamem, které hrají významnou roli nejen v modulaci hybnosti, ale i kognitivních funkcí a regulaci psychiky člověka [10 – 12]. Významná role putamen v jednotlivých psychických procesech byla dosud prokázána u operantního podmiňování, implicitního učení, kategoriálního učení a v propojení prefrontálního kortexu s ostatními částmi mozku a jeho roli ve fungování pracovní paměti a jiných exekutivních funkcí při celkové regulaci chování člověka [13 – 15].
Cílem této studie bylo proto prokázat, zda krátkodobé důsledky intoxikace metanolem mají vliv na celkovou kognitivní výkonnost, resp. zda dochází k poškození psychických funkcí funkčně spjatých s predilekčními částmi CNS.
Soubor a metodika
Soubor osob intoxikovaných metanolem (METH) v průběhu série otrav ve druhé polovině roku 2012 byl vyšetřen v rámci komplexního lékařského sledování na klinikách Všeobecné fakultní nemocnice (VFN) vedených Klinikou pracovního lékařství 1. LF UK a VFN. Z celkem oficiálně evidovaných 121 osob akutní otravu metanolem v průběhu epidemie od 9. 12. 2012 přežilo 81 lidí, z toho jsme vyšetřili 50 (62 %) osob, tedy většinu z intoxikované populace [16,17]. Medián průměrné doby od vzniku příznaků intoxikace do prvního kontaktu s lékařem byl 24 hod (v rozmezí od 1 do 96 hod), interval vyšetření od otravy byl mezi 3. a 4. měsícem. Magnetickou rezonanci (MR) a další laboratorní vyšetření podstoupily pouze osoby po intoxikaci (soubor METH). Všechna vyšetření byla u každého jedince provedena během jednoho dne.
K tomuto souboru jsme pomocí reklamy na odděleních VFN rekrutovali ze zaměstnanců nenáhodným způsobem soubor osob kontrolních (KS). Metoda výběru se označuje jako „sněhová koule (snowball sampling)“ [18]. Osoby z KS musely splnit následující anamnestická kritéria pro zařazení do studie: nesměly utrpět zranění mozku či být v bezvědomí delším než 1 min, trpět vážným neurologickým či psychiatrickým onemocněním s vlivem na CNS, abúzem psychoaktivních látek, opakovanými anesteziemi či aktuálním užíváním léků nebo látek s vlivem na CNS (antipsychotika, antidepresiva, stimulancia či kognitiva). Demografické a psychologické charakteristiky obou souborů zachycuje tab. 1.
Tab. 1. Základní popisné charakteristiky intoxikovaných methanolem (n = 50) a kontrolního souboru (n = 39). 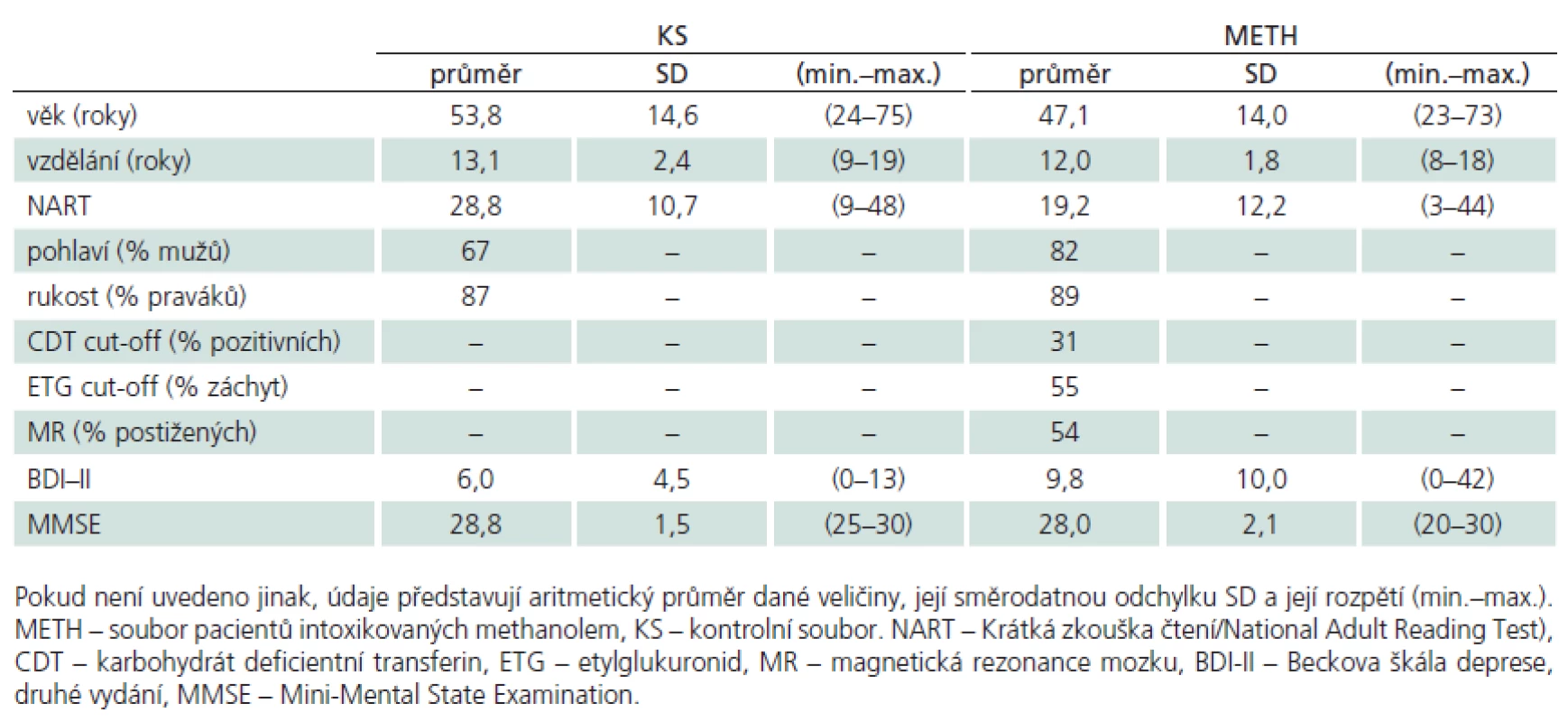
Vzhledem k zásadní metodické podmínce analýzy výsledků, zda některé osoby ze souboru METH nesplňují rovněž kritéria pro rizikové pití alkoholu, byla z celkového souboru METH selektována skupina pacientů (METHna) neužívajících alkohol rizikově (tj. dle WHO množství 40 g čistého alkoholu/ den (u mužů) a 20 g čistého alkoholu/ den (u žen)). Výběr jsme provedli na základě následujících kritérií:
- tyto osoby nesměly mít v době vyšetření na základě biochemického vyšetření karbohydrát deficientní transferin (CDT) > 2 %,
- nesměly mít jaterní enzym gamma ‑ glutamyl tranferázu (GGT) > 1,5 µkat/ l,
- nesměly mít etylglukuronid v moči,
- nesměly uvádět rizikové užívání alkoholu v anamnéze.
Pokud kombinací těchto kritérií osoby prošly a viděly na text, který četly, byly zařazeny do skupiny osob METHna (neužívajících alkohol rizikově). K METHna byly přiřazeny osoby ze souboru KS dle demografických kritérií (věk a vzdělání) a dle výsledku ve zkoušce čtení National Adult Reading Test (NART) jako měřítku premorbidní inteligenční úrovně [19], dle celkového kognitivního výkonu měřeného pomocí Mini‑Mental State Examination (MMSE [20]) a dle úrovně depresivních projevů měřených Beckovou škálou deprese, druhé vydání (BDI ‑ II [21], tj. v obou skupinách METHna a KS nesměly být významné rozdíly ve všech těchto posuzovaných parametrech obou souborů. Popisné a psychologické charakteristiky takto homogenizovaných souborů METHna a KS zachycuje tab. 2.
Tab. 2. Popisné charakteristiky souborů intoxikovaných bez abúzu alkoholu (n = 28) a přiřazeného souboru kontrolního (n = 28). 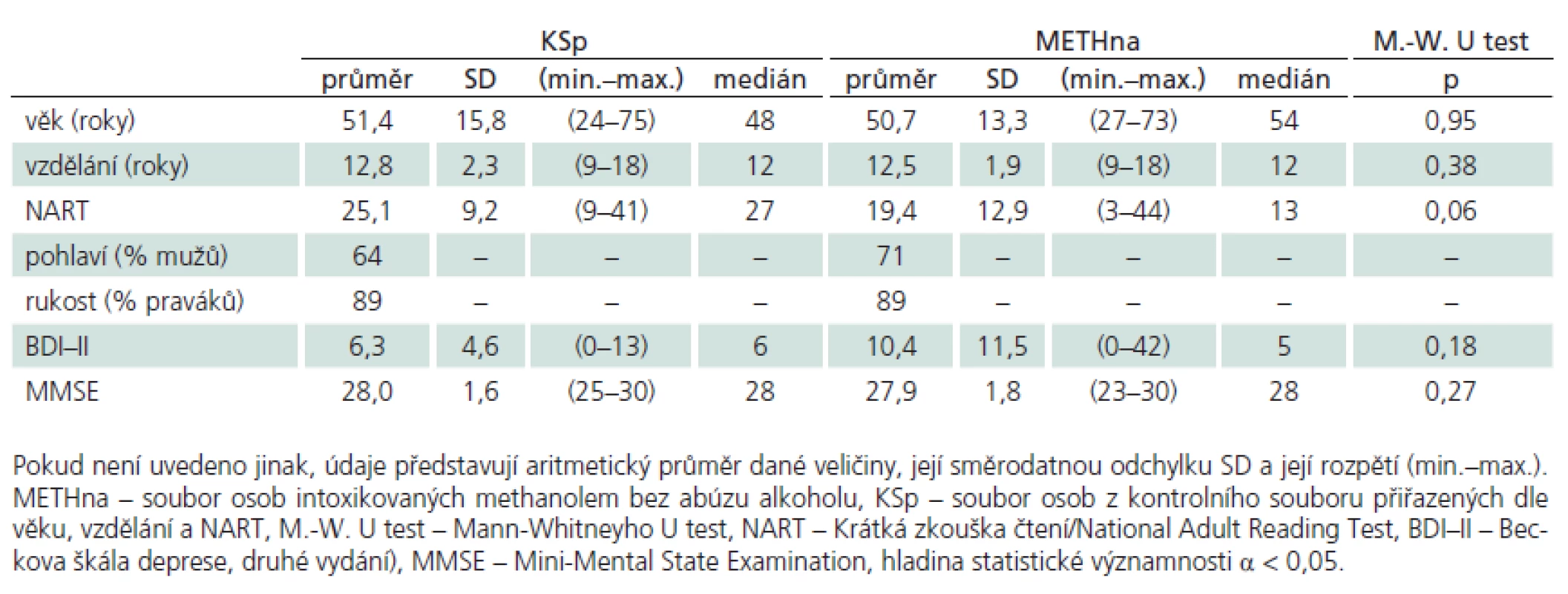
Všichni ze souborů METH a KS byli vyšetřeni komplexní neuropsychologickou baterií sestavenou za účelem diagnostiky základních psychických funkcí a zejména funkcí spojených se systémem BG, frontálního laloku a funkcí bílé hmoty. Baterie pokrývá:
- celkový kognitivní výkon (Mini‑Mental State Examination/ Krátký test mentálního stavu, MMSE [20]),
- frontální chování (Škála frontálního chování FAB [22]),
- explicitní paměť (Paměťový test učení, AVLT [23]: vštípení, uložení, vybavení, rekognice),
- exekutivní funkce: iniciaci (verbální fluence, COWAT [24]), set shifting (Test cesty, TMT-B [25]), inhibici podnětu (Stroopova zkouška W a C [26], FAB subtest Go ‑ No Go), konceptualizaci (Podobnosti z Wechslerovy inteligenční škály pro dospělé, WAIS ‑ III [27]),
- zaměřenou sluchovou i zrakovou pozornost (Opakování čísel popředu z WAIS ‑ III, Stroopova zkouška D [27,26]),
- sluchovou pracovní paměť (Opakování čísel pozadu z WAIS ‑ III [27]),
- psychomotorické a motorické tempo (Dírkovaná deska/ Grooved Pegboard [28] a Ťukání prstem/ Finger Tapping [29]).
Metodika vyšetření MR je popsána v práci Vaněčkové et al [4]. Všichni pacienti byli na MR vyšetřeni ve stejném protokolu a byla u nich hodnocena přítomnost a rozsah postižení v souvislosti s intoxikací metanolem. Z jejích výsledků jsme sestavili pořadovou škálu míry globálního postižení mozku na základě sečtení binárních proměnných (hodnocení jako 0 (žádné změny) nebo 1 (postižení) v kategoriích: symetrické léze putamen atd. v dalších kategoriích: subkortikální ložiska, atrofie optiku, léze BG mimo putamen, léze mozečku, léze kmene, atrofie mozku), tj. celkem min. 0 až max. 6 bodů postižení na MR. Z této globální škály jsme ještě odvodili škálu postižení BG (0 – 4 bodů), kdy jsme léze putamen hodnotili jako trichotomickou proměnnou (0 žádné postižení, 1 jednostranné, 2 oboustranné), zvlášť byla hodnocena přítomnost hemoragie (hemoragická nekróza).
Sběr dat probíhal od ledna do července 2013. Statistická analýza výsledků byla provedena pomocí programu SPSS IBM pro Windows (Version 20, SPSS Inc., Chicago, IL, USA). Pro deskriptivní statistiku jsme užili míry průměr, směrodatnou odchylku a variační rozpětí (minimální a maximální hodnotu), nominální proměnné jsou vyjádřeny jako poměry či procenta. Pro analýzu pořadových skórů (výsledky MR atd.) jsme použili neparametrického Spearmanova korelačního koeficientu. Pro analýzu demografických proměnných jsme použili u věku a vzdělání Mann‑Whitneyho U test pro dva nezávislé výběry. Významnost rozdílů mezi skupinami jsme vzhledem k nenormální distribuci dat testovali neparametrickými metodami inferenční statistiky, jmenovitě Mann‑Whitneyho U testem pro dva nezávislé výběry. Za hladinu statistické významnosti jsme zvolili a = 0,05.
Výsledky
Porovnávané skupiny (tab. 2) METHna a KSp se významně nelišily v základních demografických charakteristikách (věk, vzdělání), v úrovni premorbidní inteligence (NART), v míře celkového kognitivního deficitu (MMSE) ani v celkové úrovni depresivních projevů (BDI–II). V analýze metod neuropsychologické baterie jsme prokázali významné rozdíly mezi skupinou METHna a KSp pouze ve škále FAB, proto zbylé výsledky dalších testů pro přehlednost nerozvádíme. Detailní analýzu FAB rozloženou na jednotlivé subskóry ukazuje tab. 3 a graf 1. Nejvýznamnější rozdíl se jeví v celkovém skóru FAB, mezi další významné rozdíly patří subskóry Podobnosti/ Konceptualizace, Slovní plynulost/ Duševní flexibilita a Série pohybů/ Programování činnosti. Pro propojení morfologické a funkční roviny činnosti mozku jsme analyzovali korelační vztahy mezi nálezy na MR a jednotlivými subskóry FAB. U souboru METHna se všechny tyto vztahy ukázaly jako statisticky nevýznamné. Pakliže jsme do analýzy zahrnuli celý soubor METH, ukázaly se výsledky směřující k významnosti v subskóru FAB Slovní plynulost/ Duševní flexibilita (rho = – 282, p = 0,054).
Tab. 3. Rozdíly souborů intoxikovaných bez abúzu alkoholu (n = 28) a přiřazeného souboru kontrolního (n = 28) dle subskórů FAB. 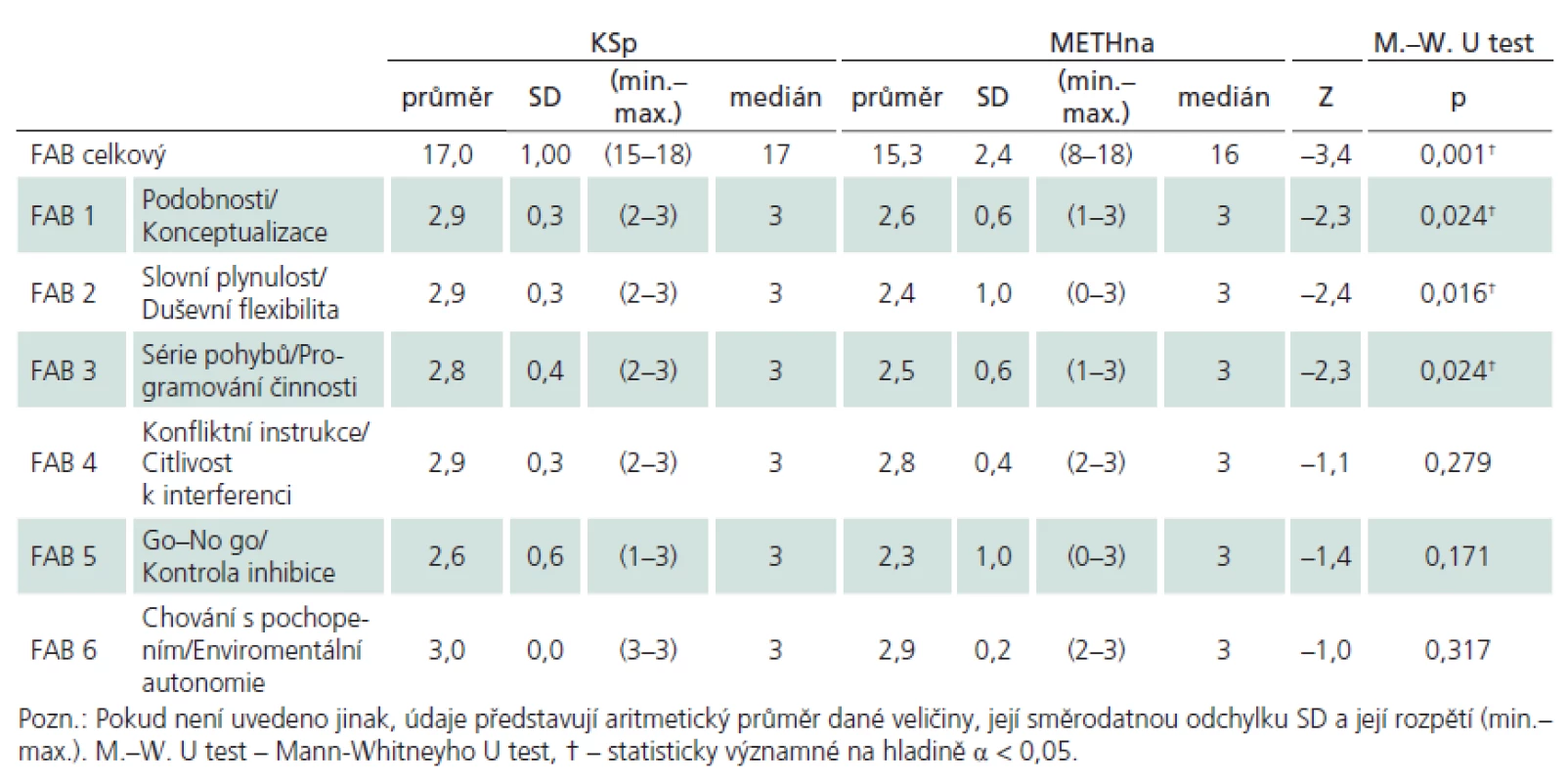
Graf 1. Histogram celkových skórů FAB mezi intoxikovanými bez abúzu alkoholu (n = 28) a kontrolní souborem (n = 28). 
Diskuze
Tato studie měla za cíl identifikovat, zda se soubor osob intoxikovaných metanolem liší v určitých charakteristikách kognitivních funkcí od souboru kontrolního. Základním zjištěním je, že metanolem intoxikované osoby neužívající alkohol rizikově projevují selektivní kognitivní deficit frontálního typu. Tento deficit se konkrétně projevuje v horší schopnosti konceptualizovat činnost (nacházet podobnosti mezi věcmi ze stejné kategorie), horší mentální flexibilitě (schopnosti iniciovat určitou činnost podle předem zadaného pravidla) a v horší schopnosti programovat činnost (provádět opakovaně sérii pohybů). Ze zobrazovacích studií FAB pomocí PET a SPECT víme [30,31], že tato krátká škála aktivuje zejména dorzolaterální a mediofrontální okruhy v rámci prefrontálního kortexu. Tyto oblasti jsou silně propojeny se systémem BG, zejména dorzolaterální prefrontální kortex tvoří se striatem samostatný funkční okruh [10,11]. Z naší korelační analýzy jsme ukázali trend k významnosti a slabou asociaci mezi mírou postižením BG na zobrazení MR (nekróza či hemoragická nekróza putamen) a výkonem ve FAB, ale tento trend či asociace nebyly nalezeny mezi celkovým postižením mozku a FAB. Tato zjištění propojují možnou souvislost mezi toxickým vlivem metanolu na systém BG a našimi zjištěními na funkční úrovni z neuropsychologické baterie.
Pozorované rozdíly mezi skupinami nejsou vysvětlitelné řadou jiných faktorů, než je intoxikace metanolem, které ale mohly mít vliv na srovnání: rozdílné demografické charakteristiky, premorbidní inteligenční úroveň, celkový kognitivní výkon a míra depresivních projevů. Další nežádoucí faktor, který jsme se snažili eliminovat, představuje vliv rizikového užívání alkoholu v kombinaci s metanolem, proto i tato skupina byla ze srovnání vyloučena. Všechny tyto nežádoucí proměnné jsme se snažili přísně kontrolovat a naše výsledky jimi pravděpodobně nejsou významně ovlivněny.
Naše studie však má i jistá omezení. Kritéria pro vyloučení osob, které se intoxikovaly metanolem a zároveň užívající alkohol pravidelně ve vyšších dávkách, nejsou zcela objektivní. U skupiny osob z kontrolního souboru jsme neprovedli zobrazovací vyšetření ani jiné laboratorní testy, které by byly nezbytné pro jejich další srovnání. Použitou neuropsychologickou baterii lze označit za flexibilní a nelze ji považovat za standard, který kompletně pokrývá všechny možné deficity v důsledku intoxikace metanolem. Je možné, že některé deficity touto baterií nebyly odhaleny. Dále není zřejmé, proč některé subtesty a celkový skór FAB vyšly jako významné, zatímco řada základních exekutivních testů, jako Stroopova zkouška či TMT ‑ B a COWAT, neukázaly rozdíly mezi skupinami. Vysvětlujeme si to specifičností FAB k frontálním projevům chování u postižení BG [22,30], velikostí zkoumaných souborů a přísnými kritérii pro zařazení osob do souboru METHna. Je nutné mít na paměti, že skupina zkoumaných osob představuje podskupinu ze všech intoxikovaných, která byla schopna zvládnout neuropsychologické vyšetření, což pravděpodobně svědčí o relativně nízkém vlivu metabolitů acidózy na jejich funkční kapacitu. Možné kognitivní deficity, které pramení z celkově vyššího toxického vlivu metanolu na CNS, navíc s polymorbidními vlivy v důsledku možného rizikového užívání alkoholu u zbylé části souboru, jsou pravděpodobně podstatně hlubší. Další závažný faktor představuje časová osa. Je totiž možné, že kognitivní důsledky intoxikace metanolem se nerozvíjí akutně, ale až po delší době, než je 3 – 8 měsíců po intoxikaci. K tomu bychom potřebovali longitudinální sledování, jehož výsledky zatím nemáme k dispozici.
Závěrem bychom zdůraznili, že předkládaná studie je v současné době nejrozsáhlejší studií na světě o vlivu metanolu na kognitivní funkce, co se týče počtu vyšetřených pacientů a procedur k eliminaci nežádoucích proměnných, které vedly k jejich porovnatelnosti s kontrolním souborem. Její výsledky dokládají, že intoxikace metanolem může vést ke kognitivnímu deficitu frontálního typu. A že tyto funkční deficity vznikají pravděpodobně jako důsledek postižení systému BG a poruchy zejména dorzolaterálního prefrontálního okruhu a jeho role při regulaci psychiky člověka.
Tento výzkum byl uskutečněn v rámci projektu 36/13/NAP „Prospektivní studie dlouhodobých zdravotních následků akutních intoxikací metanolem“ (VFN) Ministerstva zdravotnictví ČR a podpořen granty Univerzity Karlovy P26/LF1/4 a IGA MZ ČR NT 13145 a MŠM LH13256, RVO-VFN64165 a Nadací Agrofert.
První autor by rád poděkoval doc. MUDr. Robertu Rusinovi, Ph.D., za cenné připomínky i odbornou pomoc a Lucii Bernáškové za pomoc při sběru dat.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Ondřej Bezdíček
Neurologická klinika a Centrum klinických neurověd
1. LF UK a VFN v Praze
Kateřinská 30
128 21 Praha 2
e-mail: ondrej.bezdicek@gmail.com
Přijato k recenzi: 14. 1. 2014
Přijato do tisku: 4. 2. 2014
Zdroje
1. Lezak MD, Howieson DB, Bigler ED, Tranel D. Neuropsychological Assessment. 5th ed. Oxford: Oxford University Press 2012.
2. Jacobsen D, McMartin KE. Methanol and ethylene glycol poisonings. Mechanism of toxicity, clinical course, diagnosis and treatment. Med Toxicol 1986; 1(5): 309 – 334.
3. Paasma R, Hovda KE, Jacobsen D. Methanol poisoning and long term sequelae – a six years follow‑up after a large methanol outbreak. BMC Clin Pharmacol 2009; 9 : 5. doi: 10.1186/ 1472 - 6904 - 9 - 5.
4. Vaněčková M, Zakharov S, Klempíř J, Růžička E, Bezdíček O, Lišková I et al. Intoxikace metanolem v obraze magnetické rezonance – kazuistiky. Cesk Slov Neurol N 2014; 77/ 110(2): 235 – 239.
5. Airas L, Paavilainen T, Marttila RJ, Rinne J. Methanol intoxication‑induced nigrostriatal dysfunction detected using 6 - [18F]fluoro‑L ‑ dopa PET. Neurotoxicology 2008; 29(4): 671 – 674.
6. Arora V, Nijjar IBS, Multani AS, Singh JP, Abrol R,Chopra R et al. MRI finding in metanol intoxication: a report of two cases. Br J Radiol 2007; 80(958): e243 – e246.
7. Blanco M, Casado R, Vázque F, Pumar JM. CT and MR imaging findings in methanol intoxication. AJNR Am J Neuroradiol 2006; 27(2): 452 – 454.
8. Gaul HP, Wallace CJ, Auer RN, Fong TC. MR findings in metanol intoxication. AJNR Am J Neuroradiol 1995; 16(9): 1783 – 1786.
9. Singh P, Paliwal VK, Neyaz Z, Kanaujia V. Methanol toxicity presenting as haemorrhagic putaminal necrosis and optic atrophy. Pract Neurol 2013; 13(3): 204 – 205. doi: 10.1136/ practneurol ‑ 2012 - 000500.
10. Alexander GE, Crutcher MD. Functional architecture of basal ganglia circuits: neural substrates of parallel processing. Trends Neurosci 1990; 13(7): 266 – 271.
11. Růžička E. Role bazálních ganglií při řízení hybnosti a psychiky člověka (Suppl). Psychiatrie 2006; 10 : 44 – 45.
12. DeLong MR, Wichmann T. Circuits and circuit disorders of the basal ganglia. Arch Neurol 2007; 64(1): 20 – 24.
13. Packard MG, Knowlton BJ. Learning and memory functions of the Basal Ganglia. Annu Rev Neurosci 2002; 25(1): 563 – 593.
14. Ell SW, Marchant NL, Ivry RB. Focal putamen lesions impair learning in rule‑based, but not information ‑ integration categorization tasks. Neuropsychologia 2006; 44(10): 1737 – 1751.
15. Ell SW, Weinstein A, Ivry RB. Rule‑based categorization deficits in focal basal ganglia lesion and Parkinson’s disease patients. Neuropsychologia 201; 48(10): 2974 – 2986. doi: 10.1016/ j.neuropsychologia.2010.06.006.
16. Zakharov S, Pelclová D, Navrátil T, Fenclová Z, Petrik V. Hromadná otrava metanolem v České Republice v roce 2012: srovnání s „metanolovými epidemiemi“ v jiných zemích. Urgent Med 2013; 16(2): 25 – 29.
17. Zakharov S, Pelclova D, Navratil T, Belacek J, Kurcova I, Komzak O et al. Methanol and formate elimination half‑life during treatment for methanol poisoning: intermittent haemodialysis vs continuous haemodialysis/ hemodiafiltration. Kidney Int 2014. In press 2014.
18. Beirnacki P, Waldorf D. Snowball sampling: Problems and Techniques of Chain Referral Sampling. Sociol Method Res 1981; 10(2): 141 – 163.
19. Krámská L, Preiss M. Určování premorbidní úrovně – možnosti zkoušky čtení slov. Psychiatrie 2007; 11(1): 4 – 7.
20. Folstein MF, Folstein SE, Fanjiang G. MMSE. Mini‑Mental State Examination. Clinical Guide. Lutz Psychological Assessment Resources: 2001.
21. Beck AT, Steer RA, Brown GK. Beck Depression Inventory ‑ II. (BDI – II). Manual. San Antonio: The Psychological Corporation 1996.
22. Dubois B, Slachevsky A, Litvan I, Pillon B. The FAB: a Frontal Assessment Battery at bedside. Neurology 2000; 55(11): 1621 – 1626.
23. Bezdicek O, Stepankova H, Moták L, Axelrod BN, Woodard JL, Preiss M et al. Czech version of Rey Auditory Verbal Learning test: Normative data. Aging Neuropsychol C. In press 2013.
24. Preiss, M, Bartoš A, Čermáková R, Nondek M, Benešová M, Rodriguez M et al. Neuropsychologická baterie Psychiatrického centra Praha. 3. vyd. Praha: Psychiatrické centrum Praha 2012.
25. Bezdicek O, Motak L, Axelrod BN, Preiss M, Nikolai T, Vyhnalek M et al. Czech Version of the Trail Making Test: Normative data and Clinical utility. Arch Clin Neuropsychol 2012; 27(8): 906 – 914.
26. Troyer AK, Leach L, Strauss E. Aging and response inhibition: Normative data for the Victoria Stroop Test. Neuropsychol Dev Cogn B Aging Neuropsychol Cogn 2006; 13(1): 20 – 35.
27. Wechsler D. Wechslerova inteligenční škála pro dospělé. WAIS ‑ III. Praha: Hogrefe Testcentrum 2010.
28. Kløve H. Clinical neuropsychology. In: Forster FM (eds). The medical clinics of North America. New York: Saunders 1963.
29. Reitan RM, Wolfson D. The Halstead ‑ Reitan Neuropsychological Test Battery: Theory and clinical interpretation. 2nd ed. Tucson: Neuropsychology Press 1993.
30. Sarazin M, Pillon B, Giannakopoulos P, Rancurel G,Samson Y, Dubois B. Clinicometabolic dissociation of cognitive functions and social behavior in frontal lobe lesions. Neurology 1998; 51(1): 142 – 148.
31. Guedj E, Allali G, Goetz C, Le Ber I, Volteau M, Lacomblez L et al. Frontal Assessment Battery is a marker of dorsolateral and medial frontal functions: A SPECT study in frontotemporal dementia. J Neurol Sci 2008; 273(1 – 2): 84 – 87.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2014 Číslo 3- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
-
Komentář ke článku autorů Kotase a Polívky
Přehled méně častých primárních bolestí hlavy - Spasticita po iktu jako projev maladaptivní plasticity a její ovlivnění botulotoxinem
- Méně obvyklé indikace hluboké mozkové stimulace
- Projekt ncRNAPain
- Fluorescencí navigovaná resekce vysokostupňových gliomů mozku
- Neurologické hypotézy u panické poruchy
- Účinky intoxikace metanolem na kognitivní funkce
- Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení
-
Komentář ke článku autorů Mrliana, Ďuriše, Neumana, Vybíhala a Smrčky
Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení - Pupilární reakce na barevné podněty
- Klíšťová encefalitida, průběh a komplikace – naše poznatky z let 2009– 2012
- Naše zkušenosti s mobilní náhradou krčního disku Mobi‑ C – výsledky studie s intervalem sledování pět let
- Neuromodulace sakrálních nervů při řešení inkontinence stolice
- Kombinovaný paramediánní supracerebellární‑ transtentoriální a miniinvazivní subokcipitální přístup při resekci gliomu celé délky mediobazální temporální oblasti
- Selektivní denervace karpu při řešení artrotického postižení zápěstí
- Flekční cervikální myelopatie (Hirayamova choroba) – skutečnost, nebo mýtus? Dvě kazuistiky
- Simultánní výskyt leptomeningeálních a intramedulárních metastáz glioblastoma multiforme – kazuistika
- Blister aneuryzma arteria carotis interna – kazuistika a přehled literatury
- Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014
- Prof. Josef Vymazal starší – in memoriam
- Webové okénko
- Recenze knih
-
Analýza dat v neurologii
XLV. Grafy usnadňující studium zavádějících faktorů v asociačních studiích – III. Spojitá data
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
- Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014
- Neurologické hypotézy u panické poruchy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



