-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pupilární reakce na barevné podněty
Pupillary Response to Chromatic Stimuli
Aim of study:
To compare chromatic pupillary responses in a group of healthy subjects and to determine if this method can be used for assessing outer and inner retinal function.Material and methods:
The study group consisted of 17 healthy subjects. Subjects were tested with a chromatic pupillometer. The parameters of the stimulus were as follows: intensity 28 lx, duration 4 sec, and color blue (420 ± 20 nm) and red (605 ± 20 nm). The examined pupil parameters were baseline pupil diameter, maximal constriction time, relative amplitude at maximal constriction, at 3 sec after stimulus onset, at stimulus offset, at 3 sec after stimulus offset and at 7 sec after stimulus offset. Pupil response parameters to red and blue light were evaluated by paired t-test.Results:
Except for the baseline pupil diameter (p = 0.148), there was a significant difference in all pupil response parameters to red and blue light (p = 0.001). With blue light, the relative amplitude was significantly greater and the time to maximal pupil constriction significantly longer compared to red light for all tested time points. Blue light evoked “sustained” pupil contraction, while red light rather induced “transient” contraction.Conclusions:
Our examination protocol allowed us to unmask differences in pupil response to red and blue light in healthy subjects and to confirm involvement of the melanopsin retinal ganglion cells in the pupil light reflex, particularly with blue light. Chromatic pupillography appears to be a highly sensitive method for objective evaluation of the outer and inner retina function.Key words:
pupillary reflex – melanopsin – photoreceptor cells
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: K. Skorkovská 1,2; F. Maeda 2; C. Kelbsch 2; T. Peters 2,3; B. Wilhelm 2,3; H. Wilhelm 2
Působiště autorů: Klinika nemocí očních a optometrie LF MU a FN u sv. Anny v Brně 1; Pupil Research Group, Centre for Ophthalmology, Institute of Ophthalmic Research, University of Tübingen, Germany 2; STZ eyetrial at the Centre for Ophthalmology, University of Tübingen, Germany 3
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(3): 334-338
Kategorie: Krátké sdělení
Studie byla podpořena Jungovou nadací pro vědu a výzkum (Jung Stiftung für Wissenschaft und Forschung).
Souhrn
Cíl:
Porovnat pupilární reakci na barevné světelné stimuly v souboru zdravých osob a zjistit, zda lze tuto metodu aplikovat pro hodnocení funkce zevní a vnitřní vrstvy sítnice.Soubor a metodika:
Do studovaného souboru bylo zařazeno 17 zdravých osob. Ke stimulaci bylo použito červené (605 ± 20 nm) a modré (420 ± 20 nm) světlo o intenzitě 28 lx, které difuzně osvětlovalo jedno oko po dobu 4 s. Pro druhé oko každé osoby byly hodnoceny následující parametry pupilární reakce: výchozí průměr zornice, latence do maximálního zúžení zornice, relativní pupilární amplituda při maximálním zúžení zornice, tři sekundy po zahájení stimulu, při ukončení stimulu, 3 a 7 s po vypnutí stimulu. Parametry pupilární reakce byly srovnány pro červený a modrý stimulus pomocí párového t‑testu.Výsledky:
S výjimkou výchozího průměru zornice (p = 0,148) byly rozdíly v parametrech zornicové reakce na červený a modrý stimulus ve všech případech statisticky významné (p = 0,001). Při osvitu zornice modrým světlem byla relativní amplituda v každém měřeném okamžiku významně větší a latence do maximálního zúžení zornice významně delší než při působení červeného světla. Při působení modrého světla převažovala prolongovaná („sustained“) kontrakce zornice, zatímco při působení červeného světla přechodná („transient“) kontrakce zornice.Závěry:
Pomocí našeho vyšetřovacího protokolu bylo možné vysledovat u zdravých osob rozdíly v pupilární reakci na červené a modré světlo, a potvrdit tak zapojení gangliových buněk sítnice s obsahem melanopsinu do pupilárního reflexu zejména při působení modrého světla. Chromatická pupilografie se jeví jako vysoce citlivá metoda, která dokáže objektivně zhodnotit funkci jednotlivých populací fotosenzitivních buněk sítnice.Klíčová slova:
pupilární reflex – melanopsin – fotoreceptorové buňkyÚvod
Pupilárnímu reflexu a jeho významu při objektivním hodnocení neuroretinální funkce se dostalo nové pozornosti díky nedávnému objevu nových fotoreceptorů sítnice – gangliových buněk obsahujících melanopsin [1 – 4]. Melanopsin funguje jako fotopigment a propůjčuje těmto speciálním buňkám sítnice tzv. vnitřní fotosenzitivitu. K depolarizaci buněk může dojít buď po fototransdukci v tyčinkách a čípcích, nebo vlastní vnitřní fototransdukcí za účasti melanopsinu, anebo oběma způsoby najednou. Na rozdíl od tyčinek a čípků nepřispívají gangliové buňky s obsahem melanopsinu k tvorbě zrakového vjemu. Fungují spíše jako detektor intenzity okolního osvětlení, a podílejí se tak na řízení cirkadiánního rytmu. Jsou ve spojení s centry pro řízení cirkadiánního rytmu v předním hypothalamu (nucleus suprachiasmaticus, intergenikulární vrstva nucleus geniculatum laterale) a spánku (nucleus praeopticus ventrolateralis). Kromě toho vedou axony gangliových buněk s obsahem melanopsinu také do nucleus pretectalis olivaris v dorzálním středním mozku, a tvoří tak aferentní část zornicového reflexu. Právě zapojení melanopsin‑RGCs (Retinal Ganglion Cells) do zornicového reflexu vysvětluje, proč osoby, které osleply v důsledku postižení klasických fotoreceptorů sítnice (tyčinek a čípků), mají zachovalý zornicový reflex a normální cirkadiánní rytmus [5,6].
Tyčinky a čípky se nacházejí v zevní jádrové vrstvě sítnice, gangliové buňky s obsahem melanopsinu leží ve vnitřní jádrové vrstvě sítnice a jejich axony jsou součástí zrakového nervu. Jednotlivé typy fotoreceptorů sítnice mají přitom jiná absorpční maxima a citlivost. Pomocí světla o různé vlnové délce a intenzitě by tedy mělo být možné aktivovat selektivně jednotlivé receptorové systémy. Metoda postavená na tomto principu byla pojmenována chromatická pupilografie. V současné době jsou v klinických studiích testovány různé protokoly, které by pomocí světla o různé vlnové délce a intenzitě umožnily stimulovat jednotlivé populace fotoreceptorů sítnice jak u zdravých osob, tak u nemocných s různými očními patologiemi [7 – 11]. Takto vypracovaná metodika by pak v klinické praxi mohla pomoci objektivně rozlišit, zda se jedná o onemocnění zrakového nervu nebo fotoreceptorů sítnice, případně lépe kvantifikovat postižení jednotlivých populací fotoreceptorů u degenerativních onemocnění sítnice. Cílem naší práce bylo porovnat pupilární reakci na červený a modrý světelný stimulus ve skupině zdravých osob pomocí vlastního protokolu a dostupného technického vybavení a zjistit, zda a ve kterých parametrech se pupilografické křivky liší, aby bylo v budoucnu možné použít tento postup pro klinické účely.
Soubor a metodika
Studie byla provedena v pupilografické laboratoři na oční klinice v Tübingenu. Do studie byly zařazeny zdravé osoby s normálním oftalmologickým nálezem z řad zaměstnanců oční kliniky a přátel autorů studie. U všech zúčastněných osob bylo před měřením zornicové reakce provedeno běžné oftalmologické vyšetření k vyloučení oční patologie (vyšetření zrakové ostrosti, změření nitroočního tlaku, vyšetření zornicových reakcí, vyšetření předního a zadního očního segmentu na štěrbinové lampě). S výjimkou korekce refrakční vady brýlemi nebo kontaktními čočkami se nikdo z osob ve studovaném souboru s očima neléčil. Studie byla schválena etickou komisí lékařské fakulty na univerzitě v Tübingenu v Německu. Účastníci studie byli podrobně informováni o účelu a průběhu studie a podepsali souhlas se svou účastí ve studii.
K vyšetření zornicové reakce byl použit přístroj Compact Integrated Pupillograph (CIP, výrobce AMTech, Německo, obr. 1). Měření probíhalo v zatemněné místnosti. Při vyšetření bylo vždy jedno oko osvětleno barevným světlem a zornicová reakce byla měřena na druhém oku pomocí infračervené videokamery. Do studie pak bylo u každé osoby zařazeno jen pravé oko. Ke stimulaci bylo použito červené (605 ± 20 nm) nebo modré (420 ± 20 nm) světlo o intenzitě 28 lx, které difuzně osvětlovalo stimulované oko po dobu 4 s. Rozlišení přístroje bylo 0,01 mm a jeho vzorkovací frekvence 250 Hz.
Obr. 1. Přístroj Compact Integrated Pupillograph. 
Každý stimulus byl prezentován pětkrát. Z pěti odpovědí zornice byla zjištěna průměrná amplituda pupilární reakce na daný barevný podnět a ta byla použita pro další výpočty. Byly hodnoceny následující parametry pupilární reakce: výchozí průměr zornice, latence do maximálního zúžení zornice, relativní pupilární amplituda při maximálním zúžení zornice (podíl změny průměru zornice po prezentaci stimulu a jejího výchozího průměru), relativní pupilární amplituda 3 s po zahájení stimulu, relativní pupilární amplituda při ukončení stimulu, 3 s po vypnutí stimulu a 7 s po vypnutí stimulu. Relativní pupilární amplituda byla ve všech případech definována jako podíl průměru zornice v daný okamžik a jejího výchozího průměru. Všechny zjišťované parametry pupilární reakce byly ve studovaném souboru následně srovnány pro červený a modrý stimulus pomocí párového t‑testu.
Výsledky
Do studovaného souboru bylo zařazeno 17 očí 17 zdravých osob. Průměrný věk osob ve studovaném souboru byl 55,6 ± 11,7 let. V tab. 1 jsou uvedeny průměrné hodnoty všech měřených parametrů zornicové reakce pro červený a modrý stimulus a jejich standardní odchylka. V posledním sloupci tabulky je statistická významnost „p“ rozdílu obou hodnot po vyhodnocení t‑testem. S výjimkou výchozího průměru zornice (p = 0,148) byly rozdíly v parametrech zornicové reakce na červený a modrý stimulus ve všech případech statisticky významné (p = 0,001).
Tab. 1. Průměrné hodnoty jednotlivých parametrů pupilární reakce měřených ve studovaném souboru během prezentace modrého nebo červeného stimulu. Tučně zvýrazněné hodnoty „p“ ukazují na statisticky významné rozdíly mezi zjištěnými hodnotami. 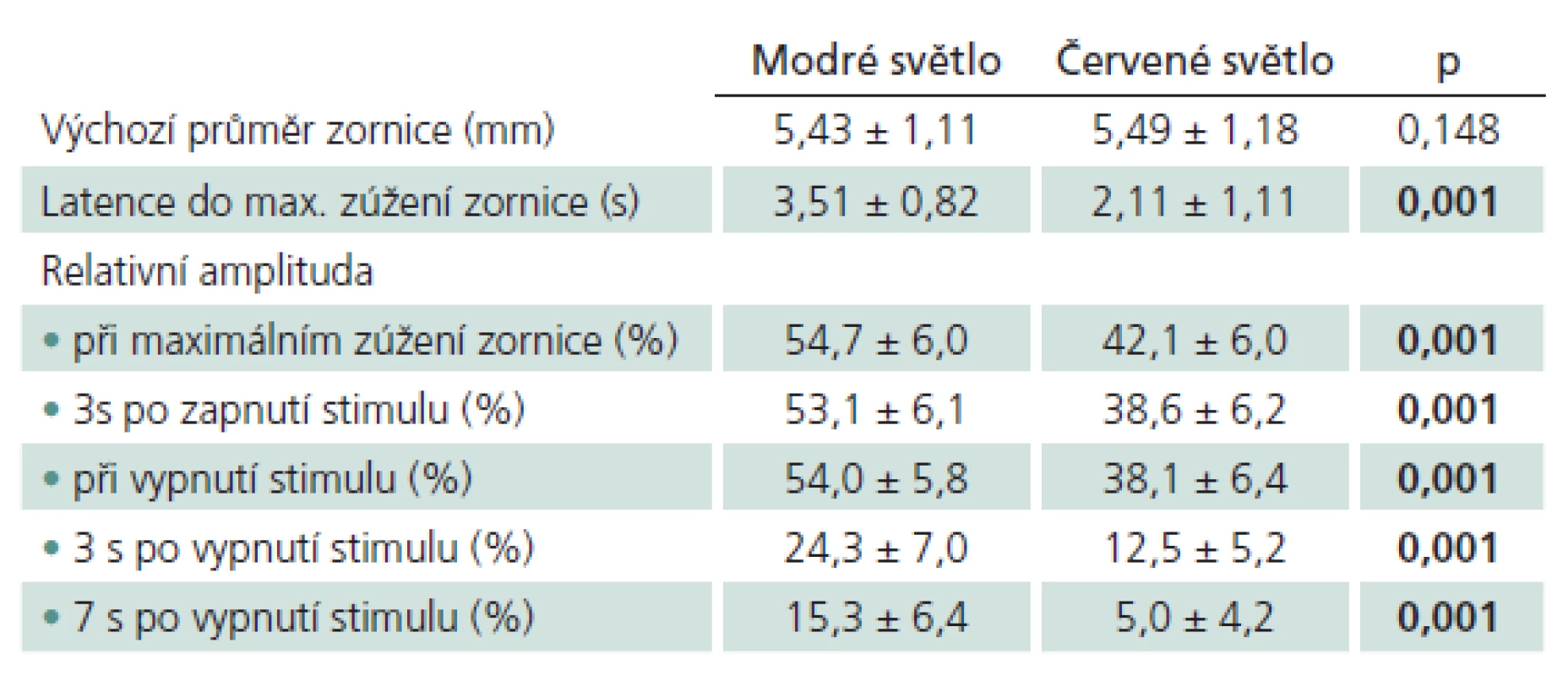
Na grafu 1 je prezentována průměrná zornicová reakce na červený a modrý podnět ve studovaném souboru. Rozdíl v průběhu zornicové reakce na červený a modrý podnět je jasně patrný. Při osvitu zornice modrým světlem byla relativní amplituda významně větší a latence pupilární reakce významně delší než při působení červeného světla. Při působení modrého světla převažovala prolongovaná („sustained“) kontrakce zornice, zatímco při působení červeného světla přechodná („transient“) kontrakce zornice.
Graf 1. Průměrná zornicová reakce na červený a modrý podnět ve studovaném souboru. 
Diskuze
Pupilární reflex kontroluje změnou průměru zornice množství světla dopadajícího na sítnici. Pupilární reflex byl u člověka spojován pouze s aktivací tyčinek v šeru a čípků při denním osvětlení. Z těchto klasických fotoreceptorů byla informace vedena pomocí bipolárních, amakrinních a horizontálních buněk sítnice ke gangliovým buňkám sítnice a jejich axony dále do mozku. Před 10 lety však Lucas et al prokázali, že u pokusných myší postrádajících tyčinky i čípky byla pupilární reakce na osvit sice snížená, nicméně však přítomná. Zároveň byl u těchto zvířat zachován normální cirkadiánní rytmus [12]. Krátce nato se podařilo identifikovat podskupinu vnitřně fotosenzitivních gangliových buněk sítnice obsahujících melanopsin [2,13], které se na rozdíl od tyčinek a čípku neúčastní tvorby zrakového vjemu, nýbrž se podílejí na zajištění cirkadiánního rytmu a zornicového reflexu [3,4,14]. Axony těchto buněk vedou do oblasti dorzálního středního mozku (centrum pupilárního reflexu) a do hypothalamu (centrum pro cirkadiánní rytmus).
Pupilární reakce na osvit je tedy kombinací aktivity tyčinek, čípků a gangliových buněk sítnice obsahujících melanopsin. Nejčastěji se při pupilometrii používá bílé světlo. Bílé světlo však zahrnuje široké spektrum vlnových délek, takže dochází k sumaci odpovědí všech fotosenzitivních buněk sítnice účastnících se pupilární reakce. Chromatická pupilografie naopak umožňuje odlišit jednotlivé populace buněk, které k této sumaci přispívají. V naší studii jsme se zabývali srovnáním pupilární reakce na červené a modré světelné stimuly v souboru zdravých osob. Červené světlo má dlouhou vlnovou délku a aktivuje zejména čípky. Modré světlo reprezentuje krátkou vlnovou délku, na kterou reagují při nízkých intenzitách tyčinky, s rostoucí intenzitou osvětlení se přidávají gangliové buňky sítnice obsahující melanopsin a částečně také čípky. Podle dosavadních poznatků dochází k přímé (vnitřní) aktivaci gangliových buněk s obsahem melanopsinu zejména při stimulaci světelnými podněty o krátké vlnové délce (cca 482 nm), velké intenzitě (100 cd/ m2) a dlouhém trvání (13 s) [5].
Při osvitu zornice modrým světlem byla v naší studii relativní pupilární amplituda významně větší a latence do maximálního zúžení zornice významně delší než při působení červeného světla. Lze se tedy domnívat, že za navýšením amplitudy při působení modrého světla stojí zapojení gangliových buněk s obsahem melanopsinu do pupilární odpovědi. Delší latence pupilární reakce na modrý stimulus rovněž podporuje dosavadní poznatky o chování gangliových buněk obsahujících melanopsin. Elektrofyziologická studie Daceyho et al, kteří měřili akční potenciály z jediné gangliové buňky s obsahem melanopsinu izolované in vitro ze sítnice opice makaka, totiž ukázala, že po přímé depolarizaci této gangliové buňky následuje dlouhá latence k dosažení prvního akčního potenciálu. Rychlost výbojů pak pomalu narůstá až do dosažení maxima, které je přímo úměrné světelné intenzitě, a poté je rychlost výbojů udržována v konstantním stavu po celou dobu trvání světelného stimulu. Po ukončení osvitu neklesne frekvence výbojů náhle, nýbrž postupně. Naopak při hyperpolarizaci tyčinek a čípků je latence do počáteční depolarizace gangliových buněk sítnice krátká, počáteční výboj ihned dosahuje maxima a následně se frekvence výbojů rychle snižuje, což ukazuje na časnou adaptaci těchto klasických fotoreceptorů [15].
Zmíněným elektrofyziologickým charakteristikám sítnicových fotoreceptorů odpovídají dvě fáze pupilární reakce během zúžení zornice. Když se rozsvítí světelný stimulus, nastává rychlé a okamžité zúžení zornice do dosažení maxima neboli tzv. maximální konstrikční amplitudy. Tato časná, přechodná („transient“) odpověď je následována rychlou pupilární redilatací neboli únikem („escape“), který přejde v postupnou, prolongovanou („sustained“) pupilární konstrikci. Ta pokračuje po zbytek trvání stimulu. „Přechodná“ a „prolongovaná“ komponenta pupilárního reflexu může být vysvětlena rozdílným přispěním tyčinek, čípků a gangliových buněk sítnice s obsahem melanopsinu při zpracování světla [5]. V naší studii při působení modrého světla převažovala prolongovaná („sustained“) kontrakce zornice, zatímco při působení červeného světla přechodná („transient“) kontrakce zornice. Prolongovaná pupilární kontrakce při prezentaci modrého stimulu dokumentuje déletrvající elektrické výboje gangliových buněk s obsahem melanopsinu. Při stimulaci červeným světlem nebyla prolongovaná kontrakce zornice patrná.
Využití chromatické pupilografie u onemocnění sítnice je zatím ve fázi klinických studií. Různé vyšetřovací protokoly jsou testovány zejména u pacientů s dysfunkcí tyčinek a čípků. Všechny protokoly vychází z předpokladu, že tyčinky (absorpční maximum 498 nm) reagují nejlépe na modré světlo o nízké intenzitě a gangliové buňky s obsahem melanopsinu jsou citlivé na modré světlo o mnohem vyšší intenzitě. S ‑ čípky (čípky s absorpčním maximem při 460 nm, tedy při krátkých vlnových délkách) přispívají k pupilární reakci při hodnotách světelnosti asi o 3 log více, než je dostačující pro tyčinky. L/ M čípky (čípky se spektrální citlivostí ke středním (530 nm) a dlouhým (560 nm) vlnovým délkám) mohou být naopak samostatně stimulovány při vlnových délkách nad 620 nm, při kterých tyčinky, gangliové buňky a S ‑ čípky nereagují [16,17]. Kardon et al při vývoji jejich protokolu chromatické pupilografie vyšetřili i pacienta s retinitis pigmentosa, což je hereditární dystrofie sítnice postihující tyčinky a čípky. Pupilární odpověď na modré světlo nízké a střední intenzity byla ve srovnání se zdravými osobami výrazně snížená (v důsledku převažujícího postižení tyčinek) a odpověď na červené světlo byla mírně snížená (v důsledku postižení čípků). Pupilární reakce na intenzivní modré světlo však snížená nebyla, pravděpodobně díky zachované vnitřní aktivaci gangliových buněk s obsahem melanopsinu, které u retinitis pigmentosa nejsou postiženy [7]. Rovněž ve své další studii hodnotili Kardon et al pupilární reakci na barevné podněty, tentokrát u větší skupiny pacientů s retinitis pigmentosa. Byly nalezeny významné rozdíly mezi pacienty s retinitis pigmentosa a zdravými osobami při testovacích podmínkách, které měly zdůraznit přispění tyčinek (1 cd/ m2, modré světlo) nebo čípků (100 cd/ m2, červené světlo). V obou případech byla pupilární odpověď u pacientů s retinitis pigmentosa ve srovnání se zdravými osobami významně snížená, nicméně přítomná i u pacientů s vyhaslým elektroretinogramem (ERG). Navzdoryslibným výsledkům byla však u dvou pacientů ve studii pupilární odpověď i přes abnormální ERG srovnatelná se zdravými osobami. Autoři proto konstatují, že jejich současný testovací protokol ještě není dostatečně selektivní pro aktivaci jednotlivých populací fotoreceptorů [9]. Kawasaki et al srovnávali pomocí pupilární reakce funkci tyčinek, čípků a gangliových buněk s obsahem melanopsinu u devíti pacientů s autozomálně dominantně dědičnou formou retinitis pigmentosa a 12 zdravých osob. Pupilární odpověď na modré světlo nízké intenzity po adaptaci na tmu byla u pacientů s retinitis pigmentosa snížená, což pravděpodobně reflektovalo sníženou funkci tyčinek, a dále se s progresí onemocnění snižovala. Pupilární reakce na červené světlo se u nemocných očí adaptovaných na světlo naopak nelišila od pupilární reakce zdravých osob. Překvapivě ale byla u pacientů s retinitis pigmentosa významně snížená i pupilární odpověď zprostředkovaná gangliovými buňkami s obsahem melanopsinu. Autoři studie zdůrazňují, že s ohledem na korelaci amplitudy pupilární reakce a progrese onemocnění lze chromatickou pupilografii využít pro detailnější monitorování degenerace fotoreceptorů, než nabízí klasická elektroretinografie [11].
Dalším parametrem, který lze sledovat při hodnocení příspěvku gangliových buněk sítnice s obsahem melanopsinu k pupilárnímu reflexu, je protrahovaná kontrakce zornice po vypnutí stimulu (Postillumination Pupil Response, PIRP). Ve srovnání s jasným, červeným stimulem probíhá redilatace zornice po ukončení modrého stimulu o vysoké intenzitě opožděně v důsledku protrahované elektrické aktivity gangliových buněk sítnice obsahujících melanopsin [18]. Bylo prokázáno, že u pacientů s glaukomem se s progresí onemocnění parametr PIRP zkracuje, což potvrzuje úbytek gangliových buněk sítnice u tohoto onemocnění [19,20].
Současné vyšetřovací metody, které hodnotí zrakové funkce, jsou převážně metody subjektivní. Vyžadují dobrou spolupráci pacienta a nelze vyloučit fluktuaci výsledků. Naopak pupilometrie je metoda objektivní, protože pupilární reflex závisí na aktivních nervových spojeních mezi sítnicí a mozkovým kmenem a ty nemohou být pacientem ovlivněny. Na základě dosavadních výsledků se chromatická pupilografie jeví jako vysoce citlivá metoda, jež dokáže objektivně zhodnotit funkci jednotlivých populací fotosenzitivních buněk sítnice. To může být velmi výhodné při hodnocení progrese onemocnění nebo přínosu léčby. Jako přínosné se jeví zejména její využití při vyšetřování pacientů s degenerativním onemocněním sítnice či při kvantifikaci přínosu nových léčebných postupů u pacientů zařazených do experimentálních studií. Pomocí našeho vyšetřovacího protokolu bylo možné vysledovat u zdravých osob rozdíly v parametrech pupilární reakce na červené a modré světlo, a potvrdit tak podíl gangliových buněk sítnice s obsahem melanopsinu na pupilární reakci. V další studii plánujeme aplikovat náš protokol pro srovnání parametrů pupilární reakce mezi souborem zdravých osob a pacienty s onemocněním sítnice a zrakové dráhy.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Karolína Skorkovská, Ph.D.
Klinika nemocí očních a optometrie
LF MU a FN u sv. Anny v Brně Pekařská 53
656 91 Brno
e-mail: skorka@centrum.cz
Přijato k recenzi: 11. 11. 2013
Přijato do tisku: 17. 1. 2014
Zdroje
1. Provencio I, Rodriguez IR, Jiang G, Hayes WP, Moreira EF, Rollag MD. A novel human opsin in the inner retina. J Neurosci 2000; 20(2): 600 – 605.
2. Hattar S, Liao HW, Takao M, Berson DM, Yau KW. Melanopsin‑containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity. Science 2002; 295(5557): 1065 – 1070.
3. Hattar S, Lucas RJ, Mrosovsky N, Thompson S, Douglas RH, Hankins MW et al. Melanopsin and rod ‑ cone photoreceptive systems account for all major accessory visual functions in mice. Nature 2003; 424(6944): 76 – 81.
4. Lucas RJ, Hattar S, Takao M, Berson DM, Foster RG, Yau KW. Diminished pupillary light reflex at high irradiances in melanopsin knockout mice. Science 2003; 299(5604): 245 – 247.
5. Kawasaki A, Kardon RH. Intrinsically photosensitive retinal ganglion cells. J Neuroophthalmol 2007; 27(3): 195 – 204.
6. Wilhelm BJ. Das Auge der Inneren Uhr – Pupillenforschung in neuem Licht. Klin Monatsbl Augenheilkd 2010; 227(11): 840 – 844. doi: 10.1055/ s ‑ 0029 – 1245658.
7. Kardon R, Anderson SC, Damarjian TG, Grace EM, Stone E, Kawasaki A. Chromatic pupil responses: preferential activation of the melanopsin‑mediated versus outer photoreceptor ‑ mediated pupil light reflex. Ophthalmology 2009; 116(8): 1564 – 1573. doi: 10.1016/ j.ophtha.2009.02.007.
8. Park JC, Moura AL, Raza AS, Rhee DW, Kardon RH, Hood DC. Toward a clinical protocol for assessing rod, cone, and melanopsin contributions to the human pupil response. Invest Ophthalmol Vis Sci 2011; 52(9): 6624 – 6635. doi: 10.1167/ iovs.11 – 7586.
9. Kardon RH, Anderson SC, Damarjian TG, Grace EM,Stone E, Kawasaki A. Chromatic pupillometry in patients with retinitis pigmentosa. Ophthalmology 2011; 118(2): 376 – 381. doi: 10.1016/ j.ophtha.2010.06.033.
10. Lorenz B, Strohmayr E, Zahn S, Friedburg C, Kramer M, Preising M et al. Chromatic pupillometry dissects function of the three different light ‑ sensitive retinal cell populations in RPE65 deficiency. Invest Ophthalmol Vis Sci 2012; 53(9): 5641 – 5652. doi: 10.1167/ iovs.12 – 9974.
11. Kawasaki A, Crippa SV, Kardon R, Leon L, Hamel C. Characterization of pupil responses to blue and red light stimuli in autosomal dominant retinitis pigmentosa due to NR2E3 mutation. Invest Ophthalmol Vis Sci 2012; 53(9): 5562 – 5569. doi: 10.1167/ iovs.12 – 10230.
12. Lucas RJ, Douglas RH, Foster RG. Characterization of an ocular photopigment capable of driving pupillary constriction in mice. Nat Neurosci 2001; 4(6): 621 – 626.
13. Berson DM, Dunn FA, Takao M. Phototransduction by retinal ganglion cells that set the circadian clock. Science 2002; 295(5557): 1070 – 1073.
14. Panda S, Provencio I, Tu DC, Pires SS, Rollag MD,Castrucci AM et al. Melanopsin is required for non‑image ‑ forming photic responses in blind mice. Science 2003; 301(5632): 525 – 527.
15. Dacey DM, Liao HW, Peterson BB, Robinson FR,Smith VC, Pokorny J et al. Melanopsin‑expressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature 2005; 433(7027): 749 – 754.
16. Gamlin PD, McDougal DH, Pokorny J, Smith VC, Yau KW, Dacey DM. Human and macaque pupil responses driven by melanopsin‑containing retinal ganglion cells. Vision Res 2007; 47(7): 946 – 954.
17. McDougal DH, Gamlin PD. The influence of intrinsically photosensitive retinal ganglion cells on the spectral sensitivity and response dynamics of the human pupillary light reflex. Vision Res 2010; 50(1): 72 – 87. doi: 10.1016/ j.visres.2009.10.012.
18. Kankipati L, Girkin CA, Gamlin PD. Post‑illumination pupil response in subjects without ocular disease. Invest Ophthalmol Vis Sci 2010; 51(5): 2764 – 2769. doi: 10.1167/ iovs.09 – 4717
19. Feigl B, Mattes D, Thomas R, Zele AJ. Intrinsically photosensitive (melanopsin) retinal ganglion cell function in glaucoma. Invest Ophthalmol Vis Sci 2011; 52(7): 4362 – 4367. doi: 10.1167/ iovs.10 – 7069.
20. Kankipati L, Girkin CA, Gamlin PD. The post‑illumination pupil response is reduced in glaucoma patients. Invest Ophthalmol Vis Sci 2011; 52(5): 2287 – 2292.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2014 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
-
Komentář ke článku autorů Kotase a Polívky
Přehled méně častých primárních bolestí hlavy - Spasticita po iktu jako projev maladaptivní plasticity a její ovlivnění botulotoxinem
- Méně obvyklé indikace hluboké mozkové stimulace
- Projekt ncRNAPain
- Fluorescencí navigovaná resekce vysokostupňových gliomů mozku
- Neurologické hypotézy u panické poruchy
- Účinky intoxikace metanolem na kognitivní funkce
- Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení
-
Komentář ke článku autorů Mrliana, Ďuriše, Neumana, Vybíhala a Smrčky
Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení - Pupilární reakce na barevné podněty
- Klíšťová encefalitida, průběh a komplikace – naše poznatky z let 2009– 2012
- Naše zkušenosti s mobilní náhradou krčního disku Mobi‑ C – výsledky studie s intervalem sledování pět let
- Neuromodulace sakrálních nervů při řešení inkontinence stolice
- Kombinovaný paramediánní supracerebellární‑ transtentoriální a miniinvazivní subokcipitální přístup při resekci gliomu celé délky mediobazální temporální oblasti
- Selektivní denervace karpu při řešení artrotického postižení zápěstí
- Flekční cervikální myelopatie (Hirayamova choroba) – skutečnost, nebo mýtus? Dvě kazuistiky
- Simultánní výskyt leptomeningeálních a intramedulárních metastáz glioblastoma multiforme – kazuistika
- Blister aneuryzma arteria carotis interna – kazuistika a přehled literatury
- Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014
- Prof. Josef Vymazal starší – in memoriam
- Webové okénko
- Recenze knih
-
Analýza dat v neurologii
XLV. Grafy usnadňující studium zavádějících faktorů v asociačních studiích – III. Spojitá data
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
- Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014
- Neurologické hypotézy u panické poruchy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



