-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCytomegalovirové infekce v intenzivní péči: léčit, nebo ignorovat?
Cytomegalovirus infection in intensive care. Treat or ignore them?
Cytomegalovirus (CMV) reactivation, infection and associated organ dysfunction in immunocompetent critically ill patients is getting into the intensivists’ focus. Although the causal relationship between CMV reactivation and unfavorable outcomes has not been confirmed yet, observational evidence suggests a strong association with higher mortality, prolonged organ support and length-of-stay in intensive care. In addition to these relatively direct consequences, affected patients are more susceptible to the development of nosocomial infections, potentially as a result of complex immunomodulation of the host caused by CMV reactivation. Epidemiology, pathophysiology, clinical manifestation, treatment and prevention of selected herpesviruses in the immunocompetent patients are summarized in the presented review.
KEYWORDS:
cytomegalovirus – infection – immunocompetency – intensive care
Autoři: T. Karvunidis 1,2; T. Reischig 1,2; M. Matějovič 1,2
Působiště autorů: I. interní klinika, Lékařská fakulta v Plzni, Univerzita Karlova a Fakultní nemocnice Plzeň 1; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova 2
Vyšlo v časopise: Anest. intenziv. Med., 29, 2018, č. 5, s. 275-282
Kategorie: Intenzivní medicína - Přehledný článek
Souhrn
Reaktivace cytomegaloviru (CMV), případně infekce a orgánové dysfunkce jím způsobené u imunokompetentních kriticky nemocných, se dostávají do popředí zájmu intenzivistů. Kauzální souvislost mezi CMV reaktivací a vyšší mortalitou, protrahovanou potřebou orgánových náhrad a délkou hospitalizace v intenzivní péči nebyla dosud potvrzena. Kromě těchto relativně přímých konsekvencí jsou tito nemocní současně více ohrožení nozokomiálními infekcemi v důsledku komplexní imunomodulace způsobené virovou reaktivací. Aktuální poznatky z epidemiologie, patofyziologie, klinických projevů, léčby a prevence CMV u imunokompetentních nemocných jsou shrnuty v tomto přehledovém článku.
klíčová slova
cytomegalovirus – infekce – imunokompetence – intenzivní péče
ÚVOD
Cytomegalovirová (CMV) infekce je již dlouhou dobu známým a významným problémem imunokompromitovaných nemocných. Je důležitou příčinou morbidity a mortality zejména nemocných po orgánových transplantacích, transplantaci kostní dřeně a jedinců s HIV/AIDS či léčených imunosupresivy/chemoterapeutiky nebo biologickou, resp. cílenou („targeted“) léčbou [1].
Stále častěji je však problematika CMV infekce diskutována také v souvislosti s imunokompetentními kriticky nemocnými bez ohledu na primární příčinu kritického stonání (trauma, infekce, popáleniny aj.) [2, 3]. Několik studií ukázalo možnou asociaci mezi CMV infekcí a vyšší mortalitou, delší dobou hospitalizace, delší potřebou umělé plicní ventilace (UPV) a vyšší incidencí nozokomiálních infekcí v této populaci nemocných [3–5]. Je ovšem potřeba zdůraznit, že tato data nejsou konzistentní a přímá asociace, resp. kauzalita, není zcela zjevná [6, 7].
Cílem této přehledové práce je sumarizovat aktuální poznatky z patofyziologie interakce CMV a hostitele v souvislosti s kritickým onemocněním, komentovat diagnostické postupy a diskutovat vhodnou léčbu, prevenci a indikace k nim včetně jejich důležitého načasování.
ZÁKLADNÍ FAKTA
Cytomegalovirus (CMV) je prototypickým představitelem β-herpetických virů. Se svými 230 kb genomické DNA patří mezi největší a nejkomplexnější známé lidské viry.
CMV primoinfekce je velmi častá; epidemiologická data ukazují séroprevalenci od 30 % do > 90 % v dospělé populaci [8]. Přenos infekce je možný horizontálně i vertikálně, vektorem je člověk. Primoinfekce je nejčastější v dětství či adolescenci a u imunokompetentních jedinců probíhá většinou asymptomaticky či pouze s mírnými a tranzitorními příznaky nespecifického virového onemocnění. Po rezoluci akutní infekce přechází CMV do latentní fáze, která je charakterizována perzistencí jeho genomické DNA v buňkách zejména myeloidní řady hostitele. Virovou DNA lze detekovat v monocytech, dendritických buňkách (dendritic cells, DC), ale také megakaryocytech a myeloidních progenitorových buňkách (CD34+) v kostní dřeni [9]. V této fázi standardně nedochází k replikaci virové DNA a syntéze virových proteinů. Nicméně za určitých okolností dochází přeci jen k replikaci virionů na hranicích detekčních limitů současných diagnostických metod. Tato subklinická produkce („latent replication“, „shedding“) je vázána na konkrétní buněčné typy – permisivními jsou zejména diferencované makrofágy a nezralé DC. Latentní fáze je charakterizována přítomností specifických anti-CMV IgG (séropozitivita). Za určitých okolností – obecně při jakékoliv alteraci imunitního dohledu – dochází k reaktivaci, zahájení intracelulární replikace viru a syntéze virionů. Hovoříme o endogenní reaktivaci CMV; při morfologickém či funkčním postižení orgánů a tkání pak o CMV nemoci. Definice a nomenklatura CMV interakcí s hostitelem jsou shrnuty v tab. 1.
Tab. 1. Nomenklatura a definice CMV interakce s hostitelem 
Kritické onemocnění víceméně jakékoliv etiologie (infekce, trauma, popáleniny atd.) může vést k významné imunoalteraci [10, 11]. Prevalence aktivní CMV infekce u imunokompetentních nemocných v intenzivní péči (IP) dosahuje 17–36 % [12]. Vyšší je zejména u séropozitivních jedinců, pacientů se sepsí či septickým šokem, multiorgánovým postižením (vyšším rizikovým skóre) a vyžadujících IP déle než 5 dní [12]. Téměř dvojnásobná incidence CMV infekce u septických nemocných je vysvětlitelná významnou mírou zmíněné imunoalterace/imunosuprese těchto pacientů [10, 11]. Nejvíce reaktivací se odehrává 7–28 dní od začátku kritického stonání [2]. Detekovaná prevalence se bude samozřejmě lišit i dle použité diagnostické metody (viz níže). Rizikové faktory CMV infekce jsou shrnuty v tab. 2.
Tab. 2. Rizikové faktory endogenní CMV reaktivace imunokompetentních kriticky nemocných (upraveno dle [31]) ![Rizikové faktory endogenní CMV reaktivace imunokompetentních kriticky nemocných (upraveno dle [31])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/a49f4e8e241e2135201b896ef03a0a86.png)
Klinická manifestace CMV infekce závisí na konkrétní klinické situaci. CMV asociované orgánové či tkáňové postižení (CMV nemoc) je nejčastější u imunokompromitovaných nemocných. U běžné populace premorbidně imunokompetentních kriticky nemocných jsou projevy CMV infekce/nemoci spíše nespecifické [13]. Relativně častou může být i myelosuprese, nejčastěji manifestovaná trombocytopenií, méně často pak neutropenií. Dalšími projevy může být hemolytická anémie, koagulopatie či trombotické komplikace. Relativně málo častá jsou pak orgánová postižení charakteru pneumonitidy, hepatitidy, gastroenteritidy, kolitidy, retinitidy či meningoencefalitidy. Raritní bývá CMV myokarditida [14, 15].
VIRTUÓZ IMUNOMODULACE
Iniciální kontakt hostitele s CMV spouští komplexní imunitní odpověď. Role vrozené imunity je klíčová zejména ve správné aktivaci mechanismů imunity adaptivní. Nicméně časná kontrola a limitace virové expanze je samozřejmě nezbytná, je zajištěna zejména působením interferonů a profesionálních antigen prezentujících buněk (antigen-presenting cells, APC). Pro kontrolu CMV replikace je nezbytná precizní adaptivní T-lymfocytární (vč. NK buněk) odpověď. Až > 10 % všech cirkulujících T-lymfocytů (TC) zajišťuje imunitní dohled nad CMV u séropozitivních jedinců [16]. Tento počet (CMV-specifická frakce TC) se s věkem ještě dále zvyšuje. Existují hypotézy dávající do souvislosti trvalou stimulaci imunitního systému dohledem nad replikací CMV s jeho exhauscí a změnami vedoucími k jeho dysfunkci a stárnutí (imunosenescence) [17, 18].
Miliony let evoluce vedly k vytvoření a selekci celé řady mechanismů, které umožňují udržení delikátního a po většinu času relativně benigního vztahu CMV s hostitelem. Virová DNA kóduje proteiny indukující apoptózu vybraných imunokompetentních buněk, modulaci odpovědi NK buněk, alteraci prezentace CMV epitopů antigen prezentujícími buňkami T-lymfocytům [19–21]. CMV produkuje také celou řadu chemokinů, chemokinových receptorů a cytokinů, které se podílejí na úniku před imunitním systémem hostitele. Příkladem může být cmvIL-10 (CMV interleukin-10), který je pouze z 27 % identický s lidským IL-10, ale i přesto se váže na stejný specifický receptor, a spouští tak signalizační kaskádu vedoucí k potlačení imunitní odpovědi [22]. Inhibuje proliferaci mononukleárů a jejich produkci cytokinů, dále také potlačuje maturaci dendritických buněk a současně stimuluje jejich apoptózu. Selektivně ovlivňuje migraci imunokompetentních buněk – inhibice migrace lymfocytů umožňuje viru uniknout destrukci a současná potenciace migrace myeloidních elementů napomáhá šíření viru v organismu hostitele [23, 24]. Vybrané mechanismy CMV indukované imunomodulace shrnuje tab. 3.
Tab. 3. Mechanismy CMV indukované imunomodulace 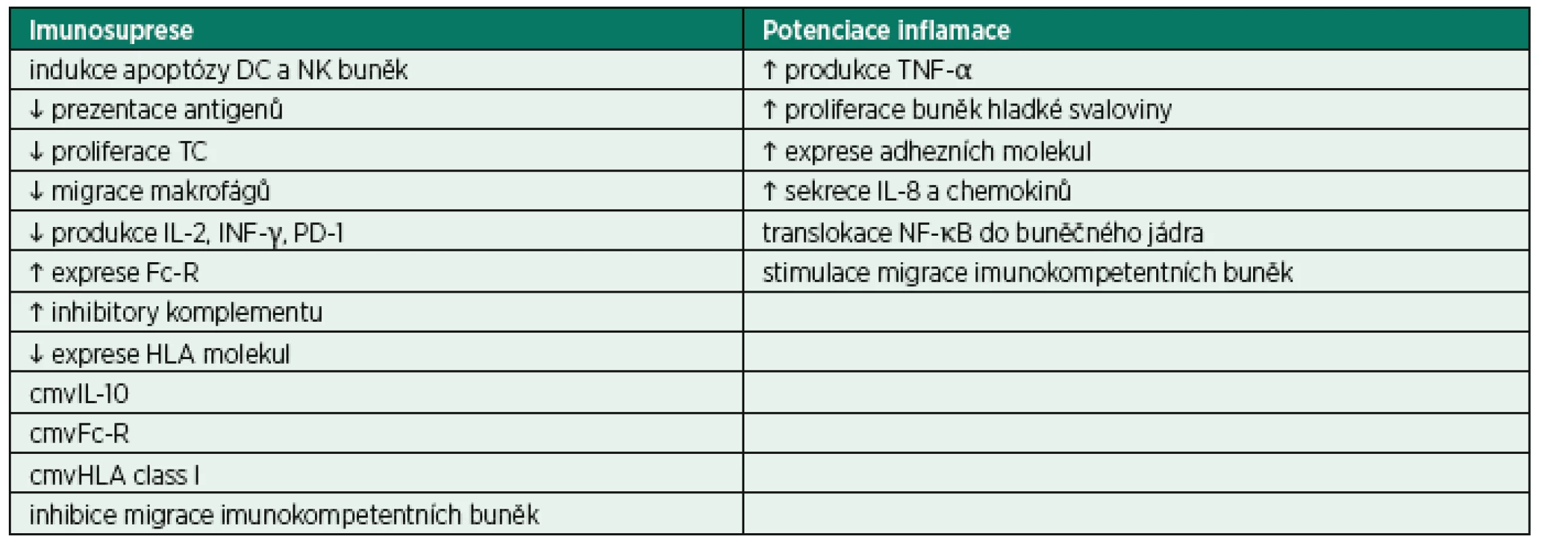
DC – dendritické buňky; NK – natural killer buňky; TC – T-lymfocyty; IL-2 – interleukin-2; INF-γ – interferon γ; PD-1 – programmed cell death-1 molekula; Fc-R – Fc receptor; HLA – lidské leukocytární antigeny; cmvIL-10 – CMV interleukin-10; cmvFc-R – CMV Fc receptor; cmvHLA class I – CMV HLA 1. třídy; TNF-α – tumor nekrotizující faktor α; IL-8 – interleukin 8; NF-κB – nukleární faktor kappa B VINÍK, PŘIHLÍŽEJÍCÍ ČI ŠEDÁ EMINENCE?
Asociace mezi CMV infekcí a mortalitou kriticky nemocných je literárně doložena, kauzalita však není zcela jednoznačná. Literatura popisuje vyšší smrtnost těchto nemocných, delší dobu dependence na UPV i delší dobu hospitalizace v IP v porovnání s kohortou bez CMV infekce/reaktivace [2, 5, 12, 25]. Chybí však jednoznačný průkaz příčinné souvislosti [7].
Vzhledem k velmi delikátní rovnováze mezi CMV latencí a replikací vyžadující neustálý a precizní imunitní dohled hostitele lze o CMV reaktivaci uvažovat spíše jako o markeru imunoalterace [6, 26, 27]. Je například dokumentován tranzitorní pokles CMV specifických CD8+ T-lymfocytů i IgG v průběhu sepse, který může stát za ztrátou kontroly nad CMV replikací [27, 28].
Vedle přímých důsledků CMV reaktivace/infekce (orgánové a tkáňové postižení) jsou neméně důležitými i ty nepřímé. CMV navozená imunomodulace, jejíž součástí je i potlačení funkcí DC a NK buněk, může sekundárně vést k vyšší náchylnosti k bakteriálním a mykotickým nozokomiálním infekcím a v důsledku ke všem nepříznivým konsekvencím (prodloužení doby na UPV, prodloužení doby hospitalizace, zvýšení mortality apod.). CMV indukuje produkci potentních proinflamatorních mediátorů, a tak může současně docházet k modifikaci, respektive potenciaci již probíhající zánětlivé odpovědi hostitele, což opět vede k popsaným nepříznivým následkům [29].
DIAGNOSTIKA
Imunitní systém imunokompetentních kriticky nemocných velmi dynamicky interaguje s CMV a minimálně v úvodu hospitalizace je schopen kontrolovat replikaci viru. Pokud není CMV primoinfekce či reaktivace důvodem kritického stavu, a tedy i přijetí do IP, není obecně potřeba podnikat aktivní kroky v detekci CMV. V těchto případech nelze téměř jistě očekávat pozitivní výsledky minimálně v prvních 3–5 dnech [2, 25, 30]. Takto časně lze zvážit pouze potřebu sérologického screeningu – stanovení CMV specifických IgG protilátek – k identifikaci séropozitivní skupiny nemocných, tedy těch v potenciálním riziku pozdější endogenní reaktivace viru.
Sérologické vyšetření je stále nejčastější diagnostickou modalitou. Stanovení CMV specifických IgM protilátek, nejčastěji metodou enzymatické imonoeseje (enzyme-linked immune assay, ELISA), umožňuje identifikovat jedince s akutní CMV infekcí. Pozitivita anti-CMV IgM přetrvává 4–6 měsíců a je dále vystřídána pozitivitou anti-CMV protilátek třídy IgG, která je dlouhodobá. Obecnou nevýhodou sérologických testů je jejich malá senzitivita a specificita. Řídit léčbu na základě jejich výsledků nelze doporučit [31]. Zvláště kriticky nemocní mohou, jak již bylo zmíněno výše, v průběhu svého stonání procházet imunoparalýzou (anergií) s limitací imunitní odpovědi, a tedy i tvorby protilátek. Negativní výsledek sérologie tedy nevylučuje probíhající CMV replikaci, resp. infekci.
Přímá detekce virové DNA v biologických materiálech (plná krev, krevní plazma, tracheální aspirát, bronchoalveolární laváž aj.) pomocí polymerázové řetězové reakce (polymerase chain reaction, PCR) – CMV PCR – je v současné době pro svou vysokou senzitivitu a specificitu považována za zlatý standard v diagnostice CMV reaktivace. Umožňuje kvalitativní i kvantitativní zhodnocení, přičemž přesné stanovení virové nálože (v kopiích virové DNA či mezinárodních jednotkách – IU – v jednotce objemu vzorku) by mělo být jednoznačně preferováno, jelikož nám poskytuje i možnost sledovat dynamiku replikace viru, a rozhodnout se tak k případnému zahájení léčby. Přesné stanovení míry replikace viru může mít i prognostický význam [2]. Přibližně 20 % vyšetřovaných nemocných má virémii > 1 000 kopií/ml. Nejčastěji vyšetřovanými a preferovanými biologickými vzorky jsou plná krev a krevní plazma (DNAémie). Vyšetření z plné krve v porovnání s plazmou umožňuje detekovat i intracelulární virovou nálož [32]. Výsledky získané z těchto dvou odlišných biologických materiálů nejsou tedy porovnatelné; plazmatická viremie je přibližně 5–10krát nižší.
T-lymfocyty a NK buňky hrají klíčovou roli v kontrole CMV reaktivace [33, 34]. V tomto ohledu může být vyšetření funkcí T-lymfocytů přínosné ve smyslu stanovení pravděpodobnosti reaktivace viru zejména u rizikových nemocných [35, 36]. I u imunokompetentních kriticky nemocných byla dokumentována asociace mezi zachovanou funkcí CMV-specifických CD8+ T-lymfocytů hodnocenou mírou stimulované sekrece interferonu γ (INFγ) a ochranou před reaktivací CMV [37]. Tento princip buňkami zprostředkované imunitní odpovědi je podstatou i komerčně dostupného vyšetření QuantiFERON-CMV® (Qiagen, Melbourne, Austrálie). Při tomto vyšetření jsou in vitro směsí 22 CMV-peptidů nepřímo (cestou antigen prezentujících buněk) stimulovány CMV-specifické CD8+ T-lymfocyty buněk k produkci INFγ. Hladina INFγ je následně stanovena pomocí ELISA. Nedílnou součástí vyšetření je i negativní (voda) a pozitivní (mitogen – fytohemaglutinin) kontrola. Nízká produkce INFγ svědčí pro deficit zmíněné buněčné imunity, a tedy i potenciálně zvýšené riziko ztráty dohledu imunitního systému nad replikací CMV.
Detekce CMV antigenu pp65 (CMV antigenémie) v leukocytech pomocí imunofluorescence specifických protilátek je senzitivitou i specificitou relativně srovnatelná s přímým průkazem virové DNA. Toto vyšetření však selhává v případě leukocytopenie [38].
Kultivační vyšetření má výhodu vysoce specifické detekce viru v nejrůznějších biologických materiálech, je nicméně velmi zdlouhavé a pracné a rovněž jeho senzitivita je v porovnání s výše uvedenými nízká [31].
Histopatologické vyšetření je nejspecifičtějším vyšetřením a konfirmuje přímé postižení tkání (CMV nemoc). Je nezbytné (a diagnostické) například v diagnostice CMV kolitidy, při které nekoreluje DNAémie s tkáňovým poškozením [39, 40]. Toto vyšetření je závislé na kvalitě odběru a přípravy bioptického vzorku, zkušenostech patologa, je invazivní a jeho senzitivita je nižší [31].
Nedílnou součástí v diagnostice CMV je vyšetření krevního obrazu s diferenciálním rozpočtem leukocytů. Toto základní a běžné vyšetření může jednoduše odhalit patologii v počtu základních elementů leukocytární řady a s tím související riziko imunosuprese, a tedy i reaktivace CMV. Elektivní pak může být flowcytometrická analýza lymfocytů, která sofistikovaněji prokazuje možné početní deficity v lymfocytární řadě včetně NK buněk.
Samozřejmě jako v mnoha jiných situacích je vždy výhodou sledování trendu výsledků vyšetření. Navrhovaný diagnostický a rozhodovací algoritmus vedoucí k případnému zahájení CMV specifické léčby je zobrazen na obr. 1.
LÉČBA A PREVENCE
Pro léčbu a prevenci imunokompromitovaných nemocných v riziku CMV infekce existují v současné době respektovaná doporučení [38, 41, 42]. Obdobně lze doporučit zahájení léčby „imunokompetentních“ kriticky nemocných s klinicky konfirmovanou CMV nemocí (signifikantní virová nálož detekovaná CMV PCR či CMV-pp65 antigenémií a současně přítomnost klinických známek orgánového/tkáňového postižení při vyloučení jiné příčiny). V těchto situacích velmi pravděpodobně převažují benefity léčby nad jejími riziky [43].
Otázka preemptivní léčby subklinické CMV replikace/reaktivace bez prokázaného či velmi pravděpodobného přímého orgánového/tkáňového postižení „imunokompetentních“ kriticky nemocných či preventivní léčby vybrané skupiny jedinců v riziku rozvoje CMV nemoci je však velmi kontroverzní. Informace o prospěchu (ve smyslu lepšího výstupu pro nemocné) plynoucí z dosavadních studií nejsou jednoznačné [44, 45]. Například recentní randomizovaná a placebem kontrolovaná studie neprokázala pozitivní efekt profylaktické léčby ganciklovirem (hladiny IL-6, mortalita, délka UPV, délka hospitalizace v IP, sekundární bakteriemie či fungemie), a to i přes signifikantní redukci CMV reaktivací (plazmatická DNAémie) [46]. I další recentní studie neprokázala jednoznačný benefit profylaktické léčby, v tomto případě nízké dávky gancikloviru, resp. valgancikloviru. Profylaxe valaciklovirem byla pak spojena s vyšší mortalitou, byť kauzalita není jasná [47].
Moderní diagnostické metody (CMV PCR a CMV antigenémie) jsou velmi cenné v detekci virové reaktivace. Díky své vysoké citlivosti však nedokážou v některých situacích odlišit klinicky nevýznamnou „latentní replikaci“ virové DNA či produkci virových antigenů („shedding“).
Z výše diskutovaných poznatků z patofyziologie interakce CMV a hostitele plyne logická úvaha o snaze primárně zabránit reaktivaci CMV u séropozitivních kriticky nemocných. Lze mluvit o oprávněné obavě z nepříznivé imunomodulace následně vedoucí k nozokomiálním infekcím a protrahované intenzivní péči. Na druhou stranu je potřeba mít také na paměti významnou toxicitu (nefrotoxicitu, myelotoxicitu) virostatické léčby, zejména v populaci kriticky nemocných s orgánovými dysfunkcemi (tab. 4). Dalším důvodem k určité zdrženlivosti v léčbě je možnost vzniku rezistence CMV k virostatikům [45]. Recentní souhrnná práce Papaziana et al. doporučuje zahájení kurativní virostatické léčby pouze v případech pozitivní detekce virové replikace (CMV-PCR/CMV-antigenémie) a současně jasných klinických projevů virové infekce (primární plicní infiltráty) a nejméně dvou rizikových faktorů (leukocytopenie, hemofagocytóza, absence detekce bakteriálního/mykotického agens, UPV > 2 týdny, horečka, průjem, významná elevace bilirubinu, významná elevace jaterních enzymů) [7]. V současné době neexistují jasná doporučení k rozlišení, u kterých kriticky nemocných provádět screening CMV reaktivace. Dle dostupné literatury jsou určité populace těchto nemocných ve vysokém riziku reaktivace CMV a rozvoje CMV nemoci. Mezi tyto jedince patří zejména pacienti se sepsí, resp. septickým šokem, popáleninami, traumaty, nozokomiálními infekcemi, dlouhodobě ventilovaní, s jinak nevysvětlitelným poškozením jater, horečkou či dysfunkcí trávicího traktu [7, 48, 49]. U těchto nemocných lze doporučit vyšetření CMV-PCR či CMV-antigenémie, ne však dříve než pátý den hospitalizace v IP (viz výše; obr. 1). Samozřejmě je mnohem lepší tento screening opakovat (např. s jednotýdenním odstupem) k posouzení dynamiky výsledků. Významná progrese CMV DNAémie či CMV-antigenémie či jednotlivý výsledek prokazující extrémní virovou nálož (DNAémie > cca 10 000 kopií/ml) je pak vodítkem k zahájení preemptivní virostatické léčby i bez průkazu CMV-asociovaného orgánového postižení. Pomocným vyšetřením v rozhodovacím algoritmu může být také QuantiFERON-CMV® (viz výše; obr. 1).
Tab. 4. Vybraná CMV virostatická léčba, mechanismus účinku, obvyklé dávkování a vybrané nežádoucí účinky (upraveno dle [31]) ![Vybraná CMV virostatická léčba, mechanismus účinku, obvyklé dávkování a vybrané nežádoucí účinky (upraveno dle [31])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/eca7193189fc694c525a6acd00963db3.png)
*Detailní informace o dávkování jsou k dispozici v příbalových letácích jednotlivých léků Kontrolní vyšetření DNAémie (při/po léčbě či při sledování dynamiky před rozhodnutím o zahájení léčby) lze doporučit v 5–7denních intervalech, jelikož poločas CMV DNA v plazmě/krvi je přibližně 3–8 dní [50]. Vyšetření v kratším intervalu nemusí být validní. Virová nálož může být totiž stejná, či dokonce vyšší než při vstupním stanovení (probíhající replikace viru > clearance viru), a výsledek tak může být chybně interpretován jako selhání léčby. Nicméně kontrola DNAémie v adekvátních intervalech je nezbytná ke sledování úspěšnosti léčby – perzistující či stoupající virová nálož může vypovídat o případné rezistenci viru ke zvolenému virostatiku.
Tab. 4 sumarizuje aktuální doporučenou dostupnou léčbu CMV včetně doporučeného dávkování, přičemž ganciklovir je v současnosti považován za lék první volby, samozřejmě při respektování jeho kontraindikací či znalosti rezistence.
Na základě dostupných informací a empirických zkušeností s léčbou rizikových skupin nemocných je obecná strategie pracoviště autorů následující (viz též obr. 1):
Obr. 1. Diagnostický a rozhodovací algoritmus 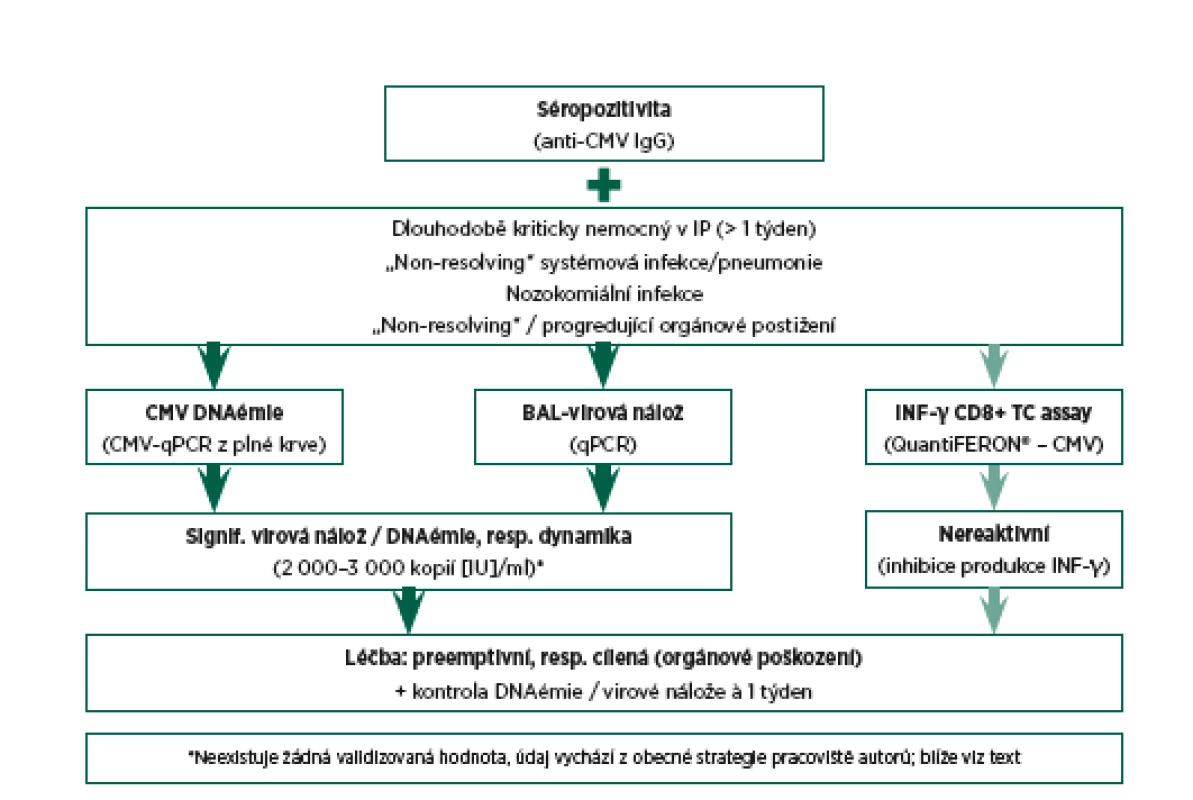
- U neprospívajících rizikových kriticky nemocných je vyšetřena DNAémie, případně i virová nálož z bronchoalveolární laváže (BAL).
- Při detekci signifikantní virové nálože (přibližně 2 000–3 000 kopií, resp. IU/ml) a perzistenci či progresi klinického stavu je provedeno kontrolní vyšetření CMV-PCR s odstupem 5–7 dnů.
- Další vzestup virové nálože dokumentovaný tímto kontrolním vyšetřením je pak indikací k zahájení virostatické léčby (ganciklovir), samozřejmě při respektování kontraindikací.
Tato strategie je vždy přizpůsobena konkrétnímu nemocnému a průběhu stonání. U nemocných s významným podezřením na orgánové poškození způsobené virem (a v dané chvíli nevysvětlitelné jinou příčinou) je virostatická léčba zahájena v řadě případů již po první detekci signifikantní virové nálože.
ZÁVĚR
Cytomegalovirové infekce imunokompetentních kriticky nemocných nejsou ve světle současných diagnostických možností již ničím vzácným. Endogenní reaktivaci CMV, resp. CMV infekci lze na podkladě aktuálních poznatků považovat u této skupiny nemocných za rizikový faktor možného nepříznivého průběhu stonání a známku imunoalterace, imunosuprese. Přestože není možné na otázku v názvu tohoto článku odpovědět zcela jednoznačně, nelze jistě problematiku CMV infekcí u kriticky nemocných ignorovat. S ohledem na vše výše uvedené je vhodné po případné CMV reaktivaci/infekci aktivně pátrat u (CMV séropozitivních) nemocných, kteří vyžadují déletrvající intenzivní péči (> 5–7 dní) a jejich stav se navzdory adekvátní léčbě nelepší. Indikace k léčbě CMV infekce by měla být vždy přísně individuální, respektovat její tíži (CMV infekce vs. CMV nemoc), stav nemocného a rizika nežádoucích účinků léčby.
Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli a souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Podíl autorů na vytvoření článku:
KT: 70 %
RT: 10 %
MM: 20 %
Financování: 1. Program rozvoje vědních oborů Univerzity Karlovy (PROGRES – projekt Q39), 2. Projekt CZ.02.1.01/0.0/0.0/16_019/0000787, Centrum výzkumu infekčních onemocnění, udělený MŠMT, financovaný EFRR, 3. Projekt institucionálního výzkumu MZČR – FNPl 00669806.
Do redakce došlo dne 31. 5. 2018.
Do tisku přijato dne 4. 9. 2018.
Adresa pro korespondenci:
MUDr. Thomas Karvunidis, Ph. D.
Zdroje
1. Ljungman P, Boeckh M, Hirsch HH, et al. Definitions of cytomegalovirus infection and disease in transplant patients for use in clinical trials. Clin Infect Dis. 2017;64 : 87–91.
2. Limaye AP, Kirby KA, Rubenfeld GD, et al. Cytomegalovirus reactivation in critically ill immunocompetent patients. JAMA. 2008;300 : 413–422.
3. Ziemann M, Sedemund-Adib B, Reiland P, et al. Increased mortality in long-term intensive care patients with active cytomegalovirus infection. 2008;36 : 3145–3150.
4. Sinclair J. Human cytomegalovirus: latency and reactivation in the myeloid lineage. J Clin Virol. 2008;41 : 180–185.
5. Ong DSY, Spitoni C, Klein Klouwenberg PMC, et al. Cytomegalovirus reactivation and mortality in patients with acute respiratory distress syndrome. Intensive Care Med. 2016;42 : 333–341.
6. Mansfield S, Griessl M, Gutknecht M, et al. Sepsis and cytomegalovirus: foes or conspirators? Med Microbiol Immunol. 2015;204 : 431–437.
7. Papazian L, Hraiech S, Lehingue S, et al. Cytomegalovirus reactivation in ICU patients. Intensive Care Med. 2016;42 : 28–37.
8. Bate SL, Dollar SC, Cannon MJ. Cytomegalovirus seroprevalence in the United States: the national health and nutrition examination surveys, 1988–2004. Clin Infect Dis. 2010;50 : 1439–1447.
9. Gandhi MK, Khanna R. Human cytomegalovirus: clinical aspects, immune regulation, and emerging treatments. Lancet Infect Dis. 2004;4 : 725–738.
10. Xiao W, Mindrinos MN, Seok J, et al. A genomic storm in critically injured humans. J Exp Med. 2011;208 : 2581–2590.
11. Delano MJ, Ward PA. Sepsis-induced immune dysfunction: can immune therapies reduce mortality? J Clin Invest. 2016;126 : 23–31.
12. Kalil AC, Florescu DF. Prevalence and mortality associated with cytomegalovirus infection in nonimmunosuppressed patients in the intensive care unit. Crit Care Med. 2009;37 : 2350–2358.
13. Heininger A, Haeberle H, Fischer I, et al. Cytomegalovirus reactivation and associated outcome of critically ill patients with severe sepsis. Crit Care. 2011;15:R77.
14. Balthesen M, Messerle M, Reddehase MJ. Lungs are a major site of cytomegalovirus latency and recurrence. J Virol. 1993;67 : 5360–5366.
15. Toorkey CB, Carrigan DR. Immunohistochemical detection of an immediate early antigen of human cytomegalovirus in normal tissues. J Infect Dis. 1989;160 : 741–751.
16. Sylwester AW, Mitchell BL, Edgar JB, et al. Broadly targeted human cytomegalovirus-specific CD4+ and CD8+ T cells dominate the memory compartments of exposed subjects. J Exp Med. 2005;202 : 673–758.
17. Moss P. The emerging role of cytomegalovirus in driving immune senescence: a novel therapeutic opportunity for improving health in the eldery. Curr Opin Immunol. 2010;22 : 529–534.
18. Solana R, Tarazona R, Aiello AE. CMV and immunosenescence: from basics to clinics. Immun Ageing. 2012;9 : 23.
19. McCormic AL. Control of apoptosis by human cytomegalovirus. Curr Top Mircobiol Immunol. 2008;325 : 281–295.
20. Powers C, DeFilippis V, Malouli D, et al. Cytomegalovirus immune evasion. Curr Top Microbiol Immunol. 2008;325 : 333–359.
21. Wilkinson GW, Tomasec P, Stanton RJ, et al. Modulation of natural killer cells by human cytomegalovirus. J Clin Virol. 2008;41 : 206–212.
22. Slobedman B. Virus-encoded homologs of cellular interleukin-10 and their control of host immune response. J Virol. 2009;83 : 9618–9629.
23. Noda S, Aguirre SA, Bitmansour A, et al. Cytomegalovirus MCK-2 controls mobilization and recruitment of myeloid progenitor cells to facilitate dissemination. Blood. 2006;107 : 30–38.
24. Vomaske J, Melynchuk RM, Smith PP, et al. Differential ligand binding to a human cytomegalovirus chemokine receptor determines cell type-specific motility. PLoS Pathol. 2009;5:e1000304.
25. Osawa R, Singh N. Cytomegalovirus infection in critically ill patients: a systematic review. Crit Care. 2009;13:R68.
26. Seckert CK, Griessl M, Buettner JK, et al. Viral latency drives „memory inflation“: a unifying hypothesis linking two hallmarks cytomegalovirus infection. Med Microbiol Immunol. 2012;201 : 551–566.
27. Campbell J, Trgovcich J, Kincaid M. Transient CD8–memory contraction: a potential contributor to latent cytomegalovirus reactivation. J Leukoc Biol. 2012;92 : 933–937.
28. Vogel T, Vadonis R, Kuehn J, et al. Viral reactivation is not related to septic complications after major surgical resections. APMIS. 2008;116 : 292–301.
29. Frantzeskaki FG, Karampi ES, Kottaridi C, et al. Cytomegalovirus reactivation in a general, nonimmunosuppressed intensive care unit population: incidence, risk factors, associations with organ dysfunction, and inflammatory biomarkers. J Crit Care. 2015;30 : 276–81.
30. Kalil AC, Levitsky J, Lyden E, et al. Meta-analysis: the efficacy of strategiesto prevent organ disease by cytomegalovirus in solid organ transplant recipients. Ann Intern Med. 2005;143 : 870–880.
31. Al-Omari A, Aljamaan F, Alhazzani W, et al. Cytomegalovirus infection in immunocompetent critically ill adults: literature review. Ann Intensive Med. 2016;6 : 110.
32. Lisboa LF, Preiksaitis JK, Humar A, et al. Clinical utility of molecular surveillance for cytomegalovirus after antiviral prophylaxis in high-risk solid organ transplant recipients. Transplantation. 2011;92 : 1063–1068.
33. Crough T, Khanna R. Immunobiology of human cytomegalovirus: from bench to bedside. Clin Microbiol Rev. 2009;22 : 76–98.
34. Chiche L, Forel JM, Thomas G, et al. Interferon-γ production by natural killer cells and cytomegalovirus in critically ill patients. Crit Care Med. 2012;40 : 3162–3169.
35. Cantisán S, Lara R, Montejo M, et al. Pretransplant interferon-γ secretion by CMV-specific CD8+ T cells informs the risk of CMV replication after transplantation. Am J Transplant. 2013;13 : 738–745.
36. Mattes FM, Vargas A, Kopycinski J, et al. Functional impairment of cytomegalovirus specific CD8 T cells predicts high-level replication after renal transplantation. Am J Transplant. 2008;8 : 990–999.
37. Castón JJ, Catisán S, González-Gasca F, et al. Interferon-γ production by CMV-specific CD8+ T lymphocytes provides protection against cytomegalovirus reactivation in critically ill patients. Intensive Care Med. 2016;42 : 46–53.
38. Kotton CN, Kumar D, Caliendo AM, et al. Updated international consensus guidelines on the management of cytomegalovirus in solid-organ transplantation. Transplantation. 2013;96 : 330–360.
39. Durand CM, Marr KA, Arnold CA, et al. Detection of cytomegalovirus DNA in plasma as an adjunct diagnostic for gastrointestinal tract disease in kidney and liver transplant recipients. Clin Infect Dis. 2013;57 : 1550–1559.
40. Goodman AL, Murray CD, Watkins J, et al. CMV in the gut: a critical review of CMV detection in the immunocompetent host with colitis. Eur J Clin Microbiol Infect Dis. 2015;34 : 13–18.
41. Razonable RR, Humar A. Cytomegalovirus in solid organ transplantation. Am J Transplant. 2013;13 : 93–106.
42. Torre-Cisneros J, Aguado JM, Caston JJ, et al. Management of cytomegalovirus infection in solid organ transplantrecipients: SET/GESITRA-SEIMC/REIPI recommendations. Transplant Rev. 2016;30 : 119–143.
43. Fernández-Ruiz M, Munos-Codoceo C, López-Medrano F, et al. Cytomegalovirus myoperikarditis and hepatitis in an immunocompetent adult: successful treatment with oral valganciclovir. Intern Med. 2008;47 : 1963–1966.
44. Forel JM, Martin-Loeches I, Luyt CE. Treating HSV and CMV reactivations in critically ill patients who are not immunocompromized: pro. Intensive Care Med. 2014;40 : 1945–1949.
45. Chanques G, Jaber S. Treating HSV and CMV reactivations in critically ill patients who are not immunocompromized: con. Intensive Care Med. 2014;40 : 1950–1953.
46. Limaye AP, Stapleton RD, Peng L, et al. Effect of ganciclovir on IL-6 levels among cytomegalovirus-seropositive adults with critical illness: a randomized clinical trial. JAMA. 2017;318 : 731–740.
47. Cowley NJ, Owen A, Schiels SC, et al. Safety and efficacy of antiviral therapyfor prevention of cytomegalovirus reactivation in immunocompetent critically ill patients: a randomized clinical trial. JAMA Intern Med. 2017;177 : 774–783.
48. Chiche L, Forel JM, Roch A, et al. Active cytomegalovirus infection is common in mechanically ventilated medical intensive care unit patients. Crit Care Med. 2009;37 : 1850–1857.
49. Kalil AC, Florescu DF. Is cytomegalovirus reactivation increasing the mortality of patients with severe sepsis? Crit Care. 2011;15 : 138.
50. Humar A, Kumar D, Boivin G, et al. Cytomegalovirus (CMV) virus load kinetics to predict recurrent disease in solid-organ transplant patients with CMV disease. J Infect Dis. 2002;186 : 829–833.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Anestezie u popáleninČlánek Zajímavosti, tipy a triky
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2018 Číslo 5- Jak souvisí postcovidový syndrom s poškozením mozku?
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Použití plicnicového katétru na kardiochirurgických pracovištích v České a Slovenské republice – mezinárodní dotazníková studie
- Vliv infuzních roztoků na krevní srážlivost
- Co všechno vnese umělá inteligence do anesteziologie?
- Regionální anestezie k operacím kolene – periferní nervové blokády s minimálním dopadem na motorickou funkci dolní končetiny
- Uplatnění paliativní péče v oblasti intenzivní medicíny
- Perzistující pooperační bolest
- Cytomegalovirové infekce v intenzivní péči: léčit, nebo ignorovat?
- Diagnostika a léčba peripartálního život ohrožujícího krvácení - Česko-slovenský mezioborový konsenzus
- Kortikosteroidy v sepsi – definitivní názor?
- Stanovisko výboru k podávání léčivých přípravků s obsahem propofolu z jedné lahvičky/ampulky pro více pacientů
- Používání propofolu – co je zakázáno, tak není (opravdu) dovoleno... aneb co vše riskujeme, pokud jej používáme v rozporu se SPC?
- Vrací se plná krev do civilní traumatologie?
- Anestezie u popálenin
- Čichové receptory – nejde jen o čich aneb fascinující příklad dokonalé evoluce (jen ještě úplně nevíme, proč to tak vše je…)
- Zobrazovací metody v klinické praxi
- Porucha vědomí a okluze Percheronovy arterie
- Konsenzuální doporučení pro nitrožilní podávání ketaminu v léčbě akutní bolesti
- Praktická doporučení pro středně hlubokou analgosedaci
- Statistika oboru anesteziologie a intenzivní medicína – A 025
- Ohlédnutí za kongresem ČSIM v Brně 20.−22. června 2018: Co jste na něj říkali vy?
- Zajímavosti, tipy a triky
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Používání propofolu – co je zakázáno, tak není (opravdu) dovoleno... aneb co vše riskujeme, pokud jej používáme v rozporu se SPC?
- Regionální anestezie k operacím kolene – periferní nervové blokády s minimálním dopadem na motorickou funkci dolní končetiny
- Vliv infuzních roztoků na krevní srážlivost
- Cytomegalovirové infekce v intenzivní péči: léčit, nebo ignorovat?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



