-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Spontánní návrat antikoagulačního účinku kumulovaného dabigatranu po odeznění účinku antagonisty: Kazuistika pacienta s život ohrožujícím krvácením
Spontaneous rebound of the anticoagulant effect of accumulated dabigatran after the antagonist activity cessation: Case report of life-threatening haemorrhage
NOAC (Non-Vitamin K Oral Anticoagulants) are currently increasingly used for treatment of thromboembolism. The main reason for their popularity is the possibility of oral application without the need to monitor their effect. In our report we describe the case of an 81-year-old man with paroxysmal atrial fibrillation treated with dabigatran, which accumulated in the patient, resulting in a life-threatening gastrointestinal bleeding. The patient was first treated with a prothrombin complex concentrate and then the selective dabigatran antagonist idarucizumab. An important finding from the case report was the existence of rebound phenomenon of returning anticoagulant activity of NOAC after application of idarucizumab due to accumulation of the dabigatran.
Keywords:
dabigatran – hemorrhage – idarucizumab − prothrombin complex concentrate − renal insufficiency
Autoři: J. Pažout 1; M. Mikešová 2; F. Duška 1
Působiště autorů: Klinika anesteziologie a resuscitace, 3. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady 1; Laboratoř hematologie, Ústav laboratorní diagnostiky, Fakultní nemocnice Královské Vinohrady 2
Vyšlo v časopise: Anest. intenziv. Med., 29, 2018, č. 4, s. 201-206
Kategorie: Kazuistika
Souhrn
NOAC (Non-vitamin K Oral Anticoagulants) jsou v současné době stále častěji užívané preparáty k prevenci a léčbě tromboembolie. Jejich obliba spočívá v praktickém perorálním podání, bez nutnosti monitorovat jejich efekt. V naší kazuistice popisujeme případ 81letého muže s paroxysmální fibrilací síní léčeného dabigatranem, u kterého došlo ke kumulaci léčiva a rozvoje život ohrožujícího krvácení do trávicího traktu. Uvedený pacient byl námi léčen nejprve pomocí koncentrátu protrombinového komplexu a poté selektivním antagonistou dabigatranu idarucizumabem. Hlavní poučení z kazuistiky je existence fenoménu návratu antikoagulační aktivity kumulovaného NOAC po odeznění účinku antagonisty.
klíčová slova:
dabigatran – krvácení – idarucizumab − koncentrát protrombinového komplexu − renální insuficience
ÚVOD
Perorální antikoagulancia jsou nejčastěji předepisována pacientům s fibrilací síní a při léčbě hluboké žilní trombózy. S postupným stárnutím populace narůstá i procento pacientů užívající tyto látky. V období 2009−2015 byl ve Velké Británii zaznamenán nárůst užívání perorálních antikoagulancií o 58 % [1]. Hlavní zástupce perorálních antikoagulancií warfarin je od doby svého uvedení na trh v roce 1954 až dodnes nejčastěji předepisovaným lékem této skupiny. Jeho výhodou je nízká cena a možnost antagonizace jeho efektu pomocí selektivního antidota. Jeho nevýhodami jsou nutnost pravidelné kontroly PT-INR, pomalý nástup účinku na začátku léčby, značná interindividuální variabilita a kolísání efektu v závislosti na dietě a další medikaci [2].
V roce 2008 se na trhu objevil další preparát ze skupiny antikoagulancií – dabigatran (Pradaxa®, Boehringer Ingelheim Pharma). Patří do skupiny látek přímo inhibujících trombin (gatrany). Následně se na trhu objevily i další perorální antikoagulancia inhibující koagulační faktor Xa (xabany). Souhrnně jsou látky označené akronymem NOAC („New Oral Anticoagulans“ nebo „Non-vitamin K Oral Anticoagulans“) [2]. V budoucnosti se budeme stále častěji setkávat i s alternativním pojmem DOAC („Direct Oral Anticoagulants“). V roce 2009 byla v časopise NEJM uveřejněná klíčová studie RE-LY [3], která prokázala stejnou účinnost a menší výskyt krvácivých komplikací u pacientů s non-valvulární fibrilací síní užívajících dabigatran ve srovnání s warfarinem. To vedlo k nárůstu preskripce dabigatranu a dalších NOAC [1]. Hlavním argumentem ve prospěch NOAC v porovnání s warfarinem je lépe predikovatelná farmakokinetika umožňující jejich podávání bez nutnosti monitorovat jejich účinek. Antikoagulovaných pacientů celkově tedy přibývá a zároveň se zvyšuje podíl pacientů užívajících NOAC. Tento trend bude nejspíše v nadcházející dekádě dále pokračovat, a tak lze očekávat značný nárůst počtu pacientů užívajících tyto látky a následně i komplikací takové léčby. Obávané jsou situace, kdy je třeba urgentně obnovit hemostázu jako v případě závažného krvácení nebo při potřebě akutního chirurgického zákroku. Od roku 2015 je na trhu dostupné antidotum dabigatranu idarucizumab (výrobní název Praxbind®, Boehringer Ingelheim Pharma), v USA je již schváleno použití andexanetu alpha k antagonizaci xabanů. V případě, že není antidotum NOAC dostupné, je indikováno podání koagulačních faktorů (PCC − koncentráty protrombinového komplexu, FEIBA − aktivované koncentráty protrombinového komplexu) [4].
Kazuistika
81letý pacient hospitalizovaný v léčebně dlouhodobě nemocných pro ztrátu soběstačnosti. V anamnéze opakované pády, úraz bederní páteře s omezením mobility, diabetes mellitus II. typu, na dietě, stav po resekci ledviny pro tumor, paroxysmální fibrilace síní.
Den 1
Nemocný byl ráno nalezen na pokoji s poruchou vědomí, měl nitkovitý puls a melénu. Po infuzi krystaloidů byl již oslovitelný, TK 70/40 torr. Přivolaná rychlá zdravotnická pomoc pacienta transportuje na Resuscitační oddělení Kliniky anesteziologie a resuscitace Fakultní nemocnice Královské Vinohrady. K transportu zavedena intraoseální kanyla, pacient byl převážen spontánně ventilující na O2 masce.
KLINICKÝ NÁLEZ PŘI PŘÍJMU
Hmotnost 70 kg, výška 164 cm, dýchací cesty hraničně udržuje, vyčerpaný, apatický.
Ventilace spontánní, dechová frekvence18/min, SpO2 100 % na kyslíkové masce.
Oběh centralizovaný, tachykardie 130/minutu, hypotenze 90/45 torr, sérový laktát 9 mmol/l.
GCS 14, bez zjevného neurologického deficitu.
Ze žaludeční sondy byl odsáván nazelenalý obsah, per rektum tmavá melenózní stolice.
Během příjmu byly zajištěny vstupy do oběhu, nemocný byl intubován a napojen na umělou plicní ventilaci. Zahájeno podávání transfuzí. Klinicky byly přítomné známky koagulopatie: krvácení kolem centrální žilní a arteriální kanyly i z vpichu po intraoseálním přístupu.
Měli jsme k dispozici několik měsíců starou dokumentaci, ve které je zmíněn warfarin, který pacient užívá na paroxysmální fibrilaci síní. Pacient má renální insuficienci, hodnoty sérového kreatininu se pohybují mezi 170–200 µmol/l.
Vstupní hodnota urey byla 22 mmol/l, kreatininu 178 µmol/l (clearance kreatininu dle Cockrofta--Gaulta 34 ml/hod). Hodnoty protrombinového času (PT) a aktivovaného částečného tromboplastinového času (APTT) byly extrémně prodloužené (mimo měřitelné rozmezí, tab. 1). Tromboelastometrie (ROTEM) potvrzovala závažnou poruchu koagulace, čas do zahájení tvorby koagula (EXTEM-CT) byl extrémně pomalý (více než 20 minut, norma je do 79 sekund, obr. 1 a 2).
Tab. 1. Laboratorní hodnoty popisovaného pacienta seřazené podle času uplynulého od příjmu 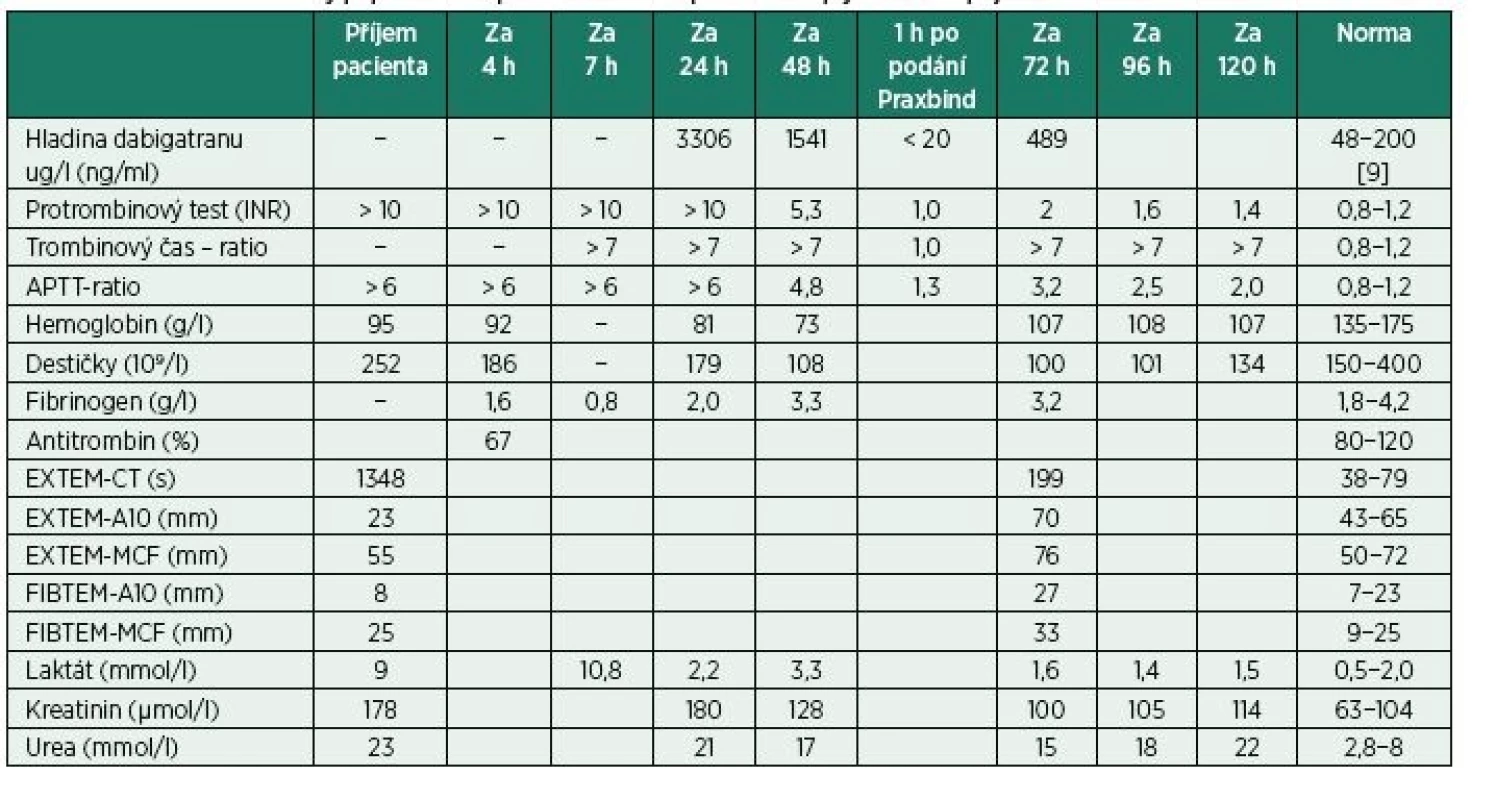
Obr. 1 a 2 Vyšetření ROTEM (EXTEM + FIBTEM) při příjmu pacienta, koagulum se začíná tvořit až po 20 minutách (norma je do 79 sekund!) 
Provedená gastroskopie neprokázala krvácení do proximální části gastrointestinálního traktu. Stav byl uzavřen jako krvácení z distální části GIT při předávkování warfarinem.
FARMAKOTERAPIE
Vzhledem k závažnému klinickému stavu byla hned po odebrání krevního vzorku k laboratorní diagnostice zahájena empirická léčba warfarinem navozené koagulopatie: intravenózně podáno 10 mg vitaminu K, 1 500 j koncentrátu protrombinového komplexu (hlavní složky PCC jsou koagulační faktory FII, VII, IX, X), kyselina tranexamová 1 g, fibrinogen 2 g, 2 transfuzní jednotky (TU) erymasy (EM) a 4 TU mražené plazmy (MP).
Podle Česko-slovenského mezioborového doporučeného postupu zabývajícího se diagnostikou a léčbou život ohrožujícího krvácení u dospělých pacientů v intenzivní a perioperační péči je doporučená dávka PCC 25−50 jednotek/kg tělesné hmotnosti [5]. Při neznalosti aktuální hodnoty PT u našeho pacienta podáváme na úvod dávku odpovídající dolní hranici doporučeného dávkování − 25 j/kg tělesné hmotnosti (pacient má 70 kg, 70 × 25 = 1750 j, PCC je v ampulích po 500 j, podáváme na úvod 1500 j).
KLINICKÝ STAV PO ÚVODNÍ LÉČBĚ
Krátce po příjmu a po zajištění CŽK sestry odstranily pacientovi intraoseální kanylu, následné krvácení z tohoto vpichu trvalo několik hodin a jen obtížně se stavělo. Po úvodní léčbě se oběh stabilizoval, takže bylo možné snížit i dávku noradrenalinu a došlo k poklesu hladiny sérového laktátu.
S krátkou prodlevou byly k dispozici výsledky koagulačních testů odebraných ještě před léčbou: příjmové hodnoty PT a APTT byly mimo měřitelné rozmezí (tab. 1). Tyto extrémní hodnoty naznačovaly, že hladina antikoagulační látky v organismu pacienta byla velmi vysoká. Ani po podání úvodní dávky PCC nedošlo k sebemenšímu poklesu hodnot koagulačních testů, proto jsme podali dalších 2 000 jednotek PCC (celkem tedy 3 500 jednotek, což odpovídá hornímu doporučenému rozmezí uvedeného doporučení: 70 kg × 50 j/kg = 3500 j).
V Čechách dostupné preparáty PCC většinou obsahují 4 koagulační faktory: II, VII, IX, X. PCC je indikován při krvácení nebo jako prevence peroperačního krvácení u pacientů se získanou poruchou koagulace navozenou podáváním antagonistů vitaminu K. V současné době se jeho indikace rozšiřuje i o krvácivé stavy navozené podáváním NOAC, pokud není k dispozici selektivní antagonista (jako idarucizumab v případě dabigatranu). PCC se vyrábí z lidské plazmy, a tak není koncentrace koagulačních faktorů u jednotlivých balení zcela konstantní. Výrobce na lahvičce uvádí obsah každé složky (např. koagulačního faktoru) v jednotkách IU. Jedna jednotka odpovídá průměrnému množství koagulačního faktoru v 1 ml dárcovské plazmy. Pokud je tedy na balení napsáno 500 jednotek, znamená to, že obsahuje např. tolik FIX jako v 500 ml dárcovské plazmy. Informace o obsahu ostatních koagulačních faktorů jsou uvedeny v příbalovém letáku.
Pacient obdržel 3 500 jednotek PCC, to je množství výše uvedených koagulačních faktorů obsažené nejméně v 3,5 litru plazmy – více než se nachází v krvi průměrného člověka –, přesto i třetí koagulační vyšetření ukazuje hodnoty PT a APTT mimo měřitelný rozsah (tab. 1, hodnoty za sedm hodin od přijetí)! Pokud ani při takové dávce PCC nedochází k normalizaci krevní srážlivosti, je pravděpodobně problém jinde než v nízké hladině koagulačních faktorů II, VII, IX, X. Nelze tak již obviňovat warfarin nebo jiné kumariny, ale musíme pátrat po látce, která je přítomná v krvi pacienta a přímo inhibuje koagulační faktory, a to i při jejich masivní suplementaci.
V době, kdy se kazuistika odehrála, nebylo stanovení hladiny NOAC ve Fakultní nemocnici Královské Vinohrady rutinně k dispozici.
Další pátrání u příbuzných pacienta pak potvrdilo toto podezření – pacient před měsícem změnil medikaci z warfarinu na dabigatran, který užíval v dávce 2× denně 110 mg.
Pro pacienty užívající dabigatran je k dispozici selektivní antagonista idarucizumab (Praxbind®). Jedná se o látku tvořenou fragmenty monoklonální protilátky, které se váží na dabigatran s vysokou afinitou a zabraňují mu tak inhibovat trombin. O podání idarucizumabu jsme uvažovali hned, jak jsme doplnili anamnézu, ale pacient byl v danou chvíli bez známek krvácení. Poslední dávku dabigatranu pacient vzal večer před rozvojem krvácení (12 hodin před příjmem), takže se vliv této láky na koagulaci dal stále předpokládat (eliminační poločas dabigatranu při normální funkci ledvin je 12−17 hodin a je třeba minimálně tří dnů, než hladina dabigatranu klesne z terapeutických hladin na úroveň, kde se funkce koagulačního systému zotaví). Dodatečně, po stanovení hladiny léku ex post z archivovaného vzorku, se ukázalo, že hladina dabigatranu byla v tento okamžik velmi vysoká, zcela mimo terapeutické rozmezí (tab. 1).
Den 2
Hodnoty koagulačních testů byly stále nad měřitelné rozmezí. Došlo k recidivě krvácení do gastrointestinálního traktu provázené poklesem hemoglobinu a oběhovou nestabilitou. Podán idarucizumab (48 hodin od příjmu) v doporučené dávce 5 gramů. Bylo nutné podat i 5 TU EM a 6 TU MP. Účinek antidota byl promptní: koagulační testy za 1 hodinu po podání idarucizumabu byly zcela v normě (tab. 1), krvácení ustalo.
Další průběh hospitalizace pacienta
V dalších dnech již krvácení nepokračovalo, nicméně za méně než 24 hodin po podání idarucizumabu bylo opět zaznamenáno prodloužení koagulačních testů (tab. 1). Výrobcem doporučená dávka 5 gramů idarucizumabu je schopná antagonizovat dabigatran u naprosté většiny pacientů, výjimečně je ale někdy nutné dávku idarucizumabu opakovat, hlavně u předávkování nebo kumulace preparátu [6]. Sérová hladina dabigatranu, změřená v naší kazuistice, překračovala horní mez doporučeného terapeutického rozmezí více než 16násobně. Bezprostředně po podání idarucizumabu sice došlo k inaktivaci dabigatranu v krevním oběhu pacienta s obnovením hemokoagulace, následně pak došlo k přesunu extravaskulárního dabigatranu do intravaskulárního kompartmentu s opětovným narušením koagulace a vzestupem koagulačních časů. Tehdy je třeba zvážit zopakování dávky idarucizumabu a v případě renální insuficience i zahájení hemodialýzy (u takového pacienta provedení bez antikoagulace, případně v citrátové antikoagulaci) k urychlení eliminace dabigatranu.
U našeho pacienta jsme provedli kontrolní tromboelastometrické vyšetření, ve kterém je patrná uspokojivá funkce koagulačního systému (obr. 3 a 4). V současné době chybí evidence o tom, zda je tromboelastometrie senzitivní a specifická pro detekci klinicky významného antikoagulačního efektu NOAC a zda může nahradit stanovení hladiny léku. Klinicky jsme nepozorovali žádné známky krvácení, další dávku idarucizumabu jsme už nepodali.
Obr. 3 a 4 Vyšetření ROTEM (EXTEM + FIBTEM) 24 hodin po podání Praxbind, CT je proti normě jen lehce prodloužen, tvorba koagula (A10, MCF) je zvýšená 
Za čtyři dny se průběh léčby zkomplikoval rozvojem ventilátorové pneumonie s následnou progresí do multiorgánového selhávání. Přes veškerou léčbu pacient umírá šestý den hospitalizace na selhání oběhu (šokový stav nereagující na terapii).
DISKUSE
Vstup NOAC na trh s antikoagulancii si vyžaduje revizi zavedených postupů při diagnostice a léčbě poruch koagulace u pacientů v těžkých stavech. Bohužel, jak se dle našich zkušeností opakovaně ukázalo, nelze spoléhat na anamnézu zjištěnou od pacienta nebo od příbuzných, dostupná zdravotní dokumentace často není aktuální. Proto je nutné mít možnost tyto údaje objektivně ověřit. Pro ilustraci – do nemocnice jsme přijali jiného pacienta v bezvědomí s akutním subdurálním hematomem. S pacientem byla dodána dokumentace, ze které vyplývalo, že užívá dabigatran. Podali jsme idarucizumab, abychom se druhý den dozvěděli, že medikace byla nedávno změněna – na rivaroxaban. Takto může dojít k ohrožení zdraví pacienta a zároveň se plýtvá i finančními prostředky. Ne všechna zdravotnická zařízení mají zavedenou metodiku na stanovení hladiny jednotlivých NOAC, v některých případech je nutné se v situaci zorientovat pomocí standardních vyšetření.
Jak je možné situaci zvládnout pomocí dostupných koagulačních vyšetření, zjistíme díky algoritmu zveřejněnému na internetových stránkách České společnosti pro trombózu a hemostázu (www.csth.cz). Nechybí ani informace, jak daný stav řešit [7]. Například: chceme-li verifikovat užívání dabigatranu, pacient by měl mít výrazně prodloužený až neměřitelný TT. Pokud zároveň zjistíme aPTT ratio > 2 a významně prodloužené PT/INR, lze očekávat, že nemocný je dabigatranem předávkován a hrozí závažné krvácení. V případě, že bude hodnota TT v normě, je velmi pravděpodobné, že pacient neužívá dabigatran (nebo je hladina dabigatranu velmi nízká a nemůže výrazněji ovlivnit koagulační nález). U inhibitorů FXa (xabanů) zaznamenáme v porovnání s dabigatranem následující odlišnosti: bude zde vysoká hodnota anti-Xa (výrazně vyšší než při podávání terapeutických dávek LMWH), TT bude v normě. U pacienta léčeného warfarinem očekáváme prodlouženéPT/INR, parametry TT a anti-Xa by měly být v normě (tab. 2). Ideálem je samozřejmě možnost stanovení hladiny daného antikoagulancia.
Tab. 2. Vliv užívaných antikoagulancií na časy koagulačních testů [7] [10] ![Vliv užívaných antikoagulancií na časy koagulačních testů [7] [10]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/452e22711eb94eb9a7f478026bb0f429.jpeg)
PT/INR − prothrombin time / international normalized ratio, APTT − aktivovaný parciální tromboplastinový čas, TT − trombinový čas, 0 − vyšetření není senzitivní a koagulační čas v terapeutických hladinách látky nebývá prodloužen, 0/+ −vyšetření není k uvedené látce dostatečně senzitivní, čas vyšetření může, ale nemusí být prodloužen (závisí na druhu reagencie), + − vyšetření je senzitivní, čas vyšetření v terapeutických hladinách látky bývá prodloužen, ++ − vyšetření je vysoce senzitivní, čas vyšetření je v terapeutických hladinách látky vždy prodloužen Poznámka: léčba NOAC také ovlivňuje stanovení antitrombinu (AT). Laboratoře by měly podávat informaci, jakým testem stanovení AT provádějí. V případě, že je součástí reagencie lidský FXa, je u léčby xabany AT falešně zvýšený. Pokud je stanovení vedeno přes FIIa, může být hodnota AT falešně zvýšená v přítomnosti dabigatranu. U některých metodik mohou vysoké hladiny dabigatranu ovlivňovat i stanovení hladiny fibrinogenu, který je pak falešně snížený.
Následná léčba se odvíjí od užitého antikoagulancia: Při léčbě závažné koagulopatie navozené dabigatranem je lékem volby antidotum idarucizumab (Praxbind) v dávce 5 g i.v. Koagulopatie navozená xabany zatím specifické antidotum nemá a doporučuje se tak podávat koncentrát protrombinového komplexu v dávce 25−50 IU/kg nebo aktivované koncentráty protrombinového komplexu (FEIBA) 50 IU/kg. Při selhání léčby možno zvážit podání rFVIIa (NovoSeven) 90 µg/kg [4, 7, 8].
Pacient z naší kazuistiky měl řadu rizikových faktorů, jako je věk, křehkost, dehydratace, renální insuficience. Podle našeho názoru je v těchto situacích vhodné změřit sérovou hladinu léčiva na začátku léčby dabigatranem a následně ji zkontrolovat před případným operačním zákrokem [9]. Předepisující lékař také musí uvážit, zda by pro takového pacienta nebyl vhodnější jiný NOAC, například apixaban, který se převážně eliminuje jaterní cestou. Je také nutné instruovat personál, který pečuje o pacienty, že je nezbytné určitou medikaci podávat způsobem, při kterém nedojde k porušení povrchu tablety nebo kapsle. Například u Pradaxy výrobce upozorňuje na prudký nárůst biologické dostupnosti (až o 75 %) při vysypání a přimíchání obsahu kapsle do pití nebo jídla. V literatuře jsou popisovány i případy akutního krvácení u takových pacientů! Je možné, že toto mohlo mít vliv i v citovaném případě.
ZÁVĚR
Rostoucí popularita NOAC s sebou nese i nutnou úpravu diagnostických a léčebných algoritmů u pacientů s krvácením a v případě dalších komplikací. Problémem je ověření užívaného agens a stanovení jeho sérové hladiny. Často je nezbytné závažnost koagulační poruchy odvodit z dostupných anamnestických údajů (typ preparátu, doba od podání poslední dávky), klinického stavu a dostupných koagulačních vyšetření. Do budoucna by se vyšetřování hladin NOAC ve statimovém režimu mělo rozšířit a stát standardem na pracovištích, která se o tento typ pacientů starají. V našem případě se osvědčilo i tromboelastometrické vyšetření (ROTEM), které dokázalo při příjmu signalizovat závažnou poruchu koagulace. Vlastní léčba koagulopatie se pak odvíjí podle konkrétního antikoagulancia, v ideálním případě máme dostupné selektivní antidotum, které účinek NOAC rychle a účinně antagonizuje. U pacientů s vyšší iniciální hladinou dabigatranu a/nebo renální insuficiencí se po podání idarucizumabu nabízí rutinní kontrola hladiny dabigatranu s odstupem 12−36 hodin od aplikace. V případě opětovného vzestupu hladiny dabigatranu na klinicky významné hodnoty může být potřeba dávku antidota opakovat. V současné době je takové antidotum dostupné pro dabigatran, v USA je již schváleno antidotum i pro xabany, v České republice zatím na jeho schválení a uvolnění do distribuce čekáme.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Podíl autorů na vytvoření článku:
PJ: sepsal první verzi rukopisu článku a zpracoval přehled dostupných dat na dané téma.
MM: doplnila popisy laboratorních metod.
DF: všechny verze opravoval a připomínkoval. Všichni autoři: provedli finální korekturu textu.
Do redakce došlo dne 23. 3. 2018.
Do tisku přijato dne 30. 6. 2018.
Adresa pro korespondenci:
MUDr. Jaroslav Pažout
Zdroje
1. Loo SY, Dell'Aniello S, Huiart L, Renoux C. Trends in the prescription of novel oral anticoagulants in UK primary care. Br J Clin Pharmacol. 2017;83;2096–2106.
2. Bultas J. Nová perorální antikoagulancia – o čem se nemluví. Remedia. 2015;25 : 1127–1134.
3. Connolly SJ, Ezekowitz MD. Dabigatran versus warfarin in patients with atrial fibrillation. NEJM. 2009;361 : 1139–1151.
4. Rossaint R, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition. Critical Care. 2016;20 : 117.
5. Česko-slovenský mezioborový doporučený postup, „Diagnostika a léčba život ohrožujícího krvácení u dospělých pacientů v intenzivní a perioperační péči“. Anest intenziv Med. 2017;28 : 263–269.
6. Pollack CVJ, Reilly and van Ryn PA. Idarucizumab for dabigatran reversal—full cohort analysis. NEJM. 2017;377 : 431–441. http://doi.org/10.1056/NEJMoa1707278.
7. Česká společnost pro trombózu a hemostázu, „Postup při krvácení a perioperační management u nemocných léčených novými perorálními anticoagulancii (NOACs). [Online]. Available: https://www.csth.cz/soubory/csth-postup-pri-krvaceni.pdf. [Přístup získán 1. 2. 2018].
8. Tomaselli GF, Mahaffey KW. 2017 ACC Expert Consensus Decision Pathway on Management of Bleeding in Patients on Oral Anticoagulants. J Am Coll Cardiol. 2017; 70 : 3042–3067.
9. Ketha H, Mills JR. To Monitor Dabigatran or Not: A Matter of Patient Safety. Clinical Chemistry. 2015;61 : 691–693. http://doi.org/10.1373/clinchem.2014.232207.
10. Samuelson BT, Cuker A. Laboratory assessment of the anticoagulant activity of direct oral anticoagulants: a systematic review. CHEST. 2017;151 : 127–138. http://doi.org/10.1016/j.chest.2016.08.14.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Sepse a novinky 2018Článek EKG v klinické praxiČlánek EKG lekce 1Článek Zajímavosti, tipy a triky
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2018 Číslo 4- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Porovnanie katétrovej vysokofrekvenčnej dýzovej ventilácie pľúc a konvenčnej ventilácie počas intervenčnej bronchoskopie u pacientov s obštrukciou dýchacích ciest
- Akutní koronární syndrom po nekardiochirurgických operačních výkonech
- Calprotectin a calgranulin C v krvi u polytraumatizovaných pacientů
- Horečka po spinálních traumatech
- Spontánní návrat antikoagulačního účinku kumulovaného dabigatranu po odeznění účinku antagonisty: Kazuistika pacienta s život ohrožujícím krvácením
- Nová definice status epilepticus a možnosti jeho farmakologické léčby
- Restriktivní versus liberální tekutinová terapie
- Využití ultrazvuku v intervenční léčbě bolesti
- Sepse a novinky 2018
- Překlady pacientů mezi pracovišti a „spádová“ zdravotnická zařízení
- Analgezie u vaginálního porodu
- Péče o zemřelého dárce orgánů s diagnózou smrti mozku
- Smrt mozku, péče o dárce orgánů
- Evoluční adaptační mechanismy (nejenom na hypoxii) a jejich význam pro klinickou medicínu
- EKG v klinické praxi
- EKG lekce 1
- Zajímavosti, tipy a triky
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nová definice status epilepticus a možnosti jeho farmakologické léčby
- EKG lekce 1
- Překlady pacientů mezi pracovišti a „spádová“ zdravotnická zařízení
- Využití ultrazvuku v intervenční léčbě bolesti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



