-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Specifika intervenční bronchologie z pohledu anesteziologa
Specifics of interventional bronchology from the anaesthetic perspective
Modern interventional bronchology covers a wide range of various endotracheal, endobronchial and pleuroscopic procedures. Patients often present with the syndrome of central airway obstruction from external or internal causes. Anaesthesia for interventional bronchology procedures has its specific features including sharing the airways with the surgeon who is using a rigid bronchoscope, application of jet ventilation and employment of total intravenous anaesthesia using short-acting anaesthetic agents. Selective lung ventilation is required for pleuroscopic procedures. Bronchologic procedures may be associated with acute life-threatening complications including loss of airway patency in the supraglottic area or trachea, massive bleeding, ignition of the tissue in the airways, pneumothorax and haemothorax.
KEYWORDS:
interventional bronchology – airway obstruction – jet ventilation – total intravenous anaesthesia
Autoři: P. Michálek 1,2; J. Závada 1; T. Brožek 1
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. LF UK a Všeobecná fakultní nemocnice, Praha 1; Department of Anaesthesia, Antrim Area Hospital, United Kingdom 2
Vyšlo v časopise: Anest. intenziv. Med., 27, 2016, č. 4, s. 207-213
Kategorie: Anesteziologie - Přehledový článek
Souhrn
Moderní intervenční bronchologie zahrnuje široké spektrum endotracheálních, endobronchiálních a pleuroskopických výkonů. Pacienti mají často syndrom centrální obstrukce dýchacích cest z externích nebo interních příčin. Anestezie pro výkony intervenční bronchologie má svá specifika, která zahrnují sdílené dýchací cesty s operatérem, použití rigidního bronchoskopu, tryskovou ventilaci a aplikaci totální intravenózní anestezie s použitím látek s krátkým poločasem účinku. Pro pleuroskopické výkony je nutná selektivní ventilace plic. Výkony mohou být spojeny s akutními život ohrožujícími komplikacemi, k nimž patří ztráta průchodnosti dýchacích cest v supraglotické oblasti nebo trachei, masivní krvácení, vznícení tkáně v dýchacích cestách, pneumotorax a hemotorax.
Klíčová slova:
rigidní bronchoskop – trysková ventilace – aplikace totální intravenózní anestezie – pleuroskopické výkonyÚVOD
Operační techniky se v současné medicíně obecně mění od chirurgických směrem k méně invazivním. Podobně jako v obecné chirurgii, urologii, gynekologii, i v chirurgii krku a respiračního systému se část technik přesunuje do působnosti intervenčního bronchologa nebo pulmonologa. V dřívějších letech nepředstavovaly bronchologické výkony pro anesteziologa zásadní výzvu – jednalo se především o diagnostické bronchoskopie, které byly většinou prováděny pouze v lokální topické anestezii, případně v analgosedaci. S rozvojem endotracheálních a endobronchiálních invazivních technik, které jsou uvedeny níže, ale nastala potřeba poměrně rozsáhlých výkonů v celkové anestezii, u polymorbidních pacientů, s interferencí poměrně robustního instrumentária operatéra v dýchacích cestách.
Dalšími specifiky výkonů jsou významné dráždění dýchacích cest při použití rigidních nebo flexibilních bronchoskopů a použití tryskové nebo jiné nekonvenční ventilace [1].
SPECIFIKA PACIENTA
Pacienti jsou obvykle vyššího věku, s mnohočetnými přidruženými chorobami respiračního i oběhového systému. Často se vyskytuje syndrom centrální obstrukce dýchacích cest (central airways obstruction – CAO) [2]. Jedná se o soubor příznaků postihujících hlavně tracheu, oblast hrtanu a velké bronchy. Obstrukce může být způsobena překážkou uvnitř dýchacích cest, externím útlakem nebo může jít o kombinovanou příčinu. K nejčastějším příčinám vnitřní obstrukce patří primární endoluminální karcinom bronchogenní nebo hrtanu, granulace uvnitř trachey či dynamické stenózy při tracheomalacii. Zevní útlak dýchacích cest může být způsoben nádorovou masou v mediastinu (thymom, lymfom) nebo útlakem anomální cévní struktury.
Syndrom se při zátěži začíná projevovat dušností obvykle při poklesu průměru trachey pod 8 mm a klidovými příznaky při snížení průměru pod 5 mm. Stridor je většinou známkou závažné obstrukce v oblasti hrtanu nebo trachey.
TYPY INTERVENČNÍCH VÝKONŮ
Metody intervenční bronchologie se v posledních dvaceti letech vyvíjejí velmi rychle. Výkony lze z hlediska intervenčního bronchologa rozdělit do několika kategorií [3].
Endobronchiální ultrazvuk
Endobronchiální ultrazvuk (EBUS) je metoda, která v sobě spojuje bronchoskopii a ultrazvukové vyšetření okolní plicní, případně i jiné tkáně [4]. Lineární sondou lze provést biopsii plicní tkáně skrz pracovní kanál bronchoskopu s ultrazvukovou navigací v reálném čase (obr. 1).
Obr. 1. Biopsie navigovaná pomocí EBUS 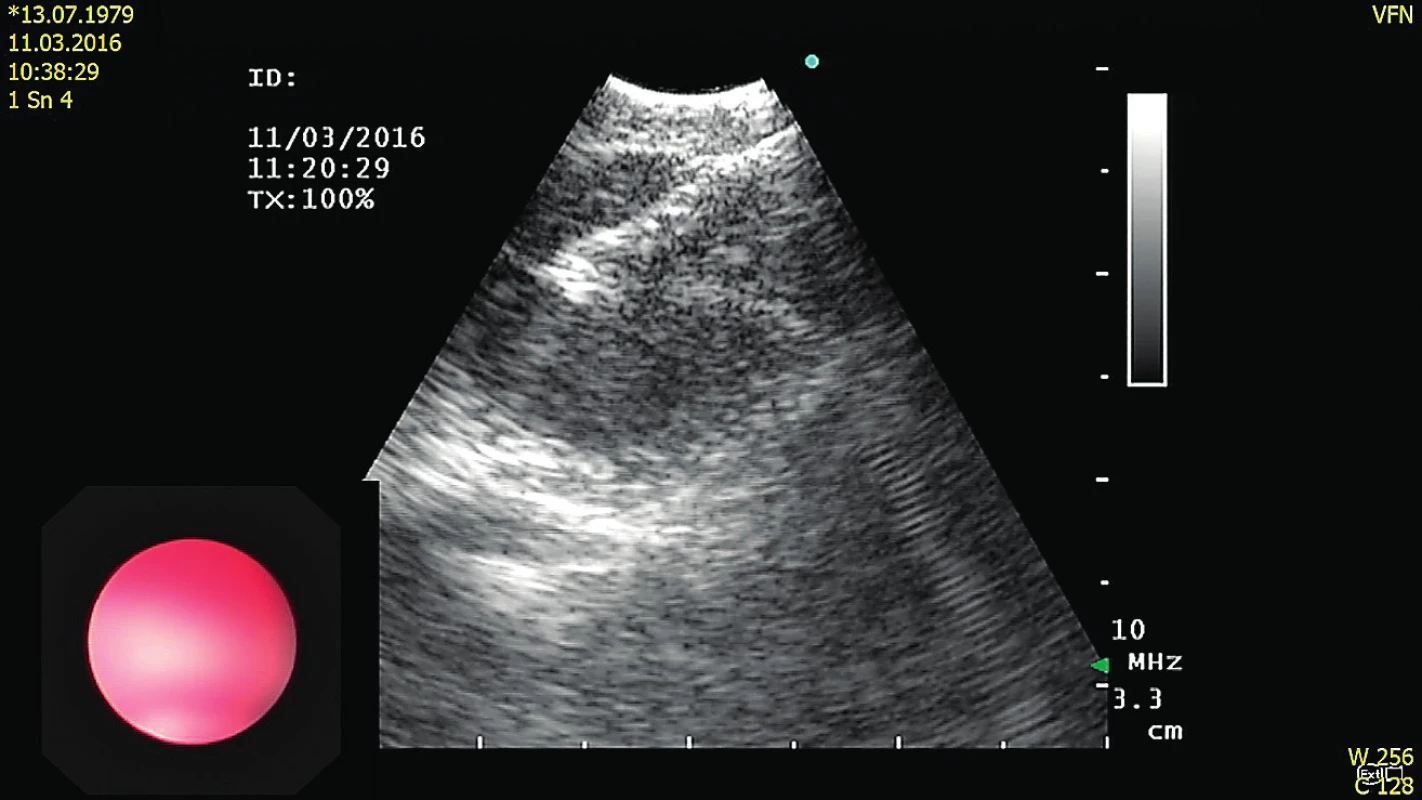
Radiální sondy umožňují obsáhnout 360 stupňů tkáně v okolí sondy a používají se pro diagnostiku a biopsii maligních nodulů. EBUS se používá také pro zobrazení paratracheálních, subkarinálních, hilových a interlobárních lymfatických uzlin. Colour flow mapping (CFM) a dopplerovské zobrazení pomůže identifikovat cévní struktury. Riziko krvácení je malé, protože bioptické jehly jsou tenké.
Elekrokoagulace/elektrokauterizace/laserová vaporizace
Lze využít elektrokoagulační kličku k oddělování papilomatózních granulací (obr. 2), elektrokauterizační katétr, nůž i optické laserové vlákno. Léčba elektrokauterem i laserem je prakticky stejně účinná pro endobronchiální paliaci a měli bychom dosáhnout symptomatické úlevy u 70–94 % pacientů [5].
Obr. 2. Odstranění papilomatózního tumoru obturujícího tracheu pomocí elektrokoagulační kličky a kryosondy – vlevo tumor, vpravo rekanalizované dýchací cesty 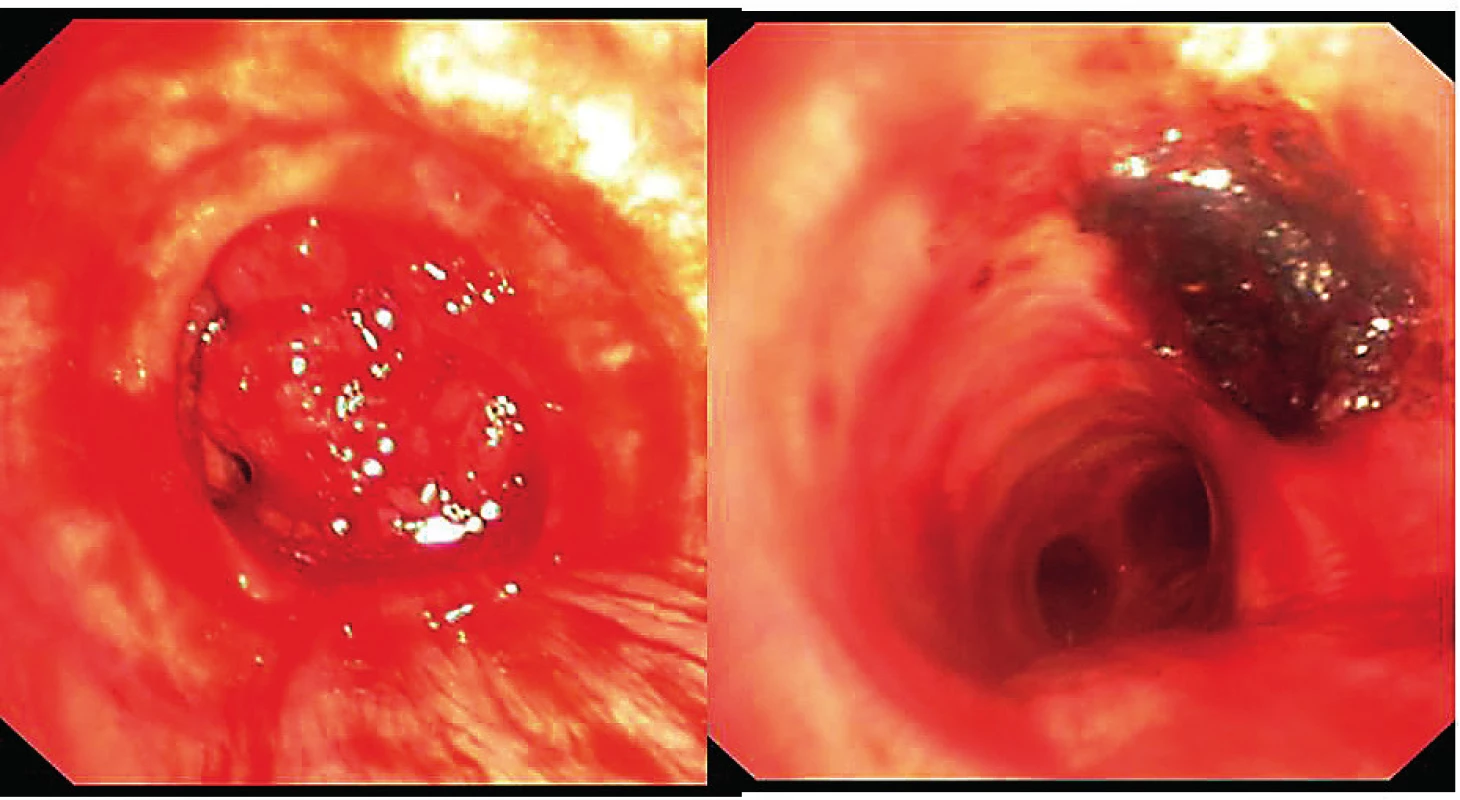
Kryoterapie
Je využívána kryosonda, jejíž teplota na distálním konci může dosáhnout až -70 °C [1]. Vzorek z požadovaného místa je namrazen na distální konec sondy. Kryoterapie je často využívána i u stenóz velkých dýchacích cest s výhodou malé tvorby nových granulací po odloučení zmražené tkáně.
Endobronchiální brachyterapie
Při brachyterapii je do oblasti trachey nebo bronchů aplikována ve spolupráci pneumologa s radiačním onkologem vysoce dávkovaná radioterapie [1]. Záření neničí zhoubné buňky přímo, ale indukuje apoptózu a sníženou proliferaci buněk, efekt léčby se projeví za 4–6 týdnů po aplikaci.
Zavedení stentu
Tracheální i bronchiální stenty jsou zaváděny zpravidla rigidním bronchoskopem nebo v kombinaci s videoendoskopem. Někdy je použito i mobilní C-rameno. Stenty do dýchacích cest jsou vyrobeny ze silikonu nebo z kompozitních materiálů typu nitinolu (sloučenina niklu a titanu s dobrou materiálovou pamětí) a silikonu. Zavádění stentů je nejčastěji indikováno při kompresi velkých dýchacích cest, méně často u komplexních benigních stenóz, jestliže není indikováno chirurgické řešení [6]. Může jít o výkon čistě paliativní, přemosťující nebo i kurativní.
Novějším typem stentu je takzvaný dynamický „Y“ stent, určený k řešení stenóz distální trachey, kariny a hlavních bronchů. Stent je zhotoven ze silikonu, tracheální část obsahuje podkovovité kovové proužky napodobující chrupavčité prstence. Měkká zadní část imituje pars membranacea trachey, což zlepšuje mobilitu v průběhu kašle (obr. 3).
Obr. 3. Stent s měkkou pohyblivou zadní stěnou 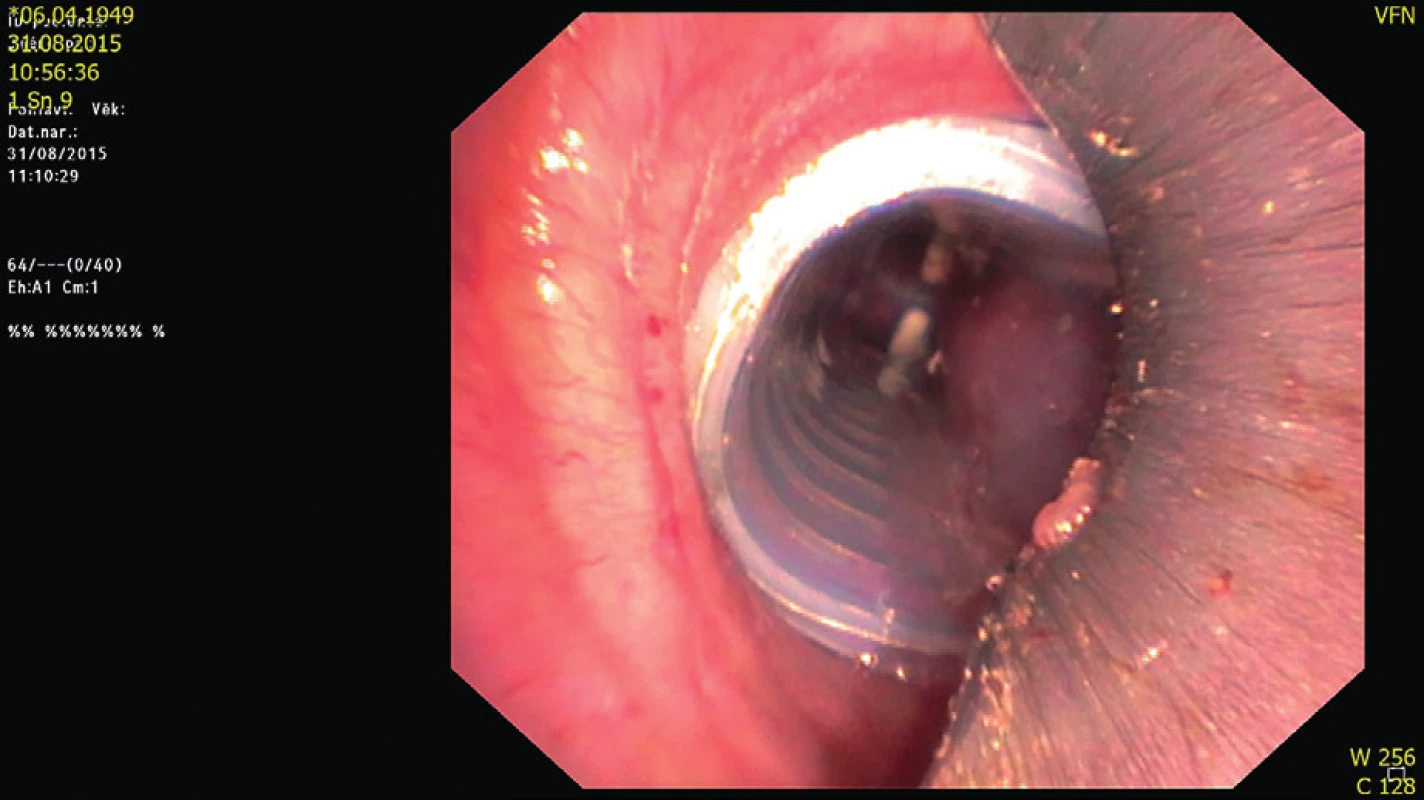
Extrakce cizího tělesa
Na aspiraci cizího tělesa ročně umírá ve světě přibližně 3 000 lidí, často ještě před poskytnutím lékařské pomoci. Nejčastěji aspirují děti, konkrétně batolata od jednoho do tří let. V bronších se zaklíní 80–90 % těles, zbývajících 10–20 % pak mezi hlasovými vazy nebo v průdušnici. U dětí byla v souvislosti s aspirací cizího tělesa popsána 0,42% úmrtnost. Metodou volby je rigidní bronchoskopie se zavedením extrakčních kleští nebo flexibilního bronchoskopu s dostatečně velkým pracovním kanálem [7]. U dospělých je aspirace cizího tělesa řídká, objevuje se pouze v souvislosti s neurologickým postižením, v opilosti, při intoxikacích nebo při demenci.
Endoskopická volum-redukční terapie
Výkony endoskopické volum-redukční léčby jsou indikovány u CHOPN s emfyzémem, mají za účel zamezit ventilaci emfyzematózních okrsků plíce. Zahrnují zavedení jednocestných chlopní, aplikaci bioaktivních materiálů, které vytvoří atelektázu v oblasti postižené emfyzémem, a vytvoření arteficiálního bypassu mezi jednotlivými plicními segmenty [8].
Bronchiální termoplastika
Tento výkon je indikován u pacientů s nestabilním bronchiálním astmatem, které špatně reaguje na farmakologickou léčbu kombinace inhalačních kortikosteroidů a beta2-agonistů s prodlouženým účinkem (LABA) [9].
Bronchiální termoplastika spočívá ve třech fázích, při každé je léčena jiná část plic. Tenký katétr je zaveden skrze flexibilní bronchoskop do segmentálních a tenčích bronchů (3–10 mm) a pomocí radiofrekvenční energie jsou destruovány hladké svaly průdušek (obr. 4). Snížení kontraktilní masy a reaktivity hladkého svalu v průduškách vede ke zlepšení symptomů a snížení četnosti astmatických záchvatů.
Obr. 4. Bronchiální termoplastika 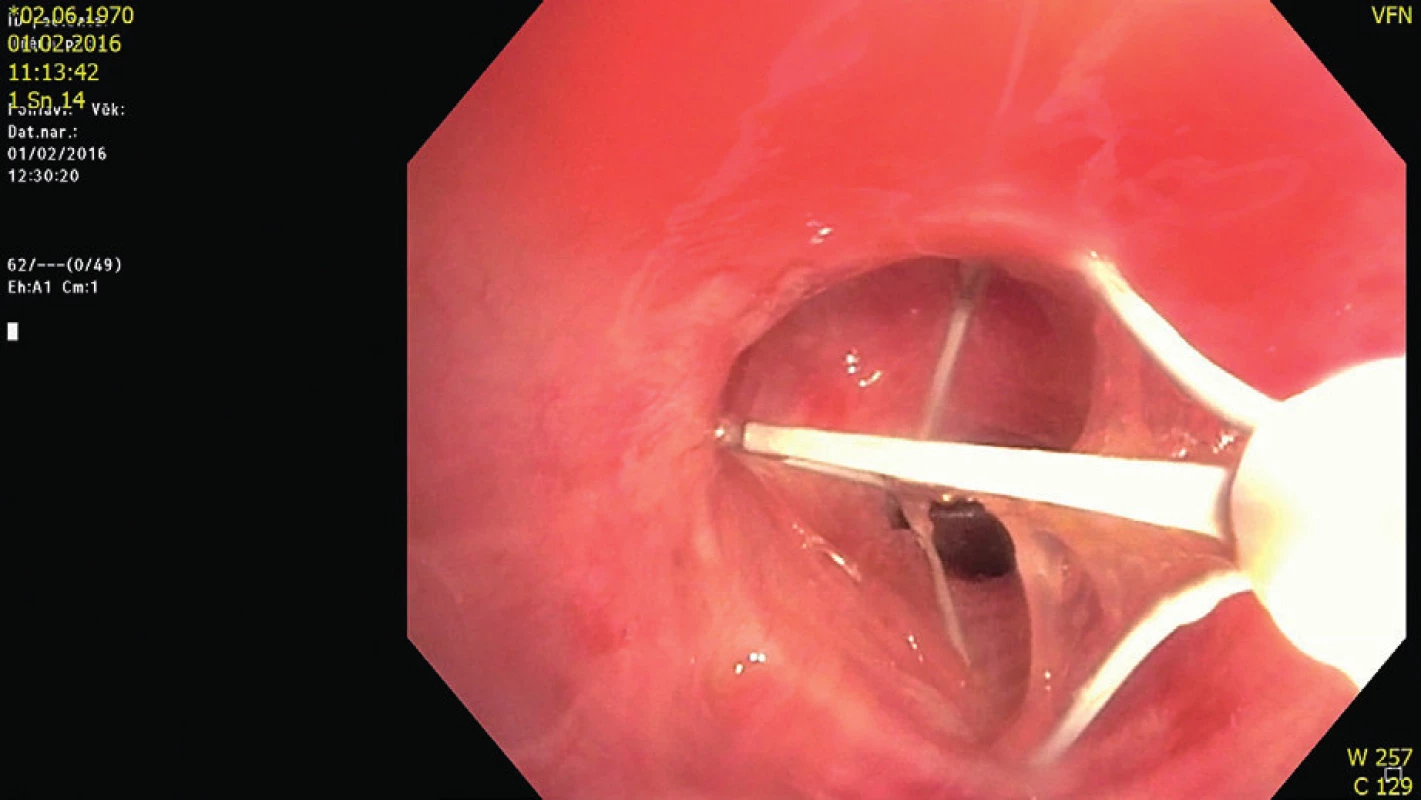
Výkony na pleuře
Pleuroskopie spočívá v zavedení rigidního endoskopu po nářezu a preparaci, mezižeberním prostorem do hrudní dutiny [10]. Pleuroskopem lze vizualizovat pleuru, evakuovat patologický tekutý obsah z hrudníku, odebrat vzorek tkáně nebo tekutiny na mikrobiologii nebo cytologii. S přídatným instrumentáriem je možné provést i resekci patologického útvaru, uvolnění adhezí, talkáž i dekortikaci pleury. Diagnostické výkony na pleuře jsou doménou intervenčního bronchologa, náročnější výkony provádí hrudní chirurg.
SPECIÁLNÍ ANESTEZIOLOGICKÉ POSTUPY
Anesteziolog musí při těchto výkonech řešit: atypické metody zajištění dýchacích cest, jejich sdílení s operatérem, komplikace přímo související s instrumentací a výkony uvnitř dýchacích cest, použití nekonvenčních metod ventilace, především vysokofrekvenční tryskové ventilace a to, že často náročné výkony u polymorbidních pacientů jsou ambulantní nebo semiambulantní [11, 12]. Dýchací cesty jsou při celkové anestezii zajištěny nejčastěji pomocí rigidního bronchoskopu nebo pomocí supraglotické pomůcky, popř. tracheální rourky.
Trysková ventilace
Trysková ventilace je charakterizována supranormální dechovou frekvencí obvykle mezi 100–200 dechy za minutu, nízkými dechovými objemy (1–3 ml/kg) a výrazně sníženými inspiračními tlaky [13]. Dosažené objemy však nejsou dostatečné k udržení účinné výměny plynů, proto se podílejí na výměně plynů i jiné mechanismy než přímá alveolární ventilace a turbulence ve velkých dýchacích cestách. Patří k nim Taylorova disperze, kolaterální perfuze (proudění plynu mezi jednotlivými alveoly, které jsou v časové konstantě plněny rozdílně), asymetrie rychlostních profilů a molekulární difuze. V malé míře přispívá i kardiogenní směšování plynů, při pohybech přilehlé plicní tkáně následkem srdečních kontrakcí.
Trysková ventilace je poskytována speciálními přístroji. Nastavitelné parametry na přístroji jsou:
- řídicí tlak,
- dechová frekvence,
- čas nádechu,
- složení aplikované směsi.
Dechový objem není možné nastavit – je závislý na řídicím tlaku, délce inspiria, odporu trysky a celkovém odporu dýchacího systému. Nádech je aktivní děj s nastaveným pozitivním inspiračním tlakem, zatímco výdech je vždy děj pasivní. Všechny tryskové ventilátory by měly být vybaveny bezpečnostními prvky – tlakovým alarmem a automatickým vypnutím trysky při překročení bezpečných vrcholových tlaků.
Nejčastěji používaným typem tryskové ventilace u výkonů intervenční bronchologie je vysokofrekvenční trysková ventilace (HFJV). Tryska je připojena buď supragloticky na tracheální rourku, supraglotickou pomůcku nebo rigidní bronchoskop, nebo zavedena do trachey skrze dýchací pomůcku, či transtracheálně. Měření parciálních tlaků oxidu uhličitého u tryskové ventilace je složité z důvodu vysokého průtoku a otevřeného dýchacího systému. Tento problém lze řešit buď měřením paCO2 z arteriální linky, nebo neinvazivně transkutánně (TCM Tosca systém, SenTec monitor, TCO2M monitor) [14].
Vrcholové inspirační tlaky a střední tlaky v dýchacích cestách jsou při HFJV nižší než při konvenční ventilaci. Během výdechu je v dýchacích cestách vždy pozitivní tlak: intrinsický PEEP se zvyšuje se zvyšující se frekvencí ventilace a klesá s prodlužující se délkou exspiria. Zvýšení frekvence může také způsobit hyperkapnii při konstatním řídicím tlaku a délce inspiria – dochází ke snížení dechového objemu. Výhody a nevýhody vysokofrekvenční tryskové ventilace jsou shrnuty v tabulce 1.
Tab. 1. Výhody a nevýhody vysokofrekvenční tryskové ventilace 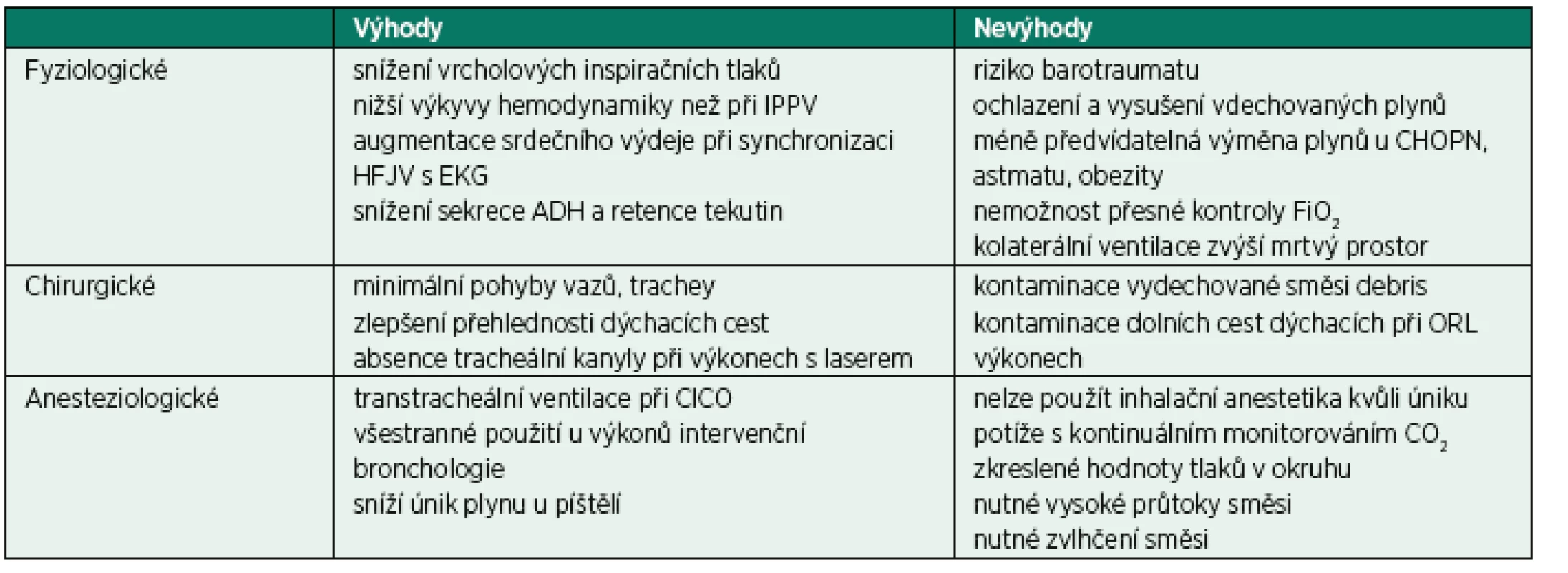
(podle Evans et al., 2007, [16]). V některých případech je možné použít i nízkofrekvenční tryskovou ventilaci s frekvencí 8–20 za minutu. Je aplikována většinou transtracheálně kanylou s vysokotlakým zdrojem kyslíku (Sandersův injektor, Manujet III) [15]. Kromě použití pro krátké diagnostické výkony ji lze aplikovat pro udržení oxygenace u stavů CICO („cannot intubate, cannot oxygenate“).
Rigidní bronchoskopie a ostatní metody zajištění dýchacích cest
Rigidní bronchoskopy jsou kovové trubice, poměrně širokého průměru (obr. 5), které jsou pod přímou laryngoskopií zaváděny skrze hlasové vazy do trachey.
Rigidní bronchoskopy umožní intervenčnímu bronchologovi přehlédnout velkou část trachey a bifurkaci a po zavedení dalšího instrumentária i další části tracheobronchiálního stromu. Rigidní bronchoskop nemá těsnicí manžetu, proto dochází při řízené ventilaci vždy k úniku směsi. Před úvodem do anestezie je nezbytné zjistit pohyblivost krční páteře. Po úvodu do anestezie a dostatečné svalové relaxaci je maximálně zakloněna hlava pacienta a rigidní bronchoskop je zaveden pomocí laryngoskopu nebo přímo pod vnitřní optickou kontrolou těsně za hlasové vazy pacienta.
Strategie ventilace skrze rigidní bronchoskop v průběhu intervenčního výkonu je extrémně důležitá [17]. Mohou být aplikovány celkem čtyři typy ventilační strategie. Nejčastěji je používána vysokofrekvenční trysková ventilace. Je možné aplikovat i konvenční ventilaci přerušovaným pozitivním tlakem, kdy je ventilátor připojen na boční port bronchoskopu. Zachované spontánní dýchání je preferováno u pacientů s předpokládanou obtížnou intubací, při intermitentní obstrukci dýchacích cest cizím tělesem a někdy i u kritických stenóz trachey. Apnoická oxygenace se využívá v současnosti minimálně.
Zajištění dýchacích cest rigidním bronchoskopem je poměrně invazivní výkon, může způsobit poranění oblasti hrtanu i trachey, po výkonu mohou pacienti krvácet, rozvinout bronchospazmus nebo laryngospazmus. Na našem pracovišti jej používáme striktně u stenóz trachey s plánovanou rekanalizací, ostatní výkony obvykle zajišťujeme zavedením supraglotické pomůcky i-gel, která má rigidní širokou dýchací trubici a dobré pokrytí hlasových vazů (obr. 6).
Obr. 6. Trysková ventilace skrze i-gel s pozicí přímo u vchodu do hrtanu 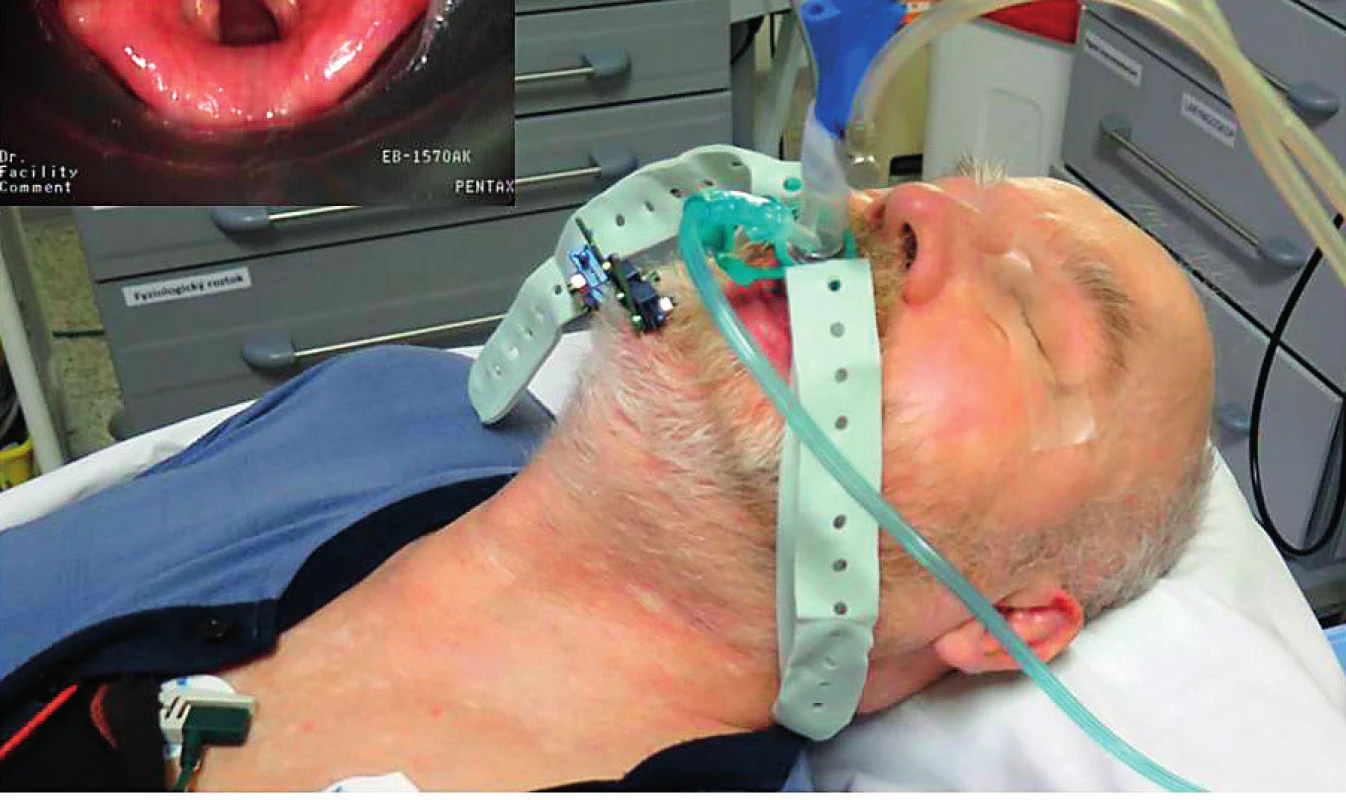
Diagnostické výkony s flexibilním bronchoskopem jsou ve většině případů prováděny v topické anestezii a sedaci [18]. Výjimkou jsou děti a nespolupracující pacienti. Složitější výkony typu komplexní bronchoalveolární laváže jsou indikovány k celkové anestezii s tracheální intubací nebo v indikovaných případech, jako je plicní alveolární proteinóza [19], i se zavedením biluminální kanyly.
Obecná strategie vedení anestezie
Taktika vedení anestezie vychází z toho, že výkon sám je spojen s výrazným drážděním, ale bolest po výkonu je minimální. Dalším důležitým faktem je, že volatilní anestetika jsou nevhodná vzhledem k netěsnosti okruhu a úniku do prostředí. Anestezie je vedena jako totální nitrožilní (TIVA) s kontinuální aplikací propofolu buď podle dávkovacích tabulek nebo s použitím režimu TCI („target-controlled infusion“) [20]. Z opioidů lze použít alfentanil, remifentanil nebo i sufentanil. Svalová relaxancia jsou aplikována vždy – krátkodobě účinkující mivakurium nebo středně dlouhé rokuronium, které má výhodu specifické antagonizace sugammadexem.
Při syndromu patologické masy v předním mediastinu je doporučován inhalační úvod do anestezie a zachování spontánní ventilace, neboť aplikace řízené ventilace a svalové relaxace může v supinní poloze způsobit úplnou externí obstrukci trachey nebo hlavních bronchů [21]. Podobně je zajištění dýchacích cest prováděno za spontánního dýchání v přítomnosti tracheoezofageální píštěle [22].
Anestezie pro aspiraci cizího tělesa
Vždy je nezbytná bezchybná spolupráce anesteziologa s intervenčním bronchologem. U dětí je dávána přednost inhalačnímu úvodu do anestezie sevofluranem a za zachované spontánní ventilace kvůli možnosti kompletní obstrukce z částečné ventilace. Při asfyxii s obstrukcí hrtanu je indikována urgentní koniotomie [23]. I navzdory odpovídající diagnostice a péči je aspirace nebo následná extrakce cizího tělesa spojena s rizikem hypoxického poškození mozku až v 1 % případů.
U dospělých závisí volba anestezie na závažnosti obstrukce a lokalizaci cizího tělesa. Obvykle se podává celková anestezie s inhalačním úvodem nebo nitrožilní anestezie propofolem. Akutní kompletní obstrukce dýchacích cest spojená s asfyxií, v úrovni hlasových vazů nebo subglotickém prostoru vyžadují urgentní provedení chirurgického přístupu do dýchacích cest [24].
Anestezie pro pleuroskopické výkony
Pro složitější výkony v pleurální dutině je nezbytná celková anestezie s izolací plic podobně jako v hrudní chirurgii nebo i jednotlivých laloků. Na našem pracovišti preferujeme izolaci skrze supraglotickou pomůcku i-gel a pomocí nezávislého blokátoru bronchu (obr. 7, obr. 8).
Obr. 7. Bronchiální blokátor zavedený skrze i-gel 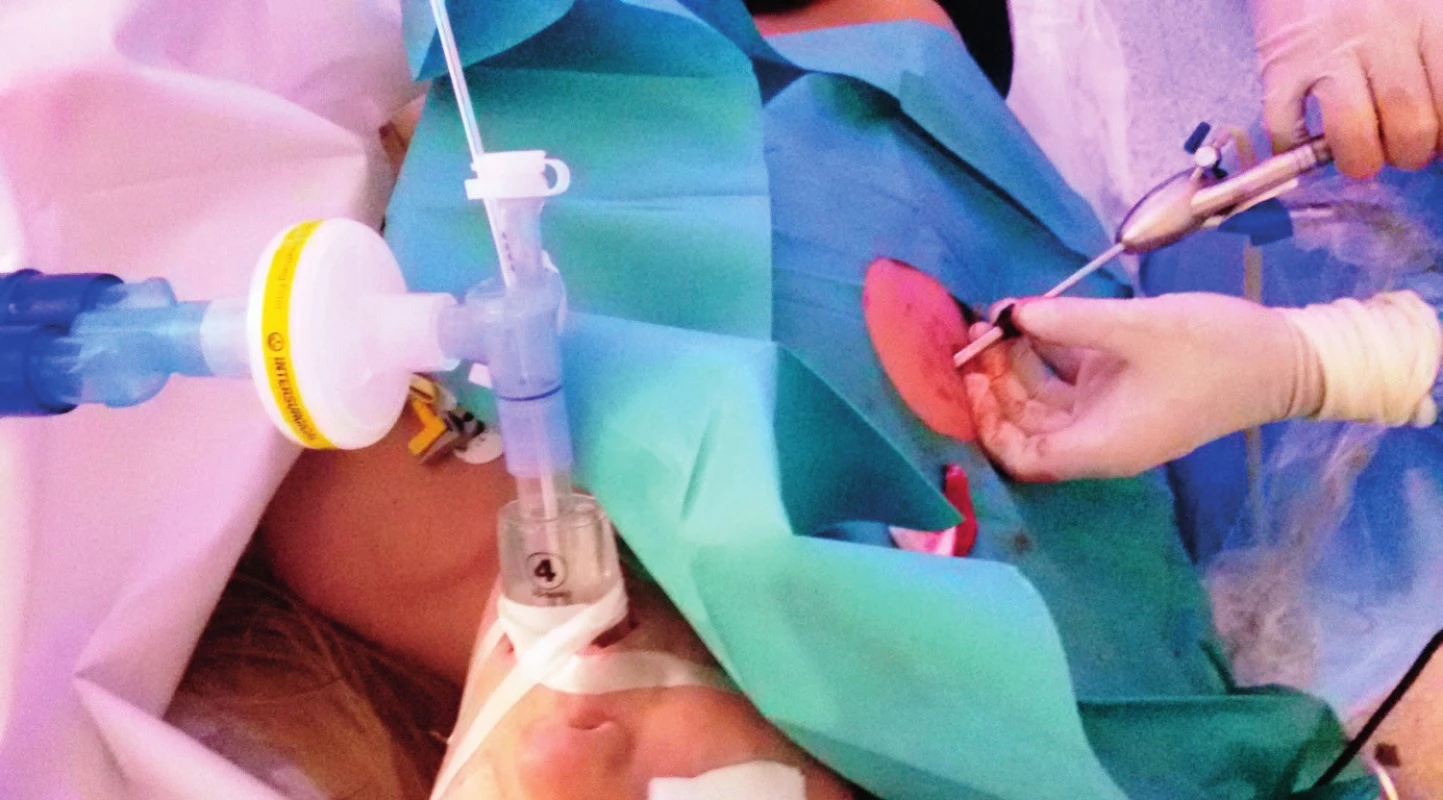
Obr. 8. Selektivní kolaps bronchus intermedius při pleuroskopii 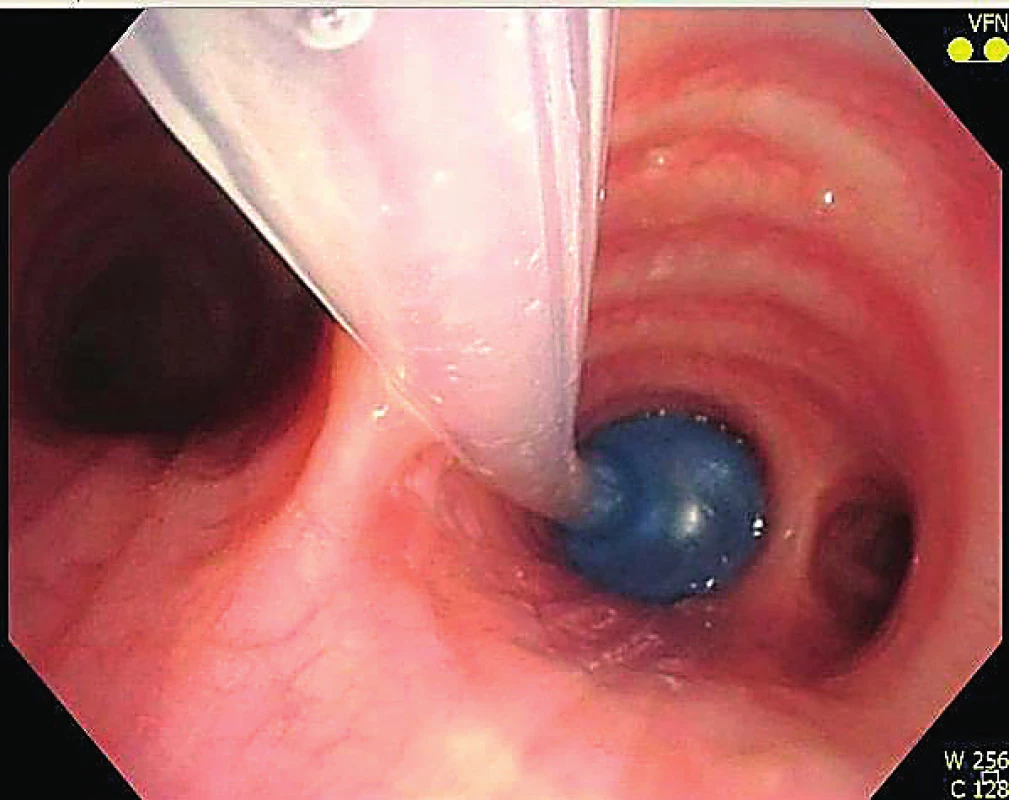
ŽIVOT OHROŽUJÍCÍ KOMPLIKACE VÝKONŮ
Výkony intervenční bronchologie mohou komplikovat akutní, život ohrožující stavy [1].
Kompletní obstrukce dýchacích cest
Ke kompletní obstrukci dýchacích cest může dojít následkem patologického procesu v oblasti hrtanu nebo trachey, následkem instrumentálního výkonu v dýchacích cestách, malpozice stentu nebo externí kompresí průdušnice [25]. Management závisí na příčině a primárním cílem je poskytnout oxygenaci. U kompletní vysoké obstrukce (hrtan, subglotická část trachey) je indikován urgentní chirurgický přístup do dýchacích cest pod úrovní překážky. Užitečnou roli má bed-side ultrazvuk, kterým je možné zobrazit oblast vazů i trachey [4]. Při obstrukci v úrovni bifurkace nebo externí kompresi distální trachey není provedení koniotomie/tracheotomie možné a musí být urgentně zajištěna alternativní oxygenace – zavedení tenkého katétru skrze stenózu a pasivní oxygenace, rekanalizace dýchacích cest bronchoskopem a trysková insuflace kyslíku, případně extrakorporální metody oxygenace.
Masivní krvácení
Ke krvácení do dýchacích cest může dojít při prorůstání tumoru do velké cévy nebo při poranění v průběhu výkonu. Část pacientů může krvácet do hrudní dutiny. Při endobronchiálním zdroji krvácení je prvním krokem separace poškozeného bronchu pomocí biluminální rourky nebo blokátoru bronchu a poté snaha o endobronchiální nebo chirurgické řešení. Masivní krevní ztráty jsou řešeny podle protokolu s aplikací resuspendované erytrocytární masy, plazmy, trombocytů a fibrinogenu [26]. Krevní koagulum může způsobit akutní neprůchodnost dýchacích cest.
Pneumotorax
K pneumotoraxu může dojít při perforaci následkem intervenčního výkonu nebo při spontánní ruptuře emfyzematózní buly. Nejlepším diagnostickým nástrojem je ultrazvuk, léčbou zavedení hrudního drénu [27].
Vznícení v dýchacích cestách
Ke vzniku ohně v dýchacím systému může dojít při použití elektrokoagulace, kauteru nebo laseru. Vznik hoření v trachei a bronších podporují vyšší frakce inspirovaného kyslíku, přítomnost plastové endotracheální kanyly nebo silikonových stentů [28]. Prevencí vznícení je použití nízkých koncentrací kyslíku (ideálně vzduchu) v průběhu koagulace nebo laserové vaporizace, použití rigidního bronchoskopu nebo supraglotické pomůcky místo tracheální rourky, insuflace oxidu uhličitého před zahájením kauterizace. Při vznícení je ihned snížena FiO2 na 0,21, přerušen výkon a zahájeny proplachy velkým množstvím sterilního fyziologického roztoku [29].
ZÁVĚR
Anestezie pro výkony intervenční bronchologie vyžaduje anesteziologa, který je obeznámen s principy tryskové ventilace, obtížného zajištění dýchacích cest včetně infraglotických chirurgických přístupů a také se základními principy anestezie v hrudní chirurgii. V budoucnosti je možné očekávat nárůst náročných endobronchiálních intervencí včetně hybridních výkonů s torakoskopiemi nebo i otevřenými operacemi hrudníku [30].
Poděkování
Prim. MUDr. Jiřímu Votrubovi za poskytnutí fotodokumentace a kritické připomínky k textu.
Do redakce došlo dne 20. 3. 2016.
Do tisku přijato dne 10. 6. 2016.
Adresa pro korespondenci:
doc. MUDr. Pavel Michálek, Ph.D., DESA, MSc
KARIM 1. LF UK a VFN Praha
U Nemocnice 2
128 08 Praha 2
e-mail: pavel.michalek@vfn.cz
Zdroje
1. Pawlowski, J. Anesthetic considerations for interventional pulmonary procedures. Current Opinion in Anesthesiology, 2013, 26, 1, p. 6–12.
2. Ernst, A., Feller-Kopman, D., Becker, H. D., Mehta, A. C. Central airway obstruction. American Journal of Respiratory Critical Care Medicine, 2004, 169, 12, p. 1278–1297.
3. Beaudoin, E. L., Chee, A., Stather, D. R. Interventional pulmonology: an update for internal medicine physician. Minerva Medica, 2014, 105, 3, p.: 197–209.
4. Votruba, J., Zemanová, P., Lambert, L., Vesela, M. M. The role of airway and endobronchial ultrasound in perioperative medicine. BioMed Research International, 2015, p. 754–626.
5. Mahmood, K., Wahidi, M. M. Ablative therapies for central airway obstruction. Seminars in Respiratory and Critical Care Medicine, 2014, 35, 6, p. 681–692.
6. Lukas, J., Votruba, J., Paska, J., Cernohorsky, S., Lukas, D., Machon, D. Laryngotracheal stenosis in critically ill patients. Acta Otolaryngologica, 2011, 131, 1, p: 91–95.
7. Fidkowski, C. W., Zheng, H., Firth, P. G. The anesthetic considerations of tracheobronchial foreign bodies in children: a literature review of 12,979 cases. Anesthesia Analgesia, 2010, 111, 4, p. 1016–1025.
8. Meena, M., Dixit, R., Singh, M., Samaria, J. K., Kumar, S. Surgical and bronchoscopic lung volume reduction in chronic obstructive pulmonary disease. Pulmonary Medicine, 2014, 2014 : 757016.
9. Thomson, N. C., Rubin, A. S., Niven, R. M. et al. Long-term (5 year) safety of bronchial thermoplasty: Asthma Intervention Research (AIR) trial. BMC Pulmonary Medicine, 2011, 11 : 8.
10. Michaud, G., Berkowitz, D. M., Ernst, A. Pleuroscopy for diagnosis and therapy for pleural effusions. Chest, 2010, 138, 5, p. 1242–1246.
11. Jose, R. J., Shaefi, S., Navani, N. Anesthesia for bronchoscopy. Current Opinion in Anesthesiology, 2014, 27, 4, p. 453–457.
12. Abdelmalak, B., Doyle, D. J. Anesthesia for otolaryngologic surgery. Cambridge University Press, Cambridge 2013.
13. Evans, E., Biro, P., Bedforth, N. Jet ventilation. Continuing Education in Anaesthesia, Critical Care and Pain Management, 2007, 7, 1, p. 2–5.
14. Nicolini, A., Ferrari, M. B. Evaluation of a transcutaneous carbon dioxide monitor in patients with acute respiratory failure. Annals of Thoracic Medicine, 2011, 6, 4, p. 217–220.
15. Baraka, A. S., Siddik, S. S., Taha, S. K., Jalbout, M. I., Massouh, F. M. Low frequency jet ventilation for stent insertion in a patient with tracheal stenosis. Canadian Journal of Anaesthesia, 2001, 48, 7, p. 701–704.
16. Evans, K. L., Keene, M. H., Bristow, A. S. High-frequency jet ventilation – a review of its role in laryngology. Journal of Laryngology and Otology, 1994, 108, 1, p. 23–25.
17. Pathak, V., Welsby, I., Mahmood, K., Wahidi, M., MacIntyre, N., Shofer, S. Ventilation and anesthetic approaches for rigid bronchoscopy. Annals of American Thoracic Society, 2014, 11, 4, p. 628–634.
18. José, R. J., Shaefi, S., Navani, N. Sedation for flexible bronchoscopy: current and emerging evidence. European Respiratory Review, 2013, 22, 128, p. 106-116.
19. Vymazal, T., Krecmerova, M. Respiratory strategies and airway management in patients with pulmonary alveolar proteinosis: a review. BioMed Research International, 2015, 2015, 639543.
20. Passot, S., Servin, F., Allary, R., Pascal, J., Prades, J. M., Auboyer, C., Molliex, C. Target-controlled versus manually-controlled infusion of propofol for direct laryngoscopy and bronchoscopy. Anesthesia Analgesia, 2002, 94, 5, p. 1212–1216.
21. Blank, R. S., de Souza, D. G. Anesthetic management of patients with an anterior mediastinal mass. Canadian Journal of Anesthesia, 2011, 58, p. 853–867.
22. Robins, B., Das, A. K. Anesthetic management for acquired tracheoesophageal fistula: a brief report. Anesthesia Analgesia, 2001, 93, 4, p. 903–905.
23. Coté, C. J., Hartnick, C. J. Pediatric transtracheal and cricothyrotomy airway devices for emergency use: which are appropriate for infants and children? Paediatric Anaesthesia, 2009, 19, S1, p. 66–76.
24. Seghal, I. S., Dhooria, S., Ram, B. et al. Foreign body inhalation in the adult population: experience of 25,998 bronchoscopies and systematic review of the literature. Respiratory Care, 2015, 60, 10, p. 1438–1448.
25. Ost, D. E., Ernst, A., Grosu, H. B., Lei, X., Diaz-Mendoza, J., Slade, M. et al. Complications following therapeutic bronchoscopy for malignant central airway obstruction: results of the AQuIRE registry. Chest, 2015, 148, 2, p. 450–471.
26. Vymazal, T. Massive hemorrhage management – a best evidence topic report. Therapeutics and Clinical Risk Management, 2015, 11, p. 1107–1111.
27. Husain, L. F., Hagopian, L., Wayman, D., Baker, W. E., Carmody, K. A. Sonographic diagnosis of pneumothorax. Journal of Emergencies, Trauma and Shock, 2011, 5, 1, p. 76–81.
28. Lee, J. Y., Park, C. B., Cho, E. J., Kim, C. J., Chea, J. S., Lee, B. H. et al. Airway fire injury during rigid bronchoscopy in a patient with a silicone stent – a case report. Korean Journal of Anesthesiology, 2012, 62, 2, p. 184–187.
29. Zakaluzny, S. A., Lane, J. D., Mair, E. A. Complications of tracheobronchial airway stents. Otolaryngology, Head and Neck Surgery, 2003, 128, 4, p. 478–488.
30. Arias, S., Lee, H. J. The future of interventional pulmonology. Seminars in Respiratory and Critical Care Medicine, 2014, 35, 6, p. 763–768.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Slovo vedoucího redaktoraČlánek Zajímavosti, tipy a triky
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2016 Číslo 4- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Slovo vedoucího redaktora
- Specifika intervenční bronchologie z pohledu anesteziologa
- Pooperační nauzea a zvracení u dětí
- Novinky v kardiopulmonální resuscitaci v porodnictví
- Biomarkery akutního poškození ledvin – pohled za oponu
- Několik poznámek klinických biochemiků k akutnímu poškození ledvin
- Je morfin stále indikován v léčbě kardiogenního plicního edému?
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Neopioidní analgetika v léčbě akutní pooperační bolesti
- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Koncept stressed and unstressed volume a jeho klinický význam
- Doporučení pro léčbu akutního selhání pravé komory
- Zajímavosti, tipy a triky
- Perioperační management u pacientů s kardiostimulátorem
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Perioperační management u pacientů s kardiostimulátorem
- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Pooperační nauzea a zvracení u dětí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání