-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Je morfin stále indikován v léčbě kardiogenního plicního edému?
Is morphine still indicated for the management of cardiogenic pulmonary oedema?
Morphine has been one of the cornerstones of the emergency pharmacological management of acute cardiogenic pulmonary oedema (CPE). However, there is only minimal evidence-based support for this strategy and some studies suggest that its administration might be associated with increased risk of need of mechanical ventilation and with higher mortality. Thus, we decided to evaluate the current knowledge on the use of morphine in the treatment of CPE, and assess the pros and cons of its use in the emergency clinical setting. At present there is no reliable evidence either supporting or rejecting the use of morphine in CPE. Therefore we conclude that morphine should not be used in this indication routinely, but after careful individual consideration only.
KEYWORDS:
acute cardiogenic pulmonary oedema – morphine
Autoři: R. Škulec 1,2,3; K. Kučera 1; J. Callerová 1; J. Knor 1; P. Merhaut 1; V. Černý 2,3,4,5
Působiště autorů: Zdravotnická záchranná služba Středočeského kraje, Kladno 1; Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně v Ústí nad Labem, Masarykova nemocnice v Ústí nad Labem 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové 3; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové 4; Department of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Nova Scotia, Canada 5
Vyšlo v časopise: Anest. intenziv. Med., 27, 2016, č. 4, s. 237-242
Kategorie: Intenzivní medicína - Speciální článek
Souhrn
Morfin je tradičním lékem používaným v urgentní terapii akutního kardiogenního plicního edému (CPE). Pro jeho podávání však existuje pouze minimální podpora založená na důkazech a některé práce dokonce naznačují, že podávání morfinu v léčbě CPE může být spojeno s vyšším rizikem nutnosti umělé plicní ventilace a s vyšší mortalitou. Rozhodli jsme se prozkoumat dosavadní poznatky o využití morfinu v léčbě CPE a zhodnotit argumenty pro a proti jeho podávání v urgentní léčbě. V současnosti nemáme k dispozici žádný spolehlivý důkaz, který by svědčil proti používání morfinu v urgentní léčbě CPE, ale ani který by prokazoval prospěch z jeho použití. Domníváme se proto, že by morfin neměl být v této indikaci podáván jako rutinní součást farmakoterapie, ale jeho použití by mělo být velmi pečlivě individuálně zváženo.
Klíčová slova:
akutní kardiogenní edém plic – morfinÚVOD
Akutní kardiogenní edém plic (CPE) je jedním z klinických projevů akutního srdečního selhání. Patří mezi relativně časté indikace k výjezdu zdravotnické záchranné služby. Jedná se o život ohrožující stav a vyžaduje okamžitou léčebnou intervenci. Terapeutická strategie záleží na vyvolávající příčině a klinickém průběhu. V řadě učebnic i v doporučeních pro diagnostiku a léčbu se jako součást urgentní terapie uvádí nitrožilní podání morfinu [1, 2, 3]. Překvapivě, pro podávání tohoto léku existuje pouze minimální podpora založená na důkazech a dokonce se zdá, že jeho indikace může být sporná. Rozhodli jsme se proto prozkoumat dosavadní poznatky o využití morfinu v léčbě CPE a zhodnotit argumenty pro a proti jeho podávání v urgentní léčbě.
PATOFYZIOLOGICKÉ POZNÁMKY
Z hlediska volby odpovídající urgentní terapie je klíčové rozpoznat, zda se jedná o CPE s normální systolickou funkcí levé komory srdeční nebo se systolickou dysfunkcí. Pokud nemáme k dispozici anamnestické údaje a/nebo echokardiografické vyšetření, což je realitou zejména v přednemocniční neodkladné péči, rozlišujeme, zda se jedná o CPE spojený s arteriální hypertenzí nebo s hypotenzí. CPE s hypertenzí doprovází známky zvýšené aktivace sympatiku s tachykardií a vazokonstrikcí. Systolická funkce levé komory bývá většinou normální nebo mírně snížená [4]. Plicní edém nebývá doprovázen známkami systémového městnání, bývá přítomna euvolémie nebo pouze lehká hypervolémie. Prognóza je při správně zvolené terapii dobrá a klinická odpověď na včas zahájenou léčbu bývá rychlá. Naproti tomu CPE s hypotenzí je závažný stav s vysokou mortalitou. Obvykle je spojen s pokročilou systolickou dysfunkcí levé komory srdeční a/nebo s významnou chlopenní vadou. Může probíhat až pod obrazem kardiogenního šoku se všemi typickými projevy. Časté jsou poruchy srdečního rytmu. CPE s normotenzí představuje diagnosticky šedou zónu s řadou možných vyvolávajících příčin.
TERAPIE CPE
Prioritou urgentní terapie CPE s hypertenzí je úprava oxygenace snížením afterloadu levé srdeční komory (tedy odstraněním hypertenze) a oxygenoterapií, respektive některou z forem ventilační podpory [5]. Úvodní léčba musí být energická a řídí se aktuálním klinickým stavem. Z farmakologických postupů jsou indikovány nitráty (nitroglycerin, isosorbiddinitrát, eventuálně nitroprussid sodný) a kličková diuretika (furosemid). Cotter et al. prokázali, že podání nízké dávky furosemidu následované bolusovou titrací vysoké dávky nitrátů je bezpečné a efektivnější než podání vysoké dávky furosemidu a nízké dávky nitrátů [16]. U pacientů s CPE s hypertenzí bývá obvykle intravaskulární objem normální a projevy plicního edému jsou projevem redistribuce. Nadměrná dávka kličkových diuretik může vést k depleci objemu a k následné hypotenzi, iontové dysbalanci s rizikem arytmií a k nadměrné neurohumorální aktivaci. Může být indikován morfin či antihypertenziva s dominujícím vazodilatačním účinkem (inhibitory angiotenzin konvertujícího enzymu, urapidil). Samozřejmostí je oxygenoterapie kyslíkovou maskou s rezervoárem a s vysokým průtokem O2 (10–15 l/min.). Indikována může být neinvazivní plicní ventilace, v krajním případě i konvenční umělá plicní ventilace. Z dalších nefarmakologických postupů je zásadní poloha vsedě a je vhodné zvážit nekrvavou venepunkci.
Léčba CPE s hypotenzí vyžaduje odlišnou strategii [5]. Je zaměřená především na redukci preloadu a zvýšení systolické funkce levé komory s očekávaným zlepšením oxygenace a odstraněním tkáňové hypoperfuze. Přestože nitráty a furosemid snižují preload, jejich použití je omezené pro riziko dalšího poklesu krevního tlaku. Kontraindikována jsou všechna farmaka, která mohou prohlubovat hypotenzi. Na místě je včasná indikace umělé plicní ventilace, používáme anestetika s minimálním kardiodepresivním účinkem. Vazopresory jsou indikovány pouze pro stavy s rozvíjející se těžkou život ohrožující systémovou hypotenzí progredující do kardiogenního šoku. Do nemocniční péče patří použití inotropik (dopamin, dobutamin, inhibitory fosfodiesterázy, levosimendan), či nějaká forma mechanické podpory krevního oběhu.
Od prvního kontaktu s nemocným je třeba vždy aktivně vyhledávat a léčit odstranitelnou příčinu CPE, zejména akutní koronární syndrom.
POZICE MORFINU V LÉČBĚ CPE
Podle posledních doporučení Evropské kardiologické společnosti pro diagnostiku a léčbu akutního a chronického srdečního selhávání může být morfin indikován v léčbě akutního srdečního selhání [1]. Indikace je založena na očekávání především anxiolytického účinku a potlačení subjektivního vnímání dušnosti a také na možné redukci preloadu prostřednictvím venodilatace a sympatolytického efektu [1]. Zmíněny jsou možné nežádoucí účinky, konkrétně nauzea a útlum dechové aktivity. Tato doporučení akceptuje i Česká kardiologická společnost.
Hemodynamický efekt morfinu u nemocných s CPE
Studií sledujících bezprostřední hemodynamický efekt morfinu na nemocné s akutním levostranným srdečním selháním s těžkou dušností, respektive s plicním edémem, bylo publikováno velmi málo (tab. 1). Dominantní efekt je pokles krevního tlaku a tepové frekvence s minimálním vlivem na plicní cirkulaci a srdeční výdej. Pokles arteriální oxygenace je navozen spíše útlumem spontánní dechové aktivity než sekundárně ovlivněním hemodynamiky. Jako další argumenty pro používání morfinu v terapii CPE byly uváděny klinické studie sledující hemodynamický efekt morfinu u pacientů s akutním infarktem myokardu, kteří ale byli bez známek plicního edému [12, 13, 14].
Publikovaných prací je ve skutečnosti příliš málo na to, abychom získali podrobný obraz hemodynamického účinku morfinu u pacientů s různými typy CPE. V každém případě, některé předpokládané účinky extrapolované z nálezů u zdravých dobrovolníků nebo pacientů s jinými kardiovaskulárními onemocněními byly potvrzeny, jiné však nikoliv.
Naopak byla publikována kazuistická sdělení a experimentální práce dokladující, že morfin sám o sobě může vést k dysfunkci myokardu a ke kardiogennímu šoku [15–21].
Další možné relevantní účinky morfinu u pacientů s CPE
Morfin je lékem s řadou různých dalších účinků, kromě vyjmenovaných v tabulce 1, z nichž některé mohou být potenciálně prospěšné, nebo naopak škodlivé u pacientů s CPE (tab. 2) [10, 16, 21–30]. Je však třeba zdůraznit, že se jedná opět o extrapolace z jiných klinických situací než CPE a přes široké používání morfinu v této indikaci po mnoho let nemáme žádné spolehlivé informace. Dokonce ani anxiolytický účinek a potlačení subjektivního vnímání dušnosti, tedy účinky, které nesporně jsou morfinem u většiny pacientů s CPE navozeny, nebyly nijak experimentálně objektivizovány a kvantifikovány. Jsou v podstatě konsenzuální shodou. Tímto tvrzením nechceme uvedené účinky nijak zpochybnit, ale jejich podrobné prostudování by posílilo vědomí, že přesně víme, co lze od podávání morfinu u nemocných s CPE očekávat. Pro srovnávání anxiolytického účinku morfinu s jiným lékem je tato kvantifikace nezbytná.
Tab. 1. Hemodynamický efekt morfinu u nemocných s akutním srdečním selháním s plicním edémem 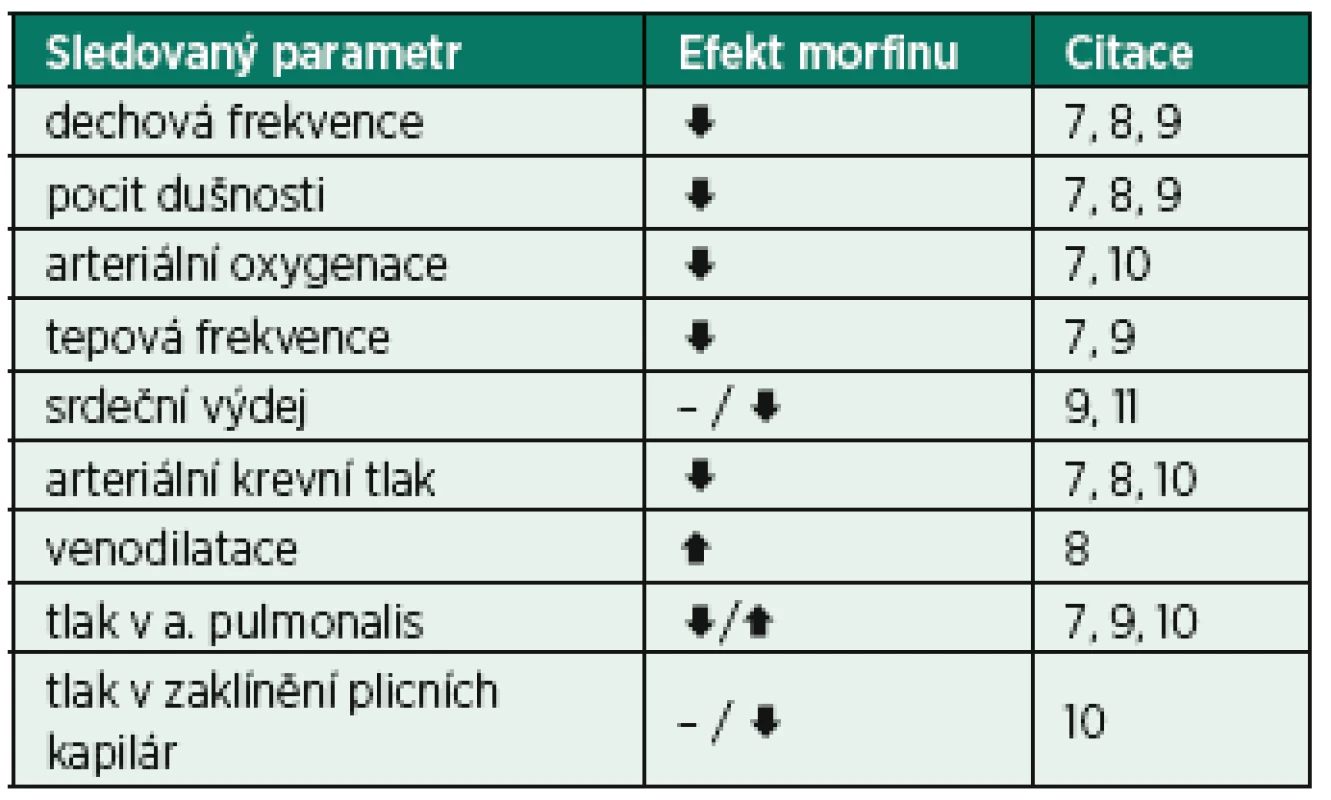
↓– snížení, ↑ – nárůst, – bez efektu Tab. 2. Potencionálně prospěšné a nežádoucí účinky morfinu u nemocných s CPE 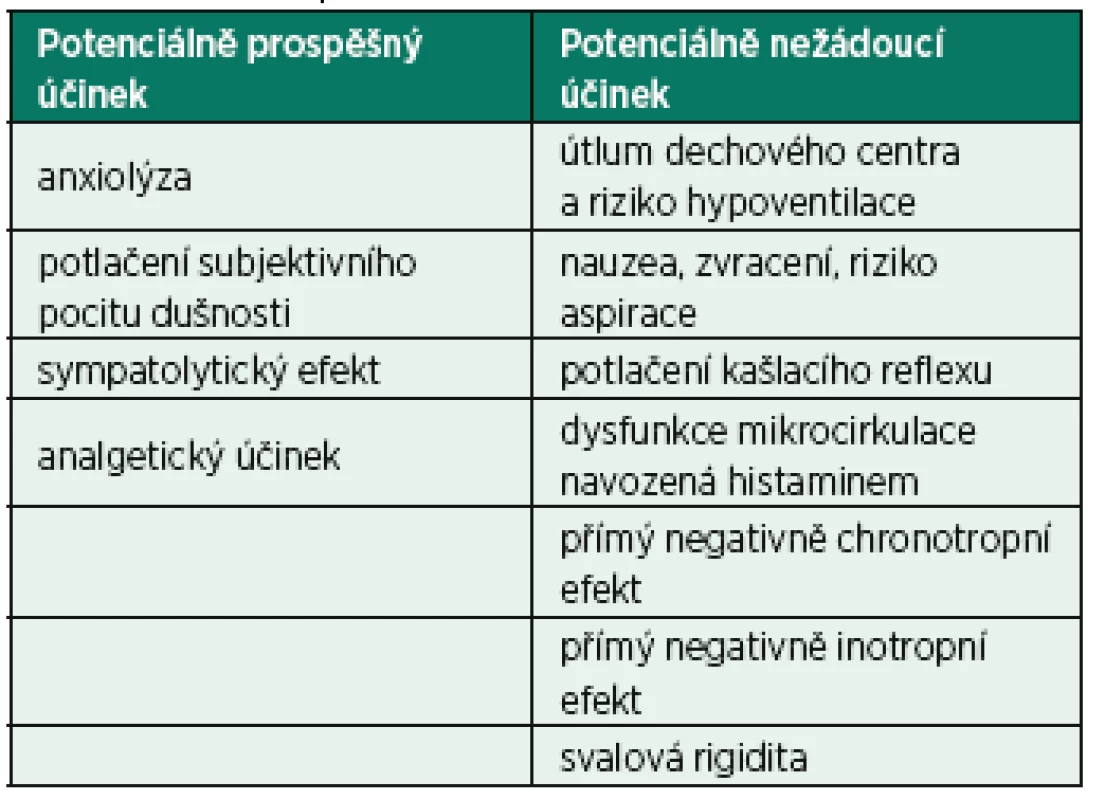
KLINICKÉ STUDIE
Doposud bylo publikováno několik klinických studií, které hodnotí vliv morfinu podávaného jako součást akutní léčby nemocných s CPE na prognózu (tab. 3). PE bez akutního infarktu myokardu, srovnávali poměrně neobvyklé kombinace léků. V první skupině (F/M skupina) podávali průměrně 80 mg furosemidu i. v. v kombinaci s průměrnou dávkou morfinu 3 mg i. v., ve druhé skupině (NTG/NAC skupina) N-acetylcystein v kontinuální 24hodinové infuzi v dávce 6,6 μg/min. a nitroglycerin i. v. v průměrné dávce 2,5 μg/min. v první hodině s následnou eskalací. Autoři nezaznamenali žádné rozdíly mezi skupinami v kardiopulmonálních parametrech, v mortalitě a v nutnosti UPV. Interpretace studie je však velmi obtížná pro výrazné poddávkování morfinu i nitroglycerinu, hodnocení dvou léčiv v každé skupině a zcela nejasná je pozice N-acetylcysteinu [31].
Tab. 3. Přehled klinických studií hodnotících podávání morfinu v urgentní léčbě kardiogenního plicního edému 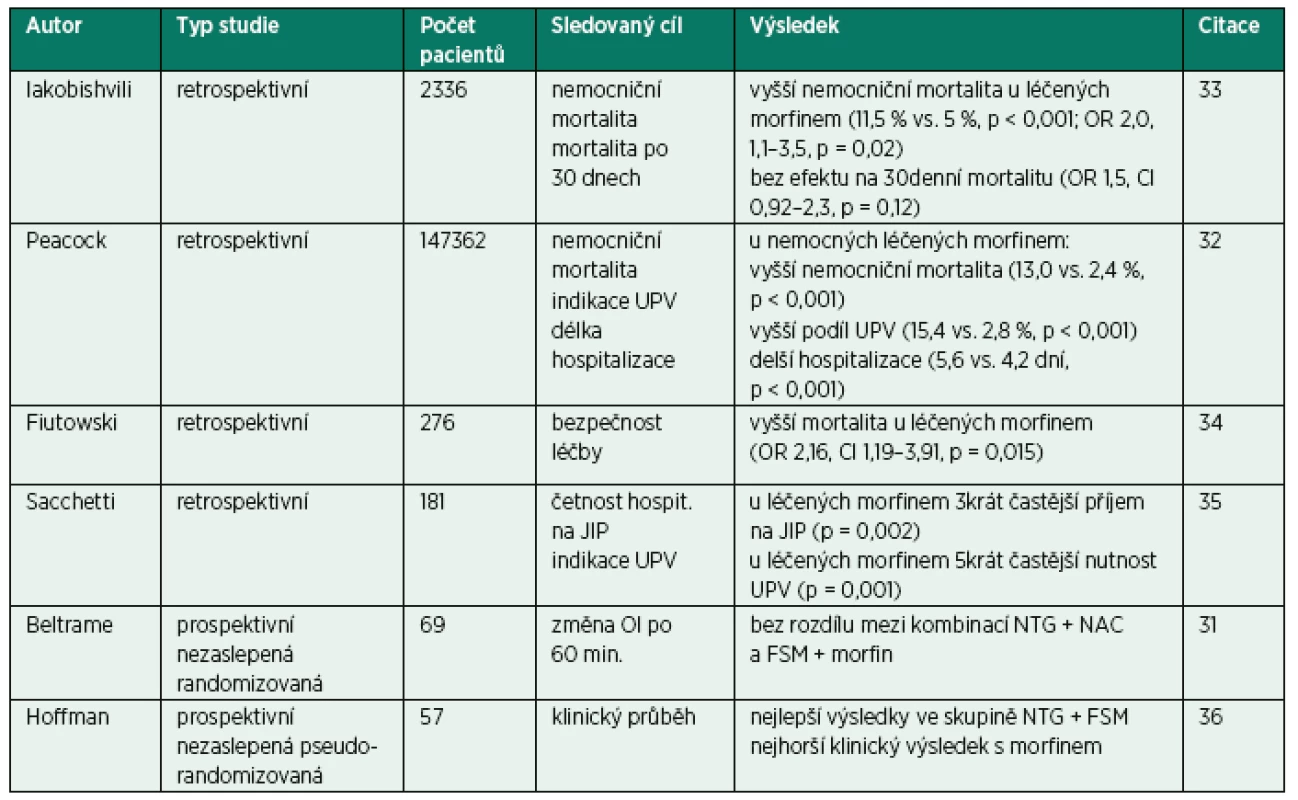
UPV – umělá plicní ventilace, JIP – jednotka intenzivní péče, OI – oxygenační index, NTG – nitroglycerin, NAC – N-acetylcystein, FSM – furosemid Peacock et al. realizovali rozsáhlou retrospektivní analýzu databáze ADHERE (The Acute Decompensated Heart Failure National Registry). V rozsáhlém souboru 147 362 hospitalizovaných pacientů s akutním srdečním selháním porovnali výsledky ve skupině léčené morfinem s nemocnými, u kterých nebyl morfin aplikován. Z celkového počtu nemocných bylo morfinem léčeno 14,1 %. Mezi skupinami nebyly ve vstupních datech pozorovány zásadní rozdíly. V dalším průběhu však pacienti léčení morfinem častěji vyžadovali podávání inotropik a vazodilatátorů, měli vyšší nemocniční mortalitu (13,0 versus 2,4 %), častěji byli léčeni umělou plicní ventilací (15,4 versus 2,8 %) a byli déle hospitalizováni (5,6 versus 4,2 dní, p pro všechny srovnání < 0,001). I po vyřazení nemocných vyžadujících umělou plicní ventilaci byl morfin nezávislým prediktorem hospitalizační mortality (OR 4,84; CI 4,52–5,18; p < 0,001) [32].
V ostatních retrospektivních analýzách zahrnujících vždy pouze několik desítek nemocných léčených v nemocnici autoři referovali o asociaci podávání morfinu u nemocných s CPE s některými nepříznivými ukazateli, jako je hospitalizační mortalita nebo nutnost umělé plicní ventilace [33–36].
Autoři tohoto přehledného článku v rámci projektu ProAir (Pre-hospital intervention in acute cardiogenic pulmonary oedema) hodnotí retrospektivní registr nemocných s CPE ošetřených Zdravotnickou záchrannou službou Středočeského kraje. Analýza prvních konsekutivních 213 nemocných ukázala, že morfinem bylo léčeno 14,1 %.
Svoboda et al. uvádí použití morfinu u 6,1 % z celkového počtu 1345 pacientů léčených v přednemocniční neodkladné péči pro akutní srdeční selhání [37].
INTERPRETACE POZNATKŮ
Domníváme se, že pečlivým vyhodnocením dostupných klinických a experimentálních studií, konsenzuálních názorů a vlastních osobních zkušeností lze konstatovat následující:
- Morfin není používán v léčbě CPE často, ale je po desetiletí považován za plnohodnotný lék volby, s kterým má mnoho lékařů velké zkušenosti a jeho použití podporují i aktuální doporučení.
- Od morfinu je v urgentní terapii CPE očekáváno potlačení subjektivního pocitu dušnosti, anxiolytický efekt a redukce preloadu.
- V kontrastu s body 1 a 2 téměř neexistují přímé klinické vědecké důkazy doložené relevantní randomizovanou studií podporující podávání morfinu v této indikaci.
- Nedostatečné experimentální důkazy o hemodynamickém účinku morfinu v této indikaci nesplňují očekávání extrapolované z účinků morfinu v jiných indikacích či u zdravých organismů.
- Dostupné důkazy o nízké kvalitě (retrospektivní analýzy) naznačují, že podávání morfinu v této indikaci může být spojeno s horší prognózou nemocných.
ZÁVĚR A DOPORUČENÍ PRO PRAXI
V současnosti nemáme k dispozici žádný spolehlivý důkaz, který by svědčil proti používání morfinu v urgentní léčbě CPE, ale ani který by prokazoval prospěch z jeho použití. Domníváme se proto, že by morfin neměl být v této indikaci podáván jako rutinní, fixní součást farmakoterapie, ale jeho použití by mělo být velmi pečlivě individuálně zváženo. Je třeba mít i na paměti, že morfin nemá zásadní vliv na kauzální léčbu CPE, ale jeho dominantní účinek je symptomatické potlačení úzkosti a subjektivního vnímání dušnosti.
Přestože se jedná o velmi tradiční lék, uspořádání randomizované klinické studie hodnotící jeho vliv na prognózu může vést jak k renesanci jeho používání v uvedené indikaci, tak k ukončení jeho používání nebo nahrazení jiným anxiolytikem.
Konflikt zájmů: žádný.
Podíl účasti jednotlivých spoluautorů
Všichni spoluautoři se podíleli na analýze a interpretaci dostupné literatury. KK a RŠ připravovali text, všichni se podíleli na úpravách textu do finální podoby.
Do redakce došlo dne 14. 11. 2015.
Do tisku přijato dne 1. 12. 2015.
Adresa pro korespondenci:
MUDr. Roman Škulec, Ph.D.
Prof. Veselého 461
266 01 Beroun
e-mail: skulec@email.cz
Zdroje
1. McMurray, J. J. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. Eur. Heart J., 2012, 33, 14, p. 1787–1847.
2. Yancy, C. W. et al. 2013 ACCF/AHA Guideline for the Management of Heart Failure. Circulation, 2013, 128, 16, p. e240–e327.
3. Mann, D. L. , Zipes, D. P., Libby, P. B. R., Bonow, R. O. Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 10th ed.: Elsevier Saunders, 2012.
4. Gandhi, S. K. et al. The pathogenesis of acute pulmonary edema associated with hypertension. N. Engl. J. Med., 2001, 344, 1, p. 17–22.
5. Mebazaa, A. et al. Recommendations on pre-hospital & early hospital management of acute heart failure: a consensus paper from the Heart Failure Association of the European Society of Cardiology, the European Society of Emergency Medicine and the Society of Academic Emergency Medicine. Eur. J. Heart Fail. 2015, 17, 6, p. 544–558.
6. Cotter, G. et al. Randomised trial of high-dose isosorbide dinitrate plus low-dose furosemide versus high-dose furosemide plus low-dose isosorbide dinitrate in severe pulmonary oedema. Lancet, 1998, 351, 9100, p. 389–393.
7. Hoel, B. L., Refsum, H. E. The effects of morphine on the arterial and mixed venous blood gas state and on the hemodynamics in patients with clinical pulmonary congestion. Acta Med. Scand., 1971, 190, 6, p. 549–554.
8. Vismara, L. A. et al. The effect of morphine on venous tone in patients with acute pulmonary edema. Circulation, 1976, 54, 2, p. 335–337.
9. Timmis, A. D. et al. Haemodynamic effects of intravenous morphine inpatiens with acute myocardial infarction compilacated by severe left ventricular failure. Br. Med. J., 1980, 280, 6219, p. 980–982.
10. Klinefelter, H. Morphine for pulmonary edema (Letter). JAMA, 1974, 229, 6, p. 638.
11. Grendahl, H. et al. The effect of intravenous morphine in patients with mitral valvular disease and congestive heart failure. Acta Med. Scand., 1973, 1–2, 1, p. 69–74.
12. Lee, G. et al. Comparative effects of morphine, meperidine and pentazocine on cardiocirculatory dynamics in patients with acutemyocardial infarction. Am. J. Med., 1976, 60, 7, p. 949–955.
13. Lee, G. et al. Hemodynamic effects of morphine and nalbuphine in acute myocardial infarction. Clinical Pharmacology and Therapeutics, 1981, 29, 5, p. 576–581.
14. Alderman, E. L. et al. Hemodynamic Effects of Morphine and Pentazocine Differ in Cardiac Patients. N. Engl. J. Med., 1972, 287, 13, p. 623–627.
15. Feeney, C. et al. Morphine Induced Cardiogenic Shock. The Annals of Pharmacotherapy, 2011, 45, 6, p. 30.
16. Llobel, F., Laorden, M. L. Effects of morphine on atrial preparations obtained from nonfailing and failing human hearts. Br. J. Anaesth., 1996, 76, 1, p. 106–110.
17. Hung, C. F., Tsai, C. H., Su, M. J. Opioid receptor independent effects of morphine on membrane currents in single cardiac myocytes. Br. J. Anaesth., 1998, 81, 6, p. 925–931.
18. Kistner, J. R. et al. Indices of myocardial oxygenation during coronary artery revascularization in man with morphine versus halothane anesthesia. Anesthesiology, 1979, 50, 4, p. 324–330.
19. Riggs, T. R., Yano, Y., Vargish, T. Opiate agonist depression of myocardial function is dose related and independent of pentoobarbital or chloral hydrate anesthesia. Am. Surg., 1986, 52, 12, p. 654–658.
20. Riggs, T. R., Yano, Y., Vargish, T. Morphine depression of myocardial function. Circ. Shock, 1986, 19, 1, p. 31–38.
21. Vargish, T. et al. Morphine sulfate depression of cardiac function is attenuated by opiate receptor antagonism with naloxone. Circ. Shock, 1987, 23, 3, p. 189–195.
22. Freye, E. Opioide in der Medizin. 8th ed.: Berlin: Springer, 2010.
23. Herz, A. Opioids I. and II. Handbook of Experimental Pharmacology. Berlin: Springer, 1993, vol. 104 I. and II.
24. Kitahata, L. M., Collins, J. G., Robinson, C .J. Narcotic Analgesics in Anesthesiology. Baltimore: Williams& Wilkins, 1982, p. 57.
25. Grossmann, M. et al. Morphine-induced venodilation in humans. Clin. Pharmacol. Ther., 1996, 60, 5, p. 554–560.
26. Durant, P. A., Yaksh, T. L. Drug effects on urinary bladder tone during spinal morphine-induced inhibition of the micturition reflex in unanesthetized animals. Anesthesiology, 1988, 68, 3, p. 325–334.
27. Kuipers, P. W. et al. Intrathecal opioids and lower urinary tract function: A urodynamic evaluation. Anesthesiology, 2004, 100, 6, p. 1497–1503.
28. Malinovsky, J. M. et al. The urodynamic effects of intravenous opioids and ketoprofen in humans. Anesthesia Analgesia, 1998, 87, 2, p. 456–461.
29. Van der Lee, R., Ceelie, I., de Wildt, S. N. Morphine-induced muscle rigidity in a term neonate. Ann. Pharmacother., 2009, 43, 10, p. 1724–1726.
30. Wardas, J., Ossowska, K., Wolfarth, S. The role of gamma-aminobutyric acid mechanisms of the zona incerta-lateral hypothalamus in the catalepsy and muscle rigidity evoked by morphine. Brain Research, 1987, 408, 1–2, p. 363–366.
31. Beltrame, J. F. et al. Nitrate therapy is an alternative to furosemide/morphine therapy in the management of acute cardiogenic pulmonary edema. J. Card. Fail., 1998, 4, 4, p. 271–279.
32. Peacock, W. F. et al. Morphine and outcomes in acute decompensated heart failure: an ADHERE analysis. Emerg. Med. J., 2008, 25, 4, p. 205–209.
33. Iakobishvili, Z. et al. Use of intravenous morphine for acute decompensated heart failure in patients with and without acute coronary syndromes. Acute Card. Care, 2011, 13, 2, p. 76–80.
34. Fiutowski, M. et al. Relationship of medical therapy and survival in patients after acute cardiogenic pulmonary oedema. Polski Przeglad Kardiologiczny, 2003, 5, 4, p. 409–414.
35. Sacchetti, A. et al. Effect of ED management on ICU use in acute pulmonary edema. Am. J. Emerg. Med., 1999, 17, 6, p. 571–574.
36. Hoffman, J. R., Reynolds, S. Comparison of nitroglycerin, morphine and furosemide in treatment of presumed pre-hospital pulmonary edema. Chest, 1987, 92, 4, p. 586–593.
37. Svoboda, J. et al. Acute heart failure in pre-hospital care. Results from CARE PRE-H registry. Exp. Clin. Cardiol., 2014, 20, 8, p. 3604–3620.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Slovo vedoucího redaktoraČlánek Zajímavosti, tipy a triky
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2016 Číslo 4- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Slovo vedoucího redaktora
- Specifika intervenční bronchologie z pohledu anesteziologa
- Pooperační nauzea a zvracení u dětí
- Novinky v kardiopulmonální resuscitaci v porodnictví
- Biomarkery akutního poškození ledvin – pohled za oponu
- Několik poznámek klinických biochemiků k akutnímu poškození ledvin
- Je morfin stále indikován v léčbě kardiogenního plicního edému?
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Neopioidní analgetika v léčbě akutní pooperační bolesti
- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Koncept stressed and unstressed volume a jeho klinický význam
- Doporučení pro léčbu akutního selhání pravé komory
- Zajímavosti, tipy a triky
- Perioperační management u pacientů s kardiostimulátorem
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Perioperační management u pacientů s kardiostimulátorem
- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Pooperační nauzea a zvracení u dětí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



