-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
Metformin-associated lactic acidosis
This review summarizes the issue of metformin-associated lactic acidosis based on three case reports of patients with a significant haemodynamic alteration – severe circulatory shock associated with lactic acidosis.
KEYWORDS:
metformin – lactic acidosis – circulatory shock – intensive care
Autoři: T. Karvunidis; M. Harazím
; J. Raděj; I. Novák; J. Horák; M. Matějovič
Působiště autorů: I. interní klinika, Fakultní nemocnice Plzeň a Lékařská fakulta Plzeň, Univerzita Karlova v Praze
Vyšlo v časopise: Anest. intenziv. Med., 27, 2016, č. 4, s. 243-251
Kategorie: Intenzivní medicína - Kazuistika
Souhrn
Přehledový článek prezentuje problematiku s metforminem asociované laktátové acidózy na podkladě tří případů nemocných s významnou alterací hemodynamiky – těžkým cirkulačním šokem s laktátovou acidózou.
Klíčová slova:
metformin – laktátová acidóza – cirkulační šok – intenzivní péčeKAZUISTIKA I
Šedesátiletý hypertonik a diabetik 2. typu (inzulin + metformin) byl přijat na standardní oddělení ortopedické kliniky k elektivní náhradě pravého kolenního kloubu. Výkon zajištěný perioperační antibiotickou profylaxí (cefuroxim) proběhl zcela nekomplikovaně. Druhý pooperační den se rozvinul celotělový svědící exantém charakteru urtiky. Byla ukončena zmíněná antibiotická (ATB) léčba a aplikována antihistaminika. Čtvrtý den po operaci došlo k synkopě/kolapsu s pádem při chůzi na toaletu. Tato událost nevedla k žádnému traumatu včetně operovaného kolene. Následující den pociťoval nemocný nevolnost a několikrát zvracel žaludeční obsah bez patologické příměsi. Laboratorně byla současně dokumentována těžká hypoglykémie (glykémie 1,9 mmol/l). Po intravenózní aplikaci koncentrované glukózy došlo k parciálnímu zlepšení stavu a dočasnému ústupu obtíží. Následující den (6. pooperační) byl nemocný od rána klidově dušný, desaturovaný (SpO2 < 80 %), tachypnoický (DF 48/min), hypotenzní (až 80/60 mm Hg), opocený, bledý s chladnými akry. Vzhledem k uvedenému byl přeložen na jednotku intenzivní péče (JIP) ortopedické kliniky. Konzultovaný internista a kardiolog indikovali CT pneumoangiografii, která však neprokázala plicní embolizaci ani postižení plicního parenchymu či jinou nitrohrudní patologii. V dalších hodinách dále progredovala oběhová i ventilační nestabilita, přidala se i porucha vědomí a laboratorně byla zjištěna těžká metabolická acidóza (MAC) s hyperlaktatémií (tab. 1). Byly přítomny známky systémové infekce a akutního poškození ledvin. Nemocný byl v tomto stavu přeložen na naše pracoviště.
Tab. 1. Vybrané laboratorní parametry – kazuistika I 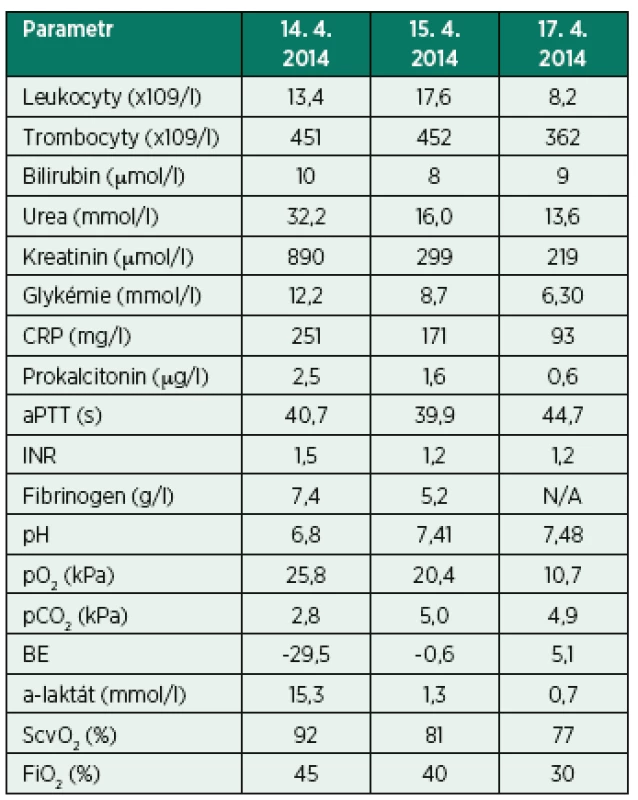
CRP – C-reaktivní protein, aPTT – aktivovaný parciální tromboplastinový čas, INR – international normalized ratio, pO2 – parciální tlak kyslíku, pCO2 – parciální tlak oxidu uhličitého, BE – base excess, ScvO2 – saturace hemoglobinu kyslíkem v centrální žíle Zde byla bezprostředně po přijetí nezbytná orotracheální intubace a zahájení umělé plicní ventilace (UPV), podpora hemodynamiky významnou dávkou noradrenalinu (1,6 µg/kg/min) a zahájení kontinuální náhrady funkce ledvin (kontinuální veno-venózní hemodialýza, CVVHD). Indikací byla těžká MAC a neoligurické akutní poškození ledvin, jehož etiologie byla nejspíše kombinací dehydratace (prerenální etiologie), sepse, možného efektu podané kontrastní látky a suspektní alergické intersticiální nefritidy při alergické reakci na podaná ATB. Fyzikální, laboratorní ani echokardiografický (TTE) nález neukazoval na kardiální komponentu šoku – kardiogenní šok/syndrom nízkého srdečního výdeje včetně případné dynamické obstrukce výtokového traktu levé srdeční komory. Systémová infekce (suspektní uroinfekce) byla léčena empiricky (meropenem a vankomycin). Ultrasonografické vyšetření břicha vyloučilo zásadní patologii na orgánech dutiny břišní i ledvinách a vývodném močovém traktu. Zcela klidný klinický nález na břiše, rychlá normalizace laktatémie a zlepšení stavu svědčilo proti nitrobřišní katastrofě charakteru např. perforace trávicí trubice s peritonitidou či cévní okluze s viscerální ischémií. CT/CTAG vyšetření jsme z těchto důvodů nedoplňovali. Uvedená opatření vedla k rychlé stabilizaci stavu, normalizaci hemodynamiky, acidobazické rovnováhy, kompletní reparaci renálních funkcí a kontrole infekce. Třetí den hospitalizace na našem pracovišti bylo možné ukončit UPV i CVVHD. Osmý den byl nemocný přeložen v dobrém stavu na standardní oddělení interní kliniky a po dalších 5 dnech byl propuštěn do domácí a ambulantní péče.
Kazuistika II
Další z kazuistik popisuje případ 86leté obézní hypertoničky s diabetus mellitus 2. typu (metformin), která byla dopravena na interní ambulanci regionální nemocnice pro anamnézu týdenních febrilií s neproduktivním kašlem a ten den náhle vzniklou a rychle progredující dušností. Již během transportu byla zjištěna hyperlaktatémie (venózní laktát 15 mmol/l). Při vyšetření v ambulanci se nemocná prezentovala klidovou dušností s tachypnoí (DF 35/min), hypotenzí (TK 75/45 mm Hg), tachykardií (TF 125/min), kvantitativní (somnolence) i kvalitativní (dezorientace) poruchou vědomí a anurií. Vstupní laboratorní vyšetření verifikovalo těžkou metabolickou (laktátovou) acidózu, poškození ledvin, koagulopatii a systémovou infekci. Rentgenové vyšetření neprokázalo ložiskové postižení plic ani významný pleurální výpotek. Nemocná byla odeslán na naše pracoviště a následně i přeložena na naši JIP.
Při přijetí byla pacientka somnolentní až soporózní, hypotenzní, tachykardická a anurická, se známkami dehydratace. Byla tedy intubována a byla zahájena orgánová podpora: UPV, kontrolovaná tekutinová resuscitace, vazopresorické podpora (vysoká dávka noradrenalinu; > 2 µg/kg/min) a CVVHD. Protože nebylo možné vyloučit současnou infekční komplikaci (eventuálně tedy spouštěcí faktor aktuální deteriorace zdravotního stavu), byla zahájena i antiinfekční léčba empirickou ATB kombinací (cefotaxim a ciprofloxacin). Zdrojem infekce mohl být komunitní zánět močových cest; patogen nebyl identifikován. Vstupní TTE vyšetření bylo s výjimkou mírné koncentrické hypertrofie levé komory srdeční (LKS) bez patologického nálezu. V průběhu následujících pěti dní došlo postupně k úpravě acidobazické rovnováhy, normalizaci laktatémie a kontrole iniciální systémové infekce (tab. 2). Perzistovala však oběhová nestabilita, dependence na náhradě funkce ledvin, projevila se encefalopatie (nejspíše „septická“) a těžká symetrická svalová slabost (neuromuskulopatie kriticky nemocných). Stav nemocné se navíc komplikoval femoro-popliteo-krurální hlubokou žilní trombózou pravé dolní končetiny se známkami jejího kritického ohrožení (flegmazie). Zahájili jsme antikoagulační léčbu nefrakcionovaným heparinem (UFH). Další komplikací byla recidiva uroinfekce sedmý den hospitalizace, provázená prohloubením šokového stavu s vazoplegií a zhoršením multiorgánového postižení (multiple organ dysfunction syndrome; MODS). Nápadná byla opět hemodynamická nestabilita s výraznou sinusovou tachykardií a známkami nízkého srdečního výdeje. Důvodem byla, podle opakovaného TTE vyšetření, relativní hypovolémie v kombinaci s dynamickou obstrukcí výtokového traktu LKS (left vetricular outflow tract dynamic obstruction; LVOTDO) se systolickým dopředným pohybem cípů mitrální chlopně (systolic anterior motion; SAM) při preexistující hypertrofii levé komory srdeční (LKS) včetně interventikulárního septa. Případná významná plicní embolizace byla z dostupných údajů a vyšetření nepravděpodobná (kontinuální účinná heparinizace, normální morfologie a funkce pravé komory srdeční). Částečné stabilizace hemodynamiky bylo dosaženo optimalizací intravaskulární volémie/preloadu LKS kontrolovanou tekutinovou resuscitací, paradoxním snížením dávky noradrenalinu („dekatecholaminizací“) a kontrolou tepové frekvence krátce působícím betablokátorem (esmolol). S ohledem na daný stav a neznalost patogenu(ů), byla ATB léčba empiricky změněna a rozšířena (meropenem, linezolid a vorikonazol). V dalších pěti dnech progredovalo multiorgánové postižení (encefalopatie, oběhová nestabilita, respirační selhání, poškození ledvin, poškození jater, koagulopatie, trombocytopenie a dysfunkce gastrointestinálního traktu). Po celkem dvanácti dnech za pokračující resuscitace septického šoku a MODS nemocná zemřela.
Tab. 2. Vybrané laboratorní parametry – kazuistika II 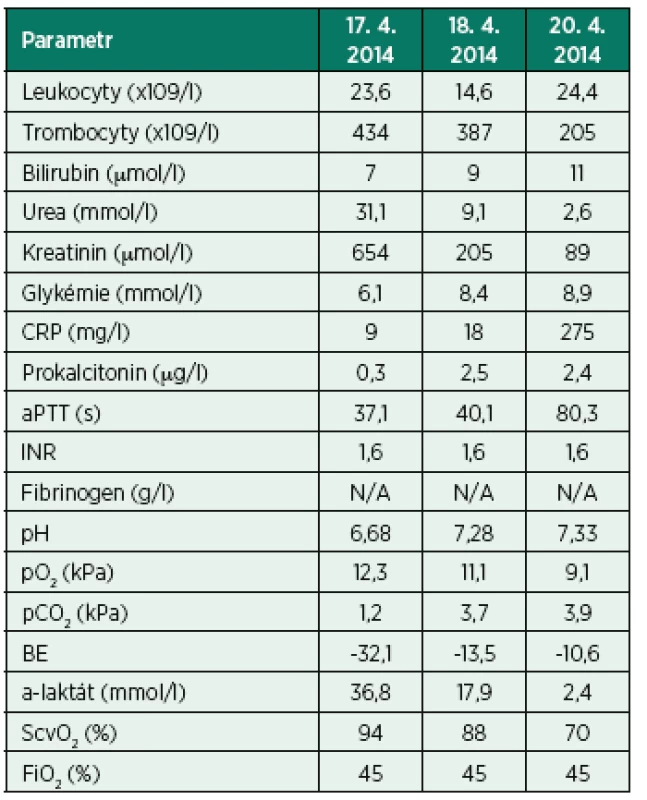
CRP: C-reaktivní protein; aPTT: aktivovaný parciální tromboplastinový čas; INR: international normalized ratio; pO2: parciální tlak kyslíku; pCO2: parciální tlak oxidu uhličitého; BE: base excess; ScvO2: saturace hemoglobinu kyslíkem v centrální žíle Kazuistika III
Poslední z kazuistik popisuje případ sedmdesátileté hypertoničky, diabetičky léčené metforminem, po ischemické cévní mozkové příhodě v povodí levé krkavice bez reziduálního neurologického deficitu a s významnou aortální stenózou. Tato se z relativně plného zdraví dostavila na interní ambulanci regionální nemocnice pro téměř dva dny trvající a progredující dušnost. Vstupní laboratorní screening odhalil těžkou metabolickou acidózu s hyperlaktatémií, elevaci dusíkatých katabolitů a známky systémové infekce (tab. 3). Klinicky byla nemocná somnolentní, dušná, tachypnoická, s hraničním krevním tlakem a anurická. Po osmi hodinách byla nemocná přeložena na naši JIP.
Tab. 3. Vybrané laboratorní parametry – kazuistika III 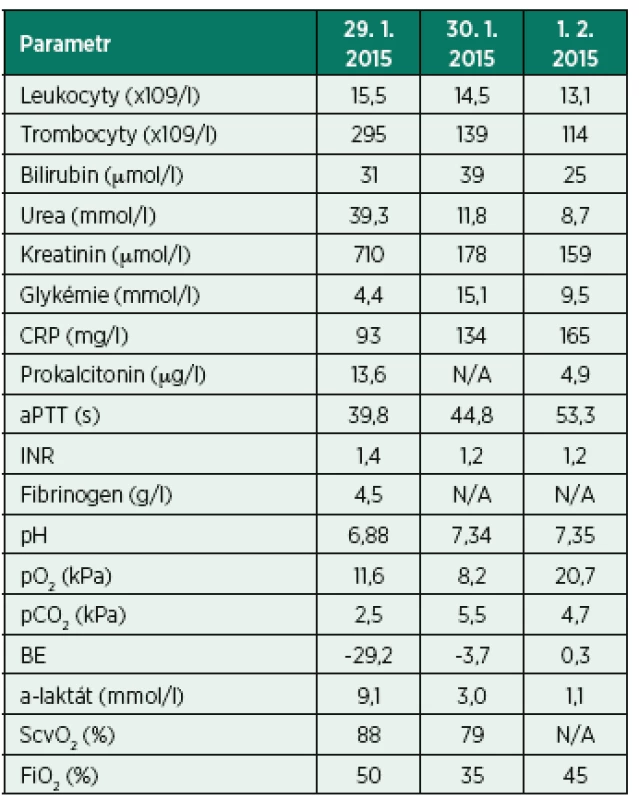
CRP: C-reaktivní protein; aPTT: aktivovaný parciální tromboplastinový čas; INR: international normalized ratio; pO2: parciální tlak kyslíku; pCO2: parciální tlak oxidu uhličitého; BE: base excess; ScvO2: saturace hemoglobinu kyslíkem v centrální žíle Bezprostředně po přijetí a zavedení dialyzační kanyly byla zahájena CVVHD, empirická ATB léčba (amoxicilin/klavulonát, ciprofloxacin) a byla nezbytná významná podpora vazopresorem – noradrenalinem (dávka > 1 µg/kg/min). Zdrojem infekce byla komunitní uroinfekce (Escherichia coli) a současně pravděpodobně i pneumonie (patogen nezjištěn). Infekce byla i v tomto případě velmi pravděpodobně spouštěcím faktorem (progrese) poškození ledvin a rozvoje MAC. Sonograficky byla vyloučena zásadní patologie v dutině břišní včetně případné obstrukce vývodných cest močových. TTE vyšetření neprokázalo známky systolické dysfunkce srdečních komor. Ještě v průběhu prvního dne pobytu na JIP dospěla nemocná k potřebě zajištění dýchacích cest orotracheální intubací a UPV pro progresi dušnosti a poruchy výměny plynů. Korekce poruchy acidobazické rovnováhy s hyperlaktatémií byla i přes potenciál CVVHD velmi pomalá. Teprve třetí den došlo k jejich normalizaci. Současně bylo možné konstatovat kontrolu infekce a stabilizaci hemodynamiky (viz tab. 3). Stav nemocné se však čtvrtý den hospitalizace komplikoval subjektivně asymptomatickým infarktem myokardu s elevacemi ST úseku přední stěny LKS (EKG, kardiomarkery, TTE). Pacientka podstoupila urgentní kardiointervenci s implantací konvenčního stentu do významné stenózy distální části kmene levé koronární arterie s optimálním výsledkem. Nevyskytly se žádné komplikace spojené s akutním koronárním syndromem (arytmie, kardiální selhání aj.). Pátý den bylo možné nemocnou odpojit z UPV, ukončit CVVHD a přeložit na kardiologickou JIP. I nadále však perzistovala oligoanurie a závislost na náhradě funkce ledvin (již ve formě intermitentní hemodialýzy, IHD). V průběhu dalšího týdne došlo i k reparaci renálních funkcí, dále již nebyla potřebná dialýza a nemocná byla k doléčení přeložena na standardní oddělení interní kliniky.
SYNTÉZA POZNATKŮ Z KAZUISTIK A DISKUSE
U všech tří popisovaných případů dominoval těžký cirkulační šok s významnou vazopresorickou podporou, extrémní metabolická acidóza s hyperlaktatémií a poškození ledvin. Z možných příčin a v rámci diferenciální diagnostiky bylo možné vyloučit hypovolemický a hemoragický šok, obstrukční šok – plicní embolizaci, tenzní pneumotorax, srdeční tamponádu aj. – i případné ischemické trauma (klinický stav, TTE, zobrazovaní metody – CT, laboratorní vyšetření). K odlišení od šoku kardiogenního a obstrukčního může být nápomocné stanovení saturace smíšené žilní krve kyslíkem (SvO2), respektive saturace žilní krve kyslíkem v centrální žíle (ScvO2). Při metabolické acidóze s hyperlaktatémií asociované s metforminem (metformin-associated lactic acidosis, MALA), jakožto stavu s alterací utilizace kyslíku tkáněmi (porucha na úrovni mitochondrií) bývá poměrně typicky SvO2, respektive ScvO2 abnormálně zvýšená (viz tab. 1–3). Obdobně tomu může být u jiných „distribučních“ šokových stavů (septický šok) a intoxikací noxami alterujícími mitochondriální respirační řetězec (kyanid, propofol, linezolid aj.).
Společným jmenovatelem stavů uvedených v kazuistikách je tedy možné označit současnou přítomnost systémové infekce/zánětu s poškozením ledvin a užívání metforminu v rámci léčby diabetu. V logické konsekvenci: sepse-septický šok-poškození ledvin-kumulace metforminu-indukce, či lépe potenciace laktátové acidózy, pak tento stav ústil do těžkého (cirkulačního) šoku s další extenzí orgánového postižení. Akutní poškození ledvin (acute kidney injury, AKI) nemělo svůj původ pouze v systémové infekci/sepsi (sepsis-associated AKI, S-AKI), ale bylo zřejmě multifaktoriální etiologie. Svůj podíl zde mohla sehrát léčba inhibitory angiotenzin konvertujícího enzymu, nesteroidními antiflogistiky, dehydratace, podání kontrastní látky k CT vyšetření a případně také alergická intersticiální nefritida (viz kazuistiky výše).
Metformin
Metformin, patřící do skupiny biguanidů, je při absenci kontraindikací v současné době lékem první volby ve farmakoterapii diabetu 2. typu (type 2 diabetes; T2D) podle American Diabetes Association (ADA) a European Association for the Study of Diabetes (EASD). Obecně je doporučováno zahájení podávání metforminu současně s úpravou životního stylu a diety bezprostředně po stanovení diagnózy T2D [1]. Jeho základním mechanismem účinku je snížení produkce glukózy v játrech inhibicí glukoneogeneze [2, 3]. Metformin také zvyšuje inzulinem zprostředkovanou utilizaci glukózy v periferních tkáních (svaly, játra), snižuje plazmatickou koncentraci volných mastných kyselin, snižuje tělesnou hmotnost a je spojován s poklesem kardiovaskulární morbidity a mortality a incidencí některých nádorových onemocnění [2, 4–9]. Metformin má významný hypoglykemizující efekt (snižuje glykémii cca o 20 % a HbA1c cca o 1,5–2,0 %, respektive 15–20 mmol/mol) a na druhou stranu je spojen jen s velmi malým rizikem hypoglykémie (většinou v souvislosti s léčbou dalším antidiabetikem) – obrázek 1. Metformin je po požití vstřebáván zejména v orální části tenkého střeva, vyznačuje se zanedbatelnou vazbou na plazmatické bílkoviny a za ideálních podmínek je jeho biologický poločas přibližně 5 hodin. Cestou eliminace z organismu je aktivní transport v proximálních tubulech ledvin; při poruše funkce ledvin dochází k jeho kumulaci [10, 11]. Nejčastějším nežádoucím účinkem metforminu je abdominální diskomfort a anorexie (< 5 %) a snížení absorpce vitaminu B12 vedoucí k snížení jeho plazmatické koncentrace (5–10 %), přičemž rozvoj megaloblastové anémie je v této souvislosti raritní [12]. Další komplikací užívání metforminu může být rozvoj MAC s hyperlaktatémií.
Obr. 1. Mechanismy účinku metforminu 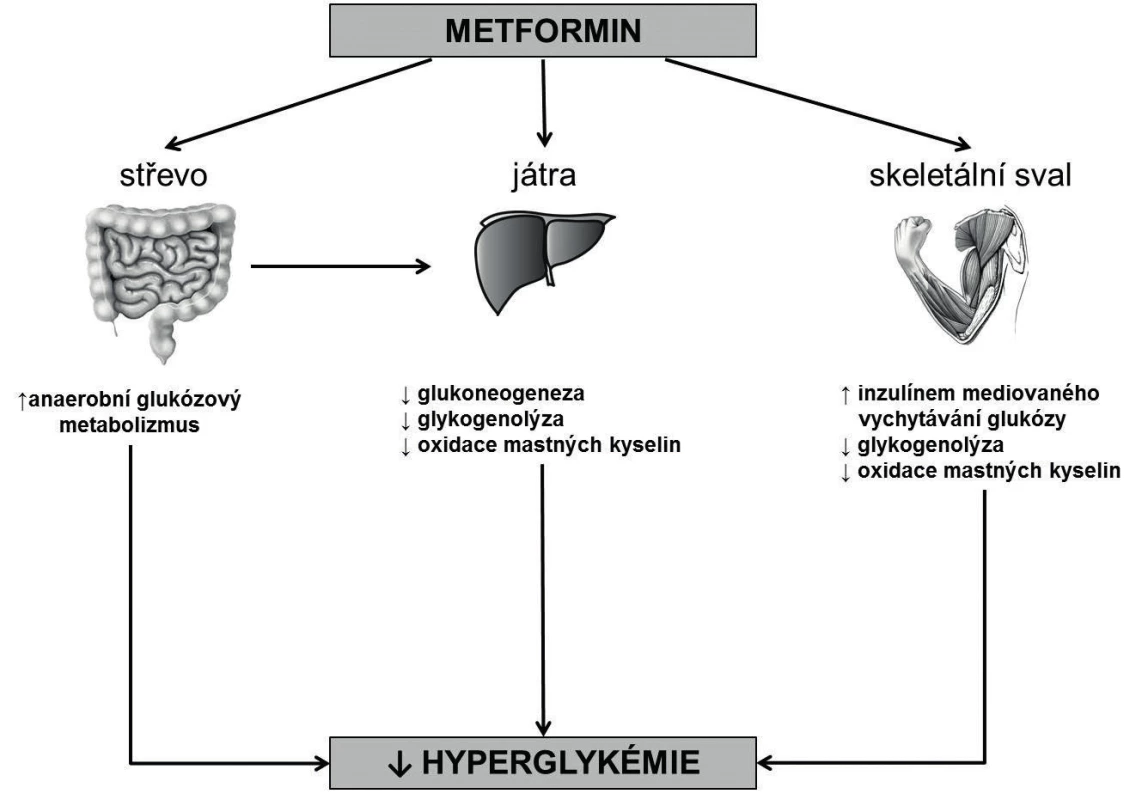
(volně podle Bailey CJ, Feher MD. Therapies for diabetes, Sherborne Gibbs Ltd., Birmingham, UK, 2004) Metabolická acidóza s hyperlaktatémií
Metabolická acidóza s hyperlaktatémií je nejčastější formou metabolické acidózy u hospitalizovaných pacientů a je spojena s elevací anion gapu (AG) a laktatémie (> 4 mmol/l). Kyselina mléčná (laktát) je za normálních okolností produkována rychlostí 15–20 mmol/kg tělesné hmotnosti za den. Většina pochází z metabolismu glukózy cestou glykolýzy a dále vzniká také deaminací alaninu. Majoritně je produkován izomer L-laktát; D-laktát se u lidí vyskytuje zejména jako produkt bakteriálního metabolismu. Laktát je primárně utilizován oxidací na oxid uhličitý a vodu (70–80 %), regenerací na glukózu (15–20 %) a minoritně i zpětnou konverzí na alanin. Na tomto metabolismu se podílí zejména játra a ledviny, ale i jiné tkáně. V ideálním případě je produkce a utilizace kyseliny mléčné v rovnováze. Příčiny akumulace laktátu a z toho vyplývající laktátové MAC mohou byt rozděleny na ty, u kterých je zjevná tkáňová hypoxie (typ A), a ty, u kterých není porucha tkáňové oxygenace přítomná či detekovatelná (typ B) – tabulky 4 a 5. D-laktátová MAC je vzácnější formou, která se může vyskytnout u nemocných s gastrointestinální malabsorpcí (např. syndrom krátkého střeva). V těchto případech je abnormálně velké množství glukózy a škrobu fermentováno intestinální bakteriální mikroflórou na řadu organických kyselin včetně D-laktátu. Vzhledem k velmi pomalému metabolismu D-laktátu může jeho nadměrné vstřebání ze střeva vést k hyperlaktatémii. Dalšími příčinami D-laktátové MAC mohou být velká intravenózní dávka propylenglykolu (rozpouštědlo některých intravenózních preparátů) či diabetická ketoacidóza. D-laktát je v těchto případech produktem metabolismu laktaldehydu (propylenglykol) a metylglyoxalu (diabetické ketoacidóza). D-laktát není detekovatelný standardními laboratorními testy ke stanovení laktátu; vyšetření vyžaduje speciální analytický test.
Tab. 4. Příčiny laktátové metabolické acidózy 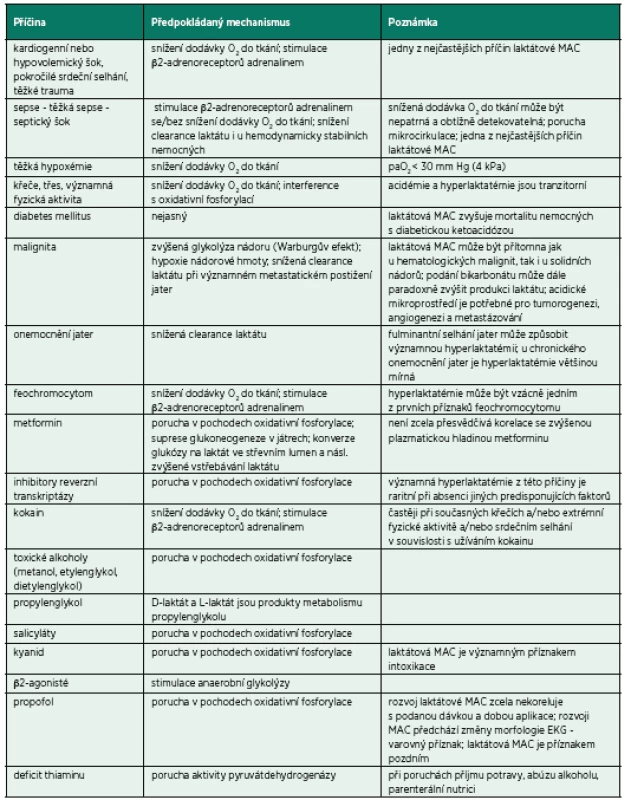
MAC: metabolická acidóza; paO2: parciální tlak kyslíku v arteriální krvi (volně podle Kraut, J. A., NEJM, 371, 24 p. 2309–2319) Tab. 5. Klinické projevy (laktátové) metabolické acidózy 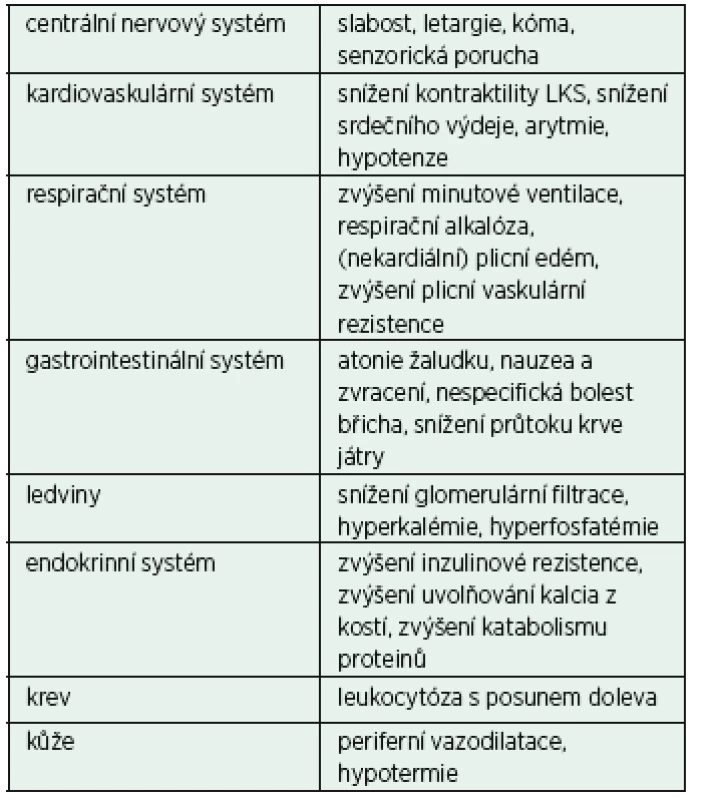
LKS: levá komora srdeční Metabolická acidóza s hyperlaktatémií asociovaná s metforminem
Mechanismus laktátové acidózy asociované s metforminem (metformin-associated lactic acidosis, MALA) je komplexní. Metformin zvyšuje ve střevním lumen konverzi glukózy na laktát, který je následně vstřebán. Současně způsobuje přímý buněčný a mitochondriální energetický stres, který vede k tkáňově specifickým sekundárním účinkům. Hepatocyty jsou vystaveny vysokým koncentracím metforminu, který také zde způsobuje alteraci mitochondriálních funkcí, nejpravděpodobněji cestou inhibice komplexu 1 mitochondriálního respiračního řetězce. To následně vede k energeticky neefektivnímu mitochondriálnímu metabolismu, limitaci metabolismu glukózy včetně glukoneogeneze. Energeticky deficientní buňky pak kompenzují nedostatek adenozintrifosfátu (ATP) anaerobní glykolýzou. Obdobné mechanismy se nejspíše uplatňují i v inhibici nádorového růstu [13, 14, 15].
Vše uvedené vede k zvýšené produkci laktátu či substrátů k jeho tvorbě [16]. S výjimkou akutní intoxikace, dochází k rozvoji MALA raritně v nepřítomnosti komorbidit, jako jsou renální a/nebo jaterní poškození a/nebo akutní systémová infekce. Incidence MALA je literárně < 5,1 případu na 100 000 pacientů za 1 rok [17]. Stejný autor však později v metaanalýze prospektivních a observačních studií prezentuje absenci dostatečných důkazů, že je užívání metforminu spojené se zvýšeným rizikem laktátové acidózy a/nebo laktatémie v porovnání s kohortou nemocných léčených jinými antidiabetiky (4,3 vs. 5,4 případu/100 000/rok) [18]. Bez ohledu na zmíněné kontroverze lze připustit jisté logické a patofyziologické mechanismy vedoucí ke kumulaci a/nebo zvýšené produkci laktátu u nemocných léčených metforminem s významnou akutní zdravotní komplikací většinou vedoucí k jeho kumulaci v organismu. V této souvislosti lze arbitrárně rozlišovat dvě jednotky:
- a) metforminem indukovaná metabolická acidóza s hyperlaktatémií (metformin-induced lactic acidosis, MILA), která se rozvíjí v přímé souvislosti s léčbou či intoxikací metforminem [19];
- b) metabolická acidóza s hyperlaktatémií asociovaná s metforminem (metformin-associated lactic acidosis, MALA), kdy se MAC s hyperlaktatémií rozvíjí bez jednoznačné patofyziologické souvislosti s léčbou metforminem.
Stanovení sérových hladin metforminu není v drtivé většině případů užitečné; většina zdravotnických zařízení nemá možnost je stanovit a i přes recentní poznatky o mechanismech jeho účinku zde stále není jasná korelace s laktatémií, MAC, tíží stavu ani s morbiditou či mortalitou [16, 20, 21].
Vzhledem k nejasným mechanismům a kontroverzím se autoři kloní k užití pojmu MALA – v situacích charakterizovaných MAC s hyperlaktatémií v souvislosti s akutní významnou deteriorací zdravotního stavu – minimálně v rámci diferenciální diagnostiky a jako možnosti vysvětlující či se spolupodílející na dané acidóze. Predisponujícími faktory rozvoje MALA jsou: orgánová dysfunkce (ledviny, játra, srdce), šok, systémová infekce, dehydratace a anamnéza již proběhlé MAC s hyperlaktatémií. Obecně jsou to tedy situace, kdy kumulace metforminu a laktátu převažuje nad jejich eliminací [22]. Mortalita MALA, respektive stavů spojených s MALA, je literárně 30–50% [23, 24, 25]. Na druhou stranu prognóza MALA je signifikantně lepší než prognóza laktátové MAC stejné tíže, ale jiné etiologie [26]. Autoři mají vlastní zkušenost s extrémní MAC s hyperlaktatémií ve spojitosti s metforminem, kdy nemocná přežila MAC s iniciálním pH 6,54 s laktatémií 21,2 mmol/l [26]. I přes extrémní podporu vazopresory (ve zmiňovaném případě noradrenalin až 4,44 µg/kg/min a terlipressin 0,1 mg/h), která bývá v těchto případech vzhledem k cirkulačnímu šoku nezbytná, není na místě stav považovat za refrakterní a léčbu předčasně omezit či ukončit.
Terapie metabolické acidózy s hyperlaktatémií asociované s metforminem
Terapie MALA kopíruje obecné principy doporučených postupů léčby šokových stavů. I zde platí, že zásadní je časně řešit základní onemocnění – vyvolávající faktor. Tato opatření pak doplňuje další komplexní podpůrná léčba včetně náhrad orgánových funkcí. S obnovením a/nebo náhradou přirozených mechanismů metabolismu/eliminace laktátu a snížením jeho produkce dochází zpravidla i ke korekci MAC. MALA je jednou z mála situací, kdy lze indikovaně zvážit podání bikarbonátu ke korekci těžké metabolické acidózy (při pH < 7,0). Dávka by ovšem měla být co nejmenší k dosažení stabilizace klinického stavu. I v této indikaci je třeba mít na paměti nepříznivé efekty této léčby. Tyto zahrnují zejména „rebound“ metabolickou alkalózu, hypernatrémii, rychlé změny v kalémii a kalcémii, přetížení tekutinami, snížení myokardiální kontraktility, zvýšení produkce oxidu uhličitého, reflexní vazodilataci po bolusovém podání, posun disociační křivky hemoglobinu doleva aj.
Podle tíže stavu a současných komorbidit lze v managementu vždy zvažovat použití eliminačních metod – náhrad funkce ledvin (renal replacement therapy, RRT). Časná indikace a zahájení RRT se jeví výhodné z pohledu morbidity i mortality. Tato modalita má potenciál jak v eliminaci laktátu a metforminu [27, 28], ale zejména v současné korekci acidobazické rovnováhy při užití bikarbonátových roztoků. Tato forma „alkalizace“ je z pohledu výše diskutovaných nežádoucích efektů podání bikarbonátu výhodnější. Forma RRT se rovněž odvíjí od aktuální tíže stavu nemocného a výběr intermitentní RRT či kontinuální RRT vychází z obecných principů a doporučení. Intermitentní RRT je obecně v daném časovém intervalu účinnější, kontinuální RRT je však výhodnější z pohledu její tolerance při oběhové nestabilitě [29]. Dávku RRT je vhodné volit vyšší (30–40 ml/kg/h), než je obecně doporučovaná [30]. Významnou pozornost si také zaslouží volba antikoagulace při RRT. V současnosti u kriticky nemocných preferovaná regionální citrátová antikoagulace [31] nemusí být v případech MALA vždy vhodnou volbou. Alterace mitochondriálních mechanismů v hepatocytech při MALA (a jiných laktátových acidózách a/nebo jaterních onemocněních) vede ke snížené utilizaci citrátu, jeho kumulaci a paradoxní potenciaci acidózy. Tato citrátová toxicita je charakteristická snížením systémového ionizovaného kalcia (Cai) a současným zvýšením celkové kalcémie (Catot) a zvyšováním substituční dávky kalcia v rámci protokolu regionální antikoagulace. Toxicita citrátu je velmi pravděpodobná, pokud podíl Catot a Cai je větší než 2,0–2,5. Tuto možnou komplikující skutečnost je třeba mít vždy na paměti při rozvaze o volbě antikoagulačního zajištění mimotělního okruhu. Při absenci kontraindikací (těžká trombocytopenie a/nebo koagulopatie aj.) je vhodnou alternativou antikoagulace heparinem (nefrakcionovaným či nízkomolekulárním) s příslušnou kontrolou účinnosti. Pokud nelze bezpečně použít tuto možnost je možné užít RRT bez antikoagulace (v případech trombocytopenie a/nebo koagulopatie) či metodu (lépe intermitentní) s pravidelnými proplachy mimotělního okruhu krystaloidy [31].
Závěr
Metformin je při absenci kontraindikací lékem první volby v léčbě diabetu 2. typu. Komplikace spojené s jeho užíváním nebývají časté. Za nejzávažnější lze označit laktátovou acidózu asociovanou s jeho aplikací (MALA). Tato vzniká a rozvíjí se spíše sekundárně, bez jednoznačné korelace s dávkou a/nebo možnou kumulací léku; typickým spouštěčem je systémová infekce v terénu preexistujícího či nově se rozvíjejícího poškození funkcí ledvin. MALA ve svém důsledku vede k cirkulačnímu šoku, často v kombinaci s šokem septickým. Klinickým fenotypem tak může tento stav napodobit jakýkoliv distribuční šok, ale i šok kardiogenní, respektive obstrukční (např. plicní embolie). Podstatou léčby je kauzální řešení vyvolávající příčiny (často infekce) se současnou podpůrnou léčbou směřující ke korekci vnitřního prostření nemocného včetně zapojení náhrad orgánových funkcí (náhrada funkce ledvin). Pozornost jistě v těchto případech zaslouží volba antikoagulace k zajištění patence mimotělního okruhu.
MALA je jistě vzácnější nozologickou jednotkou, nicméně, zcela jistě stojí ji mít na paměti při setkání s diabetikem užívajícím metformin s akutní deteriorací zdravotního stavu. Tito nemocní bývají často primárně přijímáni k hospitalizaci s respirační insuficiencí (acidotické dýchání) a s případnou oběhovou nestabilitou. Od pomyšlení na možnou souvislost s léčbou metforminem vede ke správné vstupní pracovní diagnóze doplnění laboratorního screeningu včetně stanovení acidobazické rovnováhy s laktatémie. Na rozdíl od jiných etiologií MAC s hyperlaktatémií má MALA při adekvátní léčbě mnohem lepší prognózu a jako v mnoha jiných případech i zde ji včasná adekvátní léčba dále zlepšuje.
Práce byla podpořena:
- Programem rozvoje vědních oborů Univerzity Karlovy (PRVOUK – projekt P36)
- MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806)
- CZ.1.05/2.1.00/03.0076 Evropský fond pro regionální rozvoj (Biomedicínské centrum LF Plzeň, UK v Praze)
Do redakce došlo dne 23. 1. 2016.
Do tisku přijato dne 2. 6. 2016.
Adresa pro korespondenci:
MUDr. Thomas Karvunidis, Ph.D.
JIP, I. interní klinika FN a LF v Plzni, UK v Praze
Alej Svobody 80
304 60 Plzeň
email: karvunidist@fnplzen.cz
Zdroje
1. Inzucchi, S. E., Bergenstal, R. M., Buse, J. M. et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and European Association for the Study of Diabetes (EASD). Diabetes Care, 2012, 6, p. 1364–1379.
2. Lamanna, C., Monami, M., Marchionni, N., Mannucci, E. Effect of metformin on cardiovascular events and mortality: a meta-analysis of randomized clinical trials. Diabetes Obes. Metab., 2011, 3, p. 221–228.
3. Pernicova, I., Korbontis, M. Metformin – mode of action and clinical implications for diabetes and cancer. Nat. Rev. Endocrinol., 2014, 3, p. 143–156.
4. Glueck, C. J., Fontaine, R. N., Wang, P. et al. Metformin reduces weight, centripetal obesity, insulin, leptin, and low-density lipoprotein cholesterol in nondiabetic, morbidly obese subjects with body mass index greater than 30. Metabolism, 2001, 7, p. 856–861.
5. Salpeter, S. R., Bucklea, N. S., Kahn, J. A., Salpeter, E. E. Meta-analysis: metformin treatment in persons ať risk for diabetes mellitus. Am. J. Med., 2008, 2, p. 149–157.
6. ADVANCE Collaborative Group. Intensive blood control and vascular Outcomes in patients with type 2 diabetes. N. Engl. J. Med., 2008, 24, p. 2560–2572.
7. ACCORD Study Group. Long-term effects of intensive glucose lowering on cardiovascular Outcomes. N. Engl. J. Med., 2011, 9, p. 818–828.
8. Libby, G., Donnelly, L. A., Donnan, P. T. et al. New users of metformin are ať low risk of incident cancer: a cohort study among people with type 2 diabetes. Diabetes Care, 2009, 9, p. 1620–1625.
9. Landman, G. W., Kleefstra, N., van Hateren, K. J. et al. Metformin associated with lower cancer mortality in type 2 diabetes: ZODIAC-16. Diabetes Care, 2010, 2, p. 322–326.
10. Graha, G. G., Punt, J., Arora, M. et al. Clinical pharmacokinetics of metformin. Clin. Pharmacokinet., 2011, 2, p. 81–98.
11. Duong, J. K., Furlong, T. J., Roberts, D. M. et al. The role of metformin in metformin-associated lactic acidosis (MALA): case series and formulation of a model of pathogenesis. Drug Saf., 2013, 9, p. 733–746.
12. de Jager, J., Kooy, A., Lehert, P. et al. Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B-12 deficiency: randomised placebo controlled trial. BMJ, 2010, 340, p. 2181–2187.
13. Andrzejewski, S., Gravel, S-P., Pollak, M., St-Pierre, J. Metformin directly acts on mitochondria to alter cellular bioenergetics. Cancer Metab., 2014, 2.
14. Wheaton, W. W., Weinberg, S. E., Chandel, N. S. et al. Metformin inhibits mitochondrial complex I of cancer cells to reduce tumourgenesis. eLife, 2014, 3.
15. Bridges, H. R., Jones, A. J., Pollak, M. N., Hirst, J. Effects of metformin and other biguanides on oxidative phosphorylation in mitochondria. Biochem J, 2014, 3, p. 475–487.
16. Vecchio, S., Giampreti, A., Petrolini, V. M. et al. Metformin accumulation: lactic acidosis and high plasmatic metformin levels in retrospective case series of 66 patients on chronic therapy. Clin. Toxicol., 2014, 2, p. 129–135.
17. Salpeter, S., Greyber, E., Pasternak, G., Salpeter, E. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus. Cochrane Database Syst Rev, 2006, 1.
18. Salpeter, S., Greyber, E., Pasternak, G., Salpeter, E. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus. Cochrane Database Syst Rev, 2010, 4.
19. Chang, C. T., Chen, Y. C., Fang, J. T., Huang, C. C. High anion gap metabolic acidosis in suicide: don’t forget metformin intoxication – two patients‘ experiences. Ren Fail, 2012, 5, p. 671–675.
20. Lalau, J. D., Lacroix, C., Compagnon, P. et al. Role of metformin accumulation in metformin-associated lactic acidosis. Diabetes Care, 1995, 18, 6, p. 779–784.
21. Lalau, J. D., Race, J. M. Lactic acidosis in metformin-treated patients. Prognostic value of arterial lactate levels and plasma metformin concentration. Drug Saf, 1999, 4, p. 377–384.
22. DeFronzo, R., Fleming, G. A., Chen, K., Bicsak, T. A. Metformin-associated lactic acidosis: Current perspectives on causes and risk. Metabolism, 2016, 2, p. 20–29.
23. Kirpichnikov, D., McFarlane, S. I., Sowers, J. R. Metformin: an update. Ann. Intern. Med., 2002, 1, p. 25–33.
24. Seidowsky, A., Nseir, S., Houdret, N., Fourrier, F. Metformin--associated lactic acidosis: a prognostic and therapeutic study. Crit. Care Med., 2009, 7, p. 2191–2196.
25. Friesecke, S., Abel, P., Roser, M., Felix, S. B., Runge, S. Outcome of severe lactic acidosis associated with metformin accumulation. Crit. Care, 2010, 6, p. 226.
26. Radej, J., Matejovic, M., Krouzecky, A. et al. How severe acidosis can a human survive? Successful hemofiltration use. Dial. Transplant., 2007, 11, p. 608–611.
27. Hoste, E. A., Dhondt, A. Clinical review: use a renal replacement therapies in special groups of ICU patients. Crit. Care, 2012, 1, p. 201.
28. Calello, D. P., Liu, K. D., Wiegand, T. J. et al. Extracorporeal treatment for metformin poisoning: systematic review and recommendations from the extracorporeal treatments in poisoning workgroup. Crit. Care Med., 2015, 8, p. 1716–1730.
29. Ronco, C., Ricci, Z., DeBacker, D et al. Renal replacement therapy in acute kidney injury: controversy and consensus. Crit. Care, 2015, 1, p. 146–156
30. Vinsonneau, C., Allain-Launay, E., Blayau, C. et al. Renal replacement therapy in adult and pediatric intensive care: recommendations by an expert panel from the SRLF with the SFAR, GFRUP and SFD. Ann. Intensive Care, 2015, 1, p. 58.
31. Bai, M., Zhou, M., He, L. et al. Citrate versus heparin anticoagulation for continuous renal replacement therapy: an updated meta-analysis of RCTs. Intensive Care Med., 2015, 12, p. 2098–2110.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Slovo vedoucího redaktoraČlánek Zajímavosti, tipy a triky
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2016 Číslo 4- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Slovo vedoucího redaktora
- Specifika intervenční bronchologie z pohledu anesteziologa
- Pooperační nauzea a zvracení u dětí
- Novinky v kardiopulmonální resuscitaci v porodnictví
- Biomarkery akutního poškození ledvin – pohled za oponu
- Několik poznámek klinických biochemiků k akutnímu poškození ledvin
- Je morfin stále indikován v léčbě kardiogenního plicního edému?
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Neopioidní analgetika v léčbě akutní pooperační bolesti
- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Koncept stressed and unstressed volume a jeho klinický význam
- Doporučení pro léčbu akutního selhání pravé komory
- Zajímavosti, tipy a triky
- Perioperační management u pacientů s kardiostimulátorem
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Perioperační management u pacientů s kardiostimulátorem
- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Pooperační nauzea a zvracení u dětí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



