-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Protidestičková léčba v sekundární prevenci nekardioembolických ischemických mozkových cévních příhod
Antiplatelet therapy in secondary prevention of non‑embolic ischaemic stroke
The authors address the topic of antiplatelet therapy after a non-cardioembolic ischaemic stroke. They discuss some controversial issues in therapy such as monotherapy versus combination therapy, short-term versus long-term therapy and whether current therapy should be modified or continued in the event a patient has experienced a stroke. Other outstanding issues dealt with include e.g., the risk of such therapy in patients developing cerebral microbleeds. While consensus has been reached by experts regarding the utility of dual therapy in the initial period, divergent opinions exist as to the selection of drugs and therapy duration. Definition of the optimal strategy is hindered by the lack of evidence and robust data from clinical trials.
Keywords:
acetylsalicylic acid – clopidogrel – dipyridamole – dual therapy – monotherapy.
Autoři: Štefan Alušík 1; Zoltán Paluch 2
Působiště autorů: Katedra vnitřního lékařství IPVZ Praha 1; Ústav farmakologie 2. LF UK Praha 2
Vyšlo v časopise: Vnitř Lék 2020; 66(8): 501-506
Kategorie: Přehledové články
Souhrn
Autoři se v článku věnují problematice protidestičkové léčby po nekardioembolické ischemické mozkové cévní příhodě. Ta s sebou nese některé kontroverzní otázky, např. zda volit monoterapii či antiagregancia kombinovat, jak dlouho léčbu podávat, či zda v případě vzniku příhody terapii měnit nebo ponechat léčbu stávající. Záměrem je diskuze i nad spornými otázkami, např. jaké je riziko takové léčby u pacientů s přítomností cerebrálních mikrokrvácení. V otázce duální terapie v úvodu léčby se odborníci shodují, nicméně pokud jde o následnou monoterapii, pohled na volbu léčiva i délku jeho podávání se mezi odborníky liší. Ke stanovení optimálního postupu chybí podklady z klinických studií.
Klíčová slova:
dipyridamol – duální léčba – klopidogrel – kyselina acetylsalicylová – monoterapie
Úvod
Po vzniku nekardioembolické ischemické cévní mozkové příhody (nkiCMP) nebo tranzitorní mozkové ischemie (TIA) je riziko recidivy poměrně vysoké a nejvyšší je v prvních hodinách až dnech po příhodě. Ve starších studiích dosahuje 90denní riziko recidivy 12–20 %, v novějších je nižší vzhledem k pokroku v diagnostice i léčbě. Nadále je však vysoké (1), a to nejen z krátkodobého, ale i dlouhodobého rizika. V minimalizaci rizika (kromě léčby rizikových faktorů a případných intervenčních zákroků) plní důležitou roli protidestičková léčba. Dnes máme k dispozici několik skupin přípravků s různým mechanismem účinku:
- inhibice cyklooxygenázy-1 a ve vysokých dávkách i cyklooxygená ‑ zy-2 (kyselina acetylsalicylová – ASA),
- blokáda receptoru P2Y12 (klopidogrel, prasugrel, tikagrelor, kangrelor),
- blokáda receptoru Gp IIb/IIIa (abciximab, tirofiban, eptifibatid),
- inhibice fosfodiesterázy (PDE-3) (cilostazol, dipyridamol),
- blokáda receptoru trombinu PAR-1 (vorapaxar, atopaxar).
Praxe ukázala se, že nelze mechanicky přebírat poznatky získané o protidestičkové léčbě kardiology. Zatímco ischemie myokardu vyvolá koagulační nekrózu, která se hojí relativně pevnou jizvou, ischemie v mozku vyvolává nekrózu kolikvační, hojící se pseudocys ‑ tou. Ischemická mozková tkáň je náchylná k hemoragické transformaci, která je relativně častá a zvyšuje se při použití antitrombotické a zejména trombolytické léčby (2). Kromě toho pacienti s nkiCMP mají vyšší věk a větší poškození cév (fibrohyalinóza, amyloidová angiopatie) i vyšší riziko ostatních hemoragických komplikací protidestičkové léčby.
V článku se budeme věnovat některým kontroverzním otázkám protidestičkové léčby po nkiCMP, resp. TIA:
- monoterapie vs. kombinovaná léčba (monoterapie, dvojkombinace a trojkombinace),
- krátkodobá vs dlouhodobá léčba,
- podávat ASA dlouhodobě?
- nkiCMP u pacientů s protidestičkovou léčbou – pokračování nebo změna preexistující léčby?
- cerebrální mikrokrvácení a protidestičková léčba.
Monoterapie vs. kombinovaná léčba
Monoterapie
Z nejčastěji používaných protidestičkových přípravků (ASA, klopidogrel a dipyridamol) se v sekundární prevenci nkiCMP v monoterapii používá nejčastěji ASA, méně často klopidogrel. Ve většině zemí se monoterapií pokračuje až po krátkém období duální léčby. Výjimkou jsou britské doporučené postupy, které doporučovaly monoterapii klopidogrelem (75 mg/denně) jak v akutním období po vzniku nkiCMP, resp. TIA, tak i dlouhodobě (3). Dokonce i v nových doporučených postupech publikovaných nedávno trvají na monoterapii – pro změnu ASA v dávkách 300 mg/den po dobu 14 dní a potom doporučují pokračovat v dlouhodobé léčbě (4).
V případě, že pacient netoleruje ASA, nabídne se mu alternativní protidestičková léčba.
Standardně používaná dávka ASA v USA je 325 mg 1× denně, v nových britských doporučených postupech je dávka ASA 300 mg/denně, což je v souladu s výsledky studie publikované nedávno (5).
Ani ASA (podobně jako jiná protidestičková léčiva) nedokáže úplně zabránit vzniku nkiCMP, resp. její recidivě. Kromě toho se zjistilo, že účinek ASA je méně významný než u srdečního infarktu a oproti placebu snižuje riziko recidivy nkiCMP jen o 10–15 %; navíc má také nežádoucí účinky, zejména krvácení do GIT. Dnes už víme, že nejvýznamnější efekt ASA se uplatňuje v prvních týdnech po příhodě a v prvních 6 týdnech snižuje riziko recidivy až o 60 % (6), jak uvedeme níže. ASA si nadále zachovává vedoucí pozici v protidestičkové léčbě nkiCMP kromě Velké Británie také v USA. Ve Francii je oficiálním stanoviskem kritického farmakoterapeutického časopisu Prescrire International tvrzení, že ASA v monoterapii zůstává nadále lékem první volby (7).
V monoterapii lze použít i klopidogrel, používá se však zatím v této indikaci méně často.
Tiklopidin se dnes používá výjimečně vzhledem k jeho nežádoucím účinkům (průjem, neutropenie) a byl nahrazen klopidogrelem.
Podobně dipyridamol se používá jen v kombinaci s ASA a nemá lepší účinnost než samotná ASA. Nepříjemným nežádoucím účinkem dipyridamolu jsou bolesti hlavy, které často zapříčiňují ukončení léčby. Podle vyjádření Státního ústavu pro kontrolu léčiv není v současnosti v ČR registrován žádný přípravek obsahující dipyridamol.
Prasugrel se podává jen v kardiologických indikacích (spolu s ASA), u nkiCMP v současnosti probíhají klinické studie.
V Asii se používá cilostazol. Selektivně inhibuje fosfodiesterázu 3 A, což nejméně dvěma různými mechanismy vede k inhibici aktivity destiček (8). Kromě toho zlepšuje endoteliální funkci a zabraňuje proliferaci svalových buněk tepen. Po rozpačitých výsledcích před léty se dnes jeho příznivý efekt v léčbě pokládá za prokázaný (9). Cilostazol snižuje kardiovaskulární riziko méně než ASA, na druhé straně je považován za bezpečnější. Byl zkoušen v monoterapii i v kombinaci s ASA. Pro zavedení do léčby v Evropě jsou potřebné adekvátní populační klinické studie. V USA je registrován od roku 1999 jen pro léčbu ischemické choroby dolních končetin (ICHDK) a v jiné indikaci nebyl FDA povolen. U nás je dostupný jen pro léčbu ICHDK ve zvláštním režimu.
Dvojkombinace
Ve snaze zvýšit účinnost léčby se antiagregancia začala kombinovat. Cílem bylo využít různých mechanismů účinku jednotlivých léčiv a jejich vlivem na trombocyty zvýšit účinnost léčby. Následně bylo provedeno několik klinických studií, které potvrzovaly významnější snížení kardiovaskulárního rizika u kombinované léčby v porovnání s monoterapií ASA.
Účinnost dipyridamolu v prevenci nkiCMP byla prokázána ve studiích ESPS-2 (10) a ESPRIT (11). V obou studiích byla testována kombinace dipyridamol + ASA, která byla účinnější než samotná ASA. Zatímco ve studii ESPS-2 kombinace snižovala riziko nkiCMP v porovnání s placebem o výrazných 37 % (samotná ASA o 18 % a dipyridamol o 16 %) a autoři mluvili o aditivním efektu kombinace, ve studii ESPRIT byl výsledek lepší pro kombinaci, ale rozdíl ve sledovaném kompozitním ukazateli byl už malý (u kombinované léčby 13 %, u samotné ASA 16 %), viz podrobná statistika v tab. 1. Kromě toho, ve skupině s dipyridamolem 33 % pacientů předčasně ukončilo léčbu. Podstatným nedostatkem studií je fakt, že doba zařazování pacientů po nkiCMP, resp. TIA, byla až do 1 měsíce, nebyla tedy hodnocena kritická doba, kdy k recidivám dochází nejčastěji. Ve studii PRoFESS (12) již žádná výhoda kombinace ASA + dipyridamol nebyla prokázána. Také kombinace klopidogrel + dipyridamol neprokázala žádné výhody oproti léčbě klopidogrelem samotným (13).
Tab. 1. Základní údaje k citovaným studiím s duální protidestičkovou léčbou 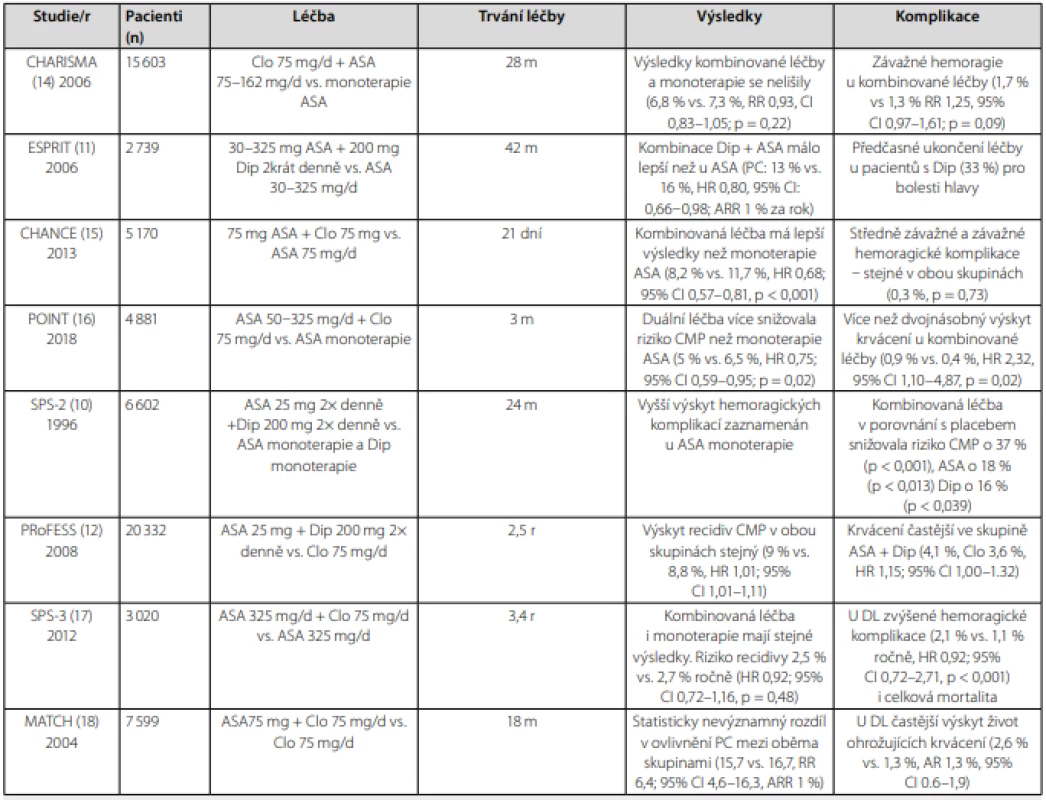
ASA – kyselina acetylsalicylová, Clo – klopidogrel, Dip – dipyridamol, iCMP – ischemická cévní mozková příhoda, DL – duální léčba, m – měsíc, r – rok, PC – primární cíl, RR – relativní riziko, HR – poměr rizik (hazard ratio), AR – absolutní riziko, ARR – absolutní redukce rizika, CI 95% – 95% konfidenční interval (interval spolehlivosti) Ze starších klinických studií s ASA a klopidogrelem se za nejvýznamnější pokládá CHARISMA (14). Studie neprokázala vyšší účinnost kombinované léčby (ASA + klopidogrel) v porovnání s monoterapií ASA v primárních ukazatelích. O něco lepší výsledek byl zjištěn při analýze podskupiny pacientů se symptomatickou aterotrombózou. Závažné hemoragické komplikace se v obou skupinách v celé studii statisticky nelišily.
Novější studie CHANCE (15) a POINT (16) potvrdily lepší účinnost duální léčby, která snižovala riziko recidivy nkiCMP kolem 30 % ve sledovaném období 90 dnů. Vstupní kritéria pro zařazení do studie byla v obou studiích stejná: pacienti s TIA s vysokým rizikem recidivy nebo tzv. „minor stroke“ (skóre 3 a méně NIHSS). Negativním důsledkem kombinované léčby bylo zvýšení počtu závažných krvácení, které ve studii POINT bylo 2,3× vyšší v porovnání se skupinou léčenou monoterapií ASA. Studie CHANCE byla provedena v Číně, studie POINT, která ji kopírovala, byla provedena u západní populace (82,8 % pacientů pocházelo z USA). Lišila se delší dobou léčby (90 dnů místo 21 dnů), i kratším intervalem zařazování pacientů do studie – do 12 h po vzniku příhody. Také úvodní dávka klopidogrelu byla vyšší – 600 mg oproti 300 mg – než ve studii CHANCE. O výsledcích obou studií referujeme níže. Studie CHANCE a POINT prokázaly lepší účinnost kombinované léčby. Účinnost je vázána na včasnou periodu onemocnění, což může vysvětlovat výsledky dřívějších déle trvajících studií CHARISMA (14), SPS3 (17), MATCH (18) (Tab. 1), v nichž nebyl prokázán prospěch z duální léčby.
Trojkombinace
Kombinace 3 antiagregačních přípravků byla v klinice použita již dříve, avšak jednalo se spíše o kazuistická sdělení. Velká klinická studie byla provedena až nedávno (19). Autoři opět vycházeli z předpokladu, že kombinace 3 antiagregačních látek může být efektivnější v porovnání s dosud doporučovanou léčbou. Ve studii s pacienty po nkiCMP nebo TIA byl porovnáván efekt trojkombinace (ASA 75 mg/den, klopidogrel 75 mg/den a dipyridamol 200 mg 2× denně) s klopidogrelem samotným nebo kombinaci ASA + klopidogrel. Léčba byla započata do 48 h od vzniku příhody. Incidence a závažnost recidiv nkiCMP nebo TIA se nelišily mezi intenzivně léčenou skupinou a mezi ostatními léčenými podle dosavadních doporučených postupů za sledované období 90 dnů. Naproti tomu se výrazně zvýšil výskyt hemoragických komplikací. Studie byla předčasně ukončena na doporučení monitorovací komise a autoři trojkombinační léčbu v rutinní praxi nedoporučují. Studie byla kritizována z mnohých důvodů: pozdní zařazování do studie od vzniku příhody (70 % pacientů až v intervalu 24–48 h), závažný iktus mělo 11 % pacientů a dalších 10 % absolvovalo trombolýzu, trojkombinace se podávala po dobu 30 dnů místo vhodnějších 8–10 dnů apod. (20).
Krátkodobá vs. dlouhodobá protidestičková léčba
Duální léčba
Také v této problematice se vycházelo z výsledků kardiologických studií CURE (21) a CREDO (22), kde duální léčba s klopidogrelem po dobu 1 roku výrazně snižovala recidivu kardiovaskulárních příhod. Podobné výsledky se očekávaly i v prevenci nkiCMP. Následně provedené studie CHARISMA (14), SPS3 (17) a MATCH (18) však ukázaly, že duální léčba v sekundární prevenci nkiCMP podávaná dlouhodobě nepřináší žádný prospěch, zejména ne u pacientů s lakunárním typem iCMP. Naopak studie CHANCE (15) ukázala, že duální léčba podávaná po dobu prvních 21 dnů po iCMP snižovala riziko recidivy zhruba o 30 % ve sledovaném období 90 dnů.
Nedávno publikované výsledky studie POINT (16) prokázaly, že duální léčba (klopidogrel + ASA) snižuje výskyt recidiv nkiCMP (5 %) v porovnání s monoterapií ASA (6,5 %) po dobu léčby trvající 90 dnů. Nejvíce recidiv nkiCMP bylo zaznamenáno během 1. týdne po vzniku příhody. V souvis ‑ losti s duální léčbou byl zaznamenán více než dvojnásobný výskyt velkých krvácení (0,9 %) v porovnání s monoterapií ASA (0,4 %). Právě pro zvýšený výskyt krvácení byla studie předčasně ukončena. Na zvýšeném výskytu hemoragických komplikací se kromě vyšší úvodní dávky klopidogrelu a delší doby léčby mohla podílet i větší prevalence postižení drobných cév v souboru pacientů ve studii. Významnou úlohu mohla hrát i skutečnost, že americká populace má menší prevalenci polymorfismu cytochromu P450 2C19 a tím i vyšší účinnost klopidogrelu. Studie byla podrobena kritice. Efekt duální léčby byl prokázán jen v prvním měsíci, v dalších 2 měsících mělo nkiCMP jen 0,9 % pacientů a nebyl zjištěn žádný rozdíl mezi oběma skupinami. Přidání klopidogrelu také nemělo žádný vliv na mortalitu ani disabilitu. Po započtení hemoragických komplikací proto celkový profit z kombinované léčby byl malý. Autoři však odhadují, že duální léčba u 1000 pacientů po dobu 90 dnů zabrání 15 ischemickým iktům a vyvolá 5 závažných krvácení. Jiní autoři poukazují na to, že dlouhodobě účinnost léčby klesá a naopak, stoupá výskyt hemoragických komplikací, zejména u pacientů ve věku nad 75 let.
Na základě výsledků zejména studií CHANCE a POINT se odborníci shodují na tom, že duální léčba ASA + klopidogrel se má zejména podávat po vzniku nkiCMP a TIA po dobu 3–4 týdnů a poté pokračovat v monoterapii ASA nebo klopidogrelem. Optimální doba podávání duální léčby se bude dále upřesňovat klinickými studiemi.
Monoterapie po duální léčbě
Jak dlouho máme pokračovat v monoterapii po duální léčbě, není jasno. Pro určení optimální doby léčby chybí podklady z klinických studií, proto některá doporučení odkazují na individuální posouzení klinických okolností (23). Vyřešena není ani otázka, jak dlouho máme pokračovat v léčbě ASA. Analýza 12 klinických studií s ASA (6) ukázala, že mohutný účinek ASA se projevuje zejména v akutním stadiu. V prvních 6 týdnech snižovala riziko recidivy o 60 % (84 z 8452 účastníků v ASA skupině utrpělo nkiCMP vs. 175 z 7326 účastníků kontrolní skupiny; HR 0,42, 95% CI 0,32–0,55, p < 0,0001) a riziko závažného poškození nebo úmrtí po iCMP až o 70 % (36 z 8452 vs 110 z 7326; HR 0,29, CI 0,20-0,42, p < 0,0001). Maximum účinku bylo zaznamenáno v prvních 2 týdnech po příhodě, následně došlo k poklesu a po 12 týdnech už nebyl zjištěn rozdíl v porovnání s kontrolní skupinou.
Pro tvrzení, že klopidogrel v monoterapii je dlouhodobě účinnější než ASA, však také chybí důkaz z velké klinické studie.
Podávat ASA dlouhodobě?
Nízké dávky ASA se v sekundární prevenci kardiovaskulárních příhod podávají často dlouhodobě. Snižují riziko recidivy srdečního infarktu i nkiCMP a prospěch z léčby převyšuje případná rizika, zejména krvácení. Kontroverzní je podávání ASA v primární prevenci. ASA se dnes dlouhodobě podává jen u osob s vysokým kardiovaskulárním rizikem (v USA desetileté riziko 10 % a více pro osoby ve věku 50–59 let). Prospěch z léčby by mohli mít i pacienti věkové skupiny 60–69 let (24). Pacientům ve věku nad 70 let se léčba nedoporučuje, protože v této věkové skupině je vyšší počet hemoragických komplikací, které znehodnocují eventuální sporný přínos.
Protidestičková léčba po iCMP – pokračování nebo změna preexistující léčby?
Velká část zejména starší populace užívá protidestičkovou léčbu, nejčastěji ASA, dlouhodobě. V případě, že u nich dojde k nkiCPM nebo TIA, lékaři jsou na rozpacích, jak postupovat dále v protidestičkové léčbě. Zhruba polovina z nich změní ASA za jiný přípravek, nebo ho k ASA přidá. K takovému postupu však chybí klinická evidence. Nedávno byly publikovány výsledky zpracované z databáze VISTA (Virtual International Stroke Trials Archive) v Glasgowě. Soubor obsahoval 1129 pacientů, u 538 z nich byla po příhodě změněna protidestičková léčba, u 591 pacientů bylo pokračováno v dosavadním režimu (25). Změna léčby ve sledovaném intervalu (90 dnů) však nesnižovala riziko recidivy příhody (4,1 % vs. 4,3 %, 95% CI: 0,54-175,p = 0,929). Také incidence intrakraniálního a extrakraniálního krvácení v obou skupinách byla podobná. Jiné výsledky ukázala nedávno publikovaná metaanalýza 5 klinických studií (8723 pacientů). U pacientů po nkiCMP, kteří do té doby užívali ASA, byla u části z nich změněna dosavadní terapie (přidána další protidestičková léčiva, pře ‑ vážně klopidogrel, nebo ASA byla nahrazena jiným přípravkem). Změna léčby v porovnání s monoterapií ASA měla za následek nižší riziko vzniku velkých kardiovaskulárních příhod, včetně nkiCMP (26). Výsledky jiných prací však podpořily léčbu ASA. V práci Nelsona et al (27) autoři zjistili, že pokud došlo k iCMP u pacientů užívajících ASA, klinické projevy nkiCMP byly mírnější a objem akutního infarktu byl menší. Autoři se domnívají, že pacienti s vysokým rizikem by mohli mít prospěch z rutinního podávání ASA. Jiní autoři prokázali, že pacienti s nedostatečně ASA suprimovaným tromboxanem měli závažnější mozkovou příhodu i větší objem mozkového infarktu (28). Nedávno publikované doporučené postupy v USA po vzniku nkiCMP umožňují i zvýšit doposud užívané dávky ASA, nebo zvolit jinou protidestičkovou léčbu (29).
Na úvodní otázku, zda změnit stávající léčbu nebo v ní pokračovat, nemáme tedy v současnosti jednoznačnou odpověď
Cerebrální mikrokrvácení a protidestičková léčba
Cerebrálním mikrokrvácením (CMK) nazýváme drobná depozita degradačních produktů erytrocytů (zejména hemosiderinu) obsaženého v makrofázích v těsné blízkosti strukturálně abnormálně změněných cév (fibrohyalinóza, amyloidóza apod.). Předpokládá se, že CMK jsou výsledkem extravazace erytrocytů z poškozených arteriol a kapilár. Hemosiderin je silný paramagnetický materiál, což umožňuje jeho detekci v magnetickém poli. Nález CMK u pacienta zvyšuje riziko mozkových cévních příhod, a to jak ischemických, tak hemoragických, ale také i riziko smrti a demence. U pacientů s iCMP nebo TIA, kteří dostávali antikoagulační léčbu pro fibrilaci síní a měli zjištěné CMK, bylo symptomatické intrakraniální krvácení více než 3× častější v porovnání s pacienty bez průkazu CMK (7/712; 9,8/1000 pacientoroků, 95%CI 4,0–20,3 vs. 7/2654; 2,6/1000 pacientoroků, 95% CI 1,1–5,4), u pacientů bez CMK (30). Také u pacientů užívajících protidestičkovou léčbu se CMK vyskytovala častěji, striktně vázána na lobární oblasti mozku. Rovněž intrakraniální krvácení u nich bylo častější. Podobně u pacientů s nkiCMP stojíme před otázkou, zda protidestičkovou léčbou zabráníme recidivě nebo vyvoláme mozkové krvácení. Lau et al. (31) v souboru pacientů po iCMP užívající protidestičkovou léčbu a přítomnými CMK sledovali riziko vzniku trom ‑ botických a hemoragických komplikací. U pacientů s CMK bylo 5leté absolutní riziko pro vznik nehendikepující ischemické mozkové příhody vyšší v porovnání s nehendikepujícím intrakraniálním krvácením (9,4 % vs. 1,2 %; P < 0,0001). Také ve skupině pacientů s 5 a více CMK převažovaly ischemické příhody nad hemoragickými (9,8 % vs. 2,1 %; P = 0,008). Odlišný byl nález při hodnocení závažných a fatálních iCMP a intrakraniálních krvácení. Zatímco ve skupině do 5 CMK byla statistika podobná (8,3 % vs. 1,3 %; P = 0,0004), ve skupině 5 a více CMK riziko závažného/fatálního CMP a riziko intrakraniálního krvácení se vyrovnalo (9,0 % vs. 9,4 %; P = 0,81). Vzhledem k tomu, že riziko pro vznik iCMP je mnohem vyšší, protidestičkovou léčbu pokládá za indikovanou a její vysazení v době do prvního roku od příhody pokládá za nevhodné. Hao (32) u pacientů s větším počtem CMK než 5 doporučuje protidestičkovou léčbu po jednom roce postupně ukončit. Pro jednoznačná doporučení jsou však potřebná data z velkých klinických studií.
Lze tedy shrnout:
- protidestičková léčba u nkiCMP a TIA by měla být zahájena do 24 h od začátku prvních příznaků příhody,
- léčbu až na výjimky začínáme dvojkombinací (nejčastěji ASA + klopidogrel) po dobu 3 týdnů, maximálně měsíc,
- po duální léčbě pokračujeme v monoterapii ASA nebo klopidogrelem. Jak dlouho se má podávat, není jasné, a doporučené postupy odkazují na individuální posouzení konkrétního pacienta,
- u pacientů s nkiCMP/TIA a zjištěnými CMK zahajujeme protidestičkovou léčbu, protože riziko recidivy je vyšší než riziko intrakraniálního krvácení.
Výhled do budoucna
Očekává se, že v sekundární prevenci nkiCMP a TIA se více uplatní zejména cilostazol a klopidogrel. Cilostazol se pokládá za optimální léčbu z hlediska hodnocení účinnosti a bezpečnosti. Krátkodobá studie kombinace aspirin + cilostazol potvrdila bezpečnost kombinace, ale z hlediska účinnosti v porovnání se skupinou léčenou ASA samotnou nebyl žádný rozdíl (33). Klopidogrel má výrazný antiagregační účinek. V prevenci nkiCMP je stejně účinný jako ASA, avšak u léčených klopidogrelem byla vyšší mortalita než u léčených ASA (34). Práce ze základního výzkumu ukazují, že klopidogrel má také antiaterosklerotické a neuroprotektivní účinky. Jejich potvrzení v klinice by pozici klopidogrelu výrazně posílilo.
Studie SOCRATES neprokázala lepší účinnost tikagrelolu v porovnání s ASA (35) a v současnosti probíhá klinická studie THALES, jejíž výsledky rozhodnou i o tom, zda se v léčbě uplatní tikagrelol v kombinaci s ASA. Zkouší se i kombinace protidestičkových léčiv a přímo působících perorálních antikoagulancií (36). Výskyt hemoragických komplikací ve skupině rivaroxaban + ASA byl téměř dvojnásobný v porovnání se skupinou léčených ASA samotnou. Z indikace protidestičkové léčby by se neměly podávat enterosolventní formy ASA (ecASA) pro jejich nižší biologickou dostupnost a pravděpodobně menší protidestičkový efekt (37, 38).
Závěr
Cílem protidestičkové léčby je snížit riziko recidiv nkiCMP. Zde ještě více než v jiných případech musíme pečlivě balancovat mezi účinností léčby a nežádoucími účinky, zejména hemoragickými komplikacemi. Zatímco mezi odborníky je víceméně shoda v přístupu v prvních týdnech po příhodě, pro další optimální postup chybí podklady z klinických studií. Přes velký pokrok v léčbě v posledních letech je riziko recidivy nkiCMP stále neakceptovatelně vysoké. V komplexním přístupu v jeho snižování má důležitou roli i protidestičková léčba a její postupná optimalizace na základě získávání klinických zkušeností s jednotlivými léčivy i jejich kombinacemi.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Štefan Alušík, CSc.,
Katedra vnitřního lékařství IPVZ,
Ruská 85,
100 05 Praha 10
Cit. zkr: Vnitř Lék 2020; 66(8): 501–506
Článek přijat redakcí: 31. 7. 2019
Článek přijat po recenzích: 20. 12. 2019
Zdroje
1. Amarenco P, Lavallee PC, Labreuche J, et al. One‑year risk of stroke after transient ischemic attack or minor stroke. N Engl J Med 2016; 374 : 1533–1542.
2. Zhang J, Yang Y, Sun H, et al. Hemorrhagic transformation after cerebral infarction: current concepts and challenges. Ann Transl Med 2014; 8 : 81.
3. Royal College of Physicians. National clinical guideline for stroke. Prepared by the Intercollegiate Stroke Working Party. 5th ed.2016.
4. NICE guideline: Stroke and transient ischaemic attack in over 16 s: diagnosis and initial management (NG 128). Dostupné z WWW: https://www.nice.org.uk/guidance/ng128
5. Rothwell PM, Cook NR, Gaziano JM, et al. Effects of aspirin on risks of vascular events and cancer according to bodyweight and dose: analysis of individual patient data from randomised trials. Lancet 2018; 392 : 387–399.
6. Rothwell PM, Algra A, Chen Z, et al. Effects of aspirin on risk and severity of early recu ‑ rrent stroke after transient ischaemic attack and ischaemic stroke: time‑course analysis of randomised trials. Lancet 2016; 388 : 365–375.
7. No author listed. Minor ischaemic stroke and antiplatelet drugs. Very little advantage from adding clopidogrel to aspirin. Prescrire Int 2019; 28 : 77.
8. Karetová D, Bultas J. Cilostazol. Remedia 2014; 24 : 441–449.
9. Shi L, Pu J, Xu L, et al. The efficacy and safety of cilostazol for the secondary prevention of ischemic stroke in acute and chronic phases in Asian population - an updated meta‑analysis. BMC Neurology 2014; 14 : 251.
10. Diener HC, Cunha L, Forbes C, et al. European Stroke Prevention Study. 2. Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke. J Neurol Sci 1996; 143 : 1–13.
11. ESPRIT Study Group. Aspirin plus dipyridamole versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial. Lancet 2006; 367 : 1665–1673.
12. Sacco RL, Diener HC, Yusuf S, et al. PRoFESS Study Group. Aspirin and extended‑release dipyridamole versus clopidogrel for recurrent stroke. N Engl J Med 2008; 359 : 1238–1251.
13. Wang MT, Liang HL, Hung CC, et al. Combination Therapy with Dipyridamole and Clopidogrel for Secondary Stroke Prevention in Aspirin‑Intolerant Patients After Myocardial Infarction: Results of a Nationwide Case‑Control Study. CNS Drugs 2019; 33 : 175–185.
14. Bhatt DL, Fox KA, Hacke W, et al. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006; 354 : 1706–1717.
15. Wang Y, Wang Y, Zhao X, et al. CHANCE Investigators. Clopidogrel with aspirin in acute minor stroke or transient ischemic attack. N Engl J Med 2013; 369 : 11–19.
16. Johnston SC, Easton JD, Farrant M, et al. Clinical Research Collaboration, Neurological Emergencies Treatment Trials Network, POINT Investigators. Clopidogrel and Aspirin in Acute Ischemic Stroke and High‑Risk TIA. N Engl J Med 2018; 379 : 2015–2025.
17. The SPS3 Investigators. Effects of clopidogrel added to aspirin in patients with recent lacunar stroke. N Engl J Med 2012; 367 : 817–825.
18. Diener HC, Bogousslavsky J, Brass LM, et al. MATCH investigators. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high‑risk patients (MATCH): randomised, double‑blind, placebo‑controlled trial. Lancet 2004; 364 : 331–337.
19. Bath PM, Woodhouse LJ, Appleton JP, et al. Antiplatelet therapy with aspirin, clopidogrel, and dipyridamole versus clopidogrel alone or aspirin and dipyridamole in patients with acute cerebral ischaemia (TARDIS): a randomised, open‑label, phase 3 superiority trial. Lancet 2018; 391 : 850–859.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Role metabolického syndrome v indukci chronické pankreatitidy po první atace akutní pankreatitidy – multicentrická studie
- Akutní infekce, žilní trombóza a doporučená tromboprofylaxe
- Hypogonadismus obézních mužů
- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- K 100. výročí narození prof. MUDr. Jiřího Šonky, DrSc.
- Monitorování farmakokinetiky infliximabu u idiopatických střevních zánětů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Prof. Jiří Šonka a obezitologie
- Změny farmakokinetiky léčiv u obézních pacientů
- Neobvyklá manifestace CMV infekce – cirkulární stenóza žaludku
- Chirurgická léčba těžké obezity – bariatrie
- Současnost a perspektivy farmakoterapie obezity
- Fyzická aktivita v léčbě obezity v praxi
- Jak léčit obézního hypertonika?
- Suplementácia vitamínu D ako dôležitý faktor v prevencii a liečbe ochorenia COVID-19: aké máme dôkazy?
- Vplyv ageizmu na správnosť indikácie antikoagulancií u seniorov s fibriláciou predsiení v práci kardiologickej ambulancie medzi rokmi 2012 a 2017
- Protidestičková léčba v sekundární prevenci nekardioembolických ischemických mozkových cévních příhod
- Věkem podmíněná remodelace myokardu: mýtus nebo realita?
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
- Fixní kombinace rosuvastatinu s ezetimibem
- Molekula erdostein společnosti Recipharm byla s pozitivním výsledkem testována jako součást léčby pacientů s COVID-19
- Antioxidační a bronchoprotektivní účinek erdosteinu
- Zkrácená informace o přípravku ERDOMED
- Disekcia ascendentnej aorty, diagnóza na ktorú treba myslieť
- 2020: rok, kdy ambulantní internisté vzali budoucnost do svých rukou. Konečně!
- Programy kvality Q‑OSTEOPORÓZA a Q‑DYSLIPIDEMIE – cesta k dlouhodobé stabilitě v oboru
- 110. výročí narození primáře Kadeřábka
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Změny farmakokinetiky léčiv u obézních pacientů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



