-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Fixní kombinace rosuvastatinu s ezetimibem
Fixed-dose combination of rosuvastatin and ezetimibe
Atherosclerotic cardiovascular diseases (ASCVD) play a significant role in morbidity and mortality not only in developed but also increasingly in developing countries. The only causal risk factor (RF) of ASKVO is LDL-cholesterol. The basic pillar of pharmacotherapy of dyslipidaemias are statins, which should be titrated to the maximum (tolerated) dose and then combined with ezetimibe if the LDL-cholesterol targets for the specific categories of CV risk are not reached. Combination therapy is known to be far more effective than increasing the statin dose. Fixed combinations of statins with ezetimibe can be advantageously used to improve adherence.
Keywords:
cardiovascular disease – CV risk – dyslipidemia – rosuvastatin – ezetimibe – fixed combination.
Autoři: Martin Šatný
Působiště autorů: Centrum preventivní kardiologie, 3. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Vyšlo v časopise: Vnitř Lék 2020; 66(8): 513-517
Kategorie: Farmakologický profil
Souhrn
Aterosklerotická kardiovaskulární onemocnění (ASKVO) se významnou měrou podílejí na morbiditě a mortalitě nejen ve vyspělých, ale stále častěji také v rozvojových zemích. ASKVO jsou determinována řadou rizikových faktorů (RF), přičemž jediný kauzální RF ASKVO je LDL-cholesterol (2). Základní pilíř farmakoterapie DLP představují statiny, které by měly být titrovány do maximální (tolerované) dávky a v případě nedosažení cílových hodnot LDL -cholesterolu pro dílčí kategorie KV rizika pak kombinovány s ezetimibem. Je známo, že kombinační léčba je daleko účinnější než navyšování dávky statinu. Pro zlepšení adherence k léčbě lze s výhodou využít právě fixních kombinací statinů s ezetimibem.
Klíčová slova:
kardiovaskulární onemocnění – KV riziko – dyslipidemie – rosuvastatin – ezetimib – fixní kombinace.
Úvod
Navzdory všem léčebně preventivním opatřením zůstávají kardiovaskulární onemocnění (KVO), jejichž značnou část zaujímají ASKVO, vedoucí příčinou předčasné morbidity a mortality nejen ve vyspělých, ale stále častěji i v rozvojových zemích. Dle aktuálních dostupných údajů Ústavu zdravotnických informací a statistiky (ÚZIS) z roku 2018 se KVO podílela na standardizované úmrtnosti 44,0 % mužů, respektive 47,5 % žen v České republice (1).
Klíčovou roli při manifestaci ASKVO sehrává DLP, respektive zvýšený LDL-cholesterol (LDL‑C)), který je v kontextu dnešních znalostí (doloženo mimo jiné Mendeliánskými randomizovanými studiemi) považován za jediný kauzální rizikový faktor ASKVO (2).
Prevalence DLP není snadno stanovitelná, jelikož chybí její jasná definice. Diskutují se spíše cílové hodnoty plazmatických lipidů než DLP jako taková. Lze však předpokládat, že obdobně, jako je tomu v případě arteriální hypertenze, bude vysoká.Například dle německé studie DGES byla zaznamenána prevalence DLP (definovaná jako celkový cholesterol > 4,92 mmol/l, respektive lékařem stanovená diagnóza poruchy metabolismu lipidů) v populaci dospělých ve věku 18–79 let dokonce 65 % (3).
Intervence DLP a dalších RF ASKVO má zásadní léčebně preventivní význam, kdy se uvádí, že adekvátním screeningem a léčbou dílčích RF lze předejít manifestaci KV komplikací až v 80 % případů (4).
Základem léčby jsou vždy režimová opatření, tj. změny stravovacích návyků, dostatečná pohybová aktivita či zanechání kouření, a v indikovaných případech navazující farmakoterapie. Zlatým standardem léčby DLP jsou statiny (preferenčně moderní potentní statiny – např. rosuvastatin či atorvastatin) – léky velmi dobře tolerované, efektivní, cenově dostupné s minimem nežádoucích účinků. Tyto mají být u pacientů nedosahujících cílových hodnot LDL‑C (při maximální tolerované dávce statinu) kombinovány s ezetimibem. Pro zvýšení adherence k léčbě je lze s výhodou podávat ve fixní kombinaci.
Fixní kombinace – rosuvastatin/ezetimib – indikace
Fixní kombinace rosuvastatin/ezetimib je indikována u pacientů tolerujících volnou kombinaci těchto účinných látek v léčbě familiární (homogyzotní/heterozygotní), nefamiliární (primární) hypercholesterolemie a dále u pacientů s anamnézou ischemické choroby srdeční, respektive akutního koronárního syndromu v prevenci dalších kardiovaskulárních (KV) příhod (5, 6).
Fixní kombinace – rosuvastatin/ezetimib – dávkování
Fixní kombinaci rosuvastatin/ezetimib lze užívat kdykoliv během dne, a to nezávisle na jídle (6). Jakkoli bylo doloženo, že večerní dávkování snižuje dlouhodobou adherenci k léčbě (častější zapomínání), proto by mělo být preferováno spíše podání ranní (7).
Fixní kombinace – rosuvastatin/ezetimib – farmakodynamika
Rosuvastatin (Obr. 1) řadíme mezi selektivní (kompetitivní) inhibitory 3–hydroxy–3–methylglutaryl–koenzym A (HMG‑CoA) reduktázy, která je stěžejním katalyzátorem procesu syntézy endogenního cholesterolu. Díky docílenému nedostatku intracelulárního cholesterolu dochází kontraregulačně k overexpresi LDL‑receptorů na povrchu hepatocytů, což v konečném důsledku vede k zvýšení clearance LDL‑částic z krevní cirkulace (5, 6).
Obr. 1. Chemická struktura rosuvastatinu, upraveno dle (8) 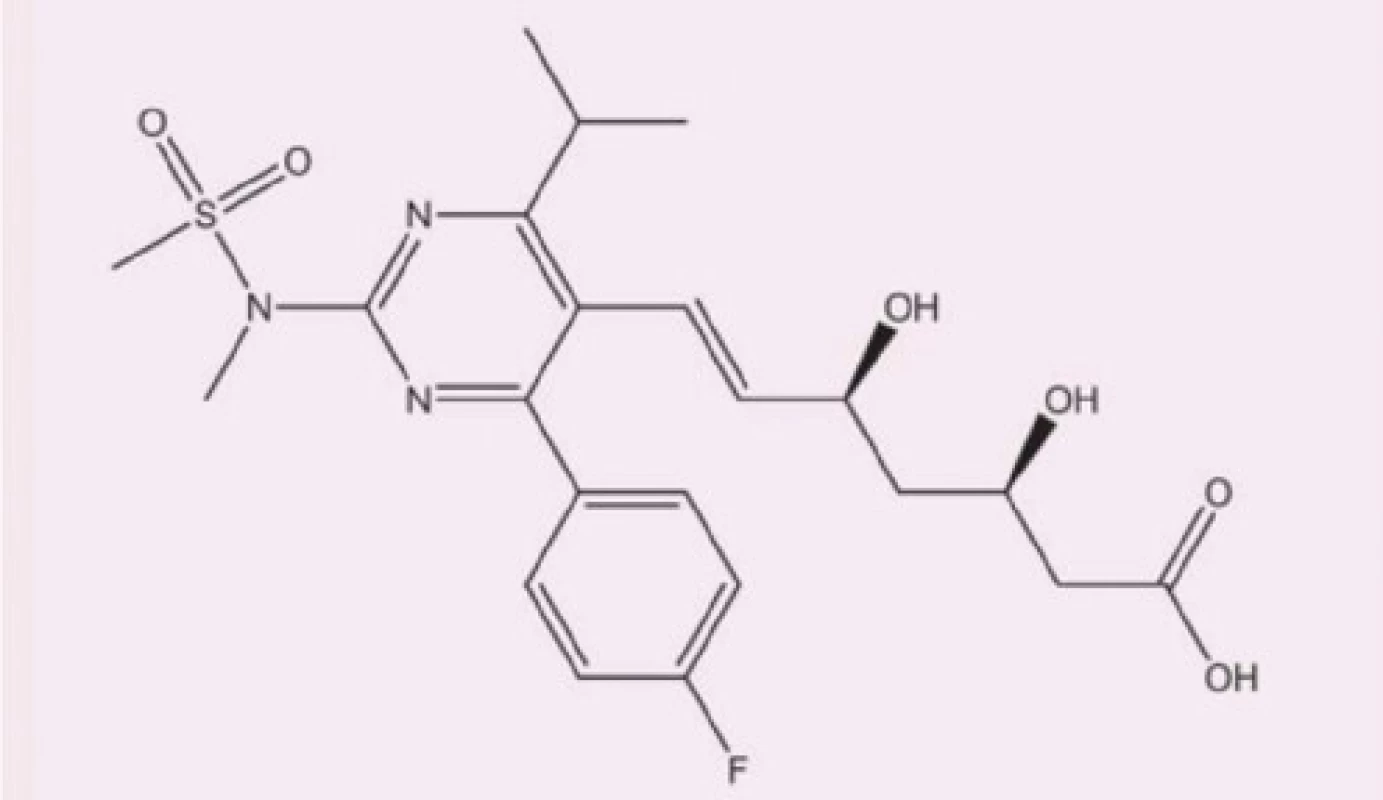
Ezetimib – selektivní inhibitor Niemann‑PickC1-like 1 proteinu – je odpovědný za snížené vstřebávání cholesterolu (jak dietního, tak z enterohepatalního oběhu) a rostlinných sterolů z lumen střeva. V případě jeho samostatného podávání byla dokumentována zvýšená syntéza endogenního cholesterolu, tj. je zřejmá kompenzatorní tvorba cholesterolu de novo na vrub snížené absorpce ze střeva; proto by vždy měl být ezetimib podáván alespoň s malou dávkou statinu (9). Jeho chemická struktura je znázorněna na obrázku (10).
Obr. 2. Chemická struktura ezetimibu, upraveno dle (10) 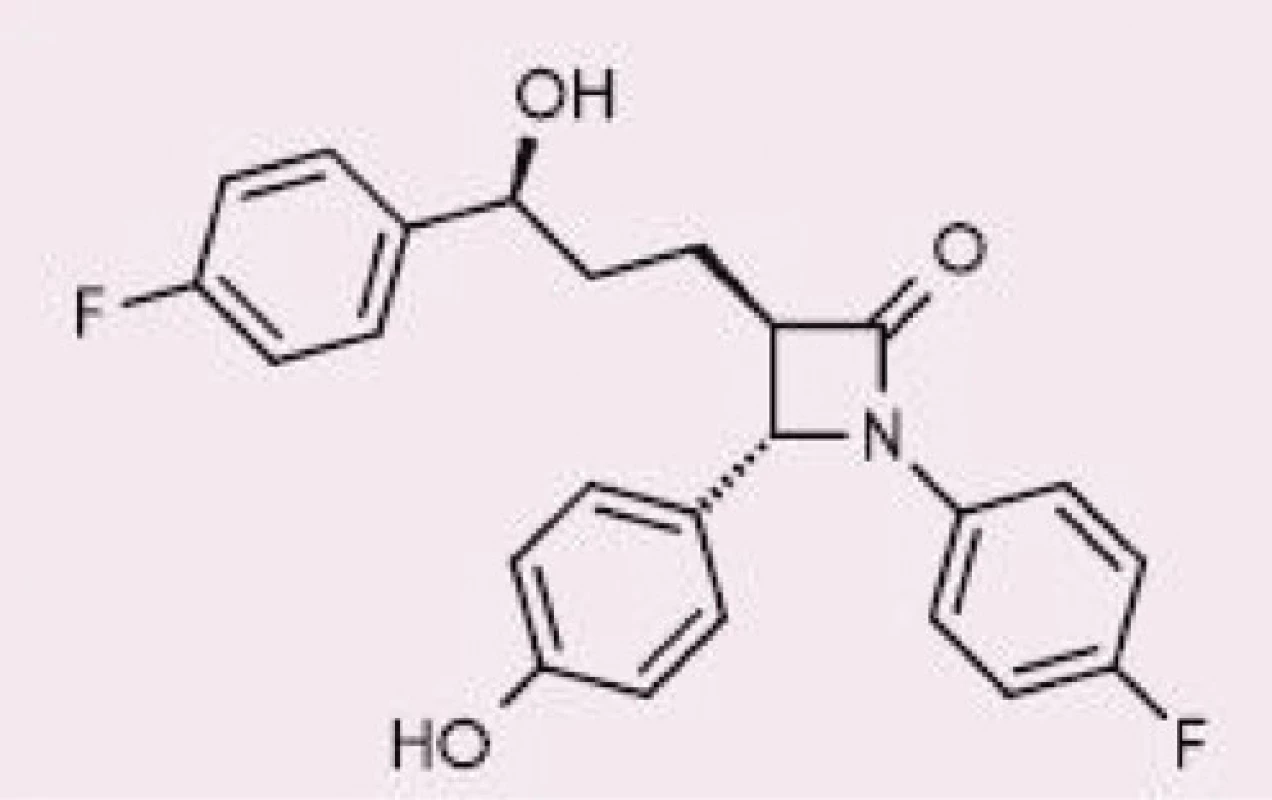
Fixní kombinace rosuvastatin/ezetimib – farmakokinetika
Po perorálním podání rosuvastatinu je docíleno jeho maximální plazmatické koncentrace po 5 hodinách, přičemž biologická dostupnost se uvádí 20 %. V cirkulaci se v cca 90 % váže na plazmatické bílkoviny (zejména albumin) a je vychytáván preferenčně v játrech, kde je částečně (asi 10 %) metabolizován prostřednictvím izoenzymu CYP2C9 cytochromu P450 na méně účinný N‑desmetyl rosuvastatin (50% účinnost) a klinicky neúčinný lakton. Poločas eliminace činí v případě rosuvastatinu přibližně 19 hodin; z 90 % je vyloučen v nezměněné podobě stolicí, zbylá část pak močí (5, 6).
Na tomto místě je třeba zmínit praktické informace stran renální a jaterní insuficience. Rosuvastatin lze bezpečně podávat u pacientů s chronickým onemocněním ledvin (chronic kidney disease – CKD) při kreatininové clearence (ClCr) > 0,5 ml/s/1,73 m2 . U pacientů s nižší ClCr bez nutnosti náhrady funkce ledvin lze očekávat až 3× vyšší hladiny rosuvastatinu, přičemž u pacientů chronicky dialyzovaných jsou obvykle hladiny tohoto léčiva přibližně o 50 % vyšší než u pacientů s normální funkcí ledvin, tj. při ClCr < 0,5 ml/s/1,73 m2 je nutné dávku redukovat na maximálně 5 mg, dávky 30 či 40 mg jsou kontraindikovány (5). U nemocných s chronickým toxonutritivním (alkoholovým) postižením jater narůstá koncentrace léčiva v krvi úměrně se snižující se funkcí jater (11). Bezpečně jej lze užít u nemocných s Child‑Pughovým skóre ≤ 7 (5, 6).
Po per os podání (toto není závislé na denní době či jídle) je ezetimib promptně vstřebán a konjugován na ezetimib‑glukuronid, jehož maximální koncentrace je dosaženo za 1–2 hodiny. Ezetimib i ezetimib‑glukuronid jsou asociovány s plazmatickými bílkovinami, což je třeba zohlednit zejména u pacientů se střední až závažnou poruchou funkce jater. Metabolizace ezetimibu pak probíhá jak v tenkém střevě, tak v játrech, kde je konjugován s glukuronidem a dále secernován do žluče s následnou eliminací stolicí. Jeho biologický poločas činí přibližně 22 hodin (6, 9).
Dávkování ezetimibu není třeba upravovat v závislosti na aktuálních renálních funkcích a lze jej bezpečně podávat pacientů s Child‑Pughovým skóre < 7 (6, 9).
Fixní kombinace rosuvastatin/ezetimib – kontraindikace
Rosuvastatin je kontraindikován u pacientů s ClCr < 0,3 ml/s/1,73 m2 , tj. se závažnou poruchou funkce ledvin, dále pak u těhotných a kojících žen. Dle SPC nelze kombinovat maximální dávku (tj. 40 mg) s fenofibrá ‑ tem. Rosuvastatin by neměl být také podáván u nemocných s aktivním jaterním onemocněním, respektive s nevysvětlitelnou elevací transamináz nad trojnásobek horního limitu normy. Mezi kontraindikacemi je dále vedena elevace kreatinkinázy (CK) nad 5násobek horního limitu normy, a to opakovaně – vždy s odstupem 5–7 dní. Obě výše uvedené kontraindikace však nejsou v souladu s aktuálními doporučenými postupy pro léčbu DLP, kde se uvádí, že při terapii rosuvastatinem nedochází ke zhoršení jaterní funkce či progresi hepatopatie. Dokonce máme k dispozici data u pacientů s nealkoholovou steatózou/steatohepatitidou dokumentující pozitivní dopad léčby jak na snížení hladin transamináz, tak na zlepšení histologického nálezu v jaterním parenchymu; navíc bylo prokázáno i zlepšení KV prognózy těchto nemocných (2, 5, 6, 11, 12). Stran elevace CK doporučení apelují na určení kauzality elevace CK s léčbou statiny; uvádějí, že u asymptomatických nemocných lze statiny bezpečně podávat až do 10násobku horního limitu normy pro CK (2). Další kontraindikací užití rosuvastatinu představují myopatie či terapie cyklosporinem (5, 6).
Podobně jako statiny není ezetimib určen těhotným a kojícím ženám. Jeho užití je dle SPC dále kontraindikováno u pacientů s aktivním jaterním onemocněním či nevysvětlitelnou elevací transamináz, jakkoli tyto stavy nejsou dále definovány (6, 9).
Fixní kombinace rosuvastatin/ezetimib – lékové interakce
Stran možného výskytu nežádoucích lékových interakcí je třeba být obezřetným při současné terapii rosuvastatinu s kyselinou fusidovou (jak současně, tak během 7 dnů od ukončení jejího podávání), inhibitory proteáz/transportních proteinů, erythromycinem (snížení maximální koncentrace až o 30 %) či antacidy (5, 6).
Při užití ezetimibu nejsou známy interakce na cytochromu P450, k nimiž by docházelo s dalšími léčivy. V případě současného podání se sekvestranty žlučových kyselin, tj. cholestyraminem, může dojít k poklesu hladin ezetimibu až o 55 %. Při konkomitantní terapii s fibráty existuje riziko rozvoje cholelitiázy, respektive onemocnění žlučníku (9).
Fixní kombinace rosuvastatin/ezetimib – nežádoucí účinky
Zmiňme úvodem nejčastěji diskutované myalgie, respektive myopatie. Stran myopatií vyplynulo z dat klinických sledování, že se jedná o komplikace zcela výjimečné; četnost jejich výskytu je uváděna 0,5 na 1000 případů za 5 let (5, 6). Metaanalýza 14 primárně preventivních studií přinesla ještě zajímavější data týkající se této problematiky. Během doby sledování nebyl zaznamenán rozdíl ve výskytu myopatií v léčených a placebových větvích dílčích studií (4). Jakkoli v klinické praxi je reference myalgií spojených se statiny relativně častá, jejich kauzalita s užíváním statinů v řadě situací průkazná není.
Pro běžnou praxi je tedy důležité rozlišit, zda myopatie/myalgie souvisí s podávanou léčbou či nikoliv; pro tyto účely byl již opakovaně publikován algoritmus řešení svalových obtíží dostupný v aktuálních doporučeních pro management léčby DLP (více viz zdroj 2). I za předpokladu průkazu souvislosti obtíží pacienta s léčbou statiny z klinických zkušeností víme, že redukcí dávky, výměnou preparátu, alternativním podáváním statinu či kombinační léčbou dochází často k vymizení obtíží nemocného a k jeho dobré adherenci k léčbě.
Se vzestupem transamináz (ALT, resp. AST) – jakožto NÚ statinů – se nejčastěji setkáváme v prvním půlroce léčby, přičemž probíhá nejčastěji asymptomaticky a odeznívá po deeskalaci či vysazení léčby. Současná guidelines nedoporučují rutinní kontroly jaterních testů (ALT); tyto by měly být vyšetřeny pouze v indikovaných případech, tj. před zahájením léčby, změně dávky či v klinicky odůvodněných případech (při obtížích pacienta). Tato skutečnost dobře odráží bezpečnost a obecně dobrou toleranci léčby statiny (2). Specifickou skupinu pak tvoří senioři, u kterých je sice situace obdobná, ale výskyt těchto NÚ může být v kontextu polymorbidity, polypragramazie (resp. lékových interakcí) či alterovaným metabolismem nepříznivě ovlivněn. Proto je nutné u této populace léčbu titrovat postupně za pravidelných kontrol jaterních enzymů.
Podávání (zejména vysoce dávkovaných) statinů může být asociováno s rizikem mírného zvýšení glykemie u predisponovaných pacientů. U jedinců s již známou poruchou glukózové tolerance (hraniční či mírně zvýšenou hladinou glykemie nalačno) tak může dojít k překročení arbitrární hranice pro diagnózu diabetes mellitus. Jakkoli u zdravých jedinců nebyla popsána asociace léčby statiny s rizikem rozvoje DM (např. studie JUPITER). Je třeba mít na paměti, že redukce KV rizika získaná „statinovou léčbou“ zcela převažuje potenciální riziko rozvoje DM a bylo by chybou statiny v tomto duchu kontraindikovat. Nezbytné je povědomí o této skutečnosti, její screening a eventuální navazující léčebná intervence (13, 14).
U ezetimibu je popisována a v klinické praxi také dokumentována výborná tolerance prakticky bez nežádoucích účinků; ty byly v řadě klinických studií srovnatelné s monoterapií statinem, resp. placebem. Tato skutečnost může být do jisté míry ovlivněna jeho dobrým mediální „obrazem“ ve srovnání s velmi často negativně debatovanými statiny (15).
Nejčastěji popisovanými nežádoucími účinky ezetimibu jsou gastrointestinální intolerance – dyspepsie, bolesti břicha, průjem či nadýmání. Dále se dle SPC mohou objevit myalgie, hepatopatie či únava (9).
Fixní kombinace – rosuvastatin/ezetimib – data podporující její užití
Data týkající se kombinace rosuvastatin/ezetimib
Jak již bylo uvedeno výše, kombinační léčba statin/ezetimib má zcela zásadní a aditivní hypolipidemický efekt, kdy lze díky tzv. duální inhibici docílit většího poklesu LDL‑C než monoterapií dílčími preparáty.
Zde je nutno poznamenat, že fixní kombinace rosuvastatinu s ezetimibem nebyla testována žádnou velkou klinickou studií sledující KV morbiditu, respektive KV či celkovou mortalitu, což však nijak neumenšuje význam této fixní kombinace v běžné klinické praxi.
K dispozici máme několik menších studií, jež dokumentují změny lipidové spektra evokované volnou či fixní kombinací rosuvastatin/ezetimib. Nelze opomenout 2 studie – I‑ROSETTE a MRS‑ROZE. Studie I‑ROSETTE byla designovaná k porovnání fixní kombinace rosuvastatinu (5–10–20 mg) s ezetimibem (10 mg) proti monoterapii rosuvastatinem v odpovídajícím dávkování. V populaci probandů léčených právě fixní kombinací došlo k poklesu LDL‑C o více než 50 %, přičemž výskyt nežádoucích účinků byl v obou větvích studie totožný. Další výše diskutovaná studie – MRS‑ROZE – hodnotila efekt fixní kombinace rosuvastatin/ezetimib vůči monoterapii statinem, a to v populaci pacientů s DM, metabolickým syndromem či hypercholesterolemií. V průběhu klinického sledování byl zaznamenán pokles LDL‑C až o 63 %, celkového cholesterolu o 43 % a triglyceridů o 24 % (v závislosti na podané dávce statinu) (16, 17).
Další důkazy podporující využití diskutované kombinace léčiv vyplynuly ve shodě s předchozími např. ze studií EXPLORER, ACTE či GRAVITY (18–20).
Máme k dispozici také data dokládající pozitivní dopad kombinační léčby na regresi aterosklerotických cévních plátů. Masuda at al. sledovali po dobu 6 měsíců populaci 51 pacientů se známou ischemickou chorobou srdeční indikovaných k intervenci na koronárních tepnách; kombinační léčba u nich vedla nejen k výraznému poklesu LDL‑C (o 55,8 %), ale i ke zmenšení objemu aterosklerotických plátů (o 13,2 %) (21).
Z farmakokinetických studií sledujících plazmatické koncentrace podávaných léčiv vyplynulo, že není rozdílu mezi volnými a fixními kombinacemi rosuvastatinu/ezetimibu, což dále podporuje bezpečnost a racionalitu fixního podání. Další skutečností podtrhující užití těchto léčivých forem je zvýšení adherence k léčbě, jelikož, jak známo, tato klesá s rostoucím počtem podávaných tablet, a to i v populaci nemocných s již manifestním ASKVO (22). Na užívání fixních kombinací apelují také odborná doporučení pro management léčby DLP (2).
Data podporující kombinační léčbu statin/ezetimib obecně
Zcela revoluční v tomto směru byla studie IMPROVE‑IT – sekundárně preventivní studie, do které bylo zavzato na 18 000 pacientů do 10 dnů po akutním koronárním syndromu s výchozí hladinou LDL‑C 1,3–3,2 mmol/l (respektive 1,3–2,6 mmol/l u nemocných léčených nižší dávkou statinu než odpovídá 40 mg simvastatinu), přičemž doba sledování činila 7 let. Po zařazení do studie následovala randomizace ke kombinační léčbě simvastatin/ezetimib, respektive simvastatin/placebo. Sledované parametry zahrnovaly výskyt KV úmrtí, infarktu myokardu (IM), nestabilní anginy pectoris (AP) vyžadující hospitalizaci, koronární revaskularizace či cévní mozkové příhody (CMP). Sedmiletý follow‑up dokumentoval u pacientů léčených právě kombinací simvastatin/ezetimib signifikantní redukci relativního rizika (RRR) nefatálního IM o 13 % a nefatální CMP o 20 %, přičemž ostatní ukazatele nebyly statisticky významně ovlivněny a zásadně se nelišily v obou větvích studie (23).
Stran benefitu kombinační léčby stojí za zmínku také studie SEAS (The Simvastatin and Ezetimibe in Aortic Stenosis) s 1873 pacienty ve věku 45–85 let s asymptomatickou lehkou až středně těžkou aortální stenózou srovnávající léčbu statin/ezetimib vs. placebo. Během doby sledování došlo jednak k signifikantní RRR výskytu ischemických KV příhod o 22 %, jednak k signifikantní RRR potřeby implantace aortokoronárního bypassu o 32 % (24).
V roce 2011 byly publikovány výsledky studie SHARP (Study of Heart and Renal Protection), v níž bylo sledováno více než 9 000 pacientů s chronickým renální onemocněním/renálním selháním dosud bez anamnézy IM či koronární revaskularizace. Kombinační hypolipidemická terapie u nich podmínila RRR výskytu KV příhod o 17 %; současně nebylo zaznamenáno zvýšené riziko myopatií, hepatopatií, malignit či mortality nesouvisející s KV onemocněními (25).
Obecně mají největší profit z kombinační léčby samozřejmě nejvíce rizikoví nemocní. Zjednodušeně lze konstatovat, že profit je do jisté míry přímo úměrný výši KV rizika. Zhodnotíme‑li data klinických studií, je evidentní, že léčba statin/ezetimib představuje největší přínos pro nemocné s DM 2. typu (ve studii IMPROVE‑IT se u diabetiků snížil výskyt KV příhod o 14 % oproti pacientům bez diabetu), po prodělaném aortokoronární bypassu, s chronickým onemocněním ledvin/renálním selháním, dále pak pro ženy, osoby starší 65 let či osoby již léčené hypolipidemiky ve srovnání s „naivními“ pacienty (26).
Pár slov závěrem
Léčba DLP je považována za základní pilíř KV prevence, a je tedy mocným nástrojem umožňujícím ovlivnění KV morbidity a mortality. U řady pacientů, zejména těch nejrizikovějších, se nedaří maximální tolerovanou dávkou statinu dosahovat ambiciózních léčebných cílů. Právě zde nachází své uplatnění kombinační léčba s ezetimibem, kterou podporují robustní data z klinických sledování. Pokud je léčba statin/ezetimib dobře tolerována, lze v kontextu zvýšení adherence a racionalizace medikace užívat jejich fixních kombinaci.
V současné době máme na trhu v případě fixní kombinace rosuvastatinu s ezetimibem tři dávkovací schémata, tj. ezetimib 10 mg a rosuvastatin 10 mg, 20 mg a 40 mg. Stran zvýšení adherence k léčbě by mělo být preferováno ranní podání.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Martin Šatný,
Centrum preventivní kardiologie,
3. interní klinika – klinika endokrinologie a metabolismu
1. LF UK a VFN v Praze
Cit. zkr: Vnitř Lék 2020; 66(8): 513–517
Článek přijat redakcí: 6. 10. 2020
Článek přijat po recenzích: 23. 11. 2020
Zdroje
1. ÚZIS. Zdravotnická ročenka České republiky 2018, dostupné z: https://www.uzis.cz/ res/f/008280/zdrroccz-2018.pdf.
2. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the manage ‑ ment of dyslipidaemias: lipid modification to reduce cardiovascular risk. European Heart Journal (online). 2019 (cit. 2019-09-01). DOI: 10.1093/eurheartj/ehz455. ISSN 0195668X. Dostupné z: https://academic.oup.com/eurheartj/advance‑article/doi/10.1093/ eurheartj/ehz455/5556353
3. Scheidt‑Nave C, DU Y, Knopf H, et al. Verbreitung von Fettstoffwechselstörungen bei Erwachsenen in Deutschland. Bundesgesundheitsblatt – Gesundheitsforschung - Gesundheit‑sschutz(online). 2013; 56(5–6): 661–667 (cit. 2019-08-14). DOI: 10.1007/s00103-013-1670-0. ISSN 1436-9990. Dostupné z: http://link.springer.com/10.1007/s00103-013-1670-0.
4. Sanin V, Koenig W. Therapie der Hypercholesterinämie in der Primärprävention. DMW - Deutsche Medizinische Wochenschrift (online). 2019; 144(05): 322–328 (cit. 2019-08-14). DOI: 10.1055/a-0657-1668. ISSN 0012-0472. Dostupné z: http://www.thieme‑connect.de/ DOI/DOI?10.1055/a-0657-1668
5. Rosuvastatin (SPC). Souhrn informací o přípravku. Dostupný na: www.sukl.cz.
6. Rosuvastatin/ezetimib (SPC). Souhrn informací o přípravku. Dostupný na: www.sukl.cz.
7. Lund TM, Torsvik H, Falch D, et al. Effect of morning versus evening intake of simvastatin on the serum cholesterol level in patients with coronary artery disease. Am J Cardiol 2002; 90(7): 784–786.
8. Rosuvastatin. Pubchem diabase. Dostupné z: https://pubchem.ncbi.nlm.nih.gov/com ‑ pound/Rosuvastatin#section=Top.
9. Ezetimib (SPC). Souhrn informací o přípravku. Dostupný na: www.sukl.cz.
10. Ezetimib. Pubchem diabase. Dostupné z: https:/ / pubchem.ncbi.nlm.nih.gov/ com ‑ pound/ Ezetimibe#section=Top.
11. Drug Information 2016. Bethesda: American Society of Health‑System Pharmacists 2016 : 1865–1866.
12. Athyros VG, Alexandrides TK, Bilianou H, et al. The use of statins alone, or in combi ‑ nation with pioglitazone and other drugs, for the treatment of non‑alcoholic fatty liver disease/non‑alcoholic steatohepatitis and related cardiovascular risk. An Expert Panel Statement. Metabolism 2017; 71 : 17–32. doi: 10.1016/j.metabol.2017. 02. 014.
13. Law M, Rudnicka AR. Statin safety: a systematic review. Am J Cardiol 2006; 97(8 A): 52C – 60C.
14. Ridker PM, Pradhan A, MacFadyen JG, et al. Cardiovascular benefits and diabetes risks of statin therapy in primary prevention: an analysis from the JUPITER trial. The Lancet (on ‑ line). 2012; 380(9841): 565–571 (cit. 2020-11-14). ISSN 01406736. Dostupné z: doi:10.1016/ S0140-6736(12)61190-8.
15. Šatný M, Vrablík M. Desatero užití ezetimibu aneb stručný průvodce jeho použitím v současnosti. AtheroRev 2019; 4(3): 181–184.
16. Hong SJ, Jeong HS, Ahn, JC, et al. A phase III, multicenter, randomized, double‑blind, active comparator clinical trial to compare the efficacy and safety of combination therapy with ezetimibe and rosuvastatin versus rosuvastatin monotherapy in patients with hyper ‑ cholesterolemia: I‑ROSETTE (Ildong Rosuvastatin & Ezetimibe for Hypercholesterolemia) ran ‑ domized controlled trial. Clin Ther 2018; 40(2): 226–241. doi: 10.1016/ j.clinthera.2017. 12. 018.
17. Kim KJ, Kim SH, Yoon YW, et al. Effect of fixed‑dose combinations of ezetimibe plus rosuvastatin in patients with primary hypercholesterolemia: MRS‑ROZE (Multicenter Ran ‑ domized Study of ROsuvastatin and eZEtimibe). Cardiovasc Ther 2016; 34(5): 371–382. doi: 10.1111/ 1755-5922.12213.
18. Ballantyne CM, Weiss R, Moccetti T, et al. Efficacy and safety of rosuvastatin 40 mg alo ‑ ne or in combination with ezetimibe in patients at high risk of cardiovascular disease (re ‑ sults from the EXPLORER study). Am J Cardiol 2007; 99 : 673–680.
19. Bays HE, Davidson MH, Massaad R, et al. Safety and efficacy of ezetimibe added on to rosuvastatin 5 or 10 mg versus up‑titration of rosuvastatin in patients with hypercholes ‑ terolemia (the ACTE Study). Am J Cardiol 2011; 108 : 523–530.
20. Ballantyne CM, Hoogeveen RC, Raya JL, et al. Efficacy, safety and effect on biomarkers related to cholesterol and lipoprotein metabolism of rosuvastatin 10 or 20 mg plus ezeti ‑ mibe 10 mg vs. simvastatin 40 or 80 mg plus ezetimibe 10 mg in high‑risk patients: Results of the GRAVITY randomized study. Atherosclerosis 2014; 232 : 86–93.
21. Masuda J, Tanigawa T, Yamada T, et al. Effect of combination therapy of ezetimibe and rosuvastatin on regression of coronary atherosclerosis in patients with coronary artery disease. Int Heart J 2015; 56 : 278–228.
22. Kyselák O, Šoška V. Fixní kombinace rosuvastatinu s ezetimibem – lékový profil. Kar ‑ diol Rev Int Med 2018; 20(2): 142–146.
23. Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe Added to Statin Therapy af ‑ ter Acute Coronary Syndromes. New England Journal of Medicine (online). 2015; 372(25): 2387–2397 (cit. 2019-09-12). DOI: 10.1056/NEJMoa1410489. ISSN 0028-4793. Dostupné z: http://www.nejm.org/doi/10.1056/NEJMoa1410489.
24. Rossebo AB, Pedersen TR, Boman K, et al. Intensive Lipid Lowering with Simvastatin and Ezetimibe in Aortic Stenosis. New England Journal of Medicine (online). 2008; 359(13): 1343–1356 (cit. 2019-09-12). DOI: 10.1056/NEJMoa0804602. ISSN 0028-4793. Dostupné z: http://www.nejm.org/doi/abs/10.1056/NEJMoa0804602.
25. Baigent, C, Landray MJ, Reith C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo‑controlled trial. The Lancet (online). 2011; 377(9784): 2181–2192 (cit. 2019-09-12). DOI: 10.1016/S0140-6736(11)60739-3. ISSN 01406736. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0140673611607393.
26. Soška V. Vliv kombinace simvastatinu s ezetimibem na krevní lipidy a na kardiovaskulární příhody u diabetiků (komentář k výsledkům subanalýzy studie IMPROVE‑IT). Vnitř Lék 2015; 61 : 965–969.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Role metabolického syndrome v indukci chronické pankreatitidy po první atace akutní pankreatitidy – multicentrická studie
- Akutní infekce, žilní trombóza a doporučená tromboprofylaxe
- Hypogonadismus obézních mužů
- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- K 100. výročí narození prof. MUDr. Jiřího Šonky, DrSc.
- Monitorování farmakokinetiky infliximabu u idiopatických střevních zánětů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Prof. Jiří Šonka a obezitologie
- Změny farmakokinetiky léčiv u obézních pacientů
- Neobvyklá manifestace CMV infekce – cirkulární stenóza žaludku
- Chirurgická léčba těžké obezity – bariatrie
- Současnost a perspektivy farmakoterapie obezity
- Fyzická aktivita v léčbě obezity v praxi
- Jak léčit obézního hypertonika?
- Suplementácia vitamínu D ako dôležitý faktor v prevencii a liečbe ochorenia COVID-19: aké máme dôkazy?
- Vplyv ageizmu na správnosť indikácie antikoagulancií u seniorov s fibriláciou predsiení v práci kardiologickej ambulancie medzi rokmi 2012 a 2017
- Protidestičková léčba v sekundární prevenci nekardioembolických ischemických mozkových cévních příhod
- Věkem podmíněná remodelace myokardu: mýtus nebo realita?
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
- Fixní kombinace rosuvastatinu s ezetimibem
- Molekula erdostein společnosti Recipharm byla s pozitivním výsledkem testována jako součást léčby pacientů s COVID-19
- Antioxidační a bronchoprotektivní účinek erdosteinu
- Zkrácená informace o přípravku ERDOMED
- Disekcia ascendentnej aorty, diagnóza na ktorú treba myslieť
- 2020: rok, kdy ambulantní internisté vzali budoucnost do svých rukou. Konečně!
- Programy kvality Q‑OSTEOPORÓZA a Q‑DYSLIPIDEMIE – cesta k dlouhodobé stabilitě v oboru
- 110. výročí narození primáře Kadeřábka
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Změny farmakokinetiky léčiv u obézních pacientů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



