-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
Draft of the best medical treatment in patients with low-risk thyroid cancer
Introduction:
The incidence of well-differentiated low-risk thyroid cancer have increased globally over the last three decades. Thyroid cancer treatment relates to a suitable surgical procedure and the use of adjuvant radioiodine therapy in selected patients. Evaluation of prognostic factors and risk stratification are critical for determining appropriate treatment. Survival of patients with low-risk thyroid cancer is excellent. Appropriate choice of medical treatment resulted in full recovery in most patients. Relapse risk increases with the size of the primary tumor, along with the findings of the risk factors in men.Methods and results:
Our study included a total of 1 980 patients in whom were diagnosed T1a and T1b tumors between the years 2003 to 2012. The population included 1 675 women (84.6 %) of average age of 45.22 years and 305 men (15.4 %) of average age of 50.0 years. The bulk of the file represented papillary carcinomas (1 868; 94.4 %), and smaller group of follicular carcinomas (112; 5.6 %). Patients were divided into four groups according to tumor size. Patients were evaluated according to risk factors: unifocality no other risk factors, multifocality – more bearings in thyroid tumor, metastases in regional lymph nodes, distant metastases or combination of risk factors. Group A: In the monitored set of 678 patients with papillary and follicular microcarcinoma up to 5 mm, during histological input, the findings revealed one bearing (unifocal type of cancer) in 566 patients. Multifocality was found in 112 patients, local nodal metastasis were demonstrated in 24 cases and pulmonary metastasis was discovered in 1 case. Group B: In this group there were 576 study patients with papillary and follicular microcarcinoma size of 5–10 mm. Histological findings were captured input one bearing carcinoma in 434 patients, 142 patients with multifocality, in 53 cases of local nodal metastasis, and 1 case of bone metastases. Group C: In this group there were 467 study patients with papillary and follicular microcarcinoma size 10–15 mm. The histological initial finding captured unifocal type of cancer in 344 patients, multifocality in 123 patients, in 45 cases local metastases and in 3 cases of pulmonary metastases. Group D: 259 patients were monitored in this group with breast size 16–20 mm. At the initial finding was captured one bearing cancer in 188 patients, multifocality in 71 patients, in 24 cases evidence of local metastases and 2 patients had a case of distant lung metastases. In patients in whom risk factors were found, radioiodine treatment was indicated. This included 744 patients. In this group of patients after a year or more, relapse was observed in 74 patients (9.94 %). In 1 236 patients who did not undergo radioiodine treatment, there was a relapse in 49 patients (3.96 %).Conclusion:
Based on our analysis, it is necessary to stratify the risk of relapse according to risk factors. In case of missed radioiodine therapy in patients with low-risk cancer without confirmed risk factors, it is also necessary to have regular clinical, laboratory and ultrasound examination. It is important to distinguish patients with risk factors that may contribute to disease recurrence. Only in this way, on one hand we prevent excessive treatment of patients with low-risk thyroid cancer which leads to increased cost of health care, and on the other hand prevent reduced level of care for patients with an increase in relapses.Key-words:
low-risk thyroid cancer – radioiodine treatment – risk stratifications
Autoři: Petr Vlček 1; Dagmar Nováková 1; Jan Vejvalka 1; Jaroslav Zimák 1; Martin Křenek 1; Květuše Vošmiková 1; Svatopluk Smutný 1; Petr Bavor 1; Jaromír Astl 1,3; Jindřich Lukáš 1,4
Působiště autorů: Klinika nukleární medicíny a endokrinologie 2. LF UK a FN Motol Praha, přednosta prof. MUDr. Petr Vlček, CSc. 1; Chirurgická klinika 2. LF UK a FN Motol Praha, přednosta prof. MUDr. Jiří Hoch, CSc. 2; ORL klinika 3. LF UK a ÚVN Praha, přednosta prof. MUDr. Jaromír Astl, CSc. 3; Oddělení otorinolaryngologie a chirurgie hlavy a krku, Nemocnice Na Homolce Praha, primář MUDr. Petr Jirák 4
Vyšlo v časopise: Vnitř Lék 2015; 61(9): 769-777
Kategorie: Původní práce
Souhrn
Úvod:
Výskyt dobře diferencovaného nízkorizikového karcinomu štítné žlázy zaznamenal v posledních 3 desetiletích celosvětový nárůst. Léčba karcinomu štítné žlázy se týká vhodného chirurgického výkonu a použití adjuvantní terapie radiojodem u vybraných pacientů. Pro stanovení vhodné léčby je rozhodující hodnocení prognostických faktorů a stratifikace rizika. Přežívání pacientů s nízkorizikovým karcinomem štítné žlázy je vynikající. Vhodnou volbou léčebného postupu je u většiny pacientů dosaženo úplného vyléčení, riziko relapsů stoupá s velikostí primárního nádoru, při nálezu rizikových faktorů a u mužů.Metodika a výsledky:
Do sledovaného souboru bylo zařazeno celkem 1 980 pacientů, u kterých byly v letech 2003–2012 diagnostikovány nádory T1a a T1b. Jednalo se o 1 675 žen (84,6 %), průměrný věk 45,22 let, a 305 mužů (15,4 %), průměrný věk 50,0 let. Převážnou část souboru představovaly karcinomy papilární (1 868; 94,4 %), menší část pak karcinomy folikulární (112; 5,6 %). Pacienti byli rozděleni do 4 skupin podle velikosti nádoru. U pacientů byly hodnoceny rizikové faktory: unifokalita bez dalších rizikových faktorů, multifokalita – více ložisek nádoru ve štítné žláze, metastázy ve spádových lymfatických uzlinách, vzdálené metastázy, případně kombinace více rizikových faktorů. Skupina A: V souboru 678 sledovaných nemocných s papilárním a folikulárním mikrokarcinomem do 5 mm bylo při histologickém vstupním nálezu zachyceno jedno ložisko (unifokální typ karcinomu) u 566 nemocných, multifokalita byla nalezena u 112 pacientů, ve 24 případech byly prokázány lokální uzlinové metastázy a v 1 případě byl nález plicních vzdálených metastáz. Skupina B: V této skupině bylo 576 sledovaných pacientů s papilárními a folikulárními mikrokarcinomy velikosti 5–10 mm. Při histologickém vstupním nálezu bylo zachyceno jedno ložisko karcinomu u 434 nemocných, multifokalita u 142 pacientů, v 53 případech lokální uzlinové metastázy a v 1 případě kostní metastázy. Skupina C: V této skupině bylo 467 sledovaných pacientů s papilárními a folikulárními mikrokarcinomy velikosti 10–15 mm. Při histologickém vstupním nálezu byl zachycen unifokální typ karcinomu u 344 nemocných, multifokalita u 123 pacientů, v 45 případech lokální metastázy a ve 3 případech plicní metastázy. Skupina D: V této skupině bylo 259 sledovaných pacientů s karcinomem velikosti 16–20 mm. Při vstupním nálezu bylo zachyceno jedno ložisko karcinomu u 188 nemocných, multifokalita u 71 pacientů, v 24 případech byly prokázány lokální metastázy a u 2 pacientů byl nález vzdálených plicních metastáz. U pacientů, u kterých byly nalezeny rizikové faktory, byla indikována léčba radiojodem. Jednalo se o 744 pacientů. V této skupině pacientů došlo po roce a více k relapsu u 74 pacientů (9,94 %). U 1 236 pacientů, u kterých nebyl podán radiojod, došlo k relapsu u 49 pacientů (3,96 %).Závěr:
Na základě naší analýzy je nezbytné stratifikovat riziko relapsu podle rizikových faktorů. V případě vynechání léčby radiojodem u nemocných s nízkorizikovým karcinomem bez potvrzení rizikových faktorů je nezbytné i tyto pacienty vést v dispenzárním programu a pravidelně je vyšetřovat klinicky, laboratorně a sonograficky. Je důležité rozlišovat pacienty s rizikovými faktory, které se mohou podílet na recidivě onemocnění. Jen tak zabráníme tomu, aby na jedné straně docházelo k nadměrné léčbě nemocných s nízkorizikovým karcinomem štítné žlázy a ke zvyšování vynaložených nákladů na zdravotní péči a aby na druhé straně nedošlo ke snížení úrovně péče provázené nárůstem relapsů.Klíčová slova:
nízkorizikový karcinom štítné žlázy – radiojod – stratifikace rizikaÚvod
Zhoubné nádory štítné žlázy představují 1–2 % všech lidských nádorů. Jde o 7. nejčastější zhoubný nádor. Ve věku 15–45 let patří zhoubné nádory štítné žlázy mezi 5 nejčastějších malignit. Přibližně 28 % nádorů štítné žlázy se manifestuje mezi 20.–40. rokem. V posledních letech jsme svědky rychlého nárůstu nově diagnostikovaných diferencovaných karcinomů štítné žlázy (differentiated thyroid cancer – DTC), a to převážně jeho papilárních forem, z nichž většina je menší než 2 cm. Nálezy těchto nádorů se během posledních 30 let téměř ztrojnásobily. Karcinom štítné žlázy je častější u žen než u mužů, v poměru 3 : 1 [20,24].
V současné době je DTC považován za neoplazii s nejrychleji rostoucí incidencí [9]. Vzhledem k rozvoji diagnostiky a podle dosavadních statistických údajů lze očekávat, že během 20 let bude ve světě každý rok zachyceno 310 000 nových onemocnění. V České republice se dá očekávat, že v budoucnosti bude ročně diagnostikováno asi 1 000 nových případů [12]. V USA se v roce 2030 stane karcinom štítné žlázy 4. nejčastější malignitou [21].
Hledání příčin celosvětového zvýšení výskytu rakoviny štítné žlázy je stále předmětem odborných diskusí. Někteří autoři se domnívají, že zvýšený počet nových případů karcinomu štítné žlázy je ovlivněn především intenzitou prováděných diagnostických vyšetření, zavedením nových zobrazovacích metod (sonografie, počítačové tomografie) a intenzivnějším sledováním (možnost provádění cílené aspirační biopsie tenkou jehlou). Díky těmto diagnostickým možnostem dochází k včasnějšímu záchytu dosud klinicky němých, indolentních papilárních mikrokarcinomů, které jsou spojeny s velmi nízkým rizikem rekurence nebo perzistence onemocnění [1].
Za málo rizikové karcinomy štítné žlázy jsou považovány: mikrokarcinomy velikosti < 10 mm (T1a) a nádory velikosti < 20 mm (T1b), bez nálezu uzlinových metastáz v době diagnózy. Některé autority řadí mezi nízkorizikové karcinomy i tumory < 40 mm bez uzlinového syndromu a extra tyreoidální propagace v době diagnózy [16].
Dosavadní odborná literatura se značně liší v doporučení pro rozsah léčby u pacientů s výše uvedenými karcinomy. Někteří autoři navrhují pouhé sledování a jiní doporučují chirurgický výkon a podání radiojodu [3,8]. U papilárních mikrokarcinomů (papillary thyroid microcarcinoma – PTMC) panuje obecný konsenzus nepodávat radiojod, na druhou stranu existují studie, které podporují důvody pro totální tyreoidektomii a podání radiojodu. V případech PTMC někteří autoři také doporučují volit radikálnější léčebné postupy [22]. Týká se to zejména pacientů s histologií papilárních karcinomů z vysokých buněk, sklerotickou variantou PTMC, přítomnou multifokalitou, extra tyreoidálním šířením či metastazováním do lymfatických uzlin.
V České republice v posledních 3 dekádách dochází rovněž k výraznému nárůstu málo rizikových karcinomů štítné žlázy [12,13]. Na našem pracovišti proto považujeme nalezení optimálního léčebného postupu za velmi aktuální. Za racionální přístup považujeme takový léčebný algoritmus, který je založen na vstupním posouzení prognostických rizikových faktorů a stratifikaci rizika nemoci. Naším cílem je minimalizovat rizika relapsu a minimalizovat rizika nadměrné léčby.
Soubor nemocných a metodika
Cílem naší studie bylo zhodnotit agresivitu mikrokarcinomu velikosti 1–10 mm (T1a) a nízkorizikového karcinomu velikosti 11–20 mm (T1b). Analyzovali jsme klinická a histopatologická data pacientů spolu s hodnocením nejčastějších rizikových faktorů, které mají vliv na recidivu onemocnění: multifokalitu, angioinvazi, přítomnost lokálních metastáz v lymfatických uzlinách či nález vzdálených metastáz v době diagnózy.
Do souboru byli zařazení nemocní s karcinomem štítné žlázy < 20 mm, léčení na Klinice nukleární medicíny a endokrinologie 2. LF UK a FN Motol v Praze v letech 2003–2012. Všichni pacienti zařazení do našeho souboru absolvovali jako iniciální léčbu totální tyreoidektomii. Pacienti byli dále rozděleni na základě pooperačního histologického nálezu do 4 podskupin podle velikosti primárního nádoru podle TNM klasifikace (7. verze):
- skupina A: T1a nádory rozměru 1–5 mm
- skupina B: T1a nádory rozměru 6–10 mm
- skupina C: T1b nádory rozměru 11–15 mm
- skupina D: T1b nádory rozměru 16–20 mm
U pacientů byla hodnocena klinická a další histopatologická data, fokální nebo multifokální lokalizace tumoru. Za multifokální tumor byl považován tumor v případě průkazu 2 a více ložisek v jednom nebo v obou lalocích štítné žlázy. Pro zařazení do podskupiny podle velikosti bylo hodnoceno největší ložisko tumoru. Dále byla hodnocena angioinvaze a detekce uzlinových metastáz.
U všech pacientů bylo provedeno pooperační sonografické vyšetření se zaměřením na posouzení velikosti zbytkové tyreoidální tkáně v lůžku žlázy, popřípadě přítomnosti lokálního uzlinového metastatického syndromu.
Indikace k léčbě radiojodem
K iniciální tyreoablační léčbě radiojodem byli zařazeni pacienti s nálezem multifokality v obou lalocích štítné žlázy, nálezem uzlinových metastáz, přítomných na krku či vzdálených metastáz.
Naopak k léčbě radiojodem nebyli indikováni pacienti s unifokálním karcinomem velikosti < 10 mm (T1a), bez známek dalších rizikových znaků histologických subtypů: nádory z vysokých buněk, kolumnární karcinom, inzulární, solidní varianta jak dobře, tak hůře diferencovaného karcinomu, folikulární karcinom a karcinom z Hürthleho buněk.
Radiojod nebyl také podán pacientům s multifokálním karcinomem, u nichž byla ložiska < 10 mm a u nichž chyběly výše uvedené rizikové faktory.
Pokud byla indikována tyreoablace radiojodem, byla obvykle provedena do 3–4 měsíců od vstupní diagnózy.
Kontrola úspěšnosti radioablace byla provedena za 9–12 měsíců, a to po 4týdenním vysazení hormonů štítné žlázy nebo po podání rhTSH (2krát 0,9 mg) během hospitalizace. Byla provedena celotělová scintigrafie, sonografické vyšetření krku a stanovení hladin TSH, fT4, tyreoglobulinu a protilátek proti tyreoglobulinu. Jako úspěšná radioablace s navozením remise byl považován negativní scintigrafický nález (chybění akumulace), negativní sonografický nález na krku a hladina tyreoglobulinu < 0,1 µg/l. Následně byli pacienti kontrolováni ambulantně 1krát ročně při supresní léčbě hormony štítné žlázy s provedením sonografie krku a stanovením hladin TSH (pod 0,1 mIU/l), fT4 (do 25 pmol/l), tyreoglobulinu (pod 0,1 µg/l), negativita protilátek proti tyreoglobulinu – nulová hladina.
V případě změny některých z výše uvedených parametrů (vzestup hladiny tyreoglobulinu > 5 µg/l, sonografický či palpační nález lokálního uzlinového syndromu na krku) podstoupili pacienti další vyšetření, včetně případné disekce metastatického uzlinového syndromu či kontrolní hospitalizace po vysazení hormonů s podáním radiojodu.
Výsledky
Do sledovaného souboru bylo zařazeno celkem 1 980 pacientů s nádory T1a a T1b. Jednalo se o 1 675 žen (84,6 %), průměrný věk 45,22 let, a 305 mužů (15,4 %), průměrný věk 50,0 let. Podle iniciální histologie tvořily převážnou část souboru karcinomy papilární (1 868; 94,4 %), menší část pak karcinomy folikulární (112; 5,6 %). Věkové rozdělení souboru pacientů podle pohlaví a podle velikosti primárního nádoru nemocných ukazují grafy 1 a 2.
Graf 1. Věkové složení souboru, dělení podle pohlaví 
Graf 2. Rozdělení souboru pacientů podle pohlaví a velikosti karcinomů 
Skupina A
V souboru 678 sledovaných nemocných s papilárním a folikulárním mikrokarcinomem < 5 mm bylo při histologickém vstupním nálezu zachyceno jedno ložisko (unifokální typ karcinomu) u 566 nemocných, multifokalita byla nalezena u 112 pacientů, ve 24 případech byly prokázány lokální uzlinové metastázy a v 1 případě byl nález plicních vzdálených metastáz.
Skupina B
V této skupině bylo 576 sledovaných pacientů s papilárními a folikulárními mikrokarcinomy velikosti 5–10 mm. Při histologickém vstupním nálezu bylo zachyceno jedno ložisko karcinomu u 434 nemocných, multifokalita u 142 pacientů, v 53 případech lokální uzlinové metastázy a v 1 případě kostní metastázy.
Skupina C
V této skupině bylo 467 sledovaných pacientů s papilárními a folikulárními mikrokarcinomy velikosti 10–15 mm. Při histologickém vstupním nálezu byl zachycen unifokální typ karcinomu u 344 nemocných, multifokalita u 123 pacientů, v 45 případech lokální metastázy a ve 3 případech plicní metastázy.
Skupina D
V této skupině bylo 259 sledovaných pacientů s karcinomem velikosti 16–20 mm. Při vstupním nálezu bylo zachyceno jedno ložisko karcinomu u 188 nemocných, multifokalita u 71 pacientů, v 24 případech byly prokázány lokální metastázy a u 2 pacientů byl nález vzdálených plicních metastáz.
Přehled uvádí tab. 1.
Tab. 1. Charakteristika jednotlivých skupin pacientů, dělení podle velikostí nádorů 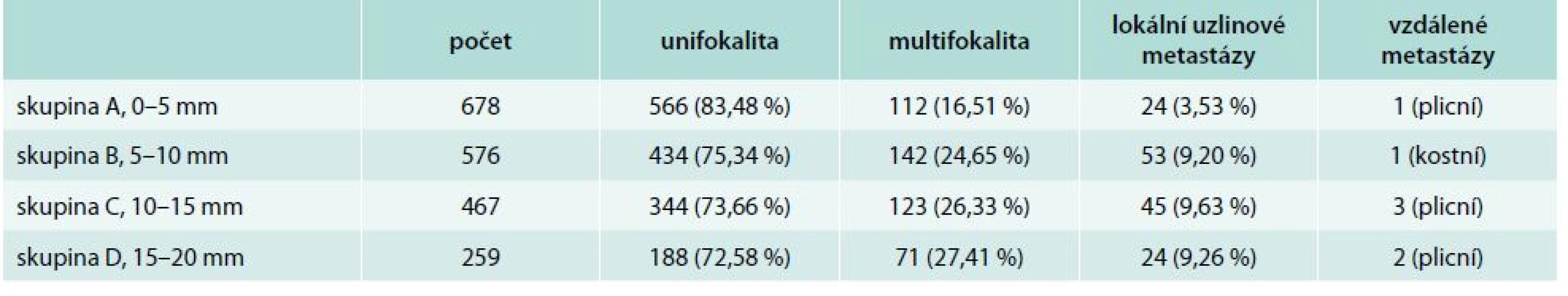
Hodnocení rizika ve všech skupinách pacientů (skupiny A až D)
Při zhodnocení rizikových faktorů jsme v celém souboru pacientů nalezli u 1 451 (73,28 %) pacientů pouze 1 ložisko karcinomu bez současné přítomnosti dalšího rizikového faktoru. Multifokalita bez dalších rizikových faktorů byla nalezena u 365 (18,43 %) pacientů. Unifokální ložisko karcinomu společně s nálezem uzlinových metastáz bylo prokázáno u 97 (4,89 %) nemocných. V 7 případech (0,35 %) byly současně s unifokálním ložiskem karcinomu prokázány vzdálené metastázy. U 60 (3,03 %) pacientů jsme kromě jednoho ložiska karcinomu nalezli více rizikových faktorů současně.
Iniciální riziko u nízkorizikové skupiny pacientů s papilárním a folikulárním karcinomem štítné žlázy ukazuje graf 3.
Graf 3. Iniciální rizika u celého sledovaného souboru 
Rozložení rizikových faktorů podle pohlaví pacientů
Jedno ložisko (unifokalita) bylo nalezeno u 200 (65,55 %) mužů a 1 251 (74,68 %) žen, více ložisek (multifokalita) u 52 (17,04 %) mužů a 313 (18,68 %) žen. Nález jednoho ložiska současně s uzlinovým syndromem u 32 (10,49 %) mužů a 65 (3,88 %) žen. Vzdálené metastázy byly pozorovány u 1 muže (0,33 %) a 6 žen (0,36 %). Více rizikových faktorů bylo zachyceno u 21 (6,88 %) mužů a 39 (2,32 %) žen (tab. 2).
Tab. 2. Iniciální riziko – rozdělení podle pohlaví 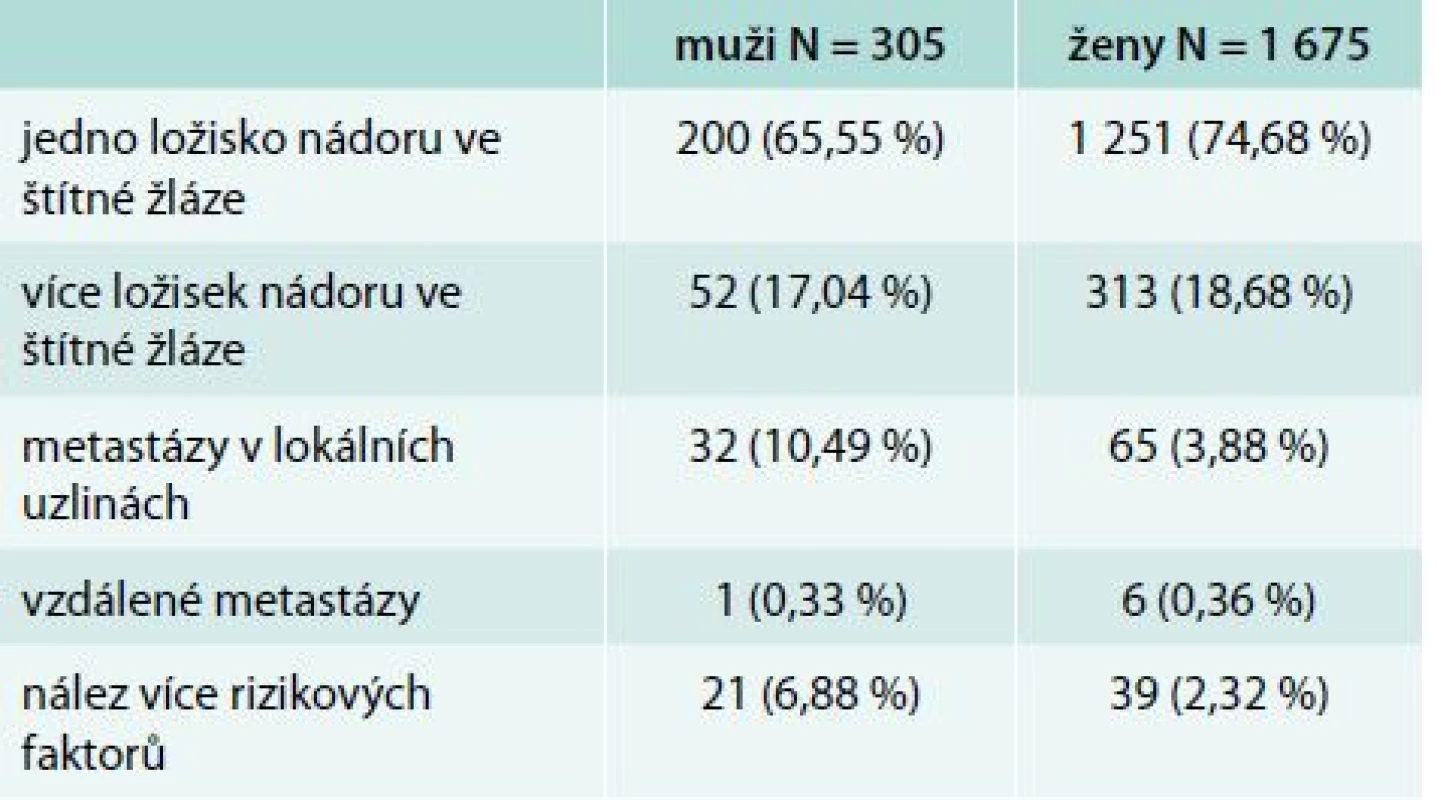
Léčebný postup – léčba radiojodem
Pacienti s jedním ložiskem nádoru. Pacientům bez přítomnosti rizikových faktorů pouze s jedním ložiskem nádoru nebyl radiojod podán. Jednalo se o 1 058 pacientů (53,43 %). Pokud byla při operačním nálezu prokázána těsná blízkost tumoru k okraji resekčního řezu nebo byla velikost nádoru nad 15 mm, byl radiojod podán. Jednalo se o 393 pacientům (19,84 %).
Pacienti s více ložisky nádoru. U 221 (11,16 %) pacientů v této skupině byla jako iniciální léčba po operaci indikována tyreoablace radiojodem V případě multifokálního nálezu byl volen konzervativní přístup k léčbě a nebyl aplikován radiojod pacientům, u kterých součet všech ložisek tumoru nepřekročil 15 mm a největší z ložisek bylo < 10 mm. Jednalo se o 144 pacientů (7,17 %).
Pacienti s metastázami v lymfatických uzlinách a vzdálenými metastázami. Při vstupním nálezu metastáz v lymfatických uzlinách nebo se vzdálenými metastázami, nebyl radiojod podán pouze ve 14 případech (0,70 %), v nichž velikost primárního karcinomu nepřekročila 5 mm a při ambulantním pooperačním sonografickém vyšetření nebyly nalezeny zvětšené uzliny, které by svědčily pro lokální recidivu. V ostatních 150 případech (7,57 %) byl u pacientů s metastázami radiojod podán.
Volba léčebného postupu v závislosti na velikosti nádoru je zobrazena v grafu 4.
Graf 4. Volba léčebné strategie podle velikosti nádoru 
Hodnocení úspěšnosti zvolené léčby
Úspěšnost námi zvolené léčebné strategie jsme hodnotili podle iniciálního stadia nemoci. K relapsu nemoci došlo v průběhu našeho sledování u 123 pacientů (6,2 %), 37 mužů a 86 žen, naopak bez známek onemocnění zůstalo 1 857 pacientů (93,8 %), 268 mužů a 1 589 žen. Při konzervativnějším přístupu, při němž jsme nepodávali radiojod, došlo k relapsu u 49 pacientů z 1 236 sledovaných (3,96 %). V případech, v nichž byl radiojod indikován pro přítomnost rizikových faktorů, došlo k relapsu u 74 ze 744 (9,94 %) takto léčených pacientů. U mužů dochází k relapsu častěji (p < 0,001), tab. 3.
Tab. 3. Výsledky léčby podle typu léčebné strategie 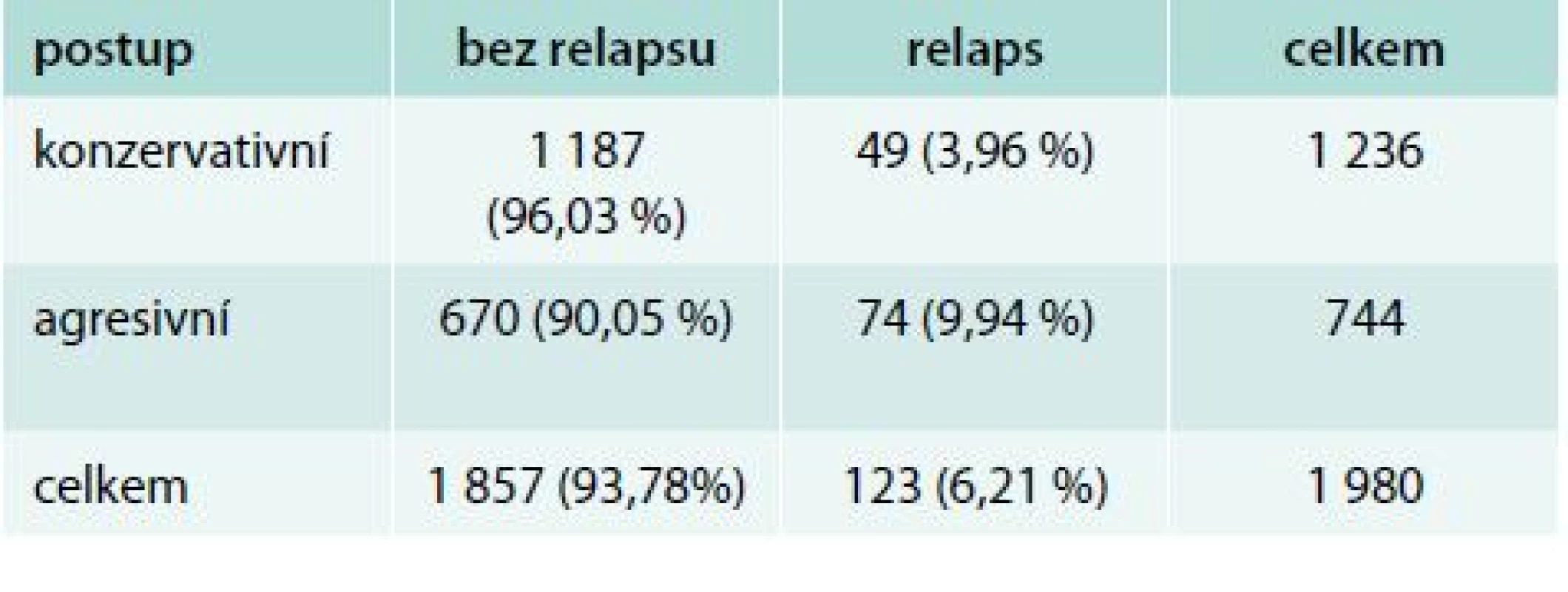
Podle histologického typu došlo k relapsu téměř výhradně u nemocných s papilárním karcinomem štítné žlázy – 124 pacientů (6,64 %). V případě folikulárního karcinomu došlo k relapsu u jednoho pacienta (0,89 %). Ve skupinách 1–5 mm, 6–10 mm, 11–15 mm stoupal s velikostí karcinomu podíl relapsů u papilárního karcinomu; ve skupině 16–20 mm se pak podíl relapsů od skupiny 11–15 mm neliší (tab. 4).
Tab. 4. Výsledky léčby podle velikosti a histologického typu nádoru 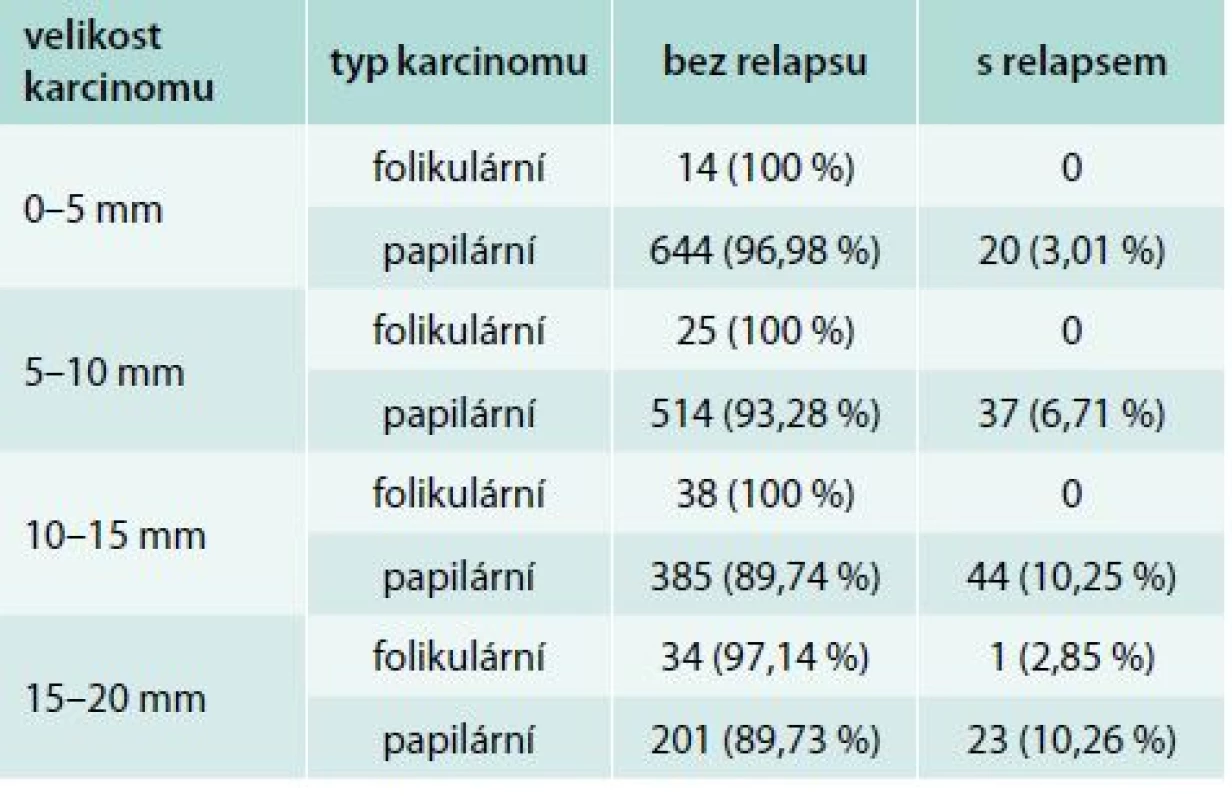
Ve skupině 960 nemocných s unifokálním karcinomem, u nichž nebyl pro chybění rizikových faktorů indikován radiojod, jsme zaznamenali relaps u 14 pacientů (1,45 %). V případě multifokality došlo k relapsu také u 14 z 207 (6,76 %) pacientů. Statisticky významný je větší podíl relapsů (p < 0,001) u multifokálních mikrokarcinomů s velikostí 0–10 mm. Unifokální a multifokální karcinomy o velikosti 10–20 mm relabují přibližně stejně (tab. 5).
Tab. 5. Multifokální vs unifokální karcinomy bez rizikových faktorů 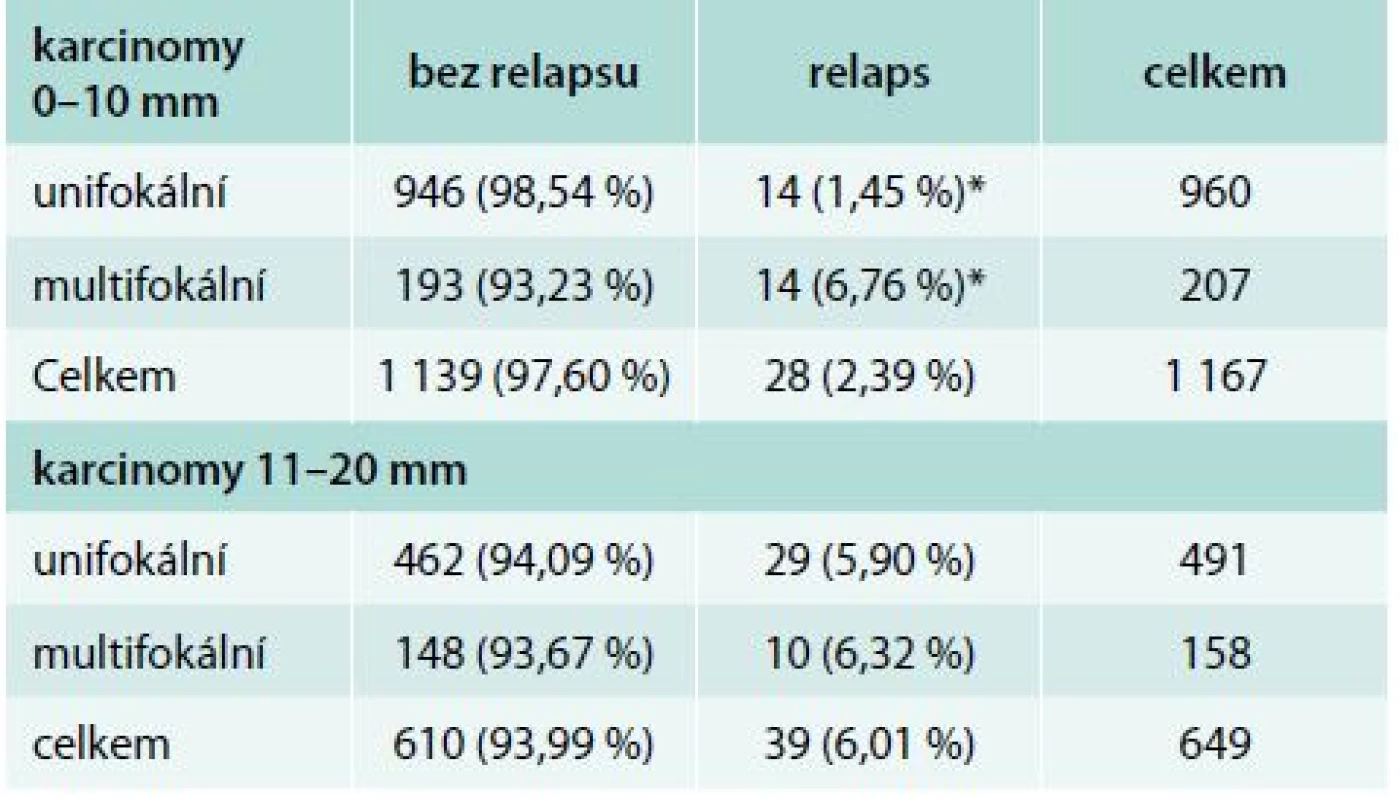
*p < 0,001 Při nálezu uzlinových metastáz, ve srovnání se skupinou unifokálního karcinomu bez dalších rizikových faktorů, bylo bez relapsu celkem 1 473 pacientů. K relapsu došlo u 43 n
emocných s unifokálním ložiskem bez uzlinového syndromu. K přetrvávání akumulace radiojodu v oblasti mimo lůžko žlázy na krku došlo u 33 sledovaných pacientů, kterým byl podán radiojod pro nález uzlinového syndromu. V celém souboru i ve všech podskupinách podle velikosti relabují pacienti s postižením uzlin častěji (p < 0,001), tab. 6.
Tab. 6. Unifokální karcinomy vs uzlinové metastázy bez dalších rizikových faktorů 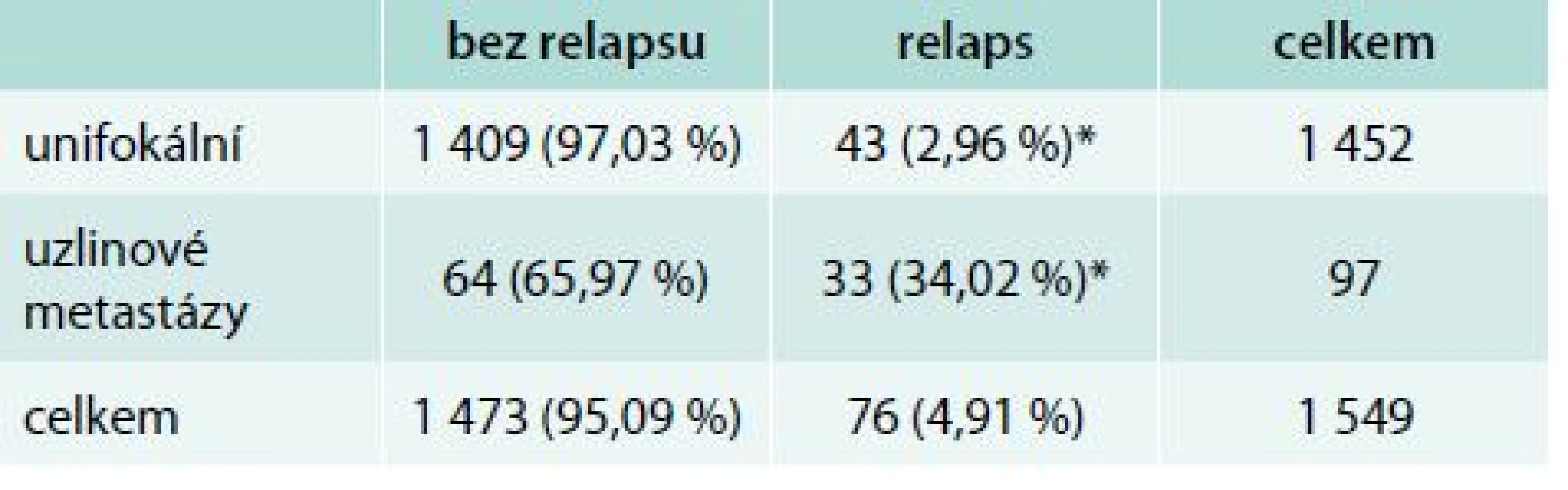
*p < 0,001 V případech, v nichž jsme se na počátku našeho indikačního algoritmu rozhodli nepodat radiojod, došlo k relapsu pouze u 7 ze 532 nemocných s velikostí tumoru < 5 mm, v 7 z 364 sledovaných ve skupině velikosti tumoru 6–10 mm, v 7 ze 114 ve skupině 11–15 mm a u 3 ze 24 pacientů ve skupině velikosti 16–20 mm (tab. 7).
Tab. 7. Úspěšnost zvolené strategie u unifokálních karcinomů bez výskytu dalších rizikových faktorů, podle velikosti nádoru 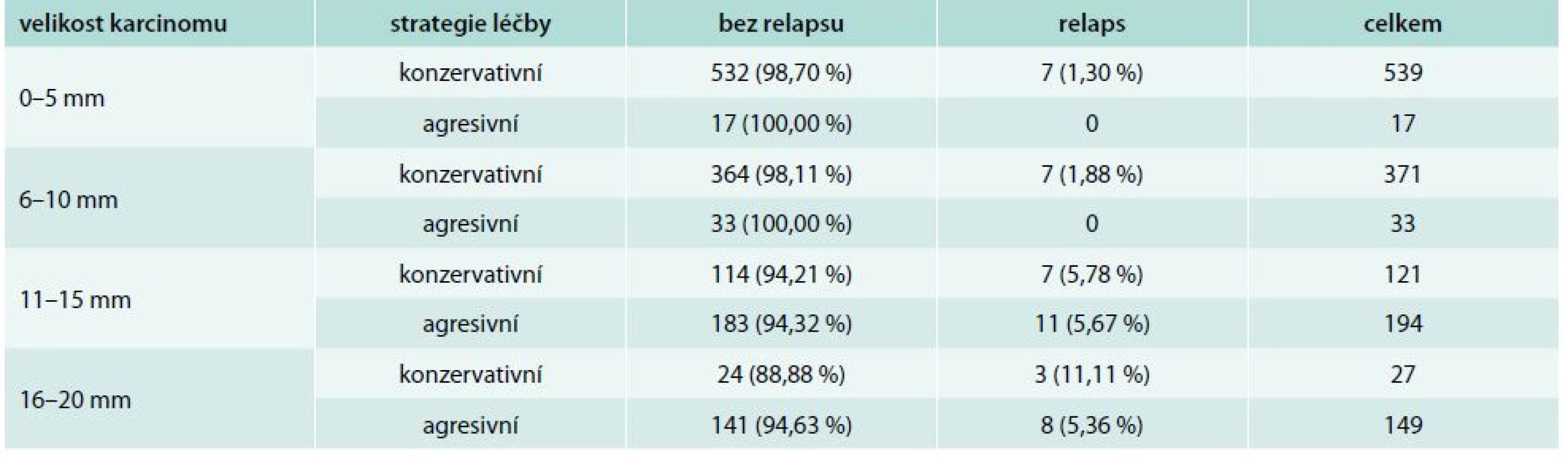
Diskuse
Podle současných doporučení lze rozdělit nemocné s karcinomem štítné žlázy, vhodné k léčbě radiojodem, do 3 skupin dle závažnosti onemocnění [4,18].
Do skupiny nemocných s velmi nízkým rizikem patří pacienti s unifokálním mikrokarcinomem T1a, který se nešíří mimo pouzdro štítné žlázy a nemetastazuje do lymfatických uzlin. U této skupiny není indikováno doléčení radiojodem ani jiná onkologická léčba. Nález mikrokarcinomu bývá obvykle náhodným nálezem během operace štítné žlázy pro jiné benigní onemocnění (struma, cytologicky benigní uzel a podobně).
Do skupiny s vysokým rizikem jsou zařazeni pacienti, u nichž histologický nález prokazuje nádorový uzel > 4 cm, u nichž byl nález metastáz do spádových lymfatických uzlin, popřípadě pokud byly již založeny vzdálené metastázy. U těchto nemocných je indikováno podávání radiojodu o vysoké aktivitě (3,7–7,4 GBq) s častou nezbytností jeho opakovaného podávání. Tato skupina nemocných je velmi riziková jak pro nebezpečí častějších recidiv nádorového procesu, tak pro riziko perzistence nemoci.
Skupina s nízkým rizikem pak zahrnuje všechny ostatní pacienty. Obecně je volen intenzivnější způsob léčby – podání radiojodu, ale v situacích, v nichž chybí rizikové faktory, popřípadě histologický nález nesvědčí pro větší rozsah postižení, může být v individuálních případech od doléčení radiojodem upuštěno.
V některých publikacích, zejména amerických autorů, je považován za zcela dostačující jednostranný chirurgický výkon na štítné žláze, bez nutnosti rozšíření výkonu do totální tyreoidektomie (TTE) a léčebná opatření se omezují pouze na ambulantní sledování s monitorováním hladin tyreoglobulinu a pravidelnými sonografickými kontrolami krku.
Ito et al sledovali pacienty s PTMC, u kterých nebyl proveden chirurgický výkon [10]. Pacienti v úvodní části studie dostali pouze hormonální supresi a měli provedeny odběry krve na stanovení tyreoglobulinu a 2krát ročně sonografické vyšetření. Růstová progrese nádoru byla definována jako zvětšení nádoru > 3 mm. Průměrná doba sledování pacientů byla 74 měsíců. U 31 pacientů (9,1 %) došlo k růstu primárního nádoru, u 7 pacientů (2,1 %) došlo k rozvoji metastáz do lymfatických uzlin. V následné studii, kdy byli pacienti rozděleni podle věku (< 40, 40–59 a > 60 let), pouze mladší věk byl nezávislým prediktorem progrese PTMC. Autoři doporučují pouhé sledování starších pacientů bez nutnosti další léčby [10]. V jiné práci byl hodnocen soubor 900 pacientů s PTMC s průměrnou dobou sledování 17 let. Z 892 pacientů, kteří podstoupili operaci, prokázali recidivu u 6 % pacientů za 30leté období sledování a u 8 % pacientů po 40tiletém sledování. Většina recidiv (> 80 %) byla lokalizována na téže straně krku, kde byl původní nádor. Rozsáhlejší chirurgické výkony a podání tyreoablační dávky radiojodu neměly zásadnější vliv na rozvoj recidiv, ke kterým došlo pouze u 0,8 % pacientů s intratyreoidálním postižením a bez nálezu uzlinových metastáz. Na základě tohoto zjištění autoři poukazují na to, že většina pacientů s PTMC má vynikající prognózu a rozsáhlejší léčebná opatření, ve smyslu radikální chirurgie a podání radiojodu, nezlepšují přežití a jsou nadbytečná [8]. K podobnému závěru dochází Wang et al [25], který zjistil, že pacienti se solitárním PTMC, kteří podstoupili operaci bez dalšího podávání radiojodu, měli přežití podobné, jaké dosahuje běžná populace v USA.
Čas od času se však objevují zprávy o potencionální agresivitě PMTC a je doporučován radikálnější léčebný postup [23,27]. V práci Malandrino et al [14] srovnávali epidemiologické charakteristiky PTMC během 5letého období, čerpali ze Sicilského registru pro rakovinu štítné žlázy (SRRTC) a v americké databázi SEER (Surveillance, Epidemiology and End Results). Zjistili, že incidence karcinomu a zvláště pak mikrokarcinomů štítné žlázy v jednotlivých věkových skupinách byla větší na Sicílii (PTMC 5,8 na 100 000 obyvatel, 52,7 % všech tyreoidálních karcinomů) než v USA (2,9 na 100 000 obyvatel, 32,5 % všech TC). Za tímto rozdílem může stát etnický původ nebo enviromentální faktory (SRRTC zahrnuje i provincii Katánie, vulkanickou oblast s nejvyšší incidencí tyreoidálních karcinomů přepočteno na věk). Jako nejpravděpodobnější vysvětlení však může být častější diagnostikování subklinických uzlů na Sicílii než v USA. Itálie patří mezi země s mírným jodovým deficitem a screening štítné žlázy je v éře ultrazvuku prováděn po celé zemi včetně Sicílie, kde ordinuje několik týmů spádových endokrinologů. Tato situace je obdobná i v České republice, kde je endokrinolog schopen samostatně provádět sonografické vyšetření a má možnost i sám provést cílenou aspiraci tenkou jehlou pro biopsii. V obou jmenovaných registrech byly nalezeny u více než 35 % pacientů s PTMC dva nebo více rizikových faktorů pro recidivu (42 % v SEER a 37,8 % v SRRTC). Podle Malandrina [15] mohou tito pacienti vyžadovat podobný rozsah chirurgického výkonu a následného sledování jako pacienti s většími nádory. Malandrino jako rizikové faktory uvádí metastatické uzliny a extra tyreoidální extenzi, avšak pouze jako rizikové faktory pro recidivu, nikoliv pro mortalitu. Autoři nemají ve svých souborech data z dispenzarizace. Definice rizikových faktorů je proto extrapolována z jiných souborů. Yu et al [28] analyzovali stejnou databázi SEER z let 1988–2007 a hodnotili přežití (99,5 % a 99,3 %) za 10, resp. 15 let. Rizikové faktory spojené s nízkou úmrtností (0,5 %) byly věk nad 45 let, mužské pohlaví, afroamerický nebo minoritní etnický původ, metastázy do lymfatických uzlin, extratyreoidální invaze a vzdálené metastázy.
Jiná práce se zaměřuje na rizikové faktory pro recidivu onemocnění. Během 47letého sledování bylo zaznamenáno pouze 68 recidiv (4 %). Metastázy v lymfatických uzlinách v době diagnózy (P = 0,0001), multifokalita (P = 0,05) a mužské pohlaví (P = 0,01) byly signifikantně asociovány s recidivou. Velikost samotného nádoru nehrála významnou úlohu [2].
Mercante et al v souboru 445 pacientů s PTMC sledovali v mediánu 5,3 let 445 pacientů po totální tyreoidektomii, 389 pak podstoupilo radioablaci radiojodem. Rizikové faktory jako multifokalita byly nalezeny u 35 % a metastázy do spádových lymfatických uzlin u 41 % pacientů. Recidiva na krku a vzdálené metastázy byly prokázány u 3–8 % pacientů, signifikantně nezávislými faktory pak byly kapsulární invaze, metastázy do lymfatických uzlin a extratyreoidální šíření [17].
Jiná retrospektivní studie analyzovala terapii a průběh onemocnění u 407 pacientů s PTMC. Ke klinickým a histopatologickým charakteristikám, které předpovídaly recidivu onemocnění, náležela větší velikost nádoru, postižení krčních lymfatických uzlin a chybění léčby radiojodem. Těmto nemocným, zejména s nálezem metastatických lymfatických uzlin, je doporučeno provedení totální tyreoidektomie s následnou radioablací radiojodem [6].
Smyslem totální či téměř totální tyreoidektomie jako metody volby u pacientů s PTMC je minimalizovat možnost multifokálního postižení, a tak snížení recidivy onemocnění. Pokud je naplánována léčba radiojodem, není zapotřebí provádět preventivní lymfadenektomie u palpačně nehmatných uzlin [7].
Jiné autority považují využití rizikových faktorů pro stratifikaci rizika za užitečné u pokročilejších karcinomů, ale nepřikládají jim větší význam u léčby mikrokarcinomů štítné žlázy [18]. Opírají se i o studii, která po mnoho let prospektivně sledovala velkou skupinu pacientů s mikrokarcinomy bez jakékoliv intervence a jejíž výsledky prokazují, že přirozený průběh mikrokarcinomů štítné žlázy je benigní, navzdory přítomnosti rizikových faktorů, včetně metastáz v lymfatických uzlinách, které byly i v tomto souboru přítomné, ale nebyly spojeny s horší prognózou [11].
Z výše uvedených citací je zřejmé, že v otázce nízkorizikových karcinomů, v současné době nejčastější tyreoidální malignity, se v odborné literatuře vyskytují argumenty podporující jak konzervativní, tak i agresivnější strategii léčby. Studie poukazují na to, že u PMTC nejsou zcela bezvýznamná rizika při nálezu uzlinových metastáz pro přetrvávání či recidivu nemoci. Je však skutečností, že míra recidiv je natolik nízká (2–4 %), že jakýkoliv významnější rozdíl může být ovlivněn samotným charakterem retrospektivní studie. V prospektivní studii za účelem identifikace prognostických faktorů pro recidivu PTMC by byla doba pro sledování velmi dlouhá a počet pacientů, nezbytný k detekci statisticky významných rozdílů, by musel být značně vysoký.
Naše zjištění naznačují, že nálezy rizikových faktorů u nízkorizikových mikrokarcinomů nejsou tak řídké a že je nezbytné pečlivě stratifikovat rizika nemoci po provedené totální tyreoidektomii i v této skupině nemocných. Méně radikální chirurgický výkon než totální tyreoidektomie není vhodný při předoperačním cytologickém podezření z karcinomu a provedení totální tyreoidektomie je vhodnější i u karcinomů nad 10 mm, protože po jednostranném výkonu nemáme možnost správně a úplně nemocného stratifikovat (neznáme histologii z druhého laloku, nemožnost dalšího sledování pomocí tyreoglobulinu). Je pravda, že stoupá počet pacientů s PTMC, kteří podstupují TTE a léčbu radiojodem i přes nedostatek důkazů, že by rozsáhlejší výkony měly vliv na lepší přežití. Na druhou stranu je jistě velmi obtížné přesvědčit pacienta s nálezem karcinomu štítné žlázy, že následné doléčení radiojodem, v jeho konkrétním případě, zásadnějším způsobem neovlivní dobu jeho přežití. Zdá se, že radiojodová tyreoablace skutečně nemusí být plošně podávána všem nemocným s karcinomem velikosti nad 10 mm, jak tomu bylo zvykem, ale zároveň potvrzujeme trend, že s velikostí primárního tumoru stoupá podíl relapsů. Nelze tak akceptovat názor, že je radiojod u nízkorizikových karcinomů zbytečný a pacienty pouze nadměrně zatěžuje. V našem souboru k relapsu nemoci došlo u 123 pacientů (6,2 %), naopak bez známek onemocnění zůstalo 1 857 pacientů (93,8 %). U mužů docházelo k relapsu častěji než u žen (p < 0,001), takže v případě mužských pacientů by měla být zvýšená obezřetnost na místě. S velikostí tumoru dochází bez léčby radiojodem k častějším recidivám. Podle histologického typu relabovali téměř výhradně nemocní s papilárním karcinomem štítné žlázy (114), pouze jeden pacient s folikulárním karcinomem. Ve skupinách 1–5 mm, 6–10 mm a 11–15 mm stoupal s velikostí karcinomu podíl relapsů u papilárního karcinomu; ve skupině 16–20 mm se pak podíl relapsů od skupiny 11–15 mm neliší. Statisticky významný byl větší podíl relapsů (p < 0,001) u multifokálních mikrokarcinomů s velikostí 0–10 mm. Pacienti s nálezem unifokálních a multifokálních karcinomů o velikosti 11–20 mm relabovali přibližně stejně. V celém souboru i ve všech podskupinách podle velikosti relabovali pacienti s postižením uzlin výrazně častěji (p < 0,001). V případech, u nichž byly přítomny rizikové faktory a u nichž došlo k podání radiojodu, došlo i k častějším relapsům (p < 0,001). Tito pacienti jsou klinicky závažnější, z léčby radiojodem mají prospěch, neboť lze předpokládat, že by bez iniciální léčby radiojodem relabovali častěji. V případě vynechání léčby radiojodem u nemocných s nízkorizikovým karcinomem bez potvrzení rizikových faktorů, je nezbytné i tyto pacienty vést v dispenzárním programu a pravidelně je vyšetřovat klinicky, laboratorně a sonograficky. Je důležité rozlišovat pacienty s rizikovými faktory, které se mohou podílet na recidivě onemocnění. Jen tak zabráníme tomu, aby na jedné straně docházelo k nadměrné léčbě nemocných s nízkorizikovým karcinomem štítné žlázy a ke zvyšování vynaložených nákladů na zdravotní péči a aby na druhé straně nedošlo ke snížení úrovně péče provázené nárůstem relapsů. Je proto důležité o této problematice hovořit nejen s endokrinology, ale nabídnout ji k diskusi i odborníkům jiných specializací.
Tato práce byla podpořena grantem IGA MZ ČR NT/11455–5.
Doručeno do redakce 2. 2. 2015
Přijato po recenzi 22. 4. 2015
prof. MUDr. Petr Vlček, CSc.
petr.vlcek@fnmotol.cz
Klinika nukleární medicíny a endokrinologie 2. LF UK a FN Motol, Praha
www.fnmotol.cz
Zdroje
1. Baker SR, Bhatti WA. The thyroid cancer epidemic: is it the dark side of the CT revolution? Eur J Radiol 2006; 60(1): 67–69.
2. Buffet C, Golmard JL, Hoang C et al. Scoring system for predicting recurrences in patients with papillary thyroid microcarcinoma. Eur Endocrinol. 2012; 167(2): 267–275.
3. Cappelli C, Castellano M, Braga M et al. Aggressiveness and outcome of papillary thyroid carcinoma (PTC) versus microcarcinoma (PMC): a mono-institutional experience. J Surg Oncol 2007; 95(7): 555–560.
4. Cooper DS, Doherty GM, Haugen BR et al. American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009; 19(11): 1167–1214. Erratum in Thyroid 2010; 20(8): 942. Hauger BR [corrected to Haugen BR] Thyroid 2010; 20(6): 674–675.
5. Cappelli C, Castellano M, Braga M. Aggressiveness and outcome of papillary thyroid carcinoma (PTC) versus microcarcinoma (PMC): a mono-institutional experience. J Surg Oncol 2007; 95(7): 555–560.
6. Creach KM, Siegel BA, Nussenbaum B et al. Radioactive iodine therapy decreases recurrence in thyroid papillary microcarcinoma. ISRN Endocrinol 2012; 2012 : 816386. Dostupné z DOI: <http://dx.doi.org/10.5402/2012/816386>.
7. Demeter S, Leslie WD, Levin DP. Radioactive iodine therapy for malignant and benign thyroid disease: a Canadian national survey of physician practice. Nucl Med Commun 2005; 26(7): 613–621.
8. Hay ID, Hutchinson ME, Gonzalez-Losada T et al. Papillary thyroid microcarcinoma: a study of 900 cases observed in a 60-year period. Surgery 2008; 144(6): 980–987.
9. Howlader N, Noone A, Krapcho M et al. SEER Cancer Statistics Review, 1975–2010. National Cancer Institute: Bethesda (MD) 2013. Dostupné z WWW: http://seer.cancer.gov/archive/csr/1975_2010/.
10. Ito Y, Miyauchi A, Inoue H et al. An observational trial for papillary thyroid microcarcinoma in Japanese patients. World J Surg 2010; 34(1): 28–35.
11. Ito Y, Miyauchi A, Kihara M et al. Patient age is significantly related to the progression of papillary microcarcinoma of the thyroid under observation. Thyroid 2014; 24(1): 27–34.
12. Lukas J, Drabek J, Lukas D et al. The epidemiology of thyroid cancer in the Czech Republic in comparison with other countries. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2013; 157(3): 266–275.
13. Macková M, Vlček P. Current trends in treatment and follow-up of patients with differentiated thyroid carcinoma – experience with the use of recombinant human thyrotropin. Vnitř Lék 2013; 59(2): 106–112.
14. Malandrino P, Scollo C, Marturano I et al. Descriptive epidemiology of human thyroid cancer: experience from a regional registry and the “volcanic factor”. Front Endocrinol (Lausanne) 2013; 4 : 65. DOI: <http://dx.doi.org/10.3389/fendo.2013.00065>.
15. Malandrino P, Pellegriti G, Attard M et al. Papillary thyroid microcarcinomas: a comparative study of the characteristics and risk factors at presentation in two cancer registries. J Clin Endocrinol Metab 2013; 98(4): 1427–1434.
16. Mazzaferri EL, Jhiang SM. Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med 1994; 97(5): 418–428. Erratum in Am J Med 1995; 98(2): 215.
17. Mercante G, Frasoldati A, Pedroni C et al. Prognostic factors affecting neck lymph node recurrence and distant metastasis in papillary microcarcinoma of the thyroid: results of a study in 445 patients. Thyroid 2009; 19(7): 707–716.
18. Pacini F, Schlumberger M, Dralle H et al. European Thyroid Cancer Taskforce. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol 2006; 154(6): 787 - 803. Erratum in Eur J Endocrinol. 2006; 155(2): 385.
19. Pacini F. Management of papillary thyroid microcarcinoma: primum non nocere! J Clin Endocrinol Metab 2013; 98(4): 1391–1393.
20. Pellegriti G, Frasca F, Regalbuto C et al. Worldwide increasing incidence of thyroid cancer: update on epidemiology and risk factors. J Cancer Epidemiol 2013; 2013 : 965212. Dostupné z DOI: <http://dx.doi.org/10.1155/2013/965212>.
21. Rahib L, Smith BD, Aizenberg R et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res 2014; 74(11): 2913–2921. Erratum in Cancer Res 2014; 74(14): 400.
22. Ross DS, Litofsky D, Ain KB et al. Recurrence after treatment of micropapillary thyroid cancer. Thyroid 2009; 19(10): 1043–1048.
23. Ross DS, Tuttle RM. Observing micopapillary thyroid cancers. Thyroid 2014; 24(1): 3–6.
24. Sipos JA, Mazzaferri EL. Thyroid cancer epidemiology and prognostic variables. Clin Oncol (R Coll Radiol) 2010; 22(6): 395–404.
25. Wang TS, Goffredo P, Sosa JA et al. Papillary Thyroid Microcarcinoma: An Over-Treated Malignancy? World J Surg 2014; 38(9): 2297–2303.
26. Xu YN, Wang JD. Surgical treatment of incidental and non-incidental papillary thyroid microcarcinoma. G Chir 2010; 31(5): 205 - 209.
27. Yu XM, Wan Y, Sippel RS et al. Should all papillary thyroid microcarcinomas be aggressively treated? An analysis of 18,445 cases. Ann Surg 2011; 254(4): 653–660.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Radiojod u nízkorizikového karcinomu štítné žlázy – editorial
- Cílená léčba chronické myeloidní leukemie u starších pacientů – editorial
- Tyrozinkinázové inhibitory v léčbě starších pacientů s chronickou myeloidní leukemií – editorial
- Chronická žilní onemocnění – nutnost přesnější diferenciace stavů k určení optimálního způsobu léčby – editorial
- Kavální filtry v roce 2015 – komu, kdy a jak? – editorial
- Stravování a kardiovaskulární onemocnění – dialogy a protimluvy – editorial
- Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
- Sekundární humorální imunodeficience u nemocných se systémovým lupus erythematodes
- Má věk nemocných s chronickou myeloidní leukemií při léčbě imatinibem vliv na dosaženou léčebnou odpověď?
- Role metabolického syndromu v gastroenterologii
- Účelnost zavádění kaválních filtrů z pohledu internisty
- Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
- Změny stravovacích návyků ve vztahu k rizikovým faktorům a kardiovaskulární mortalitě
-
Myopatie při Waldenströmově makroglobulinemii.
Popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů typu IgM - František Kopřiva. Chronický kašel. Průvodce ošetřujícího lékaře
- Jan Máca et al. ARDS v klinické praxi
- Rudolf Kotas. Bolesti hlavy v klinické praxi
- Josef Veselka, Vilém Rohn a kolektiv. Kardiovaskulární medicína
- (Ne)očekávané výsledky studie EMPA-REG OUTCOME™
- Poznámka k diferenciální diagnostice hyponatremie
- Acute Leukemias XV, Biology and Treatment Strategies
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
- Účelnost zavádění kaválních filtrů z pohledu internisty
- Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
- Poznámka k diferenciální diagnostice hyponatremie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



