-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
Therapeutic potential of micronized purified flavonoid fraction (MPFF) of diosmin and hesperidin in treatment chronic venous disorder
Chronic venous disorder (CVD) is a common illness with high incidence existing especially in Europe and North America. The main goal of micronized purified flavonoid fraction (MPFF) of diosmin and hesperidin is to eliminate the symptoms of CVD (venous pain, fatigue, etc). But MPFF of diosmin and hesperidin has good effectiveness for treatment of venous oedema and venous ulcer too. There are many papers that prove its effectiveness in the experiment and in the microcirculation too. The other indications for MPFF of diosmin hesperidin is hemorrhoidal disease and the accessory treatment of lymphedema. It is proved that this substance could be used as an effective supplementary treatment of symptoms after venous intervention. Only MPFF diosmin and hesperidin received the best recommendation – 1B in the last guidelines for VAD therapy.
Key words:
chronic venous disorder – micronized purified flavonoid fraction of diosmin and hesperidin
Autoři: Lukáš Hnátek
Působiště autorů: Angiocor, s. r. o., centrum žilních onemocnění, Zlín
Vyšlo v časopise: Vnitř Lék 2015; 61(9): 807-814
Kategorie: Přehledné referáty
Souhrn
Chronická žilní choroba (v originálním anglickém znění chronic venous disorder – CVD) je postižení žilního systému s vysokou incidencí, která se vyskytuje především Evropě a severní Americe. Hlavním cílem mikronizovné purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu je eliminovat symptomy CVD (žilní bolest, tíže v nohou apod). Avšak MPFF diosminu a hesperidinu může být též použita k léčbě žilního otoku a žilního bércového vředu. Existuje mnoho studií, které dokazují jeho efekt v experimentu a též jeho efekt na úrovni mikrocirkulace. Další indikací MPFF diosminu a hesperidinu je hemoroidální choroba a jako doplňková léčba lymfedému. Je též prokázáno, že tato látka může být požita jako vhodná doplňující léčba zákroků na žilním systému. Pouze MPFF diosminu a hesperidinu obdržela nejlepší doporučení – 1B v posledních směrnicích pro léčbu venoaktivními látkami.
Klíčová slova:
chronické žilní onemocnění – mikronizovaná purifikovaná flavonoidní frakce diosminu a hesperidinuÚvod
Mikronizovné purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu řadíme mezi tzv. venoaktivní látky (venoactive drugs – VAD). Tyto substance tvoří poměrně velkou skupinu, která se používá v rámci algoritmu léčby chronické žilní choroby. V originálním anglickém znění se chronická žilní choroba označuje jako chronic venous disorder – CVD. Slovo disorder se mělo překládat jako choroba, či spíše jako postižení, protože ve své podstatě se jedná o výraz poměrně obecný a nemělo by být zaměňováno za slovo onemocnění, protože to by v originále odpovídalo výrazu disease, což však není synonymum pro výraz disorder. Tato přesná definice je přesně ukotvena v rámci CEAP klasifikace z roku 2004.
Léčba CVD má v našich zeměpisných šířkách poměrně bohatou historii. V písemnictví jsou doloženy terapeutické postupy její léčby již z dob antiky. O rozšíření tohoto onemocnění nás informují mnohé epidemiologické studie. V posledních desetiletích byla provedena celá řada těchto studií, jejichž výsledky se různily dle parametrů hodnotící stav CVD a dle lokality, v níž byly prováděny. Prevalence varikozit je prezentována od 1–73 % ženské populace a od 2–56 % mužské populace. Dle Framinghamské studie z roku 1988 je udávána incidence varikozit za rok 2,6 % u žen a 1,9 % u mužů. Prevalence kožních změn dle jednotlivých studií se pohybuje v intervalu 3–13 %, a prevalence bércového vředu, aktivního i uzavřeného, v rozmezí 1–2,7 % vyšetřované populace. Za rizikové faktory byly považovány vyšší věk, pozitivní rodinná anamnéza, ženské pohlaví, opakovaná těhotenství, profese vykonávaná ve stoje a obezita, především u žen [1]. Co se týče České republiky, nejnovější údaje o prevalenci CVD poskytl Czech Vein Program z roku 2012 (1 562 pacientů), projekt mapující epidemiologickou situaci na úrovni primární péče a navazující na celosvětově probíhající Project Vein Consult Program (22 zemí, 91 545 pacientů). Průzkum potvrdil vysokou prevalenci chronického žilního onemocnění u české populace: 8 z 10 pacientů vykazuje subjektivní symptomy a 6 z 10 pacientů dokonce objektivní známky onemocnění. Diagnóza CVD byla potvrzena u 70 % pacientů praktických lékařů ve věku nad 40 let. Přesto celých 25 % těchto pacientů zůstává neléčených, protože diagnóza CVD – i přesto, že si pacienti stěžují na obtíže – není stanovena [2].
Dělení CVD dle etiologie
Abychom správně pochopili cíle léčby CVD, je vhodné si uvědomit podstatu daného problému. V zásadě je nutno CVD chápat jako proces, který nelze kompletně odstranit. Z principů etiologie tohoto chorobného procesu pak vychází dělení a následná terapie CVD. Současný pohled na etiologii CVD je definován v rámci CEAP klasifikace, respektive v její podobě z roku 2004, která byla vytvořena pod koordinací prof. Bo Eklöfa [3]. CEAP klasifikace je v současné době nejkomplexnějším klasifikačním systémem, který zohledňuje klinický nález (C), etiologii (E), anatomické poměry (A) a patologii (P). Vedle této klasifikace byla v minulosti vytvořena celá řada klasifikačních systémů, avšak tyto již nejsou v současnosti moc používány. Za zmínku lze jen upozornit na REVAS (Recurent Varices After Surgery), resp. REVAT (Recurent Varices After Treatement) klasifikaci, která hodnotí recidivu varikozit po proběhlé intervenční léčbě.
CEAP klasifikace dělí etiologii na kongenitální, primární a sekundární.
Kongenitální etiologie je poměrně jasná a definovaná konkrétními vrozenými malformacemi cévního systému. Vedle toho primární a sekundární etiologie je diametrálně rozdílná především v procesu, který k insuficienci vede. Zatímco v klinických projevech se rozdíly velmi stírají. Bauer ve své studii z roku 1948 [4] s využitím venografie prokázal, že většina pokročilých stadií je důsledkem primární insuficience.
Primární žilní insuficience
Primární žilní insuficience (primary venous insufficiency – PVI) je degenerativním procesem žilní stěny a žilních chlopní. Obvykle začíná jako mírný reflux v povrchových žilách dolních končetin [5]. V počáteční fázi si žilní stěna i chlopně ponechávají své základní prvky. Strukturální změny se nejprve projevují na povrchněji lokalizovaných žilách a na perforátorech. Primární žilní insuficience je častěji pozorována tam, kde je jediným patofyziologickým elementem reflux. Tato forma je v populaci velmi široce rozšířena a její prevalence je významně vyšší ve srovnání s posttrombotickými změnami. Proces primární žilní insuficience se nejprve projevuje v rámci povrchového žilního systému, postupně pak na perforátorech. Ve vyšších stadiích se žilní insuficience projevuje i v rámci hlubokého žilního systému. Pouze 10 % populace má při PVI postižený hluboký žilní systém při klinickém stadiu C1–2 [6], zatímco až 70 % populace má insuficienci hlubokého žilního systému při klinickém stadiu C6 [7]. Srovnáme-li prevalenci primární a sekundární CVI, převažuje jednoznačně PVI, a to více než v 80 %. Mírnějšími projevy trpí asi 20 % dospělé populace, z toho 50 % připadá na věkovou kategorii mezi 50–70 roky. C4–6 stadiem PVI trpí 20 % převážně starší populace. V případě terapie PVI je v Evropě populární konzervativní terapie spočívající v kompresní terapii a v podávání venoaktivních látek. Toto však není doporučováno v USA. Z mnoha studií vyplývá, že v případě PVI je vhodné provedení eliminace postižených částí žilního systému v rámci epifasciálního, interfasciálního žilního systému a systému perforátoů v časných stadiích CVD, což snižuje riziko postižení hlubokého žilního systému ve vyšších stadiích PVI, a to až v 70–90 % v rámci dlouhodobých výsledků [8–10].
Sekundární žilní insuficience
Sekundární žilní insuficience (secondary venous insufficiency – SVI) je kontrastem primární. Jedná se o získanou zánětlivou chorobu, která začíná jako čistě obstrukční postižení řečiště hlubokého žilního systému. Daný stav se pak vyvíjí jako kombinace obstrukce a refluxu v rámci hlubokého žilního systému. Trombus vede k destrukci endoteliální výstelky a destrukci chlopní v žíle. V průběhu 6–12 měsíců obstrukční proces podlehne postupné přestavbě, velmi často se v lumen cévy vytvářejí sekundární lakunární lumina a dochází ke kolateralizaci oběhu. Tímto vývojem dochází ke vzniku kombinace parciální obstrukce a refluxu, přičemž celý stav nese riziko recidivy kompletní obstrukce. V případě perzistující obstrukce v. femoralis (VF), nebo spíše v. femoralis communis (VFC) nebo až v. iliaca externa (VIE) může povodí velké safény (VSM) působit jako kolaterála. Za této situace je pak nutno VSM ponechat a její eliminace je tedy kontraindikována. Takováto situace je významně náchylnější k rychlé progresi klinického nálezu. Pokud je před obstrukcí hlubokého žilního systému již přítomna insuficience povodí safény, je o to celý průběh změn akcelerován a může mít velmi závažné následky. Primárním terapeutickým úkonem musí být snaha o co nejlepší rekanalizaci hlubokého žilního systému. V případě proximální hluboké žilní trombózy je plně indikována lokální trombolýza, pokud není jiné riziko krvácení u pacienta. Za situace, v níž je kombinace obstrukce proximálního výtoku a distálního refluxu, vede celý proces k vážným až kritickým klinickým projevům. V situaci obstrukce hlubokého žilního systému je plně indikována medikamentózní antikoagulační terapie a kompresní terapie. Antikoagulační terapie se řídí ACCP guidelines (American College of Chest Physicians – ACCP). Z chirurgických zákroků jsou indikovány revaskularizační postupy, valvuloplastiky, přičemž v případě revaskularizačních zákroků je v současnosti metodou volby angioplastika se stentingem. Nejsou-li chlopně zcela destruovány trombotickým procesem, bývají valvuloplastiky velmi úspěšné. Pokud je intraluminální nebo extraluminální valvuloplastika nemožná, je možnost případné autologní transplantační valvuloplastiky – např. transplantace axilární žíly. Takto je popsána a definována etiologie SVI v rámci CEAP klasifikace i v doporučeních odborné společnosti American Venous Forum [11].
Obecně je léčba chronického žilního onemocnění poměrně komplexní. V základě ji lze rozdělit na konzervativní a intervenční. Základem konzervativní terapie CVD je kompresní terapie a terapie venoaktivními látkami. Vedle těchto 2 léčebných postupů lze do této kategorie zařadit i režimová opatření (dostatek pohybové aktivity, elevace končetin, sprchování chladnou vodou, redukce hmotnosti, žilní gymnastika), která s tímto chorobným procesem souvisí. V případě primární žilní nedostatečnosti je klíčová intervenční léčba, která kauzálně eliminuje reflux. Tuto dnes dělíme na klasické operace na žilním systému (crossektomie, flebektomie, stripping, SEPS) a endovaskulární postupy. Ty se dělí na chemické ablace, termoablace, implantační techniky a kombinované endovaskulární postupy. Cílem tohoto článku je zaměřit se na venoaktivní látky, respektive na venofarmaka, která dle současných doporučení mají nejsilnější doporučení v mezinárodních guidelines. Tato práce si klade za cíl prezentovat komplexní uplatnění této substance v jednotlivých indikacích. Z tohoto důvodu zde nebudeme více rozebírat aspekty týkající se CVD v širším kontextu.
Venofarmakologická léčba CVD
Veškerá stadia mají společný základ terapie. Do něj zahrnujeme kompresní terapii a terapii venoaktivními látkami (venoactive drugs – VADs). Postavení VADs bývalo dříve zpochybňováno, avšak dnes již existuje celá řada studií splňujících kritéria medicíny založené na důkazech (Evidence Based Medicine studies – EBM), které dokazují jejich nenahraditelné postavení v rámci algoritmu terapie CVD.
Venoaktivní farmaka tvoří heterogenní skupinu léčiv, která jsou přírodního nebo syntetického původu. Svým působením ovlivňují otoky a symptomy spojené s CVD ve všech stadiích onemocnění.
Jejich hlavním významem je antiedematózní efekt, zvýšení žilního tonu a inhibice různých spouštěcích faktorů vyšších stadií CVD. Posledně jmenovaný účinek představuje inhibici adheze leukocytů na žilní stěnu a stěnu chlopní, inhibici uvolnění mediátorů zánětu a syntézu prostaglandinů a zlepšení fibrinolýzy a reologických vlastností krve [12].
V roce 2005 se uskutečnilo mezinárodní sympozium za účelem tvorby konsenzu, který měl za cíl definovat jednoznačné stanovisko efektu a indikací jednotlivých venoaktivních látek [13]. Vzhledem k tomu, že v průběhu let prošla i terapie CVD významným vývojem, bylo nutné přepracovat doporučené postupy venofarmakologické léčby CVD.
Dle původního konsenzu z roku 2005 jsou VAD klasifikována do 4 hlavních kategorií:
- benzopyrony (α, γ)
- saponiny
- rostlinné extrakty
- syntetická léčiva
α-benzopyrony především zahrnují kumarin. Toto léčivo je široce používáno k léčbě lymfedému. Využití je limitováno jeho hepatotoxicitou při vyšších dávkách. Je používán ve spojení s troxerutinem. Do skupiny patří taktéž dikumaroly, které jsou hepatotoxické.
γ-benzopyrony, též nazývány flavonoidy. Zástupci této široké skupiny antioxidantů jsou diosmin a jeho deriváty rutosidy (HR – oxerutin, troxerutin) a hesperidin. Používají se k léčbě otoků a symptomů CVD. Řadíme sem i mikronizovanou purifikovanou frakci flavonoidů (MPFF) diosminu, hesperidinu, izorhoifolinu, linarinu.
Saponiny zahrnující extrakty semene koňského kaštanu (Aesculus hippocastanum, angl. horse chestnut seed extracts – HCSE) a extrakty listnatce trnitého (Ruscus aculeatus).
K léčbě CVD se používají i další rostlinné extrakty. Všechny obsahují flavonoidy, společně s oligomery procyanidolu (anthocyany) v extraktech borůvky (Vaccinium myrtillus), proanthocyanidoly v zrnkách bílého vína (Vitis vinifera), semínka sosny přímořské (Pinus maritima) picnogenol. Využívány jsou též extrakty z jinanu dvojlaločnatého (Ginkgo biloba), pupečníku asijského (Centella asiatica) nebo vilínu (Hamamelis). Veškeré rostlinné extrakty obsahují variabilní množství flavonoidů. A právě ty jsou alespoň částečně zodpovědné za jejich farmakologický efekt.
Syntetická léčiva – zástupcem je calcium dobesilas, naftazon, benzaron a hlavně dříve používaný tribenosid. Zda mají být poslední 2 jmenované substance používány je diskutabilní pro jejich nežádoucí účinky (benzaron může indukovat hepatitidu a tribenosid je spojen s vyšším rizikem výskytu vyrážky).
Původní konsenzus z roku 2005 třídí jednotlivé venoaktivní látky též podle prokázaných klinických účinků dle vědeckého významu studií, které jejich efekt prokazují. Mezi substance s nejlépe prokázaným efektem řadíme MPFF diosminu a hesperidinu, calcium dobesilas a HR – oxerutin. U zbylých venoaktivních látek je jejich efekt prokázán jen na pracích, které nemají dostatečný potenciál uplatňující své závěry v souladu s principy EBM studií). Studie, ze kterých konsenzus vycházel, ukazuje tab. 1 [5].
Tab. 1. Studie, ze kterých konsenzus z roku 2005 vychází 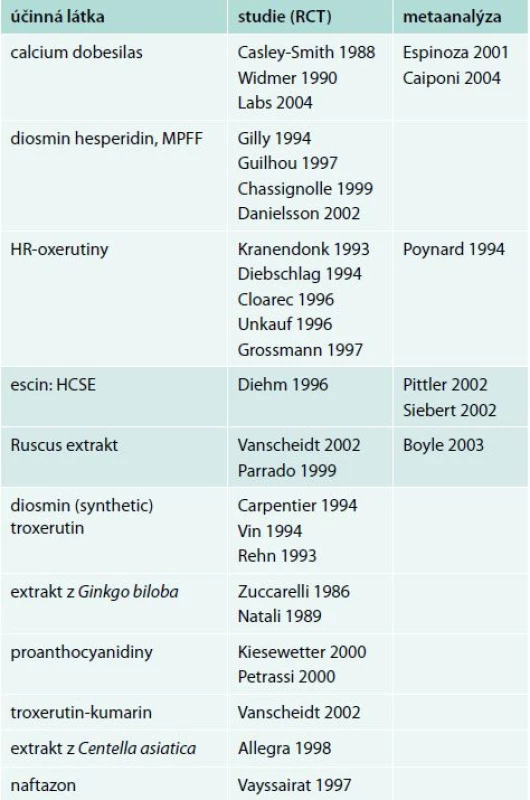
Charakteristika MPFF diosminu a hesperidinu
MPFF diosminu a hesperidinu je substance získaná z citrusového plodu Ruta aurantiae (citrusovité). Chemicky je sumární vzorec diosminu C28H32O15, tedy 7-{[6-O-(6 deoxy-α-L-mannopyranosyl)-β-D-glucopyranosyl]oxy}-5hydroxy-2-(3-hydroxy-4-methoxyfenyl)-4H-1-benzopyran-4on. Sumární vzorec hesperidinu je C28H32O15, tedy (S)-7-{[6-O-(6 deoxy-α-L-mannopyranosyl)-β-D-glucopyranosyl]oxy}-2,3-dihydro-5-hydroxy-2-(3-hydroxy-4-methoxyfenyl)-4H-1-benzopyran-4-on. Vlastní mikronizovaná purifikovaná flavonoidní frakce (MPFF) je tvořena mikronizovaným diosminem (90 %) a hesperidinem (10 %). Originální mikronizační proces zajišťuje velikost částic menší než 2 µm. Takováto velikost pak zajišťuje snazší absorpci při perorálním podávání originálního preparátu.
Hlavní indikací použití MPFF diosminu a hesperidinu je léčba CVD, kterou rozebíráme níže. Avšak další důležité uplatnění je použití dané substance v proktologii. V tomto oboru je indikován v rámci léčby hemoroidální choroby. Byl prokázán vliv na redukci frekvence krvácení z hemoroidálních uzlů, redukci pruritu, bolesti a tenezmů při tomto onemocnění [14–16]. Byl též prokázán efekt na redukci sekundárního krvácení po hemoroidektomii [17].
Existují také studie dokumentující lymfagogenní účinek MPFF [18,19]. Např. u pacientů s pokročilými stadii CVD bylo prokázáno, že MPFF diosminu a hesperidinu významně upravuje funkční i strukturální parametry důležité pro mikrolymfatickou drenáž: zmenšuje průměr lymfatických kapilár, snižuje intralymfatický tlak a zvyšuje počet funkčních lymfatických kapilár [19]. Lymfoscintigraficky bylo dokázáno signifikantní (P = 0,005) urychlení odtoku lymfy z postmastektomického otoku [20]. V oblasti lymfologie není však možné řadit MPFF diosminu a hesperidinu o primární terapie. V tomto oboru jej lze uplatnit pouze jako doplňkovou terapii.
Vliv na redukci symptomů CVD
Jedna z prvních studií publikovaných na toto téma je již z roku 1972 a hodnotí efekt MPFF diosminu a hesperidinu při léčbě varikozit u gravidních žen [21]. V průběhu let byla publikována celá řada prací, které hodnotily pozitivní vliv na eliminaci subjektivních symptomů i objektivních projevů CVD. Ty byly finálně hodnoceny v rámci již zmíněného konsenzu z roku 2005, nejaktuálnější pak při aktualizaci mezinárodních guidelines pro léčbu CVD v roce 2014 (viz dále). Z novějších studií stojí za zmínku práce Navrátilové, která prokazuje pozitivní efekt MPFF diosminu a hesperidinu na redukci otoku ve srovnání s kompresní terapií ve studii s 6měsíčním sledováním [22]. V roce 2012 byla publikována metaanalýza srovnávající efekt MPFF diosminu a hesperidinu, hydroxyethylrutosidu, Ruscus extraktu a samotného diosminu. Hodnotila jejich efekt na redukci žilní bolesti a otoku kotníku. Metaanalýza vycházela z publikací z let 1975–2009 a zahrnovala informace od 1 010 pacientů. Všechny sledované substance vykazovaly signifikantní efekt (P < 0,0001) ve smyslu redukce symptomů CVD oproti placebu. Při vzájemném srovnání vlivu na perimaleolární otok byl prokázán signifikantně větší efekt MPFF diosminu a hesperidinu vůči zbylým venofarmakům (P < 0,0001) [23]. Další vysvětlení klinického efektu MPFF diosminu a hesperidinu – tentokrát na redukci bolesti – vychází z práce neurofyziologa Danzingera. Byl prokázán specifický analgetický efekt MPFF diosminu a hesperidinu na žíly: toto venofarmakum tlumí uvolňování zánětlivých mediátorů, které aktivují C vlákna nociceptorů, což se klinicky projevuje rychlou úlevou od bolesti [24]. Koneckonců, i na posledním světovém kongresu Mezinárodní flebologické unie UIP v roce 2013 opakovaně zaznělo, že úleva od žilní bolesti, kterou Danzinger definuje jako bolest vyvolanou drážděním nociceptorů zánětlivou reakcí v okolí postižené žíly, u níž je základním vyvolávajícím činitelem žilní hypertenze [25], je základní a smysluplný cíl léčby CVD.
Efekt venoaktivních látek na morfologické a funkční změny chlopní a na zánět
Při hodnocení a srovnávání jednotlivých VADs je nutno zmínit práce, které se zabývají nejen symptomy, byť ty přímo korelují s patogenezí dané choroby[26]. Jedná se především o studii Takase z roku 2004, který prokazuje přímý efekt MPFF diosminu a hesperidinu na snížení žilního refluxu v místě žilní chlopně. Jedná se o redukci refluxního průtoku na chlopni krys měřeného po 3 týdnech terapie danou substancí. Oproti placebu byl prokázán statisticky významný rozdíl (P < 0,05). Takase navíc potvrdil, že žilní hypertenze má vliv na morfologické změny žilních chlopní – např. snížení výšky chlopně a výšky chlopenního cípu, zmenšení šířky chlopenních cípů či prodloužení délky jejich okraje. Naproti tomu podávání MPFF poškození chlopenních struktur snížilo. Vliv dané substance na reparaci žilní chlopně též prokazuje Pacarella v práci z roku 2008. Ten navodil stav žilní hypertenze provedením arteriovenózní fistuly u 48 potkanů a sledoval proces, který probíhá v takto navozených patologických podmínkách. Prokázal zvýšenou infiltraci granulocytů a makrofágů v žilní stěně a jejím okolí, zvýšení infiltrace T-lymfocytů a B-lymfocytů v postižené tkáni. V místech žilní hypertenze pozoroval též zvýšenou hladinu proteolytických enzymů. U potkanů léčených MPFF diosminu a hesperidinu pak prokázal významné snížení hladiny infiltrace granulocytů a makrofágů v místech postižené žilní chlopně [27].
V roce 2008 byla publikována studie, která srovnává diosmin a hesperidin (neudává, o jakou se jednalo přesně formu) a calcium dobesilas. Jejich efekt je srovnáván imunohistochemickým stanovením protilátek anti-bcl-2, anti-bax a anti-p53 v žilní stěně primárních varikozit. Práce sleduje apoptózu v žilní stěně primární varikozity a hodnotí její ovlivnění pomocí venoaktivních látek. Studie srovnává 4 skupiny. V první skupině byli probandi s varikozitami, kteří nikdy neužívali žádné VAD. Druhou skupinu tvořili probandi léčení diosminem a hesperidinem, třetí skupina pak byla léčena calcium dobesilas a čtvrtá skupina byla kontrolní (probandi netrpěli žádnou formou CVD). Vyhodnocením výsledků byl prokázán významný rozdíl mezi kontrolní skupinou a všemi ostatními skupinami [28]. V oblasti mikrocirkulace má významné postavení práce, která prokazuje vliv MPFF diosminu a hesperidinu na mikrocirkulaci ve smyslu redukce adheze leukocytů v místech žilní hypertenze. V této studii prokazuje významný efekt především v souvislosti s redukcí otoku končetiny [29].
V oblasti průkazu protizánětlivého efektu MPFF diosminu a hesperidinu existuje celá řada studií, experimentálních i klinických, s pacienty trpícími CVD. V prvé řadě prokazují efekt tohoto VAD na první fázi zánětlivé reakce, tj. inhibici exprese endoteliálních adhezvních molekul ICAM1 (intercellular adhesion molecule) o 32 % a VCAM1 (vascular cell adhesion molecule) o 29 % [30]. Dále bylo prokázáno signifikantní snížení adheze aktivovaných leukocytů k endotelu a jejich migrace do mezibuněčného prostoru [31].
Poslední studií, která byla publikována v 1. čísle ročníku 2015 periodika Phlebolymphology, je práce Tsoukanova, který sledoval vliv MPFF diosminu a hesperidinu u pacientů s tranzitorním refluxem ve VSM, ke kterému dochází na konci delší statické zátěže končetin. Do studie bylo zařazeno celkem 41 žen ve stadiu CVD C0s En, An, Pn. Reflux byl detekován pomocí duplexní sonografie. Byl též měřen průměr VSM ve vertikální poloze před a po zátěži. Po léčbě MPFF diosminu a hesperidinu po dobu 2 měsíců byla pozorována statisticky signifikantní redukce takto vzniklého refluxu a také měřené průměry VSM za identických podmínek byly signifikantně menší [32].
Vliv na hojení bércové ulcerace žilní etiologie
Je jen omezené množství studií, které by prokazovaly vliv venoaktivní látky na hojení bércové ulcerace žilní etiologie. V této souvislosti je však nutno odcitovat metaanalýzu od Colerdige-Smith z roku 2005. Ve své práci dokumentuje zlepšení hojení defektu o 32 % v intervalu 6 měsíců v situacích, v nichž konvenční terapie (komprese a lokální ošetřování) byla doplněna o terapii MPFF diosminu a hesperidinu oproti samotné konvenční léčbě. Nejlepší efekt byl prokázán u defektů o rozměru 5–10 cm2. V těchto případech pozoroval efekt léčby již po 2 měsících [33]. Obdobné výsledky pozorovali i čeští autoři v práci publikované již v roce 2003, kdy prokázali zkrácení doby hojení bércové ulcerace žilní etiologie o 1 měsíc [34].
MPFF diosminu a hesperidinu jako doprovodná léčba intervenční terapie CVD
Samostatnou a velmi zajímavou kapitolou je efekt venoaktivních látek jako doplňující léčby některého z intervenčních postupů léčby CVD.
V případě klasické chirurgické operace křečových žil byla publikována práce Saveljeva a Pokrovskeho (2008), v níž autoři prezentují efekt MPFF diosminu a hesperidinu na redukci bolestí v pooperačním období po strippingu VSM. Ve studii je prokázán statisticky významný rozdíl v 7. a 13. dni od provedené operace (P < 0,05). Zajímavý byl důkaz zmenšení plochy pooperačního hematomu a urychlení jeho resorpce u pacientů v aktivní větvi (tzn. užívající MPFF; P < 0,05) [35]. Obdobná studie je od autorů Veverková et al, kteří potvrdili snížení pooperační bolesti signifikantní redukcí spotřeby analgetik po strippingu VSM u pacientů užívajících MPFF diosminu a hesperidinu v pooperačním období [36].
Obdobné práce můžeme nalézt i ve vztahu k moderním endovaskulárním zákrokům, včetně skleroterapie. Pitsch v roce 2011 publikovala významnou redukci diskomfortu po skleroterapii u pacientů užívajících po zákroku MPFF ve srovnání s pacienty, kteří podstoupili pouze zákrok. Uvádí 47% redukci pocitu těžkých nohou, 52% redukci bolestivosti, 59% redukci křečí, 57% redukci parestezií a 56% redukci pruritu [37]. Bogachev publikoval randomizovanou studii srovnávající efekt této venoaktivní látky na klinický stav (dle Venous Clinical Severity Score) pacientů odrážející se v kvalitě jejich života a návratu k běžným denním činnostem po endovaskulárním zákroku. Jsou srovnávány 2 skupiny, v první jsou probandi, kteří podstoupili endoaskulární zákrok (endovaskulární laserovou terapii, radiofrekvenční termoablaci a pěnovou skleroterapii), přičemž 15 dní před zákrokem a 30 dní po něm užívali MPFF ve standardní dávce 500 mg 2krát denně. Druhou skupinu tvořili probandi, kteří podstoupili pouze endovaskulární zákrok. Před zákrokem nebyl žádný statisticky významný rozdíl mezi oběma skupinami. Po zákroku byli pacienti ve skupině s MPFF diosminu a hesperidinu více spokojeni, udávali méně subjektivních potíží oproti kontrolní skupině (P < 0,00001) a byla pozorována menší posttraumatická morbidita [38]. Efektivita MPFF diosminu a hesperidinu se ukázala i v souvislosti s mikroskleroterapií. Přínos tohoto venofarmaka na průběh hojení a snížení rizika kožních změn po skleroterapii pro teleangiektázie prezentoval na posledním světovém UIP kongresu v Bostonu 2013 Crebassa [39]. Při dobrém dodržování léčby MPFF byly pozorovány méně časté kožní komplikace související s výkonem (P = 0,009). Přidání MPFF diosminu a hesperidinu k intervenční terapii CVD zvyšuje úspěšnost zákroku u povrchových varixů a urychluje návrat pacienta k běžným denním činnostem.
Srovnání originální podoby MPFF diosminu a hesperidinu s potravinovými doplňky obsahujícími „identickou“ účinnou látku
V posledních letech se na našem trhu objevila poměrně velká škála preparátů obsahující diosmin hesperidin, nebo dokonce i jeho mikronizovanou purifikovanou flavonoidní frakci. Originálně je MPFF diosminu a hesperidinu obsažena pouze v preparátu známém v naší republice pod názvem Detralex®, v zahraničí pak též pod názvem Daflon 500. Vždy se jedná o tentýž preparát společnosti Servier. Jedině však tento preparát je uznán Státním ústavem pro kontrolu léčiv (SUKL) jako lék. Všechny ostatní přípravky jsou pak řazeny pouze jako potravinový doplněk a tudíž nespadají pod přísnou kontrolu SUKL, který zodpovídá za skutečné složení a efekt. V klinické praxi nejsou známy žádné vědecky validní studie srovnávající daný efekt těchto preparátů.
Osobní zkušenosti s použitím MPFF diosminu a hesperidinu v klinické praxi
V období prosinec roku 2012 až duben roku 2013 byla sbírána a následně zpracována data od pacientů s CVD, u kterých byla realizována pouze konzervativní terapie s venofarmaky a kompresní terapií. Sběr dat probíhal v rámci cévní ambulance nemocnice Atlas a.s. ve Zlíně, angiologické ambulance Angiocor s.r.o. ve Zlíně a v rámci angiologické ambulance, Angiologie Brno s.r.o. Cílem tohoto pozorování bylo srovnat efektivitu jednotlivých terapeutických postupů ve smyslu redukce žilní bolesti a redukce obvodu kotníku. Míra žilní bolesti byla kvantifikována na analogové vizuální škále 1–10. Údaje byly hodnoceny u 160 probandů. Tento celkový soubor byl rozdělen na 2 shodné základní skupiny. První tvořili pacienti, u kterých byla ke konzervativní léčbě CVD použita venoaktivní látka (v 81,25 % byla použitá originální forma MPFF diosminu a hesperidinu – Detralex®) a druhou skupinu tvořili pacienti, u nichž byla použita kompresní terapie. V obou skupinách byla zastoupena všechna klinická stadia CVD. Z hlediska věku a pohlaví pacientů byly obě skupiny homogenní, takže tyto faktory neovlivňovaly výsledky. Pokles žilní bolesti byl pozorován ve skupině s venofarmaky u 90 % probandů po měsíci aplikované terapie, v případě skupiny s kompresní terapií byl pokles žilní bolesti po měsíční aplikaci této léčby u 100 % pacientů. Mezi oběma skupinami nebyl nalezen statisticky významný rozdíl. V případě parametru redukce obvodu kotníku po léčbě trvající 1 měsíc byla efektivita ve skupině s venofarmaky pouze 40 % a ve skupině s kompresní terapií 90 %. V tomto parametru se ukázala kompresní terapie signifikantně efektivnější. Velmi zajímavé bylo zhodnocení efektivity ve vztahu použité účinné látky. Soubor obsahoval 65 pacientů, kteří užívali originální preparát Detralex® v dávce 2 tablety za den. Efektivita redukce žilní bolesti byla zaznamenána u celkem 63, tedy tvořila 93,8 %. V souboru se též nacházelo celkem 12 probandů, kteří užívali MPFF diosminu a hesperidinu v preparátech řazených do kategorie potravinový doplněk. Míra dávkování byla identická jako v prvním případě, efekt se projevil celkem u 8 z nich, efektivita tedy byla 66,6 %. Tyto údaje jsou ale ovlivněny malým počtem případů, není rozlišeno, o který konkrétní preparát se jednalo, a tudíž hlubší zpracování těchto údajů nelze provést. Obecně lze výsledky hodnotit tak, že efekt originální podoby MPFF diosminu a hesperidinu je v případě redukce žilní bolesti srovnatelný s kompresní terapií, což koresponduje s literárními údaji.
Toto pozorování nelze považovat za vědecky hodnotnou studii, jedná se spíše o kvantifikaci osobních zkušeností s konzervativní léčbou CVD v klinické praxi.
Nová mezinárodní guidelines pro venofarmakologickou léčbu CVD
Všechny publikované práce se snaží sumarizovat jednotlivé konsenzy. Z těch jsou pak publikována jednotlivá guidelines. V roce 2011 publikoval Perrin a Ramelet shrnující zhodnocení postavení venoaktivních látek v rámci léčby CVD. Své závěry formulovali tak, že venoaktivní látky je možno doporučit jako vhodný terapeutický prostředek k léčbě CVD [40]. Tato shrnující práce se pak stala jedním z podkladů v rámci tvorby nových guidelines pro léčbu CVD venoaktivními látkami. Její nová podoba byla poprvé prezentována v rámci IUP celosvětové konference v září roku 2013 v Bostonu. Aktualizované mezinárodní doporučení pro léčbu CVD dolních končetin bylo publikováno v dubnu roku 2014 v International Angiology [41,42]. Jednotlivá doporučení pro venofarmaka shrnuje tab. 2 [43]. Nová guidelines zohledňují narůstající význam venofarmak v léčbě CVD. Doporučení pro užívání venofarmak jsou založena na systému GRADE (Grading of Recommendations Assessment, Development and Evaluation). Ten klasifikuje doporučení buď jako silné (stupeň 1) nebo jako slabé (stupeň 2) a kvalitu důkazů jako vysokou (stupeň A), střední (stupeň B) nebo nízkou (stupeň C). Na základě dostupných důkazů prokázala MPFF diosminu a hesperidinu mezi všemi aktuálně dostupnými venofarmaky největší klinický přínos u pacientů s CVD a získala nejsilnější doporučení pro podávání číslo 1.
Tab. 2. Jednotlivá doporučení pro venofarmaka 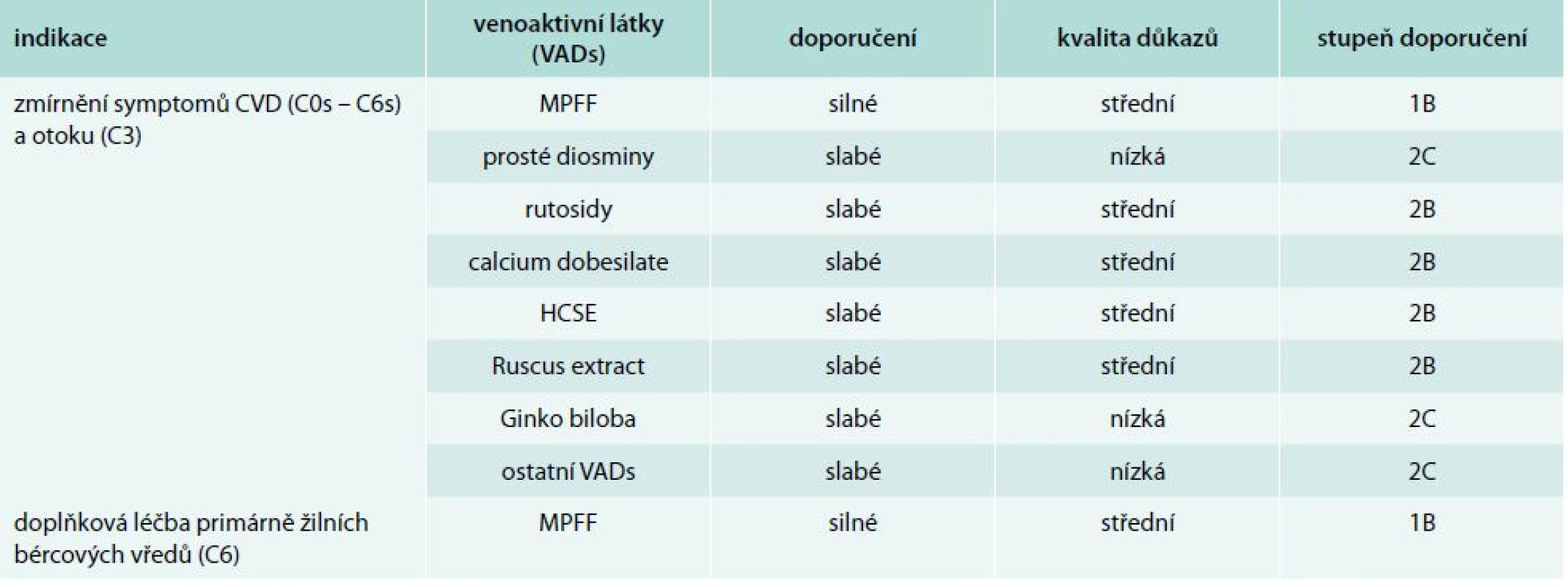
Tyto standardy jsou uznávány na celém světě a podporují je čtyři odborné společnosti: Evropské žilní fórum (European Venous Forum), Mezinárodní angiologická unie (International Union of Angiology), Nadace pro edukaci a výzkum kardiovaskulárních chorob (Cardiovascular Disease Educational and Research Trust) a Mezinárodní flebologická unie (Union Internationale de Phlébologie).
Dané shrnutí jednoznačně ukazuje, že největší potenciál efektu v rámci konzervativní terapie CVD má originální MPFF diosminu a hesperidinu. Jeho dobrý efekt vyzvedávají též doporučení v rámci American Venous Forum [10] a v rámci dalších nových shrnujících doporučení zabývajících se léčbou CVD [44].
Doručeno do redakce 13. 8. 2014
Přijato po recenzi 26. 5. 2015
MUDr. Lukáš Hnátek, Ph.D.
hnatek.lukas@gmail.com
Angiocor, s.r.o.
www.angiocor.cz
Zdroje
1. Beebe-Dimmer JL, Pfeifer J, Engel JS et al. The epidemiology of chronic venous insufficiency and varicose veins. Ann Epidemiol 2005; 15(3): 175–184.
2. Vojtíšková J. Czech Vein Program – výsledky epidemiologického programu. Praktická flebologie 2012; 21 : 8–13.
3. Eklöf B, Rutherford RR, Bergan JJ. Revision of the CEAP classification for chronic venous disorders: Consensus statement. J Vasc Surg.2004; 40(6): 1248–1252.
4. Bauer G. The etiology of leg ulcer and their treatment by resection of the popliteal vein. J Int Chir 1948; 8 : 937–967.
5. Weindorf N, Schultz-Ehrenburg U. The development of varicose veins in children and adolescents (in German). Phlebologie 1990; 43(4): 573–577.
6. Markel A, Manzo RA, Bergelin RO et al. Valvular reflux after deep vein thrombosis: Incidence and time of occurence. J Vasc Surg 1992; 15(2): 377–382.
7. Danielsson G, Arfvidsson B, Ëklof B et al. Reflux from thigh to calf, the major pathology in chronic venous ulcer disease: surgery indicated in the majority of patients. Vasc Endovascular Surg 2004; 38(3): 209–219.
8. Dwerryhouse S, Davies B, Harradine K et al. Stripping of the long saphenous vein reduces the rate of reoperation for recurrent varicose veins: five years results of a randomized trial. J Vasc Surg 1999; 29(4): 589–592.
9. Jones L, Braithwaite BD, Selwyn D et al. Neovascularization is the principal cause of varicose vein recurrence: results of a randomized trial of stripping the long saphenous vein. Eur J Vasc Endovasc Surg 1996; 12(4): 442–445.
10. Gloviczki P, Bergan JJ, Rhodes JM et al. Mid-term results of endoscopic perforator vein interruption for chronic venous insufficiency: lessons learned from the North American subfascial endoscopic perforator surgery registry. The North American Study Group. J Vasc Surg 1999; 29(3): 489–502.
11. Gloviczki P. Development and anatomy of the venous system. In: Gloviczki P (ed). Handbook of venous Disorders. Guidelines of the American Venous Forum. 3rd ed. Hodder Arnold: London 2009. ISBN 978–03–409388–05.
12. Hnátek L. Farmakoterapie chronického žilního onemocnění. Interní medicína pro praxi 2014; 16(3): 93–97.
13. Ramelet AA, Boisseaub MR, Allegra C et al. Veno-active drugs in the management of chronic venous disease. An international consensus statement: Current medical position, prospective views and final resolution. Clin Hemorheol Microcirc 2005; 33(4): 309–319.
14. Godeberge P. Daflon 500 mg in the treatment of hemorrhoidal disease: a demostrated efficacy in comparison with placebo. Angiology 1994; 45(6 Pt 2): 574–578.
15. Misra MC, Parshad R. Randomised clinical trial of micronized flavonoids in the early control of bleeding from acute internal haemorrhoids. Br J Surg 2000; 87(7): 868–872.
16. Cospite M. Double-blind, placebo-controlled evaluation of clinical activity and safety of Daflon 500 mg in the treatment of acute hemoroids. Drugs Today 1995; 31(Suppl E): 49–55.
17. Ho YH, Foo CL, Seow-Choen F et al. Prospective randomized controlled trial of micronized flavonoidic fraction to reduce bleeding after haemorrhoidectomy. Br J Surg 1995; 82(8): 1034–1035.
18. Cotonat A, Cotonat J. Lymphagogue and pulsatile activities of Daflon 500 mg on canine thoracic lymph duct. Int Angiol 1989; 8(Suppl 4): S15-S18.
19. Allegra C, Bartolo MJr, Carioti B et al. Microlymphography: assessment of Daflon 500 mg activity in patients with chronic venous insufficiency. Lymphology 1997; 31(Suppl): 12–16.
20. Pecking AP, Février B, Wargon C et al. Efficacy of Daflon 500 mg in the treatment of lymphedema (secondary to conventional therapy of breast cancer). Angiology 1997; 48(1): 93–98.
21. Gelle P, Crepin G, Delahousse G. Varices in pregnancy. Use of Daflon. Lille Med 1972; 17(Suppl 7): 1466–1468.
22. Navrátilová Z. Efficacy of a 6-month treatment with Detralex in Patients with venous edema. Phlebolymphology 2010; 17(3): 137–143.
23. Allaert FA. Meta-analysis of the impact of the principal venoactive drugs agents on malleolar venous edema. Int Angiol 2012; 31(4): 310–315.
24. Lenkovic M, Zgombic ZS, Blazic TM et al. Benefit of Daflon 500 mg in the reduction of chronic venous disease-related symptoms. Phlebolymphology 2012; 19(2): 79–83.
25. Danzinger N. Patophysiology of pain in venous disease. J Mal Vasc 2007; 32(1):1–7.
26. Takase S, Pascarella L, Lerond Let al. Venous hypertension, inflammation and valve remodeling. Eur J Vasc Endovasc Surg 2004; 28(5): 484–493.
27. Pascarella L, Lulic D, Penn AH et al. Mechanisms in experimental venous valve failure and their modification by Daflon 500 mg. Eur J Vasc Endovasc Surg 2008; 35(1):102–110.
28. Iriz E, Vural C, Ereren E et al. Effects of calcium dobesilate and diosmin-hesperidin on apoptosis of venous wall in primary varicose veins. Vasa 2008; 37(3): 233–240.
29. Nicolaides AN. From symptomps to leg edema:efficacy of Daflon 500 mg. Angiology 2003; 54(Suppl 1): S33-S44.
30. Shoab SS, Porter JB, Scurr JH et al. Effect of oral micronized purified flavonoid fraction treatment on leukocyte adhesion molecule expression in patients with chronic venous disease: a pilot study. J Vasc Surg 2000; 31(3): 456–461.
31. Korthuis RJ, Gute DC. Adhesion molecule expression in postischemic microvascular dysfunction: activity of a micronized purified flavonoid fraction. J Vasc Res 1999; 36(Suppl 1): S15-S23.
32. Tsoukanov YT, Tsoukanov AY, Nikolaychuk A. Great saphenous vein transitory reflux in patients with symptoms related to chronic venous disorders, but without visible signs (C0s), and its correction with MPFF treatment. Phlebolymphology 2015; 22(1): 25.
33. Coleridge-Smith P, Lok C, Ramelet AA. Venous leg ulcer: a meta-analysis of adjunctive therapy with micronized purified flavonoid fraction. Eur J Vasc Endovasc Surg 2005; 30(2): 198–208.
34. Roztočil K, Štvrtinová V, Strejček J. Efficacy of 6-month treatment with Daflon 500 mg in patients with venous leg ulcers associated with chronic venous insufficiency. Int Angiol 2003; 22(1): 24–31.
35. Pokrovsky AV, Saveljev VS, Kirienko AI et al. Stripping of the great saphenous vein under micronized purified flavonoid fraction (MPFF) protection (results of the Russian multicenter controlled trial DEFANCE). Phlebolymphology 2008; 15(2): 45–51.
36. Veverkova L, Jedlicka V, Wechsler J et al. Analysis of the various procedures used in great saphenous vein surgery in the Czech Republic and benefit of Daflon 500 mg to postoperative symptoms. Phlebolymphology 2006; 13(4): 181–220.
37. Pitsch F. Benefit of Daflon 500 mg in combination with sclerotherapy of teleangiectasias of the lower limbs: results form the SYNERGY and SATISFY surveys. Phlebolymphology 2011; 19(4): 182–187.
38. Bogachev VY, Golovanova OV, Kuznetsov AN et al. Can Micronized Purified Flavonoid Fraction (MPFF) improve outcomes of lower extremity varicose vein endovenous treatment? First results from DECISION study. Phlebolypmphology 2013; 20(4): 181–187.
39. Crébassa V, Karihuel J. Micronized Purified Flavonoid Fraction Treatment Improves Cutaneous Outcomes and Patient’s Satisfaction with Sclerotherapy for Superficial Varicosities. Int Angiol 2013; 32(5 Suppl 1): 105.
40. Perrin M, Ramelet AA. Pharmacological treatment of primary chronic venous disease: rationale, results and unanswered questions. Eur J Vasc Endovasc Surg 2011; 41(1): 117–125.
41. Perrin M, Nicolaides A. The Updates International Guidelines on The Management of Chronic Venous Disorders of the Lower Limbs and the Place of Venoactive Drugs. Int Angiol 2013; 32(5 Suppl 1): 106–107.
42. Nicolaides AN, Kakkos S. Management of chronic venous disorders of the lower limbs. Guidelines according to scientific evidence. Int Angiol 2014; 33(2): 87–208.
43. The Essentials from the XVIIth World Meeting of the Union Internationale de Phlébologie, 7–14 September 2013, Boston, USA. Phlebolymphology 2013; 20(3): 138–144.
44. Perrin M. Efficacy of vasoactive drugs in primary chronic venous disease survey of evidence, synthesis, and recommendations. In: Bergan JJ, Bunke N (eds) et al. The Vein Book. 2nd ed. Oxford University Press 2014 : 514–527. ISBN 978–0-19–539963–9.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Radiojod u nízkorizikového karcinomu štítné žlázy – editorial
- Cílená léčba chronické myeloidní leukemie u starších pacientů – editorial
- Tyrozinkinázové inhibitory v léčbě starších pacientů s chronickou myeloidní leukemií – editorial
- Chronická žilní onemocnění – nutnost přesnější diferenciace stavů k určení optimálního způsobu léčby – editorial
- Kavální filtry v roce 2015 – komu, kdy a jak? – editorial
- Stravování a kardiovaskulární onemocnění – dialogy a protimluvy – editorial
- Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
- Sekundární humorální imunodeficience u nemocných se systémovým lupus erythematodes
- Má věk nemocných s chronickou myeloidní leukemií při léčbě imatinibem vliv na dosaženou léčebnou odpověď?
- Role metabolického syndromu v gastroenterologii
- Účelnost zavádění kaválních filtrů z pohledu internisty
- Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
- Změny stravovacích návyků ve vztahu k rizikovým faktorům a kardiovaskulární mortalitě
-
Myopatie při Waldenströmově makroglobulinemii.
Popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů typu IgM - František Kopřiva. Chronický kašel. Průvodce ošetřujícího lékaře
- Jan Máca et al. ARDS v klinické praxi
- Rudolf Kotas. Bolesti hlavy v klinické praxi
- Josef Veselka, Vilém Rohn a kolektiv. Kardiovaskulární medicína
- (Ne)očekávané výsledky studie EMPA-REG OUTCOME™
- Poznámka k diferenciální diagnostice hyponatremie
- Acute Leukemias XV, Biology and Treatment Strategies
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
- Účelnost zavádění kaválních filtrů z pohledu internisty
- Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
- Poznámka k diferenciální diagnostice hyponatremie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



