-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Syndróm MIAC (malnutrition, inflammation, atherosclerosis, calcification)
The MIAC (malnutrition, inflammation, atherosclerosis, calcification) syndrome
The number of patients with chronic renal failure is on the rise; these patients have a 10 to 20 times higher risk of development and progression of cardiovascular diseases. Higher cardiovascular risk in such patients cannot be satisfactorily explained by traditional risk factors defined in the Framingham study. On the contrary, a concept of reverse epidemiology has been brought forward, designating a situation in which the incidence of obesity and hyperlipoproteinemia is associated with a higher survival rate of the patients concerned. Higher risk is today explained by the „MIAC (malnutrition, inflammation, atherosclerosis, calcification) syndrome“, which is present in patients with chronic kidney disease. New evidence has been recently obtained of different circulating molecules associated with atherosclerosis, the plasmatic levels of which are decreased or increased in such patients and which are in a way linked with the MIAC syndrome and the progression of atherosclerosis. Clinical management of the syndrome could increase survival in the future, and reduce morbidity and the number of hospitalisations. Circulating molecules could serve as markers evidencing the presence of the syndrome and its severity, as well as the success of treatment.
Key words:
inflammation – malnutrition – atherosclerosis – calcification – haemodialysis
Autoři: E. Mistrík; V. Bláha; S. Dusilová-Sulková; L. Sobotka
Působiště autorů: Klinika gerontologická a metabolická Lékařské fakulty K a FN Hradec Králové, přednosta prof. MUDr. Luboš Sobotka, CSc.
Vyšlo v časopise: Vnitř Lék 2007; 53(10): 1092-1099
Kategorie: Přehledné referáty
Souhrn
Pacientov s chronickým zlyhávaním ľadvín dnes pribúda a títo pacienti majú 10-20krát zvýšené riziko vzniku a progresie kardiovaskulárnych chorôb. Zvýšené kardiovaskulárne riziko u týchto pacientov nie je úplne vysvetliteľné tradičnými rizikovými faktormi, ktoré boli určené počas Framinghamskej štúdie. Naopak hovorí sa o takzvanej reverznej epidemiológii, keď výskyt obezity a hyperlipoproteinémie je asociovaný so zvýšeným prežívaním u týchto pacientov. Zvýšené riziko sa dnes vysvetľuje takzvaným MIAC syndrómom (malnutrition, inflammation, atherosclerosis, calcification) prítomným u pacientov s chronickým ochorením ľadvín (chronic kidney disease). V poslednej dobe pribúda novej evidencie o rôznych cirkulujúcich molekulách asociovaných s aterosklerózou, ktorých plazmatické hladiny sú znížené, či zvýšené u týchto pacientov a ktoré sú v určitom vzťahu k syndrómu MIAC a progresii aterosklerózy. Klinické ovplyvnenie tohto syndrómu by v budúcnosti mohlo viesť k zlepšeniu prežívania, zníženiu chorobnosti a počtu hospitalizácií týchto pacientov. Cirkulujúce molekuly by nám mohli slúžiť ako markery vypovedajúce o prítomnosti tohto syndrómu a jeho závažnosti a o úspešnosti našej liečby.
Kľúčové slová:
zápal - malnutrícia - ateroskleróza - kalcifikácie - hemodialýzaÚvod
Pacienti s chronickým renálnym ochorením vedúcim k zlyhaniu ľadvín (ESRD - end stage renal disease), majú dnes, aj napriek moderným metódam náhrady renálnych funkcií, krátku dobu prežitia. Primárna príčina smrti u týchto pacientov je až v 50% kardiovaskulárnej etiológie [1,2]. Ročná mortalita u týchto pacientov je až 20 % [3], čo je 10-20krát viac ako v normálnej populácii, dokonca aj keď sa zohľadní vek, pohlavie, rasa a diabetes mellitus [1]. V niekoľkých štúdiách v poslednej dobe bolo skúšané mortalitu u týchto pacientov znížiť tým, že by sa zvýšila účinnosť dialýzy zvýšením jej dávky alebo zmenou permeability dialyzačnej membrány. Avšak tieto štúdie dopadli nejednoznačne [4]. Rozdielne od týchto štúdií dopadli štúdie porovnávajúce vzťah reziduálnej renálnej clearance a mortality. Pacienti s lepšou reziduálnou renálnou funkciou spravidla prežívali dlhšie [5,6]. Iné štúdie z poslednej doby poukazujú na to, že kardiovaskulárnu mortalitu u týchto pacientov nie je možné vysvetliť takzvanými tradičnými rizikovými faktormi, určenými vo Framinghamskej srdcovej štúdii [7,8], ako sú napríklad obezita, hypertenzia, hypercholesterolémia, fajčenie a i. [9]. Naopak mnoho týchto tradičných rizikových faktorov vykazuje takzvanú reverznú epidemiológiu, čo znamená, že tieto sú spojené so zlepšeným prežívaním týchto pacientov oproti pacientom, ktorí tieto rizikové faktory nevykazujú. A naopak nízky BMI a nízky sérový cholesterol sú rizikové faktory pre zvýšenú morbiditu a mortalitu u týchto pacientov [10-13]. Toto sa dnes vysvetľuje takzvaným syndrómom MIAC (malnutrition, inflammation, atherosclerosis, calcification) [14] alebo MICS (malnutrition, inflammation, cachexia syndrome). U týchto pacientov sú totižto zvýšené laboratórne známky zápalu (napr. CRP) a sú prítomné známky proteino-energetickej malnutrície (napr. albumín) [15,16]. Tento chronický zápalový proces spojený s chronickou malnutríciou ďalej vedie k rozvoju aterosklerózy a kalcifikácie ako v tepennom riečišti tak aj na srdečných chlopniach. Tieto zmeny sa dnes dajú sledovať okrem iného aj pomocou rôznych cirkulujúcich molekúl, ktoré by mali vypovedať o vzniku, prítomnosti a závažnosti aterosklerotického procesu a ktoré by tiež mali mať určitú prediktívnu hodnotu do budúcnosti. Na začiatku sa pozornosť sústredila na hsCRP ako známku chronického zápalu. hsCRP je dnes už plne etablovaný marker aterosklerózy [17,18]. Postupne sa pozornosť začala upriamovať na iné známky zápalu: IL-6 [17], TNFα [19], IL-10 [20], CD146 [21], IL-18 [22] a na adhezívne molekuly, ktoré exprimuje endotel po stimuloch, ktoré vedú k jeho zraneniu. Tieto adhezívne molekuly slúžia k adhézii monocytov na dysfunkčnú endotelovú bunku, čo je prvým krokom v procese aterosklerózy. Medzi ne patria ICAM, VCAM, E-selektin, P-selektin [16]. Medzi iné cirkulujúce molekuly dnes dávané do súvislosti s rozvojom aterosklerózy či cievnych kalcifikácií u pacientov s chronickou chorobou ľadvín patria ADMA [23], Fetuin A [24], adiponektín [21]. Menej špecifické parametre, ktoré sa dnes používajú pri posudzovaní malnutrície a ktoré môžu mať určitú prediktívnu hodnotu rozsahu aterosklerózy sú fibrinogen, albumín, transferín, ev. transthyrexin.
Obr. 1. Schéma etiopatogenézie a dôsledkov syndrómu MIA (DM: diabetes mellitus, BMI: body mass index). 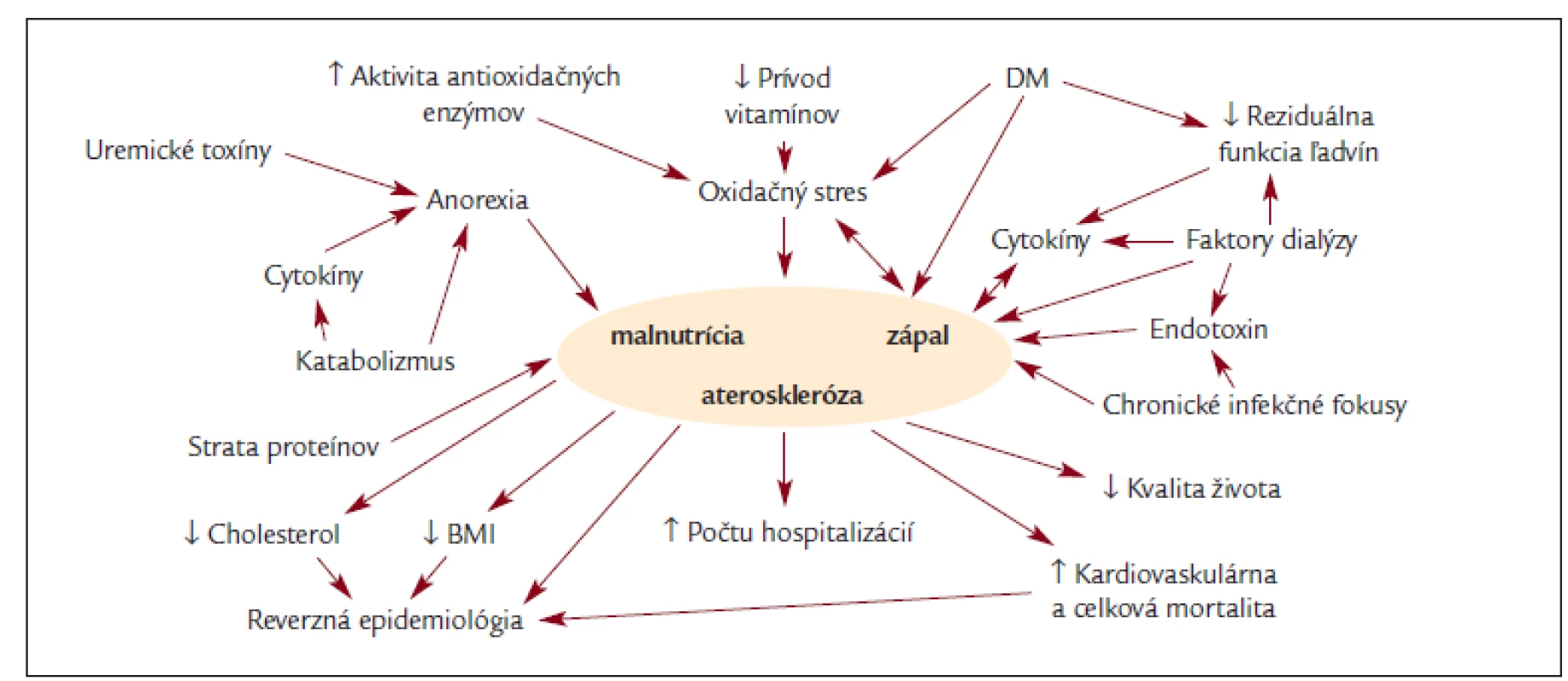
Upravené podľa Kalantar-Zadeh K et al. [90]. Obr. 2. Schéma etiopatogenézie vaskulárnych kalcifikácií. 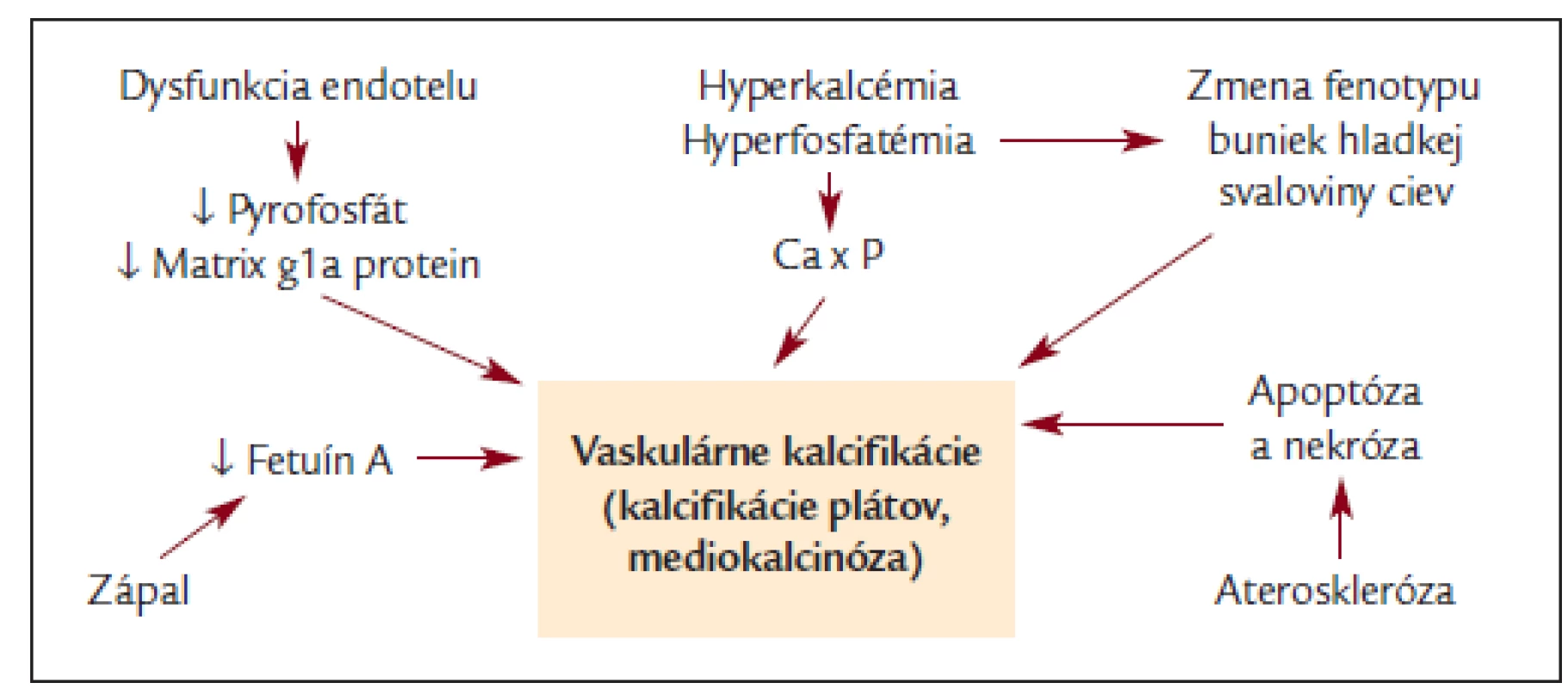
Upravené podľa Giachelli CM. [65]. MIAC syndróm (malnutrition, inflammation, atherosclerosis, calcification)
Ako prvý MIA syndróm popísal v roku 1999 Stenvinkel [14].
Chronický zápal
Chronický zápal je dnes všeobecne uznávanou primárnou príčinou syndrómu MIAC. Nie je úplne jasné, prečo u týchto pacientov tento chronický zápal prebieha. Má sa za to, že hlavnou príčinou je oxidatívny stres, ktorý vzniká dysbalanciou medzi zvýšeným tvorením oxidačných radikálov a nedostatočnými antioxidatívnymi mechanizmami [25-28]. Tento vzniká jednak zníženou clearance uremických toxínov, čo vedie k poruche funkcie leukocytov, ktoré tieto radikály vytvárajú [29-31], ale aj faktormi vyplývajúcimi z dialýzy, ako napríklad bioinkompatibilita dialyzačnej membrány, alebo peritoneálne dialyzačného roztoku. Na druhej strane stoja nedostatočné antioxidačné mechanizmy organizmu spôsobené jednak zníženou aktivitou antioxidačných enzýmov akým je napríklad superoxiddismutáza (SOD) alebo glutationperoxidáza [29,31-33], poruchou v tvorbe NO [30] ako aj často nedostatočným prívodom exogénnych antioxidantov akým sú napríklad vitamíny C a E ale aj iné menej známe látky ako napr. polyfenoly, fytoestrogeny v rámci pridruženej malnutrície [34]. Oxidatívnym stresom vznikajú kyslíkové a iné radikály, čo vedie k poškodzovaniu bunečných membrán, hlavne endotelových buniek, čo vedie k endotelovej dysfunkcii [35,36]. Endotel následne zvýši expresiu adhezívnych molekúl, čo aktivuje imunitné bunky, ktoré pomocou adhezívnych molekúl priľnú k endotelu, čo je vlastne prvým krokom v procese aterosklerózy, ktorý ďalej pokračuje rovnakým spôsobom ako u bežnej populácie, len oveľa rýchlejšie. U peritoneálnej dialýzy ďalej prispieva vysoká koncentrácia glukózy v dialyzačnom roztoku, z ktorého sa táto má tendenciu vstrebávať do krvného obehu. Glukóza a takzvané GDP (glucose degradation products), ktoré vznikajú pri sterilizácii glukózy teplom reagujú s -NH2 skupinou bielkovín za vzniku AGE (advanced glycation endproducts) [37-39]. Tím sa zmení ich štruktúra aj funkcia, ktorá je daná štruktúrou a bielkoviny sa stanú zdrojom oxidačného stresu. Tento stav je v podstate podobný ako u diabetikov, ktorí majú chronickú hyperglykémiu. Aterosklerotický proces sám o sebe ďalej prehlbuje zápalový stav, ktorý vedie k zrýchľovaniu procesu aterosklerózy a vzniká začarovaný kruh, ktorý sa točí stále rýchlejšie. K zápalu ďalej prispieva znížená renálna clearance zápalových mediátorov, ktoré vlastne ďalej aktivujú imunitné bunky, čo podporuje pretrvávanie chronického zápalového stavu. Na toto bolo zameraných niekoľko štúdií, ktoré sledovali závislosť medzi reziduálnou renálnou funkciou a hladinou cytokínov a zistili že čím nižšia bola reziduálna renálna funkcia, tým vyššie boli hladiny cytokínov [40], CRP a mortalita [41]. V inej štúdii na základe regresnej analýzy zistili, že kreatinin, ako parameter funkcie ľadvín, je jedinou spoľahlivou determinantou predikcie hladín IL-6 [42]. U niektorých pacientov môžu k zápalu prispievať aj infekcia Chlamydia pneumoniae [43] a v poslednej dobe sa kladie dôraz aj na infekcie, napríklad na rôzne dentálne, gingiválne a iné infekcie [44]. Často sa podceňuje skrytá infekcia zaniknutého cievneho prístupu. Bolo publikovaných niekoľko štúdií skúmajúcich vzťah medzi hladinou endotoxínu v krvi a cievnou dysfunkciou. Hladina endotoxínu je všeobecne výrazne zvýšená u septického šoku vyvolaného gram-negatívnymi mikroorganizmami. Tento stav je doprevádzaný všeobecne zvýšenou kapilárnou permeabilitou, disseminovanou intravaskulárnou koaguláciou až postupne dôjde k obehovému kolapsu. Endotoxín môže byť jedným z primárnych činiteľov zodpovedných za túto nadmernú cievnu dysfunkciu. U chronických zápalových stavov, akým sú napríklad už spomínané dentálne, gingiválne či iné chronicky prebiehajúce infekcie, je tiež produkovaný endotoxín, ale vo výrazne nižších koncentráciách [45]. Endotoxín v takýchto koncentráciách vedie k aktivácii v monocyto-makrofágovom systéme ako aj k odpovedi buniek hladkej svaloviny ciev a endotelu [46,47]. Zvýšená aktivácia endoteliálnych buniek u pacientov bola počas päť ročnej štúdie asociovaná s vyšším výskytom aterosklerotických lézií [48]. Pri pokusoch na zvieratách sa tiež dokázalo, že pravidelné týždenné podávanie endotoxínu injekčne zrýchľuje aterosklerózu [49,50]. Endotoxín u ľudí pôsobí cez lipopolysacharide binding protein (LBP), ktorý extrahuje endotoxín z bakteriálnej membrány a aktivuje monocyto-makrofágový systém pomocou molekuly CD14 [51]. Vyššia hladina endotoxínu môže byť všeobecne jednou z príčin chronického zápalového stavu a akcelerovanej aterosklerózy. Ešte sa nevie veľa o vzťahu LBP a aterosklerózy u ESRD. Predpokladá sa ale podobný vzťah ako u bežnej populácie.
Na našom pracovisku sme stanovili hladinu LBP pred a po intervencii s cieľom odstrániť možné infekčné fókusy a zlepšiť efektívnosť dialýzy jej prístupov (arteriovenózne fistuly a katétre). Pred intervenciou trojnásobne zvýšená hladina klesla po intervencii na úroveň kontrol. Jedná sa zatiaľ o nepublikované výsledky.
Dialýza sama o sebe môže tiež k zápalovému stavu prispievať faktormi, ako sú infekcie katétru alebo fistuly a expozíciou substanciám, ktoré samé o sebe dokážu vyvolávať produkciu cytokínov. Medzi tieto patria rôzne pyrogény, či opäť endotoxín, ktoré sa môžu nachádzať v malých množstvách v dialyzačnom roztoku. Dnes sa stále častejšie používajú takzvané ultračisté dialyzačné roztoky, ktoré prakticky nie sú kontaminované týmto spôsobom.
Malnutrícia
Malnutrícia je u pacientov s ESRD často prítomná. Proteino-energetická malnutrícia je daná:
- nedostatočným príjmom živín (anorexia z mnohých príčin),
- stratou proteínov do (peritoneálne) dialyzačného roztoku,
- katabolickým efektom zápalových mediátorov na metabolizmus proteínov. Toto je dnes vysvetľované aktiváciou rôznych faktorov (napr. NF-κB - nuklear faktor κB) [52] a proteolytických systémov (napr. ubiquitin-proteazómový proteolytický systém) [53]. Znížená chuť až nechutenstvo je spôsobené prozápalovými cytokínmi ako aj uremickými toxínmi, čo je dávané do súvislosti okrem iných aj anorektickým hormónom zvaným leptin [54,55]. Úloha leptinu v uremickej kachexii nie je ale úplne jasná. Existujú totiž dôkazy, že vysoké hladiny leptinu u hemodialyzovaných pacientov pozitívne korelujú s množstvom telesného tuku [56,57] a zvýšené množstvo telesného tuku je asociované s lepším prežívaním týchto pacientov [10-13]. Účinky leptinu nám preto budú musieť objasniť ďalšie štúdie.
- u peritoneálne dialyzovaných aj náplňou brucha dialyzačným roztokom, ktorý môže mechanicky vyvolávať pocit sýtosti ako aj zvýšenou hladinou vstrebanej glukózy v krvi, ktorá tiež pôsobí ako faktor sýtosti. Dnes sa navrhuje malnutríciu u dialyzovaných rozdeliť na dva druhy podľa etiológie a prognózy. 1. typ je malnutrícia spôsobená relatívne nedostatočným príjmom potravy z akéhokoľvek z hore uvedených dôvodov. Tento typ by mal byť ľahko zvrátiteľný adekvátnym príjmom potravy. 2. typ je zapríčinený chronickým zápalom a komorbiditami pacienta, ktorý nie je zvrátiteľný adekvátnym príjmom potravy, pokiaľ súčasne nie je snaha o zvrátenie chronického zápalového stavu [58]. Tento druhý typ je vlastne súčasťou syndrómu MIAC.
Ateroskleróza
Riziko vzniku aterosklerózy u pacientov s chronickým renálnym zlyhaním je niekoľkonásobne vyššie ako u priemernej populácie. Ateroskleróza má u týchto pacientov tendenciu progredovať oveľa rýchlejšie než by sa dalo čakať a postihuje aj oveľa rozsiahlejšiu časť cievneho riečišťa. Väčšina autorov sa pri hodnotení rozsahu a rizika aterosklerózy prikláňa k stanovaniu tzv. intima-media thickness (IMT) karotid pomocou ultrazvuku [59-61]. Táto metóda je dnes hodnotená ako spoľahlivá v tomto ohľade a preto sa pomocou nej porovnáva spoľahlivosť iných metód, hlavne biochemických. Okrem IMT rôzni autori používajú rôzne iné metódy ako je napr. plaque score, beta-index tuhosti a. carotis alebo hodnotia plaky kvantitatívne na mäkké s vyšším počtom lipidov alebo tvrdé - kalcifikované [59]. Žiadna z týchto metód sa zatiaľ neetablovala do tej miery ako stanovenie IMT. Ateroskleróza u pacientov s chronickým ochorením ľadvín je charakterizovaná mnohonásobne vyšším podielom kalcifikovaných plátov [62]. Kalcifikácie u týchto pacientov nemusia byť len v plátoch, ale takisto v stenách ciev, hlavne v tunica media, a v štruktúrach srdečných chlopní.
Kalcifikácie
Niektorí autori k pôvodnému MIA priradili aj C stojace pre „calcification“ [15]. Zvýšená miera vaskulárnej kalcifikácie je dnes vysvetľovaná viacerými faktormi:
- Zvýšením Ca × P súčinu, ktorý je dôsledkom veľmi zložitej poruchy metabolizmu vápniku a fosforu [63]. Tento je stav je všeobecne predispozíciou k extraoseálnym kalcifikáciám a podľa dnešných znalostí je pravdepodobné, že hyperfosfatémia je aktívnym faktorom v indukcii premeny fenotypu buniek hladkej svaloviny na bunky podobné osteoblastom [64,65].
- Endotelové bunky normálne exprimujú molekuly inhibujúce intravaskulárnu kalcifikáciu. Medzi takéto molekuly patrí napr. pyrofosfát alebo matrix gla protein [65,66]. Expresia týchto molekúl je u pacientov s ESRD znížená [65,66], tak ako je znížená aj hladina fetuinu-A (α2-Heremans Schmid glycoprotein), čo je protein produkovaný v pečeni [24]. Tomuto proteínu je v poslednej dobe venovaná veľká pozornosť. Funkcia tohto glykoproteínu je inhibovať extraoseálnu kalcifikáciu a zároveň slúži ako negatívny proteín akútnej fázy. Zaujímavé je, že hladina tohto glycoproteínu je znížená u dialyzovaných pacientov [24] a u peritoneálne dialyzovaných pacientov [15], čo je v oboch týchto štúdiách spojené s vyššou kardiovaskulárnou mortalitou a mierou aterosklerózy meranou biochemicky pomocou CRP. Nízka hladina fetuinu-A tiež súvisela s vyšším podielom valvulárnych kalcifikácií hodnotených echokardiograficky [15]. Ešte zaujímavejšie je, že vyššia (nie nižšia ako v predchodzích štúdiách) hladina fetuínu-A pozitívne korelovala s aterosklerózou hodnotenou pomocou IMT u pacientov bez zlyhania obličiek [67].
- Uvažuje sa tiež o podiele abnormálnej diferenciácie kmeňových buniek v stenách ciev a o zmene fenotypu buniek hladkej svaloviny médie, čo vedie k existencii už spomínaných buniek podobných osteoblastom v stenách ciev [64,65,68,69]. Toto tvrdenie je dokladané výskytom rôznych pre kosť špecifických molekúl v kalcifikovaných léziách [65,70].
- V aterosklerotických ložiskách prebieha apoptóza a nekróza, čo vedie k vytváraniu akýchsi nukleačných centier, na ktorých sa proces kalcifikácie v aterosklerotických plátoch môže začať [65,71]. Ku kalcifikácii dochádza prakticky vo všetkých nekrotických ložiskách v tele.
Solubilné molekuly a ich patogenetický vzťah k ateroskleróze
Ateroskleróza u ESRD je dávaná do súvisu s nám už známym stavom chronického zápalu. Najviac toho bolo publikované o CRP. CRP je dnes chápaný ako marker aterosklerózy a má pozitívnu prediktivitu pre mortalitu u týchto pacientov [17]. Je takisto známy súvis medzi IL-6 a iniciáciou aterosklerózy u myší [72]. Takisto je vyskúmaná prediktivita IL-6 pre mortalitu pacientov s ESRD [17] či bez nej [73]. IL-6 sa ale pre náročnosť stanovovania nehodí pre rutinnú prax a väčšina autorov sa prikláňa k hodnoteniu CRP pri predikcii mortality u týchto pacientov, aj napriek skutočnosti, že IL-6 je s mortalitou asociovaný štatisticky silnejšie [17]. Chronický zápal podľa všeobecne platného názoru spôsobí poruchu funkcie endoteliálnych buniek najprv na určitých predispozičných miestach, ktoré sú vystavené náhlym zmenám krvného prúdenia z laminárneho na turbulentné. Takýmito miestami sú bifurkácie artérií, vetvenia, či náhle anatomické zmeny smeru. Špecifickým práve u ESRD je, že ateroskleróza neostáva limitovaná len na tieto miesto, ale viac generalizovaná, než u bežnej populácie. Či už na predispozičných miestach alebo všade, kde pôsobí chronický zápal endotel exprimuje takzvané adhezívne molekuly. Prvými exprimovanými molekulami po aktivácii endotelových buniek sú najpravdepodobnejšie intercelular adhesion molecule 1 (ICAM-1) a vascular cell adhesion molecule 1 (VCAM-1) [74]. Adhezívne molekuly spôsobia, že monocyty a T-lymfocyty adherujú k miestam, kde sú tieto molekuly exprimované a následne sa aktivujú [74]. Toto vedie k zvýšenej expresii receptorov na ich membráne, ktoré viažu ďalšie adhezívne molekuly: ICAM, VCAM, selektíny (E-selectin, P-selectin), integriny, či chemokíny [MCP-1 (monocyte chemoattractant protein-1]].
V štúdii u peritoneálne dialyzovaných pacientov ICAM-1 pozitívne a nezávisle korelovala aterosklerózou posudzovanou metódou IMT [16]. V inej štúdii u peritoneálne dialyzovaných zistili silný vzťah medzi MCP-1 a IMT [75].
Tieto aktivované monocyty produkujú cytokíny, ktoré aktivujú ďalšie, ešte cirkulujúce, monocyty, a ktoré im pomôžu pri lokalizácii miesta zápalu. Monocyty prestupujú do steny ciev, kde prebieha zápal. Tu vychytávajú oxidačnými radikálmi poškodené LDL pomocou svojich zametačových (scavengerových receptorov) a vznikajú z nich penové bunky. Po určitom čase vzniknú najprv lipidové prúžky v stene ciev, z ktorých sa s postupne progredujúcim zápalom vytvorí aterosklerotický plát. Ten u pacientov s ESRD vďaka hore zmieneným faktorom má vyššiu tendenciu kalcifikovať ako u bežnej populácie. V našom súbore boli hladiny MCP-1 1,5krát vyššie u dialyzovaných ako u kontrol.
Ďalšou zo solubilných molekúl popisovaných v poslednej dobe je asymetrický dimethylarginin (ADMA). ADMA je kompetetívny inhibítor NO-syntázy, ktorý súťaží s prirodzeným substrátom tohto enzýmu, L-argininom, čo v konečnom dôsledku pôsobí endoteliálnu dysfunkciu. Hladina tohto peptidu je zvýšená u pacientov s ESRD. Príčina tohto javu dnes nie je úplne vysvetlená. Hovorí sa jednak o zníženej renálnej clearance a nedostatočnej clearance dialýzou [76]. ADMA je okrem vylučovania ľadvinami aj metabolizovaná enzýmom zvaným dimethylarginin-dimethylaminohydroláza [77]. ADMA je u týchto pacientov silne asociovaná s aterosklerózou zaznamenanou či už anamnesticky [78] alebo pomocou IMT [23], ďalej je asociovaná s CRP a hlavne zvýšenou mortalitou [23]. ADMA je dokonca asociovaná aj s progresiou renálnej poruchy u nediabetických pacientov s miernou poruchou ľadvinových funkcií [79]. Aj napriek všetkým týmto poznatkom zostáva nejasné, či ADMA pôsobí kauzálne v celkovej morbidite a mortalite u pacientov s ESRD alebo ostáva len v roli markeru a prognostického faktoru [80].
Terapia syndrómu MIAC
Jednoznačná terapia tohto syndrómu ešte neexistuje. Väčšina autorov sa ale už dnes zhoduje, že pre zlepšenie prognózy u pacientov s ESRD je nutná komplexná terapia schopná ovplyvniť všetky zložky syndrómu. Úspešnosť tejto terapie je samozrejme podmienená správnou a dostatočnou dialýzou pacienta. Niektorí autori [81-83] navrhujú okrem adekvátneho príjmu energie a proteínov suplementácie vitamínov a minerálov aj doplnkovú suplementáciu rôznych antioxidatívnych prípravkov, ako napríklad vitamínu E alebo N-acetylcysteinu [84,85] alebo liečbu protizápalovými liekmi typu NSAID, ACE-I [86] alebo statínmi. Stenvinkel et al [82] dokonca pripúšťajú možnosť cielenej anticytokínovej terapie či už solubilným receptorom TNFα (Etanercept) alebo antagonistom receptoru pre IL-1 (Anakinra), ktoré sa dnes obe používajú v iných indikáciách. Dôraz treba klásť aj na sanáciu možných infekčných fókusov (hlavne zubných, v oblasti ORL alebo skrytých infekcií zaniknutých dialyzačných prístupov), aj keď len oligosymptomatických. Syndróm MIA totiž má len časť pacientov so zlyhávaním ľadvín. Je teda dosť pravdepodobné, že bude vyvolávaný vonkajším dôvodom. V neposlednom rade je potreba zdôrazniť potrebu urovnania kalciofosfátového metabolizmu [87]. K tomuto účelu sa vyvinuli nové, nekalciové viazače fosfátov, napr. sevelamer (Renagel®) alebo lanthanum. Sevelamer, v porovnaní s kalciovým viazačom, signifikantne znižuje progresiu vaskulárnej kalcifikácie, znižuje početnosť hyperkalcemických epizód a efektívne znižuje hladinu fosforu [88,89]. Asmus et al dokonca zistili, že jeho dvojročné podávanie je asociované s nárastom trabekulárnej kostnej hmoty dolnej hrudnej časti chrbtice [88].
Záver
Syndróm MIAC prítomný u pacientov s ERDS je multifaktoriálnej etiológie a preto je ťažko ovplyvniteľný solitárnou terapeutickou intervenciou. Táto by preto mala byť komplexná a kontinuálna. Existuje mnoho solubilných faktorov, ktoré sa dajú stanovovať k určovaniu závažnosti, priebehu a ovplyvnenia terapiou. Medzi najsľubnejšie sa okrem albumínu a CRP momentálne zdajú fetuin-A, ADMA a LBP. Budú ale potrebné ďalšie štúdie, ktoré potvrdia ich význam a použiteľnosť v bežnej klinickej praxi.
Táto práce bola podporená grantovými projektmi IGA MZ ČR č.NR/9259-3, VZ MSM 0021620820, MSM 0021620819.
MUDr. Erik Mistrík
www.fnhk.cz
e-mail: erosito@gmail.com
Doručeno do redakce: 10. 2. 2007
Přijato po recenzi: 20. 4. 2007
Zdroje
1. Muntner P, He J, Hamm L et al. Renal insufficiency and subsequent death resulting from cardiovascular disease in the United States. J Am Soc Nephrol 2002; 13 : 745-753.
2. Foley RN, Parfrey PS, Sarnak MJ. Clinical epidemiology of cardiovascular disease in chronic renal disease. Am J Kidney Dis 1998; 32: S112-S119.
3. United States Renal Data System. Excerpts from the USRDS 2005 Annual Data Report: Atlas of End-Stage Renal Disease in the United States, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases. Am J Kid Dis 2006; 47(Suppl 1): 1-286.
4. Eknoyan G, Beck GJ, Cheung AK et al. Effect of dialysis dose and membrane flux in maintenance hemodialysis. N Engl J Med 2002; 347 : 2010-2019.
5. O’Hare AM, Bertenthal D, Shlipak MG et al. Impact of renal insufficiency on mortality in advanced lower extremity peripheral arterial disease. J Am Soc Nephrol 2005; 16 : 514-519.
6. Termorshuizen F, Dekker FW, van Manen JG et al. Relative Contribution of Residual Renal Function and Different Measures of Adequacy to Survival in Hemodialysis Patients: An analysis of the Netherlands Cooperative Study on the Adequacy of Dialysis (NECOSAD)-2. J Am Soc Nephrol 2004; 15 : 1061-1070.
7. Harris T, Cook EF, Garrison R et al. Body mass index and mortality among nonsmoking older persons. The Framingham Heart Study. JAMA 1988; 259 : 1520-1524.
8. Shea S, Cook EF, Kannel WB et al. Treatment of hypertension and its effect on cardiovascular risk factors: data from the Framingham Heart Study. Circulation 1985; 71 : 22-30.
9. Cheung AK, Sarnak MJ, Yan G et al. Atherosclerotic cardiovascular disease risks in chronic hemodialysis patients. Kidney Int 2000; 58 : 353-362.
10. Kalantar-Zadeh K, Block G, Humphreys MH et al. Reverse epidemiology of cardiovascular risk factors in maintenance dialysis patients. Kidney Int 2003; 63 : 793-808.
11. Kalantar-Zadeh K, Abbott KC, Salahudeen AK et al. Survival advantages of obesity in dialysis patients. Am J Clin Nutr 2005; 81 : 543-554.
12. Kalantar-Zadeh K Causes and consequences of the reverse epidemiology of body mass index in dialysis patients. J Ren Nutr 2005; 15 : 142-147.
13. Kalantar-Zadeh K, Kopple JD, Kilpatrick RD et al. Association of morbid obesity and weight change on cardiovascular survival in hemodialysis population. Nephrol Dial Transplant 2005; 20 : 1662-1669.
14. Stenvinkel P, Heimburger O, Paultre F et al. Strong association between malnutrition, inflammation, and atherosclerosis in chronic renal failure. Kidney Int 1999; 55 : 1899-1911.
15. Wang A, Woo J, Wai-Kei Lam C et al. Associations of serum fetuin-A with malnutrition, inflammation, atherosclerosis and valvular calcification syndrome and outcome in peritoneal dialysis patients. Nephrol Dial Transplant 2005; 20 : 1676-1685.
16. Papagianni A, Kokolina E, Kalovoulos M et al. Carotid atherosclerosis is associated with inflammation, malnutrition and intercellular adhesion molecule-1 in patients on continuos ambulatory peritoneal dialysis. Nephrol Dial Transplant 2004; 19 : 1258-1263.
17. Tripepi G, Mallamaci F, Zoccali C Inflammation Markers, Adhesion Molecules, and All-Cause and Cardiovascular Mortality in Patients with ESRD: Searching for the Best Risk Marker by Multivariate Modeling. J Am Soc Nephrol 2005; 16: S83-S88.
18. Tzoulaki I, Murray GD, Lee AJ et al. C-reactive protein, interleukin-6, and soluble adhesion molecules as predictors of progressive peripheral atherosclerosis in the general population: Edinburgh artery study. Circ 2005; 112 : 976-983.
19. Javaid K, Rahman A, Anwar KN et al. Tumor necrosis factor-α induces early-onset endothelial adhesivity by protein kinase Cζ - dependent activation of intercellular adhesion molecule-1. Circ Res 2003; 92 : 1089-1097.
20. Seyrek N, Balal M, Karayaylali I et al. Is there any relationship between serum levels of IL-10 and atherosclerosis in hemodialysed patients? Hemodial Int 2004; 8 : 90-91.
21. Malyszko J, Malyszko JS, Brzosko S et al. Adiponectin is related to CD146, a novel marker of endothelial cell activation/injury in chronic renal failure and peritoneally dialysed patients. J. Clin. Endocrinol. Metab 2004; 89 : 4620-4627.
22. Yano A, Nakao K, Sarai A et al. Elevated serum interleukin-18 levels might reflect the high risk of hospitalization in patients on peritoneal dialysis. Nephrology 2005; 10 : 576-582.
23. Zoccali C, Benedetto FA, Maas R et al. Asymmetric dimethylarginine, C-reactive protein, and carotid intima-media thickness in end stage renal disease. J Am Soc Nephrol 2002; 13 : 490-496.
24. Ketteler M, Bongartz P, Westenfeld R et al. Association of low fetuin-A (AHSG) concentrations in serum with cardiovascular mortality in patients on dialysis: A cross-sectional study. Lancet 2003; 361 : 827-833.
25. Himmelfarb J, Stenvinkel P, Ikizler TA et al. The elephant in uremia: oxidant stress as a unifying concept of cardiovascular disease in uremia. Kidney Int 2002; 62 : 1524-1538.
26. Locatelli F, Canaud B, Eckardt KU et al. Oxidative stress in end-stage renal disease: An emerging threat to patient outcome. Nephrol Dial Transplant 2003; 18 : 1272-1280.
27. Handelman GJ Current studies on oxidant stress in dialysis. Blood Purif 2003; 21 : 46-50.
28. Sies H Oxidative stress: Oxidants and antioxidants. Exp Physiol 1997; 82 : 291-295.
29. Descamps-Latscha B, Goldfarb B, Nguyen A et al. Establishing the relationship between complement activation and stimulation of phagocyte oxidative metabolism in hemodialyzed patients: A randomized prospective study. Nephron 1991; 59 : 279-285.
30. Ward RA, McLeish KR. Polymorphonuclear leukocyte oxidative burst is enhanced in patients with chronic renal insufficiency. J Am Soc Nephrol 1994; 5 : 1697-1702.
31. Morena M, Delbosc S, Dupuy AM et al. Overproduction of reactive oxygen species in end-stage renal disease patients: A potential component of hemodialysis associated inflammation; Hemodial Int 2005; 9 : 37-46.
32. Cristol JP, Canaud B, Rabesandratana H et al. Enhancement of reactive oxygen species production and cell surface markers expression during hemodialysis. Nephrol Dial Transplant 1994; 9 : 389-394.
33. Chen MF, Chang CL, Liou SY Increase in resting levels of superoxide anion in the whole blood of uremic patients on chronic hemodialysis. Blood Purif 1998; 16 : 290-300.
34. Stenvinkel P, Lindholm B, Heimburger O Novel approaches in an integrated therapy of inflammatory-associated wasting in end-stage renal disease. Semin Dial 2004; 17 : 505-515.
35. Endemann DH, Schiffrin EL Endothelial dysfunction. J Am Soc Nephro 2004; 15 : 1983-1992.
36. Annuk M, Zilmer M, Lind L et al. Oxidative stress and endothelial function in chronic renal failure. J Am Soc Nephrol 2001; 12 : 2747-2752.
37. Tauer A, Zhang X, Schaub TP et al. Formation of advanced glycation end products during CAPD. Am J Kidney Dis 2003; 41: S57-S60.
38. Zeier M, Schwenger V, Deppisch R et al. Glucose degradation products in PD fluids: Do they disappear from the peritoneal cavity and enter the systemic circulation? Kidney Int 2003; 63 : 298-305.
39. Schwenger V, Morath C, Salava A et al. Damage to the peritoneal membrane by glucose degradation products is mediated by the receptor for advanced glycation end-products. J Am Soc Nephrol 2006; 17 : 199-207.
40. Chung SH, Heimburger O, Stenvinkel P et al. Association between inflammation and changes in residual renal function and peritoneal transport rate during the first year of dialysis. Nephrol Dial Transplant 2001; 16 : 2240-2245.
41. Chung SH, Heimburger O, Stenvinkel P et al. Association between residual renal function, inflammation and patient survival in new peritoneal dialysis patients. Nephrol Dial Transplant 2003; 18 : 590-597.
42. Bolton CH, Downs LG, Victory JGG et al. Endothelial dysfunction in chronic renal failure, roles of lipoprotein oxidation and pro-inflammatory cytokines. Nephrol Dial Transplant 2001; 16 : 1189-1197.
43. Zoccali C, Mallamaci F, Tripepi G Atherosclerosis in dialysis patients: does Chlamydia pneumoniae infection contribute to cardiovascular damage? Nephrol Dial Transplant 2002; 17 (Suppl 8): 25-28.
44. Yao Q, Lindholm B, Stenvinkel P Inflammation as a cause of malnutrition, atherosclerotic cardiovascular disease, and poor outcome in hemodialysis patients. Hemodial Int 2004; 8 : 118-129.
45. Wiedermann CJ, Kiechl S, Dunzendorfer S et al. Association of endotoxemia with carotid atherosclerosis and cardiovascular disease. Prospective results from the Bruneck study. J Am Coll Cardiol 1999; 34 : 1975-1981.
46. Rice JB, Stoll LL, Li WG et al. Low level endotoxin induces potent inflammatory activation of human blood vessels: inhibition by statins. Arterioscler Thromb Vasc Biol 2003; 23 : 1576-1582.
47. Stoll LL, Denning GM, Li WG et al. Regulation of endotoxin-induced proinflammatory activation in human coronary artery cells: expression of functional membrane-bound CD14 by human coronary artery smooth muscle cells. J Immunol 2004; 173 : 1336-1343.
48. Schratzberger P, Kiechl S, Dunzendorfer S et al. Plasma-induced endothelial activation associated with incident atherosclerosis: prospective results from a large population study. Circulation 2001; 103 : 1064-1070.
49. Lehr HA, Sagban TA, Ihling C et al. Immunopathogenesis of atherosclerosis: endotoxin accelerates atherosclerosis in rabbits on hypercholesterolemic diet. Circulation 2001; 104 : 914-920.
50. Ostos MA, Recalde D, Zakin MM et al. Implication of natural killer T cells in atherosclerosis development during a LPS-induced chronic inflammation. FEBS Lett 2002; 519 : 23-29.
51. Stoll LL, Denning GM, Weintraub NL Potential role of endotoxin as a proinflammatory mediator of atherosclerosis. Arterioscler Thromb Vasc Biol 2004; 24 : 2227-2236.
52. Guttridge DC, Mayo MW, Madrid LV et al. NF-κB-induced loss of MyoD messenger RNA: Possible role in muscle decay and cachexia. Science 2000; 289 : 2363-2366.
53. Mitch WE, Du J, Bailey JL et al. Mechanisms causing muscle proteolysis in uremia: The influence of insulin and cytokines. Miner Electrolyte Metab 1999; 25 : 216-219.
54. Grunfeld C, Zhao C, Fuller J et al. Endotoxin and cytokines induce expression of leptin, the ob gene product, in hamsters. J Clin Invest 1996; 97 : 2152-2157.
55. Cheung W, Yu PX, Little BM et al. Role of leptin and melanocortin signaling in uraemia-associated cachexia. J Clin Invest 2005; 115 : 1659-1665.
56. Chudek J, Adamczak M, Kania M et al. Does plasma leptin concentration predict the nutritional status of hemodialyzed patients with chronic renal failure? Med Sci Monit 2003; 9: CR377-CR382.
57. Haluzík M, Sulková S, Svobodová J et al. Serum leptin levels in diabetic patients on hemodialysis : the relationship to parameters of diabetes metabolic control. Endocr Res 2000; 26 : 303-317.
58. Stenvinkel P, Heimburger O, Lindholm B et al. Are there two types of malnutrition in chronic renal failure? Evidence for relationships between malnutrition, inflammation and atherosclerosis (MIA syndrome). Nephrol Dial Transplant. 2000; 15 : 953-960.
59. Leskinen Y, Lehtimaki T, Loimaala A et al. Carotid atherosclerosis in chronic renal failure - the central role of increased plaque burden. Atherosclerosis 2003; 171 : 295-302.
60. Rohde LE, Lee RT, Rivero J et al. Circulating cell adhesion molecules are correlated with ultrasound - based assessment of carotid atherosclerosis. Arterioscler Thromb Vasc Biol 1998; 18 : 1765-1770.
61. van der Meer IM, de Maat MPM, Bots ML et al. Inflammatory mediators and cell adhesion molecules as indicators of severity of atherosclerosis. The Rotterdam Study. Arterioscler Thromb Vasc Biol 2002; 22 : 838-842.
62. London G, Marchais S, Guerin A et al. Arterial structure and function in end-stage renal disease. Nephrol Dial Transplant 2002; 17 : 1713-1724.
63. Smržová J. Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin. I. Etiopatogeneze, důsledky a diagnostika. Vnitř Lék 2005; 51 : 327-335.
64. Giachelli CM, Jono S, Shioi A et al. Vascular calcification and inorganic phosphate. Am J Kidney Dis 2001; 38 : 34-37.
65. Giachelli CM Vascular calcification mechanisms. J Am Soc Nephrol 2004; 15 : 2959-2964.
66. Luo GDP, McKee MD, Pinero GJ et al. Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein. Nature 1997; 386 : 78-81.
67. Fiore CE, Celotta G, Politi GG et al. Association of high α2-Heremans-Schmid glycoprotein/fetuin concentration in serum and intima-media thickness in patients with atherosclerotic vascular disease and low bone mass. Atherosclerosis 2006; doi:10.1016/j.atherosclerosis.2006.08.052.
68. Hunt JL, Fairman R, Mitchell ME et al. Bone formation in carotid plaques: A clinicopathological study. Stroke 2002; 33 : 1214-1219.
69. Mohler ER 3rd, Gannon F, Reynolds C et al. Bone formation and inflammation in cardiac valves. Circulation 2001; 103 : 1522-1528.
70. Bostrom K, Watson KE, Horn S et al. Bone morphogenic protein expression in human atherosclerotic lesions. J Clin Invest 1993; 91 : 1800-1809.
71. Proudfoot D, Skepper JN, Hegyi L et al. Apoptosis regulates human vascular calcification in vitro: Evidence for initiation of vascular calcification by apoptotic bodies. Circ Res 2000; 87 : 1055-1062.
72. Huber SA, Sakkinen P, Conze D et al. Interleukin-6 exacerbates early atherosclerosis in mice. Arterioscler Thromb Vasc Biol 1999; 19 : 2364-2367.
73. Harris TB, Ferrucci L, Tracy RP et al. Associations of elevated interleukin-6 and C-reactive protein levels with mortality in the elderly. Am J Med 1999; 106 : 506-512.
74. Huo Y, Hafezi-Moghadam A, Ley K Role of vascular cell adhesion molecule-1 and fibronectin connecting segment-1 in monocyte rolling and adhesion on early atherosclerotic lesions. Circ Res 2000; 87 : 153-159.
75. Pawlak K, Pawlak D, Brzosko S et al. Carotid atherosclerosis is associated with enhanced β-chemokine levels in patients on continuos ambulatory peritoneal dialysis. Atherosclerosis 2006; 186 : 146-151.
76. Kalousová M, Kielstein JT, Hodková M et al. No benefit of hemodiafiltration over hemodialysis in lowering elevated levels of asymmetric dimethylarginine in ESRD patients. Blood Purificat 2006; 24 : 439-444.
77. Vallance P. Importance of asymmetric dimethylarginine in cardiovascular risk. Lancet 2001; 358 : 2096-2097.
78. Kielstein JT, Boeger RH, Bode-Boeger SM et al. Asymmetric dimethylarginine plasma concentrations differ in patients with end stage renal disease: Relationship to treatment method and atherosclerotic disease. J Am Soc Nephrol 1999; 10 : 594-600.
79. Fliser D, Kronenberg F, Kielstein JT et al. Asymmetric dimethylarginine and progression of chronic kidney disease: The mild to moderate kidney disease study. J Am Soc Nephrol 2005; 16 : 2456-2461.
80. Vallance P, Leiper J Asymmetric dimethylarginin and kidney disease - marker or mediator? J Am Soc Nephrol 2006; 16 : 2254-2256.
81. Stenvinkel P Inflammation in end-stage renal disease: The hidden enemy. Nephrology 2006; 11 : 36-41.
82. Stenvinkel P, Lindholm B, Heimbuerger O Novel approaches in an integrated therapy of inflammatory-associated wasting in end-stage renal disease. Semin dial 2004; 17 : 505-515.
83. Kalantar-Zadeh K Recent advances in understanding the malnutrition-inflammation-cachexia syndrome in chronic kidney disease patients: What is next? Semin Dial 2005; 18 : 365-369.
84. Boaz M, Smetana S, Weinstein T et al. Secondary prevention with antioxidants of cardiovascular disease in end stage renal disease (SPACE): randomised placebo-controlled trial. Lancet 2000; 356 : 1213-1218.
85. Tepel M, van der Giet M, Statz M et al. The antioxidant acetylcysteine reduces cardiovascular events in patients with end-stage renal failure. Circulation 2003; 107 : 992-995.
86. Mann JF, Gerstein HC, Pogue J et al. Renal insufficiency as a predictor of cardiovascular outcomes and the impact of ramipril: the HOPE randomized trial. Ann Intern Med 2001; 134 : 629-636.
87. Smržová J Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin. II. Léčba. Vnitř Lék 2005; 51 : 337-344.
88. Asmus HG, Braun J, Krause R et al. Two year comparison of sevelamer and calcium carbonate effects on cardiovascular calcification and bone density. Nephrol Dial Transplant 2005; 20 : 1653-1661.
89. Chertow GM, Burke SK, Raggi P Sevelamer attenuates the progression of coronary and aortic calcification in hemodialysis patients. Kidney Int 2002; 62 : 245-252.
90. Kalantar-Zadeh K, Ikizler A, Block G et al. Malnutrition-inflammation complex syndrome in dialysis patients: causes and consequences.Am J Kid Dis 2003; 42 : 864-881.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence - editorial
- Rituximab (antiCD20 monoklonální protilátka) a molekulárně biologická negativita po léčbě nemocných s folikulárním lymfomem - cesta k vyléčení? - editorial
- Plicní alveolární proteinóza – minulost a přítomnost – editorial
- Lékové stenty - pro všechny, pro někoho, či pro nikoho? - editorial
- Změny metabolizmu lipidů u pacientů v aktivní fázi Crohnovy choroby
- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence
- Dosažení Bcl-2/IgH negativity v periferní krvi/kostní dřeni po léčbě je u nemocných s folikulárním lymfomem spojeno s lepší prognózou onemocnění
- Vliv terapie statiny na změny kostní denzity postmenopauzálních žen
- Analýza vlivu cirkadiánního rytmu na turbulenci srdeční frekvence u pacientů bez průkazu organického onemocnění srdce
- Plicní alveolární proteinóza
- Pozdní trombóza koronárního stentu a klopidogrel
- Syndróm MIAC (malnutrition, inflammation, atherosclerosis, calcification)
- Pseudomembranózní kolitida
- Inkretinová strategie léčby diabetes mellitus 2. typu - inhibitor DPP-IV sitagliptin
- Přínos ibandronátu pro léčbu postmenopauzální osteoporózy
- Chronická exsudativní benigní perikarditida - popis familiárního výskytu: kazuistiky
- Efekt transplantace ledvin na oxidační stres u pacientů s chronickým selháním ledvin
- Výsledky studie ADVANCE
- Kutnohorská J. Etika ve zdravotnictví.
- Škubla P. Veľký atlas húb
- Grofová Z. Nutriční podpora. Praktický rádce pro sestry.
- Krajíček M, Peregrin JH, Roček M, Šebesta P et al. Chirurgická a intervenční léčba cévních onemocnění.
- Prof. MUDr. Petr Broulík, DrSc., sedmdesátníkem
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Pseudomembranózní kolitida
- Plicní alveolární proteinóza
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



