-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv terapie statiny na změny kostní denzity postmenopauzálních žen
The impact of statin therapy on bone density changes in postmenopausal women
Generalised use of statins in primary and secondary prevention of ischemic heart disease has led in recent years to the discovery of a number of other „pleiotropic“ effects of statins. One of them is the effect of statins on bone metabolism. The objective of the study was to monitor bone density, bone turnover markers and basic biochemical parameters in a group of postmenopausal women at regular intervals for a period of 2 years. The monitoring allowed for an assessment of the effect of statin therapy on those parameters. Statin therapy safety was also monitored. According to expectations, the group receiving active treatment recorded a decrease in the levels of total cholesterol, as well as LDL-cholesterol, and a mild decrease in the level of triacylglycerols. However, no significant difference in bone density in any of the measured regions (NECK, TROCH, SHAFT) was found when the trends in bone density parameters were compared for the two groups, nor there was a significant change in the respective T-scores. There was no significant difference with respect to the markers of bone formation or the markers of bone resorption between the group with active treatment and the control group. The results correspond to inconsistent data from the performed and quoted retrospective and prospective studies.
Keywords:
statins – bone density – bone turnover – osteoporosis
Autoři: P. Švejda 1; V. Soška 2; M. Souček 1
Působiště autorů: II. interní klinika Lékařské fakulty MU a FN u sv. Anny, Brno, přednosta doc. MUDr. Miroslav Souček, CSc. 1; Oddělení klinické biochemie FN u sv. Anny, Brno, přednosta doc. MUDr. Vladimír Soška, CSc. 2
Vyšlo v časopise: Vnitř Lék 2007; 53(10): 1064-1070
Kategorie: Původní práce
Souhrn
Rozšířené užívání statinů v primární i sekundární prevenci ischemické choroby srdeční vedlo v posledních letech ke zjištění jejich mnohých dalších, tak zvaných pleiotropních účinků. Jedním z nich je vliv na kostní metabolizmus. Cílem práce bylo sledování kostní denzity, markerů kostního obratu a základních biochemických parametrů u skupiny postmenopauzálních žen v pravidelných intervalech po dobu celkově 2 let. Sledování umožnilo hodnocení vlivu terapie statiny na tyto parametry. Současně byla sledována také bezpečnost terapie statiny. Dle očekávání došlo v aktivně léčené skupině k poklesu hladiny celkového cholesterolu i LDL-cholesterolu, mírně i hladiny triacylglycerolů. Při porovnávání vývoje kostních denzit v obou skupinách však nebyl zjištěn signifikantní rozdíl v kostní denzitě v žádné z měřených lokalit (NECK, TROCH, SHAFT), rovněž nedošlo k signifikantním změnám příslušných T-skóre. Markery kostní novotvorby ani markery kostní resorpce se signifikantně nelišily v žádném sledovaném období mezi aktivně léčenou a kontrolní skupinou. Výsledky odpovídají nekonzistentním datům provedených a citovaných retrospektivních i prospektivních studií.
Klíčová slova:
statiny - kostní denzita - kostní obrat - osteoporózaÚvod
Osteoporóza je nejčastějším metabolickým kostním onemocněním a představuje závažný zdravotní a sociální problém zvláště ve vyšších věkových skupinách. Je důsledkem nerovnováhy kostní přestavby ve smyslu převažující resorpce nad novotvorbou kostní tkáně. Důsledkem je pokles obsahu kostního minerálu, pravděpodobně i narušení organické kostní matrice. Dochází k úbytku kostní hmoty a ztrátě její kvality především v trabekulární kosti. Ztenčení kostních trámců a jejich přerušení vede ke změně architektury, ztrátě mechanické pevnosti kosti a zvýšenému riziku zlomenin.
Vliv statinů na osteoporózu
V literatuře jsou popisovány dva možné mechanizmy, které mohou vysvětlit účinek statinů na kost [2]. Prvním z nich je inhibice produkce mevalonátu. Vychází ze zjištění, že syntéza cholesterolu a aktivace osteoklastů probíhá ve stejné biochemické kaskádě (schéma 1). Nejprve je 3-hydroxy-3-methyl-glutaryl-CoA (HMG-CoA) konvertován na mevalonát enzymem HMG-CoA reduktázou (který statiny inhibují) [16]. Dále je mevalonát konvertován na geranyl pyrofosfát, který se dále mění na farnesyl pyrofosfát enzymem syntázou farnesyl pyrofosfátu (který inhibují bisfosfonáty). Dále vzniká skvalen a výsledně cholesterol [32].
Schéma. Syntéza cholesterolu a aktivace osteoklastů využívají stejnou metabolickou cestu. 
Osteoklasty užívají molekuly farnesyl pyrofosfátu a geranylgeranyl pyrofosfátu (tvorba z farnesyl pyrofosfátu) k aktivaci klíčových intracelulárních proteinů - glutamyl transpeptidáz a guanosintrifosfatáz (GTP-áz) v procesu zvaném prenylace [37]. Bisfosfonáty inhibují enzymovou aktivitu farnesyl pyrofosfát syntázy [34], aby zabránily tvorbě těchto lipidových produktů [21].
Pokud jsou osteoklasty vystaveny působení statinů nebo bisfosfonátů, podléhají apoptóze. Kostní remodelace je redukována, kostní resorpce klesá a rovnováha kostní resorpce a formace je obnovena. Tento proces redukuje incidenci fraktur spojených s fragilitou kosti [6,9,23].
Druhým mechanizmem účinku statinů na kost je aktivace morfogenetického proteinu 2. Jde o růstový faktor, který způsobuje proliferaci osteoblastů, a tím vytváření nové kosti [12,25]. Tento efekt byl prvně pozorován u lovastatinu, odvozeného od houby Aspergillus terreus [1,29]. Když byl lovastatin podáván nově narozeným experimentálním myším 3krát denně po dobu 5 dní, kostní objem se zvýšil o 50 % proti placebu [25]. Podobný efekt byl zjištěn u fluvastatinu, simvastatinu a mevastatinu, které specificky zvyšovaly expresi kostního morfogenetického proteinu 2 ribonukleové kyseliny (RNA) a více než zdvojnásobily produkci kostního morfogenetického proteinu 2 buňkami podobnými osteoblastům (osteoblast-like cells) in vitro. Další studie ukázaly, že ovariektomované krysy (model postmenopauzální osteoporózy), kterým byl podán perorálně simvastatin, měly vyšší objem trabekulární kosti o 39-94 % [25].
Ukazatele kostní přestavby
Dynamiku kostní přestavby je možno sledovat pomocí ukazatelů kostní přestavby [13,18,30]. Je možno sledovat jednak aktivitu enzymů, které přímo či nepřímo odrážejí aktivitu buněk a struktur, zapojených do kostní remodelace, jednak substráty, které jsou inkorporovány do novotvořené kosti nebo uvolňované při její degradaci. Sledované laboratorní parametry se obvykle dělí na:
I. skupinu odrážející novotvorbu kostní tkáně, ke které patří:
- aktivita alkalické fosfatázy (ALP): jde o klasický ukazatel s poměrně vysokou citlivostí, ale malou specifitou, vzhledem k několika izoenzymům, ze kterých celková aktivita ALP sestává, výhodnější se tedy jeví vyšetření těchto izoenzymů;
- aktivita kostního izoenzymu alkalické fosfatázy (ALP-K) v krevním séru: ukazatel daleko citlivější a specifičtější, který je jedním z nejlepších ukazatelů kostní novotvorby;
- koncentrace osteokalcinu v krevním séru. Osteokalcin, jeden z nejvýznamnějších nekolagenních proteinů kostní matrice, je při novotvorbě kostní tkáně částečně uvolňován do systémové cirkulace. Tento ukazatel patří k nejlepším markerům kostní novotvorby, jeho vypovídací hodnota je ovlivněna velkou intra - i interindividuální variabilitou. Ze současných metodik je nutno dávat přednost metodám s dvěma protilátkami se stanovením N-mid fragmentu;
- koncentrace C-terminálního propeptidu prokolagenu I (PICP), který je uvolňován do systémové cirkulace při tvorbě kolagenu typu I. Tento ukazatel je poměrně specifický pro novotvorbu kosti, je však málo citlivý. S výhodou je možno jej využít u osteoporózy s vazbou ke zvýšené tvorbě či podávání kortikoidů [22];
- jiné markery, např. N-terminální propetid prokolagenu a další.
II. skupinu odrážející degradaci kostní tkáně, ke které patří:
- stanovení koncentrace hydroxyprolinu v moči, které je však dle současných podmínek již nutno považovat za vysoce nespecifické, ovlivněné kolagenem ve stravě a mnoha procesy v organizmu (zvýšená aktivizace komplementu atp) [31];
- stanovení koncentrace (absolutní či relativní - vztažené na koncentraci kreatininu) pyridinolinu a deoxypyridinolinu v moči (DEOX/U); v obou případech jde o chemické struktury, pocházející z příčnovazebných elementů kolagenu. Pyridinolin může pocházet i z jiných kolagenních struktur, deoxypyridinolin je typický pro kolagen typu I, který je pro kost specifický. V moči se vyskytuje ve formě vázané a volné, která je předpokládána ve 40 % z celkového množství;
- stanovení C - a N-terminálního telopeptidu kolagenu v séru či moči; telopeptidy se uvolňují při degradaci kolagenu typu I;
- ostatní parametry, jako stanovení koncentrace hydroxylyzinu v moči, jsou zaváděny a mohou být přínosné.
U všech laboratorních metod je nutno uvažovat vysokou intra - a interindividuální variabilitu, která komplikuje výpovědní hodnotu v čase. Pro sledování významnosti změn hodnot je nutno počítat s hodnotami „kritických diferencí měření“, která tyto faktory zohledňuje a obvykle se pohybuje mezi 20-50 %.
Cíl práce
Cílem práce bylo posoudit možnost ovlivnění osteologických parametrů u žen v postmenopauzálním věku podáváním statinů za pravidelného sledování laboratorních markerů kostního obratu a měření kostní denzity.
Metodika
Soubor pacientů
Do studie jsme zařadili pacientky v postmenopauzálním věku, které byly vyšetřovány či léčeny na ambulanci II. interní kliniky v letech 2002-2003. Byly zařazeny pacientky, u nichž byl předpoklad pokračování v ambulantním sledování po dobu 2 let a schopnost samostatného docházení na kontroly.
Pacientky jsme rozdělili do 2 skupin. První skupinu tvořily pacientky, u nichž byla vzhledem k jejich hladině cholesterolu a kardiovaskulárnímu riziku indikována terapie statiny. Druhou, kontrolní skupinu, tvořily pacientky, jejichž kardiovaskulární riziko či přidružená onemocnění nevyžadovaly terapii statiny.Všech 50 pacientek dokončilo 2leté sledování, z toho 31 ve skupině aktivně léčené a 19 ve skupině kontrolní (tab. 1).
Tab. 1. Pacientky zařazené do studie – základní údaje. 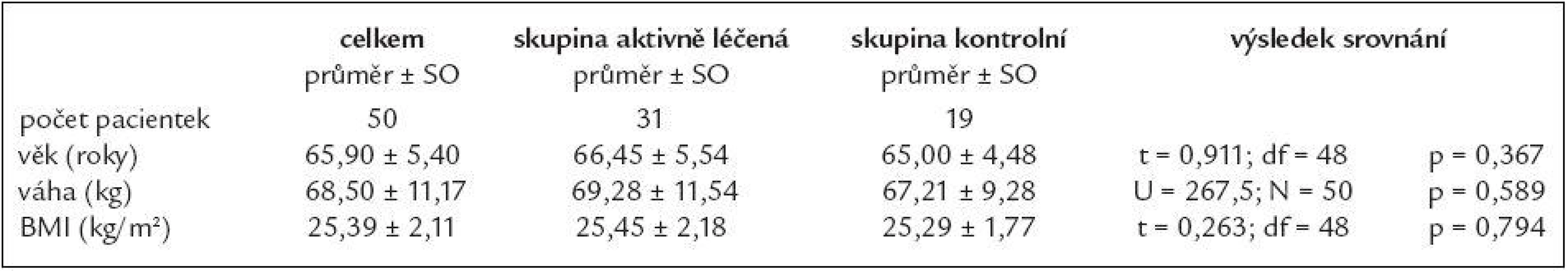
SO – směrodatná odchylka Pracovní postup
Rozhodli jsme se pro prospektivní studii se simvastatinem v dávce 20 mg denně, která byla obvyklá v době náboru pacientek do studie (nyní je obecně tendence podávat dávky statinů vyšší). Volba simvastatinu padla z toho důvodu, že jde o nejčastěji užívaný statin v České republice (nyní se na čelné místo dostává atorvastatin), statin, jehož efektivita v sekundární prevenci i bezpečnost byly prověřeny v mnoha velkých studiích (Scandinavian Simvastatin Survival Study, Heart Protection Study), statin vyskytující se kromě originálu i v největším množství generik [7]. Dávka 20 mg denně byla základní doporučovaná dávka tohoto preparátu v době náboru pacientek do studie. Z důvodu možného kolísání bioekvivalence u jednotlivých generik jsme se rozhodli používat výhradně originální simvastatin - Zocor 20 mg® firmy Merck Sharp & Dohme denně ve večerních hodinách [28].
U obou skupin pacientek byly prováděny laboratorní odběry a denzitometrická vyšetření v pravidelných intervalech.
Metody a vyšetření
Byly vyšetřovány tyto laboratorní parametry:
Krevní lipidy: celkový cholesterol, HDL-cholesterol, LDL-cholesterol, triacylglyceroly.
Ukazatele související s kostním metabolizmem: kalcium, fosfor, alkalická fosfatáza, kostní izoenzym alkalické fosfatázy, parathormon, osteokalcin, C-terminální propeptid prokolagenu I, odpad kalcia v moči za 24 hod, deoxypyridinolin v moči.
Všechny analýzy byly stanoveny před zahájením sledování, po 1 roce a po 2 letech.
Denzitometrická vyšetření byla prováděna u všech pacientek v ročních intervalech, tedy v měsících 0, 12 a 24. Všechna vyšetření byla prováděna na celotělovém denzitometru Hologic QDS 4500. Byly hodnoceny parametry denzity kosti stehenní: SHAFT - denzita v oblasti diafýzy femuru pod velkým trochanterem; NECK - denzita v oblasti krčku femuru; TROCH - denzita v oblasti velkého trochanteru.
Většina z měřených parametrů neměla normální rozložení hodnot, a proto nemohly být ke statistickému srovnání použity parametrické testy. Ke srovnání hodnot mezi aktivně léčenou a kontrolní skupinou použit neparametrický Mannův-Whitneyův U test. Ze stejného důvodu byl ke srovnání hodnot parametrů v měsících 0 a 24 použit neparametrický test, Wilcoxonův párový test. Ke zhodnocení vztahů mezi hladinou celkového a LDL-cholesterolu a markery kostního obratu (alkalická fosfatáza a její kostní izoenzym, deoxypyridinolin v moči, osteokalcin, C-terminální propetid prokolagenu I, parathormon, kalcium v moči za 24 hod) i parametrů kostní denzity (NECK, TROCH, SHAFT a jejich T-skóre) byla použita neparametrická Spearmanova korelace.
Výsledky
U markerů kostního novotvorby (kostní izoenzym alkalické fosfatázy, osteokalcin, C-terminální propetid prokolagenu I) byly v aktivně léčené skupině zjištěny vyšší hodnoty na začátku než na konci léčby, všechny změny dosahovaly statistické významnosti. V kontrolní skupině se markery novotvorby statisticky významně neměnily. Z markerů kostní resopce statisticky významně pokleslo v aktivně léčené skupině vylučování deoxypyridinolinu močí, zatímco hodnota kalcia v moči za 24 hod se nepatrně zvýšila. V kontrolní skupině nedošlo ke statisticky významným změnám ani v jednom z uvedených parametrů.
Parametry kostní denzity byly v léčené i kontrolní skupině na konci 2letého sledování statisticky významně nižší než na jeho počátku. Proto nemůžeme hodnotit změny těchto parametrů v čase u aktivně léčené skupiny na základě léčby hypolipidemiky.
U parametrů kostní denzity byla hodnocena změna ve stavu během 2 let. Cílem bylo zjistit, zda u parametrů, u nichž dochází ke změně hodnot (poklesu) v obou skupinách (kontrolní i aktivně léčené) je změna v aktivně léčené skupině výraznější, rychlejší (větší) nebo pomalejší. Bylo zjištěno, že velikost změny, ke které dochází u parametrů kostní denzity během 2 let, se mezi aktivně léčenou a kontrolní skupinou neliší.
Hladiny lipidů (celkový cholesterol, triacylglyceroly a LDL-cholesterol) byly u pacientů v aktivně léčené skupině statisticky významně nižší na konci sledování než na jeho počátku, zatímco v kontrolní skupině k jejich změně téměř nedošlo.
Prokázali jsme negativní korelaci mezi hladinou celkového cholesterolu a hodnotou osteokalcinu, a to jak na začátku sledování, kdy byla statisticky významná, tak i po 1. roce, ovšem bez statistické významnosti.
Diskuse
Zjistili jsme, že hodnoty hladin celkového cholesterolu a LDL-cholesterolu, které byly na počátku sledování vyšší v aktivně léčené skupině, zde také při terapii simvastatinem statisticky významně klesaly a v průběhu sledování dosáhly menších hodnot než ve skupině kontrolní - statiny neléčené. Tím se jen prokázal efekt zavedené hypolipidemické terapie, u pacientek bez terapie byla hladina celkového cholesterolu a LDL-cholesterolu bez signifikantních změn. Hladina triacylglycerolů po 2 letech v aktivně léčené skupině mírně klesá, což je rovněž dáno vlivem statinu užívaného v terapii kombinované dyslipidemie, ač je specifickým léčebným opatřením u hypertriglyceridemie terapie fibráty [3].
Vliv statinů na kostní denzitu je zatím nejednoznačný. Několik studií popisuje zvýšení kostní denzity. Chung et al [14] v retrospektivní studii zjistili, že užívání statinu bylo spojeno s vyšší kostní denzitou u mužů - diabetiků 2. typu. Z 69 pacientů 36 dostávalo simvastatin, pravastatin nebo lovastatin, 33 bylo bez terapie statiny. U pacientů, kteří užívali statin, kostní denzita krčku femuru po 15 měsících signifikantně stoupla, v kontrolní skupině kostní denzita ve srovnatelném období signifikantně poklesla. Bauer et al [4] v analýzách dat ze studií SOF (Study of osteoporotic fractures) a FIT (Fracture Intervention Trial) zjistili, že ženy užívající statiny, ale ne ostatní hypolipidemika, měly vyšší kostní denzitu, třebaže asociace nedosáhla statistické významnosti. Edwards et al [8] ve Velké Británii sledovali kostní denzitu krčku femuru a páteře u 41 postmenopauzálních žen užívajících statiny a u 100 kontrol po dobu 4 let. 51 % léčených užívalo simvastatin, 24 % pravastatin, 15 % atorvastatin a 10 % fluvastatin. Kostní denzita byla statisticky vyšší u pacientů užívajících statin a byl signifikantní rozdíl po adjustaci na věk, výšku a váhu. Watanabe et al [36] srovnali efekt fluvastatinu a pravastatinu u postmenopauzálních žen. Po 1 roce žádná z těchto látek nezvyšovala kostní denzitu celotělově, ale kostní denzita lumbální páteře vzrostla o 1 % ve fluvastatinové skupině, naproti tomu poklesla o 2 % ve skupině pravastatinové.
Na rozdíl od těchto studií [4,8,14,36] došlo v našem sledování shodně k signifikantnímu poklesu kostní denzity ve všech sledovaných projekcích (NECK, TROCH, SHAFT), ať už vyjádřeno absolutním číslem či pomocí T-skóre, jak ve skupině aktivně léčené, tak i ve skupině kontrolní. Pokles kostních denzit v jednotlivých lokalitách si tedy vysvětlujeme jako přirozenou progresi osteoporotického procesu postmenopauzálních žen, neovlivněnou terapií statiny. V případě, že by některá z pacientek v průběhu sledování dosáhla hodnot denzity, resp. T-skóre, které by odpovídaly nutnosti specifické terapie osteoporózy dle platných doporučení, byla by vyřazena ze sledování a léčena lege artis. K této situaci však nedošlo. V některých publikovaných studiích [24,35] byla nalezena zvýšená kostní denzita při dlouhodobé terapii thiazidovými diuretiky ve srovnání s pacienty bez této terapie. V našem sledování jsme tomuto faktoru nevěnovali pozornost, mohl jím však být u starších, často polymorbidních pacientek ovlivněn.
V naší studii nebyl sledován výskyt diabetu. U diabetu je několik faktorů, které mohou kostní metabolizmus ovlivňovat. Kostní denzita u pacientů s diabetem 1. typu je nižší než u zdravých lidí, naproti tomu hyperinzulinemie a relativně vyšší body mass index pacientů s diabetem 2. typu se zdá být ochranným faktorem proti úbytku kostní hmoty [20]. U diabetu 2. typu je však současně popisováno i snížení aktivity osteoblastů [15]. Je zde i podíl u těchto pacientů obvyklé dyslipidemie, u které je dle prací Parhamiho nižší kostní denzita dána inhibicí diferenciace osteoblastů oxidovaným LDL-cholesterolem i hyperlipidemií samou [26,27].
Osteoporóza je charakterizována narušením vztahu syntézy a resorpce kostní hmoty, tedy převážením procesu resorpce [30]. U mnoha starších postmenopauzálních žen je častěji postižena novotvorba, zatímco resorpce zůstává nezměněna [18]. Pokud resorpce převáží nad novotvorbou, stav směřuje k osteoporóze. Co se týče kostní novotvorby v našem sledování, u kostního izoenzymu alkalické fosfatázy dochází v aktivně léčené skupině k postupnému snižování hodnot v měsíci 12 a ještě více v měsíci 24, zatímco ve skupině kontrolní jeho hladina mírně narostla. Podobnou křivku vykazuje i méně specifická hladiny celkové alkalické fosfatázy. Závěr z těchto ukazatelů je tedy zpomalení novotvorby v aktivně léčené skupině ve srovnání se skupinou kontrolní.
U pacientek jsme nesledovali výskyt diabetu, nicméně ve skupině aktivně léčené bylo vyšší zastoupení polymorbidních pacientek, lze zde tedy předpokládat jak vliv diabetu, u něhož je snížení aktivity osteoblastů popisováno [15], tak i vliv samotné dyslipidemie, pro kterou jsou pacientky léčeny. Zde je diferenciace osteoblastů inhibována oxidovaným LDL-cholesterolem [26,27]. Osteoporóza neléčená bisfosfonáty má normální hodnoty osteokalcinu. V naší studii došlo k mírnému snížení hodnoty v obou skupinách. Naše výsledky tedy nepodporují hypotézu, že statiny vykazují anabolický účinek na kost. C-terminální propeptid prokolagenu I (PICP) je ukazatelem funkce osteoblastů, ale na rozdíl od N-terminálního propeptidu (PINP) není jeho sérová koncentrace ovlivňována funkcí ledvin. Jeho hlavní indikací je monitorování terapie osteoporózy bisfosfonáty, jeho výše se považuje za míru kostní novotvorby. Mírný pokles hodnot v aktivně léčené skupině tedy nesvědčí pro kostní novotvorbu. Ani jeden z formativních kostních markerů tedy nepodporuje hypotézu [25], že statiny stimulují kostní novotvorbu.
Ve složce kostní resorpce došlo v průběhu 24 měsíců ke statisticky významnému poklesu deoxypyridinolinu v moči v aktivně léčené skupině, zatímco v kontrolní skupině ke změně hladiny nedošlo. Snížení deoxypyridinolinu v moči odpovídá snížené aktivitě osteoklastů, tedy sníženému odbourávání kostní hmoty. Hodnota je ale značně ovlivněna spoluprací pacienta při sběru moči za 24 hod. Zdá se, že na změně hladiny deoxypyridinolinu v moči by mohla mít terapie statiny svůj podíl. Sběr kalcia v moči za 24 hod je jistě do velké míry ovlivněn dietou a správným odběrem vzorku ze strany pacienta. Membránou glomerulu prochází do tubulární tekutiny jen ionizované kalcium a kalcium vázané na komplexy s anionty. U zdravých jedinců je 98 % filtrovaného kalcia resorbováno zpět tubuly ledviny a jen 2 % se vyloučí močí. Zpětná resorpce je regulována parathormonem, který renální resorpci v tubulu zvyšuje [5]. Na počátku našeho sledování bylo v obou skupinách nalezeno srovnatelné vylučování kalcia močí, během 24měsíčního sledování jsme v kontrolní skupině zaznamenali výraznější progresi kalciurie proti skupině aktivně léčené, hodnoty však nedosáhly statistické významnosti. Některé práce [15] se zabývají vztahem diabetu a kalciurie. Hyperglykemie a proteinurie mohou způsobit progresi kalciurie a současně snížit kostní novotvorbu osteoblasty.
V průběhu sledování se u obou skupin shodně nesignifikantně zvýšila hladina parathormonu. Zvýšená hladina parathormonu se objevuje u sekundární či primární hyperparatyreózy, již jsme chtěli vstupním vyšetřením hladiny vyloučit. U podezření na hyperparatyreózu by se objevily abnormálně vysoké hladiny [5], které jsme však nezaznamenali. Sérová koncentrace parathormonu se postupně zvyšuje se stoupajícím věkem. Mírné zvyšování hladin parathormonu v obou skupinách, aktivně léčené i kontrolní tedy nebyla ovlivněna podáváním statinů. Hypotézu antiresopčního působení statinů by potvrzovala zvýšená hladina parathormonu v aktivně léčené skupině. Tato zvýšená hladina parathormonu se uvádí jako odezva na antiresorpční terapii bisfosfonáty [10]. Je jasné, že snížená kostní resorpce během antiresorpční terapie redukuje uvolňování kalcia z kosti s následnou stimulací sekrece parathormonu.
Závěr
Naše data nepodporují tezi, že užívání statinů je spojeno s pozitivním ovlivněním kostní denzity postmenopauzálních žen. Naše pacientky neměly vyjádřenou osteoporózu (tedy vstupní T-skóre pod -2,5, při němž by zasluhovaly specifickou antiporotickou terapii) a byly léčeny statiny v souvislosti s dyslipidemií. U vyjádřené osteoporózy by mohl být pozitivní efekt statinů vyjádřen lépe. U pacientek jsme nesledovali užívání další medikace. U pacientek ve statinové řadě, které byly jistě z kardiovaskulárního hlediska rizikovější než ve skupině kontrolní, však mohla mít předpokládaná bohatší medikace vliv i na kostní obrat [32]. Můžeme se rovněž domnívat, že dyslipidemie je častěji sdružena s vyšším body mass indexem – v tomto případě hraje tuková tkáň roli protektora proti rozvoji osteoporotického procesu. Budoucí studie by jistě měly obsahovat zohlednění body mass indexu, protože obezita stojí často na počátku vzniku přidružených chorob a rizik, které vedou k užívání statinů.
Jsme si vědomi rozdílnosti efektu různých statinů jak na ovlivnění dyslipidemie [7], tak kostní denzity [8,14,36]. Mnoho prací jen sleduje, zda pacient užíval statin, či nikoliv a nezohledňuje jeho typ a dávku. Naši pacienti byly z dnešního pohledu i z hlediska ovlivnění dyslipidemie a rizikových faktorů „poddávkováni“, navíc víme, že k ovlivnění kostní denzity je třeba dávek podstatně vyšších než v hypolipidemické indikaci [9,19]. Mundy et al [25] v jejich experimentálních studiích užívali 10krát vyšší dávky než jsou běžně užívané u dyslipidemie. Běžné statiny směřují do jater, kde probíhá většina syntézy cholesterolu a méně než 5 % podané dávky dosahuje systémové cirkulace [11]. Samozřejmě dávkování a bezpečnost statinů v léčbě hyperlipidemie se řídí jejich selektivním působením v játrech. Naše 2leté sledování bylo jistě z hlediska možného ovlivnění osteoporotického procesu krátké. Abychom dosáhli signifikantního ovlivnění osteoklastů, je třeba dlouhodobého podávání statinů. V naší studii nebyla hodnocena fyzická aktivita, třebaže víme, že je spojena s nižším rizikem fraktur.
Je třeba vyčkat velkých randomizovaných prospektivních studií na posouzení efektu statinů na ovlivnění procesu osteoporózy a vyloučit i možnost ovlivnění hodnocení dalšími dosud nesledovanými faktory. Není jasná ani vhodná délka podávání a dávka statinu, z experimentálních studií je však zřejmé, že dávka bude muset být výrazně vyšší než pro terapii běžné hypercholesterolemie. Terapie statiny jistě nevytěsní specifickou terapii osteoporózy, může však působit synergicky. Pokud bude podávána samostatně i v jiné indikaci, může oddálit nástup projevů osteoporózy či zpomalit její progresi.
MUDr. Petr Švejda
www.fnusa.cz
e-mail: petr.svejda@fnusa.cz
Doručeno do redakce: 10. 3. 2007
Přijato po recenmzi: 11. 5. 2007
Zdroje
1. Alberts AW, Chen J, Kuron G et al. Mevinolin: a highly potent competitive inhibitor of hydroxymethylglutaryl-coenzyme A reductase and a cholesterol-lowering agent. Proc Natl Acad Sci USA 1980; 77 : 3957-3961.
2. Alegret M, Silvestre JS. Pleiotropic effects of statins and related pharmacological experimental approaches. Clin Pharmacol 2006; 28 : 627-656.
3. Ascaso J, Gonzalez Santos P, Hernandez Mijares A et al. Management of dyslipidemia in the metabolic syndrome: recommendations of the Spanish HDL-Forum. Am J Cardiovasc Drugs 2007; 7 : 39-58.
4. Bauer DC, Mundy GR, Jamal SA et al. Statin use, bone mass and fracture: an analysis of two prospective studies (abstract). J Bone Miner Res 1999; 14: S179.
5. Broulík P. Osteoporosa. Praha: Maxdorf 1999.
6. Cummings SR, Black DM, Thompson DE et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA 1998; 280; 2077-2082.
7. Češka R et al. Cholesterol a ateroskleróza, léčba dyslipidémií. Praha: Triton 2005.
8. Edwards CJ, Hart DJ, Spector TD et al. Oral statins and increased bone-mineral density in postmenopausal women. Lancet 2000; 355 : 2218-2219.
9. Funkhouser HL, Adera T, Adler RA. Effect of HMG-CoA reductase inhibitors on bone mineral density. J Clin Densitom 2002; 5 : 151-158.
10. Greenspan SL, Holland S, Maitland RL et al. Alendronate stimulation of nocturnal parathyroid hormone secretion: a mechanism to explain the continued improvement in bone mineral sensity accompanying alendronate therapy. Proc Assoc Am Physicians 1996; 108 : 230-238.
11. Hamelin BA, Turgeon J. Hydrophilicity/lipophilicity: relevance for the pharmacology and clinical effects of HMG-CoA reductase inhibitors. Trends Pharmacol Sci 1998; 19 : 26-37.
12. Harris SE. Recombinant bone morphogenetic protein 2 accelerates bone cell differentiation and stimulation BMP 2 mRNA expression and BMP 2 promoter activity in primary fetal rat calvarial osteoblast cultures. Moll Cell Diff 1997; 3 : 37-155.
13. Heiss C, Keller T, Wehr U et al. Biochemical bone marrow markers and their significance in postmenopausal osteoporosis--a new method in the diagnosis of osteoporosis? Biomed Tech (Berl) 2004; 49 : 282-289.
14. Chung YS, Lee MD, Lee SK et al. HMG-CoA reductase inhibitors increase BMD in type 2 diabetes mellitus patients. J Clin Endocrinol Metab 2000; 85 : 1137-1142.
15. Inaba M, Nishizawa Y, Mita K et al. Poor glycemic control impairs the response of biochemical parameters of bone formation and resorption to exogenous 1,25-dihydroxy - vitamin D3 in patients with type 2 diabetes. Osteoporosis Int 1999; 9 : 525-531.
16. Ishimi Y. The role of mevalonate pathway in osteogenic cells. Nippon Rinsho 2004; 62(Suppl 2): 779-782.
17. Karpf DB, Shapiro DR, Seeman E et al. Prevention of nonvertebral fractures by alendronate: a meta-analysis. Alendronate Osteoporosis Treatment Study Group. JAMA 1997; 277 : 1159-1164.
18. Kelly PJ, Pocock NA, Sambrook PN et al. Age - and menopause-related changes in indices of bone turnover. J Clin Endocrinol Metab 1989; 69 : 1160-1165.
19. LaCroix AZ, Cauley JA, Jackson R et al. Does statin use reduce risk of fracture in postmenopausal women? Results from the Women’s Health Initiative Observational Study (WHI-OS; abstract). J Bone Miner Res 2000; 15(Suppl 1): 1066.
20. Levy JR, Murray E, Manolagas S et al. Demonstration of insulin receptors and modulation of alkaline phosphatase activity by insulin in rat osteoblastic cells. Endocrinology 1986; 119 : 1786-1792.
21. Luckman SP, Hughes DE, Coxon FP et al. Nitrogencontaining bisphosphonates inhibit the mevalonate pathway and prevent post-translational prenylation of GTP-binding proteins, including Ras. J Bone Miner Res 1998; 13 : 581-589.
22. Luegmayr E, Glantschnig H, Wesolowski GA et al. Osteoclast formation, survival and morphology are highly dependent on exogenous cholesterol/lipoproteins. Cell Death Differ 2004; 1(Suppl 1): 108-118.
23. McClung MR, Geusens P, Miller PD et al. Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group. N Engl J Med 2001; 344 : 333-340.
24. Morton DJ, Barret Connor EL et al. Thiazides and bone mineral density in elderly men and women. Am J Epidemiol 1994; 139 : 1107-1115.
25. Mundy G, Garrett R, Harris S et al. Stimulation of bone formation in vitro and in rodents by statins. Science 1999; 286 : 1946-1949.
26. Parhami F, Garfinkel A, Demer LL. Role of lipid in osteoporosis. Arteriol Thromb Vasc Biol 2000; 20 : 2346-2348.
27. Parhami, F, Morrow AD, Balucan J et al. Lipid oxidation products have opposite effects on calcifying vascular cell and bone cell differentiation. Arteriol Thromb Vasc Biol 1997; 17 : 680-687.
28. Pharmindex - Brevíř 2006. Kardiologie-Angiologie. Medical Tribune 484-485.
29. Porcel ER, Lopez JL, Ferron MA et al. Effects of the sporulation conditions on the lovastatin production by Aspergillus terreus. Bioprocess Biosyst Eng 2006; 29 : 1-5.
30. Rosen CJ. Biochemical markers of bone turnover. In: Rosen CJ (ed.) Osteoporosis: diagnostic and therapeutic principles. Totowa (NJ): Humana Press 1996, 129-141.
31. Seibel MJ, Cosman F, Shen V et al. Urinary hydroxypyridinium cross-links of collagen as markers of bone resorption and estrogen efficacy in postmenopausal osteoporosis. J Bone Miner Res 1993; 8 : 881-889.
32. Švejda P. Statiny a osteoporóza. Vnitř Lék 2006; 52 : 1190-1193.
33. Tannirandorn P, Epstein S. Drug-induced bone loss. Osteoporos Int 2000; 11 : 637-659.
34. Van Beek E, Pieterman E, Cohen L et al. Farnesyl pyrophosphate synthase is the molecular target of nitrogen-containing bisphosphonates. Biochem Biophys Res Commun 1999; 264 : 108-211.
35. Wasnich RD, Ross PD, Heilbrun LK et al. Differential effects of thiazide and estrogen upon bone mineral content and fracture prevalence. Obstet Gynecol 1986; 67 : 457-462.
36. Watanabe S, Fukumoto S, Takeuchi Y et al. Effects of 1-year treatment with fluvastatin or pravastatin on bone. Am J Med 2001; 110 : 584-587.
37. Zhang FL, Casey PJ. Protein prenylation: molecular mechanisms and functional consequences. Annu Rev Biochem 1996; 65 : 241-269.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence - editorial
- Rituximab (antiCD20 monoklonální protilátka) a molekulárně biologická negativita po léčbě nemocných s folikulárním lymfomem - cesta k vyléčení? - editorial
- Plicní alveolární proteinóza – minulost a přítomnost – editorial
- Lékové stenty - pro všechny, pro někoho, či pro nikoho? - editorial
- Změny metabolizmu lipidů u pacientů v aktivní fázi Crohnovy choroby
- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence
- Dosažení Bcl-2/IgH negativity v periferní krvi/kostní dřeni po léčbě je u nemocných s folikulárním lymfomem spojeno s lepší prognózou onemocnění
- Vliv terapie statiny na změny kostní denzity postmenopauzálních žen
- Analýza vlivu cirkadiánního rytmu na turbulenci srdeční frekvence u pacientů bez průkazu organického onemocnění srdce
- Plicní alveolární proteinóza
- Pozdní trombóza koronárního stentu a klopidogrel
- Syndróm MIAC (malnutrition, inflammation, atherosclerosis, calcification)
- Pseudomembranózní kolitida
- Inkretinová strategie léčby diabetes mellitus 2. typu - inhibitor DPP-IV sitagliptin
- Přínos ibandronátu pro léčbu postmenopauzální osteoporózy
- Chronická exsudativní benigní perikarditida - popis familiárního výskytu: kazuistiky
- Efekt transplantace ledvin na oxidační stres u pacientů s chronickým selháním ledvin
- Výsledky studie ADVANCE
- Kutnohorská J. Etika ve zdravotnictví.
- Škubla P. Veľký atlas húb
- Grofová Z. Nutriční podpora. Praktický rádce pro sestry.
- Krajíček M, Peregrin JH, Roček M, Šebesta P et al. Chirurgická a intervenční léčba cévních onemocnění.
- Prof. MUDr. Petr Broulík, DrSc., sedmdesátníkem
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Pseudomembranózní kolitida
- Plicní alveolární proteinóza
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



