-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dosažení Bcl-2/IgH negativity v periferní krvi/kostní dřeni po léčbě je u nemocných s folikulárním lymfomem spojeno s lepší prognózou onemocnění
Achieving Bcl-2/IgH negativity in peripheral blood/bone marrow after therapy implies better prognosis for patients with follicular lymphoma
Bcl-2/IgH rearrangement is a characteristic molecular rearrangement in patients with follicular lymphoma (FL), yet its prognostic significance is still unclear.
Objective:
Evaluation of the implications of achieving Bcl-2/IgH negativity for the prognosis of FL patients. Twenty seven patients (54 %) were receiving only chemotherapy (CHT), 23 patients (46 %) were receiving chemotherapy combined with monoclonal antibody anti/CD20, rituximab (R-CHT).Results:
Molecular genetic remission was achieved in 7 out of 11 patients (64 %) after R-CHT, and only in 2 out of 14 patients (14 %) after CHT – this difference was statistically significant (p = 0.037). 4 weekly doses of rituximab were administered in a sequence to 17 out of 27 patients who had received only chemotherapy and failed to achieve complete remission. 12 out of 17 patients (71 %) on this therapy were Bcl-2/IgH positive prior to treatment. 7 out of 12 (58 %) patients were no longer Bcl-2/IgH positive in a check performed after one month; the remaining 2 out of 5 patients had a negative Bcl-2/IgH record for the interval of 3 months (1 patient) or 6 (1 patient) months, respectively. The following factors were associated with the achievement of Bcl-2/IgH negativity at any point during the treatment: age < 65 years (p = 0.02) and performance status 0 + 1 according to WHO at baseline (p = 0.02). Patients who were Bcl-2/IgH negative after treatment had a lower recurrence/progression risk rate than the Bcl-2/IgH positive group of patients, i.e. 27 % vs. 75 % (p = 0.03), and a higher chance for progression-free survival, i.e. 81 % vs. 38 % (p = 0.004), event-free survival, i.e. 74 % vs. 38 % (p = 0.01), and overall survival, i.e. 87 % vs. 74 % (p = 0.05) at 2 years.Conclusion:
In our experience, achieving Bcl-2/IgH negativity after follicular lymphoma therapy implies a better prognosis.Keywords:
Bcl-2/IgH – follicular lymphoma 2 minimum residual disease – rituximab – prognosis
Autoři: D. Belada 1; L. Smolej 1; P. Štěpánková 1; M. Beránek 2; D. Dvořáková 3; J. Bukač 4; J. Malý 1
Působiště autorů: Oddělení klinické hematologie II. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 1; Ústav klinické biochemie a diagnostiky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Vladimír Palička, CSc. 2; Centrum molekulární biologie a genové terapie Interní hematoonkologické kliniky Lékařské fakulty MU a FN Brno, pracoviště Bohunice přednosta prof. MUDr. Jiří Vorlíček, CSc. 3; Ústav lékařské biofyziky Lékařské fakulty UK Hradec Králové, přednosta doc. Ing. Josef Hanuš, CSc. 4
Vyšlo v časopise: Vnitř Lék 2007; 53(10): 1057-1063
Kategorie: Původní práce
Souhrn
Bcl-2/IgH přestavba je charakteristickou molekulární přestavbou u nemocných s folikulárním lymfomem (FL), její prognostický význam je však stále nejasný.
Cíl práce:
Zhodnocení významu dosažení Bcl-2/IgH negativity na prognózu nemocných s FL. Samotnou chemoterapií (CHT) bylo léčeno 27 nemocných (54 %), chemoterapií v kombinaci s monoklonální protilátkou anti-CD20, rituximabem (R-CHT) 23 pacientů (46 %).Výsledky:
Molekulárně genetické remise po R-CHT dosáhlo 7 z 11 pacientů (64 %), po CHT jen 2 ze 14 pacientů (14 %) - tento rozdíl byl statisticky významný (p = 0,037). U 17/27 nemocných, kteří byli léčeni samotnou chemoterapií a nedosáhli kompletní remise, byly podány sekvenčně 4 dávky rituximabu po 1 týdnu. 12 ze 17 nemocných (71 %) takto léčených bylo před léčbou Bcl-2/IgH pozitivních. K vymizení Bcl-2/IgH pozitivity došlo při kontrole za 1 měsíc u 7/12 nemocných (58 %), u 2/5 zbývajících nemocných byla zaznamenána negativita Bcl-2/IgH v intervalu 3 (1 pacient), resp. 6 měsíců (1 pacient). S dosažením Bcl-2/IgH negativity kdykoliv během léčby byly asociovány tyto faktory: věk < 65 let (p = 0,02) a performance status 0 + 1 dle WHO v úvodu (p = 0,02). Nemocní, kteří dosáhli vymizení Bcl-2/IgH po léčbě, měli v porovnání se skupinou Bcl-2/IgH pozitivních nižší riziko relapsu/progrese - 27 % vs 75 % (p = 0,03), ve 2 letech pak vyšší pravděpodobnost přežití bez progrese - 81 % vs 38 % (p = 0,004), bez události - 74 % vs 38 % (p = 0,01) a hraničně celkové přežití - 87 % vs 74 % (p = 0,05).Závěr:
Dosažení Bcl-2/IgH negativity po léčbě folikulárního lymfomu je dle našich zkušeností spojeno s lepší prognózou onemocnění.Klíčová slova:
Bcl-2/IgH - folikulární lymfom - minimální reziduální nemoc - rituximab - prognózaÚvod
Folikulární lymfom (FL) je druhý nejčastější non-Hodgkinův lymfom (NHL) v západní populaci - v Evropě tvoří asi 20-25 % NHL u dospělé populace [7]. Medián věku v době prezentace je asi 60 let [2]. Maligní buňky nesou až v 90 % translokaci t(14;18). Tato translokace z molekulárně genetického hlediska zahrnuje lokus 18q21 (obsahující gen bcl-2), který je translokován do oblasti lokusu 14q32, který kóduje těžký řetězec imunoglobulinu (IgH) za vzniku fúzního genu Bcl-2/IgH [22]. Samotný gen bcl-2 zůstává po translokaci strukturálně nezměněn. Translokace vzniká pravděpodobně chybou během procesu přestavby genů pro těžký řetězec imunoglobulinu ve stadiu pre-B lymfocytu v době, kdy dochází k přestavbě D a J genových segmentů oblasti IgH [3]. Bcl-2 onkogen se tak dostává do oblasti genu pro těžký řetězec imunoglobulinu, což vede k jeho nadměrné expresi, a tím ke zvýšené syntéze proteinu bcl-2 - mohutného inhibitoru apoptózy [22]. Tím je vysvětlena skutečnost, že buňky folikulárního lymfomu jsou „nesmrtelné“. Růst nádoru je v tomto případě více způsoben prodlouženým přežitím lymfomových buněk než zvýšenou proliferační aktivitou.
Význam minimální reziduální nemoci (MRN) u nemocných s FL v prognóze onemocnění byl studován mnoha autory s rozporuplnými výsledky. Některé studie ukazují, že vymizení Bcl-2/IgH přestavby po léčbě je spojeno s redukcí rizika relapsu onemocnění, a podporují tak myšlenku monitorování MRN [1,8]. Některé studie dokonce poukazují na skutečnost, že jedinci Bcl-2/IgH negativní po autologní transplantaci mají nejen delší období bez progrese lymfomu, ale i lepší celkové přežití oproti skupině s přetrvávající Bcl-2/IgH pozitivitou [14]. Nevýhodou vysokodávkované terapie je riziko sekundárních malignit (zejména myelodysplastického syndromu nebo akutní myeloidní leukemie), proto se pozornost v otázce eradikace MRN upírá na oblast imunoterapie - monoklonálních protilátek. Nejvíce zkušeností je s monoklonální protilátkou anti CD20 - rituximabem. Tato chimérická protilátka je tvořená lidským imunoglobulinem třídy IgG1κ s myšími variabilními oblastmi izolovanými z myší anti-CD20 monoklonální protilátky IDEC-2B8 [19]. Váže se na CD20 antigen na povrchu B-lymfocytů, včetně buněk lymfomových. Podání rituximabu vedlo u části pacientů k dosažení molekulárně genetické remise, tedy konverze z PCR pozitivity Bcl-2/IgH do PCR negativity [20]. Příznivý efekt rituximabu na dosažení molekulární remise prezentovali i olomoučtí autoři [16]. Cílem naší práce bylo zhodnocení významu dosažení molekulárně genetické remise pomocí nested PCR po podání chemoterapie (CHT), chemoterapie s rituximabem (R-CHT) a chemoterapie s následným sekvenčním podání rituximabu jako konsolidační léčby u skupiny nemocných, kteří po samotné chemoterapii nedosáhli kompletní remise a zůstali Bcl-2/IgH pozitivní. Porovnávali jsme skupiny pacientů Bcl-2/IgH negativních a pozitivních po léčbě s cílem zjistit, zda dosažení molekulárně genetické remise ovlivnilo prognózu onemocnění.
Pacienti a metody
Od června roku 2002 do ledna roku 2005 bylo do sledování zařazeno 50 nemocných léčených pro folikulární lymfom na Oddělení klinické hematologie II. interní kliniky LF UK a FN Hradec Králové. V souboru bylo 33 mužů a 17 žen, věkový medián byl 56,5 let (rozmezí 33-76). Vstupní klinické stadium I/II/III/IV dle Ann Arbor klasifikace bylo u 3/5/4/38 nemocných. Histologicky byl prokázán v lymfatické uzlině FL grade 1/2/3 u 17/26/6 pacientů, v jednom případě nebyl grade určen. Ve většině případů se jednalo o nově diagnostikované onemocnění (43 pacientů), u 7 nemocných pak o relaps. Vstupní prognostický FLIPI index (Follicular Lymphoma International Prognostic Index) pro nízké/střední/vysoké riziko byl u 19/15/16 nemocných, B-symptomy mělo 36 % pacientů, vstupní performance status dle WHO 0/1/2 byl u 11/31/8 pacientů. Postižení kostní dřeně měla většina nemocných (74 %). Hlavní klinické charakteristiky souboru jsou shrnuty v tab. 1.
Tab. 1. Hlavní klinické charakteristiky souboru 50 pacientů s folikulárním lymfomem. 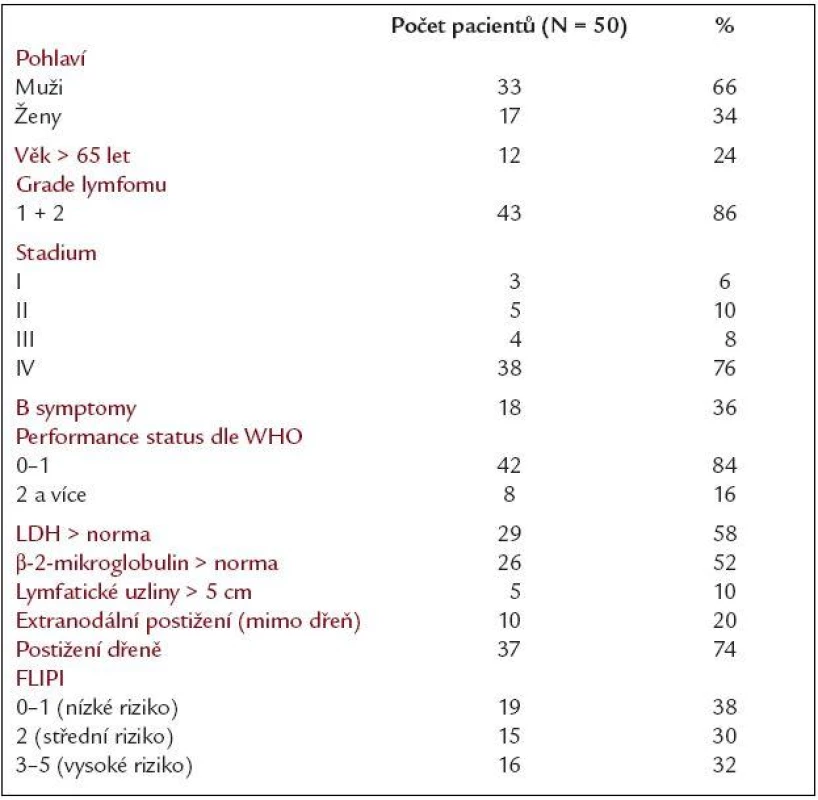
27 pacientů bylo léčeno chemoterapií (CHOP, COP), 23 chemoterapií s rituximabem (R-CHOP, R-COP, R-FND) - složení chemoterapií je uvedeno v tab. 2. U 17/27 (52 %) nemocných, kteří byli léčeni samotnou chemoterapií, u nichž však nebylo dosaženo kompletní remise onemocnění, byl podán rituximab 4krát 375 mg/m2 v týdenních intervalech s cílem odstranit reziduální nemoci. Celkem 12/17 (71 %) nemocných takto léčených bylo v době před léčbou Bcl-2/IgH pozitivních. U této podskupiny bylo sledováno, zda po podání rituximabu došlo k vymizení Bcl-2/IgH pozitivity a při jejím přetrvávání bylo vyšetření opakováno ještě po 3 a 6 měsících. Molekulárně genetická odpověď na léčbu byla hodnocena u 25 nemocných (1 zemřel při léčbě). U všech vstupně Bcl-2/IgH pozitivních nemocných byly vyšetřeny vzorky periferní krve i kostní dřeně před léčbou i po jejím skončení. U nemocných v molekulárně genetické remisi bylo hodnoceno, zda dosažení remise ovlivnilo prognózu onemocnění ve vztahu k delšímu celkovému přežití (OS), přežití bez známek progrese (PFS) a přežití bez události (EFS) oproti skupině nadále Bcl-2/IgH pozitivních. Léčebná odezva byla hodnocena dle standardních Chesonových kritérií [10].
Tab. 2. Schéma použitých chemoterapeutických režimů. 
DNA extrakce a analýza
DNA ze vzorků periferní krve a kostní dřeně byla extrahována fenol-chloroformovou extrakcí po inkubaci 200 µl vzorku s proteinázou K při 56 °C po dobu 16 hod nebo pomocí komerčních mikrokolonek (QIAamp DNA Mini Kit, Qiagen, Hilden, SRN) dle doporučení výrobce. Pro amplifikaci byla použita dvoukolová nested PCR. Produkty definované pomocí systému zevních a vnitřních primerů zahrnovaly oblasti major breakpoint region (MBR) a minor cluster region (mcr) na chromozómu 18. Sekvence primerů byly převzaty z práce Gribbena et al [9]. Obě PCR reakce byly provedeny v 25 µl reakční směsi obsahující: 150 ng nebo 500 ng DNA (v PCR I reakci) nebo 1 µl PCR I produktu (PCR II reakce), 2,5 µl 10krát PCR pufru (TaKaRa Schuzo, Otsu, Shiga, Japonsko), 200 µM koncentraci každého dNTP (TaKaRa), 0,8 µM koncentraci primerů, 2 mM chloridu hořečnatého a 1 U Taq polymerázy (TaKaRa). Amplifikace byla provedena v termocykléru GeneAmp PCR System 9600 (Perkin Elmer, Norwalk, CT, USA). Po úvodní denaturaci (5 min při 96 °C) proběhly PCR I and PCR II reakce v 30 reakčních cyklech: 60 sekund denaturace při 95 °C, 60 sekund annealing při 60 °C a 60 sekund polymerace při 72 °C. Detekce PCR produktů byla provedena pomocí elektroforézy na 2% agarózovém gelu s ethidiumbromidem.
Statistická analýza
Všichni nemocní zařazení do sledování podepsali informovaný souhlas. Sledovanými parametry byly: celkové přežití, které bylo definováno jako období od zahájení terapie do úmrtí nemocného nebo ztráty ze sledování, dále období do progrese, které bylo určeno jako doba od zahájení léčby do relapsu/progrese onemocnění. Za událost byla považována progrese/relaps lymfomu, zahájení další protinádorové léčby nebo úmrtí z jakékoliv příčiny. K porovnání shody vstupních charakteristik souboru nemocných bylo použito Fisherova přesného testu, křivky přežití byly vytvořeny dle metody Kaplana a Meiera [11], shoda křivek byla testována log rank testem.
Výsledky
Klinická a molekulární odpověď po léčbě chemoterapií a imunochemoterapií
Ve skupině 50 nemocných zařazených do sledování byla zjištěna Bcl-2/IgH pozitivita z periferní krve a/nebo kostní dřeně pomocí PCR u 26 (52 %), zbývajících 24 nemocných (48 %) bylo Bcl-2/IgH negativních. Z 26 nemocných Bcl-2/IgH pozitivních před léčbou se ve 24 případech (92 %) jednalo o přestavbu v oblasti major breakpoint region (MBR), u 2 pacientů (8 %) pak v oblasti minor cluster region (mcr). 27 pacientů bylo léčeno samotnou chemoterapií (CHT), 23 chemoterapií v kombinaci s rituximabem (R-CHT). Z 27 nemocných po podání CHT bylo 25 hodnotitelných (2 nemocní zemřeli během léčby), u 21 z nich byla zaznamenána klinicky léčebná odpověď (84 %), z toho u 7 nejistá kompletní remise (uCR) a kompletní remise (CR) - 28 %, u 14 pak parciální remise (PR) - 56 %. 4 nemocní nezareagovali na léčbu - hodnoceni jako stabilní onemocnění (SD). Ze 14 Bcl-2/IgH informativních nemocných z této podskupiny dosáhli vymizení Bcl-2/IgH přestavby po CHT jen 2 nemocní (14 %), v 1 případě se jednalo o pacienta v CR, u 1 v parciální remisi. Ze 23 nemocných léčených kombinací rituximabu a chemoterapie (R-CHT) bylo 21 klinicky hodnotitelných (2 nemocní zemřeli při léčbě). CR + uCR dosáhlo 15 z 21 pacientů (71 %), u 4 bylo dosaženo PR (19 %), 2 nemocní nedosáhli léčebné odezvy, efekt léčby hodnocen jako SD. Celková léčebná odpověď v této skupině byla 90 %. Z molekulárního hlediska ze skupiny 11 pacientů Bcl-2/IgH pozitivních dosáhlo molekulární remise po R-CHT 7 nemocných (64 %), z toho 6 bylo v uCR + CR, jeden v PR. Porovnáním obou skupin bylo zjištěno, že nemocní léčení R-CHT dosáhli statisticky významně více molekulárních remisí než pacienti léčení samotnou CHT (64 % vs 14 %, p = 0,037). Z klinického pohledu nemocní po R-CHT dosáhli významně vyššího procenta uCR + CR oproti skupině léčené samotnou CHT (71 % vs 28 %, p = 0,007). Výsledky klinické a molekulární odpovědi skupiny léčené CHT i R-CHT jsou shrnuty v tab. 3.
Tab. 3. Klinická a molekulární odpověď po chemoterapii (CHT) a chemoterapii s rituximabem (R-CHT). 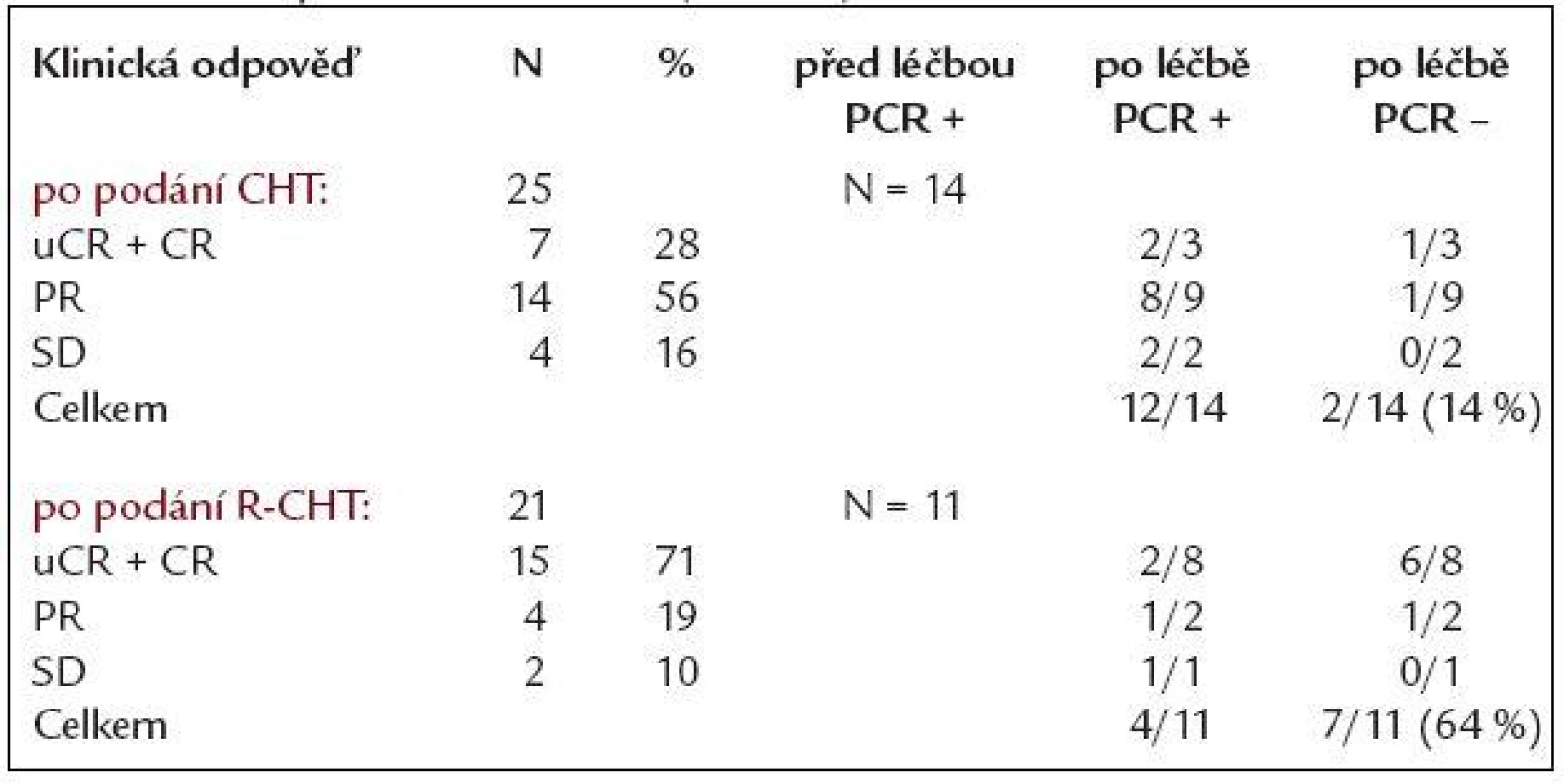
Klinická a molekulární odpověď na sekvenční podání rituximabu po chemoterapii
Sekvenčně byl podán rituximab u 17 z 27 nemocných, kteří byli léčeni samotnou chemoterapií, ale u kterých nebylo dosaženo kompletní remise onemocnění s přetrvávající Bcl-2/IgH pozitivitou. Z klinického pohledu bylo před podáním rituximabu ze 17 nemocných 14 v parciální remisi a 3 v nejisté kompletní remisi. Rituximab byl podán ve standardním dávkování, tedy 4krát 375 mg/m2 po 1 týdnu s cílem odstranění reziduální nemoci. Po podání rituximabu 8 ze 14 nemocných původně v PR dosáhlo CR, 2 pak uCR a 4 zůstali v PR. Všichni 3 nemocní, kteří byli hodnoceni jako uCR před podáním rituximabu, dosáhli poté CR. Celkem u 13/17 (76 %) nemocných došlo ke zlepšení celkové odpovědi po podání 4 dávek rituximabu. Z molekulárně genetického hlediska celkem 12/17 (71 %) nemocných bylo pozitivních na přestavbu Bcl-2/IgH před sekvenčním podáním rituximabu. K vymizení Bcl-2/IgH pozitivity došlo při kontrole za 1 měsíc od poslední dávky rituximabu u 7/12 nemocných (58 %). Zbývajících 5 Bcl-2/IgH pozitivních pacientů bylo poté sledováno po 3 měsících a u 2 z 5 došlo k vymizení Bcl-2/IgH přestavby v intervalu 3 (1 pacient), resp. 6 měsíců (1 pacient), což ukazuje na dlouhodobý biologický efekt podávaného rituximabu. Molekulárně genetická odpověď byla zaznamenána u 9/12 nemocných z této skupiny (75 %).
Záchyt Bcl-2/IgH v jednotlivých kompartmentech před léčbou a po léčbě
U 23 ze 26 vstupně Bcl-2/IgH pozitivních nemocných bylo diagnostikováno postižení obou kompartmentů současně (ve 21 případech MBR, u 2 nemocných mcr). U dvou pacientů byla Bcl-2/IgH pozitivita kostní dřeně při negativitě Bcl-2/IgH v periferní krvi, u 1 nemocného byl naopak záchyt Bcl-2/IgH elementů jen v periferní krvi při negativním nálezu v kostní dřeni. Po léčbě samotnou chemoterapií zůstalo 14 pacientů Bcl-2/IgH pozitivních v periferní krvi a/nebo v kostní dřeni, po podání rituximabu s chemoterapií 4 nemocní - celkem tedy u 18 nemocných byla zkoumána korelace mezi nálezy v kostní dřeni a periferní krvi i po léčbě. U 11 z 18 nemocných (61 %) byla nalezena Bcl-2/IgH pozitivita v obou kompartmentech, 5 z 18 nemocných bylo Bcl-2/IgH negativních v periferní krvi s přetrvávající pozitivitou ve dřeni a naopak 2 z 18 nemocných dosáhli vymizení Bcl-2/IgH v periferní krvi, ale přetrvávala u nich pozitivita v periferní krvi. Onemocnění se tak jeví více rezistentní k léčbě v kostní dřeni než v periferní krvi.
Význam dosažení Bcl-2/IgH negativity na prognózu onemocnění
Ze souboru 26 nemocných vstupně Bcl-2/IgH pozitivních ke dni hodnocení zemřelo 5 nemocných - všichni na progresi lymfomu, 3 z nich byli ze skupiny, která nedosáhla nikdy Bcl-2/IgH negativity. Následný relaps/progrese lymfomu byly po léčbě zaznamenány u 10 ze 23 (43 %) hodnotitelných pacientů (3 nemocní zemřeli během léčby) s mediánem doby do relapsu/progrese 15,5 měsíce. U skupiny, kde během léčby v kterékoli fázi bylo dosaženo Bcl-2/IgH negativity, došlo k relapsu u 4/15 pacientů (27 %), u nadále Bcl-2/IgH pozitivních pak u 6/8 případů (75 %) - tento rozdíl byl statisticky významný (p = 0,03). Medián OS u celé skupiny 26 vstupně Bcl-2/IgH pozitivních nemocných nebyl dosažen, 3. kvartil byl 37 měsíců. Ke dni hodnocení žije 21/26 nemocných (81 %), ve skupině nadále Bcl-2/IgH pozitivních žije 4/8 nemocných (50 %), ve skupině Bcl-2/IgH negativních žije 17/18 pacientů (94 %). Pravděpodobnost 2letého přežití u obou podskupin byla 74 % vs 87 % - tento rozdíl byl hraničně statisticky významný (p = 0,05). Medián doby do relapsu/progrese celého souboru nebyl dosažen, 3. kvartil byl 20 měsíců. Pravděpodobnost 2letého přežití bez progrese byla u pacientů s přetrvávající Bcl-2/IgH pozitivitou 38 %, u Bcl-2/IgH negativních 81 % (p = 0,004). Pravděpodobnost dvouletého přežití bez události byla u skupiny s přetrvávající Bcl-2/IgH pozitivitou 37 %, u Bcl-2/IgH negativních 75 % (p = 0,01). Medián sledování této časti souboru je 34 měsíců (rozmezí 4 - 54). Křivky porovnávající OS a PFS u obou skupin po léčbě jsou uvedeny v grafech 1 a 2. Porovnáním vstupních charakteristik s výsledky léčby bylo zjištěno, že v našem souboru bylo dosažení Bcl-2/IgH negativity asociováno s těmito faktory: věk < 65 let (p = 0,02), performance status 0 + 1 v úvodu (p = 0,02) a hraničně i index FLIPI (p = 0,05), tab. 4. Porovnáním léčebných výsledků nemocných, kteří kdykoliv během léčby dosáhli Bcl-2/IgH negativity se skupinou, u kterých přetrvávala Bcl-2/IgH pozitivita, byl nalezen rozdíl mezi oběma skupinami v delší době do progrese, době do události a hraničně i v delším přežití ve prospěch skupiny Bcl-2/IgH negativních po léčbě. PCR negativní status po léčbě tak byl dle našeho sledování spojen s dlouhodobější remisí onemocnění, nižším rizikem relapsu a s naznačeným trendem k delšímu celkovému přežití.
Graf 1. Graf celkového přežití u pacientů, kteří dosáhli Bcl-2/IgH negativity po terapii vs nemocní Bcl-2/IgH pozitivní. 
Graf 2. Graf doby do progrese u pacientů, kteří dosáhli Bcl-2/IgH negativity po terapii vs nemocní Bcl-2/IgH pozitivní. 
Tab. 4. Klinické, laboratorní a léčebné charakteristiky nemocných ve vztahu k vymizení či přetrvávání Bcl-2/IgH přestavby po celé léčbě. 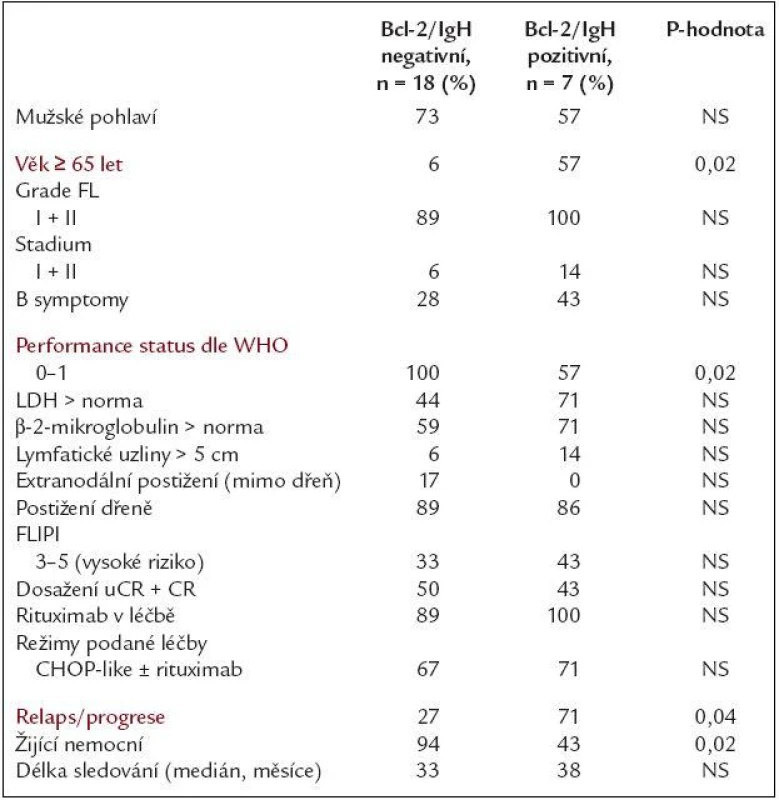
Diskuse
V našem souboru 50 nemocných jsme prokázali přítomnost Bcl-2/IgH přestavby v MBR nebo mcr oblasti u 52 % nemocných, což odpovídá výsledkům prezentovaným ostatními autory z evropských pracovišť. Italští autoři nalezli Bcl-2/IgH pozitivitu u 69 % [17], francouzští pak v 64 % [4]. Relativně nižší výskyt může být způsoben skutečností, že v našem souboru byla testována jen 2 nejčastější zlomová místa - MBR a mcr. Tento rozdíl ale není signifikantní. Samotná chemoterapie vede k dosažení Bcl-2/IgH negativity jen u malé části nemocných - v našem souboru dosáhlo negativity 14 % nemocných. V práci italských autorů tomu bylo po chemoterapii CHOP u 30 % nemocných [19]. Nižší procento molekulárních remisí po samotné chemoterapii bylo spojeno v našem souboru i se statisticky signifikantně nižší pravděpodobností dosažení klinické kompletní remise oproti skupině léčené kombinací rituximabu a chemoterapie (28 % vs 71 %, p = 0,007). Přidání rituximabu k chemoterapii vedlo u našich nemocných ke statisticky vyššímu dosažení molekulárních remisí než po podání samotné CHT (14 %), a to u 64 % nemocných - tento rozdíl byl statisticky významný (p = 0,037). Význam rituximabu pro dosažení molekulárně genetické remise onemocnění byl prezentován mnoha autory, a to jak při podání v monoterapii [4], tak v kombinaci s chemoterapií CHOP [5]. Z 18 nemocných ve studii Czuczmana et al bylo informativních pro Bcl-2/IgH přestavbu 7 pacientů - u všech došlo po podání 6 cyklů R-CHOP k dosažení molekulárně genetické remise. U naší skupiny nemocných léčených samotnou CHT, kterým byly podány 4 dávky rituximabu po 1 týdnu, dosáhlo 9/12 (75 %) molekulární remise. Nástup Bcl-2/IgH negativity byl pozvolný, 7/12 nemocných dosáhlo vymizení Bcl-2/IgH přestavby při kontrole za 1 měsíc po skončení léčby rituximabem, 2 ze zbývajících 5 pak v intervalu 3, resp. 6 měsíců po léčbě. Doznívající efekt rituximabu je způsoben přetrváváním jeho hladiny několik měsíců po poslední dávce. Rambaldi et al prezentovali výsledky sledování MRN po chemoterapii CHOP s následným sekvenčním podáním rituximabu u skupiny 128 nemocných s FL. Po chemoterapii CHOP bylo zařazeno do sledování MRN 77 nemocných, kterým byly podány sekvenčně 4 dávky rituximabu po 1 týdnu . Molekulárně genetická odpověď byla sledována 12, 28 a 44 týdnů po podání rituximabu. PCR negativity dosáhlo v daných časových obdobích 59 %, 74 %, resp. 63 % nemocných. Dosažení Bcl-2/IgH negativity v této práci korelovalo s lepší prognózou onemocnění [19]. Skutečnost, že podání rituximabu kdykoliv během terapie v našem souboru nebylo statisticky signifikantně spojeno s lepší molekulárně biologickou odpovědí, je způsobena tím, že počet nemocných, kteří rituximab nedostali, byl velmi nízký.
Hlavním cílem naší práce bylo zhodnotit klinický význam dosažení Bcl-2/IgH negativity na osud nemocných. Dosažení molekulární remise v kterékoliv fázi léčby bylo v našem sledování spojeno se statisticky významně delším obdobím do progrese (p = 0,004) i období do události (p = 0,01) oproti skupině Bcl-2/IgH pozitivních. Vliv na prodloužení celkového přežití byl shledán jako hraniční (p = 0,05) ve prospěch Bcl-2/IgH negativních pacientů. Pozitivní význam dosažení molekulárně genetické remise na prognózu onemocnění byl prezentován mnoha autory, a to jak po podání intenzivní chemoterapie - „alternative tripple therapy“ a FND [13], tak po podání samotného rituximabu [4] či vysokodávkované léčby s podporou kmenových buněk [12]. Existují ale i práce, které tuto hypotézu nepodporují. Ve Foranově práci je prezentováno 62 % nemocných, kteří dosáhli po 4 dávkách rituximabu molekulárně genetické remise onemocnění - tato skutečnost ale nekorelovala s klinickou odezvou [6]. Podobně rozporuplné výsledky prezentoval Mandigers, který vyšetřoval Bcl-2/IgH přestavbu u nemocných po chemoterapii COP s interferonem α. Dosažení molekulárně genetické remise v této studii nekorelovalo s klinickou prognózou nemocných [15]. Závěrem lze shrnout, že naše studie prokázala statisticky významně vyšší procento CR i molekulárních remisí po podání imunochemoterapie s rituximabem oproti samotné chemoterapii a současně i unikátní schopnost rituximabu dosáhnout eliminace Bcl-2/IgH pozitivních buněk v periferní krvi a/nebo v kostní dřeni, které přetrvávaly po podání chemoterapie samotné (v 75 %). Z tohoto pohledu je oproti jiným postupům, které jsou schopny vést k dosažení molekulární remise (např. autologní transplantace) hlavní výhodou rituximabu nízká toxicita, čímž odpadá riziko sekundárních nádorů. Přestože nemocní po dosažení Bcl-2/IgH negativity již nebyli dále dlouhodobě molekulárně geneticky sledováni, lze konstatovat, že dosažení molekulární remise do 6 měsíců po léčbě bylo v naší práci spojeno s lepší prognózou nemocných stran PFS a EFS. Význam dosažení Bcl-2/IgH negativity stran delšího přežití byl hraniční, z tohoto pohledu bude nutné delší sledování souboru. Hlavní problém pro zavedení monitorování Bcl-2/IgH pozitivních buněk v periferní krvi/kostní dřeni v běžné klinické praxi vyplývá z toho, že i přes dosažení Bcl-2/IgH negativity nemusí dojít k eliminaci vlastního nádoru v uzlinách. Oba kompartmenty (periferní krev i kostní dřeň) jsou totiž až sekundárně postiženými oblastmi - primárně se jedná o uzlinové onemocnění. I přes dosažení Bcl-2/IgH negativity v periferní krvi/kostní dřeni proto nelze vyloučit přítomnost reziduálních nádorových buněk v původně postižených uzlinách. Dalším problémem je rozdílná záchytnost Bcl-2/IgH pozitivních buněk v periferní krvi oproti kostní dřeni. V našem souboru bylo u 23 ze 26 Bcl-2/IgH pozitivních nemocných zjištěno postižení obou kompartmentů současně. Korelace mezi oběma kompartmenty tedy byla v našem souboru velmi dobrá. Podobné výsledky prezentoval Summers [21], naopak některé práce poukazují na kostní dřeň jako spolehlivější kompartment pro průkaz Bcl-2/IgH elementů než periferní krev [12]. Po léčbě u skupiny s přetrvávající Bcl-2/IgH pozitivitou byla shledána shoda mezi periferní krví a kostní dření u 11 z 18 nemocných (61 %). U 5 z 18 nemocných bylo dosaženo Bcl-2/IgH negativity v periferní krvi při přetrvávající pozitivitě v kostní dřeni a naopak u 2 z 18 nemocných dosáhli vymizení Bcl-2/IgH v kostní dřeni s detekovatelnými Bcl-2/IgH pozitivními elementy v periferní krvi. Účinnost léčby (zejména rituximabu) při eliminaci Bcl-2/IgH pozitivních buněk se jeví vyšší v periferní krvi než v kostní dřeni. K obdobným závěrům dospěli například i italští autoři [18]. Závěrem lze konstatovat, že pro zavedení monitorování Bcl-2/IgH do běžné klinické praxe je nezbytné sjednocení metodik stanovení této přestavby mezi laboratořemi a současně i stanovení optimálního kompartmentu, ve kterém by mělo být sledování prováděno - zda jím bude periferní krev, kostní dřeň nebo lymfatická uzlina, není dosud zcela jasné.
Poděkování
Tato práce byla podpořena výzkumným záměrem MZO 00179906 a grantem IGA NR/9453-3 Ministerstva zdravotnictví České republiky.
MUDr. David Belada
Oddělení klinické hematologie II. interní kliniky LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: david.belada@seznam.cz
Doručeno do redakce: 12. 3. 2007
Přijato po recenzi: 4. 5. 2007
Zdroje
1. Apostolidis J, Gupta RK, Granzelias D et al. High-Dose Therapy With Autologous Bone Marrow Support as Consolidation of Remission in Follicular Lymphoma: Long-Term Clinical and Molecular Follow-Up. J Clin Oncol 2000; 18 : 527-536.
2. Armitage J, Wiesenburger D New approach to classifying non-Hodgkin´s lymphomas. Clinical features of the major histologic subtypes. J Clin Oncol 1998; 16 : 2780-2795.
3. Bakhshi A, Wright JJ, Graniger W et al. Mechanism of the t(14;18) chromosomal translocation: structural analysis of the both derivate 14 and 18 reciprocal partners. Proc Natl Acad Sci USA 1987; 84 : 2396-2400.
4. Colombat P, Salles G, Brousse N et al. Rituximab (anti-CD20 monoclonal antibody) as single first-line therapy for patients follicular lymphoma with a low tumor burden: clinical and molecular evaluation. Blood 2001; 97 : 101-106.
5. Czuczman MS, Grillo-López AJ, McLauglin P, White CA et at. Clearing of celles bearing the bcl-2 [t(14;18)] translocation from blood and marrow of patients treated with rituximab alone or in combination with CHOP chemotherapy. Ann Oncol 2001; 12 : 109-114.
6. Foran JM, Gupta RK, Cunningmam D et al. A UK multicentre phase II study of rituximab (chimeric anti-CD20 monoclonal antibody) in patients with follicular lymphoma, with PCR monitoring of molecular response. Br J Heamatol 2000; 109 : 81-88.
7. Glass AG, Karnell LH, Menck HR. The national Cancer Data Base report on non-Hodgkin’s lymphoma. Cancer 1997; 80 : 2311-2320.
8. Gribben JG, Freedman AS et al. Immunologic purging of marrow assessed by PCR before autologous bone marrow transplantation for B-cell lymphoma. N Eng J Med 1991; 325 : 1525-1531.
9. Gribben JG, Neuberg D, Barber M et al. Detection of Residual Lymphoma Cells by Polymerase Chain Reaction in Peripheral Blood Is Significantly Less Predictive for Relapse Than Detection in Bone Marrow. Blood 1994; 83 : 3800-3807.
10. Cheson BD, Horning SJ, Coiffier B et al. Report of an international workshop to standardize response criteria for non‑Hodgkin’s lymphomas. J Clin Oncol 1999; 17 : 1244. Erratum in: J Clin Oncol 2000; 18 : 2351.
11. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457-481.
12. Ladetto M, Corradini P, Vallet S et al. High rate of clinical and molecular remissions in follicular lymphoma patients receiving high-dose sequential chemotherapy and autografting at diagnosis: a multicenter, prospective study by the Gruppo Italiano Trapianto Middolo Osseo (GIMTO). Blood 2002; 100 : 1559-1564.
13. Lopez-Guillermo A, Cabanillas F, McLauglin P et al. Molecular response assessed by PCR is the most important factor predicting failure-gree survival in indolent follicular lymphoma: Update of the MDACC series. Ann Oncol 2000; 11(Suppl 1): S137-S140.
14. Mahé B, Milpied N, Mellerin MP et al. PCR detection of residual Bcl-2/IgH-positive cells after high-dose therapy with autologous stem cell transplantation is a prognostic factor for event-free survival in patients with low-grade follicular non-Hodgkin’s lymphoma. Bone Marrow Transpl 2003; 31 : 467-473.
15. Mandigers CM, Meijerink PP, Mensink EM et al. Lack of correlation between numbers of circulating t(14;18)-positive cells and response to first-line treatment in follicular lymphoma. Blood 2001; 98 : 940-944.
16. Papajík T, Jedličková K, Krigerová E et al. Polymerase chain reaction detection of cells carrying t(14;18) in bone marrow of patients with follicular and diffuse large B-cell lymphoma: the importance of analysis at diagnosis and significance of long term follow-up. Neoplasma 2001; 6 : 501-505.
17. Pezzela F, Jones M, Ersboll J et al. Evaluation of bcl-2 protein expression and 14;18 translocation as prognostic markers in follicular lymphoma. British J Can 1992; 65 : 87-89.
18. Rambaldi A, Lazzari M, Manzoni C et al. Monitoring of minimal residual disease after CHOP and rituximab in previously untreated patients with follicular lymphoma. Blood 2002; 99 : 856-862.
19. Reff ME, Carner K et al. Depletion of B cells in vivo by a chimeric mouse human monoclonal antibody to CD20. Blood 1994; 83 : 435-445.
20. Rogers J, Jackson J, Rosenberg J et al. Clearance of bcl-2 t(14;18) from peripheral blood and bone marrow in patients with relapsed low-grade or follicular lymphoma following single-agent therapy with the chimaeric anti-CD20 antibody IDEC-C2B8. Ann Oncol 1996; 7 : 108a (abstract).
21. Summers KE, Davies AJ, Matthews J et al. The relative role of peripheral blood and bone marrow for monitoring molecular evidence of disease in follicular lymphoma by quantitative real-time polymerace Chin reaction. Br J Haematol 2002; 118 : 563-566.
22. Tsijumoto Y, Finger L, Yunis J et al. Cloning of the chromosome braekpoint of neoplastic B cells with the t(14;18) chromosome translocation. Science 1984; 226 : 1097-1099.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence - editorial
- Rituximab (antiCD20 monoklonální protilátka) a molekulárně biologická negativita po léčbě nemocných s folikulárním lymfomem - cesta k vyléčení? - editorial
- Plicní alveolární proteinóza – minulost a přítomnost – editorial
- Lékové stenty - pro všechny, pro někoho, či pro nikoho? - editorial
- Změny metabolizmu lipidů u pacientů v aktivní fázi Crohnovy choroby
- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence
- Dosažení Bcl-2/IgH negativity v periferní krvi/kostní dřeni po léčbě je u nemocných s folikulárním lymfomem spojeno s lepší prognózou onemocnění
- Vliv terapie statiny na změny kostní denzity postmenopauzálních žen
- Analýza vlivu cirkadiánního rytmu na turbulenci srdeční frekvence u pacientů bez průkazu organického onemocnění srdce
- Plicní alveolární proteinóza
- Pozdní trombóza koronárního stentu a klopidogrel
- Syndróm MIAC (malnutrition, inflammation, atherosclerosis, calcification)
- Pseudomembranózní kolitida
- Inkretinová strategie léčby diabetes mellitus 2. typu - inhibitor DPP-IV sitagliptin
- Přínos ibandronátu pro léčbu postmenopauzální osteoporózy
- Chronická exsudativní benigní perikarditida - popis familiárního výskytu: kazuistiky
- Efekt transplantace ledvin na oxidační stres u pacientů s chronickým selháním ledvin
- Výsledky studie ADVANCE
- Kutnohorská J. Etika ve zdravotnictví.
- Škubla P. Veľký atlas húb
- Grofová Z. Nutriční podpora. Praktický rádce pro sestry.
- Krajíček M, Peregrin JH, Roček M, Šebesta P et al. Chirurgická a intervenční léčba cévních onemocnění.
- Prof. MUDr. Petr Broulík, DrSc., sedmdesátníkem
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Pseudomembranózní kolitida
- Plicní alveolární proteinóza
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



