-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pozdní trombóza koronárního stentu a klopidogrel
Late coronary stent thrombosis and clopidogrel
The existence of late coronary stent thrombosis is a topical issue in cardiology today. The synoptic article discusses current definition of the above phenomenon, its delimitation in time and actual incidence. Based on data from available observation and randomised studies, long-term safety of conventional bare metal and drug-eluting stents is evaluated, as well as the safety profile following implantation. The length of thienopyridin treatment after percutaneous coronary intervention (PCI) varies according to the type of stent used. While a conventional bare metal stent (BMS) implant provides long-term safety with one month treatment, the implantation of a drug-eluting stent (DES) should be complemented with a 12-month period of clopidogrel administration. This approach may be in the future influenced by further progress in drug-eluting stents development and by prospectively acquired information on long-term administration of clopidogrel to such patients.
Keywords:
late coronary stent thrombosis – drug-eluting stents – clopidogrel
Autoři: I. Varvařovský; J. Matějka; A. Herman
Působiště autorů: Pracoviště invazivní kardiologie Kardio-Troll, Krajská nemocnice Pardubice, přednosta prim. MUDr. Aleš Herman, Ph. D.
Vyšlo v časopise: Vnitř Lék 2007; 53(10): 1085-1091
Kategorie: Přehledné referáty
Souhrn
Existence pozdní trombózy koronárních stentů je aktuálním problémem současné kardiologie. V přehledném článku je diskutována současná definice této jednotky, její časové vymezení a reálný výskyt. Podle údajů z dostupných observačních a randomizovaných studií je posuzována dlouhodobá bezpečnost konvenčních kovových a lékových stentů a vývoj této bezpečnosti v čase od implantace. Délka léčby thienopyridiny po koronární angioplastice (PCI) je rozdílná podle typu použitého stentu. Zatímco implantace konvenčního kovového stentu (BMS) je dlouhodobě bezpečná při jednoměsíční léčbě, implantace lékového stentu (DES) by měla být podle údajů observačních studií doplněna až 12měsíčním podáváním klopidogrelu. Tento postoj může být v budoucnu ovlivněn dalším vývojem lékových stentů a prospektivně získanými informacemi o dlouhodobém podávání klopidogrelu těmto nemocným.
Klíčová slova:
pozdní trombóza koronárního stentu - lékové stenty - klopidogrelÚvod
Stent vložený do koronární tepny je cizorodým materiálem a vyvolává biologickou odezvu struktur, se kterými se dostává do kontaktu. Kontakt s krví vede k aktivaci hemostatického systému, kontakt s cévní stěnou vyvolává zánětlivou odpověď. Patofyziologický průběh aktivace hemostatického systému a zánětlivé odpovědi je svázán řadou společných mechanizmů [1]. Za normálních okolností je výsledkem uvedených dějů vhojení struktur stentu do cévní stěny a vytvoření nového vnitřního povrchu tepny (neointimy). Nepřiměřená aktivace hemostatických procesů může vyústit do trombózy koronárního stentu, nadměrná proliferační složka zánětlivé odpovědi může mít za následek opětovné zúžení cévního průsvitu (restenózu).
Trombóza koronárního stentu
Definice trombózy koronárního stentu
Definice trombózy koronárního stentu je jen zdánlivě jednoduchá. Angiografický průkaz trombózy v oblasti dříve implantovaného stentu je jistě nejvíce specifickým nálezem. Avšak koronární příhoda v povodí tepny ošetřené stentem nemusí být nutně způsobena pouze trombózou samotného stentu. Vyvolávajícím faktorem může být i trombóza nestabilního sklerotického plátu a propagace trombu cévou poté znesnadní hodnocení příčiny. Prvním příznakem trombózy stentu může být i náhlé úmrtí nemocného. Pokud je nemocný pitván a patolog má zkušenost s hodnocením nálezů na koronárních tepnách, lze potvrdit přítomnost trombózy stentu s vysokou jistotou. Náhlá smrt však může být způsobena řadou dalších mechanizmů a při absenci patologicko-anatomického nálezu není možné přechodnou trombózu stentu s jistotou vyloučit ani potvrdit.
Pro hodnocení dlouhodobé bezpečnosti koronárních stentů je jistě nejzásadnější sledovat pravděpodobnost úmrtí a infarktu myokardu ve sledovaném období. Tato „tvrdá“ kritéria jsou i základem nové definice trombózy stentu, na kterých se sjednotil panel odborníků amerického Úřadu pro kontrolu potravin a léčiv (FDA) na konci roku 2006. Definice Academic Research Consortium (ARC) rozlišuje trombózu stentu (ST):
- a) jednoznačnou (confirmed, definite) = akutní koronární syndrom + angiograficky nebo patologem prokázaná trombóza stentu
- b) pravděpodobnou (probable) = nevysvětlené úmrtí do 30. dne nebo akutní infarkt myokardu v povodí stentované tepny
- c) možnou (possible) = nevysvětlené úmrtí po 30. dnu
Každá z uvedených definic určuje trombózu koronárního stentu s různou mírou senzitivity a specifity; z hlediska těchto parametrů je potom nejvyváženějším způsobem určena trombóza stentu spojením definice jednoznačné a pravděpodobné (definite + probable ST).
Doba vzniku trombózy koronárního stentu
Podle doby od provedení koronární angioplastiky do manifestace trombózy stentu rozlišujeme:
- časnou, akutní (early) - do 24 hodin od implantace stentu
- subakutní (subacute) - od 1. do 30. dne po implantaci stentu
- pozdní (late) - od 31. do 360. dne
- velmi pozdní (very late) - od 361. dne dále
Časná trombóza stentu je zpravidla příhodou dobře zvládnutelnou. Vzniká většinou ještě na katetrizačním sále nebo během několika hodin po intervenci, kdy je nemocný pečlivě monitorován, a příhoda tak nevede k fatálním důsledkům. Subakutní trombóza stentu již zpravidla zastihuje nemocného mimo zdravotnické zařízení. Arbitrárně je za subakutní považována každá trombóza stentu až do 30. dne od PCI, ale maximum jejího výskytu je kolem 8. dne po implantaci stentu. Mortalita subakutní trombózy stentu je vysoká a dosahuje 15-48 % [2-5].
Vhojení stentu do cévní stěny je obvykle ukončené po 4-6 týdnech od PCI a stent by poté již neměl vést ke vzniku koronární trombózy. Postupy zaměřené na prevenci restenózy, které potlačují proliferativní odpověď cévní stěny (brachyterapie, lékové stenty) mohou oddálit vhojení stentu, a umožnit tak vznik trombózy stentu i po uplynutí doby 6 týdnů. Podobný dopad může mít i přítomnost klinického stavu, který obecně omezuje schopnost dokončení proliferativní fáze zánětlivé odpovědi (léčba kortikoidy či cytostatiky, onkologické onemocnění, systémové nemoci pojiva, malnutrice). Mortalita pozdní a velmi pozdní trombózy je podobně vysoká jako v případě subakutní trombózy stentu a ve většině publikovaných prací dosahuje 19-45 % [4-11,38-40,47].
Etiopatogeneze trombózy koronárního stentu
Trombóza stentu je způsobena destičkovým trombem, jehož tvorba je spuštěna vysokým smykovým třením a agregací destiček závislou na ADP. Tento experimentální poznatek doznal klinického ověření v podobě zásadního snížení výskytu subakutní trombózy stentu pomocí vysokotlaké implantace stentu (hladký vnitřní povrch omezí vysoké smykové tření protékající krve) a pomocí léčby thienopyridiny (omezí agregaci destiček závislou na ADP a stabilizaci destičkového trombu).
Příčiny vzniku akutní a subakutní trombózy stentu souvisí nejčastěji s kvalitou technického provedení výkonu a s jeho farmakologickým zajištěním. Etiologickým faktorem, který spustí tvorbu destičkového trombu ve stentu, bývá nejčastěji neošetřená disekce koronární tepny při okraji stentu (zpravidla při distálním okraji). Dalším z praktického pohledu nejčastějším důvodem bývá nedokonalá expanze koronárního stentu. Někteří autoři udávají častější výskyt laboratorně prokázané „rezistence“ na aspirin či klopidogrel u nemocných s trombózou stentu. Předčasné vysazení léčby thienopyridiny je dalším významným rizikem pro vznik subakutní trombózy stentu.
Při vzniku pozdní a velmi pozdní trombózy stentu mohou hrát úlohu stejné etiologické faktory, jaké jsou uvedeny u příčin trombózy subakutní. Navíc ale přistupují dva důležité momenty - dlouhodobá přítomnost nezhojených struktur stentu v koronárním řečišti a přítomnost zánětlivé reakce v místě implantovaného stentu. Omezená endotelizace struktur stentu je často nacházena u nemocných zemřelých v souvislosti s trombózou stentu bez ohledu na to, zda jde o konvenční kovový (bare metal stent - BMS) či o lékový (drug eluting stent, DES) stent. Přítomnost výrazné zánětlivé odezvy je nacházena u nemocných zemřelých v souvislosti s velmi pozdní trombózou a spekuluje se o možnosti alergické reakce na některé složky stentu (kov, polymer). Zánětlivá odpověď může vést k tvorbě výdutí, jejichž další osud je nejistý - jsou dávány do souvislosti s úmrtím pacienta, mohou se však i spontánně zhojit. Restenóza v souvislosti s úmrtím při trombóze stentu je naopak vzácným nálezem [2,3,6-13].
Technicky dobře provedená angioplastika a správně vedená antiagregační léčba jsou tedy základní podmínky omezující riziko vzniku trombózy koronárního stentu. Nedokážeme však v současnosti určit nemocné, kteří budou reagovat na implantaci stentu hypersenzitivní odezvou, či kteří nebudou schopni dokončit endotelizaci struktur stentu.
Thienopyridiny po implantaci konvenčního kovového stentu (bare metal stent - BMS)
V počátečním období zavádění koronárních stentů byla subakutní trombóza hlavním omezením metody a frekvence jejího výskytu dosahovala desítek procent provedených PCI.
Kombinace aspirinu, dextranu a heparinu s následným převedením na léčbu kumariny snížila četnost subakutní trombózy stentu na úroveň 5-8 % za cenu vysokého výskytu klinicky závažných krvácení. Teprve rutinní používání vysokotlaké implantace kovových stentů s následnou léčbou thienopyridiny snížilo výskyt subakutní trombózy stentu v reálném životě pod 2 % a v podmínkách randomizovaných klinických studií dokonce na úroveň 0,2-0,6 % všech koronární angioplastik [2,3,14-17].
Prvním thienopyridinem používaným v prevenci subakutní trombózy kovových stentů byl tiklopidin. Vysoká četnost nežádoucích účinků a klinická závažnost některých (neutropenie, dřeňový útlum, hemolyticko-uremický syndrom) vedly ke snaze o podávání léku po nejkratší nutnou dobu. Z experimentu bylo známo, že doba potřebná ke vhojení kovového stentu u zvířete nepřesahuje 4-6 týdnů. Klinická zkušenost u člověka potom učila, že nejčastěji je subakutní trombóza stentu pozorována mezi 2.-10. dnem od PCI. Doba 4 týdnů léčby tiklopidinem byla považována za dostatečnou a zkrácení na pouhé 2 týdny bylo rovněž spojeno s velmi dobrými klinickými výsledky z hlediska prevence trombózy stentu. Tiklopidin byl postupně nahrazen klopidogrelem, který má kromě příznivějšího spektra nežádoucích účinků pravděpodobně i vyšší klinickou účinnost v prevenci trombózy stentu [18,19]. Stent byl od 30. dne po PCI dále považován za vhojený a trombotické příhody po této době již nebyly přičítány na vrub trombózy stentu. Pojem pozdní trombózy kovového stentu byl objeven až v souvislosti s intrakoronární brachyterapií, která využívá β - či γ-ionizujícího záření k potlačení proliferační odezvy cévní stěny [6,20]. Srovnávání frekvence výskytu pozdní trombózy lékových (DES) a kovových (BMS) stentů v randomizovaných studiích ukazuje, že problém pozdní trombózy se může týkat i stentů kovových. Potvrzení existence pozdní trombózy konvenčních stentů přichází poté i z patologicko-anatomických studií, zaměřených na toto téma [8]. Pravděpodobnost pozdní trombózy BMS je však velmi nízká a podle údajů ze studií s lékovými stenty (v nichž představovaly kovové stenty kontrolní léčbu) nepřesahuje frekvence trombózy kovového stentu mezi 30. dnem a 4. rokem hodnotu 1,5 %. Zároveň se ukazuje, že riziko pozdní trombózy konvenčního kovového stentu v čase klesá a po 1. roce od výkonu nepřesahuje hodnotu 0,3-0,5 % ročně [21,22,47].
Tab. 1. Pozdní trombóza kovového stentu (BMS). 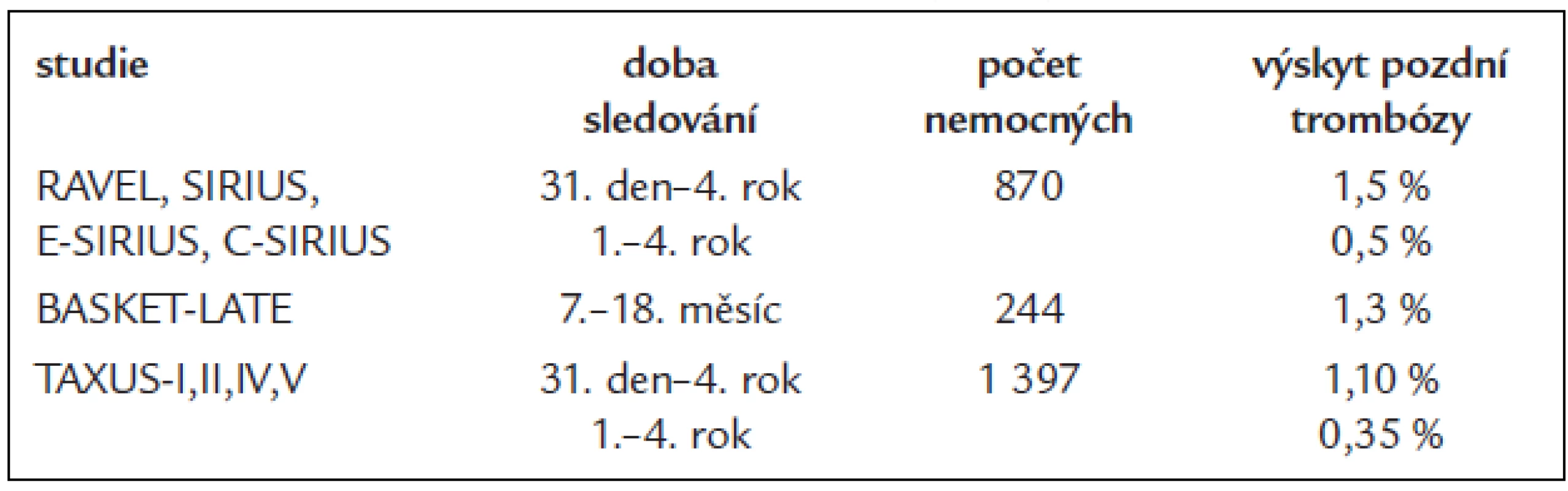
Tab. 2. Pravděpodobnost úmrtí a infarktu myokardu mezi 6.–24. měsícem od PCI. 
DES – drug eluting stent, lékový stent, BMS – bare metal stent, konvenční kovový stent Pokud tedy existuje možnost pozdní trombózy koronárního stentu a pokud současně víme, že podávání klopidogrelu výrazně omezilo riziko trombózy subakutní, nabízí se možnost řešení v pouhém prodloužení léčby klopidogrelem. Dlouhodobá léčba thienopyridiny přidaná k léčbě aspirinem však není prostá rizika. Ve studii CHARISMA bylo podávání aspirinu s klopidogrelem po dobu 28 měsíců spojeno s významným vzestupem celkové i kardiovaskulární mortality u nemocných s malým kardiovaskulárním rizikem proti podávání samotného aspirinu. Zvýšení celkové mortality o 1,6 % (5,4 % vs 3,8 %, p = 0,04) a kardiovaskulární mortality o 1,7 % (3,9 % vs 2,2 %, p = 0,01) dává cennou kvantitativní představu o velikosti ceny, placené za přidání klopidogrelu k aspirinu [23]. Riziko krvácivých komplikací dlouhodobé kombinované léčby klopidogrelu s aspirinem je potom zcela srovnatelné s rizikem dlouhodobé antikoagulační léčby warfarinem [24]. Proto bychom vždy indikaci dlouhodobé duální protidestičkové léčby měli pečlivě zvážit a měli bychom se vyvarovat jejího podávání v těch případech, v nichž je samotné riziko očekávaných kardiovaskulárních komplikací velmi nízké.
Observační studie, která hodnotila prodloužené podávání klopidogrelu po implantaci BMS, nenalezla žádný další prospěch z pokračování této léčby po 6.-12. měsíci od PCI [25]. Prospektivně získané informace z randomizovaných studií CREDO (Clopidogrel for Reduction of Events During Observation)a PCI-CURE (Clinical Implications of Percutaneous Coronary Intervention-Clopidogrel in Unstable angina to prevent Recurrent Events) rovněž nedokládají přínos pokračování v léčbě klopidogrelem více než l měsíc od implantace konvenčního kovového stentu. Riziko úmrtí a dalšího infarktu myokardu, které jsou základem současné definice trombózy stentu, je od konce 1. měsíce po PCI dále srovnatelné pro nemocné léčené klopidogrelem i placebem [26,27].
Přesvědčivé důkazy o potřebě léčby klopidogrelem déle než 1 měsíc po implantaci konvenčního kovového stentu tedy nemáme. Tato skutečnost se odráží i v nejnovějších amerických a evropských doporučeních pro koronární angioplastiku [28,29]. Léčba klopidogrelem po implantaci kovového stentu po dobu 1 měsíce má doporučení IB dle amerických doporučení a doporučení IA dle evropských. Výsledky studie CURE vedly autory evropských doporučení k návrhu prodloužené léčby klopidogrelem na 9-12 měsíců u nemocných léčených pro akutní koronární syndrom (doporučení IB). Pokud je však takový nemocný ošetřen konvenčním kovovým stentem, bude vhodné s ohledem na výsledky studie PCI-CURE při rozhodování o léčbě klopidogrelem delší 1 měsíce měřit riziko další kardiovaskulární příhody proti riziku krvácení u každého konkrétního nemocného.
Thienopyridiny po implantaci lékového stentu (drug eluting stent - DES)
S cílem omezit výskyt restenózy po konvenčních kovových stentech byly vyvíjeny stenty lékové (drug eluting stents - DES). Povrch stentu je pokrytý polymerem a léčivo se schopností omezit proliferativní složku zánětlivé odpovědi je pomalu uvolňováno do okolní cévní stěny. Tyto stenty již v prvních studiích potvrdily výrazný vliv na snížení výskytu restenózy. Sirolimus (stent CypherTM) se ukázal být účinnější v potlačení neointimální proliferace ve srovnání s paklitaxelem (stent TaxusTM), avšak bez vlivu na výskyt angiografické či klinické restenózy. Vysoká účinnost v omezení výskytu restenózy vedla k širokému používání DES ve světě a odhaduje se, že ke konci roku 2006 bylo implantováno asi 6 miliónů lékových stentů. Takový masivní nástup těchto trvalých koronárních implantátů na základě několikaměsíčních výsledků prvních studií lze hodnotit jako nekritický. Do klinického použití se mezitím dostávají další lékové stenty, podpořené klinickými studiemi se zatím kratším obdobím klinického sledování [30-34].
Doba trvání duální protidestičkové léčby po implantaci DES se řídila dobou uvolňování antiproliferativního léčiva ze struktury stentu. Pro stent CypherTM, který uvolňuje sirolimus po dobu 2 měsíců, byla doporučena a ve většině studií testována doba podávání klopidogrelu 2 měsíce. Menšina studií s tímto lékem používala 3měsíční režim a ten se nakonec stal doporučeným ve směrnicích evropské i amerických kardiologických společností. Paklitaxel se ze stentu TaxusTM uvolňuje nejméně po dobu 6 měsíců a stejnou dobu by podle doporučení měl být podáván i klopidogrel [28,29].
Pozdní trombóza lékového stentu
Pravděpodobně první popis pozdní trombózy lékového stentu byl v literatuře zaznamenán v roce 2003 [35]. Již rok poté se možné existenci tohoto fenoménu věnoval renomovaný časopis Lancet. Nejprve v srpnu v metaanalýze 11 randomizovaných studií s dobou sledování 6-12 měsíců potvrdil účinnost a bezpečnost lékových stentů v tomto časovém období, poté však v říjnu publikoval článek o 4 případech s angiograficky dokumentovanou trombózou za 1 rok a déle po implantaci stentu [36,37]. Nastalo intenzivní pátrání po reálném výskytu pozdní trombózy lékových stentů, byly hledány rizikové faktory pro tuto vážnou klinickou příhodu a výsledkem byla a je celá řada observačních klinických studií. Frekvence pozdní trombózy lékových stentů je v těchto observačních studiích udávána v rozmezí 0,26-0,70 % a je srovnatelná nebo je menší ve srovnání s frekvencí trombózy subakutní. Mortalita těchto příhod je však velmi vysoká a je udávána v desítkách procent (31-45 %). Rizikové faktory jsou identifikovány ve vzácné shodě co do své frekvence i síly významnosti. Nejvýraznějším rizikovým faktorem je předčasné vysazení klopidogrelu, následováno až s velkým odstupem renální insuficiencí, cukrovkou a nepříznivým angiografickým charakterem léze [38-41].
Pozdní trombóza DES v randomizovaných klinických studiích
Obava o dlouhodobou bezpečnost lékových stentů vedla k hodnocení nejdelších a dobře kontrolovaných údajů z prvních randomizovaných studií s lékovými stenty (FDA Advisory Panel, Circulatory systems devices panel, Gaithersburg, USA, 7.-8. 12. 2006). Pro posouzení bezpečnosti stentu sirolimus vylučujícího stentu (SES) CypherTM firmy Cordis byly použity údaje ze studií RAVEL, SIRIUS, C-SIRIUS a E-SIRIUS. Hodnoceno bylo 1 748 nemocných sledovaných více než 4 roky, kteří byli léčeni trvale aspirinem a klopidogrel užívali pouze první 2-3 měsíce. Nebyl zjištěn žádný významný rozdíl ve výskytu infarktu myokardu (SES 6,4 % vs BMS 6,2 %), ani ve výskytu úmrtí (SES 6,7 % vs BMS 5,4 %). Stent CypherTM má tedy při použití ve shodě s indikacemi randomizovaných studií schopnost snížit riziko opakované revaskularizace o 62-80 % při srovnatelném riziku infarktu myokardu nebo úmrtí v horizontu minimálně 4letého sledování. Riziko trombózy stentu CypherTM je v dlouhodobém horizontu srovnatelné s konvenčním kovovým stentem bez ohledu na typ definice.
Podobně dopadlo dlouhodobé hodnocení paklitaxel uvolňujícího stentu (PES) TaxusTM firmy Boston Scientific. Při hodnocení 1 797 pacientů ze 4 největších randomizovaných studií s dobou sledování delší 4 let bylo zjištěno srovnatelné riziko infarktu myokardu (PES 6,9 % vs BMS 6,4 %) a byla zjištěna srovnatelná mortalita (PES 7,1 % vs BMS 7,4 %). Pravděpodobnost další revaskularizace je pomocí PES snížena o významných 48 %. Bezpečnost stentu TaxusTM z hlediska rizika pozdní trombózy je opět srovnatelná s rizikem pozdní trombózy konvenčního stentu. Nemocní ve studiích s PES byli léčeni trvale aspirinem, klopidogrel užívali prvních 6 měsíců po implantaci stentu.
Dlouhodobé údaje z těchto randomizovaných a dobře kontrolovaných studií svědčí tedy pro zcela srovnatelnou bezpečnost lékových a konvenčních stentů z pohledu rizika úmrtí, infarktu myokardu i pozdní trombózy. Lékové stenty potom zásadním způsobem snižují pravděpodobnost opakované revaskularizace. Doporučení americké FDA na konci roku 2006 považuje lékové stenty Cypher a Taxus za dlouhodobě bezpečné při použití ve schválených indikacích (http://www.fda.gov/cdrh/news/091406.html).
Pozdní trombóza DES v běžné klinické praxi
V reálné klinické praxi jsou lékové stenty implantovány nemocným s méně příznivými klinickými a angiografickými charakteristikami, než jaké mají nemocní v randomizovaných studiích. Ve Spojených státech je použití DES mimo schválené indikace („off-label use“) zaznamenáno ve čtvrtině všech provedených PCI. Podíl použití DES v jiných než schválených indikacích v čase narůstá především proto, že lékové stenty jsou implantovány do lézí s nejvyšší pravděpodobností restenózy - tedy v těch případech, v nichž lékaři očekávají největší přínos jejich antiproliferativního účinku [42]. Observační studie z běžné klinické praxe potom prokazují trend k vyššímu výskytu trombotických komplikací u nemocných ošetřených lékovým stentem. Kritika těchto studií poukazuje na retrospektivní charakter sběru dat a na rozdílný rizikový profil pacientů ve srovnávaných skupinách [43,44].
Velmi cenné údaje přinesla švýcarská studie BASKET, ve které byli všichni nemocní podstupující PCI během 1 roku randomizováni k implantaci kovového nebo lékového stentu. Všichni nemocní byli léčení 6 měsíců klopidogrelem bez ohledu na to, jaký stent jim byl implantován. Během 18 měsíců od implantace stentu se ukázalo riziko úmrtí nebo infarktu myokardu srovnatelné, ať byl nemocný ošetřen lékovým či konvenčním kovovým stentem (8,4 % vs 7,5 %, p = 0,63). Významné snížení potřeby opakované revaskularizace bylo při použití DES zachováno (RR = 0,52, 95% CI 0,33 - 0,85, p = 0,009). Znepokojivý se však ukázal být trend vývoje úmrtí a infarktu myokardu, kdy u nemocných léčených BMS se po určité době křivka výskytu těchto příhod oplošťuje, zatímco u nemocných ošetřených implantací DES tyto příhody v čase prakticky lineárně narůstají [45,46].
Studie BASKET-LATE nemá statistickou sílu k průkazu vyššího výskytu pozdních klinických komplikací DES a proto je možné data považovat pouze za observační. Zásadním přínosem této studie je právě průkaz zcela odlišného trendu výskytu kardiovaskulárních komplikací v čase po implantaci DES a BMS. Tento časový vývoj nastoluje zásadní otázku, jak dlouhá má být duální antiagregační léčba aspirinem a klopidogrelem po implantaci lékového stentu, aby byl udržen příznivý klinický výsledek snížení restenózy a přitom nemocný nebyl ohrožen závažnými pozdními komplikacemi.
Jaká je správná délka léčby klopidogrelem po implantaci lékového stentu?
Do současnosti nemáme k dispozici žádnou prospektivní randomizovanou studii, která by stanovila optimální délku podávání klopidogrelu po implantaci DES. Observační studie přitom shodně shledávají předčasné ukončení léčby klopidogrelem jako výrazný rizikový faktor pro pozdní trombózu stentu [37-40]. Největší a nejaktuálnější z dosud publikovaných observačních studií se potom snaží najít bezpečnou hranici pro ukončení duální protidestičkové léčby [25]. Hodnoceno je 4 666 nemocných ošetřených v Duke Heart Center v letech 2000-2005 implantací konvenčního (n = 3 165) nebo lékového (n = 1 501) stentu. Pacienti, kteří byli v 6. měsíci od PCI bez klinické příhody, byli dále léčeni klopidogrelem či bez něj a jejich stav byl hodnocen ve 24. měsíci po PCI. Stejným způsobem byla hodnocena skupina nemocných, kteří byli bez klinické příhody ve 12. měsíci od PCI.
Pokračování v léčbě klopidogrelem v 6. měsíci po implantaci DES tedy významně snížilo riziko úmrtí nebo infarktu myokardu. Hlavní přínos byl přitom prokazatelný ve snížení úmrtnosti (-3,3 %, 95% CI -6,3 až -0,3), snížení nefatálního infarktu myokardu nedosáhlo hranice statistické významnosti (-1,3 %, 95% CI -3,4 až 0,8). Podobné výsledky byly získány při hodnocení ve 12. měsíci. Pokračování v léčbě klopidogrelem vedlo u nemocných s lékovým stentem opět ke snížení mortality (-3,5 %, 95% CI -5,9 až -1,1), ale statistické významnosti již dosáhlo i snížení výskytu nefatálního infarktu myokardu (-1,0 %, 95% CI -1,9 až -0,1). Pokud však byl nemocný ošetřen konvenčním kovovým stentem (BMS), potom nemělo prodloužení léčby klopidogrelem za 6. či za 12. měsíc žádný význam.
Tyto údaje jsou znepokojivé a jsou částečně v rozporu s dlouhodobými výsledky randomizovaných studií o lékových stentech. Pro bezpečnost 2 - až 3měsíční léčby klopidogrelem po implantaci SES svědčí 4leté sledování nemocných po implantaci stentu CypherTM, výsledky studií se stentem TaxusTM potom svědčí pro bezpečnost 6měsíční léčby po implantaci PES. Výsledky uvedené observační studie by však svědčily o zachránění 35 životů a předejití 10 nefatálním infarktům na 1 000 léčených při pokračování léčby klopidogrelem ještě po 12. měsíci od implantace lékového stentu!
Reálné klinické praxe se týká ještě jedno důležité zjištění. Zatímco se hledá optimální doba léčby klopidogrelem po implantaci lékového stentu a pátrá se po možnostech individuální detekce ohrožených nemocných, každý 7. nemocný s lékovým stentem neužívá klopidogrel z vlastní vůle ani minimální současnou doporučenou dobu. Jde především o starší nemocné, o pacienty v obtížnější ekonomické situaci a o nemocné hůře informované při propouštění z nemocnice. Pacient, který vysadí léčbu do 1 měsíce od implantace lékového stentu, má přitom 1roční mortalitu až 9násobně zvýšenou [47]!
Závěr
Pozdní trombóza koronárního stentu je reálný fenomén s velmi nízkou frekvencí výskytu, avšak se závažnými klinickými následky. Současný stav klinického výzkumu nedovolí individuální detekci ohrožených nemocných. Po implantaci konvenčního stentu (BMS) je pravděpodobnost této klinické příhody malá a v čase od implantace se dále snižuje; léčba klopidogrelem proto nebude zdůvodněna déle než 1 měsíc po PCI. Dlouhodobá bezpečnost lékových stentů je potvrzována výsledky randomizovaných studií a zpochybňována výsledky observačních studií z běžné klinické praxe. Hlavním rizikovým faktorem pozdních trombotických komplikací lékových stentů se ukazuje předčasné vysazení klopidogrelu, a proto převládá v současnosti doporučení podávat tento lék po implantaci lékového stentu 6-12 měsíců. Názory na dlouhodobé zajištění lékových stentů duální protidestičkovou léčbou se budou v blízké budoucnosti dále vyvíjet s příchodem nových typů lékových stentů a se získáváním dalších prospektivních informací.
MUDr. Ivo Varvařovský, Ph.D.
www.kardio-troll.cz
532 03, Pardubice.
e-mail: ivovarvarovsky@kardio-troll.cz
Doručeno do redakce: 3. 1. 2007
Přijato po recenzi: 18. 4. 2007
Zdroje
1. Libby P, Simon DI. Inflammation and thrombosis: the clot thickens. Circulation 2001; 103 : 1718-1720.
2. Sigwart U. Endoluminal stenting. 1st ed. London: WB Saunders 1996 : 601.
3. Mak KH, Belli G, Ellis SG Subacute stent thrombosis: evolving issues and current concepts. J Am Coll Cardiol 1996; 27 : 494-503.
4. Orford JL, Lennon R, Melby S. Frequency and correlates of coronary stent thrombosis in the modern era: analysis of a single center registry. J Am Coll Cardiol 2002; 40 : 1567-1572.
5. Ong AT, Hoye A, Aoki J. Thirty-day incidence and six-month clinical outcome of thrombotic stent occlusion after bare-metal, sirolimus, or paclitaxel stent implantation. J Am Coll Cardiol 2005; 45 : 947-953.
6. Krotz F, Sohn HY, Klauss V. Intracoronary brachytherapy-clinical state and pathophysiological considerations. Curr Pharm Des 2005; 11 : 421-433.
7. Joner M, Finn AV, Farb A. Pathology of drug-eluting stents i humans: delayed healing and late thrombotic risk. J Am Coll Cardiol 2006; 48 : 203-205.
8. Farb A, Burke AP, Kolodgie FD. Pathological mechanisms of fatal late coronary stent thrombosis in humans. Circulation 2003; 108 : 1701-1706.
9. Hong MK, Mintz GS, Lee CW. Incidence, mechanism, predictors, and long-term prognosis of late stent malapposition after bare-metal stent implantation. Circulation 2004; 109 : 881-886.
10. Virmani R, Guagliumi G, Farb A. Localized hypersensitivity and late coronary thrombosis secondary to a sirolimus-eluting stent: should we be cautious? Circulation 2004; 109 : 701-705.
11. Feres F, Costa JR, Abizaid A. Very late thrombosis after drug-eluting stents. Catheter Cardiovasc Interv 2006; 68 : 83-88.
12. Lev EI, Alviar CL, Arikan ME. Platelet reactivity in patients with subacute stent thrombosis compared with non-stent-related acute myocardial infarction. Am Heart J 2007; 153: e1-e6.
13. Bavry AA, Chiu JH, Jefferson BK. Development of coronary aneurysma after drug-eluting stent implantation. Ann Intern Med 2007; 144: e-publikace 4.12.2006.
14. Serruys PW, Strauss BH, Beatt KJ. Angiographic follow-up after placement of a self-expanding coronary artery stent. N Engl J Med 1991; 324 : 13-17.
15. Colombo A, Hall P, Nakamura S. Intracoronary stenting without anticoagulation accomplished with intravascular ultrasound guidance. Circulation 1995; 91 : 1676-1688.
16. Leon MB, Baim DS, Popma JJ. A clinical trial comparing three antithrombotic-drug regimens after coronary artery stenting. N Engl J Med 1998; 339 : 1665-1671.
17. Berger PB, Mahaffey KW, Meier SJ. Safety and efficacy of only 2 weeks of ticlopidine therapy in patients at increased risk of coronary stent thrombosis: results from the Antiplatelet Therapy alone versus Lovenox plus Antiplatelet therapy in patients at increased risk of Stent Thrombosis (ATLAST) trial. Am Heart J 2002; 143 : 841-846.
18. Bertrand ME, Rupprecht HJ, Urban P. Double-blind study of the safety of clopidogrel with and without a loading dose in combination with aspirin compared with ticlopidine in combination with aspirin after coronary stenting. The clopidogrel aspirin stent international cooperative study (CLASSICS). Circulation 2000; 102 : 624-629.
19. Bhatt DL, Bertrand ME, Berger PB. Meta-analysis of randomized and registry comparisons of ticlopidine with clopidogrel after stenting. J Am Coll Cardiol 2002; 39 : 9-14.
20. Costa MA, Sabate M, van der Giessen WJ. Late coronary occlusion after intracoronary brachytherapy. Circulation 1999; 100 : 789-792.
21. Weisz G, Moses JW, Schofer J. Late stent thrombosis in sirolimus-eluting versus bare-metal stents in 4 randomized clinical trials with 3-year follow-up. J Am Coll Cardiol 2006; 47 Suppl B: 8B.
22. Wang F, Stouffer GA, Waxman S. Late coronary stent thrombosis: early vs late stent thrombosis in the stent era. Catheter Cardiovasc Interv 2002; 55 : 142-147.
23. Bhatt DL, Fox KAA, Hacke W Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006; 354 : 1706-1717.
24. Connolly SJ. The Atrial Fibrilation Clopidogrel Trial with Irbesartan for Prevention of Vascular Events (ACTIVE-W). Late Breaking Clinical Trials III, AHA Scientific Session 2005, Dallas, November 13-16, 2005.
25. Eisenstein EL, Anstrom KJ, Kong DF. Clopidogrel use and long-term clinical outcomes after drug-eluting stent implantation. JAMA 2007; 297 : 159-168.
26. Steinhubl SR, Berger PB, Tift Mann J 3rd. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA 2002; 288 : 2411-2420.
27. Mehta S, Yusuf S, Peters RJG. Effects of pre-treatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet 2001; 358 : 527-533.
28. Smith SC, Feldman TE, Hirshfeld JW. ACC/AHA/SCAI Guideline Update for Percutaneous Coronary Intervention - Summary Article. J Am Coll Cardiol 2006; 47 : 216-235.
29. Silber S, Albertsson P, Aviles FF. Guidelines for percutaneous coronary intervention. Eur Heart J 2005; 26 : 804-847.
30. Morice MC, Serruys PW, Sousa JE. A randomized comparison of a sirolimus-eluting stent with a standard stent for coronary revascularization. N Engl J Med 2002; 346 : 1773-1780.
31. Grube E, Silber S, Hauptman KE. TAXUS-I: six - and twelve-month results from a randomized, double-blind trial on a slow-release paclitaxel-eluting stent for de novo lesion. Circulation 2003; 107 : 38-42.
32. Stone GW, Ellis SG, Cox DA. One-year clinical results with the slow-release, polymer-based, paclitaxel-eluting TAXUS stent: the TAXUS-IV trial. Circulation 2004; 109 : 1942-197.
33. Morice MC, Colombo A, Meier B. Sirolimus - vs paclitaxel-eluting stents in de novo coronary artery lesions. The REALITY trial: a randomized controlled trial. JAMA 2006; 295 : 895-904.
34. Fajadet J, Wijns W, Laarman GJ. Randomized, double-blind, multicenter study of the Endeavor zotarolimus-eluting phosphorylcholine-encapsulated stent for treatment of native coronary artery lesion: clinical and angiographic results of the ENDEAVOR II trial. Circulation 2006; 114 : 798-806.
35. Kerner A, Gruberg L, Kapeliovich M. Late stent thrombosis after implantation of a sirolimus-eluting stent. Catheter Cardiovasc Interv 2003; 60 : 505-508.
36. Babapulle MN, Joseph L, Belisle P. A hierarchical Bayesian meta-analysis of randomised clinical trials of drug-eluting stents. Lancet 2004; 364 : 583-591.
37. McFadden EP, Stabile E, Regar E. Late thrombosis in drug-eluting coronary stents after discontinuation of antiplatelet therapy. Lancet 2004; 364 : 1519-1521.
38. Ong AT, McFadden EP, Regar E. Late angiographic stent thrombosis (LAST) events with drug-eluting stents. J Am Coll Cardiol 2005; 45 : 2088-2092.
39. Iakovou I, Schmidt T, Bonizzoni E Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005; 293 : 30.
40. Kuchulakanti PK, Chu WW, Torguson R Correlates and long-term outcomes of angiographically proven stent thrombosis with sirolimus - and paclitaxel-eluting stents. Circulation 2006; 113 : 1108-1113.
41. Moreno R, Fernandez C, Hernandez R. Drug-eluting stent thrombosis. Results from a pooled analysis including 10 randomized studies. J Am Coll Cardiol 2005; 45 : 954-959.
42. Rao SV, Shaw RE, Brindis RG. On - versus off-label use of drug-eluting coronary stents in clinical practice. Report from the American College of Cardiology National Cardiovascular Data Registry. Am J Cardiol 2006; 97 : 1478-1481.
43. Carlsson J, von Wagenheim B, Linder R Is late stent thrombosis in drug-eluting stents a real clinical issue? A single center experience and review of the literature. Clin Res Cardiol 2006; 95: e-publikace 22.12.2006.
44. Lagerqvist B, James SK, Stenestrand U. Long-term outcomes with drug-eluting stents versus bare-metal stents in Sweden. N Engl J Med 2007; 356 : 1009-1019.
45. Kaiser C, Brunner-La Rocca HP, Buser PT. Incremental cost-effectiveness of drug-eluting stents compared with a third-generation bare-metal stent in a real-world setting: randomised Basel Stent Kosten Effektivitats Trial (BASKET). Lancet 2005; 366 : 921-929.
46. Pfisterer M, Brunner-La Rocca HP, Buser PT. Late clinical events after clopidogrel discontinuation may limit the benefit of drug-eluting stents: an observational study of drug-eluting versus bare-metal stents. J Am Coll Cardiol 2006; 48 : 2584-2591.
47. Spertus JA, Kettelkamp R, Vance C. Prevalence, predictors, and outcomes of premature discontinuation of thienopyridine therapy after drug-eluting stent placement. Results from the PREMIER registry. Circulation 2006; 113 : 2803-2809.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence - editorial
- Rituximab (antiCD20 monoklonální protilátka) a molekulárně biologická negativita po léčbě nemocných s folikulárním lymfomem - cesta k vyléčení? - editorial
- Plicní alveolární proteinóza – minulost a přítomnost – editorial
- Lékové stenty - pro všechny, pro někoho, či pro nikoho? - editorial
- Změny metabolizmu lipidů u pacientů v aktivní fázi Crohnovy choroby
- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence
- Dosažení Bcl-2/IgH negativity v periferní krvi/kostní dřeni po léčbě je u nemocných s folikulárním lymfomem spojeno s lepší prognózou onemocnění
- Vliv terapie statiny na změny kostní denzity postmenopauzálních žen
- Analýza vlivu cirkadiánního rytmu na turbulenci srdeční frekvence u pacientů bez průkazu organického onemocnění srdce
- Plicní alveolární proteinóza
- Pozdní trombóza koronárního stentu a klopidogrel
- Syndróm MIAC (malnutrition, inflammation, atherosclerosis, calcification)
- Pseudomembranózní kolitida
- Inkretinová strategie léčby diabetes mellitus 2. typu - inhibitor DPP-IV sitagliptin
- Přínos ibandronátu pro léčbu postmenopauzální osteoporózy
- Chronická exsudativní benigní perikarditida - popis familiárního výskytu: kazuistiky
- Efekt transplantace ledvin na oxidační stres u pacientů s chronickým selháním ledvin
- Výsledky studie ADVANCE
- Kutnohorská J. Etika ve zdravotnictví.
- Škubla P. Veľký atlas húb
- Grofová Z. Nutriční podpora. Praktický rádce pro sestry.
- Krajíček M, Peregrin JH, Roček M, Šebesta P et al. Chirurgická a intervenční léčba cévních onemocnění.
- Prof. MUDr. Petr Broulík, DrSc., sedmdesátníkem
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Pseudomembranózní kolitida
- Plicní alveolární proteinóza
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



