-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Roboticky asistovaná radikální cystektomie: technika podle Mayo Clinic
Robot assisted radical cystectomy: the Mayo Clinic technique
Robot-assisted radical cystectomy (RARC) is the latest minimally invasive treatment of bladder cancer. The technique of RARC allows for the following potential advantages: minimal blood loss, decreased fluid shifts, and smaller surgical incisions, while still maintaining sound oncologic surgical princles. All benefits theoretically translate into less patient morbidity and shorter convalescence. We describe the operative technique of RARC, robot-assisted extended pelvic lymph node dissection, and intracorporeal/ /extracorporeal urinary diversion.
Key words:
bladder cancer, robot assisted, radical cystectomy, urinary diversion
Autoři: C. O. Mmeje; E. P. Castle
Vyšlo v časopise: Urol List 2012; 10(3): 29-33
Souhrn
Roboticky asistovaná radikální cystektomie (RARC) představuje nejmodernější techniku pro minimálně invazivní léčbu karcinomu močového měchýře. Technika RARC skýtá následující výhody: minimální krevní ztrátu, menší posuny tekutin a menší incizi při současném zachování standardních onkologicko-chirurgických pravidel. Všechny výše uváděné benefity znamenají v důsledku menší morbiditu a kratší dobu rekonvalescence. Autoři článku popisují operační techniku RARC – roboticky asistovanou rozšířenou lymfadenektomii s intra-/extrakorporální derivací moči.
Klíčová slova:
karcinom močového měchýře, roboticky asistovaný, radikální cystektomie, derivace močiRadikální cystektomie s derivací moči stále představují hlavní modalitu chirurgické léčby karcinomu močového měchýře. Urologie si osvojila minimálně invazivní techniky s cílem minimalizovat dopad léčby na pacienty, tuto skutečnost lze jasně pozorovat na změně přístupu k radikální nefrektomii [1] i radikální prostatektomii. Po uvedení operačního systému da Vinci® (Intuitive Surgical, Sunnyvale, CA) došlo k významnému zvýšení prevalence laparoskopické radikální prostatektomie, neboť tento systém umožňuje překonat některé z technicky náročných fází laparoskopických operací v pánvi [2]. Urologové začali brzy využívat technologii systému da Vinci i při laparoskopické cystektomii. Menon et al v roce 2003 jako první publikovali studii popisující roboticky asistovanou radikální cystektomii (RARC) s derivací moči [3]. Některé technické a fyziologické aspekty RARC mohou potenciálně vést ke snížení morbidity. Díky vytvoření pneumoperitonea dochází k menší krevní ztrátě a díky menším přesunům tekutin v důsledku uzavřené dutiny břišní dochází k menšímu počtu významných ztrát. Výkon vyžaduje provedení menší incize a je spojen s menším retrakčním poraněním svaloviny břicha, což v důsledku klade menší požadavky na analgezii a umožňuje dřívější ambulantní léčbu. Vytvořením pneumoperitonea a umístěním pacienta do Trendelenburgovy polohy jsou střeva oddělena od operačního pole pouze pomocí gravitace; minimální manipulace tak teoreticky může přispívat k dřívější obnově střevní funkce. Ng et al uvádějí při srovnání RARC a otevřené radikální cystektomie menší krevní ztrátu, menší potřebu transfuze, kratší délku hospitalizace a nižší míru výskytu komplikací [4].
RARC zatím vzhledem k absenci jakýchkoli dlouhodobých onkologických sledovacích studií stojí na počátku své cesty k plnému přijetí urologickou komunitou, ale již byly publikovány studie uvádějící krátkodobé a střednědobé výsledky. V nedávné době jsme hodnotili údaje týkající se doby přežití u námi prováděných RARC (Mayo Clinic Arizona a Tulane University) [5]. Celkem bylo léčeno 80 pacientů, z nichž 59 bylo sledováno déle než šest měsíců – tito pacienti byli zařazeni do studijní skupiny. Pacienti byli sledováni průměrně po dobu 25 měsíců (rozmezí 6–49 měsíců). Celková doba přežití činila 82 % po 12 měsících, 69 % po 24 měsících a 69 % po 36 měsících a míra přežití bez recidivy 82 %, 71 %, a 71 %, ve stejném pořadí. Tyto výsledky jsou srovnatelné se staršími studiemi zabývajícími se otevřenou operací a nasvědčují tomu, že v rámci střednědobého sledování RARC nijak neohrožuje kontrolu karcinomu [6].
Neexistují žádné absolutní kontraindikace, na jejichž základě by byla indikace RARC považována za nevhodnou. Dvě peroperační situace však lze považovat za absolutní kontraindikaci pro další pokračování ve výkonu RARC. První kontraindikací je hypotenze nebo zhoršení ventilace po napolohování pacienta a insuflaci dutiny břišní, což je relevantní zejména u obézních pacientů, a v druhém případě se jedná o retenci CO2 vedoucí k nezvladatelné acidóze. Oba případy poukazují na význam pečlivého před-operačního vyšetření kardiopulmonární funkce u této populace pacientů. Relativní kontraindikace zahrnují morbidní obezitu, předchozí ozařování, abnormální anatomii (tj. ektopická ledvina, vaskulární aneuryzma) a předchozí operace břicha a pánve. Stejně jako u všech laparoskopických onkologických operací je nutné i při RARC dodržovat pravidla platná pro otevřenou operaci. V případě, že existují obavy, že by mohlo dojít k ohrožení pravidel týkajících se onkologické bezpečnosti, by neměl být roboticky asistovaný přístup indikován.
TECHNIKA
Polohování pacienta a umístění portů
Pacient je umístěn do dolní litotomické polohy s pažemi připevněnými po stranách. Všechna místa vystavená tlaku by měla být adekvátně podložena, speciální pozornost je třeba věnovat rukám a loktům pacienta. Pacient je uveden do maximální Trendelenburgovy polohy, což je vhodné vyzkoušet ještě před přípravou a zarouškováním pacienta. Rovněž je možné pacienta připevnit popruhem v oblasti hrudníku, po uvedení dolních končetin do dolní litotomické polohy s připevněnými pažemi však dochází k pohybu pacienta na operačním stole pouze výjimečně. Pro tento výkon lze užít da Vinci systém se třemi nebo čtyřmi rameny (robot se čtyřmi rameny může poskytnout výhodu v podobě dodatečné rektrakce střev během lymfadenektomie). Pro tuto operaci jsou nezbytné následující instrumenty: 0° a 30° optika, Maryland bipolární kleště, Cadierého kleště, monopolární nůžky nebo hák, okénkové bipolární kleště, kleště Prograsp™ a dva jehelce. Další vybavení zahrnuje endovaskulární svorkovač, uzamykatelné klipy, sací-irigační zařízení a atraumatický laparoskopický grasper.
První asistent obvykle pracuje na straně po pacientově levici a čtvrté robotické rameno je umístěno na pravé straně od pacienta. Toto uspořádání usnadňuje vytvoření intrakorporální derivace moči. V případě, že zamýšlíme provedení extrakorporální derivace, může být uspořádání opačné: asistent na pravé straně a čtvrté robotické rameno na levé straně pacienta. Při užití trojramenného systému by měl být druhý asistent naproti prvnímu asistentovi.
Celkem se užívá šest portů: jeden 12mm kamerový port, dva 8mm porty pro robotické rameno, 12mm port (nebo 15mm port, který usnadňuje odstranění vzorku) a 5mm porty na asistentově (pravé) straně a jeden doplňkový 8mm port pro čtvrté rameno vlevo. Pokud užíváme trojramenný systém, lze zavést doplňkový 5mm port na straně asistenta. Porty zavedeme ve tvaru obráceného písmene V. 12mm kamerový port zavedeme do střední čáry 1–4 cm kraniálně k pupku. Dva 8mm robotické porty jsou umístěny 8–10 cm laterálně od střední čáry a 1 cm nad úrovní pupku. Dva porty na pravé straně (jeden 5mm a druhý 12/5mm port) jsou umístěny laterálně směrem k pravému robotickému portu a robotický port pro čtvrté rameno (8 mm) je umístěn superior-laterálně směrem k levému robotickému portu (obr. 1).
Obr. 1. Zobrazení zavedení portů. 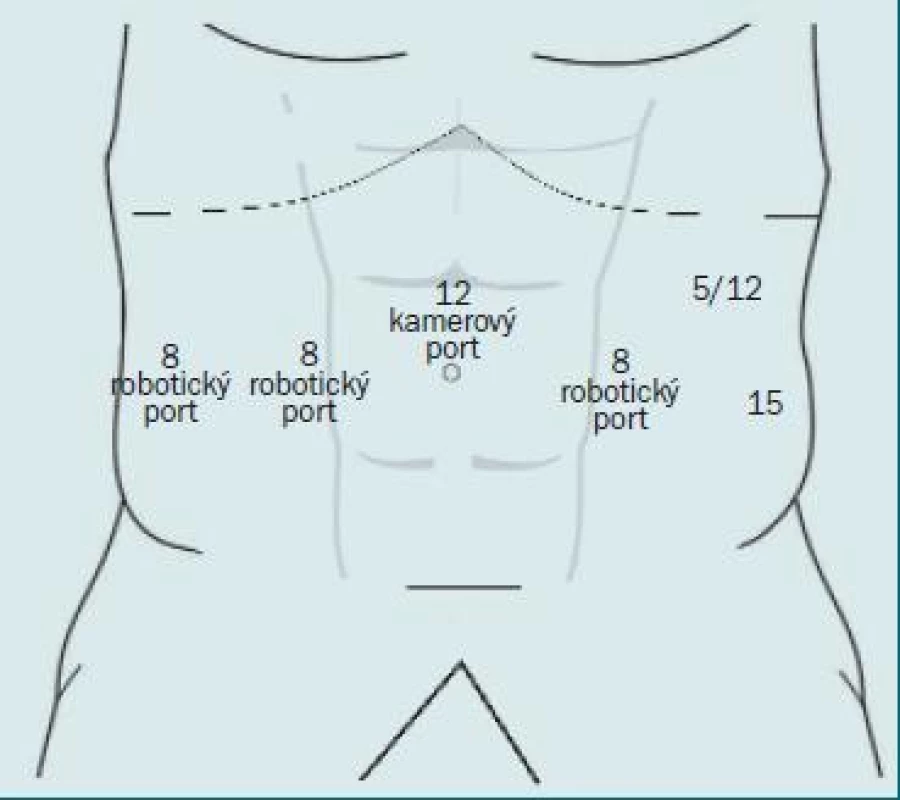
Mobilizace esovité kličky a levého kolon a přerušení levého močovodu
Po umístění portů je robot ukotven. Na počátku výkonu lze užít 30° optiku pro lepší vizualizaci pánve a retroperitonea během lymfadenektomie. Během preparace na posteriorní straně přejdeme na 0° optiku. Výkon zahájíme incizí peritonea laterálně směrem k levému kolon. Levé kolon a esovitou kličku je nutné uvolnit od levé stěny, čímž zajistíme přístup k levým iliackým žilám a levému močovodu.
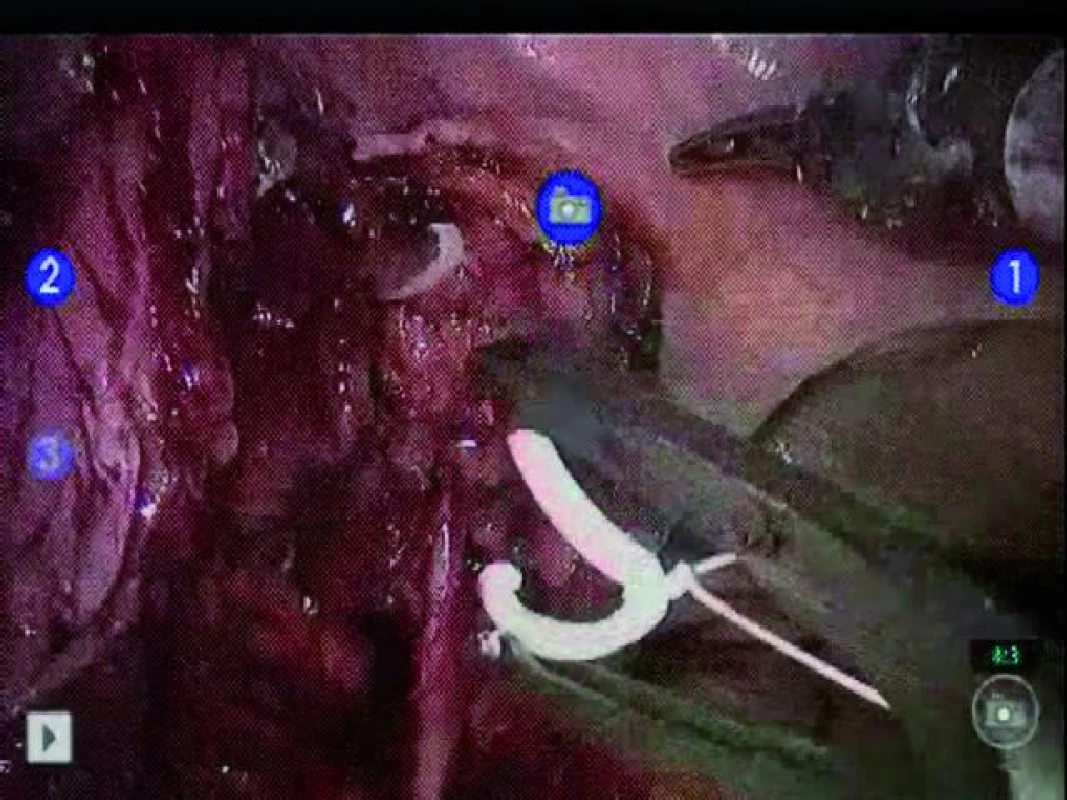
Identifikujeme levý močovod, křížící iliacké cévy. Močovod je třeba uvolnit od okolních struktur při současném zachování co největšího množství periureterální tkáně. Distální konec lze preparovat směrem dolů až k jeho ústí do močového měchýře. Přímo laterálně k ústí močovodu do močového měchýře vidíme levou umbilikální arterii nebo levou horní vezikální arterii. Močovod lze zaklipovat distálně pomocí uzamykatelného klipu. Proximální klip na močovodu by měl být opatřen připravenou ligaturou ke klipu, díky čemuž není nutné později močovod dále označovat (obr. 2). Tento steh by měl mít délku minimálně 10–12 palců, což nám usnadní vstup do extrakční incize během extrakorporální rekonstrukce. Je třeba vypreparovat všechny úpony močovodu kraniálně před jeho přerušením vzhledem k tomu, že poté může být proximální preparace obtížná. Močovod můžeme následně přerušit ostrým nástrojem. Okraj je odeslán na patologické vyšetření.
Levostranná pánevní lymfadenektomie
Při lymfadenektomii jsou v levém robotickém rameni umístěny Maryland bipolární kleště a v druhém rameni monopolární nůžky. Preparaci zahájíme na levé zevní iliacké tepně a používáme techniku tzv. „split-and-roll“. Preparaci vedeme proximálně směrem k bifurkaci aorty. Při preparaci podél zevní a společné iliacké žíly je třeba dbát zvýšené opatrnosti, vzhledem k tomu, že žíly mohou být v důsledku tlaku pneumoperitonea kolabovány. Pokud pokračujeme posteriorně přímo za bod, kde zevní iliacká žíla kříží rameno kosti stydké, narazíme na n. obturator a cévy. Hypogastrickou arterii je třeba skeletonizovat. Použití uzamykatelných klipů závisí na preferenci operatéra, autoři však doporučují umístit alespoň jeden klip na distální a proximální hranici preparace lymfatických uzlin, čímž minimalizují riziko úniku lymfy.
Pro maximální odstranění lymfatických uzlin z pánve je třeba preparaci vést laterálně od zevních iliackých žil („space of Marcille“), čímž usnadníme odstranění proximálních zevních iliackých lymfatických uzlin a lymfatických uzlin lokalizovaných posteriorně a inferiorně od n. obturator. Lymfatické uzliny lze umístit do samostatných (10mm) sáčků na preparát.
Preparaci podél laterální strany pánevních žil je třeba vést proximálně směrem nahoru k bifurkaci aorty. Podél proximální části zevní iliacké arterie můžeme narazit na malou větev tepny zásobující m. psoas, kterou lze zachovat nebo zaklipovat a přerušit. Dolní dutou žílu snadno identifikujeme podél proximální a laterální hranice pravé společné iliacké arterie.
Přerušení pravého močovodu a pravostranná lymfadenektomie
Preparaci vedeme podobným způsobem jako na levé straně, je však třeba poznamenat, že incizi v retroperitoneu na této straně je třeba rozšířit přes pravou část mezenteria esovité kličky, čímž vytvoříme preaortický prostor. V této oblasti je nutné vytvořit poměrně velký prostor. Operatéři se často obávají provádět tupou preparaci vzhledem k obavám z poranění mezenterických cév, při provádění tupé preparace v blízkosti velkých cév však snadno vytvoříme pracovní prostor. Jakmile identifikujeme močovod křížící iliacké cévy vpravo, je třeba jej před přerušením zachytit pomocí sutury distálně a preparovat až k jeho vyústění do močového měchýře (podobně jako na levé straně). Lymfadenektomii na pravé straně provádíme naprosto stejným způsobem jako na levé straně, preparaci vedeme ve stejném rozsahu. Po ukončení lymfadenektomie jasně vidíme pupeční a horní vezikální arterie, které zaklipujeme.
Transpozice levého močovodu přes mezenterium esovité kličky
Levý močovod lze transponovat přes mezenterium esovité kličky s pomocí asistenta na pravé straně. Asistent by měl jemně posouvat instrument s tupým koncem pod mezenteriem podél anteriorního povrchu aorty. Esovitá klička je posunuta směrem doprava, čímž by se měla odhalit špička instrumentu. Suturu na levém močovodu lze uchopit, čímž lze močovod snadno protáhnout oknem v mezenteriu.
Zachycení distálního ilea pomocí sutury
Ileum je třeba zachytit pomocí 2-0 vicrylové sutury o délce alespoň 10–12 palců. Pro usnadnění přesunu ilea do abdominální incize a identifikace distální části ilea je často užitečné mobilizovat laterální úpony céka.
Vytvoření prerektálního a posteriorního vezikálního prostoru
Pro optimální zobrazení vyměníme optiku kamery za 0°. Provedeme incizi v peritoneu od zadní části močového měchýře až po anteriorní esovitou kličku. Pomocí tupé preparace a opatrné elektrokoagulace vytvoříme prerektální prostor, přičemž asistent retrahuje močový měchýř a jeho posteriorní struktury anteriorním směrem. U mužů je nutné incidovat Denonvilliersovu fascii, abychom mohli vést preparaci co nejvíce kaudálně. Preparaci vedeme směrem dolů k m. rectourethralis. Pokud máme v úmyslu ušetřit nervové svazky, je třeba preparaci vést anteriorně směrem k Denonvilliersově fascii a ukončit ji na anteriorním povrchu rekta v blízkosti prostaty. U žen vedeme preparaci podél sliznice přední vaginální stěny (při výkonu se zachováním vaginy). Pokud neplánujeme zachovat vaginální stěnu, identifikujeme vaginální manžetu zavedením tamponu do vaginy. Vaginální apex lze incidovat pomocí monopolárního elektrokauteru. Ačkoli může docházet k úniku menšího množství plynu, tamponáda způsobuje dostatečnou okluzi vaginy. Následně vedeme preparaci směrem dolů k posteriornímu aspektu periuretrální incize vytvořené na počátku výkonu. Při nervy šetřícím výkonu u žen je třeba vaginu incidovat co nejvíce možná anteriolaterálně. Abychom zachovali neurovaskulární tkáň probíhající podél anteriolaterálního aspektu vaginy, je nutné ušetřit tkáň v laterální části vaginy.
Přerušení zbývajících inferiorních vezikálních cév
Po dosažení mezní hranice preparace podél posteriorního aspektu močového měchýře lze přerušit laterální úpony močového měchýře. Při výkonu bez zachování nervových svazků lze laterální úpony přerušit pomocí uzamykatelných klipů nebo kombinací bipolárního a monopolárního instrumentu. Na obou stranách lze rovněž užít endovaskulární stapler. Je třeba zdůraznit, že preparaci je nutné vést kaudálně skrze endopánevní fascii, čímž úplně mobilizujeme močový měchýř od laterálních úponů a rekta. K dokončení preparace často užíváme kombinaci preparace laterálně a posteriorně.
Zachování neurovaskulárních svazků
Při operaci se zachováním neurovaskulárních svazků jsou tyto identifikovány na posteriolaterálních aspektech prostaty směrem dolů k anteriornímu povrchu kolon. Svazky lze mobilizovat uvolněním laterální fascie anteriorně k nervovým svazkům podél povrchu prostaty nebo vaginy. Preparace je propojena s incizí anteriorně před Denonvilliersovou fascií. Abychom zabránili poranění neurovaskulárních svazků, je třeba inferiorní pedikly močového měchýře a prostaty zasvorkovat a přerušit pomocí studených nůžek. Preparaci pro zachování nervových svazků bychom měli vést směrem dolů ke genitourinární diafragmě, abychom předešli poranění při preparaci apexu a močové trubice. Po mobilizaci nervů lze dokončit preparaci zbývajících posteriorních a laterálních úponů močového měchýře a/nebo prostaty. V této fázi by měly zbývat pouze následující úpony: úpon k urachu, anteriorní úpony, úpon k prostatě a močové trubici. Mediální a střední umbilikální úpony je třeba přerušit pomocí elektrokauteru co nejvíce proximálně. Preparaci a peritoneální incizi vedeme laterálně k mediálním umbilikálním ligamentům kaudálně k přednímu povrchu močového měchýře.
Dokončení preparace apexu a podvaz a přerušení močové trubice
Pokud jsme tak již neučinili, je třeba na pravé i levé straně vytvořit paravezikální prostor. Je třeba provést bilaterální incizi endopánevní fascie a následně dokončit preparaci apexu prostaty nebo vaginy. V této fázi lze dorzální žilní komplex podvázat pomocí 1 vicrylové sutury (ve tvaru číslice 8).
Je nezbytné vypreparovat pahýl močové trubice o dostatečné délce. Dostatečně dlouhý pahýl umožní snazší aplikaci uzamykatelného klipu nebo podvaz pomocí sutury ve snaze zabránit rozsevu tumoru při přerušování močové trubice (obr. 3). Pakliže byla předchozí preparace na posteriorní straně dostatečná, mělo by zbývat pouze minimum posteriorní tkáně mimo zbytky m. rectourethralis. Před vytvořením neoveziky lze z proximální části přerušené močové trubice odebrat biopsii.
Obr. 3. Preparace a umístění uzamykatelného klipu při přerušení močové trubice. 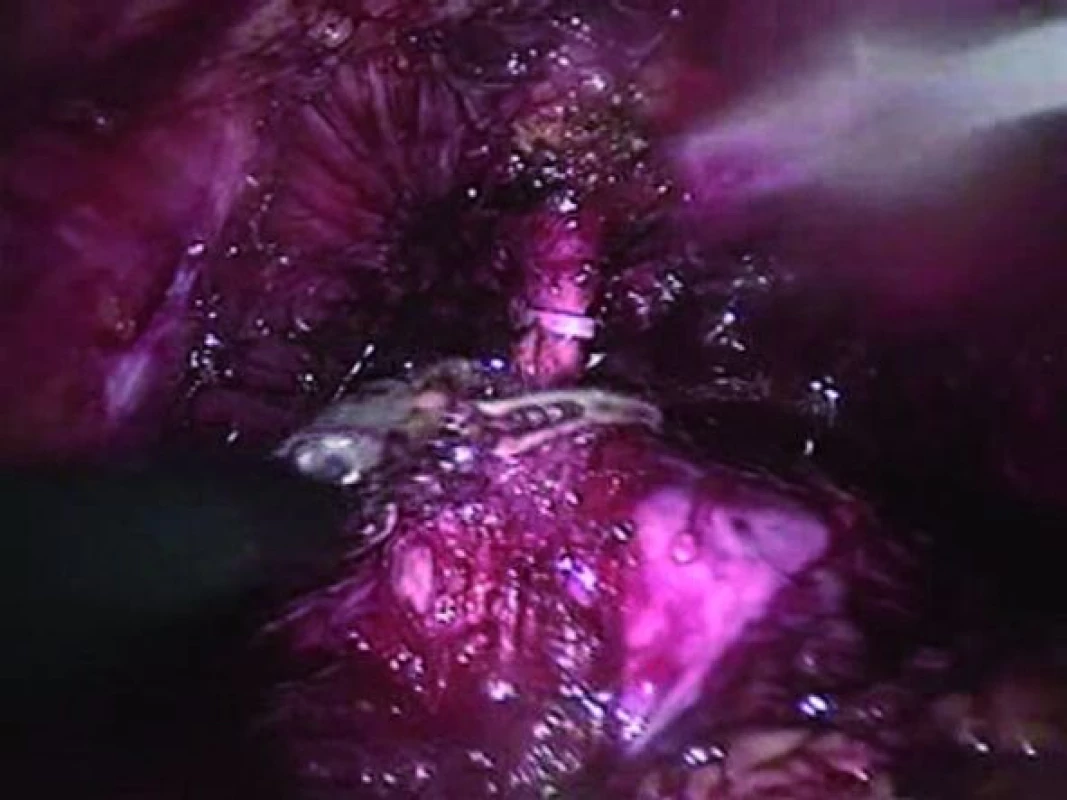
Celý vzorek lze uzavřít do 15mm sáčku na preparáty, který je vyjmut 5–6cm infraumbilikální nebo periumbilikální incizí. Před extrakcí musí asistent uchopit stehy na močovodech a ileu do grasperu, což nám umožní extrakci tumoru skrze incizi.
Vytvoření ileálního konduitu/derivace moči s vytvořením neoveziky
Derivaci moči lze provést prostřednictvím incize určené k extrakci tumoru. Volba techniky derivace moči závisí na preferenci operatéra a parametrech pacienta. Ileální konduit lze vytvořit jak intrakorporálně, tak extrakorporálně skrze extrakční incizi. Pokud se rozhodneme pro intrakorporální techniku, je nutné identifikovat požadovaný 10–20cm ileální segment. Distální a proximální konec zvoleného ileálního segmentu přerušíme pomocí svorkovače Endo GIA® (Covidien, Norwalk, CT, USA), který užijeme rovněž pro přerušení mezenteria na obou stranách. Pomocí Endo GIA® svorkovače následně obnovíme kontinuitu střeva, pomocí end-to-end anastomózy (obr. 4). Okno mezenteria uzavřeme pomocí pokračovací hedvábné sutury. Dále provedeme refluxní ureteroenterickou anastomózu pomocí Brokerovy nebo Wallaceho techniky (obr. 5). Před ukončením anastomózy je do každého močovodu zaveden 7F stent, který vede z distálního konce konduitu (obr. 6).
Obr. 4. Intrakorporální střevní anastomóza end-to-end pomocí stapleru. 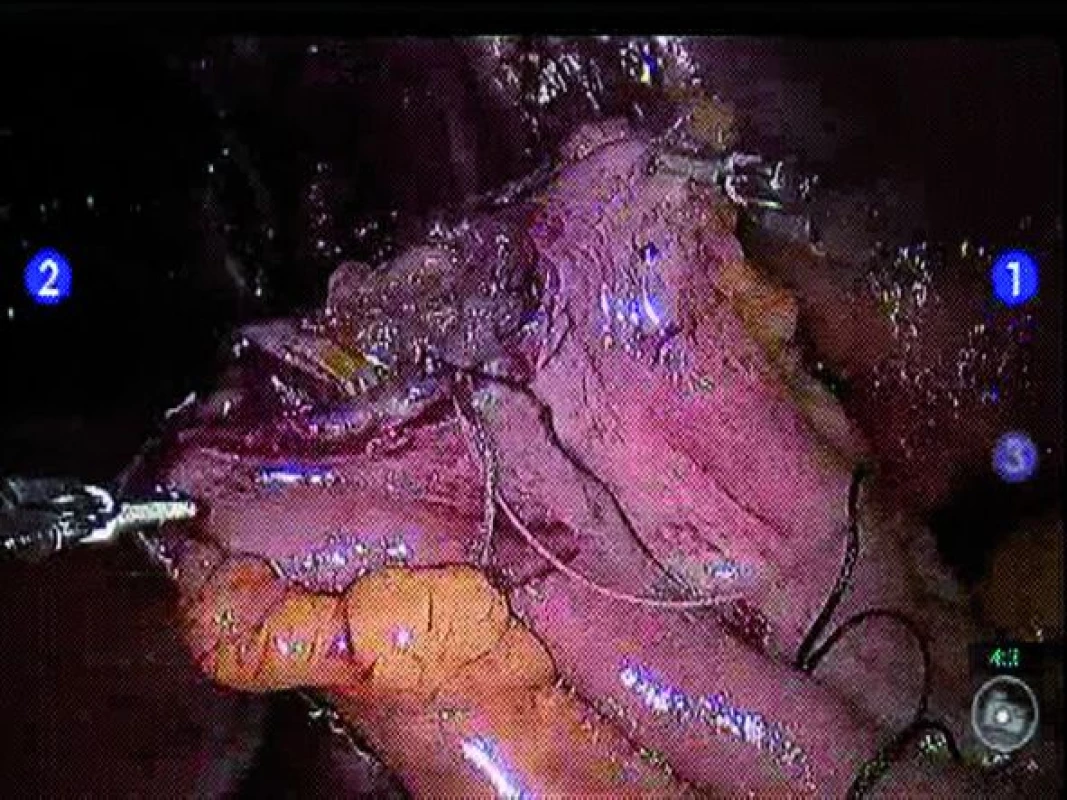
Obr. 5. Ureteroenterická anastomóza (technika podle Wallaceho). 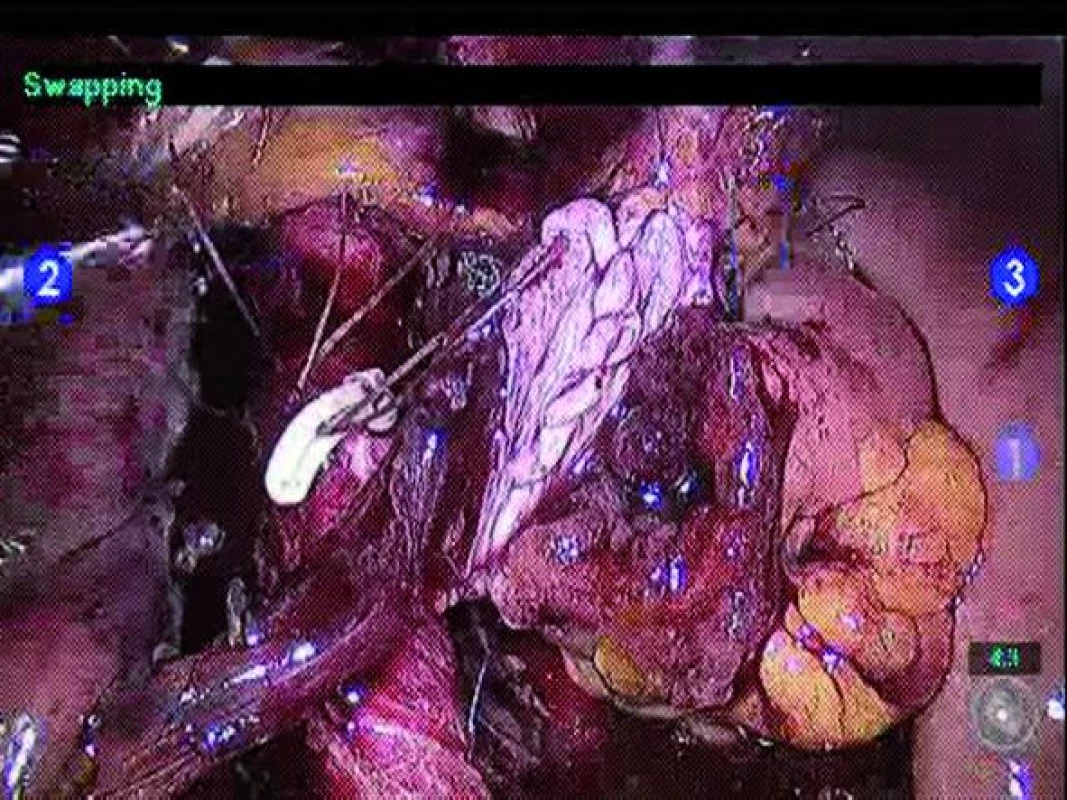
Obr. 6. Umístění uretrálních stentů. 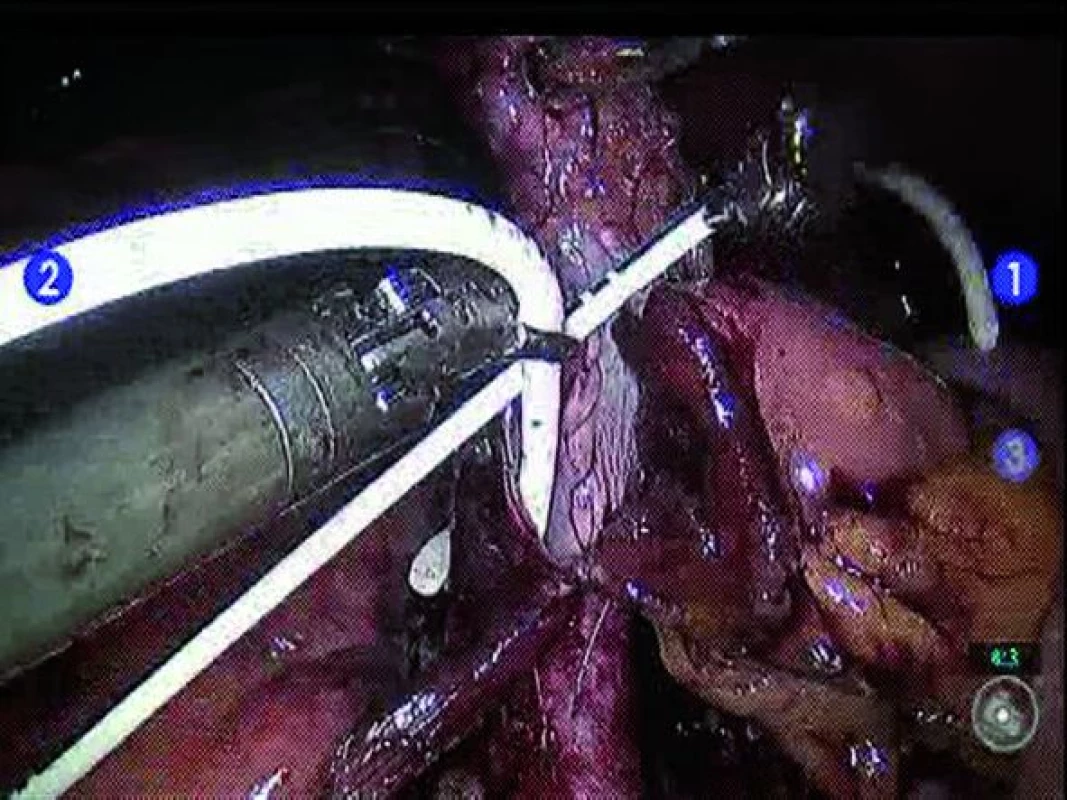
Doposud byla popsána řada technik pro vytvoření neoveziky. V některých případech je snazší vytvořit extrakční incizi velmi nízko v blízkosti symfýzy kosti stydké, což nám umožní umístění stehů anastomózy „otevřeným“ způsobem skrze extrakční incizi. Pokud plánujeme provedení uretroneovezikální anastomózy roboticky s reinstalací pozice robota, potom je nutné zavést uretrální katétr močovou trubicí a skrze extrakční incizi. Distální část katétru můžeme zavést do předpokládaného místa uretrální anastomózy a nafouknout balonek. Před vytvořením neoveziky lze předem umístit anastomotickou suturu do posteriorního laloku předpokládaného umístění neoveziky. Autoři užívají dva samostatné stehy 2-0 Monocryl s jehlami UR-6, které jsou spolu zauzleny a přestřiženy v délce 7 cm. Jemný tah za uretrální katétr usnadní tah neoveziky do pánve a směrem dolů k uretrálnímu pahýlu. Obecně je nejlepší strategií ponechat stenty v neovezice a odstranit je cystoskopicky o tři týdny později, kdy je vyjmut katétr. Další možností je vyvést stenty močovou trubicí. Následně je uzavřena extrakční incize a obnoveno pneumoperitoneum. Ve zbývající části výkonu by měl být pacient uveden do méně výrazné Trendelenburgovy polohy ke snížení napětí při dotahování uretroneovezikální anastomózy. Anastomózu dokončíme pokračovacím stehem na pozici šesté hodiny na ciferníku. Balonek uretrálního katétru lze během anastomózy vyfouknout a katétr posunout dle potřeby. Po dokončení anastomózy zkontrolujeme nepropustnost pomocí irigace. Skrze existující porty lze zavést jeden nebo dva abdominální drény. Pakliže se operatér rozhodne pro zavedení suprapubického katétru, je nutné uretrální katétr povytáhnout do uretry, abychom předešli poškození balonku. Porty jsou uzavřeny na základě preference operatéra. Poope-rační péče se neliší od péče po běžné otevřené cystektomii s močovou derivací, ačkoli jsou pacienti obvykle propuštěni z nemocnice po 4–6 dnech. Stenty jsou odstraněny z urostomie po 7–14 dnech. Foleyho katétr je vyjmut z neoveziky po 14–21 dnech.
ZÁVĚR
Roboticky asistovaná radikální cystektomie je technicky proveditelná procedura, která nabízí srovnatelné střednědobé onkologické výsledky jako otevřená radikální cystektomie (v dříve publikovaných studiích). Pacientům lze nabídnout nejrůznější formy močové derivace. Tento výkon sestává z několika fází, které je schopen zvládnout kterýkoli operatér zkušený s laparoskopickými a robotickými výkony. Díky benefitům v podobě nižší morbidity, menší ztráty krve a rychlejší rekonvalescence je robotická technika ideální pro radikální cystektomii. Až bude možné prokázat dlouhodobé klinické výsledky a onkologickou bezpečnost, bude možné tuto techniku zařadit mezi minimálně invazivní techniky volby léčby karcinomu močového měchýře.
Erik P. Castle
Mayo Clinic
Department of Urology
5777 E. Mayo Blvd
Phoenix, AZ 85054
Castle.erik@mayo.edu
Zdroje
1. Portis AJ, Yan Y, Landman J et al. Long-term followup after laparoscopic radical nephrectomy. J Urol 2002; 167(3): 1257–1262.
2. Badani KK, Kaul S, Menon M. Evolution of robotic radical prostatectomy: assessment after 2766 procedures. Cancer 2007; 110(9): 1951–1958.
3. Menon M, Hemal AK, Tewari A et al. Nerve-sparing robot-assisted radical cystoprostatectomy and urinary diversion. BJU Int 2003; 92(3): 232–236.
4. Ng CK, Kauffman EC, Lee MM et al. A Comparison of Postoperative Complications in Open versus Robotic Cystectomy. Eur Urol 2009; 57 : 274–282.
5. Martin AD, Nunez RN, Pacelli A et al. Robot-assisted radical cystectomy: intermediate survival results at a mean follow-up of 25 months. BJU Int 2009; 105 : 1706–1709.
6. Stein JP, Skinner DG. Results with radical cystectomy for treating bladder cancer: a 'reference standard' for high-grade, invasive bladder cancer. BJU Int 2003; 92(1): 12–17.
Štítky
Dětská urologie Urologie
Článek Slovo úvodemČlánek Ze zahraničních periodik
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Minimálně invazivní, ablační techniky při léčbě malých renálních tumorů
- Lokalizované nádory ledvin, epidemiologie, etiologie, chirurgická léčba, operační postupy a jejich indikace, role lymfadenektomie
- Roboticky asistovaná radikální cystektomie: technika podle Mayo Clinic
- Slovo úvodem
- Kontinentní a inkontinentní derivace moči, měchýř šetřící postupy
- Opakovaná hospitalizace a míra výskytu komplikací u pacientů po PCNL v závislosti na komorbidních faktorech
- Hodnota léčby, riziko a zodpovědnost v urologické praxi
- Kompletní duplikace měchýře a uretry jako organická příčina dysfunkce dolních močových cest
- Raritní komplikace zavedení double J stentu – migrace do pravé síně srdeční
- Současný pohled na léčbu malých nádorů ledvin
- Ze zahraničních periodik
- EAU Guidelines pro laserové technologie
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Raritní komplikace zavedení double J stentu – migrace do pravé síně srdeční
- Kontinentní a inkontinentní derivace moči, měchýř šetřící postupy
- Současný pohled na léčbu malých nádorů ledvin
- Roboticky asistovaná radikální cystektomie: technika podle Mayo Clinic
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání