-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné principy a terapeutické koncepty pro retrográdní intrarenální odstranění urolitiázy
CURRENT PRINCIPLES AND THERAPEUTIC CONCEPTS OF RETROGRADE INTRA-RENAL SURGERY FOR UROLITHIASIS
Retrograde Intra-Renal Surgery (RIRS) has undergone numerous technological advances since Hugh Hampton Young’s first foray in 1912 into the megaureter of a two month-old child using a 12Fr cystoscope, and the later introduction of rod lens optics by Harold Hopkins in 1960 [1,2]. A diverse array of equipment and accessories is available in modern practice and surgeons are increasingly tackling stone disease that previously would have required open or percutaneous surgery (PCNL), using a RIRS approach. This paper is based on the ureteroscopy part of the ESU Stone course, and aims to provided an update on recent advances and define a new and evolving framework for managing more complex stones.
Key words:
retrograde intra-renal surgery, urolithiasis, principles, therapeutic concepts
Autoři: S. Agrawal; M. Král; A. Patel *
Působiště autorů: Department of Urology, St. Mary’s Hospital at Imperial College Healthcare NHS Trust and Imperial School of Medicine, London *
Vyšlo v časopise: Urol List 2012; 10(1): 36-41
Souhrn
Od roku 1912, kdy se Hugh Hampton Young poprvé pokusil o vstup do megaureteru dvouměsíčního dítěte pomocí 12Fr cystoskopu a pozdějšího zavedení čočkové optiky Haroldem Hopkinsem v roce 1960, prodělala retrográdní intrarenální operace (RIRS) řadu technologických modifikací [1,2]. V moderní urologické praxi je k dispozici rozmanitá škála vybavení a doplňků, a urologové se tak stále častěji pouští do řešení konkrementů pomocí RIRS, jejichž léčba by v minulosti vyžadovala otevřenou nebo perkutánní operaci (PCNL). Tento článek vychází z části kurzu ESU věnovanému ureteroskopii. Cílem autorů je poskytnout přehled novinek a definovat nové postupy pro léčbu složité litiázy.
Klíčová slova:
retrográdní intrarenální operace, urolitiáza, principy, terapeutické koncepty
Léčba konkrementů lokalizovaných v horních cestách močových (UUT) je komplikovaná a často závisí na dostupném vybavení, zkušenostech lékaře, individuálních parametrech pacienta a charakteru litiázy. Pro dosažení optimálního výsledku zohledňujícího benefit na straně pacienta je nutné nalézt správnou rovnováhu mezi léčbou litiázy, stupněm invazivity a případnou morbiditou s léčbou spojenou. Při volbě optimální terapie je třeba zvážit následující faktory: celkový habitus pacienta (např. v důsledku obezity se zvětšuje vzdálenost mezi kůží a konkrementem (obr. 1), a snižuje se tak účinnost SWL a znesnadňuje perkutánní přístup pro perkutánní nefrolitotomii (PCNL), omezení pohybového aparátu (např. v důsledku chronického neuro-svalově-skeletálního onemocnění a onemocnění kloubů (obr. 2) a výskyt komorbidit (např. vysoké riziko při operaci/současná indikace antiagregační léčby) a funkční rezervu ledvin. Provedení RIRS je obtížnější (a může vyžadovat multimodální přístup) u mladších svalnatých pacientů s úzkým močovodem, anamnézou striktury v močovodu, obstrukcí UPJ, pacientů po neúspěšné ureteroskopii, pacientů s poraněním močovodu, po odstranění a substituci močového měchýře a pacientů s litiázou o velkém objemu (zejména v dolní části vývodných cest).
Obr. 1. CT snímek zobrazující vzdálenost mezi konkrementem a kůží u obézních pacientů. 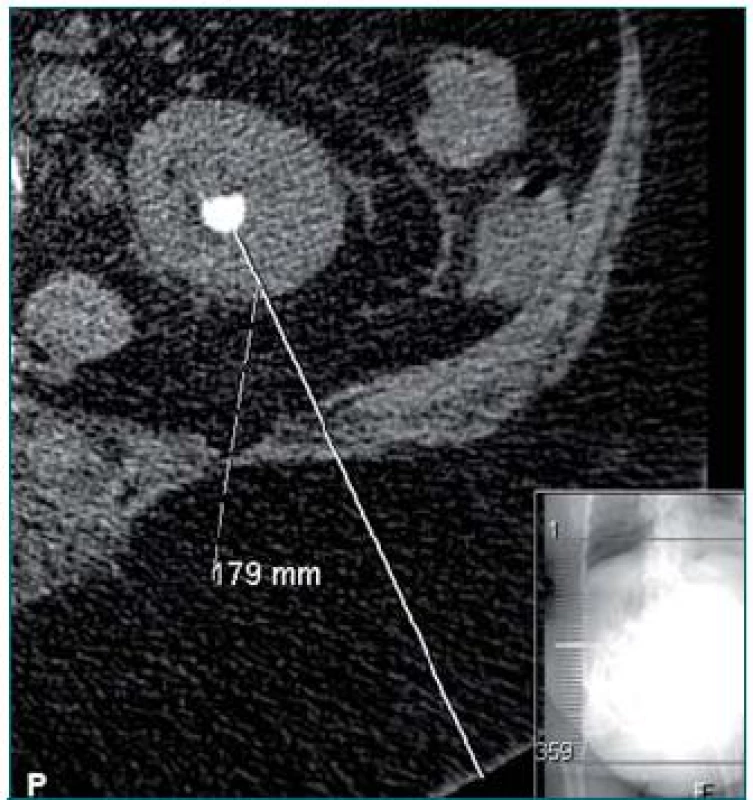
Obr. 2. Neuro-muskulo-skeletální onemocnění a onemocnění kloubů jako např. revmatická artritida a závažná kyfoskolióza mohou představovat polohový problém pro všechny druhy léčby. 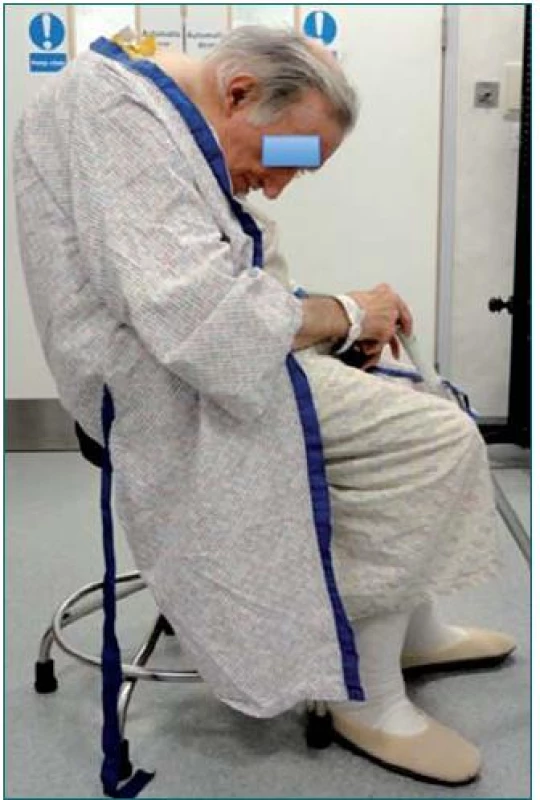
VYBAVENÍ A TECHNOLOGIE
Před zahájením RIRS musí být operatér dokonale obeznámen s technickými vlastnostmi dostupných rigidních i flexibilních ureteroskopů a dalších pomůcek (jako jsou druhy vodičů, košíčků a dalších instrumentů pro extrakci konkrementů) a vybavení pro fragmentaci konkrementů. Vhodnost a potenciální úspěšnost RIRS je nutné před operací posoudit na základě následujících faktorů: lokalizace, velikosti a denzity konkrementu, minerálního složení a anatomie vývodného systému. Tvrdé konkrementy o denzitě > 1 000 HU (Hounsfieldových jednotek) obvykle nereagují dobře na fragmentaci rázovou vlnou, zejména při nepříznivých okolnostech, jako jsou konkrementy lokalizované v močovodu a konkrementy u obézních pacientů. Tento typ litiázy tedy bude pravděpodobně vyžadovat fragmentaci přímým kontaktem s konkrementem a aktivní odstranění pomocí RIRS nebo PCNL. Při srovnávání RIRS se SWL při léčbě konkrementů v dolním pólu se uvádí rovněž vyšší (ačkoli nesignifikantní) SFR (Stone-Free Rate) [3]. Rovněž je nezbytné počítat s potenciálním výskytem komplikací a obtížnými scénáři a prodiskutovat tyto okolnosti s pacientem v rámci informovaného souhlasu.
PŘÍSTUP A DRÁTĚNÉ VODIČE
Při provádění retrográdního ureteropyeologramu (jenž poskytuje anatomickou „mapu“ horních cest močových) po vyšetření dolních cest močových a ústí močovodu (UO) se doporučuje standardizovaná technika „krok za krokem“. Po dokončení ureteropyelogramu je ústím močovodu zaveden levnější bezpečnostní vodič (potažený PTFE) a následně zatočen v horní kalichové skupině. Ureteropyelogram napomáhá definovat potenciální překážky vyskytující se za ústím močovodu. Bezpečnostní vodič zajišťuje bezpečné zavedení stentu v případě komplikací, jako je poranění močovodu, ztráta viditelnosti při krvácení nebo selhání instrumentu. Při plánování výkonu je nutné počítat s nejrůznějšími scénáři, kdy je zavedení vodiče obtížné, jako např. neobvyklé umístění močovodu (vrozené nebo v důsledku chirurgického výkonu), velká intravezikálně prominující prostatická žláza, velké nebo zaklíněné konkrementy, vinuté močovody nebo přítomnost striktury. Při kanylaci ústí močovodu může být nezbytné použití Albarranova můstku. Jako bezpečnostní i pracovní vodič užíváme 0,035palcový (3 Fr = 1 mm) vodič potažený polytetrafluoroetylenem (PTFE) s 5cm ohebnou špičkou. Při obtížnějším přístupu může být nezbytné použití dražších „speciálních“ vodičů, jako jsou čistě hydrofilní vodiče (zahnuté nebo rovné s ohebnou špičkou), hybridní vodiče (s jednou nebo více hydrofilními špičkami a pevnějším, nehydrofilním PTFE vodičem s jádrem ze slitiny nitinolu odolným proti zauzlení) a extra pevné PTFE vodiče [4]. Pokud selže pokus o zavedení Bentsonova PTFE vodiče s ohebnou špičkou a čistě hydrofilního vodiče, je obvykle nutné použít více páky blíže k místu odporu manipulací ureterálním katétrem s otevřenou špičkou a vodičem nebo zavedením vodiče semirigidním ureteroskopem pod přímou zrakovou kontrolou. Tyto techniky napomáhají narovnat močovod, minimalizovat točivou sílu na vodiči a lépe ozřejmit lumen ureteru. V případě selhání těchto technik usnadní perkutánní nefrostomie s antegrádním zavedením vodiče potenciální potřebu zavedení stentu a pozdější provedení výkonu.
URETERÁLNÍ PŘÍSTUPOVÁ POCHVA (UAS)
Jedná se o doplněk usnadňující přístup do horních cest močových méně zkušeným lékařům. Tato pomůcka je rovněž užitečná v případě zhoršení vizualizace ústí močovodu (např. při krvácení z křehké prostaty nebo středního laloku). UAS snižuje riziko poranění distálního močovodu v důsledku opakovaného zavádění instrumentů, zkracuje délku operace a zlepšuje míru odstranění komplikovaných a velkých konkrementů při současném snížení rizika iatrogenního poranění močovodu a poškození utereroskopu. UAS o vhodné velikosti (vhodná pro zavádění dostupných semirigidních i flexibilních ureteroskopů) rovněž zlepšuje endoskopickou viditelnost pomocí nepřetržité drenáže horních cest močových podél ureteroskopu, díky čemuž udržuje poměrně nízký tlak v ledvině a teoreticky snižuje riziko systémové infekce v důsledku pyelorenálního, pyelovenózního nebo pyelolymfatického refluxu. Nevýhody tohoto postupu zahrnují vyšší cenu, komplikace při zavádění (zejména u močovodů o menším průměru bez předchozího zavedení stentu), iatrogenní poranění močovodu během zavádění a zauzlení/vyklenutí (čemuž lze předejít užitím plochého vodiče). Vnitřní průměr UAS (10–14 Fr) může být rovněž překážkou pro extrakci fragmentů o šířce 3–4 mm. Na in vitro modelu bylo prokázáno, že průtok irigační tekutiny prázdným pracovním kanálem 3Fr flexibilního ureterorenoskopu se zvyšuje v závislosti na průměru pochvy, což může být způsobeno lepší drenáží horních cest močových při užití UAS. Nepřetržitého průtoku (který napomáhá odstranění prachu vzniklého při fragmentaci měkkých konkrementů) lze rovněž dosáhnout užitím ureteroskopu s dvojitým kanálem nebo pomocí přítoku tekutiny 3Fr pracovním kanálem a odtoku 4–5Fr ureterálním katétrem s otevřenou špičkou umístěným podél ureteroskopu nebo AUS s cílem zajistit nízký tlak v ledvině. Pomůcky zaváděné do pracovního kanálu flexibilního ureterorenoskopu, jako např. košíčky 1,4–2,4 Fr však způsobovaly snížení průtoku o 65 % (1,4Fr košíčky) a 90 % (2,4Fr košíčky) [5]. Dlouhodobý efekt užívání současné generace UAS není zatím znám, u první generace UAS se uvádí 19% míra vzniku perforace. Delvecchio et al v retrospektivním přehledu zahrnujícím 150 pacientů prokázali srovnatelnou míru výskytu komplikací u pacientů, u nichž byla užita UAS poslední generace, a pacientů, u nichž nebyla užita žádná UAS [6].
Experimentální studie ukazují, že během zavádění UAS dochází ke vzniku ischemie močovodu, žádná studie však neprokázala zvýšení výskytu striktury [7,8]. Abychom minimalizovali riziko perforace močovodu, je vhodné před zavedením UAS opticky předdilatovat močovod zavedením semirigidního ureteroskopu (s užitím pracovního vodiče pro narovnání močovodu) a po výkonu zavést DJ stent. Rapoport v retrospektivní studii zahrnující 161 pacientů, jimž nebyl po výkonu s užitím UAS zaveden stent, prokázal častější potřebu urgentní opakované návštěvy lékaře (37 % ve srovnání s 14 % u pacientů, jimž nebyla zavedena UAS) [9].
URETEROSKOPY
McKay a Young popsali techniku rigidní ureteroskopie. První rigidní URS provedl Goodman (1977) a Lyon (1978) s pomocí 11Fr dětského cystoskopu [1,10,11]. Lyon předdilatoval ústí močovodu na 16 Fr. Takagi v roce 1971 rovněž provádí semiflexibilní ureteroskopii s užitím 6Fr ureteroskopu o délce 75 cm s 2,5cm zahnutou špičkou [12]. Teprve Enrique Perez Castro ve spolupráci se společností Karl Storz Endoscopy vyvinul v roce 1980 první rigidní ureteroskop umožňující pohled do ledvinné pánvičky [13]. První skutečně flexibilní URS pak uskutečnil Bagley v roce 1983 [14]. První ureteroskopy měly podobně jako moderní cystoskopy 9–16Fr vnější pochvu s vyměnitelným čočkovým systémem, další generace ureteroskopů byla vybavena navíc flexibilní vláknitou optikou.
Moderní semirigididní ureteroskopy mají špičku o průměru 4,5–9 Fr a pracovní kanál o průměru 4,2–6,6 Fr (2,3–3,4 Fr (duální kanál), flexibilní ureterorenoskopy mají špičku o průměru 3–4,5 Fr. Byly popsány nejrůznější modifikace a nové designy jako např. zkosená špička pro snazší přístup do močovodu, keramické špičky minimalizující poškození laserového vlákna a jednoduché nebo duální pracovní kanály oválného tvaru umožňující průtok irigační tekutiny podél instrumentů. Další inovace zahrnují otočné světelné kanály a pracovní kanály a zahnuté okuláry pro připevnění kamery. Rovněž došlo ke zdokonalení flexibility ureteroskopů díky velkým sekundárně aktivním a velkým primárně uniplanárním aktivním deflekčním mechanizmům (ohyb až 270°) s rotovatelnými uzamykatelnými těly endskopu. Ačkoli tyto modifikace usnadňují přístup do dolního kalichu v různých úhlech, dosud neumožňují spolehlivý přístup do mediální části dolního kalichu. Jednotlivé ureteroskopy se rovněž mohou lišit optickým vybavením a vzdáleností centra ohniska (2,2–18 mm). Některé semirigidní ureteroskopy mají rovněž zahnuté čočky poskytující lepší vizualizaci kalichu.
Další z řady inovací je PolyScope (Lumenis) sestávající z 8Fr ureterálního katétru na jedno použití se 4Fr pracovním kanálem a modulárního flexibilního ureteroskopického zařízení (10 000 pixelů) pro opakované použití, bez nutnosti instrument sterilizovat. Tento instrument nabízí pouze základní funkce a vyžaduje další vývoj.
Na opačném konci cenového spektra se nalézá digitální ureteroskop (flexibilní i rigidní) poskytující lepší viditelnost bez omezení ovladatelnosti [15]. Digitální ureteroskopy obsahují CMOS (doplňkový polovodič na bázi kovu a oxidu) nebo intenzivní CCD (snímač s nábojovou vazbou) kamerový čip. U žádného z těchto dvou čipů nebyl zřetelně prokázán benefit při klinickém použití oproti druhému, CCD nabízí vyšší kvalitu zobrazení a vyšší světlenou senzitivitu. Současné CMOS čipy jsou srovnatelné, cenově méně náročné, rychlejší a sestávají z menšího počtu komponentů, díky čemuž se snáze vyrábějí. Při užívání těchto instrumentů byla zaznamenána srovnatelná SFR jako při užívání ureteroskopů s vláknitou optikou. Současná omezení digitální URS zahrnují větší špičku ureteroskopu (pro umístění současných čipů), „zrnění“ během skiaskopického vyšetření, různý stupeň ztráty obrazu během aktivace laseru (v důsledku interference frekvencí, v závislosti na výrobci) a „efekt zapadajícího červeného paprsku“ v důsledku nadměrné expozice čipu a senzitivitě na červenou barvu.
Technicky vzato, optická předdilatace močovodu pomocí semirigidního ureteroskopu umožňuje vizualizovat střední a distální část močovodu a usnadňuje bezpečné zavedení flexibilního URS instrumentu s o něco větší špičkou. Pakliže je provedení URS obtížné nebo je močovod příliš úzký, jeví se obvykle jako lepší a bezpečnější metoda pasivní ureterální dilatace pomocí zavedení DJ stentu a odložení výkonu o dva týdny, čímž se vyhneme významnému riziku natržení močovodu, perforace a pozdějšímu vzniku striktury nebo poškození flexibilního instrumentu.
FRAGMENTACE A ODSTRANĚNÍ KONKREMENTŮ
V současné době je k dispozici řada metod pro fragmentaci konkrementů lokalizovaných v močovodu a jejich následné odstranění jako např. elektrohydraulická litotrypse (EHL), pneumatické a laserové litotryptické sondy, jednorázové kleště i kleště na více použití, košíčky a další zařízení. Většina pomůcek pro flexibilní ureteroskopii je vytvořena z nitinolu, jenž neohrožuje ohyb špičky ureteroskopu [16]. Nitinol je slitina niklu a titanu vyznačující se tvarovou pamětí a superelasticitou.
Objev Holmium:YAG laseru v polovině 90. let minulého století způsobil převrat v endoskopické léčbě litiázy a striktury. Jedná se o pulzní laser o vlnové délce 2 100 nm (penetrace tkáně do hloubky 0,4 mm, penetrace ve vodě do hloubky 3 mm), který nabízí řadu výhod. Křemíkové vlákno je k dispozici v různých velikostech (150, 200, 273, 365, 550 a 1 000 mikronů), je ohebné a generuje slabší, ale přesnější rázové vlny než EHL. Při správném užívání zabraňuje Holmium:YAG laser (oproti pneumatickým kontaktním litotryptickým sondám) retropulzi. Při fragmentaci lze užít celou řadu technik (tab. 1). Je nezbytné použít zaměřovací paprsek (červené nebo zelené světlo ve viditelném spektru) a při aktivaci laseru se přesvědčit o tom, že je přenos energie vizualizován. Pakliže nezačne probíhat fragmentace konkrementu, měl by operatér předpokládat možnost poškození laserového vlákna nebo poškození ureteroskopu (obvykle v části pracovního kanálu).
Tab. 1. Techniky fragmentace konkrementu s užitím laseru. 
K dispozici jsou rovněž pomůcky pro prevenci retropulze (Stone cone/N-Trap/Accordion) zabraňující retropulzi malých fragmentů o velikosti > 1,5–2,5 mm [17]. V našem centru, kde se pneumatická kontaktní litotrypse provádí pouze ve výjimečných případech, není užití těchto pomůcek obvykle nutné, navíc jsou prostorově objemné a mohou omezovat průtok tekutiny. Užití těchto pomůcek však může přinášet užitek při odstraňování konkrementů v horní části močovodu, kde technické možnosti a lokální vybavení limitují manipulaci s konkrementy vypuzenými do ledviny. Pakliže nemáme k dispozici flexibilní instrument, doporučuje se výkon zahájit v poloze pacienta hlavou dolů, kdy existuje větší šance, že se vypuzený konkrement zachytí v horním kalichu (odkud lze vyjmout pomocí 42cm semirigidního ureteroskopu) spíše než v dolním kalichu (kde je bez použití flexibilního ureteroskopu nedosažitelný).
Nejlevnější způsob odstranění fragmentů v močovodu je často užití kleští na více použití (rotace kleštěmi při vyjímání za přímé zrakové kontroly zajistí volný pohyb). Prach a menší fragmenty lze aspirovat nebo vysát špičkou ureteroskopu. Nitinolové košíčky jsou neocenitelnou pomůckou při odstraňování konkrementů z ledviny nebo kalichu a bezesporu prodlužují životnost flexibilních ureterorenoskopů. Volba pomůcky pro vyjmutí konkrementu závisí na velikosti a tvaru/počtu fragmentů a anatomii kalichu a infundibula. Průměr zvoleného zařízení obvykle představuje kompromis mezi počtem očekávaných zavedení, nutností zavedení doplňkových instrumentů a viditelností při průtoku irigační tekutiny.
Při řešení konkrementů v dolním kalichu je žádoucí konkrementy přemístit pomocí košíčku, manipulace s konkrementem nebo vypláchnutí do přístupnějšího horního kalichu, což umožňuje snadnější fragmentaci díky menšímu ohybu ureteroskopu a rovněž umožňuje použití silnějšího laserového vlákna pro rychlejší fragmentaci. V případě většího počtu fragmentů v horním kalichu, které nelze kvůli složité anatomii snadno odstranit, lze pracovním kanálem injikovat do dolního kalichu autologní krev (s pacientem v poloze hlavou nahoru). Krevní sraženina tak způsobí okluzi kalichu a fragmenty se tak snáze přemístí z horního kalichu do močovodu a nikoli zpět do kalichu [18]. Další možností při odstraňování složitého konkrementu je aspirovat dilatovaný kalich//ledvinnou pánvičku (dochází ke kolapsu) pro snazší přístup ke konkrementu, a omezit tak prostor, do něhož se může kámen přemístit, a přiblížit ho blíže ke špičce ureteroskopu.
OBEZITA A ANTIKOAGULANCIA
Bylo prokázáno, že provedení RIRS je bezpečné (bez zvýšení morbidity) rovněž u obézních pacientů a pacientů užívajících antikoagulancia, ovšem za cenu většího počtu výkonů a nižší SFR u pacientů s BMI > 35 a konkrementy o velikosti > 2 cm [19,20]. Turna et al srovnávali RIRS u celkem 37 pacientů užívajících antiagregační léčbu nebo antikoagulancia s kontrolní skupinou. Žádný z výkonů nemusel být předčasně ukončen a autoři prokázali, že užití balonových dilatátorů a ureterální přístupové pochvy je bezpečné i u těchto pacientů [21].
VELKÉ KONKREMENTY A RIRS
Různí autoři se v současné době v retrospektivních studiích zabývali problematikou řešení velkých konkrementů (2,5–4 cm) pomocí RIRS. Riley et al uvádí 91% míru SFR při léčbě konkrementů do 3 cm. Breda et al uvádí 100% SFR při léčbě konkrementů o velikosti < 2 cm vs 85,1 % SFR při léčbě kamenů větších než 2 cm. Léčba obvykle vyžaduje 2–3 intervence. Mariana et al uvádí 88% SFR při léčbě konkrementů > 4 cm s následujícím výskytem běžných komplikací: horečka u 19 % pacientů, steinstrasse u 19 % a pneumonie u 6 % pacientů [22–24].
MEDIKAMENTÓZNÍ EXPULSIVNÍ TERAPIE (MET) PO RIRS
John et al popisují čtyřtýdenní aplikaci tamsulosinu po RIRS u pacientů s konkrementy o velikosti (před výkonem) 1–2 cm. „Stone free rate“ byla v této studii definována jako absence fragmentů na spirálním CT (5mm řezy) 4 týdny po výkonu. Celková SFR byla vyšší u pacientů podstupujících medikamentózní terapii (86,5 %) než u pacientů, kteří neužívali žádné α-blokátory (69,4 %). U pacientů užívajících α-blokátory byla rovněž zaznamenána nižší spotřeba analgetik, menší výskyt koliky po výkonu a nižší míra urgentní návštěvy lékaře [25].
MULTIMODÁLNÍ STRATEGIE PŘI LÉČBĚ KOMPLIKOVANÉ LITIÁZY/LITIÁZY S VYSOKÝM RIZIKEM
Byly popsány případy fragmentace litiázy současně pomocí RIRS a SWL [26]. Tento postup umožňuje rychlejší odstranění velkých a odlitkových konkrementů. Tato technika může být vhodná rovněž pro léčbu pacientů se současně se vyskytujícími konkrementy v močovodu a ledvinné pánvičce. Tento typ operace lze provádět v několika fázích nebo najednou pomocí zrychlené endoskopické kontaktní fragmentace. Další benefit spočívá v tom, že lze korigovat anatomické abnormality, jako je např. intrarenální stenóza, a fragmenty lze aktivně odstranit pomocí RIRS, zatímco endoskopická vizualizace umožňuje přesně monitorovat konečný výsledek fragmentace.
RIRS & PCNL „Pass the Ball“ – pro léčbu složitých rozvětvených odlitkových konkrementů využívá sekvenční nebo simultánní perkutánní a retrográdní přístup a může snižovat morbiditu a nutnost provádět větší počet perkutánních vpichů. Provedení menšího počtu vpichů má výhodu v podobě menší krevní ztráty a nižších požadavků na analgetika. Konkrementy lokalizované v kalichu, které je obvykle obtížné dosáhnout nefroskopem (rigidním nebo flexibilním), lze přemístit pomocí retrográdního přístupu nebo rozdrtit a odstranit ureteroskopicky, případně kombinací obou přístupů [27].
STENTY
Metaanalýza devíti randomizovaných kontrolovaných studií neprokázala, že by rutinní zavádění ureterálního stentu přinášelo významný benefit v SFR, nárocích na analgezii po výkonu nebo snižovalo výskyt UTI a striktury [28]. U pacientů se zavedeným stentem však byla zaznamenána významně vyšší incidence LUTS (RR 2,25) a nižší (ačkoli nesignifikantně) pravděpodobnost urgentního vyhledání lékařské péče. Existují důkazy, že distální smyčka stentu, pokud není úplná nebo zasahuje přes střední čáru, může zvyšovat morbiditu [29].
Rovněž aplikace α-blokátorů snižuje incidenci LUTS, bolesti a zmírňuje dopad na pohlavní styk u pacientů obou pohlaví [30,31].
CÍLE DO BUDOUCNA
V této oblasti je nutné učinit ještě řadu pokroků. Kromě zlepšení ureteroskopické vize a životnosti instrumentů jsou zapotřebí menší a odolnější košíčky a ohebnější a méně křehká, tenká laserová vlákna. Spolehlivý přístup do mediálního aspektu dolního kalichu je s použitím současného designu ureteroskopů obtížný. V současné době jsou vyvíjeny jak nové ureteroskopy, tak jejich design, např. instrumenty s flexibilní špičkou na semirigidní rukojeti. Desai et al popisují retrográdní robotickou ureterorenoskopii na modelu prasete i u člověka; použití robota teoreticky zlepšuje přesnost, ergonomii a plynulost pohybu [32,33]. V poslední době se objevily i další robotické instrumenty kompatabilní s existujícími nástroji. Je nezbytné provedení randomizovaných kontrolovaných studií.
Rovněž byla popsána flexibilní/semirigidní ureteroskopie v lokální anestezii s aplikací lidokainu intrauretrálně, se sedací pomocí benzodiazepinu (midazolam 2 mg) nebo bez ní a remifentanilem s ultrakrátkým účinkem. Uvádí se srovnatelná SFR s výkony v celkové anestezii, kdy 97,1 % pacientů anestezii snášelo [34,35].
ZÁVĚR
Nejnovější technologické pokroky v užívání ureterorenoskopické UAS, designu instrumentů a užívání holmium laseru umožnilo léčit větší a složitější konkrementy pomocí RIRS. Pro dosažení dobrých výsledků s minimální morbiditou lze však doporučit speciální postgraduální výcvik. Na rutinní zavádění ureterálního stentu existují protichůdné názory, doporučuje se však po výkonech se zaváděním UAS. Role flexibilní URS se rozšiřuje a zahrnuje léčbu složitých konkrementů u pacientů s významnými komorbiditami, morbidně obézních pacientů nebo pacientů užívajících antikoagulancia.
Anup Patel MS, FRCS (Urol)
Consultant Urological Surgeon and Honorary Clinical Senior Lecturer
Department of Urology
St. Mary’s Hospital at Imperial College Healthcare NHS Trust and Imperial School of Medicine
Praed Street
London W2 1NY
Zdroje
1. Young HH, McKay RW. Congenital valvular obstruction of prostatic urethra. Surg Gynecol Obstet 1929; 48 : 509–535.
2. Hopkins HH. British patent 954,629 and U.S. patent 1960, 3,257,902.
3. Pearle MS, Lingeman JE, Leveillee R et al. Prospective, randomized trial comparing shockwave lithotripsy and ureteroscopy for lower pole caliceal calculi 1cm or less. J Urol 2005; 173(6): 2005–2009.
4. Clayman M, Uribe CA, Eichel L et al. Comparison of guide wires in urology. Which, when and why? J Urol 2004; 171 (6 Pt 1): 2146–2150.
5. Ng YH, Somani BK, Dennison A et al. Irrigant flow and intrarenal pressure during flexible ureteroscopy: the effect of different access sheaths, working channel instruments, and hydrostatic pressure. J Endourol 2010; 24(12): 1915–1920.
6. Delvecchio FC, Auge BK, Brizuela RM et al. Assessment of stricture formation with the ureteral access sheath. Urology 2003; 61(3): 518–522.
7. Vanlangendonck R, Landman J. Ureteral access strategies: pro-access sheath. Urol Clin North Am 2004; 31(1): 71–81.
8. Stern JM, Yiee J, Park S. Reviews in Endourology Safety and Efficacy of Ureteral Access Sheaths. J Endourol 2007; 21(2): 119–123.
9. Rapoport D, Perks AE, Teichman JMH. Ureteral access sheath use and stenting in ureteroscopy: effect on unplanned emergency room visits and cost. J Endourol 2007; 21(9): 993–997.
10. Goodman TM. Ureteroscopy with paediatric cystoscope in adults. Urology 1997; 9(4): 394.
11. Lyon ES, Kyker JS, Schoenberg HW. Transurethral ureteroscopy in women: A ready addition to the urological armamentarium. J Urol 1978; 119(1): 35–36.
12. Takagi T, Go T, Takayasu H et al. Fiberoptic pyeloureteroscope. Surgery 1971; 70(5): 661–663.
13. Pérez-Castro Ellendt E, Martínez-Piñeiro JA. Transurethral ureteroscopy. A current urological procedure [Article in Spanish]. Arch Esp Urol 1980; 33(5): 445–460.
14. Bagley DH, Huffman JL, Lyon ES. Combined rigid and flexible ureteropyeloscopy. J Urol 1983; 130(2): 243–244.
15. Multescu R, Geavlete B, Georgescu D et al. Conventional Fiberoptic Flexible Ureteroscope Versus Fourth Generation Digital Flexible Ureteroscope: A Critical Comparison. J Endourol 2010; 24(1): 17–21.
16. Shvarts O, Perry KT, Goff B et al. Improved functional deflection with a dual-deflection flexible ureteroscope. J Endourol 2004; 18(2): 141–144.
17. Holley PG, Sharma SK, Perry KT et al. Assessment of novel ureteral occlusion de - vice and comparison with Stone Cone in pre - vention of stone fragment migration during lithotripsy. J Endourol 2005; 19(2): 200–203.
18. Patel A. Lower calyceal occlusion by autologous blood clot to prevent stone fragment reaccumulation after retrograde intra-renal surgery for lower calyceal stones: first experience of a new technique. J Endourol 2008; 22(11): 2501–2506.
19. Natalin R, Xavier K, Okeke Z et al. Impact of obesity on ureteroscopic laser lithotripsy of urinary tract calculi. Int Braz J Urol 2009; 35(1): 36–42.
20. Wheat JC, Roberts WW, Wolf JS Jr. Multi-session retrograde endoscopic lithotripsy of large renal cal-culi in obese patients. Can J Urol 2009; 16(6): 4915–4920.
21. Turna B, Stein RJ, Smaldone MC et al. Safety and efficacy of flexible ureterorenoscopy and holmium:YAG lithotripsy for intrarenal stones in anticoagulated cases. J Urol 2008; 179(4): 1415–1419.
22. Riley JM, Stearman L, Troxel S. Retrograde ureteroscopy for renal stones larger than 2.5 cm. J Endourol 2009; 23(9): 1395–1398.
23. Breda A, Ogunyemi O, Leppert JT et al. Flexible Ureteroscopy and Laser Lithotripsy for Multiple Unilateral Intrarenal Stones. Eur Urol 2009; 55(5): 1190–1196.
24. Mariani AJ. Combined Electrohydraulic and Holmium:YAG Laser Ureteroscopic Nephrolithotripsy of Large (Greater Than 4 cm) Renal Calculi. J Urol 2007; 177(1): 168–173.
25. John TT, Razdan S. Adjunctive tamsulosin improves stone free rate after ureteroscopic lithotripsy of large renal and ureteric calculi: a prospective randomized study. Urology 2010; 75(5): 1040–1042.
26. Patel A, Fuchs GJ. Expanding the horizons of SWL through adjunctive use of retrograde intrarenal surgery: new techniques and indications. J Endourol 1997; 11(1): 33–36.
27. Marguet CG, Springhart WP, Tan YH et al. Simultaneous combined use of flexible ureteroscopy and percutaneous nephrolithotomy to reduce the number of access tracts in the management of complex renal calculi. BJU Int 2005; 96(7): 1097–1100.
28. Nabi G, Cook J, N'Dow J et al. Outcomes of stenting after uncomplicated ureteroscopy: systematic review and meta-analysis. BMJ 2007; 334(7593): 572.
29. Rane A, Saleemi A, Cahill D et al. Have stent-related symptoms anything to do with placement technique? J Endourol 2001; 15(7): 741–745.
30. Deliveliotis C, Chrisofos M, Gougousis E et al. Is there a role for alpha1-blockers in treating double-J stent-related symptoms? Urology 2006; 67(1): 35–39.
31. Damiano R, Autorino R, De Sio M et al. Effect of tamsulosin in preventing ureteral stent-related morbidity: a prospective study. J Endourol 2008; 22(4): 651–656.
32. Desai MM, Aron M, Gill IS et al. Flexible robotic retrograde renoscopy: description of novel robotic device and preliminary laboratory experience. Urology 2008; 72(1): 42–46.
33. Desai MM, Grover R, Aron M et al. Robotic flexible ureteroscopy for renal calculi: initial clinical experience. J Urol 2011; 186(2): 563–568.
34. Langen PH, Karypiadou M, Steffens J. Ureteroscopy under intravenous analgesia with remifentanil. Urologe A 2004; 43(6): 689–697.
35. Park HK, Paick SH, Oh SJ et al. Ureteroscopic lithotripsy under local anesthesia: Eur Urol 2004; 45(5): 670–673.
Štítky
Dětská urologie Urologie
Článek Slovo úvodem
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Slovo úvodem
- Souvislost mezi testosteronem a karcinomem prostaty
- Nádory prostaty a varlat u české a světové populace
- Aktivní sledování malých tumorů ledviny
- Radiofrekvenční ablace nádorů ledvin
- Současné principy a terapeutické koncepty pro retrográdní intrarenální odstranění urolitiázy
- Role profylaxe antibiotiky při léčbě vezikoureterálního refluxu
-
Laparoskopická operace pánevního dna
Část I – laparoskopická kolposuspenze
Část II – laparoskopická kolpopexe - Roztroušená skleróza a dysfunkce dolních močových cest. Možnosti diagnostiky, potřeba léčby a sledování
- Jaká je skutečnost srovnání konvenčního a roboticky asistovaného přístupu k radikální prostatektomii? Je oprávněné platit vyšší cenu?
- Nykturie u geriatrické populace a její důsledky, jaké jsou možnosti jejího ovlivnění, co je možné, co reálné a co smysluplné?
- Nežádoucí účinky antimuskarinik na centrální nervový systém
- Popis a klasifikace komplikací po urologických chirurgických výkonech:Ad hoc hodnocení a doporučení EAU Guidelines
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Souvislost mezi testosteronem a karcinomem prostaty
- Nežádoucí účinky antimuskarinik na centrální nervový systém
-
Laparoskopická operace pánevního dna
Část I – laparoskopická kolposuspenze
Část II – laparoskopická kolpopexe - Radiofrekvenční ablace nádorů ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



