-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Radiofrekvenční ablace nádorů ledvin
RADIOFREQUENCY ABLATION OF RENAL TUMOURS
An increasing incidence of localized renal cancer during the last three decades and the mortality of this disease has triggered the evaluation of current treatment modalities. The standard therapy for small focal lesions is surgical excision with the aim of sparing the renal parenchyma. Urologists are continuously searching for new alternative methods to substitute classical surgical treatment. They are searching for less aggressive approaches, posing less of a burden to the patient and methods, which can be used in conditions in which the classical or laparoscopic approach is associated with undesirable burden. Alternatives to the surgical treatment of small renal masses include methods, which are based on different physical principles of tissue destruction. These methods can be applied either laparoscopically or percutaneously. The most frequently used methods in clinical practice include radiofrequency ablation and cryoablation. Also other methods are being tested, such as high intensity focused ultrasound, microwave thermotherapy, interstitial photon radiation and laser interstitial ablation. Efficacy of these novel approaches should be comparable to classical surgery. With further improvement of these techniques the long-term results, their benefit and disadvantages are evaluated and new evidence is being collected regarding the efficacy of individual techniques under individual conditions. The alternative, less invasive methods seem to be solution in selected cohorts of high-risk patients, allowing to reduce their morbidity.
Key words:
renal cell carcinoma, small renal mass, radiofrequency ablation, miniinvasive therapy, nephron-sparing surgery, cryotherapy, biopsy
Autoři: A. Čermák *; D. Pacík
Působiště autorů: Urologická klinika FN Brno *
Vyšlo v časopise: Urol List 2012; 10(1): 31-35
Souhrn
Vzrůstající počet lokalizovaných nádorových onemocnění ledvin v posledních třech dekádách a úmrtnost na toto onemocnění vede k hodnocení současných léčebných postupů. Standardní metodou léčby malých ložiskových lézí je chirurgické odstranění nádoru se snahou o postup šetřící ledvinný parenchym. Urologové stále hledají alternativní metody ke klasické chirurgické léčbě. Hledají takové postupy, které by byly méně agresivní, méně zatěžující pacienta, nebo metody, které lze využít u stavů, kdy klasické či laparoskopické metody jsou neúměrnou zátěží. Alternativami k chirurgické léčbě malých ledvinných nádorů („small renal masses“) jsou metody, které využívají různých fyzikálních principů k destrukci nádorové tkáně. Tyto metody se aplikují laparoskopicky nebo perkutánně. Nejužívanější metodiky používané v klinické praxi jsou radiofrekvenční ablace a kryoablace. Zkouší se i fokusovaný ultrazvuk vysoké intenzity, mikrovlnná termoterapie, intersticiální fotonová iradiace nebo laserová intersticiální ablace. Tyto nové metody by současně měly být svou účinností srovnatelné s klasickou chirurgií. S postupujícím časem a zdokonalováním technik se hodnotí dlouhodobé výsledky, výhody i nevýhody a jasněji se definují důkazy, kdy a jaký postup přináší efektivitu. Alternativní, méně invazivní metody jsou možným řešením u vybraných skupin vysoce rizikových pacientů se záměrem snížit jejich morbiditu.
Klíčová slova:
renální karcinom, malé nádorové ložisko ledviny, radiofrekvenční ablace, miniinvazivní léčba, nefron šetřící operace, kryoterapie, biopsie
Nádory ledvin jsou třetím nejčastějším uroonkologickým onemocněním v ČR s nejvyšší incidencí na světě. I přes nárůst detekce malých incidentálních nádorů je v současné době stále patrný poměrně vysoký záchyt také objemných nádorů. To je dáno dlouhým asymptomatickým průběhem onemocnění. Právě tyto objemné nádory udržují téměř stabilní úroveň mortality nádorů ledvin za poslední desetiletí. Mortalita nádorů ledvin narůstala strměji v rámci celé Evropy až do přelomu 80. a 90. let 20. století, od tohoto období se udržuje téměř na stejné úrovni. Standardizovaná úmrtnost na nádory ledvin u mužů byla v letech 1990–1994 4,8/100 000 obyvatel, o 10 let později 4,1/100 000 obyvatel. U žen úroveň mortality v odpovídajícím období poklesla o 17 % z 2,1/100 000 obyvatel na 1,8/100 000 obyvatel. K největšímu poklesu mortality došlo ve skandinávských zemích a částečně v zemích západní Evropy, v zemích východní Evropy se jednalo spíše jen o stabilizaci úrovně mortality. V ČR se mortalita v období 2000–2004 pohybovala na úrovni 11,4/100 000 obyvatel při incidenci 27,2/100 000 obyvatel [1]. V roce 2008 byla v ČR mortalita na toto onemocnění 11,1/100 000 a incidence 27,1/100 000 obyvatel [32].
Graf 1. Vývoj hrubé incidence a hrubé mortality v ČR pro nádorové onemocnění ledvin. 
Vzrůstající počet detekovaných malých ledvinných lézí (SRM – Small Renal Masses) s různou histologickou skladbou a s různým biologickým chováním je trend pozorovaný již několik let. Ložiskové léze jsou detekovány různými metodami. S vývojem modernějších a přesnějších zobrazovacích metod je detekováno stále více SRM.
Základní metodou léčby karcinomu ledviny, a to jak u lokalizovaného, tak i u metastatického karcinomu ledviny je léčba chirurgická. Nádory ledvin vykazují radiorezistenci i chemorezistenci. Proto chirurgická resekce zůstává nadále standardní léčbou i pro malé nádory ledviny (T1a). Nelze ji však provést u starších nemocných s četnými komorbiditami, jejichž celkový stav nedovoluje chirurgický výkon. Resekční výkon rovněž nedovoluje nevhodné umístění nádoru [2]. Proto byly hledány miniinvazivní metody, které ničí nádorovou tkáň a šetří parenchym. To je důležité především u nádorů v ledvinách s chronickou renální insuficiencí (CHRI).
ALTERNATIVNÍ CHIRURGICKÉ METODY
Ačkoli chirurgické odstranění SRM je stále standardní metodou volby na prvním místě, u vybraných pacientů s krátkou očekávanou dobou života je možné použít alternativní metody.
Méně invazivní alternativou k chirurgické léčbě jsou radiologicky naváděné perkutánní nebo laparoskopické ablační techniky. V současné době se používá radiofrekvenční ablace (RFA), kryoablace (CA), mikrovlnná ablace, laserová ablace, radiochirurgická ablace („Cyber Knife“) a high-intensity foccused ultrasound (HIFU) ablace.
Cílem a snahou alternativních metod je léčba parenchymových ložiskových lézí ledviny u vysoce rizikových pacientů se záměrem snížit jejich morbiditu. Metody lze provést v některých případech i ambulantně bez použití celkové anestezie (perkutánní, radiologicky naváděné). Vhodnými kandidáty jsou starší pacienti s vážnými komorbiditami, pro které je chirurgický postup vysokým rizikem, ale kteří se chtějí aktivně podrobit léčbě. Další skupinou, která může profitovat z alternativních metod, jsou pacienti s nádorem v solitární ledvině s hraniční ledvinnou funkcí a pacienti s vysokým rizikem úplné ztráty ledvinné funkce po chirurgické resekci [3]. Tito pacienti musí být poučeni o efektivitě a rizicích alternativních metod. Musí být poučeni o hodnocení výsledků a musí souhlasit s trvalým sledováním a opakovaným prováděním zobrazovacích vyšetření [4]. U zdravých, mladších pacientů (< 75 let) se metoda nedoporučuje, provádí se chirurgické řešení.
Kontraindikací použití alternativních metod jsou nádory s předpokládanou nízkou úspěšností této léčby (nejčastěji z důvodu velikosti nádoru – obvykle větší než 3 cm) a z důvodu nevhodné lokalizace nádoru. Dále nejsou vhodní pacienti s detekovaným vícečetným metastatickým postižením a pacienti s ireverzibilní koagulopatií. Obecně větší tumory (> 3 cm), hilové tumory, tumory v blízkosti proximálního močovodu či centrálního kalichopánvičkového systému nebo nádory nepravidelného tvaru a infiltrativního vzhledu nejsou z důvodu vysokého rizika recidivy vhodné pro alternativní metody [5].
Data střednědobého sledování jsou k dispozici pouze u RFA, kryoablace a HIFU. Ostatní metody zůstávají zatím stále v experimentálním stadiu.
Nevýhodou těchto alternativních metod je, že destrukce nádoru ledviny nepřináší histologickou verifikaci ložiska ledviny. Před zahájením léčby je třeba provést biopsii nádoru pod USG či CT kontrolou. Problémem je i skutečnost, že neexistuje vhodná zobrazovací metoda, která by spolehlivě detekovala možné vitální nádorové buňky po léčbě. S tím souvisí i chybění doporučených postupů pro dispenzarizaci těchto pacientů. To se nahrazuje prováděním opakovaných biopsií či předpokládáním nevitálního ložiska na základě radiologických nálezů. Vzhledem k malému množství dat z prospektivních studií jsou tyto modality stále považovány za experimentální [28,29].
RADIOFREKVENČNÍ ABLACE
Radiofrekvenční ablace (RFA) je metoda, která mění radiofrekvenční vlnění na termickou energii v cílové tkáni. Teploty > 50 °C způsobují koagulační nekrózu nádorových buněk. Koagulace bílkovin způsobuje ireverzibilní poškození cytosolických a mitochondriálních enzymů. Hlavním cílem RFA je dosažení a udržení teploty 50–100 °C v celém objemu nádoru [6]. Využití na lidských ledvinách ex vivo i in vivo bylo představeno v roce 1997 [7]. Radiofrekvenční ablace byla nejdříve použita pro léčbu nádorů jater, později také u nádorů sleziny a plic [8]. RFA je schválena v USA u FDA (Food and Drug Administration) pro léčbu lézí měkkých tkání [9]. Při aplikaci přímo do tumoru se někdy označuje jako RITA (Radiofrequency Interstitial Tumor Ablation). K radiofrekvenční ablaci mohou být použity monopolární i bipolární generátory. RFA způsobuje koagulaci nádoru fyzikálním způsobem. Teploty > 100 °C způsobují vaření tkáně, vaporizaci a karbonizaci, které obvykle zpomalí optimální ablaci z důvodu snížení přenosu energie [10]. Průtok krve renálními cévami může způsobit pokles teploty. Proto jsou exofytické nádory lépe destruovány než centrální nádory uložené v blízkosti renálních cév. Využívá se energie kolem 150 W vedoucí k dosažení teploty na hrotu jehly kolem 100 °C. Rozsah léze je limitován koagulací a desikací tkáně kolem sondy, což vede ke zvýšení impedance, a tím omezení dalšího působení tepla [11]. Po aplikaci RFA je za 24–48 hod patrná koagulační nekróza, která dosahuje maxima za 7 dní. Tkáň je zánětlivě změněná a postupně se resorbuje a fibrotizuje [12]. Průběh je kontrolován sonograficky nebo pomocí CT, resp. MR. Výkon je ukončen při dosažení bezpečnostního lemu kolem tumoru v šíři 5 mm – sonograficky je tato oblast hyperechogenní, při CT se postkontrastně nezvyšuje denzita. Tumor se též zmenší [13].
Tab. 1. Porovnání hrubé incidence všech nádorových onemocnění ledvin v ČR se světovým průměrem (2008) [33]. ![Porovnání hrubé incidence všech nádorových onemocnění ledvin v ČR se světovým průměrem (2008) [33].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7c37da0575a962b9013c09273216ef7e.png)
Radiofrekvenční ablace malých ledvinných ložisek je prováděna perkutánně pod ultrazvukovou (UZ), CT nebo MR kontrolou (obvykle intervenčním radiologem). Chirurgický přístup a aplikace RFA jsou prováděny obvykle laparoskopicky či otevřenou operací. V současné době je kolem 94 % aplikací RFA prováděno perkutánním přístupem [14], nejčastěji pod CT kontrolou. Přestože perkutánní přístup je méně invazivní, četnost reablací RFA i kryoablací je významně vyšší právě při perkutánním přístupu. Onkologické výsledky po RFA i kryoablaci (CA) jsou podobné. Zdá se, že nutnost reablací souvisí i se specializací operatéra (intervenční radiolog vs urolog) [15]. RFA však vyžaduje více reablací k dosažení 95% přežívání bez nádorového onemocnění. Lepší výsledky byly dosahovány u RFA při provádění intervenčním radiologem, zatímco kryoablace byla úspěšnější v rukou urologa [15].
Tab. 2. Výsledky radiofrekvenční ablace malých nádorových lézí. 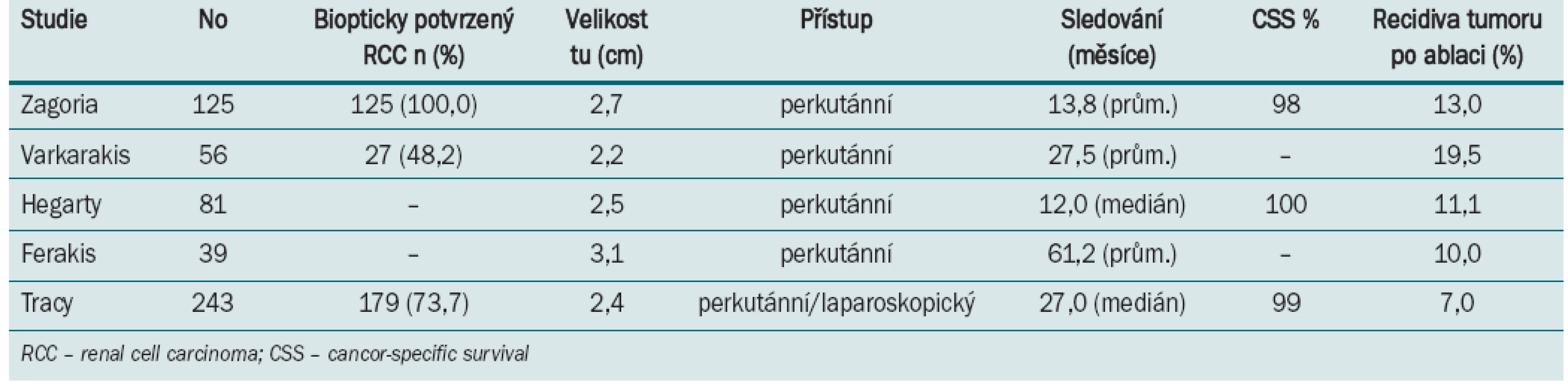
Tracy et al zhodnotili v poslední době (2010) největší studii 243 výkonů u 208 pacientů, kteří podstoupili RFA v průběhu 7,5 let [16]. Průměrná velikosti ošetřeného ložiska byla 2,4 cm a doba sledování byla 27 měsíců (1,5–90). Konvenční renální karcinom (RCC) byl z předoperační biopsie detekován v 79 % případů. Perkutánní přístup byl použit u dorzálně a laterálně umístěných nádorů, pro ventrálně umístěná ložiska a mediálně lokalizované léze v blízkosti střeva nebo jiných orgánů byl použit laparoskopický přístup. Primární úspěšnost byla 97 %, pětileté přežívání bez recidivy bylo celkem v 93 % případů a v 90 % u prokázaného RCC [16]. V dalším sdělení (Zagori et al 125 RFA) byla signifikantně (p > 0,001) prokázána kompletní ablace tumoru u ložisek velikosti < 3,7 cm [17].
Pro RFA (stejně jako pro kryoablaci) nejsou standardizovaná radiologická kritéria průkazu úspěšné ablace. Obecně se udává jako důkaz úspěšné ablace vymizení sycení kontrastní látkou na scanech počítačové tomografie (CT) nebo magnetické rezonance (MR). Pooperační biopsie se standardně neprovádí. Tři studie zabývající se hodnocením výsledků termické ablace spočívaly v provedení RFA a následné resekci nádoru nebo provedení nefrektomie [18–20]. Podle poslední a největší studie byly po laparoskopicky provedené RFA zjištěny reziduální vitální nádorové buňky ve 23,5 % případů. Nekompletní nekróza nádoru zůstává nejdiskutovanějším tématem při výkladu a dokumentování onkologických výsledků. Současně autoři uvádí, že i při použití nejnovějších technologií zůstává inkompletní nekróza (tzv. „skipping“) stále problém. Jelikož tato metoda není zcela spolehlivá, není vhodná pro standardní léčbu obecně u všech nádorů ledvin. Weight et al sledovali 109 pacientů s provedenou RFA. Vymizení sycení kontrastní látkou na CT bylo pozorováno u 85 % pacientů. U 45 % pacientů byla provedena šest měsíců po operaci biopsie a histologicky negativní výsledek byl prokázán v 65 % případů. 6 ze 13 pacientů (46,2 %) s pozitivním histologickým nálezem v biopsii nevykázalo zvýšenou denzitu kontrastní látky na CT či MR scanech. Naopak při hodnocení výsledků kryoablace bylo dokumentováno, že všechny pooperační pozitivní biopsie vykazovaly též zvýšené vysycování kontrastní látky na CT scanech [21]. Výsledky metaanalýzy (Kunkle et al) z roku 2008 zhodnotily 99 studií nechirurgické léčby SRM. Výsledky ukázaly, že častěji se lokální recidiva vyskytuje po RFA (11,7 %) oproti kryoablaci (4,6 %). Obě metody mají signifikantně vyšší výskyt lokální progrese v porovnání s nervy šetřící resekční operací (NSS „nephron sparing surgery”). Relativní riziko je 7,45 pro kryoablaci a 18,23 pro RFA. Pravděpodobnost progrese v metastatické onemocnění je po RFA 2,3 % a po kryoablaci 1,2 %. Pravděpodobnost metastatického onemocnění SRM po RFA a po chirurgické léčbě nevykazuje statisticky významný rozdíl [14].
Z metaanalýzy prací zabývajících se radiofrekvenční ablací vyplývá, že hodnocení je obtížné a ne zcela přesné, protože RFA se provádí především perkutánně na rozdíl od CA, která se provádí častěji laparoskopicky. Nekompletní ošetření léze a nutnost reablace je u RFA přijatelnější (resp. je více akceptováno), protože možnost opakování perkutánního výkonu je jednodušší než reoperace.
KRITÉRIA PRO VÝBĚR VHODNÉHO PACIENTU PRO RFA
Skupina vhodná pro aplikaci RFA zahrnuje starší, vysoce rizikové pacienty s tumorem pod 3 cm. Větší nádory vykazují nízkou úspěšnost léčby pomocí RFA. Gervais et al provedli ošetření 100 nádorů u 85 pacientů RFA zavedenou perkutánním přístupem a prokázali, že malé tumory (3 cm) a exofyticky rostoucí tumory byly kompletně koagulovány. Všechny malé (< 3 cm), ale pouze 25 % velkých (> 5 cm), byly úspěšné léčeny pomocí RFA [6].
RFA má podle analýz malý vliv na zhoršení renální funkce. Průměrná glomerulární filtrace (GFR) před provedením RFA a po něm byla zkoumána v retrospektivním hodnocení 63 pacientů s kortikálními SRM. Předoperační a pooperační výsledky byly 76,3, resp. 74,3 ml/min na 1,73 m2 [22]. Johnson provedl multiinstitucionální analýzu aplikací RFA a prokázal, že metoda RFA při léčbě malých tumorů je zatížena nízkou četností komplikací [23]. Komplikace se vyskytly v 8,3 % případů (6,1 % lehké, 2,2 % závažné) Nejčastější komplikací (3 %) byla bolest nebo parestezie s místě zavedení jehly.
BIOPSIE
Pro sledování úspěšnosti léčby doporučují nyní některá centra provádění postablační biopsie k potvrzení destrukce nádorové tkáně. Metoda biopsie je preferována před prováděním sledování radiologickými zobrazovacími metodami [24]. Současné zobrazovací metody mají velké limitace a doporučují se pouze při dlouhodobém sledování. V případě podezření na nekompletní destrukci nádoru při RFA se doporučuje rutinně provádět kontrolní biopsii. Stejně tak při podezření z lokální recidivy na RTG obrazu by mělo být potvrzeno odběrem biopsie [21].
V souhrnu kryoablace RFA (i CA) jsou slibné alterantivní techniky pro léčbu malých ložiskových lézí ledvin, ale stále chybí dlouhodobé onkologické výsledky. Chybí také standardizace přesných kritérií, která mohou definovat indikaci metody a úspěšnost léčby. V současné době zůstává u RFA rozpor mezi vymizením perfuze kontrastní látky na zobrazovacím vyšetření (CT, MR) a nálezem pozitivní biopsie. Pozitivní bioptický nález má sice výpovědní hodnotu, ale rutinní provádění postablační biopsie nejsou zatím standardem. Budou nutné další randomizované prospektivní studie porovnávající výsledky alternativních metod s klasickou chirurgickou excizí [25–27].
ZÁVĚR
Radiofrekvenční ablace je alternativní metoda léčby SRM. Další srovnatelnou metodou je kryoablace. RFA je méně invazivní technika vhodná pro léčbu většiny malých (< 3 cm) ložisek „low-grade“ nádorů u pacientů rizikových pro chirurgickou léčbu, kteří ale nejsou vhodní pro aktivní sledování. Pacienti musí souhlasit s pravidelným a dlouhodobým sledováním a s nutností provádění opakovaných radiologických vyšetření.
Retrospektivní nekontrolované studie předpokládají, že v porovnání s RFA může kryoablace nabídnout menší potřebu doplňujících procedur (reablací) a vykazuje nižší četnost lokálních recidiv. Nicméně proměnné, jako jsou chirurgický přístup (laparoskopický vs perkutánní), funkční zdatnost/nedostatečnost parenchymu, anestezie (celková vs analgosedace) a odbornost lékaře (intervenční radiolog vs urolog), mohou významně ovlivnit výsledky každé metody. Perkutánní biopsie s „fine-needle“ aspirací nebo bez ní by měla být provedena vždy před samotnou ablací k určení histologického typu nádoru. Postablační biopsie by měla být provedena v případě podezření na nekompletní destrukci tkáně nebo při podezření na lokální recidivu. Velmi potřebné (v současné době chybí) je vytvoření předoperačních algoritmů pro indikaci alternativních metod. Rovněž je potřebné vypracování pooperačních standardů a metodiky sledování po provedení ablačního výkonu. Při rozhodování o provedení termální ablace je nutné informovat pacienta o možnosti vyššího rizika vzniku lokální recidivy v porovnání s klasickým chirurgickým postupem. Informovaný souhlas by měl obsahovat poučení o limitacích současných zobrazovacích vyšetření pro potvrzení úspěšnosti léčby a pro dlouhodobé sledování. Pacient by měl být informován o možných komplikacích a též že v případě recidivy může být záchranná chirurgická léčba („salvage therapy“) po ablační terapii velmi obtížná pro perinefritickou fibrózu [30,31]. Větší nádory (> 3–4 cm) a nádory nepravidelného tvaru nebo infiltračně rostoucí mají po ablační terapii vyšší pravděpodobnost neúspěchu a recidivy.
V současné době neexistují data dlouhodobého sledování, která by umožnila rozhodnutí mezi jednotlivými ablačními technikami. Alternativní metody měly být vyčleněny pro přísně vybrané pacienty, vysoce rizikové pro klasickou chirurgickou léčbu, ale nevhodné pouze pro sledování.
MUDr. Aleš Čermák
Urologická klinika FN Brno
Jihlavská 20, 625 00 Brno
acermak@fnbrno.cz
Zdroje
1. Sobotka R. Hanuš T. Nádory ledvin in Postgraduální medicína 2001; 1 : 48.
2. Morávek P, Morávek P Jr, Dvořák P et al. Perkutánní radiofrekvenční ablace (RFA) v léčbě nádorů ledvin – vlastní zkušenosti. Ces Urol 2010; 14(2): 104–109.
3. Ljungberg B, Cowan NC, Hanbury DC et al. EAU guidelines on renal cell carcinoma: the 2010 update. Eur Urol 2010; 58(3): 398–406.
4. Campbell SC, Novick AC, Belldegrun A et al. Guideline for management of the clinical T1 renal mass. J Urol 2009; 182(4): 1271–1279.
5. Volpe A, Cadeddu JA, Cestari A et al. Contemporary Management of Small Renal Masses European Urology 2011; 60(3): 501–515.
6. Aron M, Gill IS. Minimally invasive nephron-sparing surgery (MINSS) for renal tumours. Part II: probe ablative therapy. Eur Urol 2007; 51(2): 348–357.
7. Zlotta AR, Wildschutz T, Raviv G et al. Radiofrequency interstitial tumor ablation (RITA) is a possible new modality for treatment of renal cancer: ex vivo and in vivo experience. J Endourol 1997; 11(4): 251.
8. deBaere T, Kuoch V, Smayra T et al. Radio frequency of renal cell carcinoma: preliminary clinical experience. J Urol 2002; 167(5): 1961–1964.
9. Gill IS, Novick AS, Soble JJ et al. Laparoscopic renal cryoablation: initial clinical series. Urology 1998; 52(4): 543–551.
10. Goldberg SN, Gazelle GS, Mueller PR. Thermal ablation therapy for focal malignancy: a unified approach to underlying principles, techniques, and diagnostic imaging guidance. AJRAmJ Roentgenol 2000; 174(2): 323–331.
11. Rendon RA, Gertner MR, Sherak MD et al. Development of a radiofrequency based thermal therapy technique in an in vivo porcine model the treatment of small renal masses. J Urol 2001; 166(1): 292–298.
12. Jacomides L, Ogan K, Watumull L et al. Laparoscopic application of radio frequency energy enables in situ renal tumor ablation and partial nephrectomy. J Urol 2003; 169(1): 49–53.
13. Hora M, Hes O, Klečka J. Miniinvazivní ledvinu šetřící ablační metodiky v léčbě nádorů ledvin. Urol list 2003; 2(1): 26–29.
14. Kunkle DA, Uzzo RG. Cryoablation or radiofrequency ablation of the small renal mass: a meta-analysis. Cancer 2008; 113(10): 2671–2680.
15. Long L, Park S. Differences in patterns of care: reablation and nephrectomy rates after needle ablative therapy for renal masses stratified by medical specialty. J Endourol 2009; 23(3): 421–426.
16. Tracy CR, Raman JD, Donnally C et al. Durable oncologic outcomes after radiofrequency ablation: experience from treating 243 small renal masses over 7.5 years. Cancer 2010; 116(13): 3135–3142.
17. Zagoria RJ, Traver MA, Werle DM et al. Oncologic efficacy of CT-guided percutaneous radiofrequency ablation of renal cell carcinomas. AJR Am J Roentgenol 2007; 189(2): 429–436.
18. Rendon RA, Kachura JR, Sweet JM et al. The uncertainty of radiofrequency treatment of renal cell carcinoma: findings at immediate and delayed nephrectomy. J Urol 2002; 167(4): 1587–1592.
19. Matlaga BR, Zagoria RJ, Woodruff RD et al. Phase II trial of radio frequency ablation of renal cancer: evaluation of the kill zone. J Urol 2002; 168(6): 2401–2405.
20. Klingler HC, Marberger M, Mauermann J et al.‘Skipping’ is still a problem with radiofrequency ablation of small renal tumours. BJU Int 2007; 99(5): 998–1001.
21. Weight CJ, Kaouk JH, Hegarty NJ et al. Correlation of radiographic imaging and histopathology following cryoablation and radio frequency ablation for renal tumors. J Urol 2008; 179(4): 1277–1281.
22. Stern JM, Gupta A, Raman JD et al. Radiofrequency ablation of small renal cortical tumours in healthy adults: renal function preservativ and intermediate oncological outcome. BJU Int 2009; 104(6): 786–789.
23. Johnson DB, Solomon SB, Su LM et al. Defining the complications of cryoablation and radiofrequency ablation of small renal tumors: a multi-institutional review. J Urol 2004; 172(3): 874–877.
24. Gill IS, Remer EM, Hasan WA et al. Renal cryoablation: outcome at 3 years. J Urol 2005; 173(6): 1903–1907.
25. Hora M, Hes O, Ürge T et al. A distinctive translocation carcinoma of the kidney (‘rosette-like forming’, t(6;11), HMB45 positive renal tumor). Int Urol Nephrol 2009; 41(3): 553–557.
26. Kawaciuk I. Prognóza karcinomu ledviny. Praha: Galén 2005.
27. Kolombo I, Kříž R, Janoušková L et al. Selective embolization and radiofrequency ablation of renal mass in polymorbid and elderly patients – our experience. Eur Urol Meetings 2007; Abstracts of the EAU 7th Central European Meeting 26–27 October 2007, Zagreb, Croatia; 2(7): abstract 26.
28. Kolombo I, Hanuš T, Odrážka K. Karcinom ledviny. Praha: Mladá fronta 2010.
29. Dvořáček J, Babjuk M. Onkourologie. Praha: Galén 2005.
30. Gronka L, Poršová M, Kolombo I et al. Karcinom ledviny – současné trendy: Urologie pro praxi; 9(3): 120–127.
31. Poppel H, Becker F,Cadeddu JA et al. Treatment of Localised Renal Cell Carcinoma. Eur Urol 2011; 60(4): 662–672.
32. Epidemiologie zhoubných nádoru v České Repu-blice. Report diagnózy: C64 – ZN ledviny mimo pánvičku.
33. International Agency for Research on Cancer, GLOBOCAN 2008. http://www.iarc.fr.
Štítky
Dětská urologie Urologie
Článek Slovo úvodem
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Slovo úvodem
- Souvislost mezi testosteronem a karcinomem prostaty
- Nádory prostaty a varlat u české a světové populace
- Aktivní sledování malých tumorů ledviny
- Radiofrekvenční ablace nádorů ledvin
- Současné principy a terapeutické koncepty pro retrográdní intrarenální odstranění urolitiázy
- Role profylaxe antibiotiky při léčbě vezikoureterálního refluxu
-
Laparoskopická operace pánevního dna
Část I – laparoskopická kolposuspenze
Část II – laparoskopická kolpopexe - Roztroušená skleróza a dysfunkce dolních močových cest. Možnosti diagnostiky, potřeba léčby a sledování
- Jaká je skutečnost srovnání konvenčního a roboticky asistovaného přístupu k radikální prostatektomii? Je oprávněné platit vyšší cenu?
- Nykturie u geriatrické populace a její důsledky, jaké jsou možnosti jejího ovlivnění, co je možné, co reálné a co smysluplné?
- Nežádoucí účinky antimuskarinik na centrální nervový systém
- Popis a klasifikace komplikací po urologických chirurgických výkonech:Ad hoc hodnocení a doporučení EAU Guidelines
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Souvislost mezi testosteronem a karcinomem prostaty
- Nežádoucí účinky antimuskarinik na centrální nervový systém
-
Laparoskopická operace pánevního dna
Část I – laparoskopická kolposuspenze
Část II – laparoskopická kolpopexe - Radiofrekvenční ablace nádorů ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



