-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nové trendy v systémové léčbě karcinomu ledviny
NEW TRENDS IN SYSTEMIC TREATMENT OF RENAL CANCER
Better understanding of renal cell carcinoma (RCC) biology raised interest in the research of novel therapeutic approaches based on targeted therapies. Targeted therapies can be defined as use of agents aimed at predefined exocellular, transmembranous and intracellular molecules present at pathways responsible for growth, differentation, transcription or angiogenesis control. The author of this article reviews currently available targeted medicamentous therapies for RCC treatment based on up-to-date data from recent studies.
Key words:
RCC, targeted therapies, sorafenib, sunitinib, bevacizumab, interleukin-2, mTOR, VEGF, angiogenesis inhibitors
Autoři: Z. Kirkali
Působiště autorů: Professor of Urology, Dokuz Eylul University School of Medicine, Inciralti, Izmir, Turkey
Vyšlo v časopise: Urol List 2010; 8(2): 33-47
Souhrn
Lepší pochopení biologické povahy karcinomu z renálních buněk vyvolalo zvýšený zájem o výzkum nových terapeutických postupů spočívajících v aplikaci cílených preparátů. Cílená terapie může být definována jako aplikace látek namířených proti předem určeným mimobuněčným, transmembránovým a vnitrobuněčným molekulám přítomným v drahách kontrolujících růst, diferenciaci, transkripci nebo angiogenezi. Autor článku uvádí přehled v současné době dostupných cílených medikamentózních terapií pro léčbu karcinomu z renálních buněk (RCC) na základě údajů nejnovějších studií.
Klíčová slova:
RCC, cílené terapie, sorafenib, sunitinib, bevacizumab, interleukin-2, mTOR, VEGF, inhibitory angiogenezeNa karcinom z renálních buněk (RCC) připadají 3 % ze všech solidních nádorů u dospělých, a tato malignita se vyskytuje především u jednotlivců mezi 50 a 70 lety věku. Na celém světě je každoročně diagnostikováno více než 208 000 nových případů a 102 000 úmrtí je důsledkem RCC [1]. Operace zůstává jedinou známou kurativní terapií u RCC. Většina pacientů má solitární ledvinové nádory; nicméně 10–30 % bude mít lokálně pokročilé nebo metastatické onemocnění a více než třetina s původně lokalizovaným nádorem bude mít relaps ve vzdálenějších místech. Biologie metastatických RCC (mRCC) je variabilní a může se vyznačovat prodlouženou stabilizací metastatického onemocnění, pozdním relapsem po nefrektomii nebo příležitostnou spontánní regresí metastatáz. Střední doba přežití u pacientů s mRCC je asi jeden rok a pouze 10 % přežívá více než dva roky [2].
Histologicky je RCC klasifikován do čtyř hlavních podtypů, z nichž nejobvyklejší je karcinom z jasných buněk (přibližně 75 % případů) [3]. Tyto nádory vznikají z proximálního tubulu v ledvinové kůře (tab. 1). Tento typ nádoru je typicky sporadický, jednostranný a jednoohniskový [3]. K ostatním typům patří papilární (15 %), chromofobní (5 %) a ze sběrného tubulu (< 1 %) [3]. Dnes víme, že toto jsou výrazně rozdílné typy nádorů a že přísluší k rozdílným genetickým změnám. Tudíž se liší ve svém biologickém chování a odezvě na léčbu, což vede k různým vzorům přežití.
Tab. 1. Klasifikace nádorů ledvin a jejich frekvence. 
Karcinom z renálních buněk je vysoce rezistentní proti běžným chemoterapeutickým látkám a systémová léčba je soustředěna na imunoterapii. Cykotinová terapie s IL-2 a IFN-α byla jedinou standardní terapií pro pacienty s metastatickým onemocněním, ačkoli IL-2 měl většinou za následek mírnou celkovou odpověď (ORR) u 15–20 % pacientů a vybraní pacienti (5–10 %) měli trvalou odpověď, zvláště po léčbě vysokými intravenózními dávkami IL-2 [4]. Během posledního desetiletí řada předklinických studií identifikovala určité molekulární charakteristiky RCC, jakož i některé z abnormalit v různých signálních drahách, které řídí proliferaci nádoru, vaskularitu a metastatický genotyp. O angiogenezi, procesu tvorby nových krevních cév, je známo, že hraje významnou úlohu v růstu nádorů, a má se za to, že je to důležitý cíl pro vývoj nových protirakovinných terapií [5].
Tyto nové cílené terapie směrované proti angiogenezi zrevolucionizovaly léčbu RCC. Dnešní řešení RCC je do značné míry založeno na použití cílených látek, jako jsou inhibitory tyrosin kinázy působící na více cílů, savčí terč rapamycinových (mTOR) inhibitorů a monoklonální antiangiogenické protilátky podávané ve spojení s IFN-α. V tomto článku podáváme přehled molekulárních drah, které definují relevantní terapeutické cíle v RCC včetně inhibitorů TKIs, mTOR, antiangiogenních látek a IL-2, jakož i nejčerstvější klinická data z těchto léčebných postupů.
MOLEKULÁRNÍ DRÁHY LÉČEBNÝCH PROSTŘEDKŮ PRO RCC
Lepší pochopení biologie RCC bylo doprovázeno zvýšeným zájmem o výzkum nových terapeutických postupů zahrnujících cílenou terapii pro RCC [5]. Cílená terapie může být definována jako používání látek namířených proti předem určeným mimobuněčným, transmembránovým a vnitrobuněčným molekulám přítomným v drahách kontrolujících růst, diferenciaci, transkripci nebo angiogenezi.
Ztráta Von Hippel-Lindau genu potlačujícího nádor a okolnosti v biologii RCC související s HIF
Identifikace Von Hippel-Lindau genu (VHL) a konečně pochopení role jeho patogenetické dráhy při vzniku nádoru RCC hrálo velkou roli ve vývoji léčebných prostředků pro RCC. Choroba VHL je dědičným nádorovým syndromem, o němž bylo prokázáno, že je vysoce informativní s ohledem na patogenezi ledvinových karcinomů z jasných buněk. V postižených rodinách je riziko rakoviny předáváno autosomálně dominantním způsobem a choroba se projevuje retinálními angiomy, hemangiomy CNS a RCC z jasných buněk [6]. Jedinci s chorobou VHL nesou ve své zárodečné linii jednu alelu VHL divokého typu a jednu inaktivovanou alelu VHL. Patologické změny vedou k chorobě VHL, jestliže zbývající alela divokého typu je somaticky inaktivována v náchylném typu buňky. Proto je VHL klasickým genem dvourázově potlačujícím nádor [6]. Bylo ukázáno, že inaktivace genu VHL je raným krokem ve vývoji RCC z jasných buněk spojeném s chorobou VHL [6]. Nádor VHL, který přísluší k chromozomu 3p25, je zmutován ve všech dědičných RCC a přibližně v 50 % sporadického RCC, a tak se většina RCC z jasných buněk zdá být vázána k dvojalelové inaktivaci VHL [7]. Většina RCC z jasných buněk vykazuje buď mutaci genu VHL nebo regulaci směrem dolů jeho proteinového produktu. Translace VHL mRNA dává vzniknout proteinům, které jsou genericky označovány jako VHL protein (pVHL) a pVHL má důležitou roli v buněčné odezvě na hypoxii [8]. Mezi mnoha funkcemi připisovanými pVHL, tou nejzřejměji spojenou s vývojem RCC je inhibice hypoxií idukovatelného faktoru (HIF) [9]. HIF je faktor heterodimerické transkripce tvořený nestabilní α-podjednotkou (HIF1α) a stabilní podjednotkou β [10]. Za normálních kyslíkových podmínek komplex pVHL zvšudypřítomňuje HIF1α, což vede k jeho destrukci proteosomem [11]. V podmínkách nízké přítomnosti kyslíku nebo v buňkách postrádajících pVHL se HIF1α akumuluje, váže se k HIF1β a transkripčně aktivuje geny indukovatelné hypoxií [12]. Důsledek defektního pVHL je podobný důsledku hypoxie pro stabilizaci HIF. Během hypoxie nastává akumulace nehydroxylovaného HIF, který se již neváže k VHL. HIF1α je stabilizován dimerizací s konstitutivně vyjádřenou HIF1β podjednotkou a přemisťuje se k jádru. Komplex HIF1α a HIF1β se váže k promotorům genu indukovatelného HIF, včetně genů hlavního faktoru zúčastněných na angiogenezi, regulaci pH, glukolýze, transportu glukózy, cyklu buňky, navedení a apoptóze [13].
Molekulární dráhy
Dráha VEGF-R
Bialelová ztráta obou VHL genů vede ke vzhůru regulované transkripci růstových faktorů, jako jsou VEGF, PDGF a TGF-α. Tyto faktory se pak vážou ke svým příslušným receptorům (VEGF-R, PDGF-R a EGF-R), které jsou tyrozinkinázovými receptory. Vazba ligandů k těmto receptorům pak vede k signalizaci dolů (downstream), která nakonec vede k takovým důsledkům, jako je zvýšená proliferace buněk, zvýšená angiogeneze a snížená apoptóza. Mutace pVHL spojené s RCC jsou vždy defektní s ohledem na destrukci HIF, což nasvědčuje tomu, že HIF hraje kritickou roli v karcinogenezi RCC. Byly popsány četné geny reagující na produkty HIF, přičemž řada těchto genů kóduje proteiny, které jsou receptory růstových faktorů jejich ligandů [14]. Řada produktů genů reagujících na HIF se zúčastňuje tumorogeneze. Nekontrolovaná produkce těchto růstových faktorů je stimulem k proliferaci nádorových a endoteliálních buněk.
Angiogenní stimuly produkované metabolickou potřebou hostitelských tkání iniciují angiogenní odezvu. Po vazbě k membránovým receptorům ve vaskulárních endoteliálních buňkách je spuštěn pětikrokový proces. Nejdříve se vaskulární endoteliální základní membrána rodičovské cévy zhroutí, a tím uvolní cestu k vývoji nového kapilárního výrůstku. Potom následuje migrace endoteliálních buněk vyvolaná angiogenním stimulem [15]. Tato vedoucí fronta migrujících buněk je poháněna zesílenou proliferací endoteliálních buněk, po níž následuje tvorba kapilárních trubiček organizací endoteliálních buněk a získávání pericytů a vaskulárních buněk hladkých svalů pro kapilární stabilizaci [15]. V průběhu tumorogeneze je angiogenní výhybka aktivována přímo indukcí angiogenního růstového faktoru, nebo nepřímo získáváním hostitelských imunnitních buněk, které uvolňují mediátory angiogeneze [16]. Indukce dráhy HIF vede k produkci VEGF. VEGF je nejprominentnějším regulátorem angiogeneze. Funkce VEGF jsou zprostředkovány dvěma tyrozinkinázovými receptory, VEGF-R1 a VEGF-R2, ve vaskulárních endoteliálních buňkách [17,18]. VEGF zpočátku interaguje s VEGF-R2 k podpoře proliferace endoteliálních buněk, migrace a vaskulární prostupnosti, a následně s VEGF-R1 k podpoře organizace nových kapilár. Řada přístupů cílených na angiogenezi se v současné době vyhodnocuje v klinických pokusech z hlediska jejich terapeutické účinnosti a dlouhodobého klinického prospěchu, zatímco jiné se mechanicky využívají k vyvíjení nových terapeutických modalit pro mRCC.
Dráha mTOR
Jiným regulátorem úrovní HIF1α, v buňce je mTOR, jehož signální aktivita působí zvýšení buněčných úrovní hladin HIF1α, zhoršuje celkové zvýšení úrovní způsobené absencí adekvátní funkce pVHL [19]. Laboratorní pokusy ukázaly, že antiproliferativní účinky inhibitorů mTOR u RCC mohou mít za následek inhibici esenciálních drah přežití a autofagii [20]. Účinek inhibitorů mTOR na angiogenezi má pravděpodobně významnou funkci u RCC, vysoce vaskularizovaného nádoru spojeného s angiogenezí poháněnou VHL [20]. mTOR je vysoce konzervovaná serin/ threoninová kináza, která tvoří multimolekulární komplexy a má klíčovou funkci v apoptóze, růstu buněk a proliferaci nádoru tím, že kontroluje buněčný katabolizmus a anabolizmus [20]. mTOR může tvořit komplex s regulačním sdruženým proteinem mTOR, aby vytvořil mTORC1, a může rovněž tvořit komplex s protějškem mTOR necitlivým na rapamycin, aby vytvořil jiný multimolekulární komplex nazývaný mTORC2. mTORC1 může být nakonec aktivován růstovými faktory, včetně VEGFR, PDGFR, EGFR a receptoru IGF, a živinami skrz fosfatidyinositol 3/kinázovou Akt (PI3K/Akt) dráhu [21]. Jakmile je jednou mTORC1 aktivován, působí svými dolů směřujícími efektory k stimulaci syntézy proteinu, vstupu do fáze G1 buněčného cyklu a proteinů, které regulují apoptózu. Aktivita inhibotorů mTOR v RCC zvýšila možnost, aby respondenti sdíleli společný molekulární genotyp, který činí tyto nádory závislými na mTOR, pokud jde o růst a přežití. Ukázalo se, že u RCC byl gen PTEN ve většině případů regulován dolů (downregulated), pravděpodobně epigenetickým utlumením [22]. Bylo prokázáno, že inhibitory PI3K/Akt/mTOR signální dráhy mohou nepřímo zasáhnout růst tumoru interakcí s udržením endoteliálních buněk a pericytů, které jsou potřebné pro angiogenezi tumoru [23]. Na molekulární úrovni angiogeneze nádoru závisí na faktorech vaskulárního růstu, jako jsou VEGF, pDGF, bFGF a členové superrodiny TGF-β. Ukázalo se, že všechny tyto faktory byly schopny aktivovat PI3K/Akt/mTOR v rakovinných buňkách, endoteliálních buňkách a pericytech [24]. Jedním z hlavních stimulů angiogeneze rakoviny je hypoxie, která aktivuje HIF1α, a dráha mTOR může usnadnit translaci HIF1α mRNA, a tím zesílit vaskulogennní efekt [24]. Pozorovaná klinická účinnost inhibitorů mTOR u RCC je zčásti zprostředkována závislostí účinné translace HIF na dráze mTOR zachycením signálních kaskád VEGF/VEGFR a/nebo PDGF/PDGFR. Tyto údaje celkem silně nasvědčují tomu, že protirakovinné účinky inhibitorů mTOR se účastní antiangiogenních procesů zprostředkovaných účinky na endoteliální buňky a pericyty, spíše než na samotný RCC [20].
INHIBITORY TYROZINKINÁZY A ANTIANGIOGENNÍ LÁTKY
V poslední době uváděná klinická data o těchto nových látkách, které jsou zacíleny na různé aspekty těchto molekulárních drah, nasvědčují nástupu nové terapeutické éry pro pacienty s RCC.
Inhibitory tyrozinkinázy
Sunitinib
Sunitinib malát je vysoce účinný selektivní inhibitor tyrozinových kináz četných receptorů včetně VEGFR-R1, VEGR-R2, VEGF-R3, PDGF-Rβ, c-Kir a Flt-3 [26]. Inhibice VEGF a PDGF sunitinibem brání dalšímu růstu nových cév. Předklinická data nasvědčují tomu, že sunitinib má protinádorovou aktivitu, která může vyplývat jak z inhibice angiogeneze, tak z přímých antiproliferativních účinků [26]. Ve studiích fáze I byl doporučený dávkový režim definován jako 50 mg perorálně jednou denně po čtyři týdny, načež následovaly dva týdny bez užívání v opakujících se šestitýdenních cyklech [27].
Sunitinib prokázal podstatnou klinickou účinnost ve dvou jednoramenných studiích fáze II na pacientech s mRCC rezistentními na léčbu cytokiny [28,29]. Schémata byla v obou studiích podobná. Byli zařazeni pacienti s mRCC, které progredovaly po léčbě IFN-α a/nebo IL-2 s měřitelnými lézemi a se statutem výkonnosti 0 nebo 1 ECOG (Eastern Cooperative Oncology Group). Všichni pacienti dostávali sunitinib po čtyři týdny a pak následovalo dvoutýdenní období bez léčby až do progrese nebo nepřijatelné toxicity. V první studii u 87 % ze 63 pacientů byl diagnostikován RCC z jasných buněk [28]. Střední přežití bez progrese bylo 8,7 měsíců a celkové přežití bylo 16,4 měsíce. Přibližně 40 % pacientů mělo částečnou odezvu (PR) a 26 % mělo stabilizované onemocnění po tři měsíce nebo déle. Navíc u většiny pacientů byla zaznamenána redukce měřitelné choroby. Ve druhé studii fáze II bylo zaregistrováno 106 pacientů s mRCC z jasných buněk, kteří dříve podstoupili nefrektomii [29]. Pacienti byli dále rozděleni na nízko-, středně - a vysocerizikové podskupiny podle rizikových faktorů MSKCC (Memorial Sloan Kettering Cancer Center) [30], většina pacientů měla výkonnostní status ECOG 0 nebo 1. Částečná odezva byla pozorována u 34 % ze 105 vyhodnocovaných pacientů, 29 % pacientů mělo stabilizované onemocnění po dobu třech měsíců a déle. Celková analýza těchto dvou studií fáze II ukázala, že 71 ze 168 pacientů (42 %) mělo odezvu a 40 pacientů (24 %) mělo stabilizované onemocnění po dva měsíce nebo déle [31]. Střední přežití bez progrese (PFS) bylo 8,2 měsíce u všech pacientů a 14,8 měsíců u pacientů s odezvou. Delší PFS byla pozorována u pacientů s příznivým statusem výkonnosti a normálními úrovněmi sérového hemoglobinu [31].
K dalšímu vyhodnocení účinnosti sunitinibu u dříve neléčených pacientů s mRCC byla provedena rozsáhlá vícenárodní studie fáze III [32]. Celkem 750 pacientů s nízko - až středněrizikovým RCC z jasných buněk bylo randomizováno pro léčbu buď sunitinibem, nebo IFN-α. Aby mohli pacienti být zařazeni do studie, museli mít dobrý status výkonnosti a měřitelné onemocnění. Primárním cílem bylo přežití bez progrese a sekundárním cílem byly výsledky týkající se pacienta, celkové přežití, míra odezvy a bezpečnost. Pacienti byli náhodně vybrání v poměru 1 : 1 pro dávku sunitinibu 50 mg/den perorálně v šestitýdenním cyklu nebo 9 milionů jednotek IFN-α podkožně třikrát týdně. Průměrný věk pacientů byl 60 let a 90 % již dříve podstoupilo nefrektomii. 35 % pacientů mělo onemocnění s nízkým rizikem, 58 % onemocnění se středním rizikem, 76 % pacientů onemocnění s vysokým rizikem. Střední PFS bylo jedenáct měsíců u skupiny, která dostávala sunitinib a pět měsíců u skupiny, která dostávala IFN-α (p < 0,000001). Objektivní míra odezvy stanovená nezávislou kontrolou byla 31 a 6 % (p < 0,000001). Byla pozorována pouze jedna úplná odezva (CR), která byla ve skupině sunitinibu. Sunitinib byl upřednostněn napříč všemi rizikovými skupinami MSKCC; pacienti v příznivé rizikové skupině léčení sunitinibem dosahovali střední PFS 14,9 měsíců ve srovnání s 8,4 měsíci ve skupině léčené IFN-α.
Výsledky této studie fáze III byly nedávno aktualizovány [33]. Konečná analýza přežití ukázala, že konečný medián celkového přežití (OS) byl 26,4 měsíce u pacientů léčených sunitinibem, ve srovnání s 21,8 měsíců u skupiny léčené IFN-α (p = 0,051). Střední přežití po cenzuře pacientů, kteří přešli od léčby IFN-α k léčbě sunitinibem, bylo 26,4 měsíce u skupiny sunitinibu a 20 měsíců u skupiny IFN-α (p = 0,03).
Pacienti randomizovaní pro sunitinib dosáhli významně vyšší objektivní odezvy než rameno s IFN-α [33]. Studie rozšířeného přístupu k sunitinibu zahrnovala 3 997 pacientů s mRCC, kteří nebyli vhodní pro zařazení do studií se sunitinibem [34]. Kritérii pro zařazení do této studie byl histopatologicky dokázaný mRCC s předcházející cytokinovou terapií nebo bez ní, pacienti ve vysocerizikové skupině, starší pacienti ve věku 65 a více let, RCC z nejasných buněk, pacienti s asymptomatickými mozkovými metastázami a se statutem výkonnosti ECOG 2 nebo více. Ze všech pacientů dostalo 2 854 předcházející cytokinovou léčbu a 1 132 ji nedostalo. Přežití 12 měsíců bylo 77,2 % u pacientů bez předcházející cytokinové léčby a 71 % u pacientů s předcházející cytokinovou léčbou. Objektivní ORR byla 11,4 %, což bylo méně než se uvádělo dříve, možná v důsledku rozdílů v metodologii. Analýza podskupiny pacientů s předcházející cytokinovou léčbou ukázala, že léčba sunitinibem byla prospěšná u pacientů ve věku 65 a více let, kteří neměli histologii z jasných buněk a status výkonnosti dva nebo více [34].
Sorafenib
Sorafenib tosylát je nízkomolekulární TKI, který inhibuje VEGF a PDGF receptory, Flt-3, Raf-1 a B-Raf [35]. Rodina receptorů Ras, která zahrnuje Raf-1 a b-Raf, se účastní proliferace, diferenciace a transformace normálních buněk. Signální dráha je rovněž přítomna v liniích nádorových buněk a hraje roli v patogenezi rakoviny [35]. VEGF působí přes signální dráhu Raf-Mek-Erk a sorafenib blokuje aktivitu VEGF tím, že inhibuje VEGFR a blokuje aktivitu VEGF.
Ve studii fáze II, která používala randomizované diskontinuální schéma, byla vyhodnocena účinnost sorafenibu u 202 pacientů s mRCC [36]. Studie zahrnovala pacienty, kteří nereagovali na předcházející léčbu IFN-α a IL-2. Vhodní pacienti začali léčbu sorafenibem 400 mg dvakrát denně po dobu 12 týdnů v počátečním náběhovém období. Po 12 týdnech při změnách dvourozměrného měření nádorů, které byly menší než 25 %, byli pacienti randomizováni pro sorafenib nebo placebo po dalších 12 týdnů. Pacienti, u nichž se nádor zmenšil o 25 %, pokračovali v léčbě sorafenibem, zatímco pacienti s progresí nádoru léčbu přerušili. Primárním cílem bylo PFS 24 týdnů po zahájení léčby sorafenibem. Na konci 12 týdnů bylo 50 % pacientů, kteří pokračovali se sorafenibem, bez progrese ve srovnání s 13 % randomizovaných pacientů na placebu (p = 0,0077). Střední doba do progrese u skupiny léčených pacientů byla 24 týdnů proti šesti týdnům ve skupině placeba (p = 0,0087). Pacientům, jejichž onemocnění progredovalo, byla pak dána možnost znovu zahájit léčbu sorafenibem. Celkem 28 pacientů začalo opět léčbu sorafenibem a onemocnění se stabilizovalo po střední dobu 24 týdnů [36]. Tato studie prokázala účinnost sorafenibu u pacientů, u nichž došlo k progresi při cytokinové léčbě. U těchto pacientů vede sorafenib k významnému zlepšení PFS.
Sorafenib byl rovněž studován v kombinaci s IFN-α v několika souborech fáze II. Ve dvoufázové studii bylo 186 pacientů původně randomizováno pro sorafenib jako léčbu první linie nebo IFN-α a při progresi dostávali pacienti v rameni sorafenibu vyšší dávku léku, zatímco ti, kteří byli léčení IFN-α, mohli přestoupit do ramene sorafenibu [37]. Střední PFS před přestoupením činilo 5,7 měsíců, respektive 5,6 měsíců pro rameno sorafenibu a IFN-α. Po počáteční progresi byl medián PFS u pacientů, kteří pokračovali s vyššími dávkami sorafenibu, 3,6 měsíce ve srovnání s 5,3 měsíce u pacientů, kteří přešli k sorafenibu [37].
V randomizované studii fáze III kontrolované placebem byla dále vyhodnocena účinnost sorafenibu u mRCC [38]. Celkem 903 pacientů, u nichž selhala jedna dřívější systémová terapie a měli měřitelné onemocnění, histologii karcinomu z jasných buněk a dobrou nebo střední prognózu a status výkonnosti ECOG 0 nebo 1, bylo randomizováno, aby dostávali kontinuálně 400 mg sorafenibu dvakrát denně nebo placebo. Téměř všichni pacienti podstoupili nefrektomii. Primárním cílem studie bylo stanovit celkové přežití (OS) a sekundárním cílem bylo přežívání bez známek progrese (PFS). Významně více pacientů v rameni sorafenibu mělo PR nebo SD ve srovnání s těmi, kteří dostávali placebo. Ve skupině sorafenibu mělo 43 pacientů PR (10 %) a 333 mělo SD (74 %). Ve skupině placebo mělo osm PR (2 %) a 239 mělo SD (59 %). Sorafenib významně prodloužil PFS ve srovnání s placebem (24 vs 12 týdnů; p < 0,000001) [38]. Zlepšení bylo pozorováno ve všech skupinách s rizikovou prognózou, avšak ukázalo se, že sorafenib má pozitivní vliv na pacienty, aniž by nepříznivě ovlivňoval kvalitu jejich života. Pacienti pak byli odslepeni a 216 ze 452 pacientů, kteří dostávali placebo, přešli k sorafenibu [39]. Při konečné analýze se významně nelišilo celkové přežití OS u populace “intent-to-treat“ mezi sorafenibem (17,8 měsíce) a placebem (15,2 měsíce) [39]. Nicméně po přehodnocení přestoupivších pacientů se zdálo, že doba přežití byla lepší u skupiny sorafenibu.
Klinická účinnost sorafenibu byla rovněž vyhodnocena v nedávné nekomparativní otevřené studii u pacientů s mRCC, kteří nebyli vhodní nebo u nichž selhala dřívější cytokinová terapie. Bylo zařa-zeno celkem 1 155 pacientů se středním věkem 62 let. Střední doba PSF byla 6,8 měsíců a střední doba trvání terapie byla 6,9 měsíců. Účinnost sorafenibu v této klinické studii se jevila podobná jako účinnost uváděná v randomizovaných klinických studiích [40].
Sorafenib se nyní často podává po selhání předcházející cílené terapie. V poslední době byla vyhodnocena aktivita a snášenlivost sorafenibu u pacientů refrakterních na sunitinib nebo bevacizumab v multicentrické prospektivní studii fáze II [41]. Míra zmenšení nádoru definovaná jako zmenšení nádoru nejméně o 5 % byla dosažena u 38 % pacientů a 20% nebo větší zmenšení bylo patrné u 14 % pacientů. Taková data potvrzují účinnost sorafenibu, pokud jde o zmenšení nádoru u pacientů s mRRC, u kterých předcházející cílená terapie selhala. Účinnost sorafenibu v první linii byla zkoumána v randomizované studii fáze II sorafenibu (400 mg dvakrát denně) proti IFN-α (9MU třikrát týdně) u pacientů se středním a nízkým rizikem (n = 189) [42]. PSF ve dvou ramenech studie bylo velmi podobné: 5,7 měsíce u randomizovaných pacientů užívajících sorafenib a 5,6 měsíce u pacientů užívajících IFN-α.
mTOR inhibitory
Temsirolimus
Temsirolimus je nitrožilně podávaný inhibitor mTOR, který reguluje výživové potřeby, růst buněk a angiogenezi tím, že reguluje různé proteiny, včetně HIF1α. Na základě povzbudivých výsledků studie fáze I byl zkoumán intravenózně temsirolimus podávaný jednou týdně v rozsáhlé studii fáze II pacientů s mRCC odolávajícím cytokinové terapii, randomizovaných podle dávky (25, 75 nebo 250 mg) [43]. Ze 111 randomizovaných pacientů měli mnozí znaky onemocnění vysokého rizika. Výsledky účinnosti byly ve všech skupinách podobné. Jako monoterapie vykazoval temsirolimus relativně nízkou objektivní odezvu 7 %, s dalšími 26 % menších odpovědí. Je zajímavé, že 17 % pacientů mělo stabilizované onemocnění trvající déle než šest měsíců. Delší přežití bylo pozorováno u pacientů se střední nebo špatnou prognózou, kteří vykazovali téměř dvojnásobné zvýšení přežití (22,5 měsíců u středně - a 8,2 měsíce u vysocerizikové skupiny) ve srovnání s historickými kontrolami léčenými IFN-α (13,8 a 4,9 měsíců u středně-, respektive vysocerizikových skupin) [43]. Ani toxicita ani účinnost nebyly významně ovlivněny úrovní dávek temsirolimu.
Tyto slibné výsledky pak vedly k zahájení velké multicentrické randomizované studie fáze III srovnávající IFN-α podávaný buď samotný nebo s temsirolimem, nebo monoterapii dávkou 23 mg temsirolimu podávanou intravenózně jedenkrát týdně jako léčba první linie 626 vysoce rizikovým pacientům s mRCC [44]. Obecnými kritérii pro zařazení pacientů do této studie byl status výkonnosti ECOG 2 nebo vyšší. Navíc museli mít pacienti nejméně tři z následujících vysoce rizikových faktorů: doba od diagnózy do první terapie kratší než jeden rok; korigované sérové kalcium 10 mg/dl nebo více; hladina dehydrogenázy laktátu vyšší než 1,5násobek horní hranice normálu. Dvě třetiny pacientů podstoupily předcházející nefrektomii a více než 80 % mělo histologii karcinomu z jasných buněk. Primárním cílem studie bylo celkové přežití. Temsirolimus byl obecně lépe snášen než IFN-α nebo kombinace dvou terapeutik. Nejméně jedna toxicita stupně 3 nebo 4 byla pozorována u 69 % pacientů léčených temisirolimem ve srovnání s 86 % pacientů léčených IFN-α a 87 % pacientů léčených kombinovanou terapií (p < 0,001). Objektivní míry odpovědi byly 30,6 % u kombinované terapiea 12,4 % u monoterapie (p < 0,0001). U placeba plus IFN-α byla 2% CR a 11% PR, u bevacizumabu plus IFN-α 1% CR a 30% PR. Ovšem střední OS byla delší ve skupině léčené jediným terapeutikem temsirolimusem než v ostatních dvou skupinách: 10,9 měsíců u temsirolimusu a 7,3 měsíce u IFN-α a 8,4 měsíce u kombinace (p = 0,0069) u monoterapie temsirolimem ve srovnání s IFN-α [44]. Autoři dospěli k závěru, že temsirolimus v monoterapii významně zlepšuje celkové přežití u pacientů s mRCC a vysoce rizikovými znaky ve srovnání s IFN-α, ale že však kombinace obou terapeutik nezlepší celkové přežití. Kromě toho byl temsirolimus lépe snášen než IFN-α a výzkumníci provádějící studii navrhli, aby temsirolimus byl považován za terapii první linie u pacientů s vysoce rizikovými znaky. Sunitinib se alternativně doporučuje jako terapie první linie u pacientů s mRCC u všech rizikových skupin vzhledem k prospěchu pozorovanému při léčbě první linie sunitinibem ve srovnání s IFN u vysoce rizikových pacientů [45].
Everolimus
Everolimus je perorální inhibitor mTOR a byly uváděny slibné výsledky u 41 pacientů s mRCC, kteří prodělali až jednu předchozí terapii [46]. U pacientů, kteří dostávali everolimus v dávkách 10 mg denně, vykazovalo 23 % PR a 38 % mělo SD. PFS činilo 11,2 měsíce. V poslední době byla provedena randomizovaná studie fáze III everolimu, dvojitě zaslepená placebem, u pacientů s mRCC z jasných buněk s progredujícím onemocněním během nebo do šesti měsíců léčby, buď sunitinibem nebo sorafenibem a nebo oběma preparáty [47]. Byla to populace, kde mnoho pacientů bylo již předtím léčeno řadou preparátů, včetně bevacizumabu a cytokinů. Pacienti byli namátkově vybráni v poměru 2 : 1 pro léčbu everolimem 10 mg jednou denně (n = 272) nebo placebem (n = 138). Byla zaznamenána výhodnost everolimu, pokud jde o PFS, přičemž střední hodnota byla 4 vs 1,9 měsíců v rameni placeba (p < 0,001) [47]. Podrobnější analýza neidentifikovala nějaké specifické podskupiny, které by získaly nějaký další prospěch založený na rizikovosti skupiny nebo dříve prodělané terapii. Míra objektivní odpovědi byla malá – 1 %, avšak přibližně 50 % pacientů vykazovalo určitý stupeň zmenšení nádoru. Výzkumníci dospěli k názoru, že léčba everolimem prodloužila PFS ve srovnání s placebem u pacientů s mRCC, které progredovaly po jiných cílených terapiích [47].
Monoklonální protilátky (bevacizumab)
Bevacizumab je monoklonální protilátka vyvinutá proti VEGF, která váže a neutralizuje všechny biologicky aktivní izoformy VEGF a je zacílena na dráhu VHL/HIF/ VEGF. V randomizované studii fáze II bylo 116 pacientů s mRCC odolným proti IL-2 randomizováno, aby dostávali buď bevacizumab ve dvou různých dávkách (10 mg/kg denně nebo 3 mg/kg každé dva týdny) nebo placebo [48]. Významné prodloužení doby do progrese bylo zjištěno u pacientů, kteří dostávali vysoké dávky bevacizu-mabu vs placebo, ačkoli doba přežití nebyla významně rozdílná. Žádný rozdíl v PFS nebyl pozorován při nízké dávce. V multicentrické dvakrát zaslepené randomizované studii fáze III byla vyhodnocena účinnost a bezpečnost bevacizumabu plus IFN-α (n = 327) jako terapie první linie vs placebo plus IFN-α (n = 332) u pacientů s mRCC z jasných buněk [49]. Pacienti byli randomizováni, aby dostávali bevacizumab 10 mg/kg nitrožilně každé dva týdny a IFN-α 9 MU podkožně třikrát týdně nebo placebo a IFN-α. Objektivní míry odpovědi byly 30,6 % u kombinované terapie a 12,4 % u monoterapie (p < 0,0001). U placeba plus IFN-α byla 2% CR a 11% PR, u bevacizumabu plus IFNα 1% CR a 30% PR. Střední doba PFS v rameni bevacizumab plus IFN-α byla 10,2 měsíce ve srovnání s 5,4 měsíce v rameni s monoterapií (p < 0,0001). Zdálo se, že skupina se středním rizikem podle MSKCC systému měla větší prospěch z kombinace (4,5 vs 10,2 měsíce) než nízkoriziková skupina (7,6 vs 12,9 měsíce). Střední doba OS činila 19,8 měsíce v rameni IFN-α, zatímco jí nebylo dosaženo v rameni bevacizumabu. Jiná podobná studie fáze III také porovnávala bevacizumab 10 mg/kg každé dva týdny a IFN-α 9 MU podávaných podkožně třikrát týdně se stejnou dávkou IFN-α v monoterapii u 732 pacientů s dříve neléčenými mRCC z jasných buněk [50]. Primárním cílem bylo OS, kterého dosud nebylo dosaženo, sekundárním cílem byly míry PFS a objektivní odpovědi. Střední doba PFS byla 8,5 měsíce u pacientů, kteří dostávali bevacizumab plus IFN-α vs 5,2 měsíce u pacientů, kteří dostávali monoterapii IFN-α (p < 0,0001). Objektivní míra odpovědi byla 25,5 % vs 13,1 % ve prospěch ramena kombinované terapie (p = 0,0001). Na základě výsledků obou randomizovaných studií se bevacizumab kombinovaný s IFN-α považoval za schůdnou alternativu k TKI v první linii léčby mRCC [49,50]. Nicméně otázka, zda byl bevacizumab hlavním zdrojem aktivity v těchto kombinacích, musí být teprve zodpovězena, jelikož žádná studie neměla rameno se samotným bevacizumabem.
Klinická účinnost u histologického nálezu jiného než z jasných buněk
Jelikož dráha pVHL je ovlivňována u většiny RCC z jasných buněk, byly klinické studie pokročilého onemocnění zaměřeny především na pacienty s tímto subtypem a neexistují žádná prospektivní data o jiných histologických subtypech, jako jsou papilární nebo chromofobní RCC. Účinnost sunitinibu a sorafenibu byla vyhodnocena v retrospektivní multicentrické studi u 41 pacientů s papilárním a 12 pacientů s chromofobním RCC [51]. Z papilárních RCC mělo 4,8 % pacientů PR a 68 % mělo SD po dobu tří měsíců nebo déle. PFS činila 7,6 měsíců s tendencí k lepší PFS u sunitinibu než u sorafenibu (11,9 vs 5,1 měsíce) (p = 0,001). Z 12 pacientů s chromofobním subtypem (25 %) měli tři PR a všichni ostatní měli SD nejméně tři měsíce a déle. Ve studii fáze III porovnávající temsirolimus, IFN-α a temsirolimus plus IFN-α jako léčbu první linie u vysoce rizikových mRCC, mělo přibližně 20 % pacientů RCC jiný než z jasných buněk [44]. V podrobnější analýze této studie byl vyhodnocen účinek temsirolimu vs IFN-α na OF a PFS u pacientů s histologií jinou než z jasných buněk [52]. Pacienti s RCC z jiných než z jasných buněk, kteří dostávali temsirolimus, měli delší OS a PFS než ti ve skupinách IFN-α (OS 11,6 vs 4,3 měsíce; PFS 7 vs 1,8 měsíců). Metastatická chromofobní varianta je velmi vzácná a klinická data jsou rovněž vzácná. Uvádělo se, že sorafenib byl účinný u 17 z 18 pacientů s mRCC, když stabilizované onemocnění se prohlašuje za cíl účinnosti, včetně tří parciálních odpovědí [53].
Sarkomatoidní diferenciace RCC se vyskytuje u všech histologických subtypů RCC s incidencí 1–23 % ze všech RCC [53]. Je to jednotně spojováno se špatnou prognózou, se středním přežitím 2–9 měsíců [54]. Tradiční terapie, jako je např. imunoterapie, nejsou v takových případech účinné. Proto se zkoumá účinnost nových antiangiogenních látek. V jedné studii bylo léčeno 46 pacientů se sarkomatoidními nádory sorafenibem 400 mg denně. Uvádělo se, že míra stabilizace onemocnění a PFS byla 67 %, respektive 4,3 měsíce, byla však významně nižší a kratší než u pacientů s RCC z jasných buněk [55]. V novější studii bylo identifikováno 43 pacientů s mRCC se sarkomatoidními znaky léčených antiangiogenní terapií [56]. Z nich 49 % dostávalo sunitinib, 28 % sorafenib, 19 % bevacizumab a 5 % dostávalo bevacizumab plus sunitinib. Zmenšení nádoru bylo dokumentováno u 47 % pacientů a střední zmenšení činilo 2 %. Osm pacientů (19 %) dosáhlo PR a 21 % mělo SD. Na základě těchto výsledků došli autoři k závěrům, že pacienti s mRCC se sarkomatoidními znaky prokazovali objektivní odpovědi a zmenšení nádorů při antiangiogennní terapii.
Kombinované a postupné terapie
Pacienti dostávající antiangiogenní monoterapii zaznamenali zlepšení v odpovědi nádoru a v přežití; nicméně úplné odpovědi jsou vzácné, a u všech pacientů nádor během léčby progreduje. U většiny pacientů, kteří užívají tato terapeutika, se vyvine získaná rezistence a nyní se zkoumá, zda kombinací několika terapeutik je možné v molekulární dráze HIF tuto rezistenci překonat. Byly uváděny dvě různé koncepce kombinace cílené terapie RCC [6]. Blokáda vícečetných drah (horizontální blokáda) se snaží cíleně zasáhnout četné molekuly osy HIF ve snaze předejít proliferaci rakovinných buněk, podporovat apoptózu a zabránit angiogenezi indukované nádorem. Alternativním přístupem je kombinace terapeutik, která nepřímo inhibují HIF, s terapeutiky, která inhibují na HIF odpovídající růstové faktory a jejich receptory, jako je kombinace inhibitoru mTOR s bevacizumabem a/nebo TKI (vertikální kombinace). V tomto kontextu submaximální inhibice každé komponenty v dráze může stále mít významný účinek, protože celková inhibice dráhy se bude měnit jako produkty účinků na každou složku. Nicméně neexistují žádné definitivní zprávy o synergii mezi terapeutiky užívanými v léčbě RCC. Je již zřejmé, že kombinovaná terapie značně zvyšuje toxicitu, zvláště při vertikální inhibici podél téže dráhy. Navíc dnes není známo, zda tyto kombinace budou mít zvýšenou a prodlouženou protinádorovou aktivitu, nebo zda mohou překonat mechanizmus vzniku rezistence k danému léku.
Aby se maximalizovaly protinádorové účinky, byly navrženy kombinace léků pro vertikální inhibici spojující monoklonální protilátky dráhy VEGF nebo TKI dráhy VEGF-R nebo inhibitory mTOR. Dosud se ukázalo, že pouze angiogeneze nebo dráha mTOR jsou hlavními dráhami a podporují kombinaci příbuzných léků. Významnou obavou kombinované terapie je to, že překrývající se toxicity budou mít za následek redukci dávky léků, které negují prospěšnost kombinované terapie.
V nedávné multicentrické studii fáze II byla vyhodnocena účinnost a bezpečnost kombinace antiangiogenního terapeutika bevacizumabu a mTOR inhibitoru everolimu [57]. Pacienti zařazení do studie byli rozděleni do dvou skupin: 30 pacientů (skupina I), kteří neprodělali žádnou předcházející léčbu, a 29 pacientů (skupina II) s předcházející léčbou sorafenibem nebo sunitinibem.
Částečná odpověď byla pozorována u 23 %, respektive 11 % pacientů skupiny I a II. Toxicita stupně 3/4 nastala u 19 % pacientů. Autoři dospěli k názoru, že kombinace bevacizumabu plus everolimu byla aktivní a tolerovatelná pro léčbu mRCC. Kombinace byla účinná u pacientů dříve léčených sorafenibem nebo sunitinibem [57]. Byla rovněž provedena nebo probíhá řada studií kombinujících antiangiogenní TKI s bevacizumabem, terapeutiky EGFR, inhibitory mTOR nebo cytokiny. Multicentrická randomizovaná studie fáze II kombinovala 10 mg/kg bevacizumabu s perorálně podávaným EGF receptorem TKI erlotinibem 150 mg denně a zařadila 63 pacientů s mRCC, kteří dříve prodělali jednu neúspěšnou léčbu [58]. Z 59 hodnotitelných pacientů mělo 25 % objektivní odpovědi a střední PFS byla 11 měsíců a střední OS byla více než 20 měsíců. Jiná randomizovaná studie bevacizumabové monoterapie vs bevacizumab plus erlotinib dříve neléčených mRCC ukázala 13% objektivní odpověď u pacientů, kteří dostávali bevacizumabovou monoterapii, a 8,5 měsíce PFS [59]. Jak již bylo uvedeno, existují některé randomizované klinické studie, které byly zaměřeny na kombinaci IFN s temsirolimem nebo bevacizumabem. Temsirolimus v monoterapii významně zlepšil OS u vysoce rizikových pacientů s mRCC v porovnání s kombinací temsirolamu plus IFN [44]. V jiné studii byla kombinace bevacizumabu s IFN lepší než monoterapie IFN [49]. Velké úsilí se v současné době věnuje vývoji různých kombinací dvou nebo tří inhibitorů drah VEGF nebo mTOR za účelem zvětšení rozsahu a trvání antiangiogenních účinků. Jednou takovou studií je ECOG E2804, která namátkově přiřazuje pacienty k bevacizumabu, bevacizumabu a sorafenibu, bevacizumabu a temsirolimu nebo sorafenibu a temsirolimu. Pouze míra odpovědi nebo PFS překračující tyto hodnoty u monoterapie vysoce účinným inhibitorem VEGFR s přijatelnou toxicitou by stály za to, aby se přistoupilo k budoucímu testování. Velká obava se rovněž týká kombinované terapie, která překrýváním závažných toxických účinků povede ke snížení dávek terapeutik, které nakonec neguje prospěch kombinované terapie. Pokud nebude kombinovaná terapie prokazatelně účinnější než monoterapie v těchto klinických studiích, měla by se považovat za výzkumnou.
Postupná léčba po jedné linii antiangiogenního preparátu byla vyhodnocena v řadě předcházejících studií. U pacientů, kteří byli léčeni bevacizumabem, se zdá, že sunitinib byl v některých případech schopen dosáhnout PR nebo stabilizace onemocnění [60]. V současné době vyhodnocuje několik studií posloupnost nových terapeutik ve snaze vysvětlit aktivitu a optimální posloupnost. Celkem tato data nasvědčují tomu, že by zde mohla být nezkřížená rezistence mezi antiangiogenními terapeutiky a že tato terapeutika by mohla být užívána postupně.
Nově se objevující TKI
Axitinib je inhibitor receptorů kináz VEGFR1, VEGFR2, PDGFR a c-kit [61]. Ve studii fáze II axitinibu u 52 pacientů s mRCC, z nichž všichni prodělali nejméně jednu dřívější neúspěšnou terapii na bázi cytokinů, bylo dosaženo 44% ORR, včetně dvou pacientů (4 %) s CR [61].
Axitinib byl rovněž studován u pacientů, kteří měli progresi po léčbě sorafenibem [62]. Byla prokázána míra odpovědí 21 % (ve všech případech šlo o částečné odpovědi) a u 55 % pacientů bylo dosaženo určitého stupně zmenšení nádoru. Tato data ukazují, že axitinib je aktivní lék na RCC a u pacientů, kteří prodělali jednu dřívější neúspěšnou terapii, probíhá studie fáze III axitinib vs sorafenib.
Pazopanib je další perorální terapeutikum z rodiny TKI a inhibuje VEGFR, PDGFR a c-kit [63]. Studie fáze II a III stále probíhají, ale předběžné výsledky jsou slibné. Ve studii fáze III byla dosažena stabilizace nádoru u 82 % případů (ORR u 40 % a stabilizace nádoru u 42 %) při užívání po 12 týdnů 800 mg denně jako terapie druhé linie u 60 pacientů s mRCC z jasných buněk [64].
AV-951 je nový potentní a selektivní inhibitor VEGF receptorů 1, 2 a 3 vykazující pikomolární inhibiční aktivitu proti všem třem receptorům [65]. Nedávno provedená placebem kontrolovaná nerandomizovaná diskontinuální studie fáze II hodnotila bezpečnost a účinnost jednou denně perorálně podávaného AV-951 u pacientů s mRCC, kteří doposud nedostávali žádnou terapii cílenou na VEGF. Zatím dosažené výsledky studie fáze II prokázaly 31% ORR u pacientů s RCC z jasných buněk a 12% u histologií ostatních. Nežádoucí efekt profilu AV-951 byl konzistentní s profilem selektivního inhibitoru VEGFR s minimálními mimoterčovými toxicitami [58,65].
Profily toxicity
V klinických studiích RCC vykazovaly TKI a angiogenní terapeutika konzistentní profil snášenlivosti. Nejdůležitějšími vedlejšími účinky, které se pravděpo-dobně objeví u těchto preparátů, jsou únava, hypertenze (HT), syndrom ruka-noha (HFS), gastrointestinální symptomy, změny pigmentace kůže, hematologická toxicita a dysfunkce levé srdeční komory [66].
Systémová inhibice VEGF by mohla vést ke zvýšení vaskulárního tonu; proto je HT jedním z nejobvyklejších nepříznivých vedlejších účinků spojených s užívání antiangiogenních terapeutik [67]. Proto je v průběhu terapie důležité pečlivě sledovat krevní tlak. Zvládnutí vysokého krevního tlaku se musí řešit případ od případu. U většiny případů je dobrá odpověď dosažena antihypertenzní terapií. Objevující se data o bezpečnosti ukazují, že kardiotoxicita může být spojena se sunitinibem ve vyšší míře, než jaká je patrná v klinických studiích [67]. Dysfunkce levé srdeční komory je hlavním kardiologickým vedlejším účinkem sunitinibu a může být zčásti důsledkem toxicity působící na buňky srdeční svaloviny potencované HT. Proto by krevní tlak a ejekční frakce levé srdeční komory měly být pečlivě monitorovány u těch pacientů, kteří užívají sunitinib a kteří mají anamnézu koronárního cévního onemocnění nebo kardiologické rizikové faktory.
HFS je charakterizováno zarudnutím kůže, jejím znecitlivěním, brněním a dysesteziemi nebo paresteziemi na dlaních rukou nebo chodidlech nohou [66]. Podpůrná opatření z důvodu HFS by měla být zahájena rychle, aby se předešlo progresi. Kůže by měla být zvlhčována a vystavována vzduchu, aby se zmenšilo pocení. Těžké případy mohou být zvládnuty přerušením dávky a pokračováním s aplikací snížené dávky. Funkční zánět sliznice je nejčastějším klinicky relevantním gastrointestinálním nepříznivým účinkem spojeným s cílenými terapiemi. Techniky zvládnutí zahrnují užívání narkotických analgetik k tlumení bolestí a v některých případech může být potřebná intravenózní hydratace. Změny zbarvení kůže mohou nastat při víceterčových terapiích, když se objeví nažloutlý odstín, který není spojen se žloutenkou nebo depigmentací.
Ačkoli alopecie je u sorafenibu a sunitinibu neobvyklá, může nastat řídnutí vlasů [66].
U pacientů dostávajících sunitinib může dojít k neutropenii 3. nebo 4. stupně, lymfocytopenii a trombocytopenii. Jakékoli účinky na počet krevních elementů se obvykle upraví během období, kdy je léčba vysazena, ale může trvat až tři týdny, než jejich počet dosáhne stupně 2 nebo výchozího stavu [66]. Makrocytóza definovaná jako nárůst středního korpuskulárního objemu červených krvinek byla rovněž pozorována při léčbě sunitinibem [68]. Ačkoli makrocytóza indukovaná sunitinibem byla reverzibilní při přerušení podávání léků, výskyt makrocytózy při léčbě nevylučoval pokračování v terapii.
Hypothyreoidizmus byl u pacientů uváděn již jeden až dva týdny po zahájení léčby sunitibinem a incidence se progresivně zvětšuje s trváním terapie [67]. U pacientů s mRCC léčených sunitibinem mělo 85 % abnormální výsledky při jednom nebo více testech funkce štítné žlázy, včetně zvýšení hladiny TSH, snížené hladiny T3 a méně obvyklého snížení hladiny T4 [67]. U pacientů, kteří dostávají sunitinib, je třeba zajistit pravidelné sledování funkce štítné žlázy. Dočasné přerušení sunitinibu se doporučuje ve vzácných případech (< 1 %) pacientů se záchvaty a radiologickým důkazem syndromu reverzibilní posteriorní leukoencefalopatie [67]. Znaky a symptomy konzistentní se syndromem reverzibilní posteriorní leukoencefalpatie by měly být kontrolovány řešením léků a po rozlišení může být lék znovu užíván.
IL-2
Léčba mRCC imunoterapeutickými látkami byla dlouho považována za slibný přístup. Základ imunologické manipulace u RCC měl původ v pozorování, že metastázy mohou ustoupit spontánně po nefrektomii, pozdních relapsech po nefrektomii a prodloužené stabilizaci metastatického onemocnění při absenci systémové léčby [69]. Celkem vzato, spontánní regrese nastává u méně než 1 % pacientů. Jelikož tento jev byl považován za zprostředkovaný imunitou, byla výzkumu imunologických terapií věnována značná pozornost.
Až donedávna byla cytokinová terapie IFN-α nebo IL-2 považována za standardní péči v léčbě první linie mRCC. Interferony mají přímý antiproliferativní účinek na buňky renálního nádoru in vitro, stimulují hostitelské mononukleární imunnitní buňky a zesilují expresi hlavních histokompatibilních molekul [70]. IFN-α bylo první aktivní protinádorové terapeutikum s reprodukovatelnou imunitní aktivitou u pacientů s mRCC. Monoterapie IFN-α poskytuje pouze skromnou výhodu, pokud jde o OS, a je nejlépe shrnuta v nedávno uveřejněné Cochraneově analýze 6 117 pacientů léčených v 53 randomizovaných studiích [71]. ORR bylo 12,5 % vs 1,5 % u neimunoterapeutických kontrol, se sníženou jednoroční mortalitou a významným zlepšením středního přežití o 3,8 měsíce. Pouze 3 % pacientů žilo po IFN-α monoterapii 5 a více let. Nebyl prokázán žádný vztah závislosti mezi dávkou a odpovědí, ani žádná korelace mezi mírou odpovědi a OS. Avšak výsledky randomizovaných studií cílených terapií, které používaly IFN-α jako kontrolní rameno, zjistily převahu těchto nových terapií nad monoterapií IFN-α u dříve neléčených pacientů, a tyto poznatky zužují budoucí používání IFN-α jako monoterapie v této indikaci.
IL-2 je 15-kDa glykoprotein, přirozeně vylučovaný aktivovanými T lymfocyty, většinou CD4+ buňkami a rekombinantní IL-2 je k dispozici od roku 1985. Od jeho prvního podání byly zaznamenány dramatické reprodukovatelné regrese nádorů po systémové léčbě u pacientů s mRCC, a asi 5 % z nich je vyléčeno; nicméně přesný mechanizmus zprostředkovávající regresi nádoru nebyl identifikován. Jelikož IL-2 nemá žádný přímý vliv na nádorové buňky, které mohou bez zábran růst in vitro, předpokládalo se, že vliv IL-2 na nádory in vitro je odvozen z jeho schopnosti expandovat a aktivovat lymfocyty s protinádorovou aktivitou [72]. Ve skutečnosti má IL-2 vliv na několik imunitních buněk, včetně buněk T, buněk s ničivými účinky (killer cells), buněk B, monocytů/makrofágů a neutrofilů tím, že se váže k podjednotkám receptoru IL-2 na těchto buňkách [73]. Navíc, jiné imunitní buňky jsou aktivovány cytokiny produkovanými aktivovanými T buňkami a přirozenými buňkami s ničivými účinky (killer cells), jako jsou IFN-γ, faktor stimulující kolonii granulocytů makrofágů a TNF-a. IL-2 tudíž nemá žádný přímý vliv na nádorové buňky, avšak zprostředkovává protinádorovou aktivitu modulováním imunitní odpovědi hostitele [72]. IL-2 byl rozsáhle vyhodnocen v léčbě mRCC. Studovaly se různé dávky a způsoby podávání ve snaze maximalizovat účinnost a snížit významné toxicity, které mohou být spojeny s terapií vysokými dávkami IL-2. Vysoká dávka IL-2 byla definována jako IL-2 podávaný jako intravenózní bolus nejméně 600 000 IU/kg každých 8 hod a nebo dávka překračující 65 MU/m2 denně. IL-2 v dávce 18 MU/ m2 1–4 nebo 5 dnů intravenózně se nepovažuje za vysokou dávku IL-2.
V roce 1995 Fyfe et al uveřejnili zralé výsledky získané u 255 pacientů s mRCC léčených vysokou dávkou nitrožilního bolusu IL-2 v monoterapii ze sedmi klinických studií provedených ve 27 ústavech [74]. Celkem 15 % z populace pacientů mělo objektivní odpověď (CR: 7 %; PR: 8 %). K odpovědím došlo ve všech místech onemocnění, včetně kostí, intaktních primárních nádorů, viscerálních metastáz, a u pacientů s velkou nádorovou zátěží a objemnými individuálními lézemi. Míra přežití 5 let byla u 18 % a 10 let u 10 % [74]. Avšak toxicita spojená s vysokými intravenózními bolusovými dávkami IL-2 byla významná. Horečka, pokles krevního tlaku, oligurie s výraznou retencí tekutin, pulmonální edém, zmatenost, hepatická dysfunkce a syndrom kapilárního úniku byly uváděny jako důsledek léčby IL-2 [74]. Celkem 4 % pacientů zemřely na nežádoucí účinky, o nichž se soudilo, že mohly být spojeny s léčbou, a 15 % pacientů muselo být přijato na jednotku intenzivní péče. Prospěch vysoké dávky IL-2 a nízké dávky cytokinu byl rovněž zkoumán ve dvou velkých randomizovaných studiích. Cytokine Working Group randomizovala 193 pacientů s mRCC, kteří doposud nepodstoupili léčbu cytokiny, buď pro vysokou dávku IL-2 (600 000 IU/kg) podávanou ve 14 dávkách intravenózně každých 8 hod, nebo pro podkožně podávanou nízkou dávku IL-2 při 5 mil. UI/m2 pět dní/týden [76]. Pozorovaná ORR činila 26 % u vysoké dávky IL-2 vs 11 % u nízké dávky, při žádném významném rozdílu v PFS 3 roky nebo OS 17,5 vs 13 měsíců). Podstatně zvýšený byl počet toxicit stupně 3/4 u pacientů léčených vysokou dávkou [76].
Studie Národního onkologického ústavu randomizovala 283 pacientů s mRCC pro léčbu vysokou dávkou IL-2 (720 000 UI/kg) vs nízkou intravenózní dávkou bolusem IL-2 (72 000 IU/kg) vs podkožní dávkou IL-2 125 000 UI/kg [77]. Uváděná ORR byla 21, respektive 13, respektive 10 % u pacientů, kteří dostávali vysokou dávku IL-2, respektive nízkou dávku IL-2, respektive nízkou dávku IL-2 podkožně. OS se mezi těmito třemi schématy nelišilo. Jak se očekávalo, toxicity stupně 3/4 byly častější u vysoké dávky IL-2. Ačkoli výsledky těchto studií vymezily prospěšnost léčby vysokou dávkou IL-2, pokud jde o trvalé CRs ve srovnání s režimem nízké dávky, neprojevilo se to v rozdílu střední doby OS. Se záměrem snížit závažné nežádoucí účinky byly zahájeny klinické studie vyhodnocující kontinuální nitrožilní podání IL-2 nebo podkožní aplikaci IL-2. Nejméně 116 klinických studií fáze I–III imunoterapie založené na IL-2 bylo vyhodnoceno v předcházejícím přehledu [78]. V těchto studiích se IL-2 užíval v různých dávkách a s použitím různých cest podávání, buď jako monoterapie nebo v kombinaci s jinými cytokiny, chemoterapií, endokrinní léčbou a adoptivní buněčnou imunoterapií. Ačkoli byl proveden velký počet randomizovaných studií s různými strategiemi léčby, je stále nejisté, zda dávka nebo kombinace IL-2 s jinými látkami podstatně ovlivňuje výsledek léčby [78]. Některé vybrané randomizované studie fáze III imunoterapie založené na IL-2 jsou uvedeny v tab. 2 [76,77,79–82]. Prospěšnost IL-2 pro přežití nebyla prokázána v randomizovaných studiích ve srovnání s kontrolními skupinami bez imunoterapie. Téměř všechny randomizované studie jsou malé a žádná skupina léčení IL-2 neměla víc než 140 pacientů. To znamená příliš nízkou statistickou schopnost odhalit dlouhodobý prospěch pro přežití aktuálně patrný u malé skupiny pacientů léčených IL-2. V nedávné studii byl dlouhodobý výsledek imunoterapie založené na IL-2 vyhodnocován u 330 po sobě jdoucích pacientů, kteří prodělali imunoterapii první linie, založenou na IL-2 u mRCC z jasných buněk [83]. Cílem autorů bylo vyvinout prognostickou klasifikaci, která by pomáhala vybírat pacienty, u nichž je největší pravděpodobnost prospěchu z léčby IL-2. Celkem 7 % pacientů dosáhlo CR a 17 % PR. Pokles objektivní odpovědi byl pozorován s rostoucí rizikovou skupinou MSKCC (31 % u nízkorizikové, 25 % u středněrizikové a 11 % u vysocerizikové skupiny pacientů). Vysocerizikoví pacienti s nízkým statusem výkonnosti ECOG, krátkým intervalem po diagnóze RCC, jaterními metastázami a velkým počtem míst onemocnění obvykle neměli prospěch z léčby IL-2. Podle těchto výsledků výzkumníci dospěli k závěru, že nízkorizikoví pacienti s mRCC byli výtečnými kandidáty na léčbu IL-2 [83]. Jelikož seznam efektivních terapií pro mRCC narůstá, bude nutné zlepšit výběr pacientů, aby se zajistilo, že pacienti, kteří by mohli dosáhnout trvalé remise s IL-2, nepromeškají tuto příležitost. Je zřejmé, že dlouhodobého přežití s CR po léčbě vysokou dávkou IL-2 dosahuje menšina pacientů (přibližně 10 %), nicméně důležitou otázkou je identifikovat tuto podskupinu pacientů [77]. K identifikaci predikátorů odpovědi na vysokou dávku IL-2 navrhli někteří výzkumníci uhličitou anhydrázu (CAIX) jako imunohistochemický marker pro predikci výsledků u pacientů s mRCC [84]. K expresi proteinu CAIX dochází ve většině případů RCC, avšak nikoli v normální ledvinové tkáni [84]. V nedávné metaanalýze byla exprese CAIX ve více než 85 % nádorových buněk spojována se zvýšením přežití a vyšší objektivní odpovědí u pacientů léčených IL-2 [84]. Tato data naznačují, že objektivní odpovědi včetně trvalých CR jsou vyšší u pacientů léčených vysokou dávkou IL-2; avšak není prokázán žádný prospěch pro PFS nebo OS. Toxicita je podstatná u léčby vysokými dávkami IL-2, a to zdůrazňuje nutnost správného výběru pacientů. Tudíž s ohledem na cytokinovou terapii u mRCC mohou pacienti s dobrým statusem výkonnosti, kteří mají přístup do experimentálních center, dostat odpovídajícím způsobem vysokou dávku IL-2 po pečlivém zvážení prospěchu a potenciálních nežádoucích účinků tohoto terapeutika. Stručně řečeno současné dostupné důkazy naznačují, že je vhodné pokračovat v léčbě nízkorizikových mRCC vysokými dávkami IL-2 [76]. Nicméně u pacientů se středně - až vysocerizikovým onemocněním by cytokiny nadále neměly být doporučovány. Pracovní skupina pro cytokiny (Cytokine Working Group) nedávno zahájila studii Výběr pro vysokou dávku IL-2 (high dose IL-2 „Select“ trial). Primárním cílem této studie je stanovit prospektivním způsobem, zda prediktivní model navržený Atkinsem et al může identifikovat skupiny pacientů s mRCC, u nichž je významně větší pravděpodobnost odpovědi na terapii, která je založena na vysokých dávkách IL-2 (nízkorizikoví), než u historické neselektované populace pacientů [85]. Faktory předikující odpověď na terapii vysokými dávkami IL-2 budou v této probíhající studii rovněž zkoumány se záměrem úžeji vymezit aplikaci vysokých dávek IL-2 na ty pacienty, kteří z ní budou mít s největší pravděpodobností prospěch.
Tab. 2. Randomizované klinické studie fáze III. 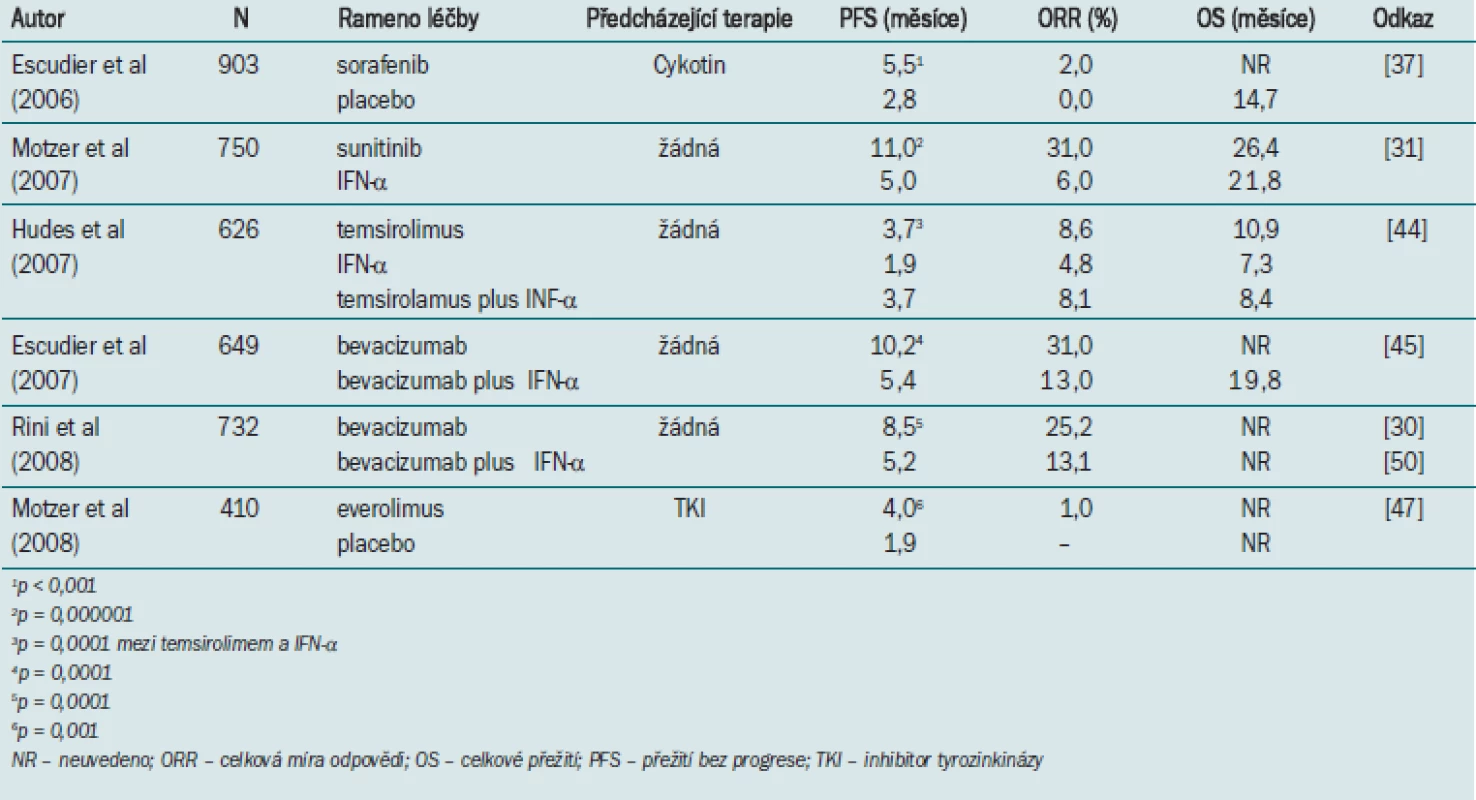
PŘEHLED RANDOMIZOVANÝCH STUDIÍ A KLINICKÝCH DOPORUČENÍ
Interpretace výsledků všech těchto klinických studií týkajících se pokročilého RCC by měly být kriticky zhodnoceny. Klinické studie by měly být interpretovány v kontextu toho, zda se snaží zlepšit vědecké pochopení nebo změnit klinickou praxi. Míry zmenšení měřitelných nádorových lézí se ve studiích obvykle používají jako primární cíl cílených terapií pro mRCC. Trvání OR se měří od doby, kdy jsou poprvé splněna měřitelná kritéria CR/PR až po první datum, kdy je recidivující nebo progresivní onemocnění objektivně dokumentováno [86]. Doba do vzniku progrese onemocnění (PFS) je rovněž důležitým cílem téměř ve všech studiích léčby mRCC. U mnoha pevných nádorů, jakož i u mRCC, mají terapeutika, která vedou ke zmenšení nádoru, u části pacientů racionální šanci následně prokázat zlepšení OS nebo jiných měřitelných kritérií (jako je PFS) v randomizovaných studiích fáze III [86]. OS je velmi významným kritériem pro vyhodnocení odpovědi na určitou léčbu. Protože schopnost dnešních terapií, včetně cílených terapií, vyléčit RCC je stále limitována a má skromné účinky na míru přežití, mohou být používána jiná měřítka odpovědi. Má-li terapie malý účinek na míru přežití, její užití je primárně paliativní a mělo by být oprávněno na základě zlepšení symptomů spojených s onemocněním a kvality života pacienta.
Porovnání výsledků randomizovaných studií fáze III používání nových terapeutik pro mRCC je uvedeno v tab. 3. Jak již bylo řečeno, účinnost sunitinibu byla demonstrována v nedávné randomizované studii fáze III jako první linie léčby [31]. Nedávná prezentace dat hodnotících OS ze studie fáze III potvrdila prospěšnost sunitinibu při léčbě první linie pacientů s mRCC [87]. Střední OS u sunitinibu (26,4 měsíců) byla podstatně delší než OS pozorovaná u IFN-α (21,8 měsíců). Tudíž nejnovější klinické směrnice pro RCC doporučují, aby byl sunitinib zvolen jako terapie první linie pro příznivé a středně rizikové pacienty s mRCC [88,101]. Alternativní volbou pro léčbu první linie by mohla být kombinace bevacizumabu plus IFN-α. Dvě studie fáze III ukázaly, že prospěch z léčby bevacizumabem v kombinaci s IFN-α byl větší u pacientů stratifikovaných do skupin příznivých a skupin středně rizikových (tab. 2). Monoterapie IFN poskytuje pouze minimální zlepšení přežití [71]. Ačkoli nemá IL-2 žádný prokazatelný prospěch pro přežití, někteří pacienti s nízkým rizikem zřejmě dosáhnou dlouhodobého přežití s CR po léčbě vysokou dávkou IL-2 [77]. To činí z IL-2 volbu první linie pro léčbu mRCC, zvláště u pacientů s nádory s nízkým rizikem. Pět rizikových faktorů spojených s kratším přežitím bylo identifikováno podle klasifikace rizika MSKCC, která byla vyvinuta v éře cytokinů. Jsou jimi: nízké hodnoty sérového hemoglobinu (méně než 10 mg/dl); zvýšená hodnota korigovaného sérového kalcia; zvýšené hodnoty laktátu dehydrogenázy v séru, špatný status výkonnosti a interval kratší než jeden rok mezi diagnózou a zahájením léčby [89]. Temsirolimus vykazoval účinnost u mRCC, i když v podskupině vysoce rizikových pacientů (tři nebo více rizikových faktorů podle kritérií MSKCC) [44]. U pacientů refrakterních na cytokiny se užití sorafenibu jako léčby druhé linie ukázalo jako schopné zdvojnásobit PFS ve srovnání s placebem [38]. I sunitinib lze považovat za léčbu druhé linie [88]. Data podporující užívání sorafenibu jako léčby první linie jsou méně přesvědčivá než data pro sunitinib, temsirolimus a bevacizumab plus IFN-α. V randomizované studii pacientů fáze II, kteří zatím nepodstoupili žádnou léčbu, nebyl žádný významnější rozdíl ve střední době PFS mezi pacienty léčenými sorafenibem a pacienty léčenými IFN-α (5,7 vs 5,6 měsíce u sorafenibu, respektive u IFN-α) [90]. Data ze studie fáze III ukázala, že pacienti, u kterých selhala léčba alespoň jedním TKI (71 % mělo sunitinib, 55 % sorafenib a 26 % obojí), zaznamenali významně delší PFS, když jim byl podáván everolimus 10 mg/kg denně namísto placeba (střední PFS: 4 měsíce vs 1,9 měsíců) [47]. Data o druhém sledovaném cíli – OS – se očekávají. Proto se everolimus nyní navrhuje pacientům, u kterých selhala léčba jedním nebo více TKI. U pacientů, kteří byli léčení bevacizumabem, se sunitinib zdá být schopen dosáhnout PR nebo stabilizaci onemocnění v určité části případů [47,60]. Proto může být sunitinib alternativou u pacientů, u kterých selhal bevacizumab. Možné schéma léčby je popsáno v kontextu různých profilů a charakteristik pacientů v tab. 3.
Tab. 3. Klinická doporučení k léčbě pacientů s metastatickým karcinomem z renálních buněk. 
V nedávné metaanalýze, která používá upravenou metodu nepřímé srovnávací analýzy, byly analyzovány všechny randomizované kontrolované klinické studie zkoumající bevacizumab, sorafenib nebo temisirolimus v léčbě mRCC [91]. Primárním cílem bylo stanovení PFS, jak je definováno jendotlivými investigátory. Rovněž byly brány v úvahu OS, střední doba trvání léčby a trvání odpovědi na léčbu a ORR. Použitím nepřímých srovnání s IFN-α jako společného srovnávacího měřítka zjistili, že sunitinib byl lepší než sorafenib i bevacizumab plus IFN-α, pokud se týká PFS. Sorafenib nebyl statisticky odlišný od bevacizumabu plus IFN-α. Při použití placeba jako podobného srovnávacího měřítka nebyla metaanalýza schopna ukázat významný rozdíl mezi sorafenibem a samotným bevacizumabem. Temsirolimus poskytl významné PFS u pacientů se špatnou prognózou [91].
ZÁVĚR
Nedávný výzkum chápání genu VHL ukázal roli angiogeneze v patofyziologii RCC a základní výzkum molekulární báze tumorogeneze RCC vedl k vývoji látek, které blokují klíčové proteiny, které se zúčastňují angiogeneze a proliferace nádoru. Proto v posledních pěti letech nastal dramatický růst možností léčby mRCC. Nedávné studie fáze III nakonec změnily terapeutické možnosti u mRCC. V léčbě první linie se sunitinib, bevacizumab plus IFN-α, temsirolimus, stejně jako vysoká dávka IL-2 ukázaly jako účinné při prodloužení PFS nebo OR v závislosti na kritériích výběru rizikové skupiny. U terapie druhé linie se ukázalo, že léčba sorafenibem pacientů s mRCC nezabírajících na cytokiny zdvojnásobuje PFS ve srovnání s placebem. Everolimus je efektivní volba pro pacienty, u nichž předcházející léčba TKI selhala. Tato nová terapeutika rovněž typicky prokazovala zlepšený nebo ekvivalentní profil snášenlivosti ve srovnání s cytokiny. Při výběru léčby pro pacienta by měly být brány v úvahu různé prognostické faktory, včetně histologického subtypu, věku, počtu a lokalizace metastatických míst a komorbidity, které mohou ovlivnit toleranci pacienta na terapii. Ačkoli výsledky uvedených studií ukázaly na konzistentní účinek nových terapeutik při měření objektivní odpovědi, celkové zmenšení nádoru a PFS a dosažení delšího přežití čekají na další zralá data. Navíc některé terapie zlepšily OS, zatímco jiné nikoli vzhledem k nedostatku účinnosti, nedostatečné statistické síle studií nebo zkřížených problémů. Navíc výsledky cíleného terapeutika by měly platit pouze pro RCC z jasných buněk, pokud není specifikováno jinak. Existují rovněž omezená data o těchto preparátech ve speciálních podskupinách, jako jsou CNS metastázy, dysfunkce orgánů nebo nejasná histologie buněk. Žádná klinická studie neporovnávala jeden preparát s druhým, a proto definitivní srovnání mezi terapeutiky ještě není možné. Navíc v současné době žádná dostupná data neukazují, že tato terapeutika vyléčí každého pacienta, ale spíše se zdá, že na určitou dobu stabilizují mRCC.
BUDOUCÍ PERSPEKTIVY
Přístupy, které mohou maximalizovat klinický prospěch nových terapeutických strategií, zahrnují racionální výběr pacienta, volbu a kombinaci režimu, identifikaci predikčních markerů odpovědí a nová schémata studií s vhodnými klinickými cíli. Účinek dávky antiangiogenních terapeutik není dosud znám a další studie se vyžadují pro potvrzení plausibilního vztahu mezi dávkou terapeutika a klinickou účinností. Mechanizmy rezistence by rovněž měly být objasněny, aby se posílila klinická aktivita antiangiogenních terapeutik. Je naléhavě nutné identifikovat prediktivní faktory pro odpověď na antiangiogennní léky. Prognostické systémy navržené v době cytokinové terapie by měly být v budoucích studiích přehodnoceny. Ačkoli některé prognostické faktory mohou být společné u imunoterapie a TKI, specifičtější faktory uplatňující se v procesu angiogeneze nádoru je nutno teprve identifikovat.
Úloha neoadjuvantní cílené terapie u pacientů s lokálně pokročilými nebo mRCC nádory není dnes dostatečně definována. Na rozdíl od imunoterapie založené na cytokinech jsou TKI schopny způsobit významné zmenšení nádoru v primárním ledvinovém nádoru [92]. V současné éře cílené molekulární terapie vyžaduje zmenšení rozměru primárního nádoru systémovou terapií k usnadnění resekce další výzkum. Několik studií nyní zkoumá neoadjuvantní použití sunitinibu, sorafenibu a bevacizumabu. Počáteční výsledky naznačují určitou redukci rozměru primárního nádoru [92].
Neexistují žádná zralá data o účinnosti antiangiogennní terapie v adjuvantním režimu. Na tuto výzvu zahájilo několik klinických studií nábor pacientů. Probíhající Studie adjuvantního sorafenibu nebo sunitinibu u nepříznivých renálních karcinomů (ASSURE), Studie sunitinibu v adjuvantní léčbě rakoviny ledvin (S-TRAC) a studie SORCE, která porovnává sorafenib s placebem u pacientů po resekci primárního RCC se středním až vysokým rizikem relapsu rozhodne otázku, zda budou TKI v následujících letech prospěšné jako adjuvantní terapie [93].
Důležitou potřebou bude identifikovat další zásadní signální dráhy u RCC a vyvinout nové léky, které vyvolají kompletní trvalé odpovědi. Dnes se zkoumají jiné cíle pro terapeutika RCC, která zahrnují HIF a terče vnitrobuněčné transdukce signálu účastnící se proliferace a přežití nádorových buněk a stimulace hypoxie. Řada slibných látek prochází klinickými testy, včetně protilátek neutralizujících VEGF, jako jsou VEGF-trap, PDGF nebo protilátky FGF a jiné inhibitory růstových faktorů. Ačkoli zbývají mnohé otázky, bude role antiangiogenních a molekulárních cílených terapií u RCC vzrůstat. Rovněž předběžné výsledky studií s nově se objevujícími TKI, jako jsou axitinibid, pazopanib a AV-951, jsou slibné, a tato terapeutika mohou být užitečná v lepší adaptaci terapií. Ačkoli jsme daleko od „vyléčení“ RCC, je naděje, že v budoucnosti budeme schopni zabezpečit těmto postiženým pacientům dlouhodobé přežití [94].
Ziya Kirkali, MD
Professor of Urology, Dokuz Eylul University School of Medicine
Department of Urology, 35340, Inciralti, Izmir, Turkey
ziya.kirkali@gmail.com
Zdroje
1. Parkin DM, Bray F, Ferlay J et al. Global cancer statistics, 2002. CA Cancer J Clin 2005; 55(2): 74–108.
2. Gleave ME, Elhilali M, Fradet Y et al. Interferon 7-lb compared with placebo in metastatic renal cell carcinoma. N Engl J Med 1998; 338 : 1265–1271.
3. Storkel S, Eble JN, Adlakha K et al. Classification of renal cell carcinoma: Workgroup no. I. Union Internationale Contre le Cancer (UICC) and the American Joint Committee on Cancer (AJCC). Cancer 1997; 80(5): 987–989.
4. Atkins MB, Regan M, McDermott D. Update on the role of interleukin 2 and other cytokines in the treatment of patients with stage IV renal carcinoma. Clin Cancer Res 2004; 10(18 Part 2): S6342—S6346.
5. Hutson TE, Figlin RA. Renal cell cancer. Cancer J 2007; 13(5): 282–286.
6. Kim WY, Kaelin WG. Molecular pathways in renal cell carcinoma — rationale for targeted treatment. Semin Oncol 2006; 33(5): 588–595.
7. Gnarra JR, Tory K, Weng Yet al. Mutations of the VHL tumor suppressor gene in renal carcinoma. Nat Genet 1994; 7(1): 85–90.
8. Blakenship C, Naglich JG, Whalet et al. Alternate choice of initiation codon procedures a biologically active product of the von Hippel Lindau gene with tumor suppressor activity. Neogene 1999; 18 : 1529–1535.
9. Kaelin WG. Molecular basis of the VHL hereditary cancer syndrome. Nat Rev Cancer 2002; 2(9): 673–682.
10. Semenza GL. HIF-1 and mechanisms of hypoxia sensing. Curr Opin Cell Biol 2001; 13(2): 167–171.
11. Jaakkola P, More DR, Tain YM et al. Targeting of HIF-α targeted to the von Hippel Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science 2001; 292 : 468–472.
12. Semenza GL. Targeting HIF-1 for cancer therapy. Nat Rev Cancer 2003; 3(10): 721–732.
13. Harris AL. Hypoxia – a key regulatory factor in tumor growth. Nat Rev Cancer 2002; 2(1): 38–47.
14. Caldwell MC, Hough C, Purer S et al. Serial analysis of gene expression in renal carcinoma cells reveals VHL-dependent sensitivity to TNF-a cytotoxicity. Oncogene 2002; 21 : 929–936.
15. Sakamato S, Ryan AJ, Kyprianu N. Targeting vasculature in Urologic tumors: mechanistic and therapeutic significance. J Cell Biochem 2008; 103(3): 691–708.
16. Folkman J. Cinical applications of research on angiogenesis. N Engl J Med 1995; 333(26): 1757–1763.
17. de Vries C, Escobedo JS, Ueno H et al. The fms-like tyrosine kinase, a receptor for vascular endothelial growth factor. Science 1992; 255(5047): 989–991.
18. Millauer B, Wizigmann-Voos S, Schnurch H et al. High affinity VEGF binding and developmental expression suggests flk-I as a major regulator of vasculogenesis and angiogenesis. Cell 1993; 72(6): 835–846.
19. Cho D, Signoretti S, Regan M et al. The role of mammalian target of rapamycin inhibitors in the treatment of advanced renal cancer. Clin Cancer Res 2007; 13 : 5758–5763.
20. Le Tourneau C, Faivre S, Raymond E. mTORC1 inhibitors: is temsirolimus in renal cancer telling us how they really work? Br J Cancer 2008; 99(8): 1197–1203.
21. Faivre S, Kraeme G, Ramond E. Current development of mTOR inhibitors as anticancer agents. Nat Rev Drug Discov 2006; 5(8): 671–688.
22. Brenner W, Farber G, Herget T et al. Loss of tumor suppressor protein PTEN during renal angiogenesis. Int J Cancer 2002; 99 : 53–57.
23. Hamada K, Sasaki T, Koni PA et al. The PTEN/ PI3K pathway governs normal vascular development and tumor angiogenesis. Genes Dev 2005; 19(17): 2054–2065.
24. Gaba M, von Breitenbuch P, Steinbauer M et al. Rapamycin inhibits primary and metastatic tumor growth by anti-angiogenesis involvement of vascular endothelial growth factor. Nat Med 2002; 8 : 128–135.
25. Arsham AM, Plas DR, Thompson CB et al. Phosphatidylinositol 3-kinase/ Akt signaling is neither required for hypoxic stabilization of HIF-1 a nor sufficient for HIF-1 dependent target gene transcription.J Biol Chem 2002; 277(17): 15162–15170.
26. Chow LQ, Eckhardt SG. Sunitinib from rational design to clinical efficacy. J Clin Oncol 2007; 25(7): 884–896.
27. Faivre S, Delbaldo, Vera K et al. Safety, pharmacokinetic and antitumor activity of SU11248, a novel oral multitarget tyrosine kinase inhibitor, in patients with cancer. J Clin Oncol 2006; 24(1), 25–35.
28. Motzer RJ, Michaelson MD, Redman BG et al. Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet derived growth factor receptor in patients with metastatic renal cell carcinoma. J Clin Oncol 2006; 24(1): 16–24.
29. Motzer RJ, Rini BI, Bukowski RM et al. Sunitinib in patients with metastatic renal cell carcinoma. JAMA 2006; 295(21): 2516–2524.
30. Motzer RJ, Mazumdar M, Bacik J et al. Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J Clin Oncol 1999; 17(8): 2530–2540. This study established a prognostic index for advanced renal cell carcinoma (RCC) in the cytokine era.
31. Motzer RJ, Michaelson MD, Rosenberg J et al. Sunitinib efficacy against advanced renal cell carcinoma. J Urol 2007; 178(5): 1883–1887.
32. Motzer RJ, Hutson TE, Tomczak P et al. Sunitinib versus interferon a in metastatic renal cell carcinoma. N Engl J Med 2007; 356(2): 115–124. This large-scale randomized Phase III trial demonstrated the clinical efficacy of sunitinib over IFN-α as front-line therapy for metastatic (m)RCC.
33. Figlin TA, Hutson TE, Tomczak P et al. Overall survival with sunitinib versus interferon (IFN) a as first line treatment of metastatic renal-cell carcinoma (mRCC). J Clin Oncol 2008; 26(Suppl.): 5256. (Abstract 5024).
34. Gore M, Szczylik C, Porta C et al. Sunitinib in metastatic renal cell carcinoma (mRCC): preliminary assessment of safety and efficacy in an expanded access trial with subpopulation analysis. Eur J Cancer 2007; 5(Suppl): 299. (Abstract 4503).
35. Wilhelm SM, Carter C, Tang L et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis. Cancer Res 2004; 64(19): 7099–7109.
36. Ratain MJ, Eisen T, Stadler WM et al. Phase II placebo controlled randomized discontinuation trial of sorafenib in patients with metastatic renal cell carcinoma. J Clin Oncol 2006; 24(16): 2505–2512.
37. Escudier B, Szcylik C, Demkov T et al. Randomized Phase II trial of the multikinase inhibitor sorafenib versus interferon (IFN) in treatment naive patients with metastatic renal cell carcinoma (mRCC). J Clin Oncol 2002; 24(Suppl. 18): 4501.
38. Escudier B, Eisen T, Stadler WM et al. TARGET Study Group: sorafenib in advanced clear cell renal carcinoma. N Engl J Med 2007; 356 : 125–134. This large-scale, placebo-controlled, randomized Phase III study demonstrated the clinical efficacy of sorafenib in the second-line setting in clear-cell mRCC.
39. Bukowski RM, Eisen T, Szcylik C et al. Final results of the randomized Phase III trial of sorafenib in advanced renal cell carcinoma: survival and biomarker analysis. J Clin Oncol 2007; 25(Suppl.): 5023.
40. Beck J, Procopio E, Verzoni S et al. Large open label non-comparative clinical experience trial of the multi-targeted kinase inhibitor sorafenib in European patients with advanced RCC. J Clin Oncol 2008; 26(Suppl). (Abstract 1621).
41. Shepard DR, Rini BI, Garcia A et al. A multicenter prospective trial of sorafenib in patients with metastatic clear cell renal cell carcinoma refractory to prior sunitinib or bevacizumab. J Clin Oncol 2008; 26(Suppl.). (Abstract 5123).
42. Szczylik C, Demkow T, Staehler M et al. Randomized Phase II trial of first line treatment with sorafenib versus IFN in patients with advanced renal cell carcinoma: final results. J Clin Oncol 2007; 25(Suppl). (Abstract 5025).
43. Atkins MB, Hidalgo M, Stadler WM et al. Randomized Phase II study of multiple dose levels of CCI-779, a novel mammalian target of rapamycin kinase inhibitor, in patients with advanced refractory renal cell carcinoma. J Clin Oncol 2004; 22(5): 909–918.
44. Hudes G, Carducci M, Tomczak P et al. Temsirolimus, interferon a or both for advanced renal cell carcinoma. N Engl J Med 2007; 356(22): 2271–2281. This Phase III randomized placebo - controlled trial demonstrated the significant improvement in overall survival for temsirolimus monotherapy in high-risk mRCC patients compared with IFN-α or as combination therapy.
45. Motzer RJ, Michaelson MD, Hutson TE. Sunitinib versus interferon-a as first line treatment of metastatic renal cell carcinoma: updated efficacy and safety results and further analysis of prognostic factors. fur. J Cancer 2007; 5(Suppl.). (Abstract 301).
46. Jac J, Giessinger S, Khan M et al. A Phase II trial of RAD001 in patients with metastatic renal cell carcinoma (mRCC). J Clin Oncol 2007; 25(Suppl.). (Abstract 5107).
47. Motzer RJ, Escudier B, Ouard S et al. Efficacy of everolimus in advanced renal cell carcinoma: a double blind, randomized, placebo-controlled Phase III trial. Lancet 372, 449-456 (2008). in tumor growth. Nat Rev Cancer 2002; 2 : 38–47.
48. Yang JC, Haworth L, Sherry RM et al. A randomized trial of bevacizumab an anti-vascular endothelial growth factor antibody for metastatic renal cancer. N Engl J Med 2003; 349(5): 427–434.
49. Escudier B, Pluzanska A, Koralewski P et al. Bevacizumab plus IFN α-2a for treatment of metastatic renal cell carcinoma: a randomised, double blind Phase III trial. Lancet 2007; 370 : 2103–2111.
50. Rini BI, Halabi S, Rosenberg JE et al. Bevacizumab plus interferon a compared with interferon a monotherapy in patients with metastatic renal cell carcinoma: CALGB. J Clin Oncol 2008; 26(33): 5422–5428. This Phase III randomized trial confirmed the addition of bevacizumab and IFN-α results in improved PFS compared with placebo and IFN-α.
51. Chouetn TK, Plantade A, Elson Petal. Efficacy of sunitinib and sorafenib in metastatic papillary and chromophobe renal cell carcinoma. J Clin Oncol 2008; 26(1): 127–131. Largest detailed retrospective series of VEGF targeted therapies of sunitinib and sorafenib in non-clear-cell mRCC.
52. Dutcher J, de Souza P, McDermott DR et al. Effect of temsirolimus versus interferon-a on survival of patients with advanced renal cell carcinoma of different tumor histologies. Med Oncol 2009; 26(2): 202–209.
53. Schrader AJ, Olbert PJ, Hegele A et al. Metastatic non-clear cell renal cell carcinoma: current therapeutic options. BJU Int 2008; 101(11): 1343–1345.
54. Mian BM, Bhadkamkar N, Slaton JW et at. Prognostic factors and survival of patients with sarcomatoid renal cell carcinoma. J Urol 2002; 167 : 65–70.
55. Beck J, Bajetta E, Escudier B et al. Large open label, non-comparative, Phase III study of the multi-targeted kinase inhibitor sorafenib in European patients with advanced renal cell carcinoma. Eur J Cancer 2007; 5(Suppl); 300. (Abstract 4506).
56. Golshayan AR, George S, Heng DY et at. Metastatic renal cell carcinoma (mRCC) patients with sarcomatoid features treated with VEGF-targeted therapy. J Clin Oncol 2008; 26(Suppl.). (Abstract 5102).
57. Whorf JD, Hainsworth DR, Spigel DA et al. Phase II study of bevacizumab and everolimus (RAD001) in the treatment of advanced renal cell carcinoma (RCC). J Clin Oncol 2008; 26(Suppl.). (Abstract 5010).
58. Hainsworth JD, Sosman JA, Spigel DR et al. Treatment of metastatic renal cell carcinoma with a combination of bevacizumab and erlotinib. J Clin Oncol 2005; 23(31): 7889–7896.
59. Bukowski RM, Kabbinavar FF, Figlin RA et al. Randomized Phase II study of erlotinib combined with bevacizumab compared with bevacizumab alone in metastatic renal cell cancer. J Clin Oncol 2007; 25(29): 4536–4541.
60. George DJ, Michaelson MD, Rosenberg JE et al. Phase II trial of sunitinib in bevacizumab refractory metastatic renal cell cancer: updated results and analysis of circulating biomarkers. J Clin Oncol 2007; 25(Suppl.). (Abstract 5035).
61. Rixe O, Bukowski RM, Michaelson MD et al. Axitinib treatment in patients with cytokine refractory metastatic renal cell cancer: a Phase II study. Lancet Oncol 2007; 8(11): 975–984.
62. Rini B, Wilding GT, Hudes G et al. Axitinib (AG-013736; AG) in patients with metastatic renal cell cancer refractory to sorafenib. J Clin Oncol 2007; 25(18S): 5032.
63. Sonpavde G, Hutson TE. Pazopanib: a novel multitargeted tyrosine kinase inhibitor. Curr Oncol Rep 2007; 9(2): 115–119.
64. Hutson TE, Davis ID, Machiels JP et al. Pazopanib (GW786034) is active in metastatic renal cell carcinoma. Interim results of a Phase II randomized discontinuation trial. J Clin Oncol 2007; 25(Suppl.): 5031.
65. Bhargava P, Esteves O, Lipatov ON et al. Activity and safety of AV-951, a potent and selective VEGFRI, 2 and 3 kinase inhibitor, in patients with renal cell carcinoma: interim results of a Phase II randomized discontinuation trial. Presented at: ASCO Genitourinary Cancers Symposium. Orlando, FL, USA. 26-28 February 2009. (Abstract 283).
66. Bellmunt J. The oncolgist's view: targeted therapies in advanced renal cell carcinoma. Eur Urol 2008; 7(Suppl. 2): 55–62.
67. Hutson TE, Figlin RA, Kuhn JG et al. Targeted therapies for metastatic renal cell carcinoma: an overview of toxicity and dosing strategies. Oncologist 2008; 13(10): 1084–1096.
68. Rini BI, Choueiri TK, Elson P et al. Sunitinib induced macrocytosis in patients with metastatic renal cell carcinoma. Cancer 2008; 113(6): 1309–1314.
69. Flanigan RC, Salmon SE, Blumenstein BA et al. Nephrectomy followed by interferon ct-2b compared with interferon ct-2b alone for metastatic renal cell cancer. N Engl J Med 2001; 345 : 1655–1659.
70. Nanus DM, Pfeffer LM, Bander NH et al. Antiproliferative and antitumor effects of a interferon in renal cell carcinomas: correlation with the expression of a kidney associated differentiation glycoprotein. Cancer Res 1990; 50(14): 4190–4194.
71. Coppin C, Porzsolt F, Awa A et al. Immunotherapy for advanced renal cell cancer. Cochrane Database Syst Rev 2005; 1: CD001425.
72. Rosenberg SA. Progress in human tumor immunology and immunotherapy. Nature 2001; 411(6835): 380–384.
73. Fehniger TA, Cooper MA, Caliguiri MA. Interleukin-2 and interleukin-15: immunotherapy for cancer. Cytokine Growth Factor Rev 2002; 13(2): 169–183.
74. Fyfe G, Fisher RI, Rosenberg SA et al. Results of treatment of 255 patients with metastatic renal cell carcinoma who received high dose recombinant interleukin therapy. J Clin Oncol 1995; 13(3): 688–696.
75. Fisher RI, Rosenberg SA, Fyfe G. Long term survival update for high dose recombinant interleukin-2 in patients with renal cell carcinoma. Cancer J Sci Am 2000; 6(Suppl. I): S55–S57.
76. McDermott DF, Regan M, Clack JI et al. Randomized Phase III trial of high dose interleukin-2 and interferon in patients with metastatic renal cell carcinoma. J Clin Oncol 2005; 23(1): 133–141.
77. Yang JC, Sherry RM, Steinberg SM et al. Randomized study of high dose and low dose interleukin-2 in patients with metastatic renal cell cancer. J Clin Oncol 2003; 21(16): 3127–3132.
78. Schmidinger M, Hejna M, Zielinski CC. Aldesleukin in advanced renal cell carcinoma. Expert Rev Anticancer Ther 2004; 4(6): 957–980.
79. Atzpodien J, Kirchner H, Jonas U et al. Interleukin-2 and interferon a-2a based immunotherapy in advanced renal cell carcinoma: a prospectively randomized trial of the German Cooperative Renal Carcinoma Chemoimmunotherapy Group (DGCIN). J Clin Oncol 2004; 22 : 1188–1194.
80. Boccardo F, Rubagotti A, Canabbia Let al. Interleukin-2, interferon-a and interleukin-2 plus interferon-a in renal cell carcinoma. A randomized Phase II trial. Tumori 1998; 84(5): 534–539.
81. Henriksson R, Nilsson S, Colleen S et al. Survival in renal cell carcinoma: a randomized evaluation of tamoxifen vs interleukin-2, a-interferon and tamoxifen. Br J Cancer 1998; 77 : 1311–1317.
82. Negrier S, Escudier B, Lasser C et al. Recombinant human interleukin-2, recombinant human interferon a-2a, or both in metastatic renal cell carcinoma. Grouppe Francois d'Immunotherapie. N Engl J Med 1998; 338 : 1272–1278.
83. Klatte T, de Martino M, Shuch B et al. Long term outcome of interleukin-2 based immunotherapy for the treatment of metastatic renal cell carcinoma. J Clin Oncol 2008; 26(Suppl.). (Abstract 5119).
84. Bui MH, Seligson D, Han KR et al. Carbonic anhyrase IX is an independent predictor of survival in advanced renal cell carcinoma: implications for prognosis and therapy. Clin Cancer Res 2003; 9(2): 802–811.
85. Atkins M, Regan M, McDermott D et al. Carbonic anhydrase IX expression predicts outcome of interleukin-2 therapy for renal cancer. Clin Cancer Res 2005; 11(10): 3714–3721.
86. Eisenhauer EA, Therasse P, Bogaerts J et al. New response evaluation criteria in solid tumors: revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45(2): 228–247.
87. Figlin RA, Hutson TE, Tomczak P et al. Overall survival with sunitinib versus interferon (IFN)-α as first line treatment of metastatic renal cell carcinoma (mRC.C). J Clin Oncol 2008; 26(Suppl.). (Abstract 5024).
88. Ljunberg B, Hanbury DC, Kuczyk MA et al. Renal cell carcinoma guideline. Eur Urol 2007; 51(6): 1502–1510.
89. Motzer RJ, Bacik J, Murphy BA et al. Interferon a as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J Clin Oncol 2002; 20(1): 289–296.
90. Szczylik C, Demkov T, Staehler M et al. Randomized Phase II trial of first line treatment with sorafenib versus interferon in patients with advanced renal cell carcinoma: final results. J Clin Oncol 2007; 25(Suppl.). (Abstract 5025).
91. Mills EJ, Rachlis B, O'Regan C et al. Metastatic renal cell cancer treatments: an indirect men-analysis. BMC Cancer 2009; 9 : 34–42. This meta-analysis demonstrated the superior efficacy of sunitinib over sorafenib and bevacizuntab plus IFN-α, in terms of PFS in clear-cell mRCC, using an indirect comparison methodology.
92. Thomas AA, Rini BI, Lane BR et al. Response of the primary tumor to neoadjuvant sunitinib in patients with advanced renal cell carcinoma. J Urol 2009; 181(2): 518–523.
93. Jonasch E, Tannic N. Adjuvant and neoadjuvant therapy in renal cell carcinoma. Cancer J 2008; 14(5): 315–319.
94. Kirkali Z. Editorial Comment on: prognostic value of renal vein and inferior vena cava involvement in renal cell carcinoma. Eur Urol 2009; 55(2): 460.
Website 101. National Comprehensive Cancer Network: NCCN clinical practice guidelines in oncology: kidney cancer v.1.2008 (2008) www.nccn.org/professionals/physician_gls/PDF/kidney.pdf
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2010 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Nádorové markery u renálního karcinomu: pomoc při diagnostice, prognóze, léčbě a sledování
- Standardizovaná anatomická klasifikace malých nádorů ledvin
- Léčba nádorů ledvin
- Ablační terapie při léčbě malých renálních tumorů: jak daleko se nalézá tato léčebná modalita od standardní péče?
- Nové trendy v systémové léčbě karcinomu ledviny
- Význam bisfosfonátů u karcinomu ledviny: bezpečnost a tolerance
- Úvodní slovo
- Ultrazvukové vyšetření skrota: principy a praktické využití
- Karcinom ledviny: nové přístu py při vyšetřování a léčbě
- Ze zahraničních periodik
- Co na publikované články říká profesor Patrik C. Walsh?
- GUIDELINES EAU PRO LÉČBU KARCINOMU Z RENÁLNÍCH BUNĚK
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ultrazvukové vyšetření skrota: principy a praktické využití
- Léčba nádorů ledvin
- Nádorové markery u renálního karcinomu: pomoc při diagnostice, prognóze, léčbě a sledování
- Standardizovaná anatomická klasifikace malých nádorů ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




