-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Ablační terapie při léčbě malých renálních tumorů: jak daleko se nalézá tato léčebná modalita od standardní péče?
Ablative therapies in the treatment of small renal tumors: how far from standard of care?
Ablative therapies in the treatment of small renal tumors:
how far from standard of care?Objectives:
To determine the current clinical value of minimally invasive thermoablative techniques (MI thermoablative T) to ablate small renal tumors through a literature review.Methods:
A literature search was conducted on the most commonly used MI thermoablative T for small renal tumors, namely cryoablation (CA) and radiofrequency ablation (RFA). Primary objective was to carry out a comparative assessment of the complication rate, recurrence rate and cancer specific survival rates across techniques. Secondary objective was to critically review technical aspects of the procedures.Results:
Five year follow up data were available only for laparoscopic CA, with a recurrence rate varying from 0 to 15 %. Follow up of percutaneous CA and RFA did not go beyond 2 years and excellent recurrence free rates were obtained at the price of a significant retreatment rate. The need for retreatment was perceived as lower with percutaneous CA than with RFA. Overall complication rate did not exceed 5 % in all techniques albeit laparoscopic CA carried a significant degree of invasiveness as compared with other percutaneous techniques.Conclusions:
MI thermoablative T for small renal tumors should still be confined to carefully selected patients. PCA seems to hold the premises for the best compromise between low invasiveness and high efficacy, while RFA appears highly advantageous in terms of procedural costs.Key words:
cryoablation, radiofrequency ablation, laparoscopic, percutaneous, renal tumors
Autoři: P. Gontero
Působiště autorů: Urologia 1 Molinette Hospital ; University of Torino
Vyšlo v časopise: Urol List 2010; 8(2): 24-32
Souhrn
Cíle:
Posoudit klinický význam minimálně invazivních termoablačních technik (MI termoablačních T) při ablaci malých renálních tumorů na základě hodnocení příslušné literatury.Metody:
Autoři vyhledali údaje týkající se nejčastěji užívaných MI termoablačních technik při léčbě malých renálních tumorů, jmenovitě kryoablace (CA) a radiofrekvenční ablace (RFA). Primární cíl spočíval ve srovnání míry výskytu komplikací, recidivy a přežití specifického pro karcinom při jednotlivých technikách. Sekundárním cílem bylo kritické hodnocení technických aspektů jednotlivých přístupů.Výsledky:
Údaje po pěti letech sledování byly k dispozici pouze u pacientů podstupujících laparoskopickou CA, kdy se míra recidivy pohybovala v rozmezí 0–15 %. Pacienti podstupující perkutánní CA a RFA byli v době sběru dat sledováni po dobu maximálně dvou let. V tomto případě bylo vynikající míry přežití bez recidivy dosaženo za cenu vysoké míry opakované léčby. Procento opakované léčby bylo nižší u pacientů podstupujících perkutánní CA než RFA. Celková míra výskytu komplikací nepřevyšovala u žádného z přístupů 5 %, ačkoli laparoskopická CA byla na rozdíl od ostatních perkutánních technik spojena s jistým stupněm invazivity.Závěr:
MI termoablační T pro léčbu malých renálních tumorů se stále doporučuje indikovat pouze u pečlivě vybrané populace pacientů. PCA je pravděpodobně nejlepším kompromisem mezi nízkou invazivitou a vysokou účinností, zatímco RFA je cenově nejvýhodnější.Klíčová slova:
kryoablace, radiofrekvenční ablace, laparoskopický, perkutánní, tumor ledvinyÚVOD
Význam minimálně invazivních termoablačních technik (MI termoablačních T) při ablaci tumorů ledviny se stále rozšiřuje. Objev skutečnosti, že zachování nefronů je zá-sadní nejenom u starší populace, ale rovněž u mladších pacientů, způsobil v uplynulých letech rozšíření role parciální resekce ledviny při léčbě karcinomu ledviny (oproti celkovému odstranění ledviny). Zjištění, že nefrony šetřící operace dosahuje srovnatelné kontroly karcinomu, podnítilo vývoj dalších méně invazivních technik umožňujících snížení míry výskytu komplikací.
Ačkoli je indikace těchto technik omezena pouze na pečlivě zvolenou populaci pacientů, u nichž je v důsledku přítomnosti komorbidit anestezie vysoce riziková, zdokonalování technologie spolu se slibnými onkologickými výsledky a výsledky týkajícími se morbidity nasvědčují tomu, že indikaci MI termoablačních technik bude možné rozšířit o mladší pacienty v celkově lepším zdravotním stavu. V rámci složitého procesu volby optimální léčby malých renálních karcinomů představuje laparoskopie nepochybně významný krok kupředu. Někteří autoři se ovšem domnívají, že technická náročnost laparoskopické operace může mít negativní dopad na osvědčenou techniku parciální resekce ledviny [1]. MI termoablační techniky by tedy mohly zaplnit mezeru mezi minimálně invazivními technikami na jedné straně a nefrony šetřící operací na straně druhé.
Vzhledem k tomu, že je zřejmé, jakým směrem se budoucnost léčby malých renálních tumorů ubírá, je nezbytné praktické urology informovat o v současné době dostupných MI termoablačních technikách, výsledcích této léčby a její potenciální roli u vybrané populace pacientů.
Tento přehled si klade za cíl poskytnout nejnovější informace o v současné době dostupných MI termoablačních technikách pro ablaci malých renálních lézí – kryoterapii a radiofrekvenční ablaci – a vytyčit jejich roli v kontextu dalších modalit pro léčbu malých renálních tumorů.
MATERIÁL A METODY
Autoři vyhledali údaje týkající se nejčastěji užívaných MI termoablačních technik při léčbě malých renálních tumorů, jmenovitě kryoablace (CA) a radiofrekvenční ablace (RFA). Primární cíl spočíval ve srovnání míry výskytu komplikací, recidivy a přežití specifického pro karcinom při jednotlivých technikách. Sekundárním cílem bylo kritické hodnocení technických aspektů jednotlivých přístupů.
Po zadání jakýchkoli kombinací hesla „minimálně invazivní technika a renální tumor“ do databáze PubMed získali autoři 144 článků na dané téma. Po zadání hesel „kryoablace a renální tumory“ vygenerovala databáze celkem 290 článků a po zadání „radiofrekvence a renální tumory“ 360 článků. Po vyhledání těchto kombinovaných hesel autoři dále zadávali následující samostatná klíčová slova: „technika“, „komplikace“, „recidiva“ a „délka přežití“.
Vygenerované články autoři dále rozdělili na základě klasifikace podle úrovně důkazů, jak je uvádí Oxford Centre for Evidence-based Medicine [2]. Vzhledem k tomu, že databáze nevygenerovala žádnou randomizovanou studii, upřednostnili autoři nerandomizované prospektivní komparativní studie. Nutná kritéria splňovalo celkem 8 přehledových článků a 63 originálních studií. Vyloučena byla všechna abstrakta publikovaná v dodatcích lékařských časopisů. Při hodnocení údajů týkajících se účinnosti léčby upřednostnili autoři vždy studie s delší dobou sledování. Hodnocení výskytu komplikací vycházelo z velkých komparativních studií uvádějících absolutní počet nežádoucích účinků u alespoň dvou různých technik.
VÝSLEDKY
Kryoterapie
Základní principy poškození zmrazením
Kryoterapie způsobuje nezvratné poškození tkáně dvojím způsobem – vedle okamžitého působení má rovněž opožděný efekt. Okamžité poškození vzniká přímo v důsledku působení ledu na tkáň, které vzniká v extracelulárním prostoru, zvyšuje osmolaritu, kdy v důsledku přesunu tekutiny z buněk do mimobuněčného prostoru dochází k poškození buňky. Extracelulární krystaly mohou navíc mechanicky poškozovat buněčnou membránu, a způsobovat tak vznik intracelulárních krystalů [3].
K dalšímu poškození tkáně dochází několik hodin až dní po kryoablaci pod obrazem koagulační nekrózy. Nejvýznamnější opožděný účinek spočívá pravděpodobně v ischemickém poškození tkáně, k němuž dochází v důsledku poranění endoteliálních buněk v akutní fázi s následným vznikem masivní trombózy ve vaskulárním lůžku [4]. V nedávné době byl identifikován další opožděný mechanizmus poškození tkáně v podobě apoptózy [5]. Daleko zajímavějším zjištěním je skutečnost, že antigeny uvolněné poškozenou tkání mohou senzitizovat imunitní systém hostitele a působit imunomodulačně [6].
Pokusy na zvířecím modelu odhalily, že během fáze tání (která nastupuje po procesu zmrazení) vzniká daleko rozsáhlejší oblast nekrózy než při technice využívající pouze mrazicí fázi [7]. Technika kryoablace tedy v současné době sestává ze dvou cyklů – fáze zmrazení a fáze tání [8,9].
Kryoablace normálního parenchymu ledviny na zvířecím modelu vyžadovala zmrazení na teplotu < -19,4 °C [10,11], tato teplota však nebyla u tumorů ledviny dostatečná. Při kryoablačním protokolu se tedy užívá zmrazení na teplotu -40 °C, čehož docílíme díky rozšíření „ice-ball“ jeden centimetr za okraj tumoru (teplota uvnitř „ice-ball“ dosahuje téměř 40 °C).
První pokusy byly znesnadněny zaváděním poměrně velkých kryosond (6,8 mm). Nové technologie na bázi argonu však umožnily vyvinout ultratenké sondy se stejnou účinností (1,47 mm). Argonové sondy rovněž umožňují zastavit růst „ice-ball“ okamžitě po zastavení mrazicího procesu. Při užívání starších sond na bázi tekutého dusíku se „ice-ball“ zvětšovala i po ukončení mrazicího cyklu, což významně omezovalo precizní provedení výkonu [12]. V současné době máme k dispozici několik druhů kryosond, které umožňují volbu izotermické oblasti (-20 °C nebo -40 °C) na základě velikosti tumoru [13].
Nejdůležitější technické aspekty
1. Laparoskopický nebo perkutánní přístup: klady a zápory
Ačkoli se kryoablace zpočátku prováděla pomocí otevřeného přístupu [14], většina operatérů přešla v současnosti k lapa-roskopické kryoablaci (LCA) [8,9,15,16]. LCA je jistě invazivnější než perkutánní kryoablace (PCA), kterou lze provádět v celkové anestezii pod MRI navigací [17], nebo v sedaci pod CT navigací v reálném čase [18].
Výhoda LCA spočívá v přesné lokalizaci tumoru a monitorování růstu „ice-ball“ prostřednictvím přímé zrakové kontroly a navigovatelné ultrazvukové sondy (US). Na US se „ice-ball“ jeví jako hyperechogenní oblast s akustickým stínem, což umožňuje přesnou navigaci „ice-ball“ 1 cm za okraj tumoru, a tedy úplnou nekrózu léze [15]. Zobrazovací vyšetření v reálném čase, které se užívá při PCA, má jistá omezení. US je levnější, ale na druhou stranu nabízí omezenou vizualizaci okrajů „ice-ball“ a špatné rozlišení u obézních pacientů, což v současnosti limituje jeho indikaci [10]. Magnetická rezonance (MR) nabízí vynikající vizualizaci lézí s jasným rozlišením „ice-ball“. Na druhou stranu však vyžaduje celkovou anestezii a nákladný MR-kompatibilní kryosystém [17,19]. Nejlepší kompromis představuje v současnosti pravděpodobně CT skiaskopie. Toto vyšetření lze provádět v sedaci a umož-ňuje kvalitně zobrazit (v reálném čase) zavádění sondy a progresi „ice-ball“ [18]. Vzhledem k tomu, že okraje oblasti s nízkou hustotou odpovídají při zobrazení pomocí CT 0 °C izotermě, abychom dosáhli spolehlivé nekrózy, musí mít „ice-ball“ významně větší rozměry než tumor. Další potenciální nevýhodou PCA je riziko poškození kolon u anteriorně lokalizovaných tumorů. V tomto případě je účinným řešením vytvoření tzv. „salinomu“ pomocí injekční aplikace fyziologického roztoku, pomocí něhož kolon mobilizujeme [12,20].
Nezbytným předpokladem pro interpretaci onkologického výsledku výkonu je provedení biopsie renální léze před kryoablací. Bez potvrzení tumoru pomocí histologického vyšetření je jakékoli srovnávání účinnosti MI termoablačních T a běžné operační ablace nespravedlivé. V pří-padě, že je značné procento renálních lézí klasifikovaných pomocí zobrazovacího vyšetření jako neoplazie ve skutečnosti benigních, může být účinnost MI termoablačních T zbytečně přeceňována. Ve studiích testujících účinnost LCA se běžně odebírá alespoň jeden vzorek biopsie vzhledem k tomu, že případné krvácení lze kontrolovat pomocí přímé zrakové kontroly [9,16]. Ve studiích testujících účinnost PCA se však obvykle biopsie z obavy z další morbidity neprovádí [21]. Jeden z výzkumných týmů však před PCA zcela běžně indikuje biopsii s odebráním tří vzorků, které jsou okamžitě vyšetřeny cytopatologem přítomným na operačním sále [18]. Jednou z výhod PCA oproti LCA je možnost opakování výkonu v případě, že nedojde k dostatečné ablaci renální léze během prvního pokusu [21].
2. Počet zaváděných sond
Většina autorů doporučuje (jak u LCA, tak u PCA přístupu) zavedení jedné nebo více sond dle potřeby tak, aby „ice-ball“ zasahovala 1 cm přes okraj tumoru. Průměrný počet sond na jeden tumor se pohybuje mezi 2–3 (v různých studiích) [8,9,17]. Bachmann et al [22] popisují techniku LCA se dvěma cykly mrazení/tání, kdy běžně zavádějí šest ultratenkých kryosond (1,5 mm, 17-G) po obvodu tumoru. Autoři se domnívají, že tento přístup umožňuje dokonalejší a preciznější navigaci „ice-ball“ při současné minimalizaci rizika krvácení a ruptury ledviny během odstraňování sondy. Střednědobé výsledky jsou velmi povzbudivé, s nulovým výskytem lokální recidivy při průměrné době sledování 21 měsíců [16].
3. Omezení kladená lokalizací a velikostí tumoru
Centrálně lokalizovaný tumor v blízkosti vývodného systému není kontraindikací pro CA [12]. „Ice-ball“ zasahující až 5 mm do vývodného systému nezpůsobuje vznik urinomu [23], což je jednou z výhod CA oproti tepelně ablačním technikám při léčbě centrálně lokalizovaných tumorů. Průměrná velikost tumoru zaznamenaná v LCA studiích byla < 3,5 cm. Studie testující PCA uvádějí, že ablace tumorů o velikosti < 2,5 cm bylo úspěšně dosaženo při jediném výkonu, léze o velikosti > 4 cm vyžadovaly více opakování [21]. Za horní hranici pro bezpečnou a účinnou CA se v současnosti považuje tumor o veli-kosti 3 cm. Centrálně lokalizovaný tumor o velikosti ≥ 4 cm lze považovat za relativní kontraindikaci [24].
Monitorování pomocí zobrazovacího vyšetření
Renální tumory reagující na léčbu pomocí MI termoablačních technik jsou obvykle spojeny (po parciální resekci ledviny nebo radikální nefrektomii) s nízkým rizikem recidivy či progrese systémového onemocnění. Nejnovější doporučení radí při běžném sledování pacientů CT nahradit scan ultrazvukovým vyšetřením [25]. Při sledování pacientů po MI termoablačním výkonu je však CT vyšetření s užitím kontrastní látky nutné, v lepším případě dokonce MRI s aplikací gadolinia. Po CA se doporučuje provádět tyto techniky v krátkých intervalech. Onkologicky úspěšný výkon je definován na základě absence, tzn. „enhancement“. V některých případech může být po jednom až třech měsících viditelný okraj „enhancement“ kolem kryoléze. Okraj postupně vymizí, není tedy znakem přetrvávajícího onemocnění [9,26]. Samotná léze nevymizí okamžitě po výkonu, ale postupně se zmenšuje. Teprve po 48 měsících dojde k vymizení 95 % léze [27]. Lékaři z Cleveland Clinic a San Rafaele Hospital doporučují po LCA následující monitorovací protokol: MRI první den po výkonu a následně jednou za 3, 6, 12, 18 a 24 měsíců [8,15]. 6 měsíců po výkonu doporučují odebrání CT biopsie v místě kryoléze. K recidivě došlo u 0/56 [8] a 2/39 [9] pacientů s karcinomem ledviny. Oba případy recidivy zaznamenané v druhé studii byly rozpoznány pomocí MRI s aplikací kontrastní látky [9], rutinní provádění biopsie v rámci monitoringu není tedy pravděpodobně nutné.
Bezpečnost a výskyt komplikací
Dopad na vývodný systém a renální funkci
Experimentální údaje potvrzují, že po CA ledviny obvykle nedochází k úniku moči. Výsledky studie ukazují, že u pacientů, u nichž došlo k poškození vývodného systému, se poranění zhojilo, aniž by došlo ke vzniku močové píštěle (jak je tomu po radiofrekvenční ablaci) [28–30].
Žádná z velkých studií neuvádí do-konce ani u pacientů se solitární ledvinou, kteří podstoupili LCA, významné změny v pooperační hladině kreatininu v séru [9]. Tento nález pomáhá vyloučit významné narušení renální funkce po CA.
Komplikace
Tab. 1 uvádí srovnání míry výskytu komplikací v nejreprezentativnějších studiích testujících účinnost CA a RF. Míra výskytu závažných i méně závažných komplikací po LCA i PCA byla pozoruhodně nízká, srovnatelná s RFA.
Tab. 1. Srovnání míry výskytu komplikací v několika reprezentativních studiích zaměřených na léčbu tumoru ledvin pomocí ablačních technik. Výskyt komplikací je vyjádřen v absolutních číslech, kdy jmenovatel představuje celkový počet pacientů v dané studii. 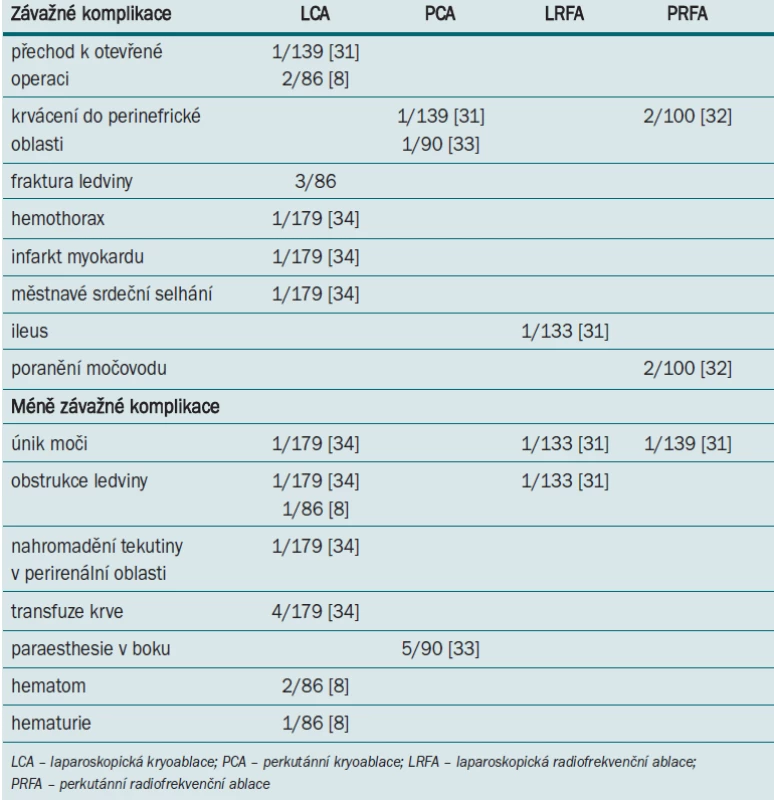
Onkologické výsledky
Tab. 2 uvádí přehled onkologických vý-sledků LCA v nejvýznamnějších studiích (tři studie mají k dispozici údaje pětiletého sledování). Shingleton a Sewell [19] publikovali největší studii týkající se PCA léčby, která zahrnovala 103 pacientů. Při výkonu autoři užívali MR navigaci, pacienti byli sledováni průměrně po dobu 35 měsíců. Jak je zřejmé z tab. 2, stále čekáme na vý-sledky pětiletého sledování pacientů po PCA.
Tab. 2. Srovnání onkologických výsledků v nejreprezentativnějších studiích zaměřených na léčbu tumoru ledvin pomocí ablačních technik. 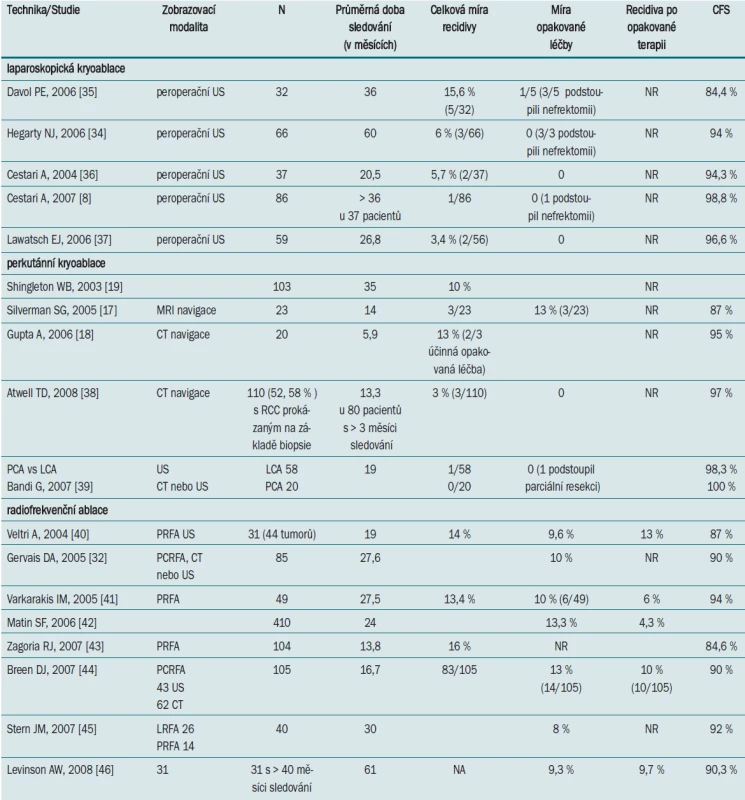
Radiofrekvenční ablace
Základní principy radiofrekvenční tepelné ablace
Při termální ablaci dochází prostřednictvím působení vysokých teplot na patologickou tkáň k poškození tumoru. Vysoká teplota způsobuje denaturaci proteinů, narušení buněčné membrány a v konečné fázi koagulační nekrózu a buněčnou smrt. Čím vyšší je teplota v cílové tkáni, tím kratší je doba nezbytná pro ablaci. Při teplotách > 50 °C trvá výše popsaný proces přibližně 4–6 min, při teplotě 60 °C se výsle-dek dostaví prakticky okamžitě. Teploty > 105 °C způsobují vypařování, vznik plynu a zuhelnatění tkáně, a mohou tedy zamezit účinnému provedení ablace [47].
Při radiofrekvenční ablaci (RFA) dochází k přeměně elektrického napětí o vysoké frekvenci (375–480 KHz) na tepelnou energii prostřednictvím pohybu iontů v tkáních obklopujících hrot elektrody. Sonda vedoucí RF energii generuje v okolních tkáních teploty až > 100 °C. Nejvyšší teploty je dosaženo pouze několik mili-metrů od hrotu aplikátoru, konvekční ohřev dále zvětšuje oblast koagulační nekrózy.
Tepelná ablace má (podobně jako tomu je u kryoablace) rovněž opožděný účinek. Při zvýšení teploty nad 60 °C dochází následkem mikrovaskulárního buněčného otoku k vaskulárnímu poškození, intravaskulární trombóze a přilnutí neutrofilů k venulárnímu endotelu. To vede k poklesu mikrovaskulární perfuze (během RFA) a přerušení vaskulárního zásobení (po RFA). Progrese poranění okrajových cév po RFA může dále podporovat procesy nekrózy tkáně [48]. Při RFA byly rovněž popsány případy imunologické modulace. Při experimentální RFA na králičím modelu byla zaznamenána sekundární aktivace T-lymfocytů (specifických pro karcinom) vedoucí k sekundární nádorové imunitě [49].
Celkový objem ablace tkáně mohou omezovat následující faktory:
- zuhelnatění tkáně zvyšující elektrický odpor: tato překážka se řeší zvětšením plochy elektrody a prováděním „mokré“ RFA (s aplikací fyziologického roztoku do tkáně ke zvýšení elektrické vodivosti) [50] raději než „suché“ RFA
- vaskulární lůžko obklopující tumor funguje jako tepelný rezervoár, čímž u centrálně lokalizovaných tumorů zmenšuje velikost zóny, v níž dochází k ablaci (na rozdíl od exofytických lézí, které jsou obaleny avaskulární tukovou tkání) [51]
Tyto systémy teoreticky umožňují vznik nekrózy kulovitého tvaru o průměru až 3 cm. Při léčbě tumorů o větší velikosti lze přemístěním aplikátoru provést několik navzájem se překrývajících ablací, lze však očekávat, že spolu s technologickým pokrokem bude brzy možné provádět koagulaci o větším průměru [52]. Moderní generátory užívané při radiofrekvenci by měly mít výkon alespoň 200 W, aby umožňovaly provedení ablace „o vysoké energii“ [53].
Elektrody se vyrábí ve velikostech 15 G, délka aktivního hrotu sondy se pohybuje v rozmezí 1–3 cm. Některé systémy jsou vybaveny několika hroty, jiné mají rovnou špičku na aktivním konci sondy. Jednotlivé přístroje se mohou lišit způsobem přenosu energie (na bázi teploty nebo na bázi odporu). Ke snížení teploty ve hrotu sondy lze užít chladicí systém, čímž předejdeme zuhelnění tkáně a umožníme ablaci větší oblasti.
Nejdůležitější technické aspekty
Nejvhodnějším přístupem je perkutánní RFA (PRFA)
Renální RFA lze provádět pomocí otevřené laparoskopické (LRFA) nebo perkutánní (PRFA) techniky. Výhoda LRFA spočívá v možnosti izolovat tumor, a zabránit tak poranění okolních orgánů. PRFA, stejně jako PCA, je skutečně minimálně invazivní přístup, který se provádí pouze v sedaci. Na rozdíl od LCA neposkytuje intraoperační US během RFA přesné vymezení oblasti koagulační nekrózy. Nejčastěji užívaným přístupem je v současné době PRFA [52].
Biopsie prováděná před výkonem je často nedostatečně zdokumentována
Nedostatečné zaznamenání biopsie limituje význam onkologického výsledku. Skutečný význam biopsie malých lézí, u nichž na základě zobrazovacího vyšetření očekáváme přítomnost RCC, je však rozporuplný. Přesnost výsledku biopsie se snižuje spolu se zmenšující se velikostí renální léze. V několika studiích, v nichž bylo zaznamenáno předoperační provedení biopsie, byl výsledek „nereprezentativní“ až v 30 % případů. Tento výsledek svědčí o nízké úrovni patologické definice lézí podrobených ablaci. Heilbrun et al [54] v nedávné době uvedli, že předoperační biopsie nemá při posuzování maligní povahy léze žádný další význam (pakliže předoperační zobrazovací vyšetření pro-káže přítomnost charakteristických maligních znaků).
Navigace pomocí zobrazovacího vyšetření a monitorování procesu ablace
Užívání US se vedle ostatních navigačních modalit pro RFA (CT a MRI) jeví jako nejméně vhodné, protože vzduchové bubliny vznikající při odpařování (zobrazující se jako hyperechogenní oblasti) významně narušují kvalitu zobrazení [52]. Bez aplikace kontrastní látky CT neumožňuje detekovat změny v renální lézi podrobené ablaci: koagulační nekróza neukazuje (na rozdíl do tumoru) signál „enhancement“ [55]. Vzhledem k tomu, že látka se vstřebává až několik hodin, lze ji bohužel aplikovat během výkonu pouze jedinkrát, což znemožňuje okamžitou detekci reziduálních tumorů a opakovaní ablačního cyklu v rámci jediného výkonu. Jako nejvhodnější zobrazovací modalita se jeví MRI, která umožňuje on-line monitorování ablačního procesu. Tkáň podrobená ablaci se zobrazí jako hypointenzivní (tmavší) oblast, reziduální tumor lze detekovat podle přetrvávajícího izointenzivního či hyperintenzivního (světlejšího) signálu. Při navigaci RFA pomocí MRI byla zaznamenána 92–100% míra kompletní ablace během jediného výkonu [56].
Omezení kladená lokalizací a velikostí tumoru
Podobně jako tomu je u CA, velikost a lokalizace tumoru jsou významnými predikátory výsledku RFA ablace. U tumorů o velikosti < 3 cm lze téměř ve všech případech kompletní ablace dosáhnout během jediného cyklu. U tumorů o velikosti 3–5 cm klesá pravděpodobnost kompletní ablace během jediné procedury na 50 % a u tumorů o velikosti > 5 cm dokonce na 25 %. Při PRFA je možné jednotlivé cykly v rámci jediného výkonu opakovat. To samé platí při léčbě centrálně lokalizovaných tumorů, kdy je míra kompletní ablace v důsledku efektu „tepelného rezervoáru“ mnohem nižší [32]. Léčba centrálně lokalizovaných tumorů je obtížnější i při parciální resekci ledviny.
Nedostatečné zasažení všech nádorových buněk
Dvě menší studie uvádějí, že RFA prováděná pomocí standardního vybavení a ablačního protokolu přímo před nefrektomií neumožňuje kompletní likvidaci léze. NADH barvení prokázalo přítomnost karcinomatózních buněk u 50–100 % případů [57–58]. Klingler et al [59] v současné době zaznamenali neúplnou ablaci u 4/17 (14 %) pacientů, kteří podstoupili LRFA před LPN. Autoři uvádějí, že k selhání RFA může dojít i při užívání moderního vyba-vení, což limituje indikaci MI termoablačních technik na populaci pacientů s vysokým rizikem. Je třeba však vzít v úvahu skutečnost, že v těchto studiích byl tumor resekován okamžitě po RFA, což znamená, že se v tomto případě neuplatnil opožděný účinek RFA. Anderson et al [60] prokázali, že správné načasování NADH barvení (s cílem detekce karcinomatózní tkáně) má obrovský význam. Během prvních 150 min po RFA není možné pomocí NADH barvení přesně posoudit živatoschopnost tkání. Abychom předešli falešně pozitivním výsledkům, je vhodné testování zahájit později.
Monitoring s užitím zobrazovacího vyšetření a definice recidivy/ přetrvávajícího onemocnění
U pacientů podstupujících RFA se z důvodu detekce případné recidivy doporučuje provádět kontrolní vyšetření nejprve v pravidelných intervalech, později s delšími intervaly. Ve velké multicentrické studii byla tři měsíce po výkonu nekompletní ablace zaznamenána u 70 % pacientů a v průběhu dalšího roku u 92 % pacientů [42]. Většina studií má následující monitorovací program: v průběhu prvního roku zobrazovací vyšetření (CT nebo MRI) každé tři měsíce, v průběhu druhého roku jednou za půl roku [52]. Jakákoli oblast, která se na CT jeví jako kontrastní „enhancement“ v zóně ablace, se obvykle považuje za reziduální tumor. Při MRI není nutná aplikace jodové kontrastní látky, která může u některých jedinců vyvolat život ohrožující nefropatii. Oblast koagulační nekrózy lze rozpoznat podle hypointenzivního T2w a hyperintenzivního T1w obrazu. MRI s aplikací gadolinia umožňuje spolehlivější definici koagulační oblasti [61], avšak za cenu potenciálního rizika nefrotoxicity. Pacienti s narušenou renální funkcí mají vyšší riziko vzniku nefrogenní systémové fibrózy – jedná se o vzácně se vyskytující stav, pro nějž je charakteristický vznik pojivové tkáně v ledvině i ostatních orgánech [62]. Během prvních dvou týdnů se oblast koagulační nekrózy zvětšuje, během dalšího sledování dochází k postupné involuci [63].
Bezpečnost a komplikace
Jednou z potenciálních komplikací RFA je tepelné poškození okolní zdravé tkáně. Při LRFA i PRFA byly zaznamenány ojedinělé případy poškození močovodu [31–64]. Pravděpodobně nejzávažnější komplikací, k níž může dojít během PRFA, je tepelné poranění střeva [65]. Někteří autoři doporučují oddělit struktury citlivé na aplikaci tepla pomocí paranefrické infuze elektricky inertní tekutiny (5% roztok glukózy, glycin) [66]. Dále může dojít k podráždění lumbálního plexu nebo genitofemorálního nervu vyvolávajícímu bolestivost a znecitlivění kůže v oblasti třísla, která může přetrvat i několik měsíců [52]. Tab. 1 uvádí srovnání komplikací po RFA a kryoterapii v nejvýznamnějších studiích.
Onkologické výsledky
Tab. 2 uvádí přehled onkologických výsledků po RFA tumoru ledviny, jak je uvádějí nejvýznamnější studie. Průměrná délka sledování pacientů po RFA ve studiích, které máme v současné době k dispozici, obvykle nepřesahuje 2–3 roky. Tento časový úsek nám neumožňuje vyvodit definitivní závěry s ohledem na onkologickou účinnost této léčebné modality, ani srovnání RFA s nefrony šetřící operací. Nejnovější publikace však uvádí výsledky RFA po minimálně 40 měsících sledování (střední doba sledování 61 měsíců), které jsou srovnatelné s výsledky kryoablace [46]. 95% míry účinnosti je dosaženo za cenu opakování léčby během prvního roku u 10 % pacientů [32,42]. Nutnost opakování léčby však v zásadě nepředstavuje významnou nevýhodu vzhledem k tomu, že opakovanou RFA lze snadno provádět v lokální anestezii nebo sedaci. 80% míru přežití lze považovat za příznivý výsledek i v rámci krátké doby sledování vzhledem k tomu, že se jedná o populaci pacientů se závažnými komorbiditami. Stern [45] publikoval malou studii srovnávající otevřenou nebo laparoskopickou parciální resekci ledviny (37 pacientů) s perkutánní nebo laparoskopickou RFA (40 pacientů). Celková míra přežití bez recidivy byla 95,8 % v případě parciální resekce ledviny a 93,4 % v případě RFA. Vzhledem k malému počtu pacientů zařazených do studie však nelze vyvodit žádné definitivní závěry.
Diskuze
Onkologické výsledky LCA jsou srovna-telné s výsledky dosaženými při LPN (laparoskopické parciální resekci ledviny) – minimálně invazivní technice, která umožňuje kompletní resekci tumoru. Tento přístup je technicky náročný a je spojen (dokonce i v centrech specializujících se na tento typ výkonu) s vyšší mírou výskytu komplikací. Desai et al [67] zaznamenali v nerandomizované studii srovnávající LCA (89 pacientů) a LPN (153 pacientů) jeden případ recidivy po LPN a dva případy po PCA. Celková míra výskytu komplikací byla 30 % po LPN vs pouze 6 % po LCA. Tab. 2 uvádí přehled nejvýznamnějších studií, které se zabývají renální kryoablací, včetně pětiletého sledování. Z onkologického hlediska zůstává PCA (vzhledem ke krátké době sledování) nadále experimentální terapií. Poměrně vysokou míru recidivy může vyvážit možnost léčbu opakovat [18].
Doposud nebyla vyřešena otázka, zda ostrůvky tkáně tumoru, jež prokáže histologické vyšetření po RFA, zůstanou životaschopné i v pozdějším stadiu. Doposud neexistuje žádný důkaz, který by prokazoval, že v případě, kdy nejsou zlikvidovány všechny buňky karcinomu, musí automaticky dojít k dalšímu růstu léze. Opakovaná léčba po selhání RFA je nutná přibližně u 14 % pacientů [42]. Bez MRI navigace se výkon provádí bez přímé vizualizace koagulační zóny, což znemožňuje kompletní ablaci tumoru. Na základě velikosti izo-termy je indikován příslušný počet ablačních cyklů. Míra výskytu závažných komplikací při MRI je nízká, maximálně 2–4 %. V současné době by měla být RFA indikována pouze u vhodně zvolené populace pacientů, kteří nejsou vhodnými kandidáty pro běžnou operaci. Ve studii zahrnující 16 pacientů se solitární ledvinou a renálním tumorem o velikosti < 4 cm byla zaznamenána 88% míra účinnosti (střední doba sledování 30,7 měsíců). Renální funkce zůstala zachována [68].
CA a RFA jsou zdaleka nejčastěji zkoumanými MI termoablačními technikami pro léčbu malých renálních tumorů. Je tedy třeba se pokusit zodpovědět tyto dvě zásadní otázky:
1. Splňují MI termoablační techniky všechna kritéria platná pro standardní metody léčby malých renálních tumorů?
Kladná odpověď by znamenala, že MI termoablační techniky dosahují srovnatelných onkologických výsledků jako parciální resekce ledviny, kterou lze považovat za ověřenou metodu léčby, která dosahuje vynikajících dlouhodobých výsledků [69].
U pacientů podstupujících LCA máme v současné době k dispozici údaje pětiletého sledování. Všechna data pocházejí ze tří poměrně malých studií, z nichž všechny uvádějí téměř 100% CSS. Znepokojujícím výsledkem je však 0–15% výskyt recidivy, který zpochybňuje základní princip léčby renálních lézí v nízkém stadiu – tj. téměř 100% účinnost léčby dosažená jediným výkonem (CFS). LCA je do jisté míry invazivní výkon, který nelze snadno opakovat.
Co se týče výsledků PCA, tato modalita dosahuje vynikající CSS. Doba sledování však v těchto studiích nepřesahuje dva roky. Pouze jediná studie testující účinnost RFA uvádí údaje po pěti letech sledování: 100% CSS a doba přežití bez metastáz, ovšem pouze 79,9% přežití bez recidivy.
Krátkodobého přežití bez recidivy (i v nejlepším případě < 5 %) je obvykle dosaženo za cenu opakování léčby (až ve 30 % případů). Opakování výkonu je ovšem obvykle snadno proveditelné a výskyt komplikací nižší než při LCA.
Celkovou míru CFS u MI termoablačních technik je nutné přehodnotit v kontextu s málo častým rutinním prováděním předoperační biopsie a absence dostatečně reprezentativních patologických vzorků. Vzhledem k tomu, že 30 % malých renálních lézí je ve skutečnosti benigních, je třeba do „skutečné“ CFS započítat pouze tumory prokázané na základě biopsie.
Po zvážení všech těchto skutečností je vhodné CA i RFA v současné době indikovat pouze u dobře vybrané populace pacientů, u nichž je běžná radikální nefrektomie nebo parciální resekce ledviny spojena s přílišným rizikem. MI termoablační techniky jsou vhodnou alternativou rovněž u pacientů vyžadujících z důvodu anatomického umístění lézí provedení nefrony šetřící operace, kdy je běžná operace spojena s vyšším rizikem výskytu komplikací, nebo u pacientů, u nichž očekáváme, že bude nutné výkon opakovat (bilaterální tumory, VHL onemocnění atd.). Střednědobé výsledky u VHL pacientů prokazují vysokou míru úplné odpovědi (definováno jako absence zvýraznění na CT) po RFA [70–71] i CA [21].
2. Pakliže považujeme za fakt, že indikace MI termoablačních technik pro léčbu malých renálních tumorů je omezena pouze na pečlivě zvolenou populaci pacientů, kterou z výše popsaných technik v současné době upřednostnit?
Z pacientova hlediska by měla volba konkrétní techniky představovat kompromis mezi následujícími třemi aspekty: účinností, snášenlivostí a stupněm invazivity. Jako potenciální nevýhoda RFA se v současnosti jeví nízká definice progrese termoablačního procesu při užití všech dostupných zobrazovacích technik (s výjimkou MRI). Během CA lze progresi „ice-ball“ spolehlivě monitorovat pomocí intraoperační US (při LCA) nebo CT (při PCA). Další nevýhodou RFA může být nedostatečné zasažení všech nádorových buněk tumoru. Oba aspekty mohou mít teoreticky negativní dopad na výsledek výkonu.
Vzhledem k absenci jakýchkoli randomizovaných kontrolovaných studií je nutné velmi opatrně interpretovat vyšší míru recidivy spojenou s RFA (oproti CA). Navíc většina CA výkonů byla prováděna laparoskopicky, kdy je nutné potenciální benefit v podobě účinné ablace uvážit v kontextu s relativní invazivitou výkonu. Obě ablační terapie jsou spojeny s pozoruhodně nízkou mírou výskytu komplikací, kdy perkutánní výkony (tj. RFA) mají o něco příznivější profil výskytu nepříznivých příhod. Retrospektivní srovnání perkutánních MI termoablačních technik ukázalo, že PRFA vyžaduje více analgezie než PCA [72].
Zatím se zdá, že kompromis mezi nízkým stupněm invazivity a vysokou účinností splňuje nejlépe PCA. V dalších komparativních studiích je nutné prokázat, zda je MI termoablační techniky možné zahrnout rovněž mezi standardní metody léčby malých renálních tumorů. Ideální termoablační technika by měla splňovat následující podmínky: výkon v lokální anestezii a kompletní ablace tumoru během jediné procedury a při nízké morbiditě.
Paolo Gontero, MD
Lecturer and Consultant Urologist University of Torino
Urologia 1 Molinette Hospital
C.so Dogliotti 14, Torino, Italy
paolo.gontero@unito.it
Zdroje
1. Perrotti M, Badger WJ, McLeod D et al. Does laparoscopy beget underuse of partial nephrectomy for T(1) renal masses? Competing treatment decision pathways may influence utilization. J Endourol 2007; 21(10): 1223–1128.
2. Phillips B, Ball C, Sackett D et al. Levels of evidence and grades of recommendation. Oxford Centre for Evidence based Medicine. Downloaded at http://www. cebm.net/levels_of_evidence.asp.
3. Acker JP, Larese A, Yang H et al. Intracellular ice formation is affected by cell interactions. Cryobiology 1999; 38(4): 363–371.
4. Hoffmann NE, Bischof JC. The cryobiology of cryosurgical injury. Urology 2002; 60 (2 Suppl 1): 40–49.
5. Baust JG, Gage AA. The molecular basis of cryosurgery. BJU Int 2005; 95(9): 1187–1191.
6. Mouraviev V, Joniau S, Van Poppel H et al. Current status of minimally invasive ablative techniques in the treatment of small renal tumors. Eur Urol 2007; 51(2): 328–336.
7. Woolley ML, Schulsinger DA, Durand DB et al. Effect of freezing parameters (freeze cycle and thaw process) on tissue destruction following renal cryoablation. J Endourol 2002; 16(7): 519–522.
8. Cestari A, Guazzoni G, Buffi NM et al. Laparoscopic Cryoablation of Small Renal Masses: Technique and Results after 6-Year Experience. Eur Urol Suppl 2007; 6 : 646–652.
9. Gill IS, Remer EM, Hasan WA et al. Renal cryoablation: outcome at 3 years. J Urol 2005; 173(6): 1903–1907.
10. Chosy SG, Nakada SY, Lee FT Jr et al. Monitoring renal cryosurgery: predictors of tissue necrosis in swine. J Urol 1998; 159(4): 1370–1374.
11. Campbell SC, Krishnamurthi V, Chow G et al. Renal cryosurgery: experimental evaluation of treatment parameters. Urology 1998; 52(1):29-33.
12. Permpongkosol S, Nielsen ME, Solomon SB. Percutaneous renal cryoablation. Urology 2006; 68(1 Suppl): 19–25.
13. Deane LA, Clayman RV. Review of minimally invasive renal therapies: Needle-based and extracorporeal. Urology 2006; 68(1 Suppl): 26–37.
14. Schwartz BF, Rewcastle JC, Powell T et al. Cryoablation of small peripheral renal masses: a retrospective analysis. Urology 2006; 68(1 Suppl): 14–18.
15. Stein RJ, Kaouk JH. Renal cryotherapy: a detailed review including a 5-year follow-up. BJU Int 2007; 99(5 Pt B): 1265–1270.
16. Wyler SF, Sulser T, Ruszat R et al. Intermediate-term results of retroperitoneoscopy-assisted cryotherapy for small renal tumors using multiple ultrathin cryoprobes. Eur Urol 2007; 51(4): 971–979.
17. Silverman SG, Tuncali K, vanSonnenberg E et al. Renal tumors: MR imaging-guided percutaneous cryotherapy--initial experience in 23 patients. Radiology 2005; 236(2): 716–724.
18. Gupta A, Allaf ME, Kavoussi LR et al. Computerized tomography guided percutaneous renal cryoablation with the patient under conscious sedation: initial clinical experience. J Urol 2006; 175(2): 447–452.
19. Shingleton WB, Sewell PE Jr. Cryoablation of renal tumors in patients with solitary kidneys. BJU Int 2003; 92(3): 237–239.
20. Milner J, Borge M, Sharma S et al. Percutaneous CT guided saline mobilization of colon to facilitate renal cryoablation of small renal tumors. J Urol 2005; 173 (Suppl): 320. Abst 1181.
21. Shingleton WB, Sewell PE Jr. Percutaneous renal cryoablation of renal tumors in patients with von Hippel-Lindau disease. J Urol 2002; 167(3): 1268–1270.
22. Bachmann A, Sulser T, Jayet C et al. Retroperitoneoscopy-assisted cryoablation of renal tumors using multiple 1.5 mm ultrathin cryoprobes: a preliminary report. Eur Urol 2005; 47(4): 474–479.
23. Warlick CA, Lima GC, Allaf ME et al. Clinical sequelae of radiographic iceball involvement of collecting system during computed tomography-guided percutaneous renal tumor cryoablation. Urology 2006; 67(5): 918–922.
24. Aron M, Gill IS. Minimally invasive nephron-sparing surgery (MINSS) for renal tumors part I: laparoscopic partial nephrectomy. Eur Urol 2007; 51(2): 337–346.
25. Ljungberg B, Alamdari FI, Rasmuson T et al. Follow-up guidelines for nonmetastatic renal cell carcinoma based on the occurrence of metastases after radical nephrectomy. BJU Int 1999; 84(4): 405–411.
26. Stein AJ, Mayes JM, Mouraviev V et al. Persistent contrast enhancement several months after laparoscopic cryoablation of the small renal mass may not indicate recurrent tumor. J Endourol 2008; 22(11): 2433–2439.
27. Hasan W, Gill IS, Spaliviero M et al. Renal cryoablation: 4-year follow-up. J Urol 2004; 171 : 438, Abs 1657.
28. Sung GT, Gill IS, Hsu TH et al. Effect of intentional cryo-injury to the renal collecting system. J Urol 2003; 170(2 Pt 1): 619–622.
29. Janzen NK, Perry KT, Han KR et al. The effects of intentional cryoablation and radio frequency ablation of renal tissue involving the collecting system in a porcine model. J Urol 2005; 173(4): 1368–1374.
30. Brashears JH 3rd, Raj GV, Crisci A et al. Renal cryoablation and radio frequency ablation: an evaluation of worst case scenarios in a porcine model. J Urol 2005; 173(6): 2160–2165.
31. Johnson DB, Solomon SB, Su LM et al. Defining the complications of cryoablation and radio frequency ablation of small renal tumors: a multi-institutional review. J Urol 2004; 172(3): 874–877.
32. Gervais DA, McGovern FJ, Arellano RS et al. Radiofrequency ablation of renal cell carcinoma: part 1, Indications, results, and role in patient management over a 6-year period and ablation of 100 tumors. AJR Am J Roentgenol 2005; 185(1): 64–71.
33. Shingleton WB, Sewell PE Jr. Percutaneous renal tumor cryoablation with magnetic resonance imaging guidance. J Urol 2001; 165(3): 773–776.
34. Hegarty NJ, Kaouk JH, Remer EM et al. Laparoscopic renal cryoablation: oncological outcomes at 5 years. J Endourol 2006; 20 (Suppl 1): A12.
35. Davol PE, Fulmer BR, Rukstalis DB. Long-term results of cryoablation for renal cancer and complex renal masses. Urology 2006; 68(1 Suppl): 2–6.
36. Cestari A, Guazzoni G, dell'Acqua V et al. Laparoscopic cryoablation of solid renal masses: intermediate term followup. J Urol 2004; 172(4 Pt 1): 1267–1270.
37. Lawatsch EJ, Langenstroer P, Byrd GF et al. Intermediate results of laparoscopic cryoablation in 59 patients at the Medical College of Wisconsin. J Urol 2006; 175(4): 1225–1229.
38. Atwell TD, Farrell MA, Leibovich BC et al. Percutaneous renal cryoablation: experience treating 115 tumors. J Urol 2008; 179(6): 2136–2140.
39. Bandi G, Wen CC, Hedican SP et al. Cryoablation of small renal masses: assessment of the outcome at one institution. BJU Int 2007; 100(4): 798–801.
40. Veltri A, De Fazio G, Malfitana V et al. Percutaneous US-guided RF thermal ablation for malignant renal tumors: preliminary results in 13 patients. Eur Radiol 2004; 14(12): 2303–2310.
41. Varkarakis IM, Allaf ME, Inagaki T et al. Percutaneous radio frequency ablation of renal masses: results at a 2-year mean followup. J Urol 2005; 174(2): 456–460.
42. Matin SF, Ahrar K, Cadeddu JA et al. Residual and recurrent disease following renal energy ablative therapy: a multi-institutional study. J Urol 2006; 176(5): 1973–1977.
43. Zagoria RJ, Traver MA, Werle DM et al. Oncologic efficacy of CT-guided percutaneous radiofrequency ablation of renal cell carcinomas. AJR Am J Roentgenol 2007; 189(2): 429–436.
44. Breen DJ, Rutherford EE, Stedman B et al. Management of Renal Tumors by Image-Guided Radiofrequency Ablation: Experience in 105 Tumors. Cardiovasc Intervent Radiol 2007; 30(5): 936–942.
45. Stern JM, Svatek R, Park S et al. Intermediate comparison of partial nephrectomy and radiofrequency ablation for clinical T1a renal tumors. BJU Int 2007; 100(2): 287–290.
46. Levinson AW, Su LM, Agarwal D et al. Long-term oncological and overall outcomes of percutaneous radio frequency ablation in high risk surgical patients with a solitary small renal mass. J Urol 2008; 180(2): 499–504.
47. Goldberg SN, Gazelle GS, Mueller PR. Thermal ablation therapy for focal malignancy: a unified approach to underlying principles, techniques, and diagnostic imaging guidance. AJR Am J Roentgenol 2000; 174(2): 323–331.
48. Ni Y, Mulier S, Miao Y et al. A review of the general aspects of radiofrequency ablation. Abdom Imaging 2005; 30(4): 381–400.
49. Wissniowski TT, Hänsler J, Neureiter D et al. Activation of tumor-specific T lymphocytes by radio-frequency ablation of the VX2 hepatoma in rabbits. Cancer Res 2003; 63(19): 6496–6500.
50. Hoey MF, Mulier PM, Leveillee RJ et al. Transurethral prostate ablation with saline electrode allows controlled production of larger lesions than conventional methods. J Endourol 1997; 11(4): 279–284.
51. Zagoria RJ, Hawkins AD, Clark PE et al. Percutaneous CT-guided radiofrequency ablation of renal neoplasms: factors influencing success. AJR Am J Roentgenol 2004;183(1): 201-207.
52. Boss A, Clasen S, Kuczyk M et al. Image-guided radiofrequency ablation of renal cell carcinoma. Eur Radiol 2007; 17(3): 725–733.
53. McAchran SE, Lesani OA, Resnick MI. Radiofrequency ablation of renal tumors: past, present, and future. Urology 2005; 66(5 Suppl): 15–22.
54. Heilbrun ME, Zagoria RJ, Garvin AJ et al. CT-guided biopsy for the diagnosis of renal tumors before treatment with percutaneous ablation. AJR Am J Roentgenol 2007; 188(6): 1500–1505.
55. Crowley JD, Shelton J, Iverson AJ et al. Laparoscopic and computed tomography-guided percutaneous radiofrequency ablation of renal tissue: acute and chronic effects in an animal model. Urology 2001; 57(5): 976–980.
56. Boss A, Clasen S, Kuczyk M et al. Radiofrequency ablation of renal cell carcinomas using MR imaging: initial results. Rofo 2005; 177(8): 1139–1145.
57. Bastide C, Garcia S, Anfossi E et al. Histologic evaluation of radiofrequency ablation in renal cancer. Eur J Surg Oncol 2006; 32(9): 980–983.
58. Brausi M, Castagnetti G, Gavioli M et al. Radiofrequency (RF) ablation of renal tumors does not produce complete tumor destruction: results of a phase II study. Eur Urol suppl 2004; 3 : 14–17.
59. Klingler HC, Marberger M, Mauermann J et al. 'Skipping' is still a problem with radiofrequency ablation of small renal tumors. BJU Int 2007;99(5): 1998–1001.
60. Anderson JK, Baker M, Jaffers O et al. Time course of nicotinamide adenine dinucleotide diaphorase staining after renal radiofrequency ablation influences viability assessment. J Endourol 2007; 21(2): 223–227.
61. Boss A, Martirosian P, Schraml C et al. Morphological, contrast-enhanced and spin labeling perfusion imaging for monitoring of relapse after RF ablation of renal cell carcinomas. Eur Radiol 2006; 16(6): 1226–1236.
62. Hasebroock KM, Serkova NJ. Toxicity of MRI and CT contrast agents. Expert Opin Drug Metab Toxicol 2009; 5(4): 403–416.
63. Lewin JS, Nour SG, Connell CF et al. Phase II clinical trial of interactive MR imaging-guided interstitial radiofrequency thermal ablation of primary kidney tumors: initial experience. Radiology 2004; 232(3): 835–845.
64. Traver MA, Werle DM, Clark PE et al. Oncological efficacy and factors influencing the success of CT-guided percutaneous radiofrequency ablation (RFA) on renal neoplasms. J Urol 2006; 175 (Suppl): 360.
65. Weizer AZ, Raj GV, O'Connell M et al. Complications after percutaneous radiofrequency ablation of renal tumors. Urology 2005; 66(6): 1176–1180.
66. Kam AW, Littrup PJ, Walther MM et al. Thermal protection during percutaneous thermal ablation of renal cell carcinoma. J Vasc Interv Radiol 2004; 15(7): 753–758.
67. Desai MM, Aron M, Gill IS. Laparoscopic partial nephrectomy versus laparoscopic cryoablation for the small renal tumor. Urology 2005; 66(5 Suppl): 23–28.
68. Raman JD, Thomas J, Lucas SM et al. Radiofrequency ablation for T1a tumors in a solitary kidney: promising intermediate oncologic and renal function outcomes. Can J Urol 2008; 15(2): 3980–3985.
69. Carini M, Minervini A, Masieri L et al. Simple enucleation for the treatment of PT1a renal cell carcinoma: our 20-year experience. Eur Urol 2006; 50(6): 1263–1268; discussion 1269–1271.
70. Hwang JJ, Walther MM, Pautler SE et al. Radio frequency ablation of small renal tumors: intermediate results. J Urol 2004; 171(5): 1814–1818.
71. Pavlovich CP, Walther MM, Choyke PL et al. Percutaneous radio frequency ablation of small renal tumors: initial results. J Urol 2002; 167(1): 10–15.
72. Allaf ME, Varkarakis IM, Bhayani SB et al. Pain control requirements for percutaneous ablation of renal tumors: cryoablation versus radiofrequency ablation--initial observations. Radiology 2005; 237(1): 366–370.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2010 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Nádorové markery u renálního karcinomu: pomoc při diagnostice, prognóze, léčbě a sledování
- Standardizovaná anatomická klasifikace malých nádorů ledvin
- Léčba nádorů ledvin
- Ablační terapie při léčbě malých renálních tumorů: jak daleko se nalézá tato léčebná modalita od standardní péče?
- Nové trendy v systémové léčbě karcinomu ledviny
- Význam bisfosfonátů u karcinomu ledviny: bezpečnost a tolerance
- Úvodní slovo
- Ultrazvukové vyšetření skrota: principy a praktické využití
- Karcinom ledviny: nové přístu py při vyšetřování a léčbě
- Ze zahraničních periodik
- Co na publikované články říká profesor Patrik C. Walsh?
- GUIDELINES EAU PRO LÉČBU KARCINOMU Z RENÁLNÍCH BUNĚK
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ultrazvukové vyšetření skrota: principy a praktické využití
- Léčba nádorů ledvin
- Nádorové markery u renálního karcinomu: pomoc při diagnostice, prognóze, léčbě a sledování
- Standardizovaná anatomická klasifikace malých nádorů ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



