-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam bisfosfonátů u karcinomu ledviny: bezpečnost a tolerance
Autoři: L. Welsh; V. Khoo
Působiště autorů: London, UK ; Royal Marsden NHS Foundation Trust
Vyšlo v časopise: Urol List 2010; 8(2): 49-57
Karcinom z renálních buněk (RCC) je ne zcela běžným maligním onemocněním, jehož incidence se neustále zvyšuje. V současné době tvoří RCC ve Velké Británii přibližně 3 % všech karcinomů [1]. V lokalizovaném stadiu lze RCC vyléčit, přibližně u 25–30 % karcinomů jsou však v době diagnózy přítomny metastázy [2]. Ke vzniku metastáz dojde rovněž u 10–40 % pacientů, kteří podstoupí nefrektomii pro léčbu lokalizovaného onemocnění [3–4]. V minulosti neměl pacient s metastazujícím RCC (mRCC) příliš nadějné vyhlídky: se střední dobou přežití 10–12 měsíců a dobou přežití 5 let < 10 % [5]. Nejnovější cílené terapie nabízejí pacientům s mRCC prodloužení doby přežití [6–9]. V důsledku toho se zvyšuje počet pacientů, kteří žijí s mRCC, a prodlužuje se období, kdy u těchto pacientů může dojít vlivem metastáz ke vzniku komplikací. Při léčbě mRCC lze využít bisfosfonáty. Autoři tohoto článku hodnotí opodstatnění terapie pomocí bisfosfonátů, dostupné údaje týkající se bezpečnosti a tolerance tohoto druhu léčby, současná doporučení pro jeho aplikaci a stručný přehled dalšího vývoje.
OPODSTATNĚNÍ
Přibližně u jedné třetiny pacientů s mRCC dojde ke vzniku kostních metastáz [10–11], které jsou v mnoha případech osteolytické (65 %) a jsou spojeny s vysokým rizikem vzniku SREs (komplikací souvisejících se skeletem), jako jsou například bolest, patologické zlomeniny a komprese míchy [11]. SREs tedy mohou významně narušovat kvalitu života pacienta (QoL) a snižovat délku přežití [12].
Existují důkazy první úrovně, které prokazují, že aplikace bisfosfonátů vede u pacientů s karcinomem prsu, mnohočetným myelomem a karcinomem prostaty k poklesu výskytu SREs vyvolaných metastázami do skeletu [13–16]. Hodnocení aplikace bisfosfonátů při léčbě metastazujícího karcinomu prsu v Cochranově databázi prokázalo 7% snížení rizika vzniku SRE (relativní riziko (RR) = 0,83, 95 % CI 0,78–0,89, p < 0,00001) [14]. Podobný účinek byl zaznamenán rovněž u pacientů s mnohočetným myelomem [16] a v menší (ačkoli stále signifikantní) míře u pacientů s karcinomem prostaty [15]. Není tedy neopodstatněné očekávat podobný efekt při léčbě pacientů s mRCC.
MECHANIZMUS ÚČINKU BISFOSFONÁTŮ
K SREs dochází v důsledku nefyziologické resorpce mineralizované kostní tkáně osteoklasty vlivem metastazujících buněk tumoru. Buňky tumoru uvolňují stimu-lační faktory, např. peptid související s parathormonem (PTHrP), který působí na osteoklasty prostřednictvím prekurzorů osteoblastů upregulací RANKL signální dráhy a downregulací osteoprotegerinu [17]. Buňky tumoru jsou schopny aktivovat osteoklasty a podporovat resorpci kostní tkáně, přičemž dochází k uvolnění růstových faktorů, např. transformujícího růstového faktoru-β (TGF-β), které na-opak podporují růst tumoru a mohou působit chemotakticky na karcinomatózní buňky a podporovat ukládání cirkulu-jících buněk tumoru do kostních metastáz [17].
Bisfosfonáty jsou syntetické analogy endogenního pyrofosfátu, které nepodléhají hydrolýze a inhibují resorpci kostní tkáně osteoklasty [18]. Namísto P-O-P centrální struktury, kterou najdeme u pyrofosfátu, mají bisfosfonáty strukturu P-C-P se dvěma postranními řetězci R1 a R2, které jsou připojeny k centrálnímu atomu uhlíku [18–19]. Struktura P-C-P umožňuje bisfosfonátům vázat dvojmocné ionty kovů jako například Ca2+, Mg2+ a Fe2+. V případě, že je postranním řetězcem R1 hydroxylová skupina, váže se Ca2+ ještě účinněji. Díky afinitě P-C-P struktury bisfosfonátů na Ca2+ jsou tyto agens cíleny na matrix kostních minerálů prostřednictvím interakce s krystaly hydroxyapatitu na povrchu kostních minerálů. Bisfosfonáty jsou cíleny primárně do oblastí aktivní remodelace skeletu, kde dochází k resorpci osteoklastů. Bisfosfonáty, jejichž postranní řetězec R2 obsahuje aminoskupinu, jako např. pamidronát, ibandronát, zoledronát a minodronát, inhibují kostní resorpci s 10 000násob-nou intenzitou než bisfosfonáty neobsahující aminoskupinu (např. klodronát a etidronát) [18].
Bisfosfonáty je možné aplikovat orálně, jejich biologická dostupnost je však velmi nízká – 1–2 % [19]. Při orální aplikaci může trvat celé týdny, než dávka dosáhne adekvátní hladiny nezbytné pro inhibici resorpce kostní tkáně (při významném pro-resorpčním stimulu osteolytických metastáz) [18–19]. Při léčbě kostních metastáz tedy bývá upřednostňována intravenózní aplikace, kdy se přibližně polovina dávky zachytí ve skeletu, kde je následně využita osteoklasty při kostní resorpci. Zbývající část je vyloučena ledvinami a není metabolizována [19]. Po absorpci preparátu osteoklasty narušují bisfosfonáty řadu intracelulárních procesů, které vedou k apoptóze. Detailní mechanizmus účinku bisfosfonátů na osteoklasty není znám, pro podrobnější informace je čtenář odkázán na studii Roelofse et al [20].
DŮKAZY ÚČINKU BISFOSFONÁTŮ U RCC: RANDOMIZOVANÁ STUDIE
První randomizovanou studii III. fáze, která prokázala benefit terapie bisfosfonáty u pacientů s kostními metastázami v důsledku solidních tumorů (jiných než jsou karcinom prsu a karcinom prostaty), publikovali Rosen et al [21]. Jedná se o multicentrickou, dvojitě zaslepenou, randomizovanou, placebem kontrolovanou studii, která testovala účinek zoledronátu u 773 pacientů, z nichž 74 jedinců (9,6 %) mělo mRCC. Pacienti byli randomizováni k aplikaci zoledronátu (4 nebo 8 mg), nebo placeba jednou za tři týdny po dobu devíti měsíců při současně probíhající léčbě karcinomu (imunoterapie nebo hormonální terapie u pacientů s mRCC). Primárním výsledkem byl podíl pacientů s alespoň jednou příhodou SRE (definováno jako fraktura, komprese míchy, radioterapie skeletu, operační výkon na skeletu). Sekundární výsledky zahrnovaly dobu do první příhody SRE, procento skeletální morbidity (počet SREs/rok) a výsledky analýzy podle Andersen-Gilla.
Výsledky studie
Během studie byly provedeny dvě úpravy protokolu: doba infuze zoledronátu byla prodloužena z 5 na 15 min a dávka 8 mg zoledronátu byla snížena na 4 mg – obě modifikace proběhly v důsledku obav týkajících se renální bezpečnosti [21]. Dále se budeme zabývat pouze výsledky skupiny pacientů užívajících 4 mg zoledronátu vzhledem k tomu, že vyšší dávkování se v současné klinické praxi nedoporučuje. Studie uvádí nesignifikantní pokles SRE u pacientů užívajících 4 mg zoledronátu oproti placebu (38 % vs 44 %, p = 0,127). Aplikace zoledronátu však vedla k signifikantnímu prodloužení střední doby do prvního výskytu SRE – ze 163 dní u placeba na 230 dní (p = 0,023) a 27% poklesu rizika vzniku mnohačetných SRE (HR = 0,732, p = 0,017).
Další retrospektivní analýza podskupiny 74 pacientů s mRCC odhalila, že aplikace bisfosfonátů vedla ve srovnání s placebem k signifikantnímu snížení procenta pacientů s alespoň jednou příhodou SRE (74 % vs 37 %, p = 0,015) [22–23]. Výsledky této analýzy jsou uvedeny v tab. 1.
Tab. 1. Výsledky léčby pomocí zoledronátu (vs placebo) po 9 a 21 měsících u pacientů s RCC a metastázami do skeletu. 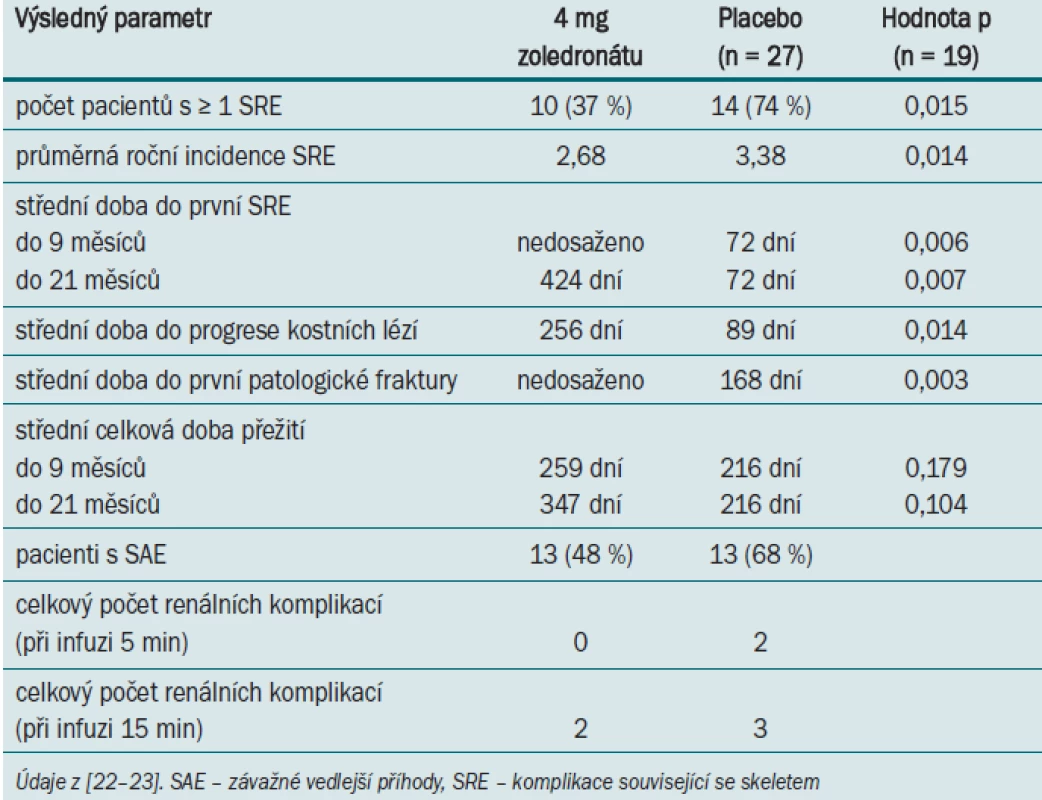
Mezi nejčastější SREs patřilo ozařování skeletu a vznik patologických fraktur. Ačkoli studie neměla dostatečnou statistickou sílu pro detekci rozdílů v celkové době přežití, byla u pacientů užívajících zoledronát pozorována tendence delší doby přežití: střední doba 295 dní ve srovnání se střední dobou 216 dní u pacientů užívajících placebo (p = 0,179). Zajímavým zjištěním je skutečnost, že ve studii zahrnující pouze placebo podskupinu pacientů došlo k výskytu alespoň jedné SRE u téměř dvojnásobného počtu jedinců s mRCC (74 %) než v hlavní studii (44 %), což odpovídá vysoké incidenci osteolytických metastáz u pacientů s mRCC (ve srovnání s ostatními druhy solidních tumorů) [11]. Toto zjištění tedy nasvědčuje tomu, že mRCC pacienti s kostními metastázami mají vyšší riziko vzniku komplikací souvisejících se skeletem. Analýza podskupiny pacientů potvrzuje benefit aplikace bisfosfonátů u této populace. U pacientů užívajících zoledronát byly zaznamenány rovněž další klinicky relevantní účinky – částečná odpověď u 7 % případů mRCC (0 % placebo) a stabilizace onemocnění skeletu u 41 % případů (14 % placebo).
Výskyt vedlejších účinků
Aplikace zoledronátu byla obecně dobře snášena všemi pacienty (včetně pacientů s mRCC) [21–23]. Nejčastější příhody (všech stupňů) u pacientů s mRCC zahrnují:
- bolest ve skeletu (52 %)
- nevolnost (52 %)
- zvracení (33 %)
- únava (33 %)
- pyrexie (30 %)
- anorexie (26 %)
- anémie (26 %)
Ve větvi zahrnující pacienty užívající zoledronát byla zaznamenána 48% míra výskytu vedlejších účinků (vs 68 % v placebo skupině). Komplikace ovlivňující funkci ledvin byly monitorovány před i po úpravě délky trvání infuze z 5 na 15 min. Při obou nastaveních protokolu byl počet pacientů, u nichž došlo k výskytu těchto komplikací (hyperurikemie a nespecifikovanému selhání ledviny), v obou intervalech aplikace infuze srovnatelný (tab. 1).
DALŠÍ STUDIE ZABÝVAJÍCÍ SE APLIKACÍ BISFOSFONÁTŮ U PACIENTŮ S MRCC
Prospektivní, otevřená, multicentrická studie v nedávné době hodnotila vliv aplikace zoledronátu (ve formě 12 infuzí) na bolest a spotřebu analgetik u 604 pacientů s kostními metastázami, u 20 (3,3 %) z nichž byl přítomen mRCC [24]. Studie prokázala významné zlepšení průměrného skóre bolesti na vizuální analogové škále a pokles průměrného skóre spotřeby analgetik (p < 0,0001 v obou případech).
Mezi jednotlivými typy karcinomů nebyl zaznamenán žádný rozdíl s ohledem na výsledek léčby ani výskyt vedlejších účinků. U 101 (16,7 %) pacientů byl zaznamenán výskyt následujících komplikací:
- pyrexie (5,1 %)
- bolest ve skeletu (2,8 %)
- nevolnost (2,2 %)
- hypokalcemie (2,2 %)
- bolest hlavy (1,2 %)
- třes (1,2 %)
- únava (1 %)
- zvýšení hladiny kreatininu v séru (1 %, započteny byly pouze případy, u nichž byla příčina přisuzována aplikaci zoledronátu)
ZAHÁJENÍ A DÉLKA TRVÁNÍ TERAPIE BISFOSFONÁTY PŘI LÉČBĚ KOSTNÍCH METASTÁZ
Údaje, které máme v současné době k dispozici, pocházejí z období cytokinové terapie, neexistují tedy žádné klinické studie, které by se zabývaly vhodným načasováním a optimální dobou pro zahájení léčby bisfosfonáty u pacientů s metastázami postihujícími skelet. Panel mezinárodních odborníků doporučuje aplikaci bisfosfonátů zahájit okamžitě po diagnostikování kostních metastáz i v případě, že jsou tyto asymptomatické [25]. Klinické údaje prokazují, že pacienti s alespoň jednou příhodou SRE mají signifikantně vyšší riziko, že u nich dojde k další příhodě SRE. Tato skutečnost byla pozorována u různých typů solidních tumorů [12,21,26–27]. Časné zahájení léčby pomocí bisfosfonátů může být nejlepší strategií pro zlepšení výsledků u této populace pacientů. V případě karcinomu prostaty bylo zjištěno, že pokles rizika SRE je nejvýznamnější u pacientů, kteří netrpí bolestivostí, což podporuje teorii neodkládat terapii až po objevení symptomů [12,25].
Rovněž existuje pouze omezené množství údajů týkajících se optimální délky trvání terapie u pacientů s kostními metastázami. Údaje randomizované studie Rosena et al prokazují benefit po 21 měsících terapie [21] se srovnatelným účinkem u populace pacientů s mRCC [23,26]. Srovnatelný benefit (při minimálním trvání terapie 2 roky) byl zaznamenán u pacientů s karcinomem prostaty, prsu i mnohočetným myelomem [28,31]. Panel odborníků doporučuje v léčbě (za předpokladu absence kontraindikací) pokračovat alespoň po dobu dvou let s individuálním hodnocením rizika u jednotlivých pacientů [25]. V aplikaci bisfosfonátů se doporučuje pokračovat i navzdory výskytu SREs vzhledem k tomu, že dvě randomizované placebem kontrolované studie prokázaly, že u pacientů podstupujících tuto terapii došlo k významnému poklesu incidence dalších příhod SREs [27,30].
VEDLEJŠÍ ÚČINKY A BEZPEČNOSTNÍ PROFIL TERAPIE BISFOSFONÁTYU MRCC
Bezpečnostní profil bisfosfonátů byl zkoumán v celé řadě prací [32–35]. V další sekci se zabýváme bezpečnostními aspekty aplikace bisfosfonátů u pacientů s mRCC.
Poruchy elektrolytů
Bisfosfonáty mohou způsobovat poruchu elektrolytů. Při intravenózní aplikaci silných bisfosfonátů [32,36] může docházet k hypokalcemii, tato komplikace byla zaznamenána u 19 % mRCC pacientů užívajících zoledronát [22]. Povaha hypokalcemie vyvolané aplikací bisfosfonátů je obvykle mírná, u některých pacientů však může být predispozicí k závažným následkům (např. záchvaty). Po zahájení kalciové terapie obvykle dojde k okamžitému ústupu hypokalcemie, zaznamenány však byly i déletrvající příhody [37]. Riziko vzniku hypokalcemie lze minimalizovat současným podáváním kalcia. U pacientů užívajících zoledronát se doporučuje denní dávka 500 mg kalcia a 400 IU vitaminu D, ovšem i navzdory těmto opatřením může docházet k hypokalcemii [38–39]. S hypokalcemií může dále souviset hypofosfatemie zejména v případě, že jsou bisfosfonáty indikovány pro léčbu hyperkalcemie doprovázející zhoubný nádor [38]. Hyperkalcemie je často doprovázená výsky-tem hypomagnesie a narušením renální funkce [36,39–40].
Renální toxicita související s aplikací bisfosfonátů
U pacientů s mRCC hrozí riziko renální toxicity vzhledem k tomu, že řada z nich podstoupila radikální nefrektomii lokalizovaného onemocnění nebo cytoredukční nefrektomii před systémovou terapií. U těchto jedinců je často již před zahájením léčby přítomen určitý stupeň chronického poškození renální funkce. Retrospektivní studie zahrnující 446 pacientů užívajících zoledronát uvádí, že již samotná diagnostika RCC představuje nezávislý rizikový faktor pro vznik renálního poškození během léčby zoledronátem. Mezi další rizikové faktory patří věk, kumulativní dávkování bisfosfonátů, vystavení nesteroidním protizánětlivým agens (NSAIDs) a terapie cisplatinou [41]. Preklinické i klinické studie testující účinnost bisfosfonátů uvádějí výskyt renální toxicity, zejména při intravenózní aplikaci preparátu [42–43]. Podstatné rozdíly existují rovněž mezi jednotlivými druhy bisfosfonátů (aplikovanými intravenózně) [44].
Byly zaznamenány případy narušení renální funkce v důsledku fokální segmentální glomerulosklerózy u pacientů užívajících vysoké dávky pamidronátu [45] a případy akutní tubulární nekrózy u pacientů užívajících zoledronát [46]. Většina případů narušení renální funkce (v důsledku terapie bisfosfonáty) byla zaznamenána u pacientů s mnohočetným myelomem [32]. U této populace pacientů je často v důsledku ukládání monoklonálního imunoglobulinu již před léčbou přítomno renální poškození – tento mechanizmus renálního poškození se však nemusí vztahovat na pacienty se solidními tumory. Omezíme tedy tuto tematiku pouze na narušení renální funkce u pacientů se solidními tumory a zaměříme se na toxicitu vznikající v důsledku aplikace zoledronátu vzhledem k tomu, že tento preparát se v současné době doporučuje pro léčbu mRCC [25].
Narušení renální funkce v důsledku léčby bisfosfonáty se může projevovat ve formě mírného, zvratného zvýšení hladiny kreatininu v séru až po vzácně se vyskytující nezvratné selhání ledviny v terminálním stadiu. Faktory související s vyšším rizikem narušení renální funkce v důsledku aplikace bisfosfonátů zahrnují dávkování, frekvenci a délku trvání infuze preparátu [43]. Údaje týkající se aplikace zoledronátu prokazují, že riziko narušení renální funkce souvisí s délkou trvání terapie. Zaznamenány však byly rovněž případy narušení renální funkce po aplikaci první dávky zoledronátu [38,41,47].
Rosen et al [21] ve své randomizované studii, zahrnující pacienty s různými solidními tumory, neprokázali žádný statistický rozdíl mezi abnormální funkcí ledviny u pacientů užívajících zoledronát (10,9 %) a placebo (6,7 %). V analýze skupiny pacientů s mRCC došlo u 2/18 případů léčených zoledronátem ke vzniku komplikací souvisejících s renální funkcí (vs 3/15 v placebo skupině) [22–23]. Údaje dalších studií zabývajících se narušením renální funkce u pacientů se solidními tumory po léčbě zoledronátem jsou uvedeny v tab. 2.
Tab. 2. Studie uvádějící poškození renální funkce u pacientů se solidními tumory při aplikaci zoledronátu. 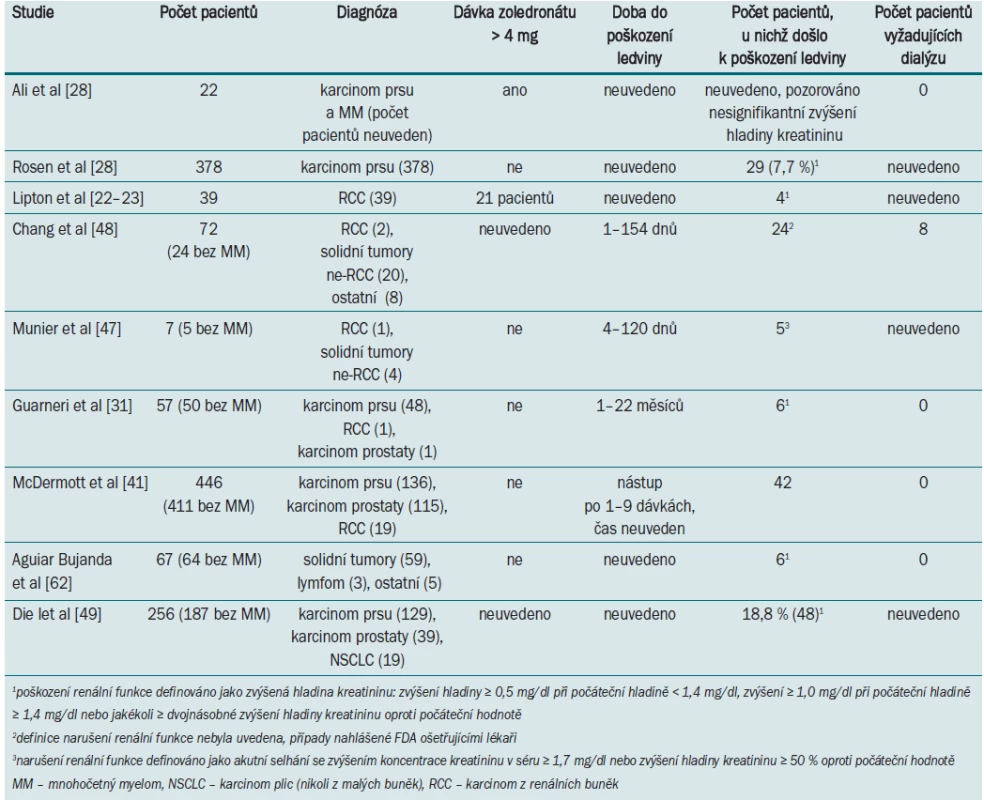
Byly zaznamenány i další případy renální toxicity při aplikaci zoledronátu. FDA systém pro reportování vedlejších účinků (US Food and Drug Administrativ Averse Event Reporting System) umožnil identifikovat v období od srpna 2001 do března 2003 72 podobných případů. Jednalo se však o heterogenní skupinu zahrnující 42 pacientů s mnohočetným myelomem, 22 pacientů se solidními tumory (pouze dva s mRCC), 2 pacienty s benigním onemocněním a 6 pacientů s neznámou diagnózou [48]. U poloviny pacientů byla zjištěna hladina kreatininu v séru > 1,4 mg/dl. Detaily týkající se léčby byly zaznamenány nejednotným způsobem a 27 pacientů vyžadovalo dialýzu. Rizikové faktory zhoršení renální funkce v důsledku aplikace zoledronátu zahrnovaly karcinom v pokročilém stadiu, dřívější aplikaci bisfosfonátů, aplikaci NSAIDs. Ve francouzské databázi French Averse Effect Reporting Database bylo v období od ledna 2001 do června 2004 identifikováno sedm případů renální toxicity vyvolané léčbou zoledronátem, pouze u jednoho pacienta byl přítomen mRCC [47]. U čtyř pacientů došlo k akutnímu selhání ledvin, zatímco u dalších tří pacientů k akutnímu zhoršení již přítomného chronického renálního selhání. K selhání ledvin již po první dávce došlo u pěti pacientů. Po ukončení terapie došlo k návratu renální funkce do původního stadia u tří pacientů (včetně pacienta s mRCC), u jednoho pacienta došlo k částečnému zlepšení, ve dvou případech však mělo fatální následky. Rizikové faktory odpovídaly faktorům identifikovaným v dalších studiích – karcinom v pokročilém stadiu, mnohočetný myelom, již přítomné renální selhání, diabetes, hypertenze a aplikace nefrotoxických agens.
Vzhledem k těmto obavám existují jednoznačná pravidla pro aplikaci zoledronátu u pacientů s již existujícím narušením renální funkce. Vhodná dávka je stanovena tak, aby AUC (oblast pod křiv-kou) odpovídala clearanci kreatininu = 75 ml/min [38]. Doporučená úprava dávkování zoledronátu a pravidla pro jeho aplikaci jsou uvedeny v tab. 3a a 3b. Při dodržování těchto opatření lze očekávat, že riziko narušení renální funkce při aplikaci zoledronátu bude nízké.
Tab. 3a. Doporučená modifikace dávkování zoledronátu u pacientů s metastázami do skeletu a poškozením ledvin [38]. ![Tab. 3a. Doporučená modifikace dávkování zoledronátu u pacientů s metastázami do skeletu a poškozením ledvin [38].](https://pl-master.mdcdn.cz/media/image/a056d8aa076c21c3feb2244a80ca3b77.png?version=1537795625)
Tab. 3b. Poznámky týkající se terapie zoledronátem v onkologii. 
Ačkoli dodržování výše uvedených pravidel může pomoci minimalizovat výskyt poškození renální funkce při léčbě zoledronátem, stále existují oprávněné obavy týkající se jeho aplikace u pacientů s již existujícím poškozením ledvin. Výsledky retrospektivní studie zahrnující 333 pacientů (75 % případů představují solidní tumory) nasvědčují tomu, že další preparát z řady bisfosfonátů, ibandronát (aplikovaný intravenózně), je méně nefrotoxický než zoledronát [49]. 256 pacientů bylo léčeno pomocí zoledronátu, 109 pomocí ibandronátu, 32 pacientů užívalo oba preparáty. Pacienti užívající zoledronát měli významně lepší počáteční funkci ledvin a menší počet pacientů měl anamnézu renálního onemocnění než pacienti užívající ibandronát. Při užití hladiny kreatininu v séru jako parametru pro hodnocení renální funkce byl větší počet případů narušení renální funkce zaznamenán u pacientů užívajících zoledronát než u pacientů užívajících ibandronát (18,8 % vs 12,8 %, RR 1,5, p = 0,17), tento rozdíl však nebyl statisticky signifikantní. Míra incidence poškození ledvin (počet případů na jednoho pacienta za rok léčby bisfosfonáty) byla signifikantně vyšší při léčbě zoledronátem než při léčbě ibandronátem (0,56 vs 0,21, p < 0,0001). Analýza podle Andersen-Gilla prokázala signifikantně vyšší riziko poruch ledvin při léčbě zoledronátem než při léčbě ibandronátem (HR 5,67, p < 0,01). Dále bylo prokázáno, že z dlouhodobého hlediska je aplikace ibandronátu bezpečná a pacienty dobře snášena [50].
Dále existují důkazy prokazující účinnost orální aplikace ibandronátu při redukci bolesti vyvolané kostními metastázami u pacientů s karcinomem prsu a zlepšení QoL [51]. Dvě studie III. fáze testující účinek orální aplikace ibandronátu u 564 pacientů s karcinomem prsu a kostními metastázami prokázaly, že ve srovnání s placebem ibandronát významně snižuje riziko vzniku SREs (HR 0,62, 95 % CI 0,48–0,79, p = 0,0001) [52]. Incidence renálních komplikací byla srovnatelná v obou skupinách (ibandronát 5,2 %, placebo 4,7 %), u pacientů užívajících ibandronát nebyl zaznamenán žádný případ renálního selhání. Novější studie srovnávající orální vs intravenózní aplikaci ibandronátu u pacientů se solidními tumory (ale nikoli mRCC) uvádí, že oba způsoby aplikace jsou stejně účinné s ohledem na radiologickou odpověď a úlevu bolesti a oba jsou spojeny s přijatelnou snášenlivostí [53]. Tyto údaje nasvědčují tomu, že orální aplikace ibandronátu může být vhodnou volbou pro léčbu pacientů s mRCC, u nichž může představovat narušení renální funkce vyvolané zolendronátem značné riziko. Je nutné prokázat v dalších studiích účinnost a bezpečnost orální aplikace ibandronátu v této populaci pacientů.
Osteonekróza horní a dolní čelisti vyvolaná aplikací bisfosfonátů
Osteonekróza čelisti vyvolaná aplikací bisfosfonátů (BRONJ) je závažný vedlejší účinek spojený s aplikací těchto preparátů, který byl popsán hned po jejich uvedení na trh [54–56]. Tato porucha postihuje mandibulu (přibližně v 66 % případů) nebo vzácněji maxilu (25 %), nebo obě čelisti (10 %). U jedné třetiny případů nemusí léze vyvolávat bolest. Léze se vyskytují samostatně nebo častěji jako mnohočetné léze [57–58]. ONJ je spojena s významnou morbiditou, což vede ke vzniku bolesti, infekce, ztrátě zubů nebo vzniku podkožní píštěle a v některých případech může vyžadovat operační léčbu. Různé skupiny specialistů publikovali v nedávné době diagnostická kritéria a guidelines pro řešení BRONJ [59–60].
Jedna ze studií uvádí 6–10% prevalenci BRONJ u pacientů s karcinomem [57]. 94 % pacientů, u nichž se vyskytla BRONJ, bylo léčeno pomocí pamidronátu, zoledronátu nebo obou preparátů, 60 % případů se vyskytlo po dento-alveolární operaci, a 40 % bylo spojeno s infekcí ústní dutiny nebo lokálním traumatem.
V prospektivní studii zahrnující 252 pacientů s mnohočetným myelomem nebo solidním tumorem, kteří podstoupili intravenózní léčbu bisfosfonáty, byla zaznamenána 6,7% prevalence BRONJ [61]. Incidence BRONJ se zvyšovala v závislosti na délce trvání terapie: z 1,5 % při léčbě trvající 4–12 měsíců až na 7,7 % při 37–48měsíční léčbě. Riziko BRONJ bylo významně vyšší u pacientů užívajících zoledronát (vs pamidronát) a u pacientů, kteří užívali nejprve pamidronát a potom zoledronát. Menší studie zahrnující 67 pacientů léčených pomocí zoledronátu uvádí při průměrném trvání terapie 34 měsíců 9% incidenci BRONJ (rozmezí 10–58 měsíců) [62].
Ačkoli klinicky připomíná BRONJ osteoradionekrózu (s níž se setkáváme u pacientů s karcinomem hlavy a krku po radioterapii), histopatologický nález BRONJ lézí je odlišný, kdy ischemie hraje méně významnou roli [56,63]. Existuje důvod domnívat se, že v kostní tkáni alveolů horní a dolní čelisti dochází k selektivní koncentraci bisfosfonátů vzhledem k tomu, že v této oblasti je kostní přestavba významně vyšší než v ostatních částech skeletu [64]. Koncentrace bisfosfonátů v čelisti může vést k tomu, že jsou tyto absorbovány jiným typem buněk, než jsou osteoklasty. Vzhledem k tomu, že bisfosfonáty působí na řadu druhů buněk cytotoxicky, lze předpokládat, že vysoká lokální koncentrace tohoto preparátu v čelisti může způsobovat toxicitu v měkkých tkáních i tkáni skeletu [64]. Na vzniku BRONJ se může rovněž podílet infekce, která vytváří uvnitř lézí biofilm.
Mikroorganizmy mohou rovněž způsobovat zvýšenou kostní resorpci v lézích a jejich bezprostředním okolí [64].
Nové cílené terapie zaměřené na léčbu RCC mají antiangiogenní vlastnosti, které mohou nepříznivě reagovat s účinkem bisfosfonátů, a zvyšovat tak riziko BRONJ u pacientů, kteří užívají obě terapie současně. Cílené terapie, stejně jako bisfosfonáty, jsou aplikovány dlouhodobě, což zvyšuje pravděpodobnost vzniku toxicity kombinované léčby. Klinické údaje týkající se bisfosfonátů, jež máme k dispozici, pochází z období před zavedením cílené léčby RCC, tato obava je tedy čistě spekulativní. Existuje však kazuistika uvádějící případ recidivující BRONJ u pacienta s mRCC, který užíval zoledronát, a poté inhibitor tyrosin kinázy sunitinib [65]. Po vysazení sunitinibu došlo ke zlepšení BRONJ, při dalším nasazení preparátu z důvodu progrese onemocnění k opětovnému zhoršení. Autoři se domnívají, že silný anti-angiogenní účinek sunitinibu může vyvolávat dlouhodobou inhibici remodelace skeletu, kdy aminofosfonáty zůstanou zachyceny v osteonekrotické kostní tkáni, čímž zabraňují hojení sliznice a vystavují skelet vzniku recidivující infekce. Tato kazuistika přispívá k teoretickým obavám týkajícím se rizikových faktorů souvisejících s aplikací antiangiogenních preparátů. Pacienti podstupující dlouhodobou terapii v kombinaci s jinými agens tedy vyžadují pečlivý monitoring.
Byly publikovány guidelines pro řešení ONJ, které zahrnují preventivní opatření umožňující předejít vzniku dentální infekce a informace týkající se nutnosti podstoupit dento-alveolární operaci [25,55,57,59–60]. Před zahájením terapie bisfosfonáty je třeba provést pečlivé vyšetření ústní dutiny, informovat pacienta o důkladné péči o ústní dutinu a zahájit profylaktickou léčbu jakéhokoli aktivního onemocnění. V prospektivní studii bylo prokázáno, že podobná preventivní opatření vedou ke snížení incidence BRONJ ze 7,8 % na 1,7 % (p = 0,016) [66]. Léčba BRONJ je v současné době empirická. Doporučuje se konzervativní přístup zahrnující analgezii, výplachy ústní dutiny, aplikaci antibiotik a ošetření BRONJ lézí. V závislosti na klinické situaci je možné zvážit ukončení terapie bisfosfonáty.
VOLBA VHODNÉHO BISFOSFONÁTU U PACIENTŮ S MRCC
Jediným bisfosfonátem, který snižuje výskyt SREs u pacientů s mRCC, je zoledronát [22–23]. Terapii zoledronátem je vhodné zvážit u všech pacientů s mRCC a kostními metastázami, na základě hodnocení předpokládané délky života pacienta a pravděpodobnosti, že léčba přinese symptomatický benefit [25]. U mRCC pacientů s poruchou renální funkce lze zvážit aplikaci ibandronátu, který snižuje bolest ve skeletu a SREs u pacientů s karcinomem prsu [51–52], jehož aplikace je méně nefrotoxická než aplikace zoledronátu [49].
Další alternativou je orální aplikace ibandronátu, význam tohoto preparátu při léčbě mRCC je však nutné ověřit v dalších studiích [51,53]. V současnosti tedy lze za zlatý standard léčby mRCC pacientů s metastázami pomocí bisfosfonátů považovat zoledronát.
SOUČASNÁ DOPORUČENÍ A VÝHLED DO BUDOUCNA
Všechny v současné době dostupné klinické studie týkající se terapie bisfosfonáty u pacientů s mRCC pocházejí z období cytokinové terapie. Cytokinová terapie neumožňuje účinnou léčbu metastazujícího onemocnění u mRCC pacientů [67], zatímco nové preparáty cílené proti mRCC dosahují lepších výsledků [6–9]. Pokud uvážíme zvyšující se terapeutický účinek těchto preparátů a jejich častější užívání, zůstává benefit bisfosfonátů nejistý. V současné době je nutné posoudit roli léčby bisfosfonáty v kombinaci s preparáty cílenými proti mRCC. Benefit aplikace bisfosfonátů a potenciální interakci jednotlivých preparátů, která může zhoršovat stupeň toxicity, je nutné prokázat v prospektivních, randomizovaných studiích.
Stále větší množství důkazů svědčí o tom, že vedle léčby kostních metastáz může mít léčba bisfosfonáty další benefity, jakými je například možnost prevence vzniku kostních metastáz [68] a přímý antitumorózní a antiangiogenní účinek [68–70]. Tyto vlastnosti mohou rozšířit roli bisfosfonátů v onkologii při léčbě kostních metastáz a mohou se podílet na zvýšení bezpečnosti a tolerance u různých druhů karcinomů.
Panel mezinárodních odborníků v nedávné době vytvořil guidelines pro léčbu bisfosfonáty u pacientů se solidními tumory, včetně RCC [25]. Přehled doporučení je uveden v tab. 4.
Tab. 3. Přehled doporučení pro aplikaci bisfosfonátů u pacientů se solidními zhoubnými nádory. 
Liam Welsh MBBS, MRCP, PhD
Royal Marsden NHS Foundation Trust
London, UK
Zdroje
1. Cancer Research UK. UKkidney cancer incidence statistics. http://info.cancerresearchuk.org/cancerstats/ types/kidney/incidence. Accessed February 2009.
2. Gupta K, Miller JD, Li JZ et al. Epidemiologic and socioeconomic burden of metastatic renal cell carcinoma (mRCC): a literature review. Cancer Treat Rev 2008; 34(3): 193–205.
3. Janzen NK, Kim HL, Figlin RA et al. Surveillance after radical or partial nephrectomy for localized renal cell carcinoma and management of recurrent disease. Urol Clin North Am 2003; 30(4): 843–52.
4. Russo P, Jang TL, Pettus JA et al. Survival rates after resection for localized kidney cancer: 1989 to 2004. Cancer 2008; 113(1): 84–96.
5. Motzer RJ, Mazumdar M, Bacik J et al. Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J Clin Oncol 1999; 17(8): 2530–2540.
6. Escudier B, Eisen T, Stadler WM et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356(2): 125–134.
7. Motzer RJ, Hutson TE, Tomczak P et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007; 356(2): 115–124.
8. Hudes G, Carducci M, Tomczak P et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007; 356(22): 2271–2281.
9. Motzer RJ, Escudier B, Oudard S et al. Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet 2008; 372(9637): 449–456.
10. Aoki J, Yamamoto I, Hino M et al. Osteoclast-mediated osteolysis in bone metastasis from renal cell carcinoma. Cancer 1988; 62(1): 98–104.
11. Zekri J, Ahmed N, Coleman RE et al. The skeletal metastatic complications of renal cell carcinoma. Int J Oncol 2001; 19(2): 379–382.
12. Saad F, Lipton A, Cook R et al. Pathologic fractures correlate with reduced survival in patients with malignant bone disease. Cancer 2007; 110(8): 1860–1867.
13. Hillner BE, Ingle JN, Chlebowski RT et al. American Society of Clinical Oncology 2003 update on the role of bisphosphonates and bone health issues in women with breast cancer. J Clin Oncol 2003; 21(21): 4042–4057.
14. Pavlakis N, Schmidt R, Stockler M. Bisphosphonates for breast cancer. Cochrane Database Syst Rev 2005; 3: CD003474.
15. Yuen KK, Shelley M, Sze WM et al. Bisphosphonates for advanced prostate cancer. Cochrane Database Syst Rev 2006; 4: CD006250.
16. Kyle RA, Yee GC, Somerfield MR et al. American Society of Clinical Oncology 2007 clinical practice guideline update on the role of bisphosphonates in multiple myeloma. J Clin Oncol 2007; 25(17): 2464–2472.
17. Guise TA, Mohammad KS, Clines G et al. Basic mechanisms responsible for osteolytic and osteoblastic bone metastases. Clin Cancer Res 2006; 12 : 6213s–6216s.
18. Rogers M. Mechanisms of action of bisphosphonates. In: Jasmin C, Capanna R, Coleman R et al., eds. Textbook of Bone Metastases. Chichester: John Wiley and Sons; 2005 : 325–343.
19. Drake MT, Clarke BL, Khosla S. Bisphosphonates: mechanism of action and role in clinical practice. Mayo Clin Proc 2008; 83(9): 1032–1045.
20. Roelofs AJ, Thompson K, Gordon S. Molecular mechanisms of action of bisphosphonates: current status. Clin Cancer Res 2006; 12 : 6222s–6230s.
21. Rosen LS, Gordon D, Tchekmedyian S et al. Zoledronic acid versus placebo in the treatment of skeletal metastases in patients with lung cancer and other solid tumors: a Phase III, double-blind, randomized trial–the Zoledronic Acid Lung Cancer and Other Solid Tumors Study Group. J Clin Oncol 2003; 21(16): 3150–3157.
22. Lipton A, Zheng M, Seaman J. Zoledronic acid delays the onset of skeletal-related events and progression of skeletal disease in patients with advanced renal cell carcinoma. Cancer 2003; 98(5): 962–969.
23. Lipton A, Colombo-Berra A, Bukowski RM et al. Skeletal complications in patients with bone metastases from renal cell carcinoma and therapeutic benefits of zoledronic acid. Clin Cancer Res 2004; 10 : 6397s–6403s.
24. Kretzschmar A, Wiege T, Al-Batran SE et al. Rapid and sustained influence of intravenous zoledronic acid on course of pain and analgesics consumption in patients with cancer with bone metastases: a multicenter open-label study over 1 year. Support Cancer Ther 2007; 4(4): 203–210.
25. Aapro M, Abrahamsson PA, Body JJ et al. Guidance on the use of bisphosphonates in solid tumours: recommendations of an international expert panel. Ann Oncol 2008; 19(3): 420–432.
26. Rosen LS, Gordon D, Tchekmedyian NS et al. Long-term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with nonsmall cell lung carcinoma and other solid tumors: a randomized, Phase III, double-blind, placebo-controlled trial. Cancer 2004; 100(12): 2613–2621.
27. Hirsh V, Tchekmedyian NS, Rosen LS et al. Clinical benefit of zoledronic acid in patients with lung cancer and other solid tumors: analysis based on history of skeletal complications. Clin Lung Cancer 2004; 6(3): 170–174.
28. Ali SM, Esteva FJ, Hortobagyi G et al. Safety and efficacy of bisphosphonates beyond 24 months in cancer patients. J Clin Oncol 2001; 19(14): 3434–3437.
29. Rosen LS, Gordon D, Kaminski M et al. Long-term efficacy and safety of zoledronic acid compared with pamidronate disodium in the treatment of skeletal complications in patients with advanced multiple myeloma or breast carcinoma: a randomized, double-blind, multicenter, comparative trial. Cancer 2003; 98(8): 1735–1744.
30. Saad F, Gleason DM, Murray R et al. Long-term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormone-refractory prostate cancer. J Natl Cancer Inst 2004; 96(11): 879–882.
31. Guarneri V, Donati S, Nicolini M et al. Renal safety and efficacy of i.v. bisphosphonates in patients with skeletal metastases treated for up to 10 Years. Oncologist 2005; 10(10): 842–848.
32. Tanvetyanon T, Stiff PJ. Management of the adverse effects associated with intravenous bisphosphonates. Ann Oncol 2006; 17(6): 897–907.
33. Diel IJ, Bergner R, Grotz KA. Adverse effects of bisphosphonates: current issues. J Support Oncol 2007; 5(10): 475–482.
34. Dunstan CR, Felsenberg D, Seibel MJ. Therapy insight: the risks and benefits of bisphosphonates for the treatment of tumor-induced bone disease. Nat Clin Pract Oncol 2007; 4(1): 42–55.
35. Coleman RE. Risks and benefits of bisphosphonates. Br J Cancer 2008; 98(11): 1736–1740.
36. Peter R, Mishra V, Fraser WD. Severe hypocalcaemia after being given intravenous bisphosphonate. BMJ 2004; 328(7435): 335–336.
37. Breen TL, Shane E. Prolonged hypocalcemia after treatment with zoledronic acid in a patient with prostate cancer and vitamin D deficiency. J Clin Oncol 2004; 22(8): 1531–1532.
38. Novartis. Zometa prescribing information. http://www.pharma.us.novartis.com/product/pi/pdf/Zometa.pdf Accessed February 2009.
39. Chennuru S, Koduri J, Baumann MA. Risk factors for symptomatic hypocalcaemia complicating treatment with zoledronic acid. Intern Med J 2008; 38(8): 635–637.
40. Champallou C, Basuyau JP, Veyret C et al. Hypocalcemia following pamidronate administration for bone metastases of solid tumor: three clinical case reports. J Pain Symptom Manage 2003; 25(2): 185–190.
41. McDermott RS, Kloth DD, Wang H et al. Impact of zoledronic acid on renal function in patients with cancer: clinical significance and development of a predictive model. J Support Oncol 2006; 4(10): 524–529.
42. Body JJ, Diel IJ, Tripathy D et al. Intravenous ibandronate does not affect time to renal function deterioration in patients with skeletal metastases from breast cancer: phase IIItrial results. Eur J Cancer Care (Engl) 2006; 15(3): 299–302.
43. Perazella MA, Markowitz GS. Bisphosphonate nephrotoxicity. Kidney Int 2008; 74(11): 1385–1393.
44. Pfister T, Atzpodien E, Bohrmann B et al. Acute renal effects of intravenous bisphosphonates in the rat. Basic Clin Pharmacol Toxicol 2005; 97(6): 374–381.
45. Markowitz GS, Appel GB, Fine PL et al. Collapsing focal segmental glomerulosclerosis following treatment with high-dose pamidronate. J Am Soc Nephrol 2001; 12(6): 1164–1172.
46. Markowitz GS, Fine PL, Stack JI et al. Toxic acute tubular necrosis following treatment with zoledronate (Zometa). Kidney Int 2003; 64(1): 281–289.
47. Munier A, Gras V, Andrejak M et al. Zoledronic acid and renal toxicity: data from French adverse effect reporting database. Ann Pharmacother 2005; 39(7–8): 1194–1197.
48. Chang JT, Green L, Beitz J. Renal failure with the use of zoledronic acid. N Engl J Med 2003; 349(17): 1676–1679.
49. Diel IJ, Weide R, Koppler H et al. Risk of renal impairment after treatment with ibandronate versus zoledronic acid: a retrospective medical records review. Support Care Cancer 2009; 17(6): 719–725.
50. Pecherstorfer M, Rivkin S, Body JJ et al. Long-term safety of intravenous ibandronic acid for up to 4 years in metastatic breast cancer: an open-label trial. Clin Drug Investig 2006; 26(6): 315–322.
51. Body JJ, Diel IJ, Bell R et al. Oral ibandronate improves bone pain and preserves quality of life in patients with skeletal metastases due to breast cancer. Pain 2004; 111(3): 306–312.
52. Body JJ, Diel IJ, Lichinitzer M et al. Oral ibandronate reduces the risk of skeletal complications in breast cancer patients with metastatic bone disease: results from two randomised, placebo-control-led phase IIIstudies. Br J Cancer 2004; 90(6): 1133–1137.
53. Mystakidou K, Stathopoulou E, Parpa E et al. Oral versus intravenous ibandronic acid: a comparison of treatment options for metastatic bone disease. J Cancer Res Clin Oncol 2008; 134(12): 1303–1310.
54. Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 2003; 61(9): 1115–1117.
55. Ruggiero SL, Mehrotra B, Rosenberg TJ et al. Osteonecrosis of the jaws associated with the use of bisphosphonates: a review of 63 cases. J Oral Maxillofac Surg 2004; 62(5): 527–534.
56. Hellstein JW, Marek CL. Bisphosphonate osteochemonecrosis (bis-phossy jaw): is this phossy jaw of the 21st century? J Oral Maxillofac Surg 2005; 63(5): 682–689.
57. Woo SB, Hellstein JW, Kalmar JR. Narrative [corrected] review: bisphosphonates and osteonecrosis of the jaws. Ann Intern Med 2006; 144(10): 753–761.
58. Bertoldo F, Santini D, Lo Cascio V. Bisphosphonates and osteomyelitis of the jaw: a pathogenic puzzle. Nat Clin Pract Oncol 2007; 4(12): 711–721.
59. Khosla S, Burr D, Cauley J et al. Bisphosphonate-associated osteonecrosis of the jaw: report of a task force of the American Society for Bone and Mine-ral Research. J Bone Miner Res 2007; 22(10): 1479–1491.
60. Weitzman R, Sauter N, Eriksen EF et al. Critical review: updated recommendations for the prevention, diagnosis, and treatment of osteonecrosis of the jaw in cancer patients–May 2006. Crit Rev Oncol Hematol 2007; 62(2): 148–152.
61. Bamias A, Kastritis E, Bamia C et al. Osteonecrosis of the jaw in cancer after treatment with bisphosphonates: incidence and risk factors. J Clin Oncol 2005; 23(34): 8580–8587.
62. Aguiar Bujanda D, Bohn Sarmiento U, Cabrera Suarez MA et al. Assessment of renal toxicity and osteonecrosis of the jaws in patients receiving zoledronic acid for bone metastasis. Ann Oncol 2007; 18(3): 556–560.
63. Hansen T, Kunkel M, Weber A et al. Osteonecrosis of the jaws in patients treated with bisphosphonates – histomorphologic analysis in comparison with infected osteoradionecrosis. J Oral Pathol Med 2006; 35(3): 155–160.
64. Reid IR. Osteonecrosis of the jaw: who gets it, and why? Bone 2009; 44(1): 4–10.
65. Brunello A, Saia G, Bedogni A et al. Worsening of osteonecrosis of the jaw during treatment with sunitinib in a patient with metastatic renal cell carcinoma. Bone 2009; 44(1): 173–175.
66. Ripamonti CI, Maniezzo M, Campa T et al. Decreased occurrence of osteonecrosis of the jaw after implementation of dental preventive measures in solid tumour patients with bone metastases treated with bisphosphonates. The experience of the National Cancer Institute of Milan. Ann Oncol 2009; 20(1) 137–145.
67. Kankuri M, Pelliniemi TT, Pyrhonen S et al. Feasibility of prolonged use of interferon-alpha in metastatic kidney carcinoma: a phase IIstudy. Cancer 2001; 92(4): 761–767.
68. Lipton A. Emerging role of bisphosphonates in the clinic – antitumor activity and prevention of metastasis to bone. Cancer Treat Rev 2008; 34(Suppl 1): S25–30.
69. Pandha H, Birchall L, Meyer B et al. Antitumor effects of aminobisphosphonates on renal cell carcinoma cell lines. J Urol 2006; 176(5): 2255–2261.
70. Santini D, Vincenzi B, Galluzzo S et al. Repeated intermittent low-dose therapy with zoledronic acid induces an early, sustained, and long-lasting decrease of peripheral vascular endothelial growth factor levels in cancer patients. Clin Cancer Res 2007; 13 : 4482–4486.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2010 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Infekce močových cest u dospělých – mezery v současných guidelines a doporučení pro klinickou praxi
-
Všechny články tohoto čísla
- Nádorové markery u renálního karcinomu: pomoc při diagnostice, prognóze, léčbě a sledování
- Standardizovaná anatomická klasifikace malých nádorů ledvin
- Léčba nádorů ledvin
- Ablační terapie při léčbě malých renálních tumorů: jak daleko se nalézá tato léčebná modalita od standardní péče?
- Nové trendy v systémové léčbě karcinomu ledviny
- Význam bisfosfonátů u karcinomu ledviny: bezpečnost a tolerance
- Úvodní slovo
- Ultrazvukové vyšetření skrota: principy a praktické využití
- Karcinom ledviny: nové přístu py při vyšetřování a léčbě
- Ze zahraničních periodik
- Co na publikované články říká profesor Patrik C. Walsh?
- GUIDELINES EAU PRO LÉČBU KARCINOMU Z RENÁLNÍCH BUNĚK
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ultrazvukové vyšetření skrota: principy a praktické využití
- Léčba nádorů ledvin
- Nádorové markery u renálního karcinomu: pomoc při diagnostice, prognóze, léčbě a sledování
- Standardizovaná anatomická klasifikace malých nádorů ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



