-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPrevence karcinomu prostaty
Autoři: Ian M. Thompson; Md
Působiště autorů: Department of Urology, The University of Texas Health Science Center, San Antonio, USA
Vyšlo v časopise: Urol List 2007; 5(4): 14-21
Úvod — břímě karcinomu prostaty
Karcinom prostaty a jeho důsledky představují obrovské břímě pro zdraví populace celého světa. Vzhledem k závažným problémům spojeným s časnou detekcí a diagnostikou karcinomu prostaty („overdetection“, neschopnost identifikace skutečně maligního onemocnění, morbidita spojená s léčbou a cena) se prevence karcinomu prostaty jeví velmi atraktivní strategií. Karcinom prostaty je nejčastěji se vyskytujícím maligním onemocněním (s výjimkou kožních malignit) u mužů ve Spojených Státech. Roční incidence za rok 2005 je odhadována na 232 090 nových případů karcinomu prostaty a 30 350 úmrtí na toto onemocnění [1].
Etiologie karcinomu prostaty není doposud známa. Rozmanitost povahy různých karcinomů prostaty vylučuje existenci jediné příčiny tohoto onemocnění. Prvním farmakologickým preparátem, u ně hoě bylo testováno a prokázáno snížení prevalence karcinomu prostaty v randomizované kontrolované studii [2], je finasterid — inhibitor typu 2 enzymu 5-alfa-reduktázy (5αR).
Androgeny a karcinom prostaty
Není pochyb o tom, že androgeny představují významný faktor při karcinogenezi nádoru prostaty. Absence androgenů má zřejmě protektivní účinek proti vzniku karcinomu prostaty. Primárním intraprostatickým androgenem je dihydrotestosteron (DHT), který vzniká přeměnou testosteronu pomocí 5αR. DHT se váže na androgenní receptory s vyšší afinitou nežli testosteron [3]. Dva izoenzymy 5αR jsou produktem dvou odlišných genů (typ I: chromozom 5, typ II: chromozom 2). 5αR I. typu je uplatňován v kůži a játrech, zatímco enzym II. typu navíc v prostatickém epitelu a ostatních tkáních genitálu [4].
Význam 5αR při vývoji genitálu byl poprvé identifikován v rámci zkoumání mužských pseudohermafroditů v 60. letech minulého století [5]. Dědičná nedostatečnost aktivity 5αR u mužského genotypu způsobuje vznik obojakého genitálu, pseudovaginální perineoskrotální hypospadie, plně diferencovaných (přestože v některých případech nesestouplých) varlat, normálních Wolffových vývodů a nedostatečně vyvinuté prostaty. Přestože spolu s nástupem puberty dochází k virilizaci (pravděpodobně následkem přeměny testosteronu na DHT 5αR I. typu v játrech), nedojde k dostatečnému vyvinutí prostaty [6].
Nedostatečná expozice prostaty DHT pravděpodobně chrání před vznikem karcinomu prostaty. Transrektální ultrasonografie provedená u mužů s dědičnou nedostatečností 5αR prokáže minimální přítomnost prostatické tkáně. Biopsie prokáže tkáň konzistentní s prostatickým stromatem (fibrotická pojivová tkáň a hladká svalovina), není však identifikována žádná epiteliální tkáň [7]. Čínští a turečtí eunuši, podobně jako členové sekty Skoptzy, jejichž pohlavní žlázy zůstaly nevyvinuty, slouží jako důkaz souvislosti mezi DHT a karcinomem prostaty [8].
Farmakologický účinek finasteridu
Finasterid je syntetická 4-azasteroidní sloučenina strukturou podobná testosteronu. Finasterid je specifický inhibitor 5αR II. typu, vytváří stabilní komplex medikament-enzym, nemá však afinitu na androgenní receptor ani nezpůsobuje inhibici produkce jiných steroidních hormonů [17,18]. Dávka 5 mg finasteridu způsobuje rychlé snížení hladiny DHT v séru (maximální účinek nastupuje po 8 hod) a supresi tvorby DHT, která přetrvá po 24 hod. Účinek finasteridu na koncentraci androgenů v séru a v prostatě byl prokázán v mnoha studiích. Nepřerušovaná aplikace 5 mg finasteridu denně (doporučená dávka pro léčbu BPH) způsobuje 70% snížení hladiny DHT v séru a 90% snížení hladiny DHT v prostatě [22,23]. Současně dochází k 10% zvýšení hladiny testosteronu a luteinizačního hormonu, jejich hodnota však zůstává v normálním fyziologickém rozmezí [24].
Klinické studie prováděné před a po uvedení finasteridu na trh prokázaly vedlejší účinky ovlivňující sexuální život, v podobě snížení libida a vzniku erektilní dysfunkce. Studie „Proscar Long-Term Efficacy and Safety Study“ (PLESS) uvádí, že 15 % účastníků zahrnutých do větve užívající finasterid zaznamenalo vedlejší účinky spojené s pohlavním životem, zatímco ve větvi užívající placebo zaznamenalo podobné účinky pouze 7 % pacientů [28]. Studie „Medical Therapy of Prostate Symptoms“ (MTOPS) zaznamenala vznik erektilní dysfunkce u 4,5 % pacientů užívajících finasterid, zatímco pouze u 3,3 % pacientů užívajících placebo [29].
Chemoprevence karcinomu prostaty pomocí finasteridu
Prevence karcinomu prostaty byla předmětem klinické studie III. fáze „Prostate Cancer Prevention Trial“ (PCPT) [2]. Design této studie zahrnoval významné otázky týkající se výběru vhodných cílů studie, výběru dostatečně velké populace mající statistickou průkaznost a kompletního zjištění stadia onemocnění.
PCPT, zahájená v roce 1993 krátce po schválení finasteridu FDA, byla první studií založenou na populaci, která se zabývala chemoprevencí karcinomu prostaty. Tato prospektivní, randomizovaná, zaslepená a placebem kontrolovaná studie zkoumala hypotézu, zda finasterid, který selektivně inhibuje 5αR II. typu a snižuje intraprostatickou hladinu DHT, a tím zabraňuje vzniku karcinomu prostaty. 18 882 mužů ve věku 55 let nebo více s normálním digitálním rektálním vyšetřením a hladinou prostatického specifického antigenu (PSA) v séru 3,0 ng/ml nebo méně bylo randomizováno k aplikaci 5 mg/den finasteridu nebo placeba po dobu 7 let. Biopsie prostaty byly prováděny z příčinných důvodů (abnormální nález při digitálním vyšetření prostaty nebo PSA > 4,0 ng/ml) a na konci 7letého sledování. Komise pro bezpečné sledování ukončila studii o 15 měsíců dříve, po dosažení primárního cíle, jímž bylo 25% snížení rizika vzniku karcinomu prostaty ve větvi pacientů užívajících finasterid, vzhledem k tomu, že analýza prokázala, že další provádění biopsií by nezměnilo výsledek studie.
Výsledky PCPT jsou následující:
- prevalence karcinomu se snížila z 24,4 % ve skupině užívající placebo na 18,4 % ve skupině užívající finasterid (snížení o 24,8 %)
- ve skupině užívající finasterid byla zaznamenána 6,4% prevalence a ve skupině užívající placebo byla zaznamenána 5,1% prevalence karcinomu s Gleasonovým skóre 7—10
- u mužů, u nichž byla prováděna odůvodněná biopsie prostaty (abnormální výsledek vyšetření prostaty nebo zvýšená hodnota PSA) a u mužů podstupujících biopsii prostaty na konci studie bylo zaznamenáno stejné snížení rizika karcinomu prostaty
- vedlejší účinky související se sexuálním životem byly častější u pacientů užívajících finasterid
- výskyt symptomů močových cest (např. symptomy dolních cest močových a riziko močové retence) a léčba (např. transuretrální resekce prostaty) byly častější u pacientů užívajících placebo
- objem prostaty ve skupině užívající finasterid byl o 25 % nižší než ve skupině užívající placebo.
Překvapivým zjištěním byla vysoká prevalence karcinomu prostaty u mužů bez klinického podezření na přítomnost karcinomu prostaty. Design této studie předpokládal 6% prevalenci vycházející z incidence databáze SEER (Surveillance, Epidemiology, and End Results), již uvádí Centrum pro kontrolu chorob [42]. Za zmínku dále stojí fakt, že ve studii byla zjištěna 6% incidence karcinomu prostaty detekovaného na základě abnormálního výsledku vyšetření prostaty nebo zvýšené hladiny PSA po 7 letech, coě prokazuje, že u značného podílu karcinomů prostaty detekovaných v PCPT nikdy nedojde ke klinickým projevům významným pro pacienta.
Tato „overdetection“ karcinomu prostaty může být u mužů léčených pomocí finasteridu z důvodu relativního odebírání více vzorků z jejich menších prostat ještě výraznější.
Nejnovější poznatky z údajů PCPT
Od publikace výsledků PCPT hodnotilo několik autorů potenciál zdraví populace a ekonomický dopad zařazení finasteridu do běžné praxe chemoprevence karcinomu prostaty. Model užívající počet zachráněných osob/rok prokázal, že chemoprevence pomocí finasteridu vede i při zvýšení výskytu karcinomů s Gleasonovým skóre 7—10 k pozitivnímu vlivu finasteridu na mortalitu populace [43]. Tento model nezahrnuje ekonomickou stránku ani vliv finasteridu na kvalitu života, ovšem prokazuje, že při publikovaném 6,9% zvýšení incidence onemocnění vyššího grade by tento preparát při užívání u mužské populace v USA starší 50 let umožnil záchranu 262 567 osob/rok (PY). Bez změny míry incidence onemocnění vysokého grade (HG) by činil výsledný počet osob/rok (PY) 316 760 a při 5% poklesu incidence HG onemocnění by byl PY 456 030. Další modely prokázaly pozitivní vliv aplikace finasteridu na mortalitu pouze v případů, že nedojde ke zvýšení incidence HG karcinomu prostaty v souvislosti s finasteridem [44]. V současné době představuje aplikace finasteridu nákladnou léčbu, kdy k poklesu incidence karcinomu prostaty dochází až po několika letech léčby. Pokud uvážíme zvýšenou incidenci HG karcinomů odhaduje analýza nárůst nákladů 200 000 USD na rok přizpůsobený kvalitě života (QALY) získaných pomocí chemoprevence finasteridem [45]. Tento nárůst klesá na 100 000 USD per QALY získaných 50% snížením hromadné ceny finasteridu při podmínce, že aplikace finasteridu předchází stejnou měrou vzniku karcinomů nízkého i vysokého stupně. Je důležité poznamenat, že od června 2006 je finasterid generikem.
Ekonomický dopad a vliv chemoprevence finasteridem na zdraví celkové populace lze zlepšit jeho selektivnější aplikací. Polymorfizmus genu SRD5A2, který kóduje 5αR II. typu, má funkční následky in vitro [46]. Funkční význam těchto polymorfizmů a princip, kterým mohou ovlivňovat riziko vzniku karcinomu prostaty, jsou v současné době předmětem intenzivního výzkumu, a je dokonce možné, že mohou hrát významnější roli při prognóze než při karcinogenezi. Substituce alaninu threoninem na kodonu 49 (A49T) genu SRD5A2 způsobuje 5násobně vyšší enzymatickou aktivitu 5αR a bývá spojována s horší prognózou karcinomu prostaty, zvláště u hispánců a afroameričanů [47,48]. Finasterid, který byl v PCPT testován jako preventivní preparát, má sníženou afinitu izoenzymu produkovaného variantou A49T [49]. Tento fakt může vysvětlovat zvýšený podíl HG karcinomů prostaty u pacientů léčených pomocí finasteridu.
Je možné, že jiné preparáty budou mít lepší účinek, nebo že tyto preparáty mohou překonat funkční vliv genetických variant SRD5A2. V současné době probíhá mezinárodní studie zahrnující 8 000 mužů, která zkoumá účinnost dutasteridu (neselektivního inhibitoru 5αR typu I i II) [50].
Fenomén HG onemocnění
V současné době je zkoumáno, zda uváděné zvýšení incidence HG onemocnění představuje neopodstatněné zjištění a artefakt nebo je skutečným biologickým fenoménem. Vědecká obec se jistě bude tímto tématem dále zabývat.
PCPT bohužel nebyl designován, aby zodpověděl tuto otázku a v nedávné době prováděná analýza prokazuje, že jakákoliv dedukce týkající se grade karcinomu je velmi riskantní a s nejvyšší pravděpodobností i nespolehlivá.
Souvisí vliv na grade karcinomu s patologickou interpretací artefaktem?
Zpočátku byl za příčinu vyššího grade karcinomu ve větvi PCPT zahrnující pacienty užívající finasterid povaěován účinek tohoto preparátu na vzhled tumoru, podobně jak je tomu u LHRH agonistů. Skupina vynikajících patologů zahrnující Francisca Civantose, Jonathana Epsteina a Victora Reutera se v rámci objasnění této otázky rozhodla v roce 2004 provést revizi 142 tumorĚ s Gleasonovým skóre 8—10 (90 z nich bylo léčeno finasteridem a 52 placebem). Cílem této revize bylo zjistit, zda lze u tumorů léčených pomocí finasteridu snadno identifikovat změny související s hormonální terapií. Po stanovení metodologického postupu autoři zaslepeně analyzovali 9 specifických znaků — velká a malá jádra s nejasnými okraji, prominenci jadérek, apoptická tělíska, mitózu, vakuoly, fibrózu stromatu, intratumorální zánět, prázdné štěrbiny. Revize nepřinesla žádné přesvědčivé důkazy, které by nasvědčovaly tomu, že finasterid ovlivňuje grade tumoru. Není tedy pravděpodobné, že by se tento artefakt podílel u pacientů léčených finasteridem na zvýšení detekce HG onemocnění.
Ovlivňuje úbytek objemu žlázy při aplikaci finasteridu detekci tumoru?
Druhá hypotéza týkající se detekce HG karcinomu prostaty je následující: Snížení objemu žlázy — u finasteridu přibližně o 25 % — zvýší poměr žlázy, z níž je odebrán vzorek pomocí sextantové biopsie, jako je tomu v PCPT. Tuto hypotézu potvrzuje Kulkarni v nedávno provedené studii, kdy zvýšení rizika detekce onemocnění HG nebylo prokázáno při zvětšení objemu žlázy.
Tuto hypotézu jsme prověřovali 2 způsoby. Nejprve jsme zjišťovali skutečnou charakteristiku tumorů vysokého grade při biopsii, určovali rozsah onemocnění a prognostické znaky u pacientů léčených finasteridem nebo placebem. Tyto znaky jsou uvedeny v tab. 1.
Tab. 1. Prognostické znaky u pacientů léčených finasteridem nebo placebem. 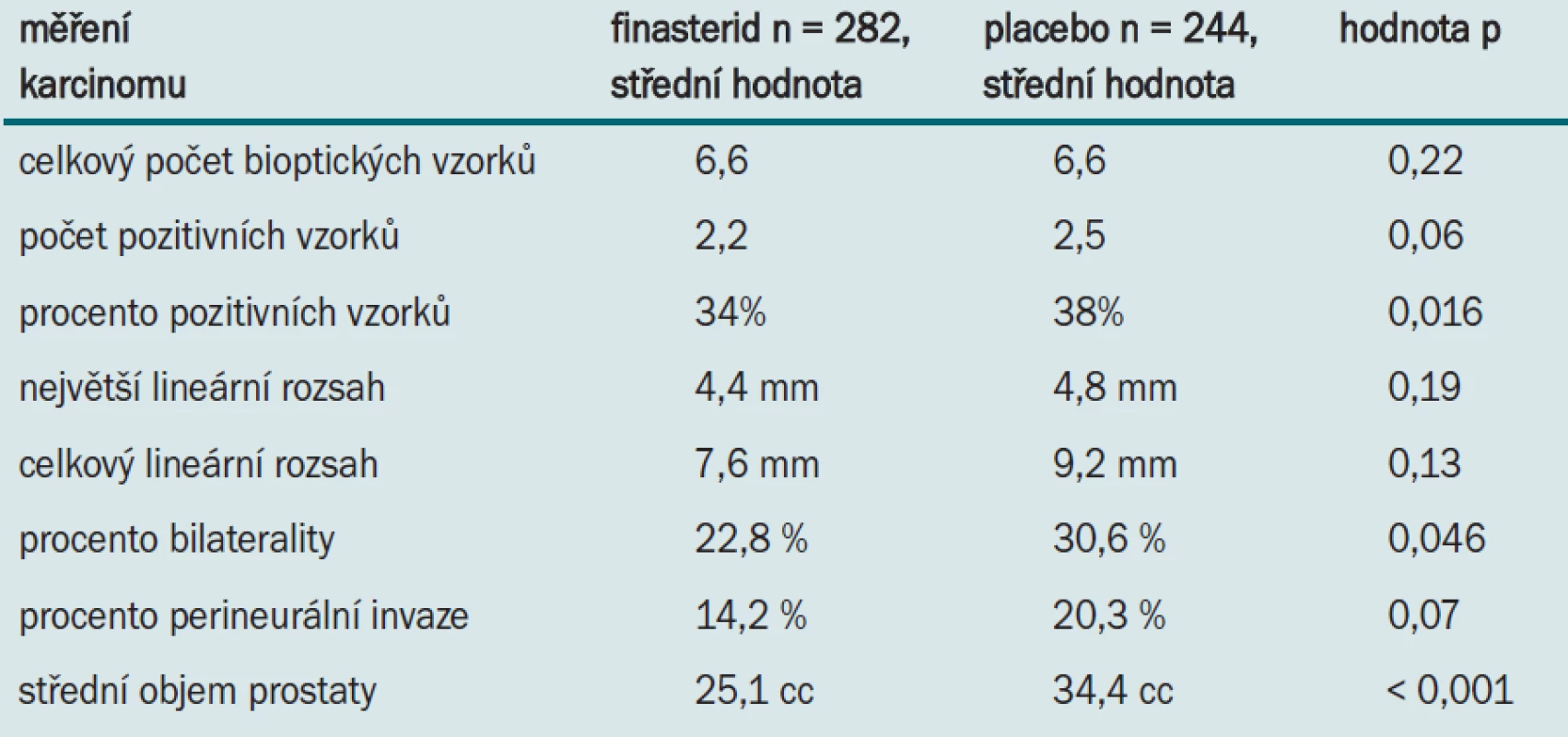
Druhý způsob analýzy této hypotézy spočívá ve srovnání změny grade karcinomu mezi biopsií a radikální prostatektomií. Pokud by skutečně při aplikaci finasteridu existovala z důvodu lepší možnosti odebrání vzorků z menší žlázy při detekci předpojatá chyba, očekávali bychom podhodnocení nižšího grade při biopsii. Tab. 2 uvádí souvislost mezi grade karcinomu při biopsii a při prostatektomii u 209 pacientů léčených pomocí finasteridu a 283 pacientů léčených placebem zahrnutých do PCPT, kteří podstoupili radikální prostatektomii.
Tab. 2. Souvislost mezi grade karcinomu při biopsii a při prostatektomii. 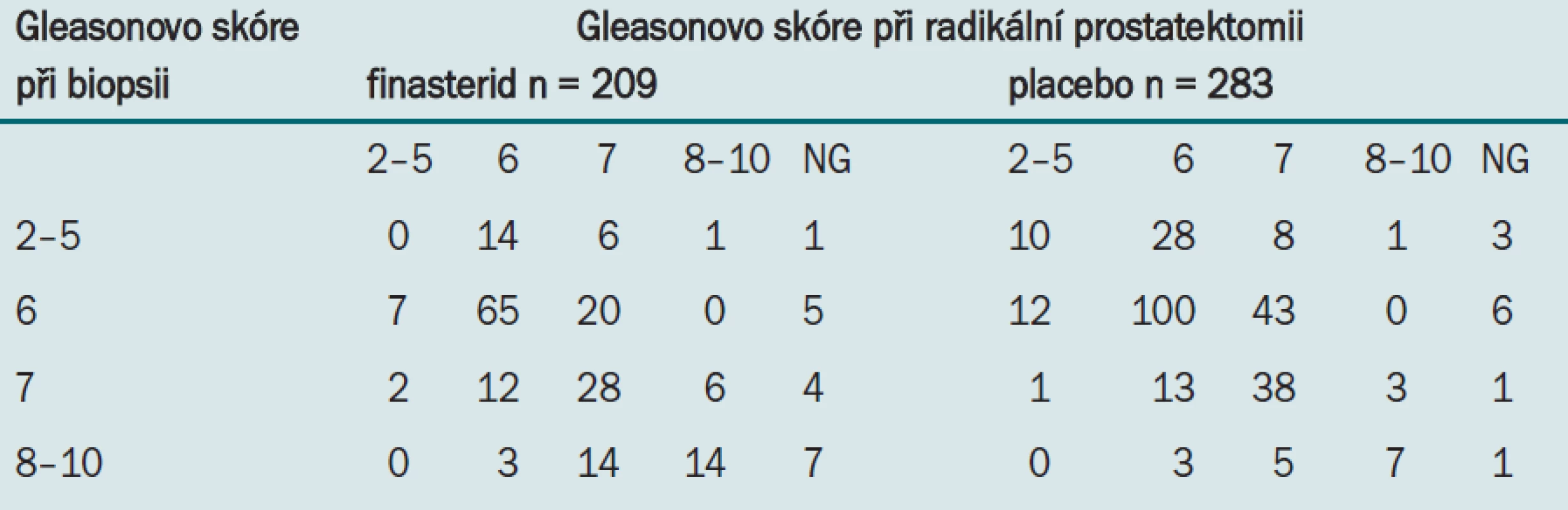
Změna Gleasonova skóre zjištěná při biopsii na hodnotu při prostatektomii představuje důkaz rozdílného odebírání vzorků. Zatímco u 30,5 % (83/272) pacientů užívajících placebo došlo ke zvýšení grade tumoru, ke stejnému zvýšení došlo pouze u 24,5 % (47/192) pacientů užívajících finasterid. Zajímavým zjištěním je, že zatímco pouze u 12,5 % (34/272) subjektů užívajících placebo došlo při RRP k poklesu grade tumoru, k tomuto poklesu došlo u 19,8 % (38/192) pacientů léčených finasteridem. Jako nejprůkaznější se jeví následující pozorování: V případů, že byl ve vzorku získaném při prostatektomii detekován tumor vysokého grade, byl tento tumor přehlédnut při biopsii u 50 % pacientů užívajících placebo a pouze u 29,7 % pacientů užívajících finasterid.
Závěrem lze říci, že odlišná detekce HG onemocnění u subjektů užívajících finasterid je pravděpodobně způsobena odebráním vzorků z většího podílu prostaty z důvodu její menší velikosti.
Poslední pozorování týkající se předpojaté chyby HG onemocnění je přímým důsledkem nálezů zjištěných v původní publikaci PCPT, které nebylo možné zpočátku vysvětlit. Tato studie zahrnovala 2 skupiny pacientů, u nichž byl diagnostikován karcinom prostaty. Jedna skupina mužů, označená „odůvodněné provádění biopsie“ podstoupila biopsii z důvodu zvýšené hladiny PSA nebo abnormálního nálezu DRE během 7 let léčby. Druhá skupina mužů s „normální“ hladinou PSA a normální DRE podstoupila biopsii na konci studie („provádění biopsie na konci studie“). Překvapivým zjištěním byl fakt, že muži, kteří byli vystaveni působení finasteridu po nejkratší dobu (1—7 let), měli vyšší riziko HG onemocnění, než muži léčení placebem. Při biopsiích prováděných z důvodu podezřelého nálezu bylo u pacientů léčených pomocí placeba detekováno celkem 148 tumorů Gleasonova skóre 7—10, u pacientů léčených finasteridem bylo detekováno 188 tumorů se skóre 7—10. Při analýze skupiny mužů, kteří byli léčení pomocí finasteridu po dobu celých 7 let nebyl překvapivě zjištěn žádný rozdíl v počtu HG tumorů: 89 tumorů u mužů léčených placebem, 92 tumorů u mužů léčených finasteridem. Pokud by finasterid skutečně vyvolával HG onemocnění, jak je možné, že není u jedinců, kteří užívají finasterid po nejdelší dobu, detekován největší počet tumorů?
Tento fakt lze zčásti vysvětlit rozdílným projevem PSA. Provedli jsme rozbor charakteristiky PSA u mužů léčených jak placebem tak pomocí finasteridu. V této analýze jsme zkoumali muže ve větvi léčené placebem i finasteridem, kteří podstoupili biopsii a během 1 roku po biopsii měření PSA. Pro detekci karcinomu v obou větvích studie jsme vypočítali senzitivitu a oblast pod ROC křivkou. Celkem byly analyzovány údaje 5 112 mužů ve skupině užívající placebo (1 111 s detekovaným karcinomem, u 1 100 bylo určeno skóre, 240 mužů s karcinomem Gleasonova skóre 7 nebo více, 55 mužů s Gleasonovým skóre 8 nebo více) a 4 579 mužů ve skupině užívající finasterid (695 mužů s detegovaným karcinomem prostaty, u 686 určeno skóre, 264 mužů s karcinomem Gleasonova skóre 7 nebo více, 81 mužů s Gleasonovým skóre 8 nebo více). Níže uvedené schéma 1 zobrazuje křivku ROC a oblast pod křivkou. Jak je zcela zřejmé, oblasti pod křivkou jsou výrazně větší.
Schema 1. Křivka ROC a oblast pod křivkou. 
Tab. 3 vyjadřuje implikaci posunu křivky. Screeningový test je vyvinut na základě specifity, která užívá prahovou hodnotu (cut-point). V případů že pro PSA vybereme například 80% specifitu, odpovídající hladina PSA, která by odpovídala této hodnotě u muže užívajícího placebo je 2,6 ng/ml a 1,1 ng/ml u muže užívajícího finasterid. Pro tyto 2 hodnoty je senzitivita o 14 % vyšší pro detekci karcinomu ve větvi s finasteridem. U HG onemocnění existuje stejné zlepšení senzitivity. Pokud například požadujeme při detekci onemocnění s Gleasonovým skóre 7 nebo více neě 90% specifitu, jsou hodnoty odpovídající této hladině u finasteridu dramaticky rozdílné při detekci karcinomu: pouze 39,2% senzitivita u placeba a 53% senzitivita u finasteridu.
Tab. 3. Sensitivita PSA pro danou specifitu při aplikaci finasteridu nebo placeba. 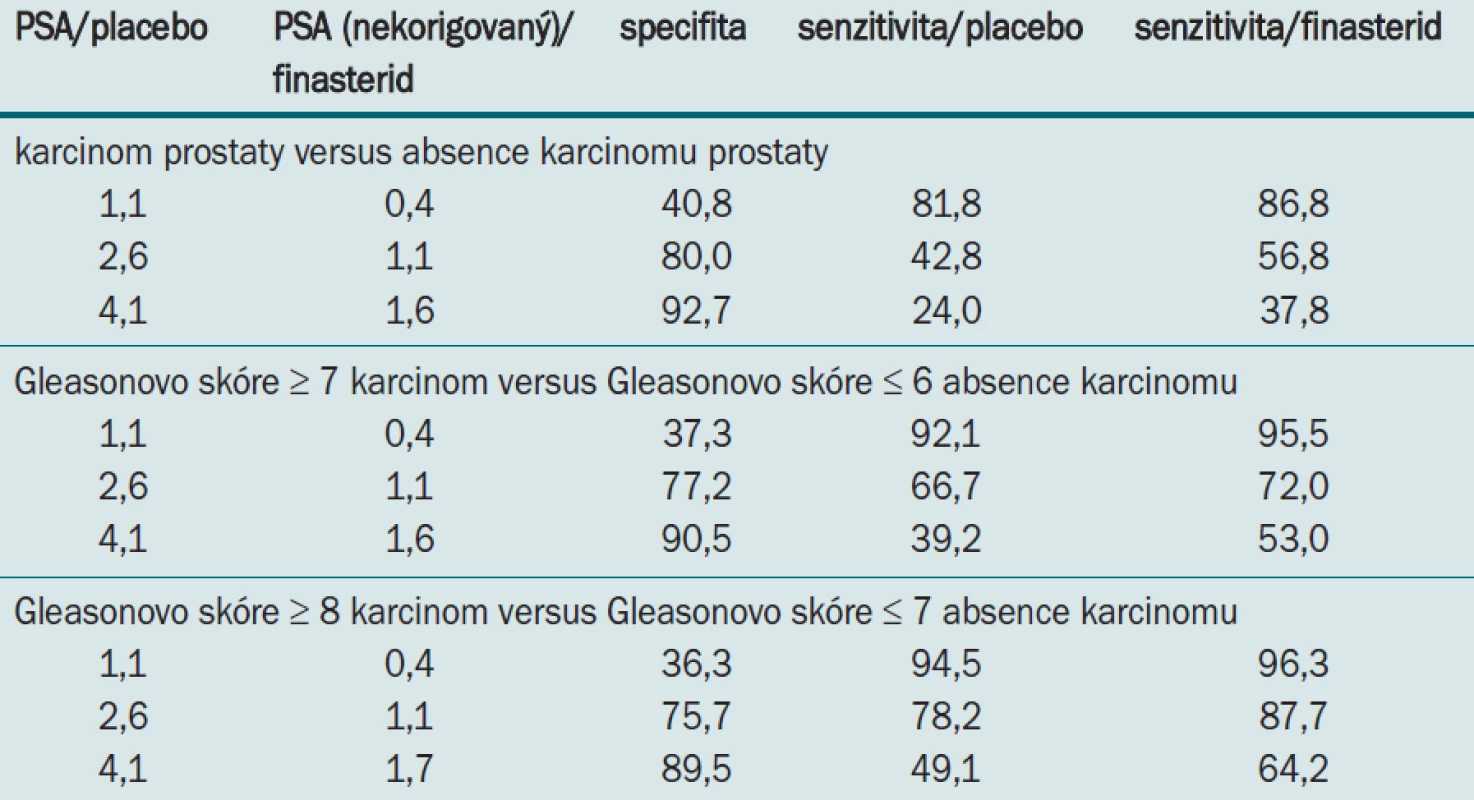
Dopad finasteridu na výstup digitálního rektálního vyšetření
Po zjištění, že u mužů podstupujících biopsii indikovanou na základě DRE a biopsii prostaty indikovanou na základě PSA existuje primární rozdíl v míře detekce HG tumoru, jsme se zabývali další otázkou předpojaté chyby týkající se indikace vedoucí k provádění biopsie: Ovlivňuje finasterid výstup DRE? Odpověď zní: zřejmě ano.
Zkoumali jsme sensitivitu a specifitu DRE u subjektů zahrnutých do PCPT, kteří měli PSA a DRE v průběhu jednoho roku od provedení biopsie a kteří v době biopsie podstupovali léčbu (finasterid nebo placebo). Z 9 423 mužů ve skupině užívající finasterid splňovalo 4 579 mužů požadavky nezbytné pro zahrnutí do studie. Ve skupině užívající placebo splňovalo daná kritéria 5 112 mužů z celkových 9 459. U 695 mužů ve skupině užívajících finasterid byl detekován karcinom (264 tumorů s Gleasonovým skóre 7 nebo vyšším, 81 s Gleasonovým skóre 8 nebo vyšším). Ve skupině užívající placebo byl karcinom detekován u 1 111 mužů (240 tumorů s Gleasonovým skóre 7 nebo vyšším, 55 s Gleasonovým skóre 8 nebo vyšším). Tab. 4 ukazuje senzitivitu a specifitu digitálního rektálního vyšetření prováděného z důvodu detekce karcinomu a detekce HG onemocnění. Jak si můžete povšimnout, finasterid signifikantně zvyšuje senzitivitu detekce karcinomu při DRE bez jakékoliv změny specifity (tj. bez zvýšení počtu negativních biopsií). Zvýšení senzitivity u tumorů vyššího grade provází celkovou detekci karcinomu, nedosahuje však statistického významu, pravděpodobně vzhledem k malému počtu tumorů vyššího grade detekovaných v obou skupinách.
Tab. 4. Senzitivita a specifita digitálního rektálního vyšetření prováděného z důvodu detekce karcinomu a detekce HG onemocnění. 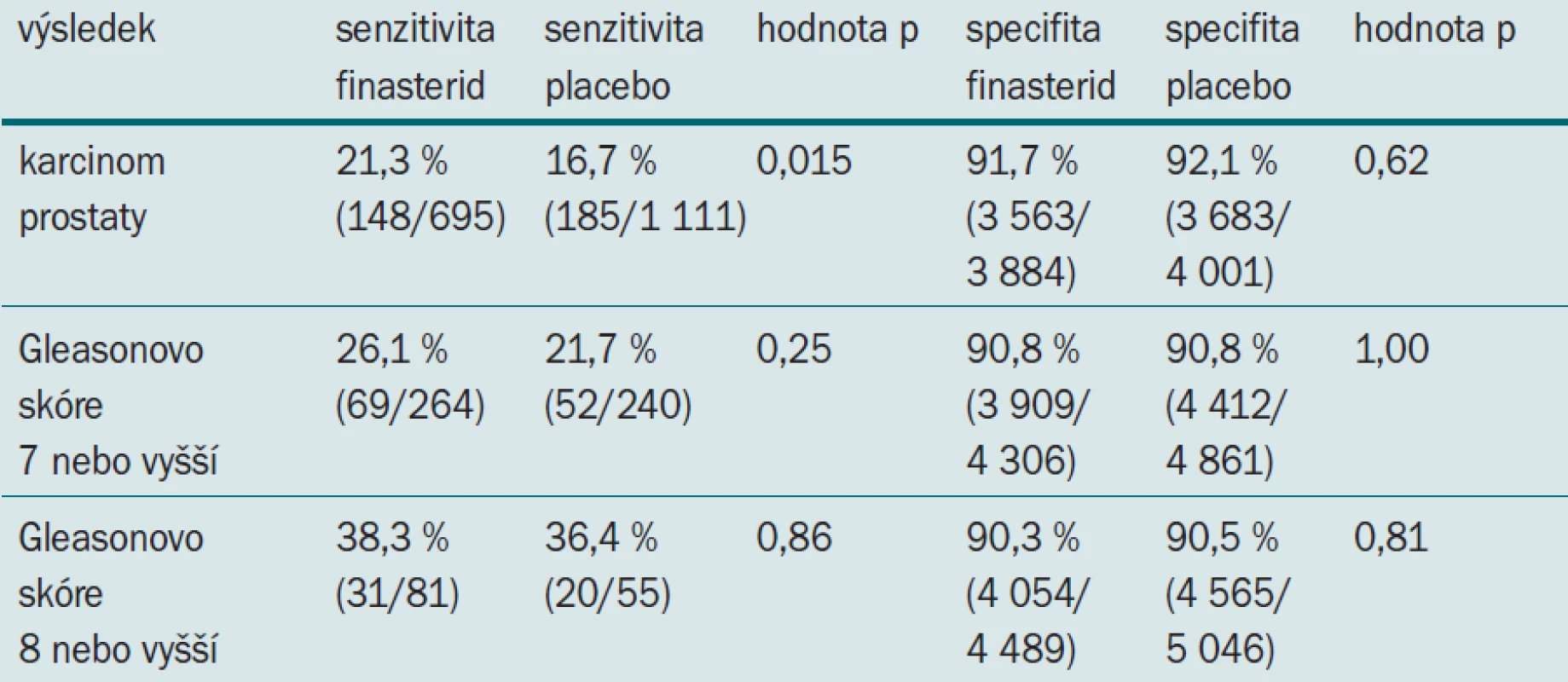
Jaký je význam těchto údajů?
Vzhledem k velmi komplikovaným předpojatým chybám při detekci karcinomu prostaty a HG onemocnění v PCPT je velmi obtížné s jistotou určit, zda došlo k posunu grade. Jak již bylo uvedeno na počátku této kapitoly tato studie nebyla konstruována tak, aby na tuto otázku mohla odpovědět. Výše uvedené důkazy prokazující předpojatou chybu při detekci závislé na objemu prostaty (vyšší pravděpodobnost detekce HG karcinomu v menší žláze léčené finasteridem) a lepší funkci PSA sloužícího jako test pro detekci HG karcinomu (u většího počtu případů zvýšení hladiny PSA byl ve skupině léčené finasteridem detekován karcinom nebo HG karcinom, neě tomu bylo ve skupině léčené placebem) zvyšují pravděpodobnost detekce HG karcinomu. Protikladem je zjištění, že pacientovi užívajícímu placebo (analogicky k případům, kdy je pacientovo PSA sledováno každoročně a jehož hodnoty jsou současně přítomnou BPH zastřeny a jehož výsledky biopsie nejsou při současném odběru vzorků zcela průkazné) hrozí riziko, že u něj bude přehlédnuto HG onemocnění a tedy i šance na vyléčení.
Naše skupina očekává analýzu těchto předpojatých chyb, jež umožní odhadnutí přibližného počtu karcinomů — nižšího i vyššího grade, jejichž vzniku lze předejít léčbou finasteridem. Tyto údaje by však prokazovaly, že aplikaci finasteridu lze považovat za intervenci s minimální morbiditou, dalšími výhodami GU a jasnými důkazy snížení výskytu onemocnění. Vedle velmi malého počtu klinických studií poskytujících důkaz účinnosti u karcinomu prostaty představuje tato modalita vynikající pokrok při kontrole tohoto onemocnění.
Další probíhající studie zabývající se prevencí karcinomu
Dvěma nejslibnějšími agens, které mohou najít uplatnění při prevenci karcinomu prostaty, jsou alfa tokoferol (vitamin E) a selen. Existuje poměrně obsáhlé množství informací týkajících se vlastností těchto 2 agens, které, stejně jako studie III. fáze zkoumající prevenci karcinomu, prokázaly, že jejich aplikace vede ke snížení rizika vzniku karcinomu prostaty. (Přestože obě studie prokázaly snížení rizika, je spolehlivost těchto důkazů nejistá, vzhledem k tomu, že žádná ze studií nebyla zaměřena přímo na karcinom prostaty) [53,54]. Oba preparáty jsou v současné době testovány ve studii „Selenium and Vitamin E Cancer Prevention Trial“ (SELECT) pod záštitou National Cancer Institute.
Toremifen je selektivní modulátor estrogenního receptoru (SERM), u něhož bylo na modelu myši prokázáno, že způsobuje prostřednictvím neandrogenní dráhy snížení prevalence karcinomu prostaty [55]. V malé studii III. fáze zahrnující 514 mužů s HG prostatickou intraepiteliální neoplázií randomizovaných k aplikaci 20, 40 nebo 60 mg/den toremifenu bylo při aplikaci dávky 20 mg zaznamenáno (po 12 měsících sledování) 48% snížení rizika karcinomu prostaty [56]. Údaje této studie podnítily zahájení v současné době probíhající studie III. fáze.
Dutasterid je silný inhibitor 5-alfa — reduktázy. Tento preparát sniěuje PSA v průběhu 1 roku o 50 % a v průběhu 4 let přibliěně o 65 %. Význam aplikace dutasteridu při prevenci karcinomu prostaty spočívá ve vysoké expresi obou izoforem 5-alfa—reduktázy u karcinomu prostaty. Zajímavým faktem je, že izoforma 2. typu je mnohem více uplatňována u BPH než izoforma typu 1. Jinými slovy, nadměrná exprese izoformy typu 1 u karcinomu versus benignímu epitelu je mnohem vyšší než exprese typu 2. Na zvířecím modelu krysy u xenograftu karcinomu prostaty R3327-H způsobuje finasterid mírné zpomalení růstu tumoru, zatímco u zvířat léčených pomocí dutasteridu došlo k mnohem větší inhibici růstu tumoru [57]. Do klinické studie REDUCE bylo zahrnuto 8 000 mužů z celého světa, očekává se, že studii dokončí přibližně 6 000 mužů. Všichni muži jsou ve věku 50—75 let, v průběhu 6měsíční randomizace podstoupili 1 biopsii prostaty s negativním výsledkem a hodnota PSA se pohybuje v rozmezí 2,5—10 ng/ml. Po období 1 měsíce užívání placeba muži v průběhu dalších 4 let podstoupí 2 plánované biopsie — po 2 a 4 letech. Výsledky této studie budou brzy k dispozici.
Druhá studie zkoumající účinek dutasteridu testuje, zda lze tento preparát užít přímo k léčbě karcinomu prostaty. Tato studie, nazývaná „REduction by Dutasterid of clinical progression Events in Expectant Management of prostate cancer“ (REDEEM) je multicentrická, randomizovaná, placebem kontrolovaná studie, která zahrnuje 300 mužů s karcinomem prostaty randomizovaných k aplikaci dutasteridu nebo placeba, u nichž je následně provedena biopsie po 1,5 a 3 letech. Primární cíle studie zahrnují stanovení doby do progrese onemocnění (primárního), doby do zahájení primární terapie, doby do patologické progrese, změn souvisejících s úzkostí pacienta spojenou s onemocněním, diagnostiku karcinomu prostaty při opakovaném provádění biopsie, změnu Gleasonova skóre a změnu klinického stadia.
Další preparáty a prevence karcinomu prostaty
Lykopen
V epidemiologických studiích bylo prokázáno, že karotenoid lykopen, který je obsažen zejména v produktech vyráběných z rajčat, sniěuje riziko vzniku karcinomu prostaty. Výsledky jednotlivých studií se různí, některé uvádějí aě 40% snížení rizika, jiné neprokazují žádný pokles [58]. V nedávné době provedená studie „Prostate, Lung, Colorectal and Ovarian Screening Trial“ zkoumající riziko vzniku karcinomu prostaty hypotézu, že by vyšší konzumace produktů obsahujících lykopen/rajčata sloužila jako prevence vzniku karcinomu prostaty, nepotvrdila [59].
Rostlinné estrogeny
Sojový bob představuje koncentrovaný zdroj izoflavonů, které mají slabý estrogenní účinek. Epidemiologické údaje prokazují, že vyšší konzumace tofu vede u Japonců ke snížení rizika vzniku karcinomu prostaty [60]. Velká mezinárodní studie zabývající se mortalitou karcinomu prostaty podporuje hypotézu, že obiloviny, cereálie a ořechy mají protektivní účinek proti vzniku karcinomu prostaty [61]. Bylo zjištěno, že některé látky obsažené v sóje (genistein a daidzein) způsobují inhibici buněk karcinomu prostaty in vitro [62,63].
Vitamin D
Schwartz a Hulka vyslovili domněnku, že nízká hladina vitaminu D zvyšuje riziko vzniku karcinomu prostaty [64]. Tato hypotéza vychází ze zjištění, že míra mortality na karcinom prostaty v USA nepřímo souvisí s vystavením ultrafialovému záření. Bylo prokázáno, že vitamin D může vyvolávat zástavu buněčného cyklu a spouštět antiproliferativní účinek [65]. Nízká hladina vitaminu D souvisí u mužů se zvýšenou incidencí karcinomu (zejména u gastrointestinálních tumorů). Je možné, že pro adekvátní zvýšení hladiny 25(OH)D v séru by byla nutná suplementace vysokých dávek vitaminu D. Před bezpečným zahájením klinických studií je třeba vyřešit hyperkalcemický účinek vitaminu D. Tomuto riziku lze předejít při užívání analogů vitaminu D [67].
Snížená konzumace červeného masa
Je možné, že existuje určitá souvislost mezi vyšší konzumací zvířecích tuků a rizikem vzniku karcinomu prostaty [68]. Bylo zjištěno, že strava obyvatel západního světa zvyšuje hladinu androgenů v séru, tento mechanizmus však doposud nebyl dostatečně objasněn [69]. Ve studiích založených na populaci je obtížné eliminovat ostatní příčiny. Je možné, že konzumace tuků může přestavovat marker pro jiný etiologický faktor přímo související s rizikem [70].
Nesteroidní protizánětlivé medikamenty (NSAID)
NSAID souvisí až s 39% snížením rizika vzniku karcinomu prostaty a jsou považovány za slibný preparát pro chemoprevenci [71,72]. Bylo prokázáno, že NSAID a inhibitory COX-2 vyvolávají apoptózu buněk karcinomu prostaty [73]. Při aplikaci NSAIDS ve studiích zaměřených na prevenci je třeba vzít v úvahu komplikace spojené s krvácením, neurologickými onemocněními, vznikem dalších karcinomů a kardiovaskulárních onemocnění [74]. Z důvodu rizika vzniku kardiovaskulárních onemocnění při aplikaci NSAIDS nebudou pravděpodobně v dalších studiích testovány [75].
Doporučení pro prevenci karcinomu prostaty
V současné době představuje jedinou prokázanou metodu umožňující snížení rizika karcinomu prostaty aplikace finasteridu. Počáteční studie i současné rozbory prokazují, že aplikace finasteridu umožňuje minimálně 24,8% snížení rizika. Vzhledem ke zlepšení senzitivity PSA a DRE a lepším výsledkům biopsie prostaty v menší žláze může být skutečné snížení rizika ještě významnější. Největší účinek byl prokázán u onemocnění s nižším grade. Počáteční zvýšení incidence HG onemocnění je pravděpodobně způsobeno částečně také těmito faktory (PSA, DRE a provádění biopsie při medikaci finasteridem). Další komplexní hodnocení musí brát v potaz všechny tyto faktory a odhadnout „skutečnou“ míru HG onemocnění. Výskyt vedlejších účinků zahrnující sexuální dysfunkci není významný. Benefit aplikace finasteridu při léčbě symptomů dolních cest močových může být dalším podnětem pro doporučení terapie finasteridem u těchto mužů. Při aplikaci finasteridu v rámci preventivní terapie je třeba brát v potaz následující upozornění: 1. účinek finasteridu byl prokázán pouze u mužů podstupujících pravidelné měření hladiny PSA a vyšetření DRE, 2. prokázaný účinek představuje snížení rizika při diagnostice (a následné léčbě), vliv aplikace finasteridu na mortalitu a další aspekty nejsou známy, 3. studie zahrnovala terapii trvající pouze po dobu 7 let, doposud není známo, zda je tato doba dostatečná, nebo zda by měla léčba trvat po delší dobu.
Co se týče ostatních preparátů, které by mohly mít potenciální účinek při prevenci, nemáme k dispozici dostatečné množství údajů. Pro stanovení skutečného benefitu a s ním spojených rizik je nutné provedení větších a dlouhodobých klinických studií. V praxi musí být tyto preparáty aplikovány většímu počtu mužů, kteří nemusí nikdy pociťovat žádný benefit léčby. I malé riziko ovlivňuje rozhodnutí, zda má daná léčba skutečný benefit. Z tohoto důvodu je nutné důkladně zvážit doporučení preparátů, které nejsou spojeny s „žádným rizikem“, neboť bez provedení velkých studií, které umožňují pečlivé monitorování výskytu komplikací a dalších onemocnění, není skutečná míra těchto potencionálních poškození známa.
Ian M. Thompson, MD
Department of Urology, The University of Texas Health Science Center, San Antonio, USA
Zdroje
1. Jemal A, Murray T, Ward E et al. Cancer statistics 2005. CA Cancer J Clin 2005; 55(1): 10-30.
2. Thompson IM, Goodman PJ, Tangen CM et al. The influence of finastcridc on the development of prostate cancer. N Engl J Med 2003; 349(3): 215-224.
3. Steers WU. 5a1pha-reductase activity in the prostate. Urology 2001; 58(6 Suppl 1): 17-24.
4. Andriole G, Bruchovsky N, Chung LW et al. Dihydrotestosterone and the prostate: the scientific rationale for 5alpha-reductase inhibitors in the treatment of benign prostatic hyperplasia. J Urol 2004; 172(4 Pt 1):1399-1403.
5. Walsh PC, Madden JD, Harrod MJ et al. Familial incomplete male pseudohermaphroditism, type 2. Decreased dihydrotestosterone formation in psendovaginal perineoscrotal hypospadias. N Engl J Med 1974; 291(18): 944-949.
6. Iniperato-McGinley J, Zhu YS. Androgens and male physiology the syndrome of 5alpha-reductase-2 deficiency. Mol Cell Endocrinol 2002; 198(1-2): 51-59.
7. Imperato-McGinley J, Gautier T, Zirinsky K et al. Prostate visualization studies in males homozygous and heterozygous for 5 alpha-reductase deficiency. J Clin Endocrinol Metab 1992; 75(4): 1022-1026.
8. Wilson JD, Roehrbom C. Long-term consequences of castration in men lessons from the Skoptzy and the eunuchs of the Chinese and Ottoman coints. J Clin Endocrinol Metab 1999; 84(12): 4324-4331.
9. Wu AH, Whittemore AS, Kolonel LN et al. Serum androgens and sex hormonebinding globulins in relation to lifestyle factors in older African-American, white, and Asian men in the United States and Canada. Cancer Epidcmiol Biomarkers Prev 1995; 4(7): 735-741.
10. Hsing AW, Tsao L. Devesa SS. International trends and patterns of prostate cancer incidence and mortality. Int J Cancer 2000; 85(1): 60-67.
11. Gann PH, Hennekens CH, Ma J, Longcope C, Stampfer MJ. Prospective study of sex hormone levels and risk of prostate cancer. Journal of the National Cancer Institute 1996; 88(16): 1118-1126.
12. Stattin P, Lumtne S, Tenkancn L et al. High levels of circulating testosterone are not associated with increased prostate cancer risk: a pooled prospective study. Int J Cancer 2004; 108(3): 418-424.
13. Chen C, Weiss NS, Stanczyk FZ et al. Endogenous sex hormones and prostate cancer risk a case control study nested within the Carotene and Retinol Efficacy Trial. Cancer Epidemiol Biomarkers Prev 2003; 12(12): 1410-1416.
14. Kaaks R, Lukanova A, Rinaldi S et al. Interrelationships between plasma testosterone, SHBG, IGF-1, insulin and leptin in prostate cancer cases and controls. Eur J Cancer Prev 2003; 12(4): 309-315.
15. Heikkila R, Aho K, Heliovaara M et al. Scrum testosterone and sex hormone-binding globulin concentrations and the risk of prostate carcinoma; a longitudinal study. Cancer 1999; 86(2): 312-315.
16. Eaton NE, Reeves GK, Appleby PN, Key TJ. Endogenous sex hormones and prostate cancer: a quantitative review of prospective studies. Br J Cancer 1999; 80(7): 930-934.
17. Anonymous. Physician‘s Dcsk Reference. 60th ed. Montvale. NJ: Thompson PDR 2006.
18. Rittrnaster RS. Finasteride. N Engl J Med 1994; 330(2):120-125.
19. Gormley GJ. Finasteride: a clinical review. Biomed Pharmacother 1995; 49(7-8): 319-324.
20. Rhoden EL, Morgentaler A. Risks of testosterone-replacement therapy and recommendations for monitoring. N Engl J Med 2004; 350(5): 482-492.
21. Foley CL, Kirby RS. 5 alpha-reductase inhibitors: what‘s new? Curr Opin Urol 2003; 13(1): 31-37.
22. Geller J. Effect of finasteride, a 5 alpha-reductase inhibitor on prostate tissue androgens and prostate-specific antigen. J Clin Endocrinol Metab 1990; 71(6): 1552-1555.
23. McConnell JD, Wilson JD, George FW et al. Finasteride, an inhibitor of 5 alpha-reductase, suppresses prostatic dihydrotestosterone in men with benign prostatic hyperplasia. J Clin Endocrinol Metab 1992; 74(3): 505-508.
24. Gormley GJ, Stoner E, Bruskewitz RC et al. The effect of finasteride in men with benign prostatic hyperplasia. The Finasteride Study Group. N Eng1 J Med 1992; 327(17): 1185-1191.
25. Bowman CJ, Barlow NJ, Turner KJ, Wallace DG, Foster PM. Effects of in utero exposure to finasteride on androgen-dependent reproductive development in the male rat. Toxicol Sci 2003; 74(2): 393-406.
26. Prahalada S, Tarantal AF, Harris GS et al. Effects of finasteride, a type 2 5-alpha reductase inhibitor, on fetal development in the rhesus monkey (Macaca mulatta). Teratology 1997; 55(2): 119-131.
27. Clark RL, Antonello JM, Grossman SJ et al. External genitalia abnormalities in male rats exposed in utero to finasteridc, a 5 alpha-reductase inhibitor. Teratology 1990; 42(1): 91-100.
28. Wessells H, Roy J, Bannow J et al. Incidence and severity of sexual adverse experiences in finasteride and placebo-treated men with benign prostatic hyperplasia. Urology 2003; 61(3): 579-84.
29. McConnell JD, Roehrborn CG, Bautista OM et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N EngI J Med 2003; 349(25): 2387-2398.
30. Rhoden EL, Gobbi D, Menti E, Rhoden C, Teloken C. Effects of the chronic use of finasteride on testicular weight and spermatogenesis in Wistar rats. BJU Int 2002; 89(9): 961-963.
31. Cukierski MA, Sina JL, Prahalada S et al. Decreased fertility in male rats administered the 5 alpha-reductase inhibitor, finasteride, is due to deficits in copulatory plug formation. Reprod Toxicol 1991; 5(4): 353-362.
32. Wise LD, Minsker DH, Cukicrski MA et al. Reversible decreases of fertility in male Sprague-Dawley rats treated orally with finasteride, a 5 alpha-reductase inhibitor. Reprod Toxicol 1991; 5(4): 337-346.
33. Iguer-Ouada M, Verstegen JP. Effect of finasteride (Prosear MSD) on seminal composition, prostate function and fertility in male dogs. J Reprod Fertil Suppl 1997; 51 : 139-149.
34. De Marzo AM, Meeker AK, Zha S et al. Human prostate cancer precursors and pathobiology. Urology 2003; 62(5 Suppl I): 55-62.
35. Marks LS, Partin AW, Dorey FJ et al. Long-term effects of finasteride on prostate tissue composition. Urology 1999; 53(3): 574-580.
36. Rittmaster RS, Norman RW, Thomas LN, Rowden G. Evidence for atrophy and apoptosis in the prostates of men given finasteride. J Clin Endocrinol Metab 1996; 81(2): 814-819.
37. Rochrborn CG, Marks LS, Fenter T, et al. Efficacy and safety of dutasteride in the four-year treatment of men with benign prostatic hyperplasia. Urology 2004; 63(4): 709-715.
38. Pannek J, Marks LS, Pearson JD et al. Influence of finasteride on free and total serum prostate specific antigen levels in men with benign prostatic hyperplasia. J Urol 1998; 159(2): 449-453.
39. Oesterling JE, Roy J. Agha A et al. Biologic variability of prostate-specific antigen and its usefulness as a marker for prostate cancer, effects of finasteride. The Finasteride PSA Study Group. Urology 1997; 50(1): 13-18.
40. Wang LG, Liu XM, Kreis W, Budman DR. Down-regulation of prostate-specific antigen expression by finasteride through inhibition of complex formation between androgen receptor and steroid receptor-binding consensus in the promoter of the PSA gene in LNCaP cells. Cancer Res 1997; 57(4): 714-719.
41. Etzioni RD, Howlader N, Shaw PA et al. Long-term effects of finasteride on prostate specific antigen levels; results from the prostate cancer prevention trial. J Urol 2005; 174(3): 877-881.
42. Feigl P, Blurnenstein B. Thompson I et al. Design of the Prostate Cancer Prevention Trial (PCPT). Control Clin Trials 1995; 16(3): 150-163.
43. Unger JM, LeBlanc M, Thompson IM, Coltman CA Jr. The person-years saved model and other methodologies for assessing the population impact of cancer-prevention strategies. Urol Oncol 2004; 22(4): 362-368.
44. Lotan Y, Cadeddu JA, Lee JJ, Roehrborn CG, Lippman SM. Implications of the prostate cancer prevention trial: a decision analysis model of survival outcomes. J Clin Oncol 2005; 23(9): 1911-1920.
45. Zeliadt SB, Etzioni RD, Penson DF, Thompson IM, Ramsey SD. Lifetime implichtions and cost-effectiveness of using finasteride to prevent prostate cancer. Am J Med 2005; 118(8): 850-857.
46. Makridakis NM, Reichardt JK. Molecular epidemiology of androgen-metabolic loci in prostate cancer: predisposition and progression. J Urol 2004; 171(2 Pt 2): S25-8; discussion S8-9.
47. Makridakis NM, Ross RK, Pike MC et al. Association of mis-sense substitution in SRD5A2 gene with prostate cancer in African-American and Hispanic men in Los Angeles, USA. Lancet 1999; 354(9183): 975-978.
48. Jaffe JM, Malkowicz SB, Walker AH et al. Association of SRD5A2 genotype and pathological characteristics of prostate tumors. Cancer Res 2000; 60(6): 1626-1630.
49. Makridakis NM, di Salle E, Reichardt JK. Biochemical and pharmacogenetic dissection of human steroid 5 alpha-reductase type 11. Phannacngenetics 2000; 10(5): 407-413.
50. Andriole G, Bostwick D, Brawley O et al. Chemoprevention of prostate cancer in men at high risk: rationale and design of the reduction by dutasteride of prostate cancer events (REDUCE) trial. J Urol 2004; 172(4 Pt 1): 1314-1317.
51. Thompson IM, Pauler DK, Goodman PJ et al. Prevalence of prostate cancer among men with a prostate-specific antigen level < or = 4.0 ng per milliliter. N Engl J Mod 2004; 350(22): 2239-2246.
52. Kulkartti GS, Al-Azab R, Lockwood G et al. Evidence for a biopsy derived grade artifact among larger prostate glands. J Urol 2006; 175 : 505-509.
53. Duffield-Lillico AJ, Dalkin BL, Reid ME, Turnbull BW, Slate EH, Jacobs ET et al. Selenium supplementation, baseline plasma selenium status and incidence of prostate cancer: an analysis of the complete treatment period of the Nutritional Prevention of Cancer Trial. BJU Int 2003; 91 : 608-612.
54. Heinonen OP, Albums D, Virtamo J et al. Prostate cancer and supplementation with alpha-tocopherol and beta-carotene: incidence and mortality in a controlled trial. J Nat Cancer Inst 1998; 90 : 440-446.
55. Raghow S, Hooshdaran MZ, Katiyar S, Steiner MS. Toremifene prevents prostate canter in the transgenic adcnocarcinoma of mouse prostate model. Cancer Res 2002; 62 : 1370-1376.
56. Price D, Stein B, Sieber P et al. Toremifene for the prevention of prostare cancer in men with high grade prostatic intraepithelial neoplasia: results of a double-blind, placebo controlled, phase DB clinical trial. J Urol 2006; 176; 965-970.
57. Xu Y, Dalrymple S, Becker R, Isaacs JT. Pharmacologic basis for dutasteride‘s enhanced efficacy against prostatic cancers. Clin Cancer Res 2006; 12 : 4072-4079.
58. Giovannucci E. A review of epidemiologic studies of tomatoes, lycopene, and prostate cancer. Exp Biol Med 2002; 227 : 852.
59. Kirsh VA, Mayne ST, Peters U et al. A prospective study of lycopene and tomato product intake and risk of prostate cancer. Cancer Epidemiol Biomarkers Prev 2006; 15 : 92.
60. Severson RK, Nomura AM, Grove JS et al. A prospective study of demographics, diet, and prostate cancer among men of Japanese ancestry in Hawaii. Cancer Res 1989; 49 : 1857.
61. Hebert JR, Hurley TG, Olendzid BC et al. Nutritional and socioeconomic factors in relation to prostate cancer mortality: a cross-national study. J Nat Cancer Inst 1998; 90 : 1637.
62. Yu L, Blackburn GL, Zhou JR. Genistein and daidzein downrcgulate prostate androgen-regulated transcript-1 (PART-1) gene expression induced by dihydrotestosterone in human prostate LNCaP cancer cells. J Nutr 2003; 133 : 389.
63. Santibanez JF, Navarro A, Martinez J. Genistein inhibits proliferation and in vitro invasive potential of human prostatic cancer cell lines. Anticancer Res 1997; 17 : 1199.
64. Schwartz GG, Hulka BS. Is vitamin D deficiency a risk factor for prostate cancer? (Hypothesis). Anticancer Res 1990; 10 : 1307.
65. Konery BR, Johnson CS, Trump DL et al. Vitamin D in the prevention and treatment of prostate cancer. Semin Urol 1999; 17 : 77.
66. Giovannucci E, Liu Y, Rimm EB et al. Prospective study of predictors of vitamin D status and cancer incidence and mortality in men. J Nat Cancer Inst 2006; 98 : 451.
67. Khan MA, Partin AW. Vitamin D for the management of prostate cancer. Rev Urol 2004; 6 : 95.
68. Kolonel LN, Nomura AM, Hinds MW el al. Role of diet in cancer incidence in Hawaii. Cancer Res 1983; 43 : 2397.
69. Hayes RB, Ziegler RG, Gridley G et al. Dietary Electors and risks for prostate cancer among blacks and whites in the United States. Cancer Epidemiol Biomarkers Prev 1999; 8 : 25.
70. Brawley OW. The potential for prostate cancer chemoprevention. Rev Urol 2000; 4(Suppl 5): S11.
71. Harris RE, Beebe-Donk J, Doss H et al. Aspirin, ibuprofen, and other non-steroidal anti-inflammatory drugs in canter prevention: a critical review ofnon-selective COX-2 blockade. Oncol Rep 2005; 13 : 559.
72. Basler JW, Piazza GA. Nonsteroidal anti-inflammatory drugs and cyclooxygenase-2 selective inhibitors for prostate cancer chernoprovention. J Urol 2004; 171: S59.
73. Andrews J, Djakiew D, Krygier S et al. Superior effectiveness of ibuprofen compared with other NSAIDs for reducing the survival of human prostate cancer cells. Cancer Chemother Pharmacol; 2000; 50 : 277.
74. Chan JM, Feraco A, Shuman M et al. The epidemiology of prostate cancer with a focus on nonsteroidal anti-inflammatory drugs. Hematology. Hematol Oncol Clin North Am 2006; 20 : 797.
75. Eresalier RS, Sandler RS, Quan H et al. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N Engl J Med 2005; 35 : 1092.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2007 Číslo 4- Infekce močových cest u dospělých – mezery v současných guidelines a doporučení pro klinickou praxi
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Význam monitorování hladiny anti-Xa u pacientů užívajících profylaktické dávky enoxaparinu − série kazuistik
-
Všechny články tohoto čísla
- Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
- Guidelines EAU pro diagnostiku, léčbu a sledování renálního karcinomu
- Kvíz
- Prevence karcinomu prostaty
- Transrektální ultrazvukem vedené biopsie prostaty
- Role operačního řešení při léčbě lokálně pokročilého karcinomu prostaty
- Možnosti chemoterapie u pacientů s karcinomem prostaty refrakterním na hormonální léčbu
- Editorial
- Co na publikované články říká profesor Patrik C. Walsh?
- EPCA a EPCA-2 jako potencionální biomarkery karcinomu prostaty
- Přednáška Patricka C. Walshe, MD, u příležitosti udělení doktorátu honoris causa Masarykovou univerzitou
- Patrick Craig Walsh Doctor Honoris Causa Universitatis Masarykianae Brunensis
- Klinické projevy, symptomy a prognostické faktory renálního karcinomu
- Paralýza signální dráhy: identifikace nových terapeutických cílů u renálního karcinomu
- Současné možnosti provedení nefroureterektomie
- Ze zahraničních periodik
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
- Transrektální ultrazvukem vedené biopsie prostaty
- Současné možnosti provedení nefroureterektomie
- Role operačního řešení při léčbě lokálně pokročilého karcinomu prostaty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



