-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH A POHLAVNÍCH CEST U MUŽŮ 2. ČÁST
Autoři: K. G. Naber; B. Bergman; M. C. Bishop; T. E. Bjerklund Johansen; H. Botto; B. Lobel; F. Jimenez Cruz; F. P. Selvaggi
Vyšlo v časopise: Urol List 2006; 4(2): 71-96
Kategorie: Guidelines
OBSAH
- Syndrom sepse v urologii (urosepse) 72
- 6.1 Souhrn 72
- 6.2 Úvod 73
- 6.3 Definice a klinická manifestace syndromu sepse v urologii 73
- 6.4 Fyziologie a biochemické markery 73
-
- 6.4.1 Cytokiny jako markery septické odpovědi 73
- 6.4.2 Prokalcitonin je potencionálním markerem sepse 74
- 6.5 Prevence 74
-
- 6.5.1 ‑Preventivní opatření prokázané nebo pravděpodobné účinnosti 74
- 6.5.2 Vhodná peroperační antimikrobiální profylaxe 74
- 6.5.3 Preventivní opatření diskutabilní účinnosti 74
- 6.5.4 Neefektivní nebo kontraproduktivní opatření 74
- 6.6 Léčba současně přítomného onemocnění 74
-
- 6.6.1 Doplňková opatření 74
- 6.7 Závěr 74
- 6.8 Literatura 74
- URETRITIDA 75
- 7.1 Definice 75
- 7.2 Epidemiologie 75
- 7.3 Patogeny 75
- 7.4 Cesta infekce a patogeneze 75
- 7.5 Klinický průběh 75
- 7.6 Diagnóza 75
- 7.7 Terapie 75
- 7.8 Prevence 75
- 7.9 Literatura 75
- PROSTATITIDA, EPIDIDYMITIDA A ORCHITIDA 76
- 8.1 Souhrn 76
- 8.2 Prostatitida 76
- 8.2.1 Úvod 76
- 8.2.2 Systémy klasifikace 76
- 8.2.3 Diagnóza 76
- 8.2.4 Léčba 78
- 8.3 Epididymitida a orchitida 79
- 8.3.1 Epidemiologie 79
- 8.3.2 Morbidita 79
- 8.3.3 Patogeneze a patologie 79
- 8.3.4 Klinické znaky 79
- 8.3.5 Diferenciální diagnóza 79
- 8.3.6 Léčba 79
- 8.4 Literatura 80
- Peroperační antibakteriální profylaxe v urologii 80
- 9.1 Souhrn 80
- 9.2 Úvod 81
- 9.3 Cíle peroperační antibakteriální profylaxe 81
- 9.4 Indikace pro peroperační antibakteriální profylaxi 81
- 9.5 Načasování a trvání peroperační antibakteriální profylaxe 82
- 9.6 Výběr antibiotik 82
- 9.7 Způsob aplikace 82
- 9.8 Doporučení dle druhu urologické intervence 82
- 9.8.1 Urologické operace zahrnující části střeva 82
- 9.8.2 Urologické operace bez střevních segmentů 83
- 9.8.3 Urologické operace mimo močové cesty 83
- 9.8.4 Endourologické operace 83
- 9.8.5 Diagnostické urologické intervence 83
- 9.8.6 Pooperační drenáž močových cest 83
- 9.9 Farmakoekonomika 83
- 9.10 Literatura 83
- SEXUÁLNĚ PŘENOSNÁ ONEMOCNĚNÍ 84
- 10.1 Úvod 84
- 10.2 Definice a klasifikace 84
- 10.3 Zobrazovací vyšetření sexuálně přenosných onemocnění 84
- 10.4 Bakteriální pohlavní onemocnění 84
- 10.4.1 Syfilis 84
- 10.4.2 Gonorea 87
- 10.4.3 Šankroid 87
- 10.4.4 Granuloma inguinale 87
- 10.4.5 Lymfogranuloma venereum 87
- 10.4.6 ‑Chlamydiová, mykoplazmatická a ureaplazmatická uretritida 87
- 10.4.7 Jiné bakteriální a kvasinkové pohlavní nemoci 87
- 10.5 Virové pohlavní nemoci 87
- 10.5.1 Léze spojené s HPV 87
- 10.5.2 Genitální herpes 87
- 10.5.3 Molluscum contagiosum 87
- 10.6 Pohlavní nemoci způsobené protozoy a epizoy 87
- 10.6.1 Trichomoniáza 87
- 10.6.2 Pediculosis pubis 87
- 10.6.3 Scabies 89
- 10.7 Literatura 89
- DODATKY 89
- 11.1 Kritéria pro určení diagnózy infekce močových cest (modifikováno dle IDSA/ESCMID guidelines [1,2,3]) 89
- 11.2 Doporučení pro antimikrobiální terapii v urologii (modifikováno dle [1]) 89
- 11.3 Doporučení pro peroperační antibakteriální profylaxi v urologii (modifikováno dle [1]) 90
- 11.3.1 Literatura 90
- 11.4 Antibakteriální preparáty 90
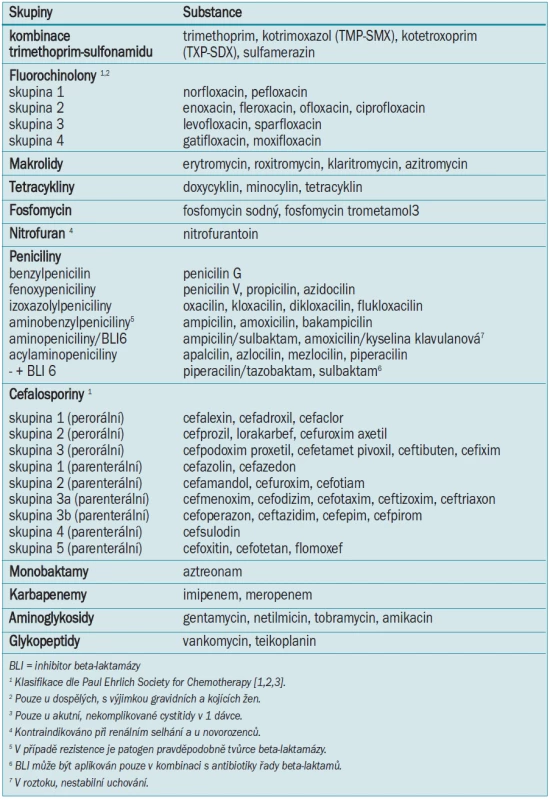
- 11.4.1 Peniciliny 90
- 11.4.2 Parenterální cefalosporiny 92
- 11.4.3 Perorální cefalosporiny 92
- 11.4.4 Monobaktamy 93
- 11.4.5 Karbapenemy 93
- 11.4.6 Fluorochinolony 93
- 11.4.7 Makrolidy 94
- 11.4.8 Tetracykliny 94
- 11.4.9 Aminoglykosidy 94
- 11.4.10 Glykopeptidy 94
- 11.4.11 Literatura 96
- 11.5 Bakterie relevantní pro urologické infekce 96
- ZKRATKY POUŽITÉ V TEXTU 96
6. SYNDROM SEPSE V UROLOGII (UROSEPSE)
6.1 Souhrn
Pacienti s urosepsí by měli být diagnostikováni v časném stadiu, zejména v případě komplikované infekce močových cest. Systémová zánětlivá reakce (horečka nebo hypotermie, tachykardie, tachypnoe, hypotenze, oligurie, leukocyturie nebo leukopenie) je první příhodou v kaskádě vedoucí k selhání více orgánů.
Léčba urosepse vyžaduje kombinaci adekvátní života podpůrné péče, vhodné aplikace antibiotik, podpůrných opatření (např. sympatomimetické aminy, kortikosteroidy, antikoagulační agens, faktor stimulující kolonie granulocytů/granulocytecolony stimulating factor - G-CSF nebo faktor stimulující kolonie granulocytů-makrofágů/granulocyte-macrophage-colony stimulating factor - GM-CSF, naloxon) a optimální zvládání poruch močových cest.
Urologům se doporučuje, aby pacienty léčili ve spolupráci se specialisty na intenzivní péči.
V řadě případů se lze vyhnout urosepsi opatřeními obvyklými pro prevenci nozokomiální infekce, např. omezení doby hospitalizace, časné odstranění zavedeného katétru, vyhnutí se zbytečné uretrální katetrizaci, správné použití uzavřeného systému katétrů a věnování pozornosti běžným denním technikám tak, aby se zabránilo přenosu infekce.
6.2 Úvod
Infekce močových cest se může v závislosti na lokalizovaném nebo systémovém rozšíření projevovat jako bakteriurie, bakteriemie, septikemie nebo septický syndrom. Septický syndrom je diagnostikován, pokud jsou klinické projevy infekce doplněny znaky systémového zánětu (horečka nebo hypotermie, tachykardie, tachypnoe, hypotenze, oligurie, leukocyturie nebo leukopenie).
Septický syndrom je závažný stav s publikovaným procentem mortality od 20 do 60 % [1-7]. V urologii závisí septický syndrom na reakci hostitele. Pacienti s větším rizikem vzniku sepse jsou: starší pacienti, diabetici, imunosuprimovaní pacienti, jako například příjemci transplantátů, pacienti podstupující chemoterapii nebo pacienti užívající kortikosteroidy a pacienti s AIDS. Urosepse také závisí na lokálních podmínkách, jako jsou například močové kameny, obstrukce v jakékoli úrovni močových cest, kongenitální uropatie, neurogenního poruchy močového měchýře nebo endoskopické výkony. Všichni pacienti mohou být postiženi druhy bakterií schopných vyvolat zánět v močových cestách. Navíc bylo zjištěno, že „syndrom systémové zánětlivé reakce/systemic inflammatory response syndrome“ (SIRS) se může vyskytnout i bez septikemie [7].
Z terapeutických důvodů by měla diagnostická kritéria sepse umožňovat identifikaci pacientů již v časné fázi syndromu a vybízet urology a specialisty intenzivní péče k hledání a léčbě infekce, aplikaci vhodné terapie a monitorování selhání orgánů a dalších komplikací.
6.3 Definice a klinická manifestace septického syndromu v urologii
Klinický průkaz infekce močových cest je založen na symptomech, fyzikálním vyšetření, sonografických a radiologických vyšetřeních a laboratorních údajích, jako je bakteriurie a leukocyturie. Platí následující definice:
- Septický syndrom je systémová odpověï na závažnou infekci.
- Závažná sepse je spojena s dysfunkcí orgánů.
- Při septickém šoku přetrvává hypoperfuze nebo hypotenze navzdory resuscitaci tekutinami.
- Refrakterní septický šok závisí na odezvě na terapii
Sepse je diagnostikována, pokud jsou klinické důkazy infekce doprovázeny symptomy systémové dysfunkce. Díky těmto charakteristikám bylo vytvořeno několik klinických a laboratorních kritérií (tab. 11).
6.4 Fyziologie a biochemické markery
Mikroorganizmy se dostávají do močových cest ascendentní, hematogenní nebo lymfatickou cestou. Aby došlo k urosepsi, musí patogeny proniknout do krve. Riziko bakteriemie je vyšší u závažných infekcí močových cest, jako je pyelonefritida a akutní bakteriální prostatitida (ABP), a její vznik je usnadněn obstrukcí. Některé mikroorganizmy jsou agresivnější, jako například meticilin-rezistentní S. aureus (MRSA), P. aeruginosa a Serratia spp. Nejčastěji k ní dochází u oslabených pacientů (např. u pacientů s diabetem mellitus nebo imunosuprimovaných pacientů) s typickými projevy generalizované sepse spojené s lokálními projevy infekce. V těchto případech může být hledání bakterie neúspěšné. Fatální výsledek je popsán u 30–60 % všech pacientů.
6.4.1 Cytokiny jako markery septické odpovědi
Cytokiny se podílejí na patogenezi septického syndromu. Jsou to peptidy, které regulují amplitudu a trvání zánětlivé odpovědi hostitele. Jsou uvolňovány různými buňkami, zahrnující monocyty, makrofágy a buňky endotelu, jako reakce na různé infekční stimuly. Poté, co se naváží na specifické receptory jiných buněk, změní cytokiny své chování v zánětlivé odpovědi. TNFa, IL-1, IL-6 a IL-8 jsou cytokiny, jež často souvisí se sepsí. Během infekce a zánětu vytváří hostitel cytokiny s predominantně prozánětlivými vlastnostmi, jako jsou například cytokiny IL-10 a IL-4 [5].
6.4.2 Prokalcitonin je potencionálním markerem sepse
Prokalcitonin je propeptid kalcitoninu, ovšem postrádající hormonální aktivitu. Normálně je prokalcitonin produkován C-buňkami štítné žlázy a u zdravých jedinců jsou jeho hodnoty nedetekovatelné. Při závažné generalizované infekci (bakteriální, parazitická a fungální) se systémovou manifestací mohou hodnoty prokalcitoninu stoupnout až > 100 ng/ml. Naopak při závažných virových infekcích nebo zánětlivých reakcích neinfekčního původu vykazují hodnoty prokalcitoninu pouze mírné nebo žádné zvýšení. Přesné místo redukce prokalcitoninu při sepsi není známo. Sledování hodnot prokalcitoninu může být užitečné u pacientů, u nichž je pravděpodobné, že dojde k zánětlivé reakci infekčního původu. Vysoké hodnoty prokalcitoninu nebo prudké zvýšení u těchto pacientů by mělo vést k hledání zdroje infekce. Prokalcitonin může být užitečný při rozlišování mezi infekčními a neinfekčními příčinami závažného zánětlivého stavu.
6.5 Prevence
Septický šok je nejčastější příčinou smrti u hospitalizovaných pacientů s nozokomiální infekcí (20–60 %) [8]. Sepse vyvolá kaskádu, jež progreduje v klinickém průběhu k závažné sepsi a potom septickému šoku. Léčba urosepse vyžaduje kombinaci adekvátního zabezpečení životních funkcí a aplikace antibiotik [9]. V takovéto situaci se doporučuje pro nejlepší řešení spolupráce urologů a specialistů intenzivní péče.
6.5.1 Preventivní opatření s prokázanou nebo pravděpodobnou úspěšností [10-13]
Nejefektivnější metody užívané pro prevenci urosepse jsou stejné jako při prevenci nozokomiální infekce:
- Izolace všech pacientů infikovaných multirezistentními organizmy, aby se zabránilo přenosu infekce.
- Správná aplikace antimikrobiálních preparátů při profylaxi a léčbě infekce aby se zabránilo selekci rezistentních kmenů. Antibiotika jsou vybírána dle bakterie predominantní v nemocničním prostředí.
- Omezení doby hospitalizace. Je dobře známo, že dlouhá doba hospitalizace před operací vede k větší incidenci nozokomiální infekce.
- Časné odstranění zavedeného katétru, jakmile to umožní stav pacienta. Nozokomiální infekce močových cest je podporována katetrizací močového měchýře i zavedením ureterálního stentu [14]. Profylaxe antibiotiky nezabrání kolonizaci stentu, k níž dojde u 100 % pacientů s permanetním ureterálním stentem a u 70 % pacientů s přechodným stentem.
- Užití uzavřené drenáže a minimalizace narušení integrity systému, např. při odebírání moči nebo proplachování močového měchýře.
- Užití co nejméně invazivní metody pro uvolnění obstrukce močových cest dokud není pacient stabilizován.
- Pozornost při prostých každodenních technikách pro zajištění asepse: rutinní užívání ochranných rukavic na jedno použití, pravidelná dezinfekce rukou a opatření pro kontrolu infekčních onemocnění k prevenci přenosu infekce.
6.5.2 Vhodná perioperační antimikrobiální profylaxe [6]
O vhodné perioperační antimikrobiální profylaxi viz kapitolu 9. Před aplikací antibiotik v jejich profylaktickém režimu je třeba zvážit jejich vedlejší účinky.
6.5.3 Preventivní opatření diskutabilní účinnosti [1]
- Instilace antibiotik nebo antiseptických přípravků do katétru a drenážních sáčků.
- Užití katétrů pokrytých antibiotiky nebo dusičnanem stříbrným.
6.5.4 Neefektivní nebo kontraproduktivní opatření [1]
- Kontinuální nebo intermitentní proplachy močového měchýře antibiotiky nebo antiseptiky, jež zvyšují riziko infekce rezistentními bakteriemi [2].
- Rutinní aplikace antimikrobiálních preparátů pacientům se zavedeným katétrem, což snižuje incidenci bakteriurie pouze na několik dnů a zvyšuje riziko infekce multirezistentními bakteriemi [2]. Jejich aplikace je rezervována pro pacienty s imunosupresí.
6.6. Léčba dalších přítomných onemocnění
Drenáž jakékoliv obstrukce močových cest a odstranění cizích těles, jako katétrů nebo konkrementů, mohou samy o sobě způsobit vymizení symptomů a vést k vyléčení.
Empirická počáteční terapie by měla poskytovat široké antimikrobiální pokrytí a měla by být později adaptována na základě výsledků kultivace. Možnosti antibakteriální léčby jsou uvedeny v dodatku 2.
6.6.1 Přídatná opatření [7]
- Řešení rovnováhy tekutin a elektrolytu je zásadním aspektem péče o pacienta se syndromem sepse, zejména pokud je léčba komplikována šokem.
- Pro léčbu hemodynamických komplikací šoku se široce užívají sympatomimetické aminy.
Alternativní preparáty jako izoproterenol, dopamin a dobutamin nahradily noradrenalin.
- Kortikosteroidy se považují za užitečnou doplňkovou terapii při gramnegativní infekci, zejména u infekce komplikované šokem.
- Antikoagulační léčba, zejména heparinizace je při léčbě septických stavů spojených s diseminovanou intravaskulární koagulací logická.
- Při léčbě infekce u neutropenických pacientů byly dříve oblíbeny transfuze granulocytů. Užití rekombinačních faktorů stimulujících kolonie jako je G-CSF a GM-CSF nahradilo transfuzi leukocytů.
- Bylo prokázáno, že naxolon, antagonista opiátů a beta-endorfinů, zlepší průběh endotoxického a hypovolemického šoku.
6.7 Závěr
Syndrom sepse v urologii zůstává závažnou situací s 20–60% procentní mortalitou. Časné rozpoznání symptomů může mortalitu včasnou léčbou poruchy močových cest, např. obstrukce, litiáza, snížit. Pro zlepšení přežití pacienta jsou nejlepším přístupem adekvátní zabezpečení životních funkcí a aplikace vhodných antibiotik. Prevence syndromu sepse závisí na dobré praxi zabránění nozokomiální infekci, užití profylaxe antibiotik a logické a dobře snášené terapie.
6.8 Literatura
1. Carlet J, Dumay MF, Gottot S, Gouin F, Pappo M. Guide pour la prévention des Infections Nosocomiales en reanimation. Arnette Ed Paris 1994 : 41-53.
2. Recommendations for prevention of nosocomial pneumonia. The Hospital Infection Control Practices Advisory Committee Center for Disease Control. Atlanta, GA, 1993
3. Measley RE, Levison ME. Host defense mechanisms in the pathogenesis of UTI. Med Clin N Am 1991; 75 : 275-286.
4. Sobel JD. Bacterial etiologic agents in the pathogenesis of UTI. Med Clin N Am 1991; 75 : 253-273.
5. Olszyna DP, Prins JM, Buis B, Van-Deventer SJ, Speelman P, Van der Poll T. Levels of inhibitors of tumor necrosis factor alpha and interleukin 1(in urine and sera of patients with
urosepsis). Infect Immun 1998; 66 : 3527-3534.
6. Carson CC. Antimicrobial prophylaxis in genitourinary surgery. In: Antibiotic Therapy in Urology. Mulholland SG (ed). Philadelphia: 1996 : 71-89.
7. Lowell S. Principles and Practice of Infectious Diseases, 4th edition. Mandell, Douglas and Bennetts 1995; 56 : 690-701.
8. Rosser CJ, Bare RL, Meredith JW. UTIs in the critically ill patient with a urinary catheter. Am J Surg 1999; 177 : 287-290.
9. Paradisi F, Corti G, Mangani V. Urosepsis in the critical care unit. Crit Care Clin 1998; 14 : 165-180.
10. Degroot-Kosolcharoen J, Guse R, Jones JM. Evaluation of a urinary catheter with a preconnected closed drainage bag. Infect Control Hosp Epidemiol 1988; 9 : 72-76.
11. Garibaldi RA. Catheter-associated UTI. Curr Opin Infect Dis 1992; 5 : 517-523.
12. MacFarlane D. Prevention and treatment of catheter-associated UTIs. J Infect 1985; 10 : 96-106.
13. Persky L, Liesen D, Yangco B. Reduced urosepsis in a veterans' hospital. Urology 1992; 39 : 443-445.
14. Riedl CR, Plas E, Hubner WA, Zimmer H, Ulrich W, Pfluger H. Bacterial colonization of ureteral stents. Eur Urol 1999; 36 : 53-59.
7. URETRITIDA
7.1 Definice
Je třeba odlišit primární uretritidu od sekundární, která se může objevit u pacientů se zavedeným katétrem nebo uretrálními strikturami a může být způsobena uropatogeny nebo stafylokoky. Kromě infekční příčiny uretritidy je třeba zvážit chemickou, mechanickou nebo neinfekční zánětlivou příčinu jako například Reiterovo, Behçetovo a Wegenerovo onemocnění [1]. V této kapitole se budeme zabývat pouze primární uretritidou [2].
7.2 Epidemiologie
Z terapeutického a klinického pohledu je třeba odlišit gonoroická uretritidu od nespecifické uretritidy. Nespecifická uretritida se ve střední Evropě vyskytuje mnohem častěji než gonoroická uretritida. Existuje vztah mezi promiskuitou a nízkým socioekonomickým stavem na jedné straně a četností výskytu N. gonorrhoeae a C. trachomatis na straně druhé. Infekce se šíří pohlavním kontaktem.
7.3 Patogeny
Patogeny zahrnují N. gonorrhoeae, Ch. trachomatis, Mycoplasma genitalium a T. vaginalis. Frekvence různých druhů se liší mezi populacemi pacientů [3-7]. Mycoplasma hominis pravděpodobně nezpůsobuje uretritidu, zatímco Ureaplasma urealyticum je málo častou příčinou. Ve většině případů představuje klinický průkaz mykoplasmata nebo Ureaplasmata asymptomatickou kolonizaci urogenitálních cest.
7.4 Průnik infekce a patogeneze
Kauzální organizmy zůstávají buï mimobuněčně na povrchu epitelu nebo penetrují do epitelu (N. gonorrhoeae, Ch. trachomatis), a tak způsobují pyogenní infekci. Chlamydie a gonokoky se po vyvolání uretritidy mohou šířit dále a způsobit epididymitidu u mužů nebo cervicitidu, endometritidu a salpingitidu u žen.
7.5 Klinický průběh
Symptomy uretritidy jsou purulentní výtok a bolestivé močení, mnoho infekcí uretry však probíhá asymptomaticky.
7.6 Diagnóza
Vyšetření uretrálního výtoku nebo stěru z vrstvy barvením dle Grama vykazující více než 5 leukocytů na mikroskopické zorné pole při velkém zvětšení (× 1000), případně gonokoky umístěné v buňkách jako gramnegativní diplokoky ukazují na pyogenní uretritidu. Pozitivní test leukocytární esterázy nebo > 10 leukocytů na mikroskopické zorné pole při velkém zvětšení (× 400) v prvním proudu moči je diagnostický. U všech pacientů s uretritidou a v případech, v nichž existuje podezření na přenos pohlavním stykem, by měla být cílem identifikace patogenních organizmů. Pokud je pro identifikaci patogenů užit systém amplifikace, může být místo uretrálního stěru odebrán první proud moči. Trichomoniázy mohou být obvykle identifikovány mikroskopicky.
7.7 Terapie
Následující doporučení (guidelines) pro terapii jsou v souladu s doporučeními Centra pro kontrolu chorob a prevenci (Center for Disease Control and Prevention) [8]. Pro léčbu kapavky lze doporučit tyto antimikrobiální preparáty:
- cefixim - 400 mg perorálně v 1 dávce
- ceftriaxon - 250 mg intramuskulárně (s lokálním anestetikem) v 1 dávce
- ciprofloxacin - 500 mg perorálně v 1 dávce
- ofloxacin - 400 mg perorálně v 1 dávce
Vzhledem k tomu, že je kapavka často doprovázena chlamydiovou infekcí, je třeba přidat účinnou terapii proti chlamydiím. Následující léčba byla úspěšně aplikována při infekci Ch. trachomatis.
Léčba první volby:
- azitromycin - 1 g perorálně v 1 dávce
- doxycyklin - 100 mg perorálně 2krát denně po dobu 7 dnů
Léčba druhé volby:
- erytromycin - 500 mg perorálně 4krát denně po dobu 7 dnů
- ofloxacin - 200 mg orálně 2krát denně po dobu 7 dnů
Doxycyklin a azitromycin jsou považovány při léčbě chlamydiové infekce za stejně účinné. Erytromycin je méně účinný a má větší množství vedlejších účinků. Pokud dojde k selhání terapie, je třeba zvážit léčbu infekce způsobené T. vaginalis a/nebo mykoplasmaty kombinací metronidazolu (2 g perorálně v 1 dávce) a erytromycinu (500 mg 4krát denně perorálně po dobu 7 dnů). Jako u ostatních pohlavně přenosných onemocnění je nezbytná souběžná léčba partnera.
7.8 Prevence
Pacienti s pohlavně přenesenou uretritidou by se měli po dobu léčby až do vymizení symptomů vyhnout nechráněnému sexuálnímu styku.
7.9 Literatura
1. Ebo DG, Mertens AV, De-Clerck LS, Gentens P, Daelemans R. Relapse of Wegener's granulomatosis presenting as a destructive urethritis and penile ulceration. Clin Rheumatol 1998; 17 : 239-241.
2. Friese K, Naber KG, Bredt W, Kühn J. Urethritis. In: Klinische Infektiologie. Marre R, Mertens T, Trautmann M, Vanek E (eds). Munich, Germany: Urban & Fischer 2000 : 472-477.
3. Borchardt KA, al-Haraci S, Maida N. Prevalence of Trichomonas vaginalis in a male sexually transmitted disease clinic population by interview, wet mount microscopy, and the In-Pouch TV test. Genitourin Med 1995; 71 : 405-406.
4. Busolo F, Camposampiero D, Bordignon G, Bertollo G. Detection of Mycoplasma genitalium and Chlamydia trachomatis DNAs in male patients with urethritis using the polymerase chain reaction. New Mikrobiol 1997; 20 : 325-332.
5. Evans BA, Bond RA, MayRae KD. Racial origin, sexual behaviour, and genital infection among heterosexual men attending a genitourinary medicine clinic in London (1993-1994). Sex Transm Infect 1998; 74 : 40-44.
6. Evans BA, Kell PD, Bond RA, MacRae KD. Racial origin, sexual lifestyle, and genital infection among women attending a genitourinary medicine clinic in London (1992). Sex Transm Infect 1998; 74 : 45-49.
7. Krieger JN. Trichomoniasis in men: old issues and new data. Sex Transm Dis 1998; 22 : 83-96.
8. Center for Disease Control and Prevention. 1998 Guidelines for treatment of sexually transmitted diseases. Morb Mortal Wkly Rep 1998; 47 : 1-111.
8. PROSTATITIDA, EPIDIDYMITIDA A ORCHITIDA
8.1 Souhrn
Prostatitida je onemocnění, jež je diagnostikováno pomocí symptomů, mikroskopickým vyšetřením prostatického exprimátu (expressed prostatic secretion - EPS) a kultivací EPS a frakcionovaných vzorků moči. Dle délky trvání symptomů je prostatitida popisována jako akutní nebo chronická, pokud jsou symptomy přítomny alespoň 3 měsíce. Doporučujeme klasifikaci prostatitidy navrhovanou National Institute of Diabetes, Digestive and Kidney Diseases (NIDDK)/National Institutes of Health (NIH), v níž je bakteriální prostatitida (akutní i chronická) odlišena od syndromu chronické pánevní bolesti (chronic pelvic pain syndrome - CPPS).
Akutní bakteriální prostatitida (ABP) může být závažnou infekcí, a je proto nezbytná parenterální aplikace baktericidních antibiotik, jako například aminoglykosidů a derivátů penicilinu nebo cefalosporinů 3. generace, a to až do poklesu teplot a normalizace parametrů infekce. U méně závažných případů může být po dobu 10 dnů podáván perorálně fluorochinolon.
U chronické bakteriální prostatitidy (CBP) a CPPS by měl být po stanovení diagnózy aplikován perorálně po dobu 2 týdnů fluorochinolon nebo TMP. Poté by měl být pacient znovu vyšetřen a léčba antibiotiky by měla pokračovat pouze, pokud byla kultivace před léčbou pozitivní nebo pokud pacient udává pozitivní účinek léčby v úlevě od bolesti. Poté se doporučuje léčba trvající 4 až 6 týdnů.
Zánětlivé procesy ve varlatech (orchitida) a nadvarlatech (epididymitida) je třeba klasifikovat jako akutní nebo chronické procesy dle nástupu a klinického průběhu. Většina případů epididymitidy je způsobena běžnými močovými patogeny. Obstrukce výtoku z močového měchýře a urogenitální malformace představují u tohoto druhu infekce rizikové faktory. Orchitida u dětí a spalničková orchitida jsou původu hematogenního. Epididymoorchitida je obvykle zjišována u systémových infekcí, jako například u tuberkulózy, luesu, brucelózy nebo kryptokokového onemocnění. Antimikrobiální preparáty by měly být vybírány na empirickém základě. Obvykle je kauzálním organizmem Ch. trachomatis, u starších mužů s BHP nebo dalšími poruchami mikce se také vyskytují nejběžnější uropatogeny.
Před antimikrobiální terapií je třeba odebrat uretrální stěr a střední proud moči pro mikrobiologické vyšetření. Medikamenty první volby by měly být fluorochinolony, zejména ty účinné proti Ch. trachomatis (např. ofloxacin, levofloxacin), vzhledem k jejich širokému antibakteriálnímu spektru a penetraci do tkání urogenitálních cest. Pokud byla jako původce infekce detekována Ch. trachomatis, měla by léčba pokračovat aplikací doxycyklinu dávce 200 mg/denně po dobu alespoň 2 týdnů. Lze zvážit také aplikaci makrolidů. V případě epididymitidy způsobené Ch. trachomatis je třeba léčit i sexuálního partnera.
8.2 Prostatitida
8.2.1 Úvod
To, co bylo dříve označováno za prostatitidu se v současné době spíše nazývá „syndrom prostatitidy“. Toto onemocnění je diagnostikováno a klasifikováno symptomy, mikroskopickým vyšetřením a kultivací EPS a frakcionovaných vzorků moči dle Mearese a Stameyho [1]. Termín syndrom ve většině případů znamená, že příčina vzniku není známa a diagnostická kritéria jsou slabá. Kauzální patogen je detekován v pouze u 5–10 % případů [2]. U zbývajících pacientů je léčba aplikována pouze na empirickém základě a bylo zaznamenáno mnoho medikamentózních i fyzikálních forem léčby. V poslední době byla zavedena nová klasifikace, a tedy lepší systematizace možností léčby, které přinášejí těmto pacientům benefit [3,4]. Tato sekce se zabývá dokumentovanými nebo podezřelými bakteriálními infekcemi prostaty.
8.2.2 Systémy klasifikace
Cílem techniky „čtyř sklenic“ popsané Mearesem a Stameym [1] bylo lokalizovat infekci uretry, prostaty nebo močového měchýře. O 10 let později navrhovali Drach et al [5] klasifikaci prostatitidy založenou na práci Mearese a Stameyho. V této klasifikaci jsou různé druhy prostatitidy rozlišeny podle nálezů leukocytů nebo pozitivní kultivace v EPS a vzorku moči (VB1 - první proud moči, VB2 - střední proud moči, VB3 - vzorek moči po masáži prostaty). Toto je posledních 30 let nejčastěji užívaná klasifikace prostatitidy (tab. 12). Nejnovější klasifikace onemocnění (International Classification of Diseases, 10th version) Světové zdravotnické organizace (World Health Organization - WHO) je na této klasifikaci založena [6].
Tab. 2. Klasifikace prostatitidy dle Dracha et al [5]. ![Klasifikace prostatitidy dle Dracha et al [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a85106f6bef73984c97e005dbddeb740.png)
V roce 1995 uspořádala NIDDK NIH workshop pro vývoj plánu, jenž by klinickým lékařům a badatelům umožnil efektivně diagnostikovat, léčit a případně předcházet syndromu prostatitidy [4]. Tento workshop doporučil novou klasifikaci syndromu prostatitidy, jež byla později přijata International Prostatitis Collaborative Network. Termíny abakteriální prostatitida a prostodynie byly změněny na CPPS s nebo bez zánětu. Byl přidán nový typ - asymptomatická prostatitida (histologická prostatitida), tab. 13. Tato klasifikace poskytuje logičtější základ pro možnosti léčby.
Tab. 3. Klasifikace prostatitidy dle NIDDK/NIH [4]. ![Klasifikace prostatitidy dle NIDDK/NIH [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/103cedc59b445803546f8f42759a9382.png)
8.2.3 Diagnóza
Klinická anamnéza a symptomy. Dle trvání symptomů je syndrom prostatitidy popisován jako akutní nebo v případě přítomnosti symptomů po dobu alespoň 3 měsíců chronický [4]. Predominantními symptomy jsou bolest v různých oblastech a LUTS [7-9]. Zermann et al [7] zaznamenali u mužů s prostatitidou bolest v následujících oblastech:
- prostata/perineum: 46 %
- šourek a/nebo varlata: 39 %
- penis: 6 %
- močový měchýř: 6 %
- dolní část zad: 2 %
Následující symptomy dolních cest močových zaznamenali Alexandr a Trissel [9]:
- častá potřeba močit
- obtíže při močení, např. slabý proud a používání břišního lisu
- bolest při močení, nebo bolest, jež se zvětšuje při močení
Nejčastější příčinou recidivující infekce močových cest u mužů je CBP [10]. Pro kvantifikaci symptomů bylo vytvořeno několik dotazníků týkajících se symptomů prostatitidy [11-13]. Byl validován NIH-index symptomů chronické prostatitidy [13], ale stále ještě nejsou k dispozici informace týkající se jeho benefitu při klinických studiích. Zdá se, že symptomy jsou u syndromu prostatitidy nejsilnějším klasifikačním parametrem [11].
Klinické nálezy: Při akutní prostatitidě může být prostata při digitálním rektálním vyšetření oteklá a bolestivá, a jedná se o stav, při němž je masáž prostaty kontraindikována. Fyzikální vyšetření by také mělo vzít v úvahu urogenitální a neurogenitální onemocnění (viz diferenciální diagnóza) a zahrnovat vyšetření svaloviny pánevního dna.
Vyšetření kultivace moči a EPS: Nejdůležitějšími vyšetřeními při hodnocení pacientů s prostatitidou je kultivace kvantitativní frakcionované bakteriologické lokalizace a mikroskopické vyšetření EPS, jak popsali Meares a Stamey [1]. Enterobakterie, zejména E. coli jsou predominantními patogeny (tab. 13). Význam nitrobuněčných bakterií, jako například Ch. trachomatis je nejasný. U pacientů s AIDS nebo virem HIV, může být prostatitida způsobena vybranými patogeny, jako např. M. tuberculosis, Candida spp., a vzácnými patogeny, jako například Coccides immitis, Blastomyces dermatitidis a Histoplasma capsulatum [14].
Tab. 4. Nejčastěji se vyskytující patogeny při prostatitidě; upraveno podle Weidnera et al [2]. ![Nejčastěji se vyskytující patogeny při prostatitidě; upraveno podle Weidnera et al [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/48611eea78ed2c52ab6b2e7cb57b11f2.png)
Histologie: Ve zvyšujícím se počtu případů je prostatitida diagnostikována z biopsií provedených při podezření na karcinom prostaty. Přesto však není žádná spojitost mezi klinickými symptomy a histologickými nálezy.
Další testy: Hlavním parametrem pro diagnostikování zánětu urogenitálních cest u mužů je zvýšený počet leukocytů v prostatické tekutině a prostatě, stejně jako zvýšené pH, zvýšená hladina laktát dehydrogenázy a imunoglobulinů. Další možné parametry jsou komplement C3, ceruloplazmin nebo polymorfonukleární leukocytelastáza v ejakulátu, žádný z nich ale není součástí rutinního diagnostického vyšetření [15].
Transrektální ultrazvuk může odhalit intraprostatické abscesy, konkrementy v prostatě a dilataci semenných váčků, ale není u prostatitidy determinujícím klasifikačním parametrem [16]. Transrektální ultrazvuk se užívá hlavně k měření velikosti prostaty a pro navigaci jehly při biopsii prostaty z důvodu vyloučení karcinomu.
Další vyšetření: Vyšetření EPS nemůže být nahrazeno vyšetřením ejakulátu. V ejakulátu je obtížné rozlišit spermatocyty od leukocytů [17], a procento detekce při pozitivní kultivaci je tak významně nižší [18]. Biopsie prostaty pro kultivaci nitrobuněčných bakterií by měla být vyhrazena pro vybrané případy nebo výzkumné účely. Videourodynamické vyšetření a kompletní urodynamické vyšetření s měřením tlaku uretrálního uzávěru by mělo být indikováno u pacientů s CPPS, u nichž nebyl nalezen žádný infekční organizmus [7,19] Měření počtu cytokinů a biofilmů v EPS se provádí pouze pro výzkumné účely [8,20]. Hodnoty PSA mohou být zvýšeny u symptomatické i asymptomatické prostatitidy, ovšem měření volného a celkového PSA u prostatitidy nepřidává žádnou praktickou diagnostickou informaci [21].
Diferenciální diagnóza: Symptomy různých urogenitálních a neurogenitálních onemocnění např. uretrální striktury, karcinomu močového měchýře, intersticiální cystitidy, karcinomu prostaty, ureterálních kameny, chronické epididymitidy, anorektální poruchy, myalgie pánevního dna a hernia inguinalis, mohou napodobovat symptomy zjištěné u pacientů se „syndromem prostatitidy“. Je nezbytné pečlivé individuální vyšetření.
Pořadí diagnostických kroků: Pořadí diagnostického hodnocení pacientů se symptomy stejnými jako při syndromu prostatitidy závisí na předchozím vyšetření, zavedené rutině v různých zdravotnických zařízeních a zemích, stejně jako na vzdálenosti pacientova bydliště od urologa. Doporučené pořadí je uvedeno v tab. 15.
Tab. 5. Urologické vyšetření pacientů s syndromem prostatitidy. 
8.2.4 Léčba
Antibakteriální terapie: Antibiotika jsou doporučována při ABP a CBP a jako empirická terapie u zánětlivé CPPS. ABP může představovat závažnou infekci s horečkou, intenzivní lokální bolestí a celkovými symptomy. Je nezbytná parenterální aplikace baktericidních antibiotik o vysokých dávkách, jako například aminoglykosidy, deriváty širokospektrálních penicilinů nebo cefalosporiny 3. generace, dokud nedojde k poklesu teplot a normalizaci parametrů infekce. V méně závažných případech může být perorálně aplikován fluorochinolon po dobu 10 dnů [3].
Antibiotika doporučená při CBP a chronické zánětlivé CPPS a jejich výhody jsou uvedeny v tab. 16 [22].
Tab. 6. Antibiotika indikovaná u chronické prostatitidy (upraveno podle Bjerklund Johansena et al [22]). ![Antibiotika indikovaná u chronické prostatitidy (upraveno podle Bjerklund Johansena et al [22]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ed99176cdf9c61930098f240afd43e39.png)
Při CBP se nedoporučuje aplikace aminoglykosidů, přestože jsou účinné proti gramnegativním bakteriím. Existují pouze v parenterální formě, jsou toxické v závislosti na dávce, a v případě aplikace více než 2-3 dávek je nezbytné monitorování. Nejsou dostatečně účinné proti grampozitivním bakteriím. Perorální aplikace beta-laktamů se nedoporučuje vzhledem k jejich špatné penetraci do prostaty, a nadto je na toto antibiotikum nespolehlivá citlivost; jsou kontraindikovány u pacientů, kteří jsou na ně alergičtí. Kotrimoxazol se nedoporučuje zejména kvůli tomu, že není účinnější než samotný TMP, a také proto, že je zde riziko závažných vedlejších účinků [22].
Trvání léčby antibiotiky závisí na zkušenosti a názoru odborníků a je podpořeno řadou klinických studií [23]. U CBP a zánětlivé CPPS by měla být antibiotika aplikována 2 týdny po počáteční diagnóze. Poté by měl být pacient znovu vyšetřen a pokračovat v podávání antibiotik je vhodné pouze, pokud byla kultivace provedená před léčbou pozitivní, nebo pokud pacient udává pozitivní účinek léčby na úlevu bolesti. Celková doporučená doba léčby je 4–6 týdnů, je preferována perorální terapie a jsou vyžadovány poměrně vysoké dávky [22]. Důvodem pro aplikaci antibiotik u chronické zánětlivé prostatitidy je možná přítomnost bakteriální infekce, dokonce i tehdy, když nejsou bakterie detekovány dostupnými metodami [23]. Navíc mnoho klinických studií uvádí dobrý účinek antibiotik u zánětlivé CPPS/ bakteriální prostatitidy [24,25].
V případě detekce nebo podezření na přítomnost nitrobuněčné bakterie by měly být aplikovány tetracykliny nebo erytromycin [22,25].
Kombinace antibiotik a alfablokátorů: Urodynamické studie prokázaly u pacientů s chronickou prostatitidou zvýšený uretrální uzavírací tlak [7]. U zánětlivé CPPS má kombinace léčby alfablokátory a antibiotiky vyšší zaznamenané procento vyléčení než samotná antibiotika [26]. Tato léčebná možnost je upřednostňována mnoha urology.
Intraprostatická injekce antibiotik: Tato léčba nebyla hodnocena v kontrolovaných studiích a měla by být zvážena pouze, pokud se nezdaří vyléčit infekci perorální léčbou [27,28].
Operace: Při ABP vyžadují někteří pacienti drenáž močového měchýře, nejlépe pomocí suprapubického katétru. Někteří autoři zaznamenali při TURP u pacientů s CBP a vážným diskomfortem pozitivní účinek [29]. Pro úlevu bolesti byla provedena dokonce prostatovezikulektomie, jejíž výsledky nejsou zcela jednoznačné [30]. Obecně bychom se měli při léčbě pacientů s prostatitidou vyvarovat operace s výjimkou drenáže abscesů prostaty.
Další léčba: Mikrovlnná energie Prostatronem 2,0 má in vitro baktericidní efekt na laboratorně kultivovanou E. Coli a enterobakterie [31] a v kontrolovaných studiích vykazovala transuretrální mikrovlnná terapie u pacientů se zánětlivou CPPS lepší výsledky než u kontrolní skupiny [32]. Transuretrální mikrovlnná terapie je však stále považována za experimentální metodu léčby pacientů s podezřením na infekci.
U nezánětlivé CPPS je navrhována řada dalších možností medikamentózní a fyzikální léčby. Vzhledem k tomu, že zde neexistují žádné důkazy infekce, sahá toto téma již za hranice této sekce, a je diskutováno v jiné části [11,12].
8.3 Epididymitida a orchititida
8.3.1 Epidemiologie
Definice a nomenklatura: Epididymitida, zánět nadvarlete, způsobuje bolestivost a otok, který je téměř vždy unilaterální s poměrně rychlým nástupem [33]. V některých případech je při zánětlivém procesu postiženo i varle (epididymoorchititida). Ovšem zánětlivé procesy varlete, zejména virově vyvolaná orchititida, často postihují i nadvarle.
Orchititida a epididymitida jsou klasifikovány jako akutní nebo chronický proces dle nástupu a klinického průběhu [34]. Chronické onemocnění s indurací se vyskytne v 15 % případů akutní epididymitidy, v případě že je postiženo i varle může vést chronický zánět k atrofii varlete a poškození spermatogeneze [35].
Incidence a prevalence: Nejsou k dispozici žádné nové spolehlivé údaje týkající se incidence a prevalence epididymitidy. Dle starších údajů byla akutní epididymitida významnou příčinou hospitalizace příslušníků armády [34]. Akutní epididymitida u mladých mužů je spojena se sexuální aktivitou a infekcí [36]. Nejčastější druh orchititidy, parotická orchititida se vyvine u 20–30 % pacientů po pubertě, kteří prodělali příušnice. Incidence závisí na úrovni vakcinace v populaci [37]. Primární chronická orchititida je granulomatózní onemocnění, vzácný stav s nejasnou příčinou vzniku zaznamenaný asi ve 100 případech v literatuře [38].
8.3.2 Morbidita
Komplikace u epididymoorchititidy zahrnuje tvorbu abscesů, testikulární infarkt, testikulární atrofii, vznik chronické epididymální indurace a infertilitu [34].
Epididymitida způsobená sexuálně přenosnými organizmy se vyskytuje hlavně u pohlavně aktivních mužů starších 35 let [34,39]. Většina případů epididymitidy je způsobena běžnými patogeny v močových cestách, které jsou také nejčastější příčinou bakteriurie [34,39]. Obstrukce výtoku z močového měchýře a urogenitální malformace jsou u tohoto druhu infekce rizikovými faktory.
8.3.3 Patogeneze a patologie
Většinou u epididymitidy, způsobené běžnými bakteriemi a pohlavně přenosnými organizmy, se infekce šíří z uretry nebo močového měchýře. U nespecifické granulomatózní orchititidy se za iniciaci chronického zánětu považuje autoimunní reakce [35,38]. Orchititida u dětí a parotická orchititida jsou hematogenního původu [35]. Epididymoorchititida se vyskytuje také u systémových infekcí, jako například tuberkulózy, syfilidy, brucelózya a kryptokokového onemocnění.
8.3.4 Klinické znaky
U akutní epididymitidy začíná zánět a otok zpravidla v ocase epididymidy a může se šířit a postihnout zbytek epididymidy a testikulární tkáň. Chámovod je obvykle citlivý a oteklý. Všichni muži se zánětem nadvarlete, který je vyvolán sexuálně přenosnými organizmy, mají v anamnéze sexuální styk; epididymitida může být latentní po mnoho měsíců před nástupem symptomů. Pokud je pacient vyšetřen okamžitě po odběru vzorku moči, může být přehlédnuta uretritida a uretrální výtok vzhledem k tomu, že leukocyty a bakterie mohou být při močení vypláchnuty z uretry.
Mikrobiální etiologie epididymitidy může být obvykle určena vyšetřením barvením dle Grama, stěru z uretry a/nebo středního proudu moči pro detekci gramnegativní bakteriurie. Přítomnost intracelulárních gramnegativních diplokoků stěru koreluje s infekcí způsobenou N. gonorrhoeae. Přítomnost pouhých leukocytů v uretrálním stěru indikuje přítomnost negonoroické uretritidy. Ch. trachomatis je izolována u přibližně 2/3 těchto pacientů [34,39].
Dle kritérií WHO zahrnujících analýzu leukocytů, může analýza ejakulátu ukazovat perzistentní zánětlivou aktivitu. V mnoha případech shledáme snížený počet spermií a jejich pohyblivost. Azoospermie způsobená úplnou obstrukcí obou epididymid je vzácnou komplikací [40]. V případě podezření na parotickou orchititidu může anamnéza parotitidy a průkaz protilátek IgM v séru tuto diagnózu podpořit. V asi 20 % případů parotické orchititidy se onemocnění vyskytuje bilaterálně u mužů po pubertě s rizikem testikulární atrofie a azoospermie [36].
8.3.5 Diferenciální diagnóza
Je nutné, aby lékaři odlišili epididymitidu a torzi chámovodu co možná nejdříve, a to pomocí všech dostupných informací, které zahrnují věk pacienta, anamnézu uretritidy, klinické vyšetření a Dopplerův (duplexní) scan testikulárního průtoku krve.
8.3.6 Léčba
Bylo provedeno pouze několik studií měřících penetraci antimikrobiálních látek do epididymis a varlete u lidí. V těchto studiích se prokázaly jako nejúčinnější fluorochinolony [41].
Antimikrobiální látky by měly být vybírány na empirické bázi, přitom u mladých pohlavně aktivních mužů je obvykle kauzálním patogenem Ch. trachomatis a u starších mužů s BHP nebo dalšími poruchami mikce jsou to obvykle nejběžnější patogeny. Studie srovnávající mikrobiologické výsledky z punkce epididymidy a z uretrálního stěru a moči prokázaly dobrou korelaci. Proto by měl být před antimikrobiální terapií proveden uretrální stěr a vyšetření středního proudu moči z důvodu mikrobiologického vyšetření.
Opět by měly být lékem první volby fluorochinolony, nejlépe ty účinné proti Ch. trachomatis (například ofloxacin a levofloxacin), vzhledem k jejich širokému antibakteriálnímu spektru a jejich dobré penetraci do tkání urogenitálního systému. Pokud byla jako příčina vzniku detekována Ch. trachomatis, měla by léčba pokračovat aplikací doxycyklinu v dávce 200 mg/den po dobu alespoň 2 týdnů. Jako alternativní přípravek mohou být aplikovány makrolidy.
Podpůrná terapie zahrnuje klid na lůžku, elevaci varlat a protizánětlivou terapii. Vzhledem k tomu, že u mladých mužů může epididymitida vést k permanentní okluzi epididymidálních kanálků, a tedy k infertilitě, je třeba zvážit antiflogistickou terapii s aplikací metylprednisolonu v dávce 40 mg/den a každý 2. den snížit dávku na polovinu.
V případě epididimitidy způsobené Ch. trachomatis by měla být léčena také sexuální partnerka. V případě, že jsou příčinou vzniku uropatogeny, mělo by být z důvodu prevence recidivy provedeno podrobné zkoumání poruch mikce. Epididymitida a orchititida způsobující tvorbu abscesů vyžadují i operační léčbu. Chronická epididymitida může někdy být prvním klinickým projevem urogenitální tuberkulózy.
8.4 Literatura
1. Meares EM, Stamey TA. Bacteriologic localisation patterns in bacterial prostatitis and urethritis. Invest Urol 1968; 5 : 492-518.
2. Weidner W, Schiefer HG, Krauss H, Jantos Ch, Friedrich HJ, Altmannsberger M. Chronic prostatitis: A thorough search for etiologically involved microorganisms in 1,461 patients. Infection 1991; 19 (Suppl 3): 119-125.
3. Schaeffer AJ. Prostatitis: US perspective. Int J Antimicrob Agents 1999; 11 : 205-211.
4. Workshop Committee of the National Institute of Diabetes and Digestive and Kidney Disease (NIDDK). Chronic Prostatitis Workshop, Bethesda, MD, 7-8 December, 1995.
5. Drach GW, Fair WR, Meares EM, Stamey TA. Classification of benign diseases associated with prostatic pain: Prostatitis or prostatodynia? J Urol 1978; 120 : 266.
6. International Classification of Diseases (ICD) 10th version. Geneva: WHO. 1989.
7. Zermann DH, Ishigooka M, Doggweiler R, Schmidt RA. Neurourological insights into the etiology of genitourinary pain in men. J Urol 1999; 161 : 903-908.
8. Alexander RB, Ponniah S, Hasday J, Hebel JR. Elevated levels of proinflammatory cytokines in the semen of patients with chronic prostatitis/chronic pelvic pain syndrome. Urology 1998; 52 : 744-749.
9. Alexander RB, Trissel D. Chronic prostatitis: results of an internet survey. Urology 1996; 48 : 568-574.
10. Krieger JN. Recurrent lower UTIs in men. J New Remed Clin 1998; 47 : 1786-1797.
11. Krieger JN, Egan KJ, Ross SO, Jacobs R, Berger RE. Chronic pelvic pains represent the most prominent urological symptoms of "chronic prostatitis". Urology 1996; 48 : 715-722.
12. Nickel JC. Effective office management of chronic prostatitis. Urol Clin North Am 1998; 25 : 677-684.
13. Litwin MS, McNaughton-Collins M, Fowler FJ Jr, Nickel FC, Calhoun EA, Pontari MA,
Alexander RB, Farrar JT, O'Leary MP. National Institute of Health Chronic Prostatitis Symptom Index: development and validation of new outcome measure. J Urol 1999; 162 : 369-375.
14. Naber KG, Weidner W. Prostatitis, epididymitis and orchitis. In: Infectious Diseases. Armstrong D, Cohen J (eds). London: Mosby 1999.
15. Blenk H, Hofstetter A. Complement C3, coeruloplasmin and PMN-elastase in the ejaculate in chronic prostatoadnexitis and their diagnostic value. Infection 1991; 19 (Suppl3): 38-140.
16. Doble A, Carter SS. Ultrasonographic findings in prostatitis. Urol Clin North Am 1989; 16 : 763-772.
17. Krieger JN, Berger RE, Ross SO, Rothman I, Muller CH. Seminal fluid findings in men with nonbacterial prostatitis and prostatodynia. J Androl 1996; 17 : 310-318.
18. Weidner W, Jantos C, Schiefer HG, Haidl G, Friedrich HJ. Semen parameters in men with and without proven chronic prostatitis. Arch Androl 1991; 26 : 173-183.
19. Kaplan SA, Santarosa RP, D'Alisera PM, Fay BJ, Ikeguchi EF, Hendricks J, Klein L, Te AE. Pseudodyssynergia (contraction of the external sphincter during voiding) misdiagnosed as chronic nonbacterial prostatitis and the role of biofeedback as a therapeutic option. J Urol 1997; 157 : 2234-2237.
20. Goto T, Nakame Y, Nishida M, Ohi Y. Bacterial biofilms and catheters in experimental UTI. Int J Antimicrob Agents 1999; 11 : 227-232.
21. Polasscik TJ, Oesterling JE, Partin AW. Prostate specific antigen: a decade of discovery - what we have learned and where we are going. J Urol 1999; 162 : 293-306.
22. Bjerklund Johansen TE, Grüneberg RN, Guibert J, Hofstetter A, Lobel B, Naber KG, Palou-Redorta J, van Cangh PJ. The role of antibiotics in the treatment of chronic prostatitis: a consensus statement. Eur Urol 1998; 34 : 457-466.
23. Naber KG. Role of quinolones in treatment of chronic bacterial prostatitis. In: Quinolone Antimicrobial Agents, 2nd edition. Hooper DC, Wolfson JS (eds). Washington: American Society for Microbiology, 1993 : 285-297.
24. De la Rosette JJMC, Hubregste MR, Meuleman EJH, Stolk-Engelaar MVM, Debruyne FMJ. Diagnosis and treatment of 409 patients with prostatitis syndromes. Urology 1993; 41 : 301-307.
25. Ohkawa M, Yamaguchi K, Tokunaga S, Nakashima T, Shoda R. Antimicrobial treatment for chronic prostatitis as a means of defining the role of Ureaplasma urealyticum. Urol Int 1993; 51 : 129-132.
26. Barbalias GA, Nikiforidis G, Liatsikos EN. Alpha-blockers for the treatment of chronic prostatitis in combination with antibiotics. J Urol 1998; 159 : 883-887.
27. Mayersak JS. Transurethral ultrasonography directed intraprostatic injection of gentamycin-xylocain in the management of the benign painful prostate syndrome. A report of a 5 year clinical study of 75 patients. Int Surg 1998; 83 : 347-349.
28. Jimenez Cruz JF, Boronat F, Gallego J. Treatment of chronic prostatitis: intraprostatic injection under echography control. J Urol 1988; 139 : 967-970.
29. Darenkov AF, Simonov VI, Kuz`min GE, Koshkarov H. Transurethral electroresection in chronic prostatitis and its complications. Urol Nefrol (Mosk.) 1989; 1 : 18-23.
30. Frazier HA, Spalding TH, Paulson DF. Total prostatoseminal vesiculectomy in the treatment of debilitating perineal pain. J Urol 1992; 148 : 409-411.
31. Sahin A, Eiley D, Goldfischer ER, Stravodimos KG, Zeren S, Isenberg HD, Smith AD. The in vitro bactericidal effect of microwave energy on bacteria that cause prostatitis. Urology 1998; 52 : 411-415.
32. Nickel JC, Sorensen R. Transurethral microwave thermotherapy for nonbacterial prostatitis: a randomized double-blind sham controlled study using new prostatitis specific assessment questionnaires. J Urol 1996; 155 : 1950-1954.
33. Naber KG, Weidner W. Prostatitis, epididymitis, orchitis. In: Infectious Diseases. Armstrong D, Cohen J (eds). London: Mosby, Harcourt Publishers Ltd, 1999 : 1-58.
34. Berger RE. Epididymitis. In: Sexually Transmitted Diseases. Holmes KK, Mardh P-A, Sparling PF, Wiesner PJ (eds), New York: McGraw-Hill, 1984 : 650-662.
35. Nistal M, Paniagua R. Testicular and Epididymal Pathology. Stuttgart: Thieme, 1984.
36. Robinson AJ, Grant JBF, Spencer RC, Potter C, Kinghom GR. Acute epididymitis: why patient and consort must be investigated. Br J Urol 1990; 66 : 642.
37. Rüther U, Stilz S, Röhl E, Nunnensiek C, Rassweiler J, Dorr U, Jipp P. Successful Interferon-2, a therapy for a patient with acute mumps orchitis. Eur Urol 1995; 27 : 174.
38. Aitchison M, Mufti GR, Farrell J, Paterson PJ, Scott R. Granulomatous orchitis. Br J Urol 1990; 66 : 312.
39. Weidner W, Schiefer HG, Garbe Ch. Acute nongonococcal epididymitis. Aetiological and therapeutic aspects. Drugs 1987; 34 (Suppl1): 111.
40. Weidner W, Garbe Ch, Weißbach L, Harbrecht J, Kleinschmidt K, Schiefer HG, Friedrich HJ. Initiale Therapie der akuten einseitigen Epididymitis mit Ofloxacin. Andrologische Befunde. Urologe A 1990; 29 : 277-280.
41. Ludwig M, Jantos CA, Wolf S, Bergmann M, Failing K, Schiefer HG, Weidner W. Tissue penetration of sparfloxacin in a rat model of experimental Escherichia coli epididymitis. Infection 1997; 25 : 178-184.
9. PERIOPERAČNÍ ANTIBAKTERIÁLNÍ PROFYLAXE V UROLOGII
9.1 Souhrn
Hlavním cílem antimikrobiální profylaxe v urologii je prevence symptomatických/ febrilních genitourinárních infekcí, jako je například akutní pyelonefritida, prostatitida, epididymitida a urosepse, stejně jako vážných ranných infekcí.
Potřeba profylaxe závisí na druhu intervence a individuálním riziku každého pacienta. Obecná profylaxe antibiotiky se nevyžaduje u otevřených operací bez použití segmentů střeva. To stejné platí pro rekonstrukční operace v genitální oblasti, s výjimkou dlouhých nebo sekundárních intervencí nebo implantační operace. U diagnostických intervencí se perioperační antibakteriální profylaxe doporučuje pouze u transrektální biopsie prostaty pomocí silné jehly. Profylaxe by měla být vždy zvážena u pacientů se zvýšeným rizikem infekce a zejména před transuretrální resekcí prostaty (TURP) v případě anamnézy infekce močových cest.
Obecně je vhodnou profylaxí 1 dávka vhodného antibiotika, pokud možno aplikovaného parenterálně (případně perorálně u preparátů s výbornou biodostupností, např. fluorochinolony). Pouze v případě prodloužené intervence (> 3 hodiny) mohou být vyžadovány další dávky, jejichž množství a doba aplikace jsou určeny farmakokinetikou antibiotik. Profylaxe antibiotiky by neměla trvat déle než 24 hodin. Pokud je po operaci ponechána drenáž, např. zavedený katétr, stent, nefrostomie atd, je prodloužení perioperační antibakteriální profylaxe kontraindikováno.
Mnoho antibiotik splňuje kritéria pro aplikaci při profylaxi (dodatek 4), např. cefalosporiny druhé generace, fluorochinolony a aminopenicilin a inhibitor betalaktamázy (beta-lactamase inhibitor - BLI). Aminoglykosidy by měly být ponechány pro pacienty se zvýšeným rizikem a pacienty alergické na betalaktamy. Širokospektrální antibiotika jako například cefalosporiny třetí generace, acylaminopeniciliny plus BLI nebo karbapenemy by měly být aplikovány pouze vzácně, např. pokud je místo operace kontaminováno rezistentními nozokomiálními bakteriemi. To stejné platí i pro aplikaci vankomycinu.
9.2 Úvod
Téměř 50 let po svém zavedení je perioperační profylaxe stále kontroverzní. Zatímco u některých operací (např. elektivní operace tlustého střeva) byl stanoven jasný benefit, neexistuje žádný obecný konsenzus pro aplikaci antibakteriální profylaxe v urologii. Tradiční klasifikace chirurgických procedur podle Cruseho a Foorda [1] na čistou, čistou kontaminovanou, kontaminovanou a špinavou, nepopisuje přesně riziko infekce v endourologii. Celkové riziko je ovlivněno stavem pacienta, operačním zákrokem a faktory prostředí. Avšak význam každého faktoru ještě nebyl přesně stanoven [2].
V současné době je většina studií špatně designovaných nebo postrádají statistickou hodnotu. Rozdíl mezi terapií a profylaxí není jasný. Hodnocení rizikových faktorů není uspokojivé a termíny bakteriurie a infekce nejsou užívány uvážlivě. Navíc mnoho z těchto studií postrádá znalost farmakokinetiky a farmakodynamiky, bakteriální patogenity a role nozokomiální infekce [3,4]. Není proto překvapivé, že literatura zabývající se profylaxí není dostatečná a vykazuje negativní i pozitivní výsledky pro každý druh urologické intervence.
Současný průzkum provedený v nedávné době u 320 německých urologů, odhalil kontroverzní názory na perioperační profylaxi antibiotiky [5]. Byla aplikována pouze v 51 % procedur zahrnujících močové cesty, a 9 % odpovídajících urologů dokonce neužívalo profylaxi při otvírání střeva. Existovala nedostatečná shoda týkající se výběru antibiotik (35,3 % užívalo kotrimoxazol, 26,6 % cefalosporiny a 8,7 % fluorochinolony) a trvání profylaxe (pouze 10 % užívalo jedinou dávku před operací). Existují také rozdíly mezi jednotlivými státy [6-8]. Proto jsou guidelines pro indikaci perioperační profylaxe v urologii nezbytná pro zlepšení kvality péče o pacienta.
Jsou prezentována praktická doporučení zahrnující pacienty s normální i zvýšenou citlivostí i různé druhy operačních zákroků. Tato doporučení jsou založena na klinických studiích, názorech odborníků a konsenzu profesionálů. Také berou v úvahu doporučení společností, jako je například Paul Ehrlich Society for Chemotherapy [9], Working Group „Infectiology“ of the German Society for Urology [10] a Association Français d´Urologie [11] a Swedish-Norwegian Consensus Group [12].
9.3 Cíle perioperační antibakteriální profylaxe
Snahou perioperační profylaxe je omezit infekce spojené s intervencí. Profylaxe však nikdy nemůže kompenzovat špatnou operační techniku. Profylaxe antibiotiky je pouze jednou částí řešení prevence infekce a měla by být zahrnuta do místní strategie aplikace antibiotik. Neměly by být zanedbány i další významné faktory (např. krátká doba hospitalizace, péče o katétr, užití uzavřeného systému drenáže) a edukace zdravotního týmu, které všechny mají značný význam [13-15].
Cíle perioperační profylaxe v urologii jsou diskutabilní. Je všeobecně přijímáno, že jejím hlavním cílem je prevence symptomatické/febrilní genitourinární infekce, jako je například akutní pyelonefritida, prostatitida, epididymitida a urosepse nebo ranné infekce. Prevenci je možné rozšířit na pooperační asymptomatickou bakteriurii, nebo dokonce malé ranné infekce, které mohou být snadno léčeny ambulantně. Za některých okolností můžeme předpokládat její větší význam, např. u implantačních operací, při nichž může dojít k riziku ztráty implantátu. Naopak asymptomatická bakteriurie po TURP může vymizet spontánně a obvykle není signifikantní. Další otázkou je, zda by měla být perioperační profylaxe zvážena i při prevenci neurologických infekcí, jako je např. endokarditida a pooperační pneumonie. Perioperační antibakteriální profylaxe v urologii by měla sahat dál, než je tradiční cíl profylaxe, jímž je prevence ranné infekce [3,16].
U transuretrální resekce prostaty (TURP) prokázalo několik kontrolovaných studií, že výskyt pooperační bakteriurie může být snížen perioperační profylaxí, což nezbytně neznamená redukci symptomatické infekce močových cest nebo prevenci febrilních příhod [17-22]. Navíc vzhledem k tomu, že procento septických komplikací je obecně < 1 %, bude prospektivní studie vyžadovat pro dosažení statistického významu velký počet pacientů. Doposud pochází většina našich znalostí o prevenci urosepse z retrospektivních studií, a jsou tudíž nedostatečné [23].
Obecně převládá názor, že incidence pooperačních septických komplikací v posledních 10–15 letech klesla, což může souviset spíše se zlepšenou asepsí a pokročilou technologií než s profylaxí antibiotiky.
9.4 Indikace pro perioperační antibakteriální profylaxi
Potřeba profylaxe závisí na druhu intervence a individuálním riziku každého jednotlivého pacienta. Je třeba zvážit rizikové faktory, jako jsou například chronické oslabení, dysfunkce metabolizmu (např. diabetes mellitus), imunosuprese, špatné operační podmínky, opakovaná operace a speciální rizikové faktory (např. umělé srdeční chlopně), tab. 17. V nedávné době byl publikován přehled faktorů důležitých pro prevenci infekce operované oblasti [24].
Tab. 7. Obecné faktory zvyšující riziko pooperační infekce po urologické intervenci způsobené stavem pacienta a/nebo zvýšeným množstvím bakterií. 
Zvýšené vystavení endogenním bakteriím lze očekávat u procedur užívajících segmenty střeva a transrektální biopsie prostaty pomocí tlusté jehly. Dále je kontaminace močových cest často spojena s dlouhodobou drenáží (katétr atd) nebo s obstrukcí. Dokonce krátkodobá hospitalizace může vést ke kolonizaci multirezistentními kmeny, které mohou vyžadovat změnu antibiotické strategie.
Při absenci rizikových faktorů a při sterilitě moči nemusí být profylaxe nezbytná. Pokud však dojde ke změně očekávaného rizika během operace (např. perforace střeva či infikovaných močových cest) je třeba zvážit peroperační aplikaci antibiotik. Při předoperačním vyšetření pacienta je třeba zjistit jakoukoliv infekci, zejména v močových cestách. Pokud je zjištěna přítomnost infekce a intervenci nelze odložit, měla by být před operací podána terapie antibiotiky na empirické bázi, která by poté měla dále pokračovat, je-li to možné, dle výsledků testů citlivosti.
Z mikrobiologického pohledu představuje jakákoliv perioperační profylaxe antibiotiky kompromis. Je třeba vytvořit rovnováhu mezi redukcí počtu bakterií na jedné straně a zvýšeným rizikem vedlejších účinků a selekcí rezistentních kmenů na straně druhé.
9.5 Načasování a trvání perioperační profylaxe antibiotiky
Základní studie ukázaly, že ranným infekcím lze zabránit aplikací antibiotik dříve, než dojde ke kontaminaci [16,25,26]. Na počátku operace jsou nezbytné vysoké hodnoty antibiotik v krvi, a proto jsou načasování a dávkování důležitými faktory [27]. V klinické praxi je nejlepší dobou pro aplikaci 30–60 minut před začátkem operace, tj. při zahájení anestezie, v případě že je antibiotikum podáváno intravenózně. V případě, že se objeví peroperační komplikace, mělo by být antibiotikum aplikováno okamžitě. Tento přístup je efektivní zejména při akutní všeobecné chirurgii [28].
Klinické studie prokázaly signifikantní nárůst infekce v případě, že byla 1 dávka profylaxe antibiotika podána > 1 hodinu před začátkem operace [25]. Jakékoliv antibiotikum aplikované po uzavření rány neovlivní míru výskytu ranné infekce. Nejsou však k dispozici žádné studie prokazující takovouto závislost při endoskopických operacích.
Obecně je 1 plná dávka vhodného antibiotika stejně efektivní jako opakované aplikace. Pouze v případě déle trvající intervence (> 3 hodiny) je zapotřebí další dávka, jejíž množství a načasování je určeno farmakokinetikou antibiotika. Antibiotická profylaxe by neměla trvat déle než 24 hodin [13,29-31]. Aplikace antibiotik > 1 den není považována za profylaxi, ale za terapii. To může být nezbytné, pokud nelze ohnisko infekce odstranit při operaci nebo v případě vážné kontaminace.
9.6 Výběr antibiotika
Vhodné antibiotikum by mělo být vysoce efektivní, dobře snášeno a levné. Jeho antibakteriální spektrum by mělo zahrnovat očekávaný rozsah normální flóry a patogenů obvykle se vyskytujících v místě operace a na okolní kůži a sliznicích. U pacientů s prodlouženou dobou předoperační hospitalizace by mělo být bráno v úvahu lokální nozokomiální bakteriální spektrum a druh jeho rezistence (tab.18).
Tab. 8. Nejčastější patogeny způsobující nozokomiální infekci močových cest a ranných infekcí. 
Tato kritéria splňuje mnoho antibiotik a mohou být aplikována, např. cefalosporiny druhé generace, fluorochinolony a aminopeniciliny v kombinaci s BLI. Aminoglykosidy by měly být aplikovány pacientům s vysokým rizikem a těm, kteří jsou alergičtí na betalaktamy. Širokospektrální antibiotika, jako například cefalosporiny 3. generace, acylaminopenicilin a BLI nebo karbapenem, by měla být aplikována vzácně, např. v případě, že je operační pole kontaminováno multirezistentními nozokomiálními bakteriemi. Obvykle by měla být jejich aplikace omezena na léčbu závažných infekcí [13,29,30]. To také platí pro rutinní užití vankomycinu při profylaxi, např. u dialyzovaných pacientů nebo pacientů s podezřením na infekci způsobenou venózními katétry, vzhledem k tomu, že tento přístup může selektovat enterokoky a stafylokoky rezistentní na vankomycin.
Výběr antibiotik závisí na farmakokinetice a dávkování by mělo zajistit efektivní hodnoty ve tkáni během operace. V závislosti na poločase rozpadu antibiotik a doby trvání intervence může být indikována dodatečná dávka. Pro urologické indikace se doporučuje vybrat léčivo s vysokými koncentracemi v moči. Doporučení měnit za hospitalizace v určitých časových intervalech režim antibiotické terapie k narušení selekce, a tedy rezistence se zdá být rozumné, je však ještě třeba je ověřit. Také se zdá být praktické neužívat rutinně stejná antibiotika pro profylaxi i terapii.
9.7 Způsob aplikace
Primárně se doporučuje pro dosažení dostatečné koncentrace antibiotik v tkáni intravenózní aplikace, zejména při akutních stavech. Moderní antibiotika jako např. fluorochinolony však mají stejně dostatečnou biodostupnost i při perorální aplikaci [22]. Lokální irigace antibiotiky se nedoporučuje vzhledem k tomu, že účinek není trvalý.
9.8 Doporučení dle druhu urologické intervence
Pro perioperační antibakteriální profylaxi jsou urologické intervence děleny na otevřené a endoskopické operace a diagnostické procedury (tab. 19). Doporučená antibiotika jsou shrnuta v dodatku 3.
Tab. 9. Klasifikace urologických operací/intervencí s ohledem na perioperační antibakteriální profylaxi. 
9.8.1 Urologické operace s použitím segmentu střeva
Za vznik pooperačních infekcí po operacích s použitím části střeva jsou obvykle zodpovědny střevní organizmy. Nejčastěji se vyskytujícím organizmem je E. coli a další enterobakterie, enterokoky, anaeroby a streptokoky, stejně jako stafylokoky u ranné infekce. Proto se doporučuje aplikace aminopenicilinu/acylaminopenicilinu v kombinaci s BLI nebo cefalosporinu 2. generace plus metronidazol.
Zůstává otázkou, zda kontinentní rezervoáry nebo náhrady močového měchýře vyžadují prodloužení doby aplikace pooperační profylaxe antibiotiky, ovšem stále ještě není toto téma prokázáno klinickými studiemi. Zavedený katétr a irigace kolonizovaných intestinálních segmentů (neovezik) může vést k pooperační bakteriemii a za výjimečných okolností k portální pyemii.
9.8.2 Urologické operace bez užití segmentu střeva
U otevřené operace bez užití části střeva se nevyžaduje obecná profylaxe antibiotiky. Její aplikace je nezbytná pouze u pacientů se zvýšeným rizikem infekce (tab. 16) nebo před TURP, v případě anamnézy infekce močových cest. Nejčastěji se vyskytující infekční organizmus je E. coli, poté enterokoky, Proteus spp. a Klebsiella spp. v močových cestách a stafylokoky v ranné infekci. Je třeba vzít také v úvahu spektrum infekce močových cest související s hospitalizací (tab. 17), zejména u pacientů se zavedeným katétrem.
Peroperační aplikace antibiotik doporučená pro profylaxi dle očekávaného rozsahu patogenů zahrnuje fluorochinolon aplikovaný perorálně/parenterálně, aminopenicilin v kombinaci s BLI nebo cefalosporin 2. generace. Cefalosporin 3. generace nebo acylaminopenicilin v kombinaci s BLI jsou alternativami u pacientů se zvýšeným rizikem infekce, kteří byli již dříve léčeni antibiotiky nebo mají permanentní katétr nebo nefrostomii.
9.8.3 Urologické operace mimo močové cesty
Peroperační profylaxe antibiotiky se obecně nedoporučuje s výjimkou dlouhých rekonstrukčních operací v genitální oblasti nebo při operacích spojených s implantací. Vzhledem k tomu, že převládá stafylokoková infekce, lze aplikovat cefalosporiny 1. nebo 2. generace.
9.8.4 Endourologické operace
Peroperační profylaxe se doporučuje pouze v případech se zvýšeným rizikem výskytu infekce (tab. 17). U pacientů podstupujících TURP je třeba zvážit další rizikové faktory morbidity, jako například velikost prostaty (> 45 g), délku operace (> 90 min) a akutní močovou retenci [32]. Vhodná antibiotika zahrnují fluorochinolon, aminopenicilin v kombinaci s BLI a cefalosporin 2. generace nebo kotrimoxazol. Komparativní studie týkající se krátkodobé profylaxe fluorochinolony ve srovnání s kotrimaxazolem nejsou k dispozici. Alternativou jsou fosfomycin trometamol a aminoglykosidy. Pokud může pacient užívat perorální preparáty, lze zvážit jako první volbu 1 dávku fluorochinolonu nebo 2 dávky fosfomycinu trometamolu [33,34]. Pro laparoskopické operace (např. varikokéla, lymfadenektomie, nefrektomie, radikální prostatektomie) chybí studie s dostatečným statistickým významem. Zdá se však rozumné postupovat zde jako u odpovídajících otevřených operací.
9.8.5 Diagnostické urologické intervence
Perioperační antibakteriální profylaxe, např. aplikace fluorochinolonu perorálně [35], aminoglykosidu, cefalosporinu v kombinaci s metronidazolem nebo aminopenicilinu v kombinaci s BLI se obecně doporučuje pouze při transrektální biopsii prostaty pomocí silné jehly. Při dalších diagnostických procedurách močových cest se profylaxe doporučuje u vysoce rizikových pacientů. Perorální/parenterální aplikace fluorochinolonu nebo kotrimoxazolu je vhodnou volbou.
9.8.6 Pooperační drenáž močových cest
Pokud je po operaci ponechána drenáž močových cest (např. zavedený katétr, stent, nefrostomie atd) je prodloužená perioperační antibakteriální profylaxe kontraindikována. Pokud dojde k symptomatické/febrilní příhodě, musí být pacient léčen empiricky, dokud nejsou k dispozici výsledky kultivace. Asymptomatická bakteriurie musí být léčena před jakoukoliv intervencí močových cest nebo pokud je odstraněna drenáž.
9.9 Farmakoekonomika
Výsledky největší celosvětové studie týkající se kontroly nozokomiálních infekcí prokázaly, že infekce močových cest (42 %) a poté ranná infekce (24 %) jsou nejčastější příčinou infekčních pooperačních komplikací [36]. Pokud lze této infekci předejít, je zde zjevně velký potenciál pro velké snížení nákladů. Avšak ekonomický benefit týkající se volby perioperační antibakteriální profylaxe nebyl ještě v urologii plně prozkoumán. Výjimkou je metaanalýza 8 prospektivních, randomizovaných, kontrolovaných studií extrakorporální litotrypsie, při nichž se ukázalo u pacientů léčených s profylaxí 50 % snížení průměrného rizika infekce močových cest (2,1 % vs průměrné riziko 5,7 %).
Rozdíl byl statisticky významný (p = 0,0005) a strategie minimálně zvýšila celkové náklady extrakorporální litotrypsie vzhledem k tomu, že zabránila závažné infekci močových cest vyžadující hospitalizaci [37]. Podobné studie pro TURP a tumory močového měchýře bohužel chybí. Odhad redukce nákladů perioperační profylaxe může být posouzen pouze vhodnými studiemi.
Přehled doporučení pro perioperační profylaxi antibiotiky je uveden v dodatku 3 [10].
9.10 Literatura
1. Cruse PJE, Foord R. The epidemiology of wound infection: a 10-year old prospective study of 62,939 wounds. Surg Clin North Am 1980; 60 : 27-40.
2. Knopf H-J, Weib P, Schäfer W, Funke P-J. Nosocomial infections after transurethral prostatectomy. Eur Urol 1999; 36 : 207-212.
3. Brühl P, Plassmann D. Zur Wertbemessung der perioperativen antibiotischen Infektionsprophylaxe bei der transurethralen Prostatachirurgie. Infektionsverhütung in der Chirurgie. R.Häring, Berlin: Blackwell Wissenschaft 1991.
4. Hofstetter A. Urogenitale Infektionen. Berlin: Springer, 1999.
5. Bruns T, Höchel S, Tauber R. Perioperative Antibiotikaprohylaxe in der operativen Urologie. Urologe B 1998; 38 : 269-272.
6. Wilson NIL, Lewi HJE. Survey of antibiotic prophylaxis in British urological practice. Br J Urol 1985; 57 : 478-482.
7. Glambek I. Antibiotikaprofylakse ved operasjoner pa prostata (Antibiotic prophylaxis in prostatic surgery). Tidsskr Nor Laegeforen 1982; 102 : 1766-1767.
8. Hedelin H, Bergman B, Frimodt-Moller C, Grabe M, Nurmi M, Vaage S, Walter S. Antibiotikaprofylax vid diagnostiska och terapeutiska urologiska ingrepp. Nord Med 1995; 110 : 9-11.
9. Vogel F, Naber KG, Wacha H et al. Parenterale Antibiotika bei Erwachsenen. Chemother J 1999; 8 : 3-56.
10. Naber KG, Hofstetter AG, Brühl P, Bichler KH, Lebert C. Leitlinien zur perioperative Prophylaxe bei Eingriffen an den Harnwegen und im männlichen Genitalbereich. Chemotherapie Journal 2000; 9 : 165-170.
11. Société Française d'Anesethésie et de Réanimation (SFAR). Recommandations pour la pratique de l'antibioprophylaxie en chirurgie. Actualisation 1999. Pyrexie 1999; 3 : 21-30.
12. Swedish-Norwegian Consensus Group. Antibiotic prophylaxis in surgery: Summary of a Swedish-Norwegian consensus conference. Scand J Infect Dis 1998; 30 : 547-557.
13. Adam D, Daschner F. Infektionsverhütung bei operativen Eingriffen: Hygienemaßnahmen und Antibiotikaprophylaxe. Stuttgart : Wissenschaftliche Verlags-Gesellschaft 1993.
14. Blumenberg EA, Abrutyn E. Methods for reduction of UTI. Curr Opin Urol 1997; 7 : 47-51.
15. Burke JP, Garibaldi RA, Britt MR, Jacobson JA, Conti M, Alling DW. Prevention of catheter-associated UTIs: efficacy of daily meatal care regimens. Am J Med 1981; 70 : 655-658.
16. Classen DC, Evans RS, Pestotnic SL, Horn SD, Menlove RL, Burke JP. The timing of prophylactic administration of antibiotics and the risk of surgical wound infection. N Engl J Med 1992; 326 : 281-286.
17. Larsen EH, Gasser TC, Madsen PO. Antibiotikaprophylaxe bei operativen Eingriffen in der Urologie. Extracta urological 1989; 12 : 340-363.
18. Naber KG. Antibakterielle Chemoprophylaxe bei transurethraler Resektion der Prostata. Aktuelle Urologie 1987; 18 (Sonderheft): 34-37.
19. Hargreave TB, Botto H, Rikken GHJM, Hindmarch JR, McDermott TE, Mjolnerod OK, Petays P, Schalkhauser K, Stellos A. European collaborative study of antibiotic prophylaxis for transurethral resection of prostate. Eur Urol 1993; 23 : 437-443.
20. Hargreave TB, Hindmarsh JR, Elton R et al. Short term prophylaxis with cefotaxime for prostatic surgery. Br Med J 1982; 284 : 1008-1010.
21. Raz R, Almog D, Elhanan G, Shental J. The use of ceftriaxon in the prevention of UTI in patients undergoing transurethral resection of the prostate (TURP). Infection 1994; 22 : 347-349.
22. Shearman CP, Silverman SH, Johnson M, Young CH, Farrar DJ, Keighley MR, Burdon DW. Single dose, oral antibiotic cover for transurethral prostatectomy. Br J Urol 1988; 62 : 424-438.
23. Del Rio G, Dalet F, Chechile G. Antimicrobial prophylaxis in urologic surgery: does it give some benefit? Eur Urol 1993; 24 : 305-311.
24. Mangram AJ, Horan TC, Pearson ML, Silver LC, Jarvis WR. Guidelines for prevention of surgical site infection. Am J Infect Control 1999; 27 : 1-55.
25. Burke JF. The effective period of preventive antibiotic action in experimental incisions and dermal lesions. Surgery 1961; 50 : 161-168.
26. Miles AA, Miles EM, Burke J. The value and duration of defense reactions of the skin to the primary lodgement of bacteria. Br J Exp Pathol 1957; 38 : 79-96.
27. Bergamini TM, Polk HC Jr. The importance of tissue antibiotic activity in the prevention of operative wound infection. J Antimicrob Chemother 1989; 23 : 301-313.
28. Bates T, Siller G, Crathern BC, Bradley SP, Zlotnic RD, Couch C, James RD, Kaye CM. Timing of prophylactic antibiotics in abdominal surgery: trial of a pre-operative versus an intraoperative first dose. Br J Surg 1989; 76 : 52-56.
29. DGKH. Empfehlungen der DGKH zur perioperativen Antibiotikaprophylaxe. Hyg Med 1994; 19 : 213-222.
30. ASHP Commission On Therapeutics. ASHP therapeutic guidelines on antimicrobial prophylaxis in surgery. Clin Pharm 1992; 11 : 483-513.
31. Dellinger EP, Gross PA, Barrett TL, Krause PJ, Martone WJ, McCowan JE, Sweet RL, Wenzel RP. Quality standard for antimicrobial prophylaxis in surgical procedures. Infect Control Hosp Epidemiol 1994; 15 : 182-188.
32. Mebust WK, Holtgrewe HL, Cockett ATK, Peters PC, and the Writing Committee. Transurethral prostatectomy: immediate and postoperative complications. A cooperative study of 13 participating institutions evaluating 3,885 patients. J Urol 1989; 141 : 243-247.
33. Baert L, Billiet I, Vandepitte J. Prophylactic chemotherapy with fosfomycin trometamol versus placebo during transurethral prostatic resection. Infection 1990; 18 (Suppl 2): S103-S106.
34. Periti P, Novelli A, Reali EF, Del Bono GP, Fontana P. Prophylactic chemotherapy with fosfomycin trometamol salt in transurethral prostatectomy. A controlled clinical trial. In: Neu HC, Williams JD (eds). New Trends in UTIs. Basel: Karger 1998 : 207-233.
35. Kapoor DA, Klimberg IW, Malek GH, Wegenke JD, Cox CE, Patterson AL, Graham E, Echols RM, Whalen E, Kowalsky SF. Single-dose oral ciprofloxacin versus placebo for prophylaxis during transrectal prostate biopsy. Urology 1998; 52 : 552-558.
36. Haley RW, Culver DH, White JW, Morgan WM, Emori TG, Munn VP, Hooton TM. The efficacy of infection surveillance and control programs in preventing nosocomial infections in US hospitals. Am J Epidemiol 1985; 121 : 182-205.
37. Pearle MS, Roehrborn CG. Antimicrobial prophylaxis prior to shock wave lithotripsy in patients with sterile urine before treatment: a meta-analysis and cost-effectiveness analysis. Urology 1997; 49 : 679-686.
10. POHLAVNĚ PŘENOSNÁ ONEMOCNĚNÍ (SEXUALLY TRANSMITTED DISEASES - STD)
10.1 Úvod
Klasické bakterie, jež způsobují pohlavní onemocnění, např. gonorea, syfilis, šankroid a ingvinální granulom, tvoří pouze malou část pohlavních nemocí známých v dnešní době. Další bakterie, viry a kvasinky, protozoa a epizoa je také třeba považovat za organizmy zapříčiňující pohlavně přenosné onemocnění. Celkově tvoří všechny infekce přenášené pohlavní cestou (sexually transmitted infections - STI) více než 30 relevantních STD-patogenů. Avšak ne všechny patogeny, jež mohou být pohlavně přenosné, způsobují onemocnění genitálií a ne všechny infekce postihující genitál musí být přenášeny výhradně pohlavní cestou. Výstižné informace a tabulky s přehledem diagnostického a terapeutického řešení STD v oblasti urologie umožňují synoptický přehled a odpovídají současným guidelines jiných specializací. Jsou zde uvedeny speciální situace (tj. virus HIV, těhotenství, kojenci, alergie) a doporučené režimy.
10.2 Definice a klasifikace
STD lze v současné době rozdělit na vyléčitelné a nevyléčitelné. Běžnými vyléčitelnými pohlavně přenosnými onemocněními jsou gonorea, chlamydiové, mykoplazmatické a ureaplazmatické infekce, syfilis, trichomonáza, šankroid, lymphogranuloma venereum a donovanóza. Dokonce i pohlavní onemocnění způsobená kvasinkami, protozoy a epizoy lze vyléčit. STD, jež jsou kurabilní, nikoliv však kurabilní jsou virová pohlavně přenosná onemocnění, ta zahrnují virus HIV, lidský papilomavirus (HPV), hepatitidu typu B/C (HBV, HCV), cytomegalovirus (CMV) a herpes simplex virus (HSV).
Budeme se zabývat výhradně genitálními infekcemi, které se přenášejí sexuálním stykem. U ostatních patogenů, které vedou k orgánové manifestaci klasifikované v jiné odbornosti, je třeba jen stručně zmínit údaje týkajících se jejich pohlavní přenosnosti a komorbidity. S ohledem na další podrobnosti týkající se těchto patogenů by se měl čtenář obrátit na guidelines patřičných odborných společností [11,15,17-22] a internetové odkazy [1-9]. Klinickými obrazy jako je uretritida, genitální vředy, prostatitida a epididymitida, jež mohou být u mužů způsobeny rozličnými STD-patogeny, se nebudeme v tomto přehledu zabývat.
Následujícími STD v oblasti urologie se budeme zabývat v synoptickém přehledu ve skupinách a tabulkách:
- Bakteriální STD1. syfilis2. gonorea3. šankroid4. donovanóza/granuloma inguinale5. lymphogranuloma venereum6. ‑chlamydiové, mykoplazmatická a ureaplazmatická uretritida
- Virová STD1. HPV-léze2. genitální herpes3. Molluscum contagiosum
- STD způsobené protozoy a epizoy1. trichomoniáza2. pediculosis pubis3. scabies
10.3 Obrazy STD
Informace a vyobrazení projevů STD poskytuje atlas Dermatology Online Atlas a lze si je tam prohlédnout.
10.4 Bakteriální STD (tab. 20)
Tab. 10. Bakteriální STD [1-9,11,18-22]. ![Bakteriální STD [1-9,11,18-22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5bc2f2e0ae46d12b292f4c2ac3af68ec.png)
10.4.1 Syfilis
Syfilis je jedna z nejstarších a nejinfekčnějších sytémových STD, zejména v primárním a sekundárním stadiu. Pokud není léčena, progreduje infekce několika stadii, během nichž jsou její symptomy často podobné jako u jiných onemocnění, a tak ztěžují určení diagnózy. Existuje úzká spojitost mezi syfilidou a infekcí HIV, s vysokou prevalencí u poskytovatelů komerčních sexuálních služeb, narkomanů, zejména v rozvojových zemích.
10.4.2 Gonorea
Celosvětová roční incidence se odhaduje přibližně 62 milionů nových případů, s nejvyšším výskytem v jižní a jihovýchodní Asii a poté v subsaharské oblasti Afriky. Signifikantní počet infikovaných jedinců (až 80 % žen, 10 % mužů) je asymptomatických. Často se vyskytuje spolu s chlamydiální infekcí a dalšími STD, po kterých je zejména třeba pátrat při vyšetřování.
10.4.3 Šankroid
Špatné pochopení epidemiologie a přirozeného průběhu tohoto onemocnění a absence spolehlivého laboratorního vyšetření ztěžuje provádění studií zabývajících se prevalencí a odhadnutí prevalence a trvání infekce. Odhaduje se, že každoročně se objeví přibližně 7 milionů nových případů. Incidence šankroidu se mezi jednotlivými zeměmi a regiony velmi liší.
10.4.4 Donovanóza/granuloma inguinale
Donovanóza je velmi vzácné vředovité pohlavně přenosné onemocnění genitálu, primárně se vyskytující u jedinců praktikujících anální sex nebo orálně-anální styk. V některých tropických rozvojových oblastech je endemické (Indie, Papua-Nová Guinea, střední Australie, jižní Afrika). Přestože je pouze mírně nakažlivá, přenáší se nejčastěji v raném stadiu.
10.4.5 Lymphogranuloma venereum
Toto onemocnění, také známé jako onemocnění Durandovo-Nicolasovo-Favreho, je v rozvinutých zemích poměrně vzácné. Lymphogranuloma inguinale má nejvyšší prevalenci v jihovýchodní Asii, Střední a Jižní Americe a karibské oblasti. Je charakteristické bolestivým otokem lymfatických uzlin a elefantiázou genitálií.
10.4.6 Chlamydiová, mykoplazmatická a ureaplazmatická uretritida
Uretritidu negonokokového původu způsobuje jednak Chlamydia trachomatis, jednak Ureaplasma urealyticum, Mycoplasma hominis a Mycoplasma genitalium a tvoří 30 %–50 % případů a 10 %–20 % případů v tomto pořadí. U 20–30 % mužů s uretritidou nezpůsobenou gonokoky nejsou detekovány žádné organizmy. U žen je častá asymptomatická infekce, zatímco asi 70 % mužů má symptomy jako například uretrální výtok, dysurii, podráždění penisu a symptomy epididymoorchitidy nebo prostatidy.
10.4.7 Další bakteriální a kvasinkové STD
Gardnerella vaginalis způsobuje bolestivou bakteriální vaginózu. Muži mohou tuto bakterii přenášet, ale nezpůsobuje jim zdravotní obtíže. Navíc bakteriální vaginóza není STD per se a ještě zcela nerozumíme změně v rovnováze bakteriálních organizmů, které se vyskytují ve vagině. Další onemocnění často spojená s vaginálním výtokem jsou trichomonáza a kandidóza. Vulvovaginální kandidóza není obvykle získána pohlavním stykem. Léčba mužského protějšku se doporučuje pouze ve vzácných případech balanitidy nebo u žen s recidivující infekcí.
10.5 Virové STD (tab. 21)
Tab. 11. Virové STD [10,12,15-17,22]. ![Virové STD [10,12,15-17,22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bbe25ad514b90e0822278bdbbf2e0a73.png)
Zde se soustředíme na pohlavně přenosné virové infekce, jež obvykle způsobují léze pohlavních cest jako například HPV-, HSV - a MCV-infekce. Další virové STD, např. AIDS, hepatitida, cytomegalické inkluzní onemocnění, onemocnění spojené s Epsteinové-Barrovým virem šířené polibkem je možné vyhledat v guidelines jiných specializací.
10.5.1 Léze související s HPV
Condylomata accuminata způsobená infekcí HPV jsou celosvětově nejčastěji se vyskytující virovou STD. Genitální bradavice se vyskytnou každoročně u více než 30 milionů jedinců. HPV patří do stejné skupiny virů jako viry, které způsobují běžné bradavice. Avšak HPV může úzce souviset s intraepiteliální neoplazií a karcinomem u obou pohlaví. Většina HPV-infekcí je subklinických nebo latentních, což znamená, že nejsou přímo viditelné nebo že mohou být diagnostikovány pouze laboratorními testy. Viditelné symptomy onemocnění zahrnují kondylomata. Bowenovo onemocnění, bowenoidní papulóza, Buschkeovy-Löwensteinovy tumory a genitální karcinom. Přestože jsou muži i ženy stejně náchylní k infekci, ženy mají daleko vyšší riziko vzniku malignity spojené s HVP.
10.5.2 Genitální herpes
Genitální herpes je chronická virová infekce přetrvávající po celý život, postihne až 80 % dospělých jedinců. Existuje 5 různých druhů viru herpes. Přestože se všechny šíří kožním kontaktem, pouze herpes simplex 1 (HSV1) a herpes simplex 2 (HSV2) jsou považovány za STD. HSV1 se původně nachází v ústech a stále častěji může být izolován u genitálních infekcí, což možná odráží změnu v sexuálních praktikách. Herpes je v dnešní době nevyléčitelný. Sdružené symptomy se nemusí nikdy projevit, nebo mohou přicházet a odcházet v průběhu života. Existuje dokonce ještě větší počet jedinců, u nichž se neprojeví žádné symptomy.
10.5.3 Molluscum contagiosum
Molluscum contagiosum je sebeomezující virová infekce na kůži, která se šíří pohlavním i běžným kontaktem. Často jsou infikovány děti. Vysoká prevalence (13 %) je zaznamenána u HIV-pozitivních dospělých, což možná opravňuje klasifikovat toto onemocnění jako STD. Ojedinělé puchýře mohou po několika měsících spontánně zmizet.
10.6 STD způsobená protozoy a epizoy
10.6.1 Trichomoniáza
Trichomoniáza je způsobena parazitickým protozooem Trichomonas vaginalis a je často diagnostikována u pacientů, kteří jsou infikováni jinými STD. Trichomonas může být přenášena přímým sexuálním kontaktem nebo infikovanými tělními tekutinami. U mužů jsou symptomy vzácné a obvykle zahrnují výtok z uretry a bolestivou nebo obtížnou mikci. Protozoa mohou být zjištěna mikroskopickým vyšetřením v zástinu vzorků z vaginy, uretrálního sekretu nebo sedimentu v moči. Kultivace těchto vzorků před mikroskopickým vyšetřením zlepší senzitivitu. Obecně by měla léčba zahrnovat oba sexuální partnery. Jedna dávka metronidazolu (2 g p.o.) by měla být efektivní. Alternativním řešením je aplikace metranidazolu 2 × 500 mg po dobu 7 dnů [11,22].
10.6.2 Pediculosis pubis
Pediculosis pubis je drobný hmyz, který infikuje chlupy pubické oblasti svých hostitelů a živí se lidskou krví. K uchycení na chlupu hostitele používají klepeta krabího tvaru a denně popolezou o několik centimetrů. Samička naklade 2–3 vajíčka denně a uchytí je k chlupu. Při pohlavním styku se hmyz může pohybovat z jednoho partnera na druhého. Příznakem bývá svědění v pubické oblasti. Pro potvrzení se užívá mikroskopické vyšetření vší nebo hnid. Léčba zahrnuje aplikaci 1% g-benzen hexachloridové masti nebo roztoku. Kůže na hlavě se léčí lindanovým šampónem. Pacienti s pediculózou pubické oblasti by měli být vyšetřeni na přítomnost dalších STD.
10.6.3 Scabies
Sarcoptes scabiei je bílohnědý roztoč s osmi končetinami, jenž se zavrtá do svého hostitele, aby kladl vajíčka.
Zavrtávání způsobuje podráždění kůže nebo vyrážku. Roztoči, jejich výkaly a vajíčka způsobují po 2 týdnech progredující senzitivitu hostitele, což vede k charakteristickému svědění. Nalezení roztoče, nebo identifikování jeho hrbolků a chodbiček potvrdí předchozí diagnózu. Existuje celá řada topických medikamentů, které léčí scabies. Zahrnují lindan, petrolejový gel a 5% směs sulfaru.
10.7 Literatura
1. Robert Koch Institute (German). http://www.rki.de.
2. IAS: International AIDS Society. http://www.ias.se.
3. DAIG: Deutsche AIDS Gesellschaft e.V. (German). http://www.daignet.de.
4. HIV Net (German). http://www.hiv.net.
5. AIDS finder (German). http://www.AIDSfinder.org.
6. CDC NCHST: National Center for HIV, STD and TB Prevention. Divisions of HIV/AIDS Prevention. http://www.cdc.gov/hiv/dhap.htm.
7. Health Canada. http://www.hc-sc.gc.ca/hpb/icdc/ bah/index.html. (website address altered, material now available at: http://www.hc-sc.gc.ca/english/diseases/std.html.
8. Public Health Laboratory Service. http://www.phls. co.uk (website discontinued, material now available at the Health Protenction Agency website): http:// www.hpa.org.uk/infections/topics_az/topics.asp?category=a.
9. National Center for HIV, STD and TB Prevention, Division of Sexually Transmitted Diseases. http:// www.cdc.gov/std.
10. Schneede P. Sexuell übertragbare virale Infektionen. In: Hofstetter A, editor. Urogenitale Infektionen. Berlin: Springer; 1999. p. 383-414. http://www.buch-steiner.de/cgi/eingang?direkteinstieg=artikeldetail&idpartner=1000723&artikelnr= 3540641734.
11. Petzoldt D, Gross G, editors. Diagnostik und Therapie sexuell übertragbarer Krankheiten. Leitlinien 2001 der Deutschen STD-Gesellschaft. Berlin: Springer; 2001. http://www.buch-steiner.de/cgi/eingang?direkteinstieg=artikeldetail&idpartner= 1000723&artikelnr=3540679901.
12. P. Schneede, Genital human papillomavirus infections, Curr. Opin. Urol. 12 (2002) 57-61. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11753135&dopt=Abstract.
13. P. Schneede, A. Leunig, P. Hillemanns, S. Wagner, A.G. Hofstetter, Photodynamic investigation of mucosa-associated human papillomavirus efflorescences, BJU Int. 88 (2001) 117-119. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11446859&dopt=Abstract.
14. P. Schneede, P. Münch, S. Wagner, Th. Meyer, E. Stockfleth, A. Hofstetter, Fluorescence urethroscopy following instillation of 5-aminolevulinic acid: a new procedure for detecting clinical and subclinical HPV lesions of the urethra, J. Eur. Acad. Dermatol. Venereol. 15 (2001) 121-125. http://www.ncbi. nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11495518&dopt= Abstract.
15. G. Von Krogh, C.J.N. Lacey, G. Gross, R. Barrasso, A. Schneider, European course on HPV associated pathology: guidelines for primary care physicians for the diagnosis and management of anogenital warts, Sex Transm. Infect. 76 (2000) 162-168. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10961190&dopt=Abstract.
16. P. Schneede, Leitlinie zur Diagnostik und Therapie von Genitalerkrankungen durch Humane Papillomviren (HPV) Leitlinie der Deutschen Gesellschaft für Urologie, Urologe A 40 (2001) 511-520. http:// www.uni-duesseldorf.de/WWW/AWMF/ll/urol-033.htm
17. E.R. Weissenbacher, A. Schneider, L. Gissmann, G. Gross, J. Heinrich, P. Hillemanns et al., Recommendations for the diagnosis and treatment of HPV infections of the female tract, Eur. J. Infect Immunol. Dis. Obstet. Gynaecol. 4 (2001) 1-12. http://www.i-idsog-europe.de/
18. A. Stary, European guideline for the management of chlamydial infection, Int. J. STD AIDS 12 (2001) 30-33.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11589794&dopt=Abstract.
19. P.J. Horner, European guideline for the management of urethritis, Int. J. STD AIDS 12 (2001) 63-67.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11589800&dopt=Abstract.
20. C.J. Bignell, European guideline for the management of gonorrhoea, Int. J. STD AIDS 12 (2001) 27-29.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11589793&dopt=Abstract.
21. B.T. Goh, P.C. van Voorst Vader, European guideline for the management of syphilis, Int. J. STD AIDS 12 (2001) 14-26. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11589792&dopt=Abstract.
22. Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines 2002. MMWR 2002;51 : 1-78. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12184549&dopt=Abstract.
11. DODATKY
11.1 Kritéria pro diagnózu infekce močových cest (upraveno de IDSA/ESCMID guidelines [1,2,3])
(tab. 22)
Literatura
1. Rubin RH, Shapiro ED, Andriol VT, Davies RJ, Stamm WE. Evaluation of new anti-infective drugs for the treatment of UTI. Clin Infect Dis 1992; 15 (Suppl1): S216-S227.
2. Rubin RH, Shapiro ED, Andriol VT, Davies RJ, Stamm WE, with modifications by a European Working Party (Norrby SR). General guidelines for the evaluation of new anti-infective drugs for the treatment of UTI. Taufkirchen, Germany: The European Society of Clinical Microbiology and Infectious Diseases, 1993; 294-310.
3. Naber KG. Experience with the new guidelines on evaluation of new anti-infective drugs for the treatment of urinary tract infections. Int J Antimicrob Agents 1999; 11 : 189-196.
11.2 Doporučení pro antimikrobiální terapii v urologii (upraveno dle [1]).
(tab. 23)
Literatura
1. Naber K, Fünfstück R, Hofstetter A, Brühl P, Hoyme U. Empfehlungen zur antimikrobiellen Therapie von Infektionen der Nieren und der Urogenital traktes bei Erwachsenen. Chemotherapie Journal 2000; 9 : 193-199.
11.3 Doporučení pro peroperační bakteriální profylaxi v urologii (upraveno dle [1])
(tab. 24)
11.3.1 Literatura
1. Naber KG, Hofstetter AG, Brühl P, Bichler KH, Lebert C. Leitlinien zur perioperative Prophylaxe bei Eingriffen an den Harnwegen und im männlichen Genitalbereich. Chemotherapie Journal 2000; 9 : 165-170.
11.4 Antibakteriální preparáty
(tab. 25)
11.4.1 Peniciliny
Penicilin G a perorální peniciliny, penicilin V, propicilin a azidocilin jsou vysoce účin-né proti streptokokům a pneumokokům. Procento rezistence pneumokoků se však může značně lišit mezi jednotlivými zeměmi. V Německu je rezistence pneumokoků na penicilin stále < 1 %. Vzhledem k jejich úzkému spektru nehrají tyto peniciliny žádnou roli při léčbě urogenitálních infekcí.
Aminopeniciliny, například ampicilin a amoxycilin, mají širší spektrum účinku. Kromě streptokoků a pneumokoků pokrývají také enterokoky, Haemophilus influenzae, Haemophilus parainfluenzae, Listeria, E. coli, P. mirabilis, Salmonella a Shigella spp.; avšak může dojít k rezistenci. Aminopeniciliny jsou senzitivní na beta-laktamázu. Proto nejsou dostatečně účinné proti některým druhům, jako například stafylokokům, Moraxelle catarrhalis, Bacteroides fragilis a mnoha enterobakteriím. Tento nedostatek ve spektru účinnosti může být zaplněn aplikací BLI (kyselina klavulanová, sulbaktam). Amoxicilin/kyselina klavulanová a ampicilin/ sulbaktam jsou k dispozici na trhu jako fixní kombinace. Indikacemi pro aplikaci aminopenicilinů a jejich kombinací s BLI jsou mírná infekce respiračního systému, infekce močových cest stejně jako kožní infekce a infekce měkkých tkání.
Acilaminopeniciliny zahrnují apalcilin, azlocilin, mezlocilin a piperacilin, jsou charakterizovány vysokou účinností proti enterokokům, enterobakteriím a Pseudomonas (mezlocilin má nižší účinnost). Acilaminopeniciliny jsou hydrolyzovány ß-laktamázou a jsou proto účinné proti kmenům stafylokoků produkujícím ß-laktamázu, B. fragilis a části enterobakterií, v případě že jsou aplikovány v kombinacis BLI. Tato kombinace poskytuje širokospektrální účinnost a může být aplikována ve velkém počtu indikací, zahrnujících komplikované infekce močových cest a urosepsi. K dispozici je výběr rozličných kombinací se sulbaktamem nebo fixní kombinace tazobaktamu a piperacilinu, jež má výhodu snadné aplikace a v dobře dokumentované databázi vycházející z kvalifikovaných klinických studií.
Izoxazolylpeniciliny, dostupné jako parenterální medikamenty s oxacilinem a flukloxacilinem, mají úzké spektrum účinku. Jejich indikace jsou omezeny na infekce způsobené S. aureus. Díky jejich suboptimálním farmakokinetickým parametrům jsou přednostně užívány při lehčích kožních infekcích a infekcích měkké tkáně a oblasti kolem ucha, nosu a krku. Nehrají žádnou roli při léčbě močových cest, ale mohou být aplikovány při léčbě stafylokokových abscesů v genitální oblasti.
11.4.2 Cefalosporiny aplikované parenterálně
Podle Paul Ehrlich Society for Chemotherapy [1] byly parenterální cefalosporiny klasifikovány do 5 skupin podle spektra účinku (tab. 26).
Tab. 16. Klasifikace parenterálních cefalosporinů dle Paul Ehrlich Society for Chemotherapy [2]. ![Klasifikace parenterálních cefalosporinů dle Paul Ehrlich Society for Chemotherapy [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f7145df77769cfb1830c4ae08175af58.png)
Cefalosporiny skupiny 1 (cefazolin, cefazedon) jsou velmi účinné proti streptokokům a stafylokokům (zahrnuje i kmeny rezistentní proti penicilinu G). Mají pouze slabou účinnost proti gramnegativním organizmům. Stejně jako všechny cefalosporiny, není cefazolin účinný proti enterokokům, MRSA a koagulázo-negativním stafylokokům rezistentním na methicilin (MRSE).
Ve srovnání s cefalosporiny skupiny 1 vykazují cefalosporiny skupiny 2, například cefuroxim, cefotiam a cefamandol, významně lepší účinnost proti gramnegativním patogenům a udržují vysokou účinnost proti stafylokokům.
Cefalosporiny skupiny 3a jsou vysoce účinné proti gramnegativním bakteriím a méně účinné proti stafylokokům. Liší se hlavně ve svých farmakokinetických charakteristikách.
Cefalosporiny skupiny 3b, například ceftazidim, cefepim, cefoperazon a cefpirom, mají zvýšenou účinnost proti Pseudomonas. Avšak účinek cefoperazonu proti P. aeruginosa je významně menší než ostatních substancí této skupiny.
Cefsulodin má speciální místo mezi cefalosporiny 4. skupiny se svojí terapeutickou relevancí omezenou na P. aeruginosa.
Cefalosporiny skupiny 5 jsou charakterizovány svým antianaerobním účinkem. Tyto cefalosporiny mají ve srovnání s cefalosporiny 1. a 2. skupiny lepší aktivitu proti gramnegativním bakteriím, ale většina z nich je méně účinná než preparáty 3. skupiny. V současné době je cefoxitin jediným léčivem této skupiny dostupným na trhu v některých zemích.
11.4.3 Perorální cefalosporiny
Perorální cefalosporiny jsou klasifikovány do 3 skupin, v závislosti na spektru účinku, dle doporučení Paul Ehrlich Society for Chemotherapy [1] (tab. 27).
Tab. 17. Klasifikace perorálních cefalosporinů [1]. ![Klasifikace perorálních cefalosporinů [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8f94fd4140838facf41454f4ddb2b035.png)
1. skupina perorálních cefalosporinů zahrnuje cefalexin, cefadroxil a cefaklor. Jsou účinné zejména proti grampozitivním kokům s omezeným účinkem proti H. influenzae (cefaklor). Jejich hlavními indikacemi jsou kožní infekce a infekce měkké tkáně a s jistým omezením i infekce dýchacích cest. Vzhledem k tomu, že je jejich účinek proti enterobakteriím omezený, lze je doporučit pouze pro léčbu nebo profylaxi nekomplikovaných infekcí močových cest u dětí nebo gravidních žen, u nichž je výběr antibiotik omezen.
Perorální cefalosporiny skupiny 2. Účinek cefprozilu proti S. aureus, Streptococcus pyogenes, Streptococcus pneumoniae, H. influenzae a M. catarrhalis je o něco vyšší než u cefakloru. Avšak proti E. coli, Klebsiella pneumoniae a P. mirabilis je cefprozil méně účinný než cefaklor.
Lorakarbef je strukturálně blízký cefakloru. Narozdíl od cefakloru je stabilní v roztoku, má lepší farmakokinetika a širší antibakteriální spektrum. Avšak jeho účinek proti stafylokokům je menší než u cefakloru. Hlavními indikacemi jsou infekce dýchacích cest, kožní infekce a infekce měkkých tkání a nekomplikované infekce močových cest.
Cefuroxim axetil má vyšší stabilitu ß-laktamázy, a tedy širší spektrum než jiné preparáty v této skupině. Může být užíván při bakteriálních infekcích horních (včetně otitis media) a dolních cest dýchacích, kožních infekcích a infekcích měkkých tkání a infekcích močových cest.
Perorální cefalosporiny skupiny 3 mají lepší účinek a širší spektrum proti enterobakteriím než preparáty ve skupině 2. Proti gramnegativním bakteriím je však jejich účinek nižší. Proti stafylokokům je účinek cefpodoximu proxetilu pouze průměrný, cefamet pivoxil, ceftibuten a cefixim nejsou účinné vůbec.
Hlavními indikacemi perorálních cefalosporinů skupiny 3 jsou komplikované infekce dýchacích cest, pokud je možné vyloučit stafylokoky a infekce způsobené enterobakteriemi, např. infekce močových cest nebo infekce u imunokompromitovaných pacientů. Cefalosporiny skupiny 3 jsou také vhodné pro přechod na perorální terapii, tj. pokud je třeba, aby počáteční parenterální terapie (aplikací parenterálních cefalosporinů skupiny 3a) pokračovala perorálně. Navíc se cefixim užívá také pro léčbu kapavky.
11.4.4 Monobaktamy
Z této skupiny je k dispozici pouze aztreonam. Je účinný pouze proti gramnegativním aerobům. V tomto ohledu je jeho spektrum a účinek podobný jako u parenterálních cefalosporinů skupiny 3b.
11.4.5 Karbapenemy
Karbapenemy jsou širokospektrální antibiotika s dobrým účinkem proti grampozitivním a gramnegativním bakteriím, zahrnujícím anaeroby. Jsou užívána zejména při léčbě kombinovaných infekcí a při počáteční léčbě život ohrožujících onemocnění, zahrnujících urosepsi. Na trhu jsou k dispozici imipenem/cilastin a meropenem.
11.4.6 Fluorochinolony
Nefluorizované chinolony se již nedoporučují vzhledem k jejich špatnému antibakteriálnímu účinku. Dle Paul Ehrlich Society for Chemotherapy jsou fluorochinolony klasifikovány do 4 skupin, v závislosti na jejich spektru účinku, farmakokinetice a indikacím (tab. 28).
Tab. 18. Klasifikace fluorochinolonů (upraveno dle Paul Ehrlich Society for Chemotherapy [3]). ![Klasifikace fluorochinolonů (upraveno dle Paul Ehrlich Society for Chemotherapy [3]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6fea18956d21cb1182ddb62169e46131.png)
Indikace fluorochinolonů skupiny 1 jsou omezeny pouze na infekci močových cest v některých zemích, např. Německu. Ve Francii a dalších zemích je k dispozici k systémovému perorálnímu parenterálnímu užití. Norfloxacin není k dispozici jako parenterální antibiotikum.
Fluorochinolony skupiny 2 zahrnují fluorochinolony pro systémovou aplikaci se širokým spektrem indikací. Zahrnují infekci močových cest, dýchacích cest, kožní infekce a infekce měkkých tkání, kostí, kloubů i systémové infekce, a dokonce sepsi. Fluorochinolony skupiny 2 vykazují dobrý účinek proti enterobakteriím a H. influenzae a menší účinek proti stafylokokům, pneumokokům a enterokokům i „atypickým“ patogenům, např. Chlamydia, Legionella a Mycoplasma. Jejich účinnost proti P. aeruginosa se různí, přitom je ciprofloxacin nejúčinnější in vitro. Navíc jsou ciprofloxacin, ofloxacin a fleroxacin k dispozici pro parenterální aplikaci.
Spektrum účinku fluorochinolonů skupiny 3 (levofloxacin a sparfloxacin) a fluorochinolonů skupiny 4 se liší od chinolonů skupiny 2 zejména tím, že mají lepší účinek proti grampozitivním patogenům, jako jsou stafylokoky, streptokoky, pneumokoky a enterokoky, se srovnatelným účinkem proti gramnegativním patogenům. Navíc jsou účinnější proti takzvaným „atypickým“ patogenům, jako je Chlamydia, Mycoplasma a Legionella spp. Navíc mají fluorochinolony 4. skupiny lepší účinek proti anaerobům. Jediným fluorochinolonem ze skupiny 3 dostupným pro parenterální aplikaci je levofloxacin. Zařazení levofloxacinu je obtížné, protože levofloxacin, antibakteriálně aktivní část ofloxacinu, jenž patří do skupiny 2. Hlavními indikacemi pro aplikaci levofloxacinu jsou infekce dýchacích cest a vzhledem ke svému vysokému vylučování ledvinami infekce močových cest, kožní infekce a infekce měkké tkáně.
Mezi fluorochinolony skupiny 4 patří gatifloxacin, moxifloxacin a trovafloxacin. Avšak v červnu 1999 byl trovafloxacin stažen z prodeje vzhledem k závažným vedlejším účinkům. Proto tedy není doposud k dispozici žádný parenterální fluorochinolon této skupiny. Kromě léčby infekcí dýchacích cest jsou tyto širokospektrální fluorochinolony vhodné pro léčbu kožních infekcí a infekcí měkkých tkání, intraabdominálních infekcí a perorální léčbu gynekologických infekcí. Avšak konečné posouzení jejich místa při léčbě těchto onemocnění zatím není možné posoudit. Gatfloxacin je při perorální aplikaci nejvíce vylučován ledvinami (asi 84 %). Proto je také nejvhodnější při léčbě nekomplikovaných a komplikovaných infekcí močových cest. Vylučování moxifloxacinu močí po perorální aplikaci je v rozmezí kolem 20 %.
TMP-SMX
Hlavními indikacemi pro aplikaci samotného TMP nebo v kombinaci se sulfonamidem, např. SMX je infekce močových cest. TMP s/bez SMX může být také užit pro profylaxi recidivující cystitidy. Procento rezistence E. coli se může lišit v jednotlivých zemích. Proto se nedoporučuje pro empirickou terapii akutní nekomplikované cystitidy nebo pyelonefritidy, pokud je procento rezistence v dané oblasti > 10–20 % [4]. U komplikované infekce močových cest by měl být TMP-SMX aplikován pouze dle výsledků testování senzitivity. TMP, zejména v kombinaci s SMX může vést k těžkým, i když vzácným negativním příhodám, jako je například Lyellův syndrom, Stevens-Johnsonův syndrom nebo pancytopenie.
Fosfomycin
Fosfomycin je účinný proti gramnegativním a grampozitivním bakteriím. Sodná sůl je pouze pro parenterální užití. Fosfomycin trometamol je určen pro léčbu nekomplikované cystitidy u žen jednou dávkou (3 g).
Nitrofurantoin
Antibakteriální účinek nitrofurantoinu je omezen na močové cesty vzhledem jeho nízkým koncentracím v séru. Je účinný proti E. coli, citrobakteru a většině kmenů Klebsiella a Enterobacter, zatímco Providencia a Serratia jsou většinou rezistentní. Proteus, P. aeruginosa a Acinetobacter jsou téměř vždy rezistentní. Je účinný proti grampozitivním kokům, např. enterokokům a stafylokokům. Nitrofurantoin je vhodný pouze pro léčbu nebo profylaxi nekomplikované infekce močových cest. Krátkodobá terapie při této indikaci nebyla prokázána v dostatečně velkých studiích. V průběhu mnoha let byl pozorován pouze malý vývoj rezistence. Léčba může vést k závažným, i když vzácným negativním příhodám, jako například deskvamativní intersticiální pneumonie s fibrózou.
11.4.7 Makrolidy
Jediný makrolid, který je k dispozici pro perorální i parenterální aplikaci je erytromycin. Novější druhy makrolidů, roxitromycin, klaritromycon a azitromycin jsou lépe snášeny než erytromycin, ale mohou být aplikovány pouze perorálně.
Makrolidy mají dobrý účinek proti streptokokům, pneumokokům, Bordetella pertussis, chlamydiím, mykoplazmatům a Legionelle spp. Vzhledem k tomu, že makrolidy nejsou účinné proti gramnegativním tyčinkám, jejich užití při léčbě infekce močových cest je omezeno na speciální indikace, jako jsou nego-nokoková uretritida způsobená Ch. trachomatis.
11.4.8 Tetracykliny
Rezistence pneumokoků, streptokoků a H. influenzae a E. coli vůči doxycyklinu a tetracyklinu vykazuje regionální rozdíly. Proto jsou tetracykliny určeny pouze pro počáteční empirickou terapii, v případě, že je lokální situace dostatečne známa a opravňuje jejich aplikaci. Vzhledem k jejich vysoké účinnosti proti takzvaným „atypickým“ patogenům (Legionella, Chlamydia, Mycoplasma spp.) mohou být aplikovány jako alternativní antibiotika při infekcích způsobených těmito mikroorganizmy, např. negonokoková uretritida způsobená Ch. trachomatis.
11.4.9 Aminoglykosidy
Aminoglykosidy jsou určeny pouze pro parenterální aplikaci a patří mezi medikamenty s úzkým terapeutickým spektrem. Efektivní hladiny jejich účinku jsou blízké hraničním toxickým koncentracím, čímž vyžadují přísné terapeutické indikace. Až na některé výjimky (např. léčba infekce močových cest) by měly být aminoglykosidy aplikovány pouze v kombinaci s jiným vhodným antibiotikem. Ideálními „partnery“ jsou antibiotika skupiny beta--laktamů, vzhledem k tomu, že tato kombinace má významný synergický účinek proti některým druhům bakterií. Jedním z nejstarších aminoglykosidů je streptomycin a je užíván pouze při léčbě tuberkulózy.
Novější aminoglykosidy zahrnují netilmicin, gentamycin, tobramycin a amikacin. Mají dobrý účinek proti enterobakteriím a Pseudomonas (zejména tobramycin). Jejich účinek proti streptokokům, anaerobům a H. influenzae není uspokojivý. Rezistence tobramycinu, gentamycinu a netilmicinu je téměř totožná, zatímco nejmenší rezistenci vykazuje proti mnoha enterobakteriím amikacin.
11.4.10 Glykopeptidy
Glykopeptidy vankomycin a teikoplanin jsou účinné proti grampozitivním patogenům, tj. stafylokokům (kmeny rezistentní na oxacilin), streptokokům, enterokokům, Clostridium difficile, difterickým bakteriím a grampozitivním anaerobům. Nepůsobí na gramnegativní patogeny. Jsou indikovány:
Při infekcích způsobených výše zmíněnými patogeny v případě alergie na jiná vhodná antibiotika.
V případě infekce způsobené enterokoky rezistentními na ampicilin nebo stafylokoky rezistentními na oxacilin nebo multirezistentními korynebakteriemi.
Jako alternativa k metronidazolu, v perorální formě, při léčbě pseudomembranózní kolitidy. Vzhledem k riziku selekce enterokoků a stafylokoků rezistentních na glykopeptidy, by mělo být jejich užití značně omezeno. Podobně jako aminoglykosidy mají glykopeptidy úzké terapetické užití.
11.4.11 Literatura
1. Scholz H, Naber KG, and an expert group of the Paul Ehrlich Society for Chemotherapy. Einteilung der Oralcephalosporine. Chemotherapie Journal 1999; 8 : 227-229.
2. Vogel F, Naber KG, Wacha H, Shah P, Sörgel F, Kayser FH, Maschmeyer G, Lode H, and an expert group of the Paul Ehrlich Society for Chemotherapy. Parenterale Antibiotika bei Erwachsenen. Chemotherapie Journal 1999; 8 : 3-49.
3. Naber KG, Adam D, and an expert group of the Paul Ehrlich Society for Chemotherapy. Einteilung der Fluorchinolone. Chemotherapie Journal 1998; 7 : 66-68.
4. Warren JW, Abrutyn E, Hebel JR, Johnson JR, Schaeffer AJ, Stamm WE. Guidelines for antimicrobial treatment of uncomplicated acute bacterial cystitis and acute pyelonephritis in women. Clin Infect Dis 1999; 29 : 745-758.
11.5 Bakterie relevantní pro urologické infekce.
(schéma)
Schéma. Bakterie relevantní pro urologické infekce. 
12. ZKRATKY UŽITÉ V TEXTU
ABP akutní bakteriální prostatitida
AIDS ‑acquired immunodeficiency syndrome/syndrom získaného defektu imunity
APCKD ‑adult polycystic kidney disease/polycystické onemocnění ledviny u dospělých
AUA ‑American Urological Association
B. fragilis Bacteriodes fragilis
BLI ‑beta-lactamase inhibitor/ inhibitor beta-laktamázy
BPH ‑benign prostatic hyperplasia/benigní hyperplazie prostaty
CBP ‑chronic bacterial prostatitis/ chronická bakteriální prostatitida
cfu ‑colony-forming unit/jednotka vytvářející kolonie
CMV cytomegalovirus
CPPS ‑chronic pelvic pain syndrome/ syndrom chronické pánevní bolesti
CRP C-reaktivní protein
CT ‑computed tomography/počítačová tomografie
Ch. tracho-matis Chlamydia trachomatis
DMSA ‑kyselina dimerkaptosukciniová
E. coli Escherichia coli
ESCMID ‑European Society of Clinical Microbiology and Infectious Diseases
EPS exprese prostatické sekrece
ESWL ‑extracorporeal shockwave lithotripsy/extrakorporální litotrypse rázovými vlnami
G-CSF ‑granulocyte-colony stimulating factor/stimulující faktory granulocytových kolonií
GM-CSF ‑granulocyte-macrophage-colony stimulating factor/granulocyte-macrophage-colony stimulating factor
HCO Health Care Office of the EAU
H. influenzae Haemophilus influenzae
HIV ‑human immunodeficiency virus/lidský virus defektu imunity
HPV ‑human papillomavirus/lidský papilomavirus
HSV herpes simplex virus
IDSA ‑Infectious Diseases Society of America
Ig imunoglobulin
IgG-FTA-Abs imunoglobin fluorescence treponoma antibody absorption text
IL interleukin
LCR ligase chain reaction/ ligázová řetězová reakce
LUTS ‑lower urinary tract symptoms/ symptomy dolních cest močových
M. cata - Moraxella catarrhalis rrhalis
MRSA ‑Staphylococcus aureus rezistentní na methicilin
MRSE ‑koagulázo-negativní stafylokokus-rezistentní na methicilin
MSU ‑mid-stream sample of urine/ vzorek středního proudu moči
M. tuber - Mycobacterium tuberculosisculosis
N. gono - Neisseria gonorrhoeae rrhoeae
NIDDK ‑National Institute of Diabetes, Digestive and Kidney Diseases
NIH ‑National Institutes of Health
PaCO2 ‑parciální tlak oxidu uhličitého v alveolárním plynu
P. aerugi - Pseudomonas aeruginosa nosa
PCR ‑mid-stream sample of urine/polymerázová řetězová reakce
P. mirabilis Proteus mirabilis
PSA ‑prostatický specifický antigen
RPR rapid plasma reagin
S. aureus Staphylococcus aureus
SIRS ‑mid-stream sample of urin/syndrom systémové zánětlivé odpovědi
SMX sulphamethoxazole
S. sapro - Staphylococcus phyticus saprophyticus
STD ‑sexually transmitted diseases/sexuálně přenosná onemocnění
STI ‑sexually transmitted infection/sexuálně přenosná infekce
Tc technecium
TMP trimethoprim
TNF ‑tumour necrosis factor/ tumor-nekrotizující faktor
TPHA ‑treponoma pallidum hemagglutionation test
TURP ‑transurethral resection of the prostate/transuretrální resekce prostaty
T. vaginalis Trichomonas vaginalis
UTI ‑urinary tract infection/ infekce močových cest
VB1 ‑first-voided urine/první proud moči
VB2 ‑mid-stream urine/střední proud moči
VB3 ‑voided bladder urine-3 moč vytlačená z močového měchýře
VCU ‑voiding cysto-urethography/ mikční cysto-uretrografie
VDRL ‑venereal disease research laboratories test
VUR veziko-ureterický reflux
WBC leukocyty
WHO World Health Organisation
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2006 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- SOUČASNÉ POSTAVENÍ ANGIOGRAFIE LEDVIN VČETNĚ INTERVENCÍ
- MOŽNOSTI ULTRAZVUKU V DIAGNOSTICE UROLOGICKÝCH ONEMOCNĚNÍ
- ULTRASONOGRAFIE PROSTATY, SEMENNÝCH VÁČKŮ A MOČOVÉHO MĚCHÝŘE
- ZOBRAZOVÁNÍ MUŽSKÉHO GENITÁLU
- NATIVNÍ CT-VYŠETŘENÍ U UROLITIÁZY
- DIFERENCIÁLNÍ DIAGNOSTIKA CYSTICKÝCH LÉZÍ LEDVIN
- DVOUFÁZOVÁ MULTIDETEKTOROVÁ CT-ANGIOGRAFIE NÁDORŮ LEDVIN
- MOŽNOSTI ZOBRAZENÍ NÁDORŮ UROGENITÁLNÍHO TRAKTU POMOCÍ 18FDG-PET/CT
- Editorial
- MRI-VYŠETŘENÍ UROGENITÁLNÍHO SYSTÉMU - NOVÉ POSTUPY A JEJICH VYUŽITÍ
- VYŠETŘENÍ ZOBRAZENÍM MAGNETICKOU REZONANCÍ V UROLOGICKÝCH INDIKACÍCH
- KONVENČNÍ RENTGENOVÁ VYŠETŘENÍ VÝVODNÝCH CEST MOČOVÝCH
- RETROPERITONEÁLNÍ FIBRÓZA: NOVÉ ONEMOCNĚNÍ ZPŮSOBENÉ AZBESTEM?
- ELIGARD - NOVÝ LHRH-AGONISTA K DISPOZICI ČESKÉMU UROLOGOVI
- ZPRÁVA Z 21. VÝROČNÍHO KONGRESU EVROPSKÉ UROLOGICKÉ ASOCIACE, PAŘÍŽ 5.– 8. DUBNA 2006
- ZPRÁVA O VI. JARNÍM UROLOGICKÉM SYMPOZIU
- ADVANCED COURSE ON PROSTATE CANCER AND LAPAROSCOPIC SURGERY, BRUSEL, 4. - 5. 5. 2006
- ZE ZAHRANIČNÍCH PERIODIK
- GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH A POHLAVNÍCH CEST U MUŽŮ 2. ČÁST
- KVÍZ
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- DIFERENCIÁLNÍ DIAGNOSTIKA CYSTICKÝCH LÉZÍ LEDVIN
- NATIVNÍ CT-VYŠETŘENÍ U UROLITIÁZY
- MOŽNOSTI ULTRAZVUKU V DIAGNOSTICE UROLOGICKÝCH ONEMOCNĚNÍ
- VYŠETŘENÍ ZOBRAZENÍM MAGNETICKOU REZONANCÍ V UROLOGICKÝCH INDIKACÍCH
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání