-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Breast conservative surgery after neoadjuvant oncologic treatment for breast carcinoma at the 1st Department of Surgery, 1st Faculty of Medicine of Charles University and General Teaching Hospital in Prague over a ten-year period (2004−2013)
Breast conservative surgery after neoadjuvant oncologic treatment for breast carcinoma at the 1st Department of Surgery, 1st Faculty of Medicine of Charles University and General Teaching Hospital in Prague over a ten-year period (2004−2013)
Introduction:
Since the first breast conservative surgery following neoadjuvant oncotherapy performed in the 1990s, there has been a shift in indications, diagnostic, surgical and oncotherapeutic procedures. The aim of the study is to present the results of the comprehensive treatment of patients with breast conservative surgery performed after neoadjuvant oncologic treatment for breast cancer at our department of surgery.Method:
A retrospective study involving 96 patients operated on at our department between 2004 and 2013. The median follow-up time is 6 years and 8 months after the diagnosis.Results:
Breast recurrence was found in 2 (2.1%) cases. No axillary recurrence occurred. A total of 8 (8.3%) patients with generalized carcinoma of the breast died. Total remission was achieved in 81 (84.4%) patients. 76 (79.2%) patients survive in the CR.Conclusions:
The results of the studies mentioned below as well as our results have shown that BCS after neoadjuvant oncologic therapy is safe and effective in appropriately selected patients.Key words:
breast cancer − neoadjuvant therapy – breast-conserving surgery – recurrence –cosmetic outcome
Autoři: J. Šuk; I. Schwarzbacherová; K. Kimleová
Působiště autorů: I. chirurgická klinika 1. LF Univezrity Karlovy a VFN v Praze přednosta: prof. MUDr. Z. Krška, CSc.
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 10, s. 432-437.
Kategorie: Původní práce
Souhrn
Úvod:
Od prvních prs šetřících výkonů po neoadjuvantní onkologické terapii provedených v 90. letech 20. století nastal posun v indikacích, diagnostických, chirurgických i onkoterapeutických postupech. Cílem práce je prezentovat dosažené výsledky komplexní léčby pacientek s provedeným prs šetřícím výkonem po neadjuvantní onkoterapii pro karcinom prsu operovaných na naší klinice.Metoda:
Retrospektivní studie zahrnující 96 pacientek operovaných na klinice v letech 2004 až 2013. Medián doby sledování je 6 let a 8 měsíců od stanovení diagnózy.Výsledky:
Recidiva v prsu ve 2 (2,1 %) případech. V axile bez recidivy. Na generalizaci zemřelo 8 (8,3 %) pacientek. Celková remise dosažena u 81 (84,4 %) pacientek. V celkové remisi přežívá 76 (79,2 %) pacientek.Závěr:
Jak ukazují výsledky níže zmíněných studií i výsledky naše, je pro vhodně vybrané pacientky provedení prs šetřícího výkonu po neoadjuvantní onkologické léčbě bezpečné a efektivní.Klíčová slova:
karcinom prsu – neadjuvantní terapie – prs šetřící operace – recidiva – kosmetický výsledekÚvod
Neoadjuvantní onkologickou terapií (NAOT) označujeme takovou léčebnou modalitu, která předchází chirurgickému výkonu. Její klinická aplikace započala v 80. letech a rozšířila se v následujícím desetiletí minulého století [1].
Indikace k NAOT se neomezuje jen na lokálně pokročilé kacinomy, ale je stále více využívána u nemocných s metastatickým postižením axilárních lymfatických uzlin. K neoadjuvantní onkologické léčbě je indikováno v multidisciplinárních týmech více pacientek než dříve. V neoadjuvanci mohou být využity různé modality onkologické léčby izolovaně i v kombinaci (hormonoterapie, chemoterapie i „biologická léčba“). Ukazuje se, že v indikaci k NAOT je vhodné zvažovat především biologické vlastnosti nádoru a indikovat ji u nádorů pokročilých s agresivnějšími biologickými vlastnostmi.
Z onkologického hlediska NAOT umožňuje časné hodnocení efektu léčby. Vede k redukci nádorové zátěže umožňující větší počet prs šetřících výkonů, zmenšení inoperabilních nádorů umožňující kurativní intervenci, použití rezidua nádoru jako prognostického markeru pro výběr následné léčby u jednotlivých pacientů. Umožňuje tedy úpravu léčby dle odpovědi. Léčbu lze měnit, pokud nádor neodpovídá, a znamená tak redukci expozice neúčinné nebo toxické léčbě. Umožňuje též upřesnění predikce rizika relapsu podle patologické odpovědi na neoadjuvantní léčbu. Patologická kompletní odpověď (pCR) je konzistentně spojována s příznivými výsledky, zvláště u hormonálně negativních nádorů jak s HER 2 negativitou (tripple negativní karcinomy), tak s HER 2 pozitivitou. Jak ukazují výsledky studií, je pro vhodně vybrané pacientky provedení prs šetřícího výkonu po neoadjuvantní onkologické léčbě bezpečné a efektivní.
První prs šetřící výkon (PŠV) po neadjuvantní onkologické terapii karcinomu prsu jsme provedli na naší klinice 29. 9. 1998, podle dostupných informací jako jedni z prvních, spíše však premiérově v Čechách, na Moravě i ve Slezsku [1,2,3,4,5,6,7,8,9,10,11,12,13,14]. Výsledky v souboru pacientek s PŠV po NAOT jsme referovali na chirurgickém kongresu v Hradci Králové a Pardubicích v září 2004. Náš tehdejší soubor čítal 93 pacientek za období od ledna 1998 do prosince 2003. Indikace k NAOT byla u všech pro lokálně pokročilý karcinom. U 76 pacientek jsme provedli ablaci prsu, pouze u 17 pacientek PŠV. U všech pacientek byla v tomto období provedena exenterace axily. U dvou pacientek po PŠV jsme museli tehdy vzhledem k definitivnímu histologickému vyšetření provést časně snesení celého prsu. Tehdy jsme v průměrné době sledování 2 roků a 4 měsíců zaznamenali při sledování lokoregionálních recidiv jednu recidivu karcinomu v prsu.
Metoda
Cílem naší nyní publikované retrospektivní studie je zhodnotit, jaké jsou dlouhodobé výsledky multidisciplinární terapie našich pacientek s karcinomem prsu indikovaných k PŠV po neadjuvantní onkologické léčbě v dalším období (od roku 2004). Výsledky v našem souboru pacientek chceme porovnat s výsledky publikovanými. Uvádíme též, jaké praktické postupy se nám osvědčily v našem multidisciplinárním týmu, i náš názor, jaké skutečnosti považujeme za nutné respektovat přímo při operaci a pooperačním sledování pacientky chirurgem.
Abychom zajistili minimální medián doby sledování 5 let od stanovení diagnózy, hodnotíme soubor pacientek operovaných na klinice od ledna 2004 do prosince 2013. Celkem jsme v těchto deseti letech provedli prs šetřící výkon u 96 pacientek po neadjuvantní onkoterapii.
Před operací (po skončení či před poslední dávkou NAOT) byla pacientce provedena kontrolní mamografie a ultrazvuk. Rezidua nádorů, která měla sonografický korelát, byla značena již těsně před operací (den před operací nebo v den operace ráno) pod US s označením na kůži prsu vždy s popisem diagnostika uvádějícím velikost rezidua a jeho vzdálenost od kůže a fascie v poloze pacientky odpovídající její poloze při operaci. U pacientek s velmi příznivou reakcí na neadjuvantní léčbu a možností dosažení kompletní zobrazovací remise byl tumor již v průběhu neoadjuvance značen nejčastěji zavedením kovového klipu ke středu nádoru pod US kontrolou. Bezprostředně před operací byly tyto klipy značeny většinou zavedením drátku ke klipu buď pod US kontrolou, či za využití stereotaktické mamografie. Výjimečně jsme operovali pacientky s označením okrajů nádoru pod US aplikací uhlíku do kůže a intraparenchymatozně, provedenou ještě před či během probíhající neoadjuvance. Operatéři resekovali tumory se snahou o makroskopický lem 1−2 cm. Vždy byly resekovány stěny kavity zvláště (shaving) a vyšetřeny též při definitivním histologickém zpracování.
Je-li ke značení místa původního uložení nádoru využito kovového klipu či má-li tumor korelát na mamografii, provádíme peroperačně RTG resekátu. Je možné jej provést v jedné či ve dvou projekcích. Okraje resekátu vždy značíme pro patologa různě dlouhými stehy do 4−5 směrů. K nim přivazujeme kovové značky vytvarované ze sterilizovaných svorek do kancelářské sešívačky, viz Obr. 1.
Obr. 1. Peroperační RTG resekátu − okraje značeny „písmeny“ ze svorek z kancelářské sešívačky; klipem je značené reziduum nádoru v centru resekátu Fig. 1: Peroperative X-ray of the resected specimen – margins marked with “letters” (staples for desktop stapler); tumor residuum marked with a clip in the center of the specimen 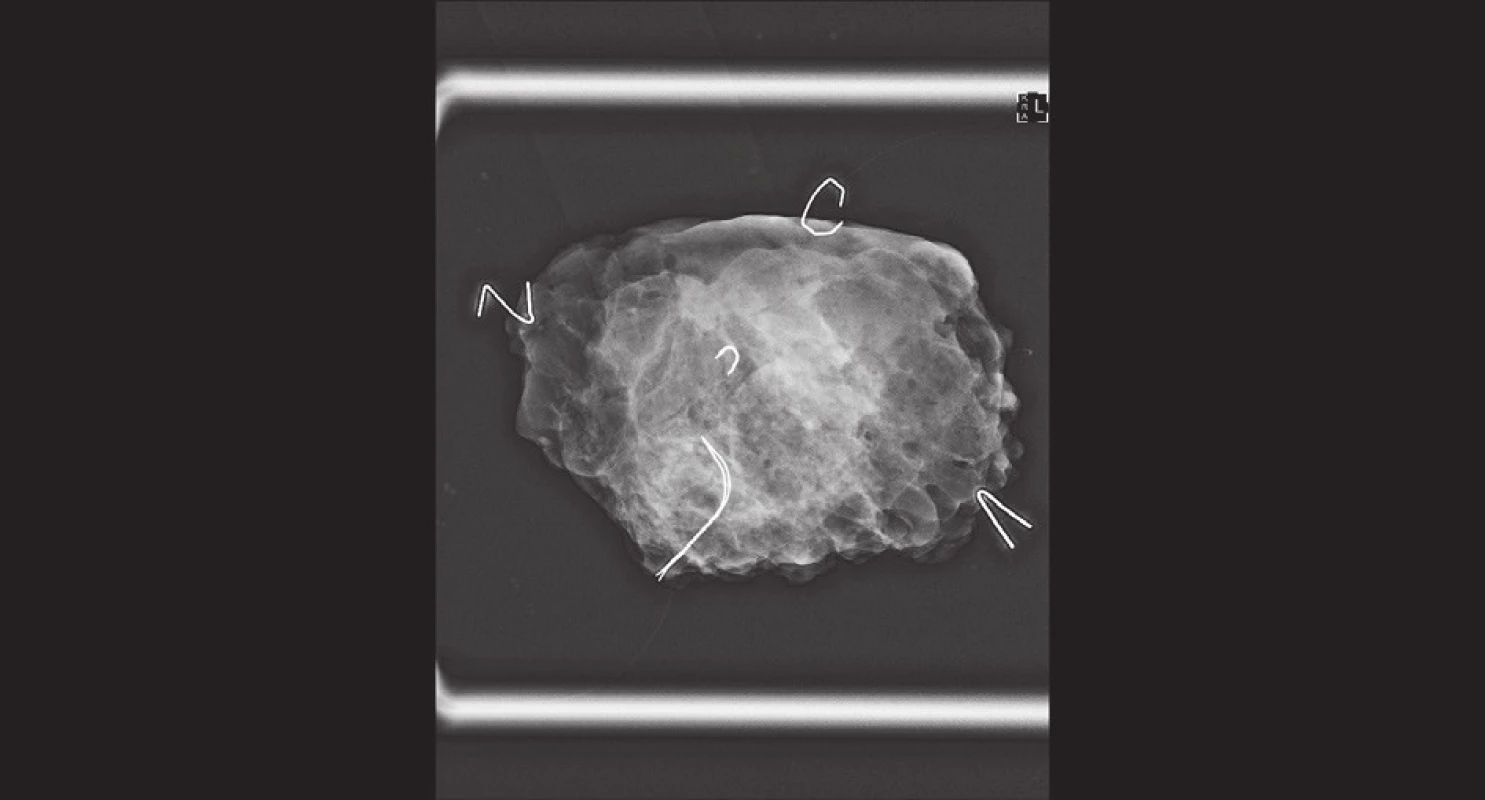
Četnost či šíři shavingových resekátů do jednotlivých směrů v prsu je tak možno určit dle výsledku peroperačního RTG vzorku. Respektive dle vzájemného vztahu nádoru či označeného místa původního uložení nádoru a kovových značek patrných na RTG vzorku při jeho okrajích, viz Obr. 2.
Obr. 2. Peroperační RTG resekátu − okraje značeny „písmeny“ ze svorek z kancelářské sešívačky; klipem je značené reziduum nádoru v okraji resekátu (tímto směrem je poté shavingový resekát širší Fig.2: Peroperative X-ray of the specimen – margins marked with “letters” (staples for a desktop stapler); tumor residuum marked with a clip near the margin of the specimen (shaving in this direction is wider) 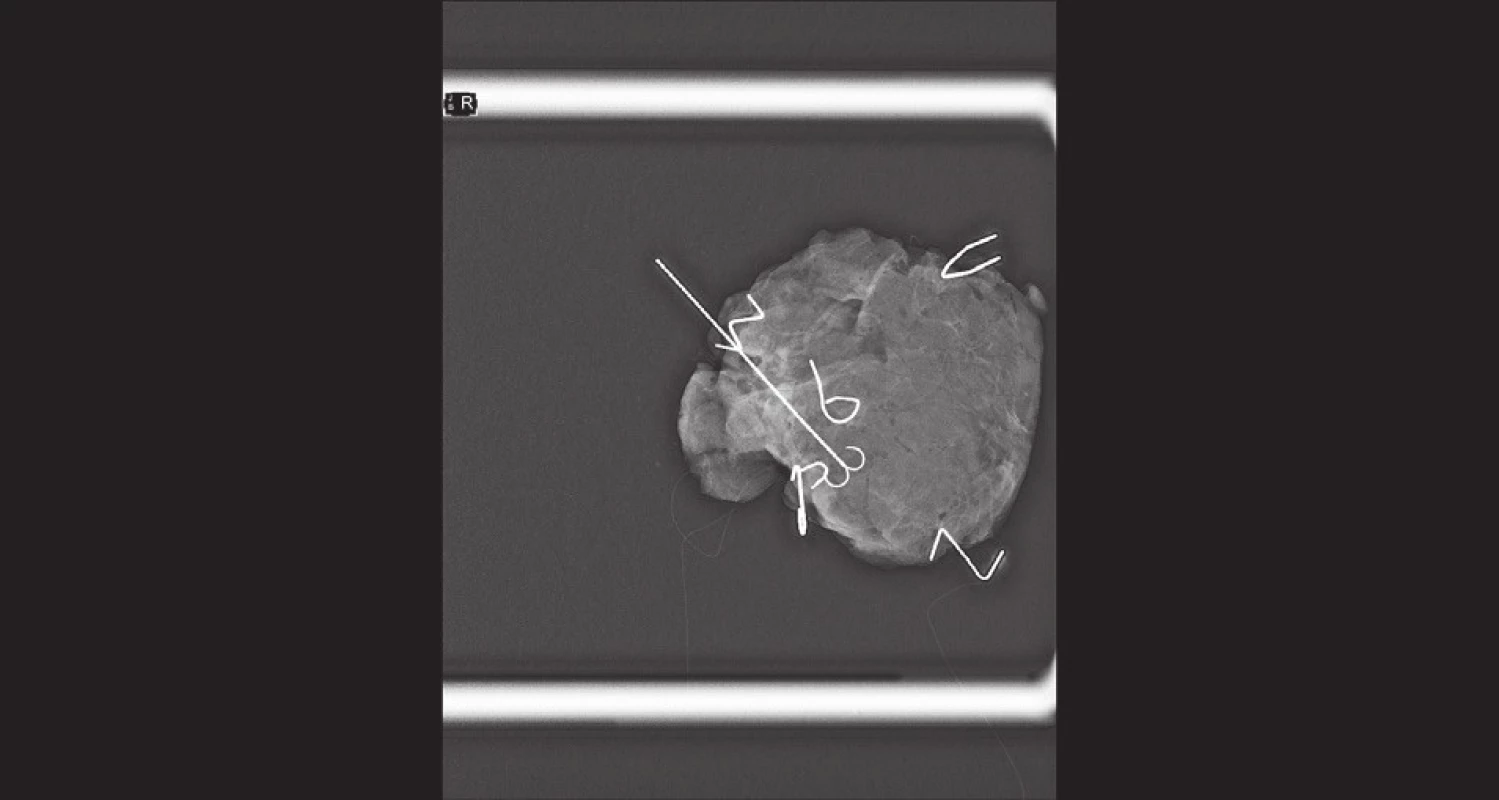
Kavitu v prsu jsme zašívali jen adaptačně či vůbec a nedrénovali. Pouze dle potřeby jsme evakuovali punkcí serosanguinolentní tekutinu, která retinovala v kavitě, při převazech.
Jako indikaci pro reresekci jsme stanovili přítomnost invazivního nádoru či karcinomatózní lymfangiopatie, eventuálně DCIS u invazivních nádorů s jeho složkou ve skutečné resekční linii shavingových resekátů (jejich plocha odvrácená od místa původního uložení nádoru). Plochu přivrácenou značíme pro patologa stehy.
U všech pacientek s US suspekcí či histologicky potvrzenou infiltrací axilárních uzlin před započetím neoadjuvance či diagnostikované během NAOT při kontrolních vyšetřeních pacientky ultrazvukem jsme provedli při operaci exenteraci axily. U ostatních byly mapovány SLN, které vyšetřujeme peroperační biopsií.
Výsledky
Počet PŠV po NAOT má v jednotlivých letech na naší klinice stoupající tendenci. V posledních čtyřech letech (2013−2016) jsme odoperovali celkem 403 pacientek s karcinomem prsu. U 143 z nich jsme provedli ablaci prsu. U 260 prs šetřící výkon. U 59 z nich se jednalo o PŠV po neadjuvantní onkoterapii.
V této původní práci hodnotíme soubor pacientek operovaných na klinice v letech 2004−2013. V tomto období jsme na I. chirurgické klinice VFN v Praze provedli PŠV po NAOT pro karcinom prsu celkem u 96 pacientek. V době diagnózy bylo nejmladší pacientce 27, nejstarší pacientce (prodělala neadjuvantní hormonální terapii) 75 let.
Rozdělení pacientek v našem souboru dle věku, viz Graf 1.
Graf 1. Věk pacientek Graph 1: Patient age 
Nejčastějším histologickým typem diagnostikovaným u 69 pacientek našeho souboru byl invazivní duktální karcinom (IDC nyní NST). Spolu s IDC (NST) se složkou DCIS u deseti pacientek představují 82,3 % histologických typů karcinomu v našem souboru, viz Graf 2.
Graf 2. Histologické typy karcinomu prsu Graph 2: Histological types of breast carcinoma 
Největší skupinu pacientek indikovaných k NAOT tvořily v našem souboru pacientky s TNM klasifikací T2N1M0 (31 pacientek) spolu se skupinami pacientek s hodnocením T2N0M0 a T1N1M0 (20, respektive 18 pacientek) představují 70,8 % našeho souboru. Podrobněji viz Graf 3.
Graf 3. TNM klasifikace před neoadjuvantní léčbou Graph 3: TNM classification prior to neoadjuvant therapy 
U většiny pacientek v souboru bylo dosaženo NAOT nižšího stadia onemocnění. Kompletní patologické remise bylo dosaženo u 17 (17,7 %) pacientek. Podrobněji opět viz Graf 4.
Graf 4. TNM klasifikace po neoadjuvantní léčbě Graph 4: TNM classification after neoadjuvant therapy 
Medián doby sledování pacientek v našem souboru byl 6 let a 8 měsíců od stanovení diagnózy. Nejdelší doba sledování u pacientky doposud v celkové remisi byla 13 let a 4 měsíce (operace únor 2004, kontrola leden 2017). Nejkratší doba sledování byla 2 roky u dvou zemřelých pacientek.
V uvedené době sledování v našem souboru zemřelo celkem 13 (13,5 %) pacientek, z toho v souvislosti se základní diagnózou karcinomu prsu při jeho generalizaci 8 a na jiná onemocnění bez souvislosti s diagnózou karcinomu prsu 5 pacientek. V celkové remisi zemřelo 5 pacientek a 76 (79,2 %) jich v celkové remisi nadále přežívá. Celkové remise bylo tedy dosaženo u 81 (84,4 %) pacientek.
Ke znovuobjevení choroby ve smyslu vzdálených metastáz došlo ve sledovaném období u 13 (13,5 %) pacientek, z toho doposud přežívá pět.
Pouze u dvou (2,1 %) pacientek z daného souboru jsme zaznamenali ve sledovaném období lokální recidivu karcinomu v prsu. Níže uvádíme stručný souhrn průběhu léčby těchto pacientek.
První z nich byl PŠV s EA po NAOT proveden ve věku 63 let (p y Tis p y N 0 M 0).
Při recidivě v prsu po pěti letech od první operace podstoupila ablaci prsu a nyní přežívá téměř 7 let od stanovení diagnózy.
U druhé, 33leté nemocné s diagnózou roztroušené sklerózy po PŠV s EA (p y T1c p y N3a (16/14+) MX) i přes pokračující celkovou onkologickou adjuvantní léčbu se jednalo o časnou recidivu agresivního karcinomu (IDC s nekrózami, G-III, ER neg PR neg HER-2 slabě +, MIB 60−70 %) ve smyslu infiltrace prsu, ale i přítomnosti karcinomatózní lymfangiopatie v kůži prsu již za 4 měsíce po operaci. Pacientka byla poté léčena opětovně celkově onkologicky. Vzhledem k probíhající adjuvantní onkologické léčbě neproběhla RT prsu. Za rok od první operace jsme provedli prostou ablaci prsu s výsledkem R 0 resekce. Po této operaci za dva měsíce pacientka zemřela bez známek generalizace malignity či lokoregionální recidivy na atypickou pneumonii, pravděpodobně jako komplikaci pokračující onkologické léčby.
Nejkratšími intervaly do znovuobjevení choroby (DFI) byly 4 měsíce po operaci u výše uvedené pacientky a 5 měsíců od operace u 42leté nemocné po PŠV s EA. U této nemocné se jednalo o metastázu v páteři řešenou operačně a RT (C5,C7). V dalších 2 letech tato nemocná měla obdobně léčené metastázy v dalších obratlích (Th1 a C2, 3). Nyní přežívá tato pacientka zatím bez dalších známek choroby celkem 4 roky a 9 měsíců od stanovení diagnózy a asi 1 rok od poslední chirurgické intervence a RT v oblasti C2,3.
Co se týká ošetření regionálních uzlin u pacientek bez podezření na postižení axilárních uzlin při počátku neoadjuvantní léčby na ultrazvuku (US) jsme mapovali sentinelové uzliny (SLN). Těchto pacientek bylo v našem souboru 24 (25 %). U 22 z nich byly SLN prosté metastáz. U dvou pacientek jsme pro přítomnost makrometastáz v SLN provedli exenteraci axily (EA). U dvou pacientek jsme v rámci jiné studie provedli EA i při negativitě SLN stran přítomnosti nádorových změn. U všech pacientek s US suspekcí či histologicky potvrzenou infiltrací axilárních uzlin před započetím neoadjuvance jsme provedli při operaci exenteraci axily. Celkem tedy v našem souboru 96 pacientek podstoupilo EA 76 (79,1 %) pacientek. Dvacet pacientek mělo pouze exstirpaci nádoru prostých SLN. Rozmezí počtu exstirpovaných SLN u jedné pacientky bylo od jedné do osmi LU.
U žádné pacientky z našeho souboru jsme ve sledovaném období nezaznamenali recidivu karcinomu v axile. Pouze u jedné z pacientek, u které bylo v exenterátu axily nalezeno 60 LU, z toho 38 infiltrovaných nádorem, byla po jednom roce od operace diagnostikována infiltrace uzlin nadklíčkových. Tato pacientka zemřela na generalizaci ca prsu po 2 letech a 4 měsících od stanovení diagnózy bez známek lokoregionální recidivy.
Lymfedém paže jsme zaznamenali u 23 (24 %) pacientek. U 22 byl stupně I – II, dobře ovlivnitelný příslušnou terapií. U jedné pacientky se jednalo o lymfedém III. stupně léčený intenzivně 3 a půl roku, který se objevil rok po operaci a půl roku po ozáření prsu, axily i nadklíčku celkem 60 Gy. Pacientka přežívá 5 let od diagnózy v CR.
Kosmetický výsledek hodnotily pacientky samy v pětistupňové škále (viz Graf 5). Z 83 žijících pacientek s prsem po prs šetřícím výkonu po NAOT se nám podařilo osobně kontaktovat 76 (91,6 %) pacientek. 47 (61,8 %) z nich hodnotilo kosmetický výsledek jako výborný, 21 (27,6 %) jako velmi dobrý, sedm (9,2 %) jako průměrný a jedna (1,3 %) jako špatný, jako nepřijatelný nehodnotila kosmetický výsledek žádná pacientka.
Graf 5. Hodnocení kosmetického výsledku našimi pacientkami Graph 5: Evaluation of the cosmetic outcome by our patients 
Zařadili jsme sem i pacientky s genovými mutacemi BRCA I a BRCA II s karcinomem prsu s dotazem na kosmetický výsledek původního PŠV pro karcinom, který předcházel kompletnímu odstranění obou prsních žláz s různými druhy plastickochirurgických výkonů. Obdobně byl hodnocen přežívající pacientkou s lokální recidivou karcinomu prsu (viz stručná prezentace tohoto případu výše) kosmetický výsledek původního PŠV.
Diskuze
Co se týká informací z odborné literatury prezentovaných na velkých souborech pacientek, metaanalýza publikovaná v říjnu 2016 [15] hodnotila výskyt lokálních recidiv u pacientek původně s lokálně pokročilým karcinomem prsu „předléčených“ neoadjuvantní chemoterapií. Porovnávala množství recidiv ve skupině pacientek s PŠV oproti skupině pacientek s provedenou mastektomií. Autoři zpracovali 8 studií na dané téma publikovaných od ledna 2010 do června 2015. Metaanalýza srovnávala množství lokálních recidiv u pacientek léčených chirurgicky PŠV nebo mastektomií. V obou skupinách předcházela operaci neoadjuvantní chemoterapie.
Metaanalýza zahrnula 8 studií s celkem 3215 pacientkami. Prevalence lokální recidivy byla 9,2 % bez významného rozdílu ve skupině po PŠV oproti 8,3 % ve skupině po mastektomii.
V závěru studie je konstatováno, že u lokálně pokročilého karcinomu prsu léčeného neoadjuvantní chemoterapií není následný PŠV oproti event. následné mastektomii zatížen větším výskytem lokální recidivy či kratší dobou přežití bez lokální recidivy. Naopak tím, že je nádor chemoterapií zmenšen, umožňuje provedení PŠV i u pacientek, u kterých by to bez neoadjuvance nebylo možné.
První soubor z MD Anderson centra [16,17] publikovaný v r. 2004 uvádí soubor 340 pacientek léčených PŠV po příznivé odezvě na neoadjuvantní chemoterapii. Autoři uvádějí 5 % lokálních recidiv v pětiletém a 10 % v desetiletém sledování. V jejich souboru mělo 72 % pacientek zpočátku klinická stadia II b nebo III. Pro úvahy k indikaci k PŠV po neoadjuvanci jsou zde identifikovány čtyři faktory, které nezávisle na sobě zvyšovaly riziko lokoregionální recidivy v jejich souboru: N2 nebo N3 v TNM klasifikaci, lymfovaskulární invaze, multifokalita rezidua nádoru a zbytkový nádor větší než 2 cm v průměru [16,17].
NSABP nedávno aktualizoval své údaje o zachování prsu po neoadjuvantní chemoterapii kombinací dat pacientů zařazených do studií B-18 a B-27. Ve své analýze 1100 pacientů uvádí v desetiletém sledování 10,3 % lokoregionálních recidiv [18].
Snad v poslední aktualizaci svých zkušeností publikované v r. 2013 [16,19] prezentují autoři z MD Anderson centra soubor 652 pacientek, které podstoupily nejdříve neoadjuvantní onkologickou léčbu, poté PŠV a následně radioterapii (RT) celého prsu. Lokoregionálních recidiv v jejich souboru bylo v pětiletém sledování 6,6 % a ve sledování desetiletém 9,7 %.
Opět zde uvádějí faktory, které v jejich souboru pacientek byly identifikovány jako faktory zvyšující riziko lokoregionální recidivy. Věk méně než 50 let, klinické stadium III, G-III, nádory ER negativní, nádory ER pozitivní bez hormonální terapie, multifokalita rezidua nádoru, přítomnost lymfovaskulární invaze a těsné či pozitivní okraje v resekátu.
Jsme si vědomi, že faktorů, které určují výsledky uvedených studií i výsledky naše, je mnoho. Nemáme ambice postihnout všechny faktory, které mají význam pro definitivní výsledek léčby. Hodnotíme proto naše výsledky z více či méně zúžené perspektivy. Jde o pohled chirurgů, kteří jsou součástí multidisciplinárního týmu, který podle našeho přesvědčení pracuje ve prospěch našich pacientek se vzájemným respektem a důvěrou. Hodnotíme tedy fakta důležitá pro chirurga. Problematiky diagnostické, patologickoanatomické a zvláště onkologické se dotýkáme jen okrajově.
Léčebné výsledky u pacientek našeho souboru jsou srovnatelné s výsledky zmiňovanými v odborné literatuře u souborů čítajících mnohem větší množství pacientek. Jsme jistě velmi spokojeni s dosaženými výsledky v počtu lokoregionálních recidiv a s kladným hodnocením kosmetického výsledku pacientkami. Jako operatéři především za tyto výsledky cítíme v rámci týmu větší zodpovědnost.
Závěr
Jak ukazují výsledky výše zmíněných studií i výsledky naše, je pro vhodně vybrané pacientky provedení prs šetřícího výkonu po neoadjuvantní onkologické léčbě bezpečné a efektivní. Předpokladem pro dosažení vynikajících výsledků je úzká spolupráce členů multidisciplinárního týmu. Každý z členů přispívá svým dílem k dosažení příslušného výsledku léčby a jeden bez druhého se již skutečně dnes neobejde. Ať už máme na mysli diagnostiky, chirurgy, onkology, patology, lékaře oddělení nukleární medicíny až po lékaře rehabilitační, výbornými léčebnými výsledky u svých pacientek mohou být potěšeni především díky vzájemné spolupráci. Ta je mnohem snazší a efektivnější ve velkých centrech s velkými počty léčených pacientek. Velké zkušenosti lékařů, ale i středních zdravotnických pracovníků v těchto centrech umožňují individuální přístup ke každé pacientce, a je-li v těchto týmech udržován vysoký standard v kvalitě práce všech odborníků, je možné dosahovat skvělých výsledků v léčbě pacientů.
Seznam použitých zkratek:
BRCA I, II – breast cancer genes 1 and 2
CR – celková remise
DCIS – duktální karcinom in situ
DFI – období bez známek choroby
EA – exenterace axily
ER – estrogenové receptory
G III – grading III
IDC – invazivní duktální karcinom (nyní NST)
LU – lymfatická uzlina
NAOT – neadjuvantní onkoterapie
NSABP – National Surgical Adjuvant Breast and Bowel Project
NST – invazivní karcinom nespeciálního typu (dříve IDC)
pCR – patologická celková remise
PR – progesteronové receptory
PŠV – prs šetřící výkon
RT – radioterapie
SLN – sentinelová uzlina
US – ultrasonografické vyšetření
Poděkování
Jsme si vědomi, že v naší práci publikovaných výsledků by bez týmové spolupráce nebylo možno dosáhnout. Naše sdělení v časopisu Rozhledy v chirurgii považujeme také za dík všem členům týmu za jejich práci pro naše společné pacienty.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Jindřich Šuk
I. chirurgická klinika 1. LF UK a
VFN
U nemocnice 2
128 08 Praha 2
e-mail: jindrichsuk@seznam.cz
Zdroje
1. Jandík P. Operace karcinomu prsu po neadjuvantní léčbě – výhody a nevýhody z pohledu chirurga a přínos pro pacientku. Breast Cancer News 2015;5 : 10−4.
2. Coufal O, Fait V, Foltinová V, et al. Chirurgická léčba karcinomu prsu v MOÚ. Rozhl Chir 2007;86 : 540−7.
3. Duda M, Hartl P, Hartlová M, et al. Záchovné operace karcinomu prsu, Rozhl Chir 1997;76 : 605−8.
4. Fait V, Chrenko V, Gatěk J. Sentinelová biopsie u karcinomu prsu a neoadjuvantní chemoterapie. Klin Onkol 2005;18 : 77−9.
5. Fait V, Chrenko V, Schneiderová M, et al. Změny ve spektru operací prsu po zavedení mahárního screeningu. Klin Onkol 2007;20 : 38−41.
6. Fait V, Coufal O, Gatěk J. Chirurgie karcinomu prsu v České republice. Rozhl Chir 2010;89 : 229−30.
7. Fait V, Coufal O, Gatěk J. Chirurgie karcinomu prsu v České republice. Klin Onkol 2009;22 : 294–5.
8. Gatěk J, Duben J, Dudešek B, et al. Výsledky konzervativní terapie u časného karcinomu prsu. Rozhl Chir 2000;79 : 201−5.
9. Chrenko V, Žaloudík J, Pačovský Z, et al. Parciální mastektomie v terapii mléčné žlázy. Rozhl Chir 1992;71 : 15−20.
10. Chrenko V, Fait V, Vagunda V, et al. Konzervativní chirurgie v rámci komplexní léčby karcinomu prsu. Klin Onkol 1997;10 : 54−9.
11. Chrenko V, Fait V, Rejthar A, et al. Konzervativní léčba časných stadií karcinomu prsu. Klin Onkol 1995;8 : 120−3.
12. Jandík P. Neoadjuvance u karcinomu prsu. Breast Cancer News 2016;6 : 25−30.
13. Jandík P. Pohled chirurga na operační výkon po neoadjuvanci. Breast Cancer News 2011;1 : 5−9.
14. Petráková K, Růžičková J, Fait V. Léčebné postupy u karcinomuprsu. Klin Onkol 2008;21 : 131−40.
15. Zhou X, Li Y. Local recurrence after breast-conserving surgery and mastectomy following neoadjuvant chemotherapy for locally advanced breast cancer − a meta-analysis. Breast Care 2016;11 : 345−51.
16. T A, Mittendorf EA, Kelly KK. Surgical considerations after neoadjuvant chemotherapy: Breast conservation therapy. J Natl Cancer Inst Monogr 2015;51 : 11−4.
17. Chen AM, Meric-Bernstam F, Hunt KK, et al. Breast conservation after neoadjuvant chemotherapy: the MD Anderson cancer center experience. J Clin Oncol 2004;22 : 2303–12.
18. Mamounas EP, Anderson SJ, Dignam JJ, et al. Predictors of locoregional recurrence after neoadjuvant chemotherapy: results from combined analysis of National Surgical Adjuvant Breast and Bowel Project B-18 and B-27. J Clin Oncol 2012;30 : 3960–6.
19. Mittendorf EA, Buchholz TA, Tucker SL, et al. Impact of chemotherapy sequencing on local-regional failure risk in breast cancer patients undergoing breast-conserving therapy. Ann Surg 2013;257 : 173–9.
20. Tiezzi DG, Moreira de Andrade J, Marana HRC, et al. Breast conserving surgery after neoadjuvant therapy for large primary breast cancer. EJSO 2008;34 : 863−7.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Infekce v chirurgiiČlánek Komplikované nitrobřišní infekce u chirurgického nemocného – postup v empirické antimikrobní léčběČlánek Sekundární peritonitida a potřeba tekutinové léčby – retrospektivní analýza jednoho pracovištěČlánek Krvácení při kombinované antikoagulační a antiagregační léčbě jako příčina náhlé příhody břišníČlánek ESCP 2017, Berlín
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2017 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Infekce v chirurgii
- Komplikované nitrobřišní infekce u chirurgického nemocného – postup v empirické antimikrobní léčbě
- Clostridium difficile remains a medical challenge
- Léčba lokoregionálně pokročilého karcinomu rekta − je čas na změnu?
- Sekundární peritonitida a potřeba tekutinové léčby – retrospektivní analýza jednoho pracoviště
- Characterisation of Candida sp. isolated from patients after abdominal surgery
- Breast conservative surgery after neoadjuvant oncologic treatment for breast carcinoma at the 1st Department of Surgery, 1st Faculty of Medicine of Charles University and General Teaching Hospital in Prague over a ten-year period (2004−2013)
- Krvácení při kombinované antikoagulační a antiagregační léčbě jako příčina náhlé příhody břišní
- ESCP 2017, Berlín
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Komplikované nitrobřišní infekce u chirurgického nemocného – postup v empirické antimikrobní léčbě
- Clostridium difficile remains a medical challenge
- Krvácení při kombinované antikoagulační a antiagregační léčbě jako příčina náhlé příhody břišní
- Léčba lokoregionálně pokročilého karcinomu rekta − je čas na změnu?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



