-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sekundární peritonitida a potřeba tekutinové léčby – retrospektivní analýza jednoho pracoviště
Secondary peritonitis and volume therapy – single-site retrospective analysis
Introduction:
Secondary peritonitis is a typical surgical intensive care situation. Leakage of fluid into the interstitial space and peritoneal cavity requires adequate fluid resuscitation to optimize the hemodynamic stability. The aim of the study is to present specific volumes of fluid transfer in situations of acute peritonitis based on a single-site retrospective analysis of volume therapy in patients with this condition.Methods:
Retrospective analysis of patients with secondary peritonitis treated at ICU-1 of the Surgical Department of the University Hospital in Hradec Kralove between 2013−2016. Volume therapy was provided using balanced crystalloids and was monitored based on dynamic hemodynamic indicators (variations of the pulse waveform, response to fluid challenge, physical examination). Fluid balance was managed by intake and output measurements and by estimating immeasurable losses.Results:
We evaluated the set of 139 patients with severe secondary peritonitis according to the Mannheim Peritonitis Index (MPI) 27.9 and predicted lethality 26%. The lethality actual was 24%. Hemodynamic stabilization was associated with the mean cumulative positive fluid balance of 8643 ml, which peaked after 1.83 day from admission. The average length of ICU stay was 8 days. Blood pressure support with norepinephrine was necessary in 42% of patients and lasted the mean of 32 hours. None of the patients was on dialysis; in two cases, kidney failure occurred in a situation of generalized cancer and intractable vascular ileus.Conclusion:
Peritonitis leads to significant leakage of fluids into the third space, and in surgery, it is one of conditions characterized by the highest need of fluid therapy in the resuscitation phase of sepsis and septic shock. The risk of underestimating fluid therapy is high in practice.Key words:
peritonitis − septic shock – fluid optimization − positive fluid balance
Autoři: E. Havel; E. Bělobrádková; P. Šafránek
Působiště autorů: Chirurgická klinika LF Univerzity Karlovy a FN Hradec Králové přednosta: doc. MUDr. J. Páral, Ph. D.
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 10, s. 421-425.
Kategorie: Původní práce
Souhrn
Úvod:
Sekundární peritonitida patří mezi typické stavy chirurgické intenzivní péče. Únik tekutiny do intersticiálního prostoru a peritoneální dutiny vyžaduje razantní přístup k hemodynamické optimalizaci infuzní léčbou. Cílem práce je v retrospektivní analýze objemové léčby pacientů s akutní peritonitidou jednoho pracoviště ukázat konkrétní objemy tekutinového přesunu v situaci akutní peritonitidy.Metody:
Retrospektivní analýza nemocných se sekundární peritonitidou léčených na JIP-1 Chirurgické kliniky FN Hradec Králové v letech 2013−2016. Volumová terapie byla prováděna balancovanými krystaloidy a monitorována dynamickými ukazateli hemodynamiky (variace pulzové křivky, reakce na tekutinovou výzvu, fyzikální vyšetření). Bilance tekutin byla prováděna na základě měření příjmu a výdeje a odhadu neměřitelných ztrát.Výsledky:
Hodnocen byl soubor 139 pacientů se závažnou sekundární peritonitidou dle Mannheim Peritonitis Index (MPI) 27,9 a predikovanou letalitou 26 %. Skutečná letalita byla 24 %. Hemodynamická stabilizace byla spojena s průměrnou kumulovanou pozitivní tekutinovou bilancí 8643 ml, která vrcholila za 1,83 dne od přijetí. Průměrná délka pobytu na JIP byla 8 dnů. Nutná podpora oběhu noradrenalinem byla u 42 % nemocných a trvala v průměru 32 hodin. Nikdo z nemocných nebyl dialyzován, u dvou případů došlo k selhání ledvin v situaci generalizovaného nádorového onemocnění a neřešitelného cévního ileu.Závěr:
Peritonitida vede k výraznému úniku tekutin do třetího prostoru a patří v chirurgii ke stavům s nejvyšší potřebou tekutinové terapie v resuscitační fázi sepse a septického šoku. Riziko podcenění tekutinové léčby je v praxi vysoké.Klíčová slova:
peritonitida − septický šok − tekutinová optimalizace − pozitivní bilance tekutinÚVOD
Sekundární peritonitida patří mezi typické stavy chirurgické intenzivní péče. Jde o širokou škálu různě závažných klinických situací s různým stupněm ohrožení života. Tomu odpovídá i široké rozmezí publikované letality nemocných se sekundární peritonitidou od 8 do 60 % [1,2]. V publikovaných souborech záleží na zastoupení případů s akutní apendicitidou či cholecystitidou, kde je letalita nemoci nízká, naopak pokročilá cévní mezenteriální ischemie a sterkorální peritonitida vykazují letalitu vysokou [3,4,5,6].
Jako sekundární peritonitidu označujeme zánět peritoneální dutiny infekčního nebo neinfekčního původu v důsledku postižení intraperitoneálního či retroperitoneálního orgánu. Samostatnou podskupinu z důvodu hodnocení kvality péče tvoří pooperační peritonitidy nejčastěji na podkladě dehiscence sutur na trávicí trubici či v důsledku chirurgické intervence na jiném orgánu (játra, pankreas apod.) [7]. Prognózu nemocných se sekundární peritonitidou ovlivňují především celkový zdravotní stav organismu a funkční rezerva k překonání akutní nemoci, typ a kvalita operačního výkonu, antimikrobiální léčba a perioperační intenzivní péče s důrazem na časnou hemodynamickou optimalizaci [8].
Z pohledu intenzivní péče je základním problémem léčby nemocných s peritonitidou léčba sepse a septického šoku. Zajištění adekvátní perfuze tkání s dostatečnou dodávkou kyslíku do tkání je prvořadým úkolem v prevenci orgánové dysfunkce. Hemodynamická optimalizace je spojena s přechodnou pozitivní bilancí tekutin v organismu. Dodávka tekutin formou infuzní léčby je vedena s cílem udržení optimálního plnění srdce a optimální cévní náplně v situaci snížené vaskulární rezistence a zvýšené kapilární propustnosti vlivem zánětové reakce. Opačná strategie upřednostňující podávání noradrenalinu k zajištění normotenze bez adekvátní tekutinové resuscitace zvyšuje riziko prohloubení tkáňové hypoperfuze se všemi důsledky rizika rozvoje orgánové dysfunkce. V běžné klinické praxi se léčba vasokonstrikčními léky vede bez podrobnějšího monitorování hemodynamiky a důvodem restrikce tekutinové resuscitace je prostá obava z převodnění pacienta. Přitom vysoká dávka noradrenalinu je negativním faktorem přežití nemocných s akutní peritonitidou [9]. Je problém dávky a délky použití vasopresorů obrazem pouze tíže klinického stavu, nebo je to i důsledek v praxi podceňované tekutinové resuscitace?
Cílem práce je v retrospektivní analýze objemové léčby pacientů s akutní peritonitidou jednoho pracoviště ukázat konkrétní objemy tekutinového přesunu v situaci akutní peritonitidy.
METODY
Retrospektivní analýza pacientů JIP-1 Chirurgické kliniky FN Hradec Králové za období let 2013−2016. Na základě analýzy všech pacientů propuštěných z jednotky vyšší intenzivní péče a analýzy všech úmrtí obou jednotek intenzivní péče chirurgické kliniky byl získán soubor 139 hodnocených pacientů se sekundární peritonitidou.
K hodnocení závažnosti peritonitidy byl použit Mannheim Peritonitis Index (MPI), který je k tomuto účelu běžně používán ve světě i u nás [1,10,11].
Tekutinová bilance byla počítána na základě příjmu tekutin, měřeného výdeje tekutin, odhadnutých neměřených ztrát a perspirace.
VÝSLEDKY
V průběhu let 2013 až 2016 bylo na JIP-1 Chirurgické kliniky FN Hradec Králové léčeno 139 nemocných s peroperačním nálezem dokumentace akutní peritonitidy. Z celého souboru zemřelo 33 pacientů, což činí 24 %. Závažnost peritonitidy hodnocená MPI dosahovala v celém souboru 27,9. Předpokládaná letalita podle MPI byla v souboru 26 %. Základní údaje shrnuje Tab. 1. Průměrná délka léčby na jednotce intenzivní péče byla 8 dnů. Téměř polovina nemocných (42 %) vyžadovala k dosažení normotenze podávání noradrenalinu a délka podávání noradrenalinu trvala u těchto nemocných průměrně 32 hodin. Umělou plicní ventilaci při zavedené orotracheální intubaci potřebovalo 61 % pacientů a ventilace u těchto nemocných trvala v průměru 74 hodin. Souhrn údajů je uveden v Tab. 2. Kumulovaná pozitivní tekutinová bilance činila průměrně 8468 ml a délka pozitivní bilance tekutin byla 1,83 dne. Rozbor diagnóz zemřelých pacientů je uveden v Tab. 3. Osm pacientů bylo ošetřováno v režimu „open abdomen“, z toho ve čtyřech případech byla důvodem nekrotizující fasciitida. Ve čtyřech případech (2x poranění břicha, 2x střevní ischemie) byla první operace provedena v režimu „damage control“ toliko se slepým uzavřením segmentů střeva a následná rekonstrukce kontinuity střeva byla řešena provedením střevní anastomózy po 24 hodinách.
Tab. 1. Celkový přehled souboru Tab. 1: Overview of the study population 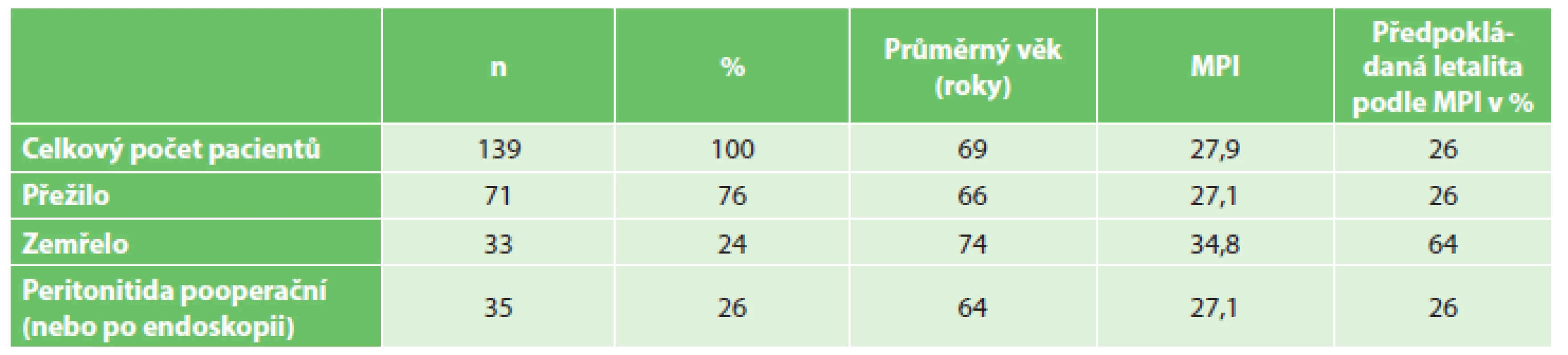
Tab. 2. Péče na JIP Tab. 2: Characteristics of ICU care 
Tab. 3. Rozbor zemřelých pacientů podle diagnóz Tab. 3: Diagnostic overview of deceased patients 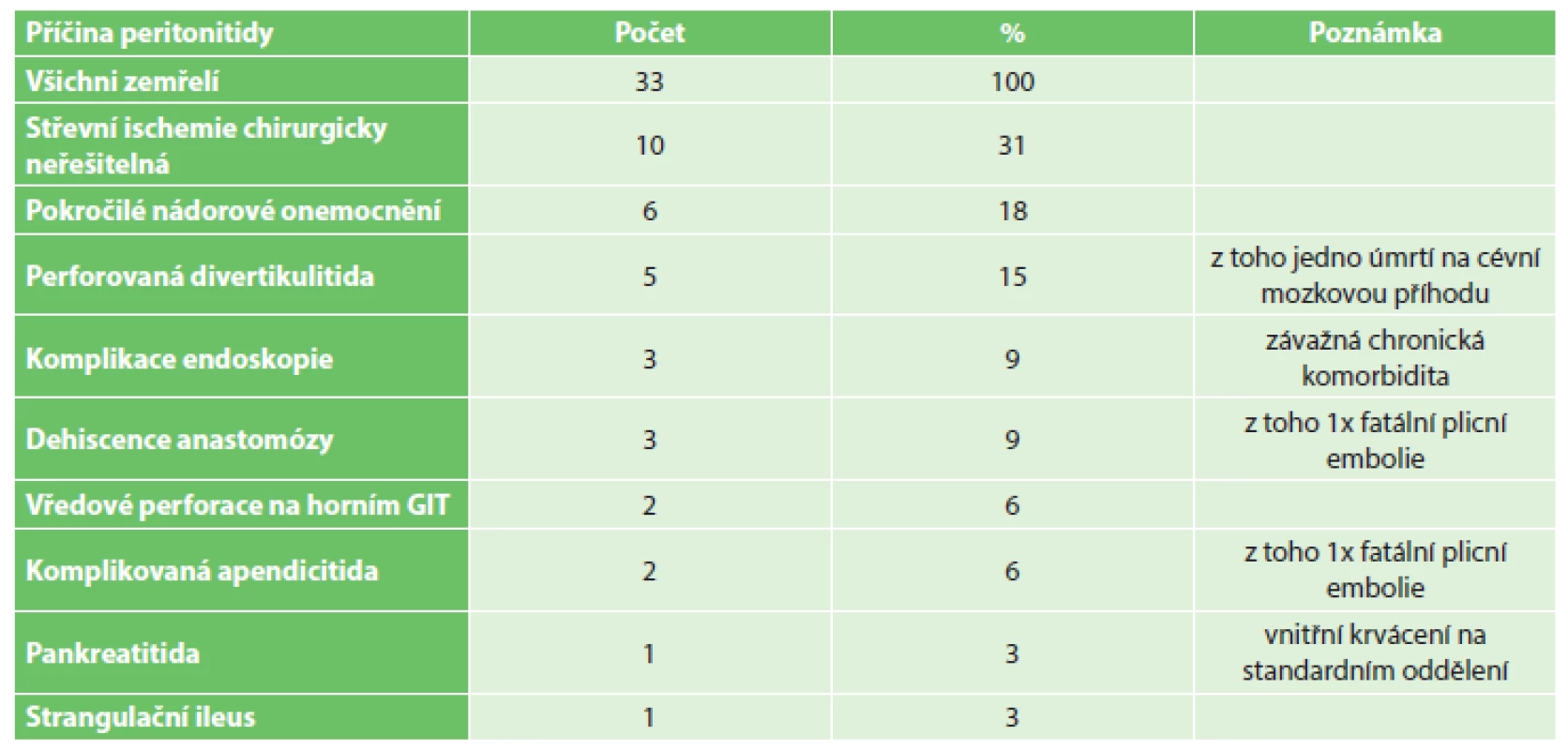
DISKUZE
Úspěch léčby nemocných s akutní peritonitidou je multifaktoriální a stejně jako u všech stavů sepse je kladen důraz na rychlost léčebných opatření. V tomto duchu jsou též vedena nová doporučení léčby sepse [12] a na první pohled zmatečná úprava terminologie pojmů život ohrožující infekce [13,14]. Tekutinová resuscitace je vedena s cílem rychlé hemodynamické optimalizace s obnovením dobrého prokrvení všech hypoperfundovaných tkání. Akutní peritonitida patří mezi stavy, jejichž léčba obecně vyžaduje vyšší míru dodávky tekutin. Tato charakteristika je vysvětlitelná patofyziologickou situací vlastní nemoci. Peritoneum rychle reaguje na chemické či infekční dráždění zvýšenou propustností kapilár a filtrací tekutiny do peritoneální dutiny. Tekutina je bohatá na humorální a buněčné imunitní elementy. Vlivem dýchacích pohybů a vlivem pohybu střev se tekutina z volné dutiny břišní transportuje kraniálně k bráničnímu hiátu, kde pokračuje hlavní transport peritoneální tekutiny do lymfatických cest a přes síť lymfatických uzlin následně do krve. Bakteriální kontaminace břišní dutiny se může během několika desítek minut projevit septikemií. Velikost peritoneální plochy, mohutná výbava imunitní tkáně ve splanchnické oblasti a filtrace noxy do krve jsou příčinou silné oběhové a mediátorové reakce, která směřuje do septického šoku [15,16]. Tekutinová terapie je hlavním nástrojem hemodynamické optimalizace a dominantním roztokem je některý z balancovaných krystaloidů. Při úspěšně zvládnutém inzultu jde o jednovrcholový přesun tekutin s pozitivní bilancí, v našem souboru průměrně 8643 ml ve dvou prvních dnech. K obratu do negativní tekutinové bilance dochází v průměru již po 2. dnu. Podporu oběhu noradrenalinem potřebuje menšina pacientů (42 %) a při současné volumové optimalizaci trvá relativně krátce (32 hodin). Ve většině případů několikalitrová retence tekutin v organismu nebrání časnému pooperačnímu ukončení umělé plicní ventilace (49 %) a v případě nutnosti ventilační pooperační podpory je tato ukončena průměrně do 74 hodin. Přesto je třeba zmínit, že míra kumulované pozitivní tekutinové bilance v průměru přesahuje míru 10 % tělesné hmotnosti, která je charakterizována jako hyperhydratace („overhydration“) [17]. Letalita v uvedeném souboru odpovídá předpokládané letalitě podle MPI 24 % (předpokládaná 26 %). Většina zemřelých nezemřela z důvodu multiorgánového selhání v důsledku protrahovaného šoku, ale z důvodu neřešitelného základního onemocnění (pokročilé nádorové onemocnění, neřešitelná střevní ischemie, plicní embolie, mozková příhoda, vysoký věk bez funkční rezervy). K renálnímu selhání, které by si vyžádalo nasazení eliminační techniky, došlo pouze ve dvou případech ve skupině zemřelých, kde vzhledem k základnímu onemocnění (generalizované nádorové onemocnění, neřešitelná střevní ischemie) nebyla orgánová podpora zahajována.
Ve shodě s novými doporučeními o léčbě sepse [15] byly při monitorování tekutinové léčby nezávisle na tomto doporučení používány dynamické ukazatele efektivity infuzní terapie – tekutinová výzva, variace pulzové křivky a test zvednutí dolních končetin. Na rozdíl od známých doporučení přikládáme velký význam obnovení diurézy při dodávce tekutin a testujeme reakci organismu na malou dávku 10 mg Furosemidu. Cílem je poznat, zda další dodávka tekutin vede ke zlepšení orgánové funkce, případně zda nízká diuréza je projevem toliko stresové antidiurézy, kterou malá dávka Furosemidu eliminuje. Velký důraz je též kladen na opakované fyzikální vyšetření – kapilární návrat na akrech, barevné změny kůže, poslechový nález plic, náplň krčních žil, hepatojugulární reflux apod. V posledních letech se stává obvyklejší kontrola tekutinové terapie „bed side“ ultrazvukovým monitorováním, přestože dosud nejde o rutinní způsob v každé službě. Počítání denní bilance tekutin s odhadem neměřitelných ztrát se nám ukázalo jako dostatečně přesné při srovnání s měřeními pomocí bioimpedance a distribučních objemů v rámci farmakokinetických sledování.
Pozitivní tekutinová bilance bývá spojována s vyšším rizikem vzniku břišního kompartmentu. Nízký výskyt renálního selhání v našem souboru svědčí proti této hypotéze. Ponechání laparostomatu po operaci peritonitidy má smysl spíše pro opakovaný vstup a toaletu břišní dutiny než jako preventivní opatření proti nitrobřišní hypertenzi. Nové metody podtlakové terapie a dynamické sutury jsou již běžnou praxí a ošetřování lapastomatu na jednotce intenzivní péče se tak stalo bezpečnější. V souboru byla metoda „open abdomen“ použita v osmi případech. Hlavní důvody byly nekrotizující fasciitida s nemožností definitivního uzávěru břicha (4 případy), etapový způsob ošetření břicha při plánování kontrolní operace z důvodu úrazu (2 případy) a střevní ischemie (2 případy). Právě v prevenci infekce fascie břišní stěny po operaci peritonitidy vidíme perspektivní indikaci přechodného ponechání laparostomatu či odložené sutury kůže [18,19].
Rozsah, včasnost a typ operačního výkonu nebyly v souboru hodnoceny. Zohlednění velikosti operačního traumatu sanační operace je důležité v kontextu dosažení a udržení oběhové stability. Operace v režimu „damage control“ zdůrazňuje toto komplexní zhodnocení konkrétní situace operatérem i u neúrazových stavů [20,21]. Ve dvou případech sekundární peritonitidy při těžké enterokolitidě byla volena prostá perkutánní drenáž dutiny břišní. V jednom případě byla operace provedena až po 24 hodinách, a to po dosažení oběhové stability a zavedení perkutánní drenáže břicha u nemocné s perforací žaludku a kardiopulmonální resuscitací v septickém šoku při přijetí. Ve dvou případech byl proveden dvoudobý výkon ošetření perforace střev v rámci polytraumatu v průběhu 24 hodin a ve dvou případech byla stejná strategie volena u nemocných se střevní ischemií.
Soubor neobsahuje nemocné, kteří byli hospitalizováni na jednotce intenzivní péče nižšího stupně chirurgické kliniky (většina komplikovaných zánětů slepého střeva a žlučníku), ale úmrtí na této jednotce jsou do hodnocení souboru zařazena. Na JIP-1 chirurgické kliniky, kde byl soubor pacientů vytvořen, jsou poskytovány všechny stupně intenzivní péče, tudíž soubor obsahuje i nejtěžší pacienty se septickým šokem, kteří na jiných pracovištích bývají hospitalizováni na odděleních ARO. V souboru jsou pouze dva nemocní s akutní pankreatitidou, neboť tito nemocní jsou přednostně přijímáni na metabolickou jednotku intenzivní péče. Podobně jsou v souboru jen dva nemocní s komplikovanou apendicitidou. Charakter souboru tak především definuje hodnota MPI s průměrem 27,9. Zvláštní skupinu tvoří nemocní s pooperační peritonitidou. Především vlivem rozvoje kolorektální chirurgie s konstrukcí více rizikových distálně situovaných anastomóz v rektu a dále vlivem operačních výkonů u rizikovějších skupin (imunosuprimovaných, onkologicky léčených a geriatrických pacientů) těchto pacientů neubývá. Letalita pooperační peritonitidy je uváděna až ve 30 % [22], v našem souboru činí 17 %. Sem jsou zařazena i dvě úmrtí po komplikacích endoskopické intervence.
ZÁVĚR
Tekutinová resuscitace je hlavním nástrojem hemodynamické optimalizace nemocných s akutní peritonitidou v sepsi a septickém šoku. Objem potřebných tekutin je vždy individuální, proto doporučení konkrétní objemy neudávají. Peritonitida vede k výraznému úniku tekutin do třetího prostoru a patří v chirurgii ke stavům s nejvyšší potřebou tekutinové terapie v resuscitační fázi sepse a septického šoku. V našem souboru nemocných s průměrným skóre MPI 27,9 byla letalita 24 % (predikovaná podle MPI 26 %) a celková kumulovaná bilance tekutin byla + 8468 ml s vrcholem za 1,83 dne. Vzhledem k tomu, že peritonitida patří mezi stavy s významným přesunem tekutin mezi intra a extravaskulárním prostorem, je riziko podcenění tekutinové léčby v praxi vysoké.
Práce vznikla za podpory projektu PROGRES Q40/04.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Eduard Havel
Jana Černého 475
503 41 Hradec Králové
e-mail: havele@lfhk.cuni.cz
Zdroje
1. Majtan P, Neumann J, Kocián P, et al. Perspektiva pacientů operovaných pro sekundární peritonitidu. Rozhl Chir 2015;94 : 199−202.
2. Doklestič SK, Bajec DD, Djukič RV. Secondary peritonitis – evaluation of 204 cases and literature review. J Med Life 2014;7 : 132−8.
3. Menclová K, Traboulsi E, Nikov A, et al. Léčba akutní apendicitidy: retrospektivní analýza vlastního souboru. Rozhl Chir 2016;95 : 317−21.
4. Sun D, Wang C, Yang L, et al. The predictors of the severity of ischaemic colitis: a systematic review of 2823 patients from 22 studies. Colorectal Dis 2016;18 : 949−58.
5. Daher R, Barouki E, Choulliard E. Laparoscopic treatment of complicated colonic diverticular disease: A review. World Journal of Gastrointestinal Surgery 2016;8 : 134−42.
6. Barbieux J, Plumereau F, Hamy A. Current indications for the Hartmann procedure. J Visc Surg 2016;153 : 31−8.
7. Gürlich R, Adámková V, Ulrych J, et al. Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS. Rozhl Chir 2014;93 : 322−49.
8. Sartelli M, Viale P, Catena F, et al. 2013 WSES guidelines for management of intra-abdominal infections. World J Emerg Surg 2013;3 : 1−29.
9. Ihnát P, Peteja M, Vávra P, et al. Současné trendy v péči o pacienty s břišní sepsí. Rozhl Chir 2015;94 : 234−7.
10. Slaninka I, Páral J, Chobola M, et al. Peritonitidy způsobené perforací trávicí trubice – analýza gerontologické skupiny pacientů. Rozhl Chir 2009;88 : 656−61.
11. Billing A, Fröhlich D, Schildberg F. Prediction of outcome using the Mannheim peritonitis index in 2003 patients. Peritonitis Study Group. Br J Surg 1994;81 : 209−13.
12. Weber DG, Bendinelli C, Balogh ZJ. Damage control surgery for abdominal emergencies. Br J Surg 2014;101 : 109−18.
13. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016;315 : 801−10.
14. Horák J, Harazim M, Karvunidis T, et al. Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice. Vnitř Lék 2016;62 : 568−74.
15. Rhodes A, Evans LA, Alhazzani W, et al. Surviving sepsis campaign: International guidelines for management of sepsis and septick shock: 2016. Intensive Care Med 2017;43 : 304−77.
16. Ordonez CA, Puyana JC. Management of peritonitis in critically ill patient. Surg Clin North Am 2006;86 : 1323-49.
17. Hoste EA, Maitland K, Brudney CS, et al. Four phases of intravenous fluid therapy: a conceptual model. British Journal of Anaesthesia 2014;113 : 740−7.
18. Bleszynski MS, Chan T, Buczkowski AK. Open abdomen with negative pressure device vs primary abdominal closure for the management of surgical abdominal sepsis: a retrospective review. The American Journal of Surgery 2016;211 : 926−32.
19. Rezendo-Neto J, Rice T, Abreu ES, et al. Anatomical, physiological, and logistical indications for the open abdomen: a proposal for a new classification system. World Journal of Emergency Surgery 2016. Available from: http://wjes.biomedcentral.com/articles/10.1186/s13017-016-0083−4.
20. Weber DG, Bendinelli C, Balogh ZJ. Damage control surgery for abdominal emergecies. BJS 2014;101:e109−18.
21. Vyhnánek F. Akutní chirurgická péče – jak dál? Rozhl Chir 2016;95 : 255−6.
22. Doklestic SK, Bajec DD, Djukic RV, et al. Secondary peritonitis – evaluation of 204 cases and literature review. Journal of Medicine and Life 2014;7 : 132−8.
23. Ruggiero R, Sparavigna L, Docimo G, et al. Post-operative peritonitis due to anastomotic dehiscence after colonic resection. Multicentric experience, retrospective analysis of risk factors and review of the literature. Ann Ital Chir 2011;82 : 369−75.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2017 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Infekce v chirurgii
- Komplikované nitrobřišní infekce u chirurgického nemocného – postup v empirické antimikrobní léčbě
- Clostridium difficile remains a medical challenge
- Léčba lokoregionálně pokročilého karcinomu rekta − je čas na změnu?
- Sekundární peritonitida a potřeba tekutinové léčby – retrospektivní analýza jednoho pracoviště
- Characterisation of Candida sp. isolated from patients after abdominal surgery
- Breast conservative surgery after neoadjuvant oncologic treatment for breast carcinoma at the 1st Department of Surgery, 1st Faculty of Medicine of Charles University and General Teaching Hospital in Prague over a ten-year period (2004−2013)
- Krvácení při kombinované antikoagulační a antiagregační léčbě jako příčina náhlé příhody břišní
- ESCP 2017, Berlín
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Komplikované nitrobřišní infekce u chirurgického nemocného – postup v empirické antimikrobní léčbě
- Clostridium difficile remains a medical challenge
- Krvácení při kombinované antikoagulační a antiagregační léčbě jako příčina náhlé příhody břišní
- Léčba lokoregionálně pokročilého karcinomu rekta − je čas na změnu?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



