-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Characterisation of Candida sp. isolated from patients after abdominal surgery
Characterisation of Candida sp. isolated from patients after abdominal surgery
Introduction:
Intraabdominal candidiasis (IAC) is the predominant type of invasive candidiasis after candidemia. The majority of epidemiological studies on Candida are focused only on bloodstream infections. Nevertheless, the role of blood cultures has limited application in patients with abdominal candidiasis. IAC, which includes peritonitis and intraabdominal abscesses, may occur in around 40% of patients following repeat gastrointestinal (GI) surgery or GI perforation.Method:
Retrospective analysis of culture isolates of Candida sp. from clinical specimens of patients after abdominal surgery. The study period was from January 1 to October 31, 2016.Results:
Our study of 33 patients with findings of Candida sp. from the abdominal cavity found a mortality of 15.2%, the most frequent strain being C. albicans and C. glabrata. All strains of Candida sp. were susceptible to echinocandins.Conclusions:
Candida sp. is part of normal microbiota of the gastrointestinal tract and its isolation is often difficult to interpret. Unfortunately, the pathophysiologic importance of Candida isolation from the abdominal space is not completely clear in many clinical situations.Key words:
invasive candidiasis − intra-abdominal candidiasis − laboratory diagnostics
Autoři: V. Adámková 1,2
; A. Vaňková 1; J. Ulrych 3; K. Matek 3
Působiště autorů: Ústav lékařské biochemie a laboratorní diagnostiky VFN, Praha přednosta: prof. MUDr. T. Zima, DrSc., MBA 1; Ústav lékařské mikrobiologie LF Univerzity Palackého, Olomouc přednosta: prof. MUDr. M. Kolář, PhD. 2; Chirurgická klinika VFN, Praha přednosta: prof. MUDr. Z. Krška, DrSc. 3
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 10, s. 426-431.
Kategorie: Původní práce
Souhrn
Úvod:
Nitrobřišní kandidóza (IAC) je druhou nejčastější formou invazivní kandidózy po kandidemii. Většina epidemiologických studií je zaměřena na infekce krevního řečiště, avšak role hemokultivace je u nitrobřišní kandidózy sporná. IAC, zahrnující jak peritonitidu, tak nitrobřišní abscesy, se vyskytuje až u 40 % pacientů po reoperacích zažívacího traktu, po perforacích CIT či po revizích pro nekrotizující pankreatitidu.Metoda:
Retrospektivní analýza kultivačních nálezů kvasinek v klinických materiálech od pacientů po nitrobřišním chirurgickém výkonu. Sledované období od 1. 1. do 31. 10. 2016.Výsledky:
V našem souboru 33 pacientů s nálezem kvasinek v souvislosti s nitrobřišním výkonem byla mortalita 15,2 %. Nejčastěji byla izolována C. albicans a C. glabrata. Všechny kmeny kvasinek byly citlivé k echinokandinům.Závěr:
Kvasinky jsou součástí normální střevní mikrobioty a jejich nález v klinickém materiálu je obtížně interpretovatelný. Patofyziologická role kvasinek stále není v mnoha klinických situacích zcela zřejmá.Klíčová slova:
invazivní kandidóza − nitrobřišní kandidóza − laboratorní diagnostikaÚVOD
Mezi invazivní kvasinkové infekce se řadí jednak kandidemie a jednak systémové invazivní formy, kam patří i nitrobřišní kandidóza.
Stejně jako bakteriální intraabdominální infekce souvisí i nitrobřišní kandidóza (Intraabdominal candidiasis IAC) nejčastěji s porušením integrity gastrointestinálního traktu (GIT), ať spontánně, nebo v rámci chirurgického výkonu. Kvasinky jsou běžnou součástí normální gastrointestinální mikrobioty a při infekčních procesech, vyžadujících podávání antibiotik, dochází k jejich pomnožení. Při porušení integrity zažívacího traktu se dostávají do okolí společně s bakteriální flórou. Mezi nejdůležitější původce nitrobřišních infekcí patří především gram negativní tyčinky, ale v posledních letech je dokumentován nárůst výskytu kvasinek izolovaných z peroperačních materiálů (Tab. 1) [1,26].
Tab. 1. Zastoupení mikroorganismů u nitrobřišních infekcí Tab. 1: Representation of microorganisms in intra-abdominal infections 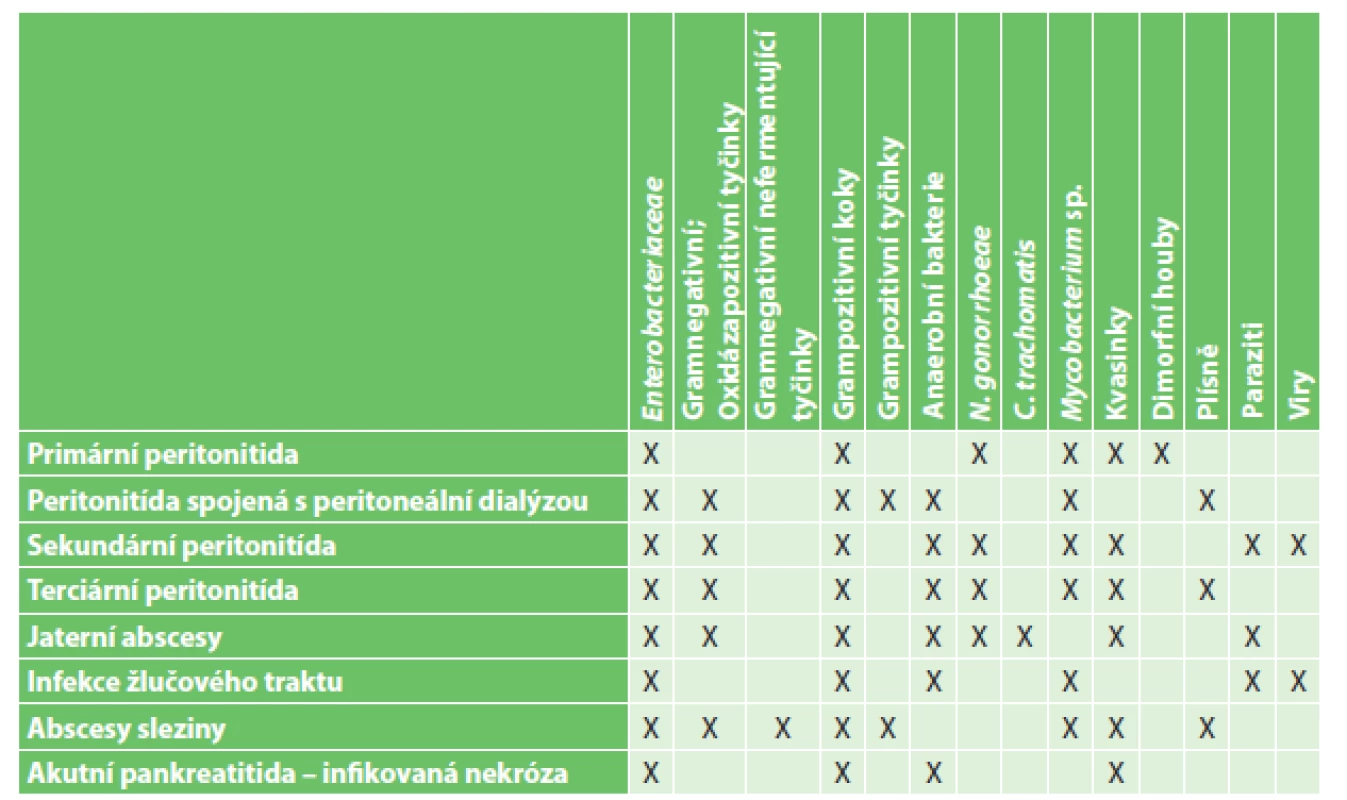
IAC se nejčastěji manifestuje jako sekundární peritonitida nebo intraabdominální absces, poměrně často nacházíme kandidy i u terciární peritonitidy. Naproti tomu jsou daleko vzácněji kandidy vykultivovány u pacientů s primární peritonitidou či infekcí biliárního traktu (Tab. 2) [2,3,4].
Tab. 2. Intraabdominální kandidóza − klinické dělení Tab. 2: Intra-abdominal candidiasis − clinical classification 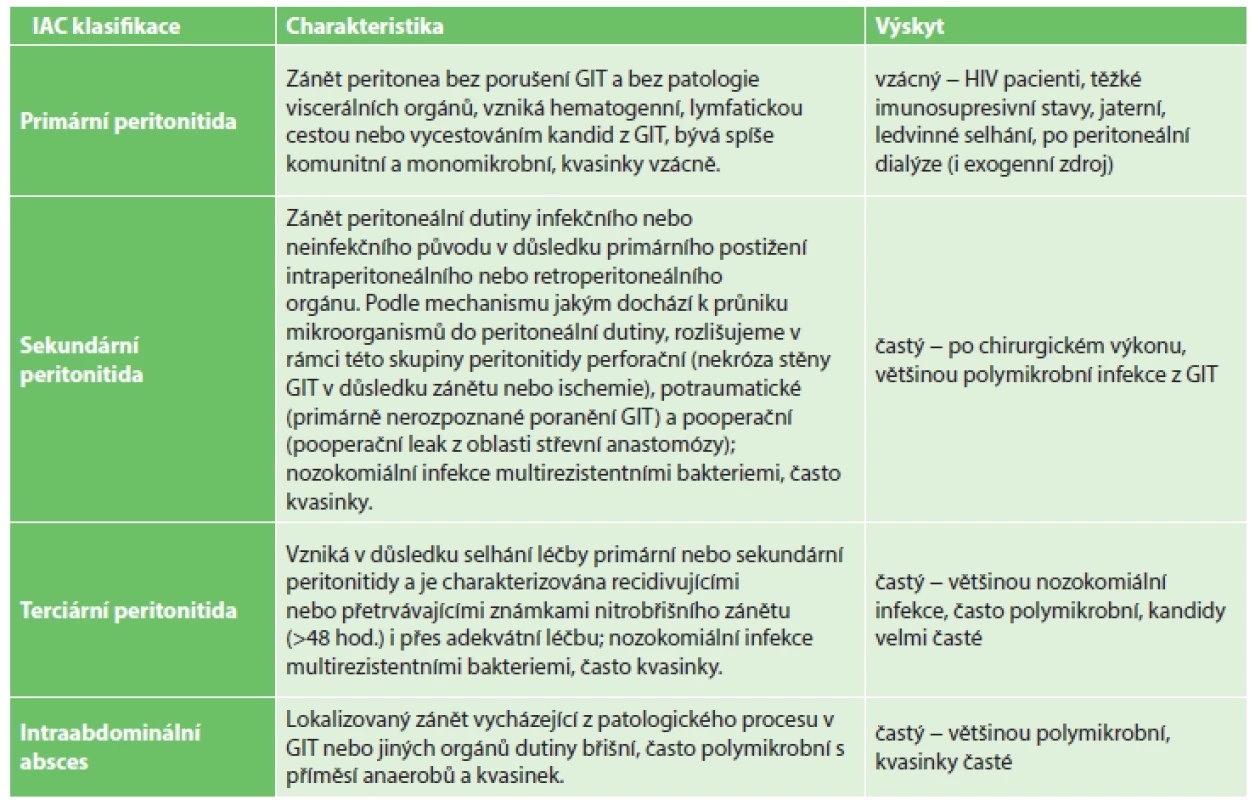
Z epidemiologického hlediska se jedná tedy převážně o infekce spojené s nemocniční péčí se zdrojem endogenního původu. IAC je druhou nejčastější formou invazivní mykotické infekce na jednotce intenzivní péče. [5]
METODA
Provedli jsme retrospektivní analýzu nálezu kvasinek v klinickém materiálu, který byl získán v souvislosti s nitrobřišní operací u pacientů operovaných na I. Chirurgické klinice VFN v období od 1. 1. do 31. 10. 2016. Vzorky (peritoneální výpotek, obsah drénu) byly zasílány dle standardního protokolu v injekční stříkačce s kombi zátkou. Materiál byl po přijetí vyšetřen mikroskopicky barvením dle Grama a byla založena aerobní kultivace (krevní agar, Uriselect4 – Bio-Rad, Francie), anaerobní kultivace (Schaedler agar – Bio-Rad, Francie) a mykologická kultivace (Sabouraud agar – Bio-Rad, Francie). Identifikace narostlých kultur byla provedena pomocí hmotnostní spektrometrie MALDI-TOF (Bruker – Německo). Citlivost na antimikrobní přípravky byla stanovena dle EUCAST.
VÝSLEDKY
Základní charakteristika souboru
Analyzovaný soubor tvořilo 33 pacientů s nálezem kvasinek v biologickém materiálu, který byl získán v souvislosti s nitrobřišní operací. V souboru bylo 17 mužů (51,5 %) a 16 žen (48,5 %), s průměrným věkem 67 let. Většina pacientů (24 pacientů; 72,7 %) patřila do kategorie seniorů (>60 let) a pouze 9 pacientů (27,3 %) bylo mladších (<60 let). Biologický materiál k mikrobiologickému vyšetření byl získán u 19 pacientů (57,6 %) v průběhu operace (peritoneální tekutina) a u 14 pacientů (42,4 %) po operaci z drénu. U 21 pacientů (63,6 %) se jednalo o nález kvasinek z biologického materiálu odebraného v souvislosti s primární operací, zatímco u 12 pacientů (36,4 %) byly zachyceny kvasinky z materiálu odebraného v souvislosti s reoperací. 17 pacientů (51,5 %) bylo operováno pro maligní onemocnění. Průměrná délka pobytu na JIP lůžku byla 17 dní s rozmezím 4−41 dnů. Průměrná délka pobytu v nemocnici byla 36 dní s širokým rozmezím 9−102 dnů. Celkem 11 pacientů (33,3 %) bylo léčeno antimykotiky, z toho 10 pacientů azolovými preparáty (flukonazol) a 1 pacient echinokandinem (anidulafungin). 30denní letalita v našem souboru byla 15,2 % (5/33).
Mikrobiologické nálezy
V analyzovaném souboru 33 pacientů bylo zachyceno celkem 40 kmenů kvasinek. U šesti pacientů (18,2 %) bylo nalezeno více druhů kvasinek, zatímco u 27 pacientů (81,8 %) se jednalo o monokandidový nález, u 17 pacientů (51,5 %) byly kvasinky přítomny společně s bakteriemi a u 16 pacientů (48,5 %) byly kandidy zachyceny v čisté kultuře (Tab. 3). Z bakterií byly vykultivovány nejčastěji o Escherichia coli 12 kmenů (70,6 %), z toho jeden kmen produkoval širokospektrou betalaktamázu (8,3 %) a Klebsiella pneumoniae 7 kmenů (41,2 %) a též pouze jeden kmen produkoval širokospektrou betalaktamázu (14,3 %).
Tab. 3. Charakteristika mikrobiologických nálezů Tab. 3: Characterisation of microbiological findings 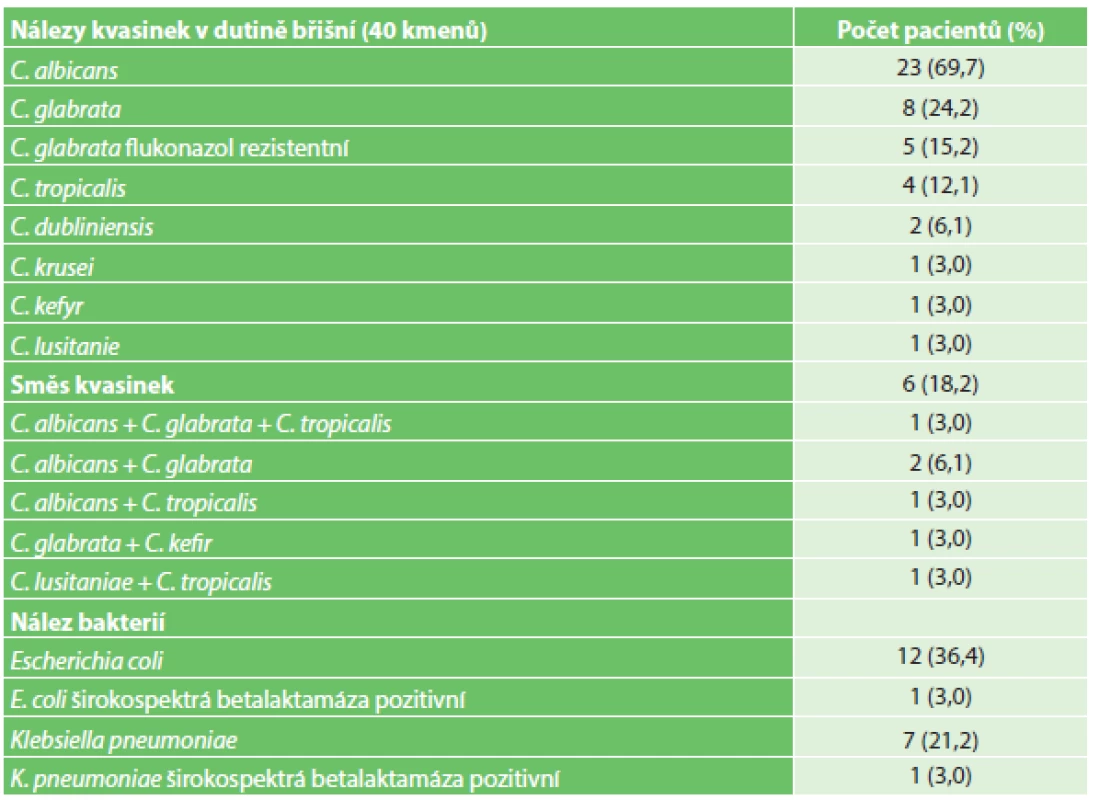
U dvou pacientů (6,1 %) byly kvasinky zachyceny i v hemokultuře, u tří pacientů na centrálním žilním katétru, 17 pacientů (51,5 %) mělo kolonizovány horní cesty dýchací, dvakrát byly zachyceny v moči a ve stolici, u jednoho pacienta ve sputu (Tab. 4).
Tab. 4. Nálezy kvasinek z ostatních klinických materiálů. Tab. 4: <i>Candida</i> isolates from other clinical specimens 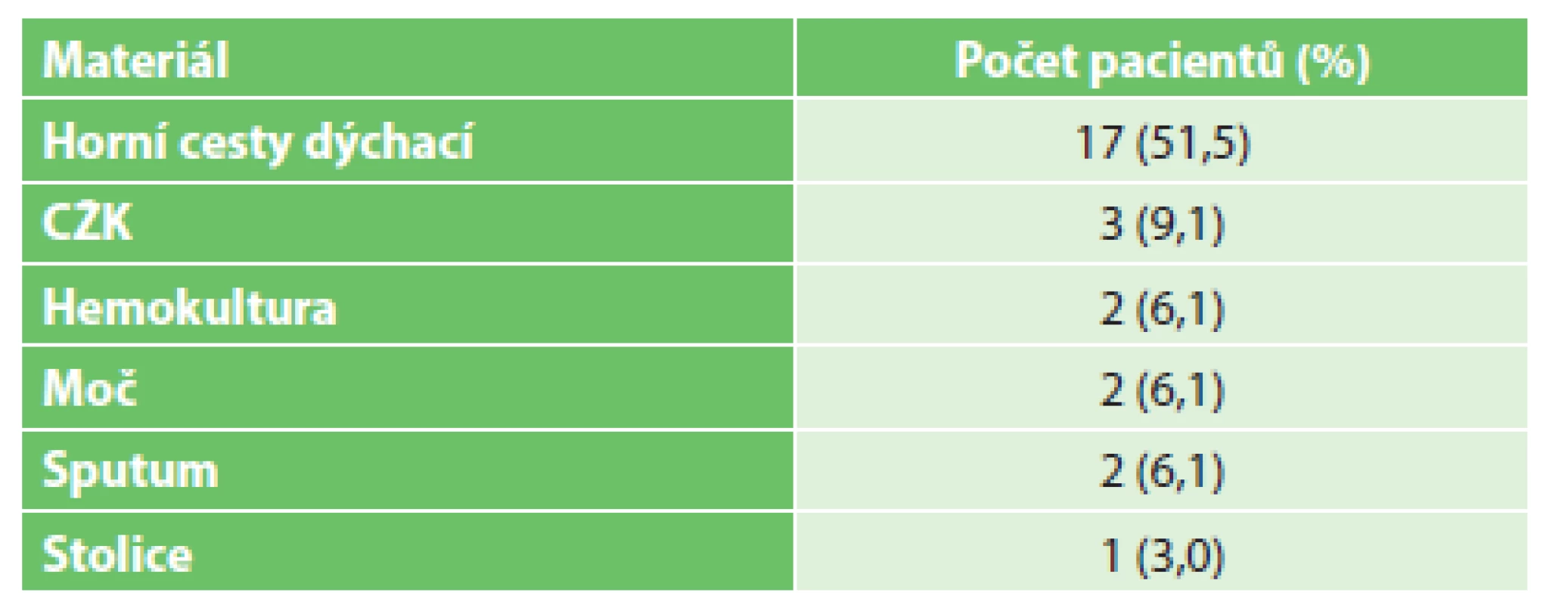
Nejčastěji izolovanou kvasinkou byla Candida albicans 23 (57,0 %), C. glabrata 8 (20,0 %), C. tropicalis 4 (10,0 %), ostatní druhy byly zachyceny jednotlivě (Graf 1). Všechny kmeny C. albicans byly dobře citlivé na všechna antimykotika, pět kmenů C. glabrata (62,5 %) mělo intermediální citlivost k flukonazolu. Nebyl zachycen žádný kmen rezistentní k echinokandinům.
Graf 1. Zastoupení jednotlivých druhů kvasinek Graph 1: Representation of the <i>Candida</i> strains 
DISKUZE
Candida sp. je nejčastějším mykotickým agens u pacientů na jednotkách intenzivní péče [6] a invazivní kandidóza (IC) je jednoznačně spojena se zvýšenou morbiditou a mortalitou u kriticky nemocných pacientů [7].
Nález kvasinek v klinických materiálech z dutiny břišní se v různých studiích pohybuje od 1 do 38 % v závislosti na charakteristice souboru a diagnostických metodách [8].
Kvasinky bývají izolovány až ve 40 % z horní části zažívacího traktu, ve 35 % z tenkého střeva, 12 % z tlustého střeva a v méně než 5 % z apendixu [9]. Naším cílem však nebylo zhodnotit prevalenci nitrobřišní kandidózy na chirurgickém pracovišti, ale provést detailnější analýzu kandidových nálezů u pacientů s nitrobřišní operací. Stejně jako v evropské studii izolátů od pacientů s IAC i v našem souboru jasně dominoval nález Candida albicans (69,7 %), následován C. glabrata (24,2 %) [10].
IAC je dnes považována za příčinu více než 10 % všech případů peritonitid a je spojena s mortalitou až 60 % v závislosti na příčině peritonitidy [11]. V našem souboru byla 30denní mortalita 15,2 %, což již samo o sobě svědčí o závažnosti této formy nitrobřišní infekce.
Nekandidemické systémové kandidózy jsou charakterizovány invazí kvasinek do primárně sterilních oblastí s kultivační či histologickou verifikací. Ve světové prevalenční studii provedené v květnu 2007 na 1265 jednotkách intenzivní péče byla kvasinková infekce (mikrobiologicky potvrzená) prokázána u 841 z 4947 pacientů (17 %), ale kandidemie pouze u 99 pacientů [6,12]. V našem souboru byly kvasinky izolovány od dvou pacientů z hemokultur, avšak zdrojem této kandidemie byla kolonizace centrálního žilního katétru, nikoliv IAC. V obou případech se jednalo o C. albicans. Většina epidemiologických studií týkajících se kvasinkových infekcí je zaměřena na infekce krevního řečiště, avšak význam hemokultivace u pacientů s nitrobřišní formou kandidózy je velmi zpochybňován, což dokumentují nejen výsledky světové prevalenční studie, ale i nízký záchyt pozitivní hemokultury u pacientů s IAC v našem souboru pacientů (6,1 %). IAC, zahrnující peritonitidy a nitrobřišní abscesy, se mohou objevit až u 40 % pacientů po opakovaných operacích gastrointestinálního traktu, perforaci zažívacího traktu nebo nekrotizující pankreatitidě [13]. Přestože jsou obecně reoperace spojeny s vyšším rizikem nitrobřišní kandidózy, i u primárních operací, je také nutné myslet na možnost kandidové etiologie. V našem souboru byly kvasinky prokázány v materiálu odebraném v souvislosti s primární operací u 21 pacientů (63,6 %) a v souvislosti s reoperací u 12 pacientů (36,4 %). U devíti reoperací byla primární diagnózou malignita.
Ačkoliv byl popsán exogenní nozokomiální přenos kvasinek, tak genotypové analýzy ukazují, že zdrojem většiny těžkých invazivních kandidóz je endogenní kolonizace [14]. Tímto lze také vysvětlit, proč k rozvoji invazivní kandidózy většinou dochází za 7 až 10 dnů po expozici rizikových faktorů [15]. V analyzovaném souboru bylo 81,8 % pacientů kolonizováno kvasinkami, z toho 51,5 % mělo zachyceno kvasinky z horních cest dýchacích, avšak údaj může být částečně zkreslený, protože ne u všech pacientů bylo screeningové vyšetření provedeno, nejčastěji z důvodu akutního příjmu.
Včasná antimykotická léčba jednoznačně redukuje mortalitu u pacientů s dokumentovanou invazivní formou kandidózy [16], ale učinit rychlou definitivní diagnózu IC je pořád obtížné [17]. V našem souboru měla antimykotickou terapii pouze třetina pacientů, přesto mortalita byla jen 15,2 %. Na základě klinického stavu a dalších pomocných laboratorních vyšetření jsme vyhodnotili nález kvasinek u zbylých dvou třetin pacientů jako kolonizaci, a proto u nich nebyla zahájena antimykotická terapie ani profylaxe.
Ačkoliv profylaxe nebo preemptivní terapie by měla být použita u pacientů ve vysokém riziku vzniku a rozvoje IC, tak jejich identifikace zůstává klinickou výzvou, protože specifické identifikační markery nebyly stále definovány [18].
Rizikové faktory vzniku invazivní kandidózy u kriticky nemocných pacientů zahrnují užívání širokospektrých antibiotik, chemoterapii, kolonizaci kvasinkami, centrální žilní katétr, celkovou parenterální výživu, chirurgický výkon, renální selhání, hemodialýzu, neutropenii a protrahovaný pobyt na jednotce intenzivní péče [19 ]. I když tyto faktory mohou být a jsou přítomny i u pacientů, kteří nerozvinou IC, a samy o sobě nejsou dostatečně diskriminující, jsou-li přítomny společně, mohou být použity k identifikaci vysoce rizikových pacientů. Strategie zaměřené na identifikaci rizik, jako jsou kolonizační index a Candida skóre, poskytují pomoc při rozhodování, kdy zahájit včasnou antimykotickou léčbu [17,20,21].
Žádné klinické studie nehodnotily potřebu léčit IAC, ale je zde otázka reálné patogenity těchto mikroorganismů. Na základě prohlášení, že zpoždění antimykotické léčby u kandidemie je spjato se špatnou prognózou, jsou rutinně předepisována širokospektrá antimykotika u IAC. Z těchto důvodů byl recentně navržen konsenzus expertů pro management IAC včetně doporučení pro laboratorní metody průkazu (Tab. 5, 6). S použitím těchto kritérií Bassetti a kol. publikovali retrospektivní mezinárodní studii 481 pacientů léčených pro IAC [22]. Důležitým aspektem, který vyplývá z jejich analýzy, je silná korelace mezi neadekvátní chirurgickou kontrolou zdroje a zvýšenou mortalitou.
Tab. 5. Laboratorní metody v diagnostice IAC [2] Tab. 5: Laboratory methods in diagnosis of IAC [2] ![Laboratorní metody v diagnostice IAC [2]
Tab. 5: Laboratory methods in diagnosis of IAC [2]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/122508e0647a89ad14ccc3c057296b66.png)
Tab. 6. Síla doporučení a kvalita evidence [2] Tab: 6 Evidence-based criteria [2] ![Síla doporučení a kvalita evidence [2]
Tab: 6 Evidence-based criteria [2]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/be28620c081db91cf35ff5635cd9cb62.png)
Je zajímavé, že „kontrola zdroje“ je věcí zájmu mnoha klinických studií. Tento termín se však sestává z široké škály různých opatření od vyjmutí katétru přes radiologickou intervenci (např. drenáž pod CT kontrolou) až po extenzivní chirurgické výkony, jako jsou relaparotomie, opakovaná laváž dutiny břišní apod. Bohužel většina studií zabývajících se problematikou komplikovaných nitrobřišních infekcí publikovaných v časopisech s infekční problematikou jasně nepopisuje, co přesně znamená „kontrola zdroje“. Následkem toho je, že zhodnocení významu nálezu kandid u pacientů s komplikovanou nitrobřišní infekcí, stejně jako zhodnocení mortality a morbidity ve vztahu k IAC, není bez znalosti rozsahu kontroly zdroje plně validní.
Pečlivá monitorace těchto vysoce rizikových pacientů opakovanými kultivačními vyšetřeními je důležitá. Bohužel, většina pacientů s IAC je hlášena z chirurgických oddělení, kde surveillance kvasinkové kolonizace je prováděna jen zřídka, nebo jsou překládáni z jiných pracovišť či urgentně přijímáni a tyto údaje nejsou dostupné.
Biomarkry jako je b-D-glukan mohou být nápomocné v identifikaci pacientů, kteří mají být léčení [23,24], zatímco stanovení ostatních rutinních biomarkrů, jako např. prokalcitoninu, se ukázalo jako zcela neefektivní. [25]. Tyto testy ale stále nejsou součástí rutinního armamentaria a jejich výpovědní hodnota je i nadále předmětem diskuzí.
ZÁVĚR
Ve světle těchto výsledků zoufale potřebujeme nejenom protokoly pro antimykotický stewardship, ale též standardizaci postupů zahrnujících „kontrolu zdroje“ u nitrobřišních infekcí. Relativně vysoká mortalita IAC jednoznačně poukazuje na nutnost spolupráce chirurga, klinického mikrobiologa a intenzivisty. Největším problémem zůstává odlišení kolonizace od invazivní infekce, a proto jsou mnohdy podávána antimykotika zbytečně, pouze na základě kultivačního nálezu. Zatím nejsou k dispozici žádné studie kriticky hodnotící nutnost antimykotické terapie u IAC s ohledem na nález kvasinek v dutině břišní. Námi publikované výsledky jsou předběžné a hodnotí mikrobiologickou charakteristiku nálezů. Podrobné klinické hodnocení ještě není uzavřeno a bude publikováno následně.
Práce byla podpořena projektem
OPPK CZ.2.16/3.1.00/24012
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Václava Adámková
Klinická mikrobiologie a ATB centrum 1. LF UK a
VFN
Ke Karlovu 2
120 00 Praha
e-mail: vaclava.adamkova@vfn.cz
Zdroje
1. Wallace WC, Cinat ME, Nastanski F, et al. New epidemiology for postoperative nosocomial infections. Am Surg 2000;66 : 874−8.
2. Bassetti M, Marchetti M, Chakrabarti A, et al. A research agenda on the management of intra-abdominal candidiasis: results from a consensus of multinational experts. Intensive Care Med 2013;39 : 2092–106.
3. Vergidis P, Clancy CJ, Shields RK, et al. Intra-abdominal candidiasis: The importance of early source control and antifungal treatment. PLoS One 2016. Available from: https://doi.org/10.1371/journal.pone. 0117195.
4. Menichetti F, Sganga G. Definition and classification of intra-abdominal infections. J Chemother 2009;Suppl 1 : 3−4.
5. Leroy O, Gangneux JP, Montravers P, et al. Epidemiology, management, and risk factors for death of invasive Candida infections in critical care: a multicenter, prospective, observational study in France (2005–2006). Crit Care Med 2009;37 : 1612–8.
6. Vincent JL, Rello J, Marshall J, et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA 2009;302 : 2323–9.
7. Schelenz S. Management of candidiasis in the intensive care unit. J Antimicrob Chemother 2008;61,Suppl 1:i31–4.
8. Montravers P, Leroy O, Eckmann C. Intra-abdominal candidiasis: it still a long way to get unquestionable data. Intensive Care Med 2015;41 : 1682–4.
9. Sandven P, Qvist H, Skovlund E, et al. Significance of Candida recovered from intraoperative specimens in patients with intra-abdominal perforations. Crit Care Med 2002;30 : 541–7.
10. Dupont H, Paugam-Burtz C, Muller - Serieys C, et al. Predictive factors of mortality due to polymicrobial peritonitis with Candida isolation in peritoneal fluid in critically ill patients. Arch Surg 2002;137 : 1341–6.
11. Montravers P, Dupont H, Gauzit R, et al. Candida as a risk factor for mortality in peritonitis. Crit Care Med 2006;34 : 646–52.
12. Kett DH, Azoulay E, Echeverria PM, et al. Candida blood - stream infections in intensive care units: analysis of the extended prevalence of infection in intensive care unit study. Crit Care Med 2011;39 : 665–70.
13. de Ruiter J, Weel J, Manusama E, et al. The epidemiology of intra-abdominal flora in critically ill patients with secondary and tertiary abdominal sepsis. Infection 2009;37 : 522–7.
14. Khan ZU, Chandy R, Metwali KE. Candida albicans strain carriage in patients and nursing staff of an intensive care unit: a study of morphotypes and resistotypes. Mycoses 2003;46 : 479–86.
15. van de Veerdonk FL, Kullberg BJ, Netea MG. Pathogenesis of invasive candidiasis. Curr Opin Crit Care 2010;16 : 453–59.
16. Garey KW, Rege M, Pai MP, et al. Time to initiation of fluconazole therapy impacts mortality in patients with candidemia: a multi-institutional study. Clin Infect Dis 2006;43 : 25–31.
17. Eggimann P, Bille J, Marchetti O. Diagnosis of invasive candidiasis in the ICU. Ann Intensive Care 2011;1 : 37.
18. Cornely OA, Bassetti M, Calandra T, et al. ESCMID guideline for the diagnosis and management of Candida diseases 2012: non-neutropenic adult patients. Clin Microbiol Infect 2012;18,Suppl 7 : 19–37.
19. Eggimann P, Garbino J, Pittet D. Epidemiology of Candida species infections in critically ill non-immunosuppressed patients. Lancet Infect Dis 2003;3 : 685–702.
20. Pittet D, Monod M, Suter PM, et al. Candida colonization and subsequent infections in critically ill surgical patients. Ann Surg 1994;220 : 751–8.
21. Leon C, Ruiz-Santana S, Saavedra P, et al. Usefulness of the “Candida score” for discriminating between Candida colonization and invasive candidiasis in non-neutropenic critically ill patients: a prospective multicenter study. Crit Care Med 2009;37 : 1624–33.
22. Bassetti M, Righi E, Ansaldi F, et al. A multicenter multinational study of abdominal candidiasis: epidemiology, outcomes and predictors of mortality. Intensive Care Med. 2015;41 : 1601–10.
23. Tissot F, Lamoth F, Hauser PM, et al. Beta - glucan antigenemia anticipates diagnosis of blood culture-negative intraabdominal candidiasis. Am J Respir Crit Care Med 2013;188 : 1100–9.
24. Leon C, Ruiz-Santana S, Saavedra P, et al. Value of beta-D - glucan and Candida albicans germ tube antibody for discriminating between Candida colonization and invasive candidiasis in patients with severe abdominal conditions. Intensive Care Med 2012;38 : 1315–25.
25. Eckmann C, Sanchez-Garcia M. Monitoring treatment response in abdominal sepsis with procalcitonin–if only! Crit Care 2013;17 : 1017.
25. Gürlich R, Adámková V, Ulrych J, et al. Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS. Rozh Chir 2014;93 : 334−52.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Infekce v chirurgiiČlánek Komplikované nitrobřišní infekce u chirurgického nemocného – postup v empirické antimikrobní léčběČlánek Sekundární peritonitida a potřeba tekutinové léčby – retrospektivní analýza jednoho pracovištěČlánek Krvácení při kombinované antikoagulační a antiagregační léčbě jako příčina náhlé příhody břišníČlánek ESCP 2017, Berlín
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2017 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Infekce v chirurgii
- Komplikované nitrobřišní infekce u chirurgického nemocného – postup v empirické antimikrobní léčbě
- Clostridium difficile remains a medical challenge
- Léčba lokoregionálně pokročilého karcinomu rekta − je čas na změnu?
- Sekundární peritonitida a potřeba tekutinové léčby – retrospektivní analýza jednoho pracoviště
- Characterisation of Candida sp. isolated from patients after abdominal surgery
- Breast conservative surgery after neoadjuvant oncologic treatment for breast carcinoma at the 1st Department of Surgery, 1st Faculty of Medicine of Charles University and General Teaching Hospital in Prague over a ten-year period (2004−2013)
- Krvácení při kombinované antikoagulační a antiagregační léčbě jako příčina náhlé příhody břišní
- ESCP 2017, Berlín
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Komplikované nitrobřišní infekce u chirurgického nemocného – postup v empirické antimikrobní léčbě
- Clostridium difficile remains a medical challenge
- Krvácení při kombinované antikoagulační a antiagregační léčbě jako příčina náhlé příhody břišní
- Léčba lokoregionálně pokročilého karcinomu rekta − je čas na změnu?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



