-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chirurgická léčba karcinomu pankreatu
Autoři: P. Záruba
; M. Ryska
Působiště autorů: Chirurgická klinika 2. LF UK a ÚVN Praha, přednosta: prof. MUDr. M. Ryska, CSc.
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 12, s. 702-709.
Kategorie: Postgraduální vzdělávání
ÚVOD
Adenokarcinom pankreatu (CaP) tvoří 90 % malignit tohoto orgánu. Zbytek připadá na vzácné primární tumory, malignizované cystické tumory pankreatu, neuroendokrinní tumory a sekundární metastatická postižení. V širším klinickém pohledu lze mezi malignity hlavy pankreatu počítat i karcinom distálního žlučovodu a maligní ampulom. Neboť ač jsou jiného tkáňového původu, vyžadují shodnou chirurgickou terapii a přístup. Ampulom má oproti CaP a karcinomu žlučových cest výrazně lepší prognózu.
Nepříznivým faktem zůstává, že resekabilních je jen asi 20 % nemocných s CaP. I u těchto pacientů se doba přežití pohybuje jen mezi 11 a 18 měsíci. U neoperovaných je to asi třetina této doby. Jedním z možných vysvětlení je, že karcinom, který se vyvíjí pomalu v průběhu deseti let, léčíme až v jeho terminální fázi, kdy je třeba toto onemocnění chápat jako systémové, nikoli pouze jako onemocnění lokoregionální.
Incidence, screening a stadium onemocnění
Česká republika se ve výskytu karcinomu pankreatu nachází na 6. místě v Evropě. Absolutní počet nemocných neustále narůstá. Ročně je u nás v posledních letech zaznamenáno 1700–1750 nových případů, poměr mužů a žen je 2 : 1, průměrný věk je 60 let – Graf 1.
Graf 1. Incidence karcinomu pankreatu (dle údajů NOR ČR z roku 2007 – www.svod.cz) 
Vzhledem k tomu, že doposud nebyly stanoveny vhodné markery onemocnění, screening časných stadií CaP nelze provádět. U části nemocných lze zaznamenat předcházející nově vzniklý diabetes a zvýšení sérových hodnot Ca 19-9. Diagnostický přínos ale hodnota Ca 19-9 nemá, neboť zvýšené hladiny nacházíme i u jiných, zčásti i benigních onemocnění. Pozdní diagnózu potvrzuje i zastoupení jednotlivých klinických stadií, kdy převažuje IV. stadium (70 %) s rostoucím meziročním trendem a malé počty ostatních stadií se stabilními počty, jak je zřetelné z Grafu 2.
Graf 2. Poměr stadií onemocnění u nově vzniklých případů CaP (dle údajů NOR ČR z roku 2007 – www.svod.cz) 
Resekabilní jsou vždy tumory ve stadiu I. a II., resekabilita ve III. stadiu je určena typem vaskulární invaze. Obecně je akceptováno, že žilní invaze do portomezenterického konfluens za krčkem pankreatu není kontraindikací k resekci a odstranění části žilní stěny, nebo její náhrada, přinášejí stejné výsledky jako resekce provedené u tumorů bez angioinvaze. Oproti tomu arteriální invaze do arteria hepatica communis či truncus coeliacus, nebo do arteria mesenterica superior je chápána jako znak lokální pokročilosti onemocnění a resekční výkony u takových tumorů nepřinášejí očekávané výsledky.
Symptomy onemocnění
CaP je v 80–90 % lokalizován v hlavě. Tato lokalizace je spojena s obstrukčním ikterem a nálezem dilatace extrahepatálních a později i intrahepatálních žlučových cest. Omezení odtoku žluče vede také k bezbolestnému zvětšení žlučníku, který může být i v podobě hydropsu hmatný – Courvoiserovo znamení. Často nalézáme u operovaných pacientů známky chronické cholecystitidy. Někdy může být prvním projevem akutní cholangoitida s Charkotovou triádou (febrilie, ikterus, třesavka) a sepsí. Analogií uzávěru žlučových cest je uzávěr pankreatického vývodu, který může vyústit i v akutní pankreatitidu obstruktivní etiologie. Je proto vždy nutné uvažovat o takové příčině v diferenciální rozvaze etiologie pankreatitidy. Zejména pak u starších nemocných bez anamnézy abusu nebo etylického excesu a bez průkazu cholelitiázy. Ostatní nespecifické příznaky jako bolesti v zádech, horní dyspepsie, nechutenství a váhová redukce přivádějí pacienta k lékaři zpravidla ve stadiu lokálně pokročilého onemocnění nebo generalizace. To je důvodem, proč většina nemocných s CaP těla a kaudy pankreatu je neresekabilní. Růst tumoru relativně vzdáleného od intrapankreatické části žlučovodu nevede dlouho nebo vůbec k obstrukci žlučovodů a bolest s dyspepsií tak zůstávají jedinými symptomy.
V poslední době je diskutována problematika vztahu CaP a nově vzniklého diabetu. Je zjevné, že u významné skupiny nemocných (cca 60 %) se několik měsíců až let před manifestací tumoru nově objeví porucha glukózové tolerance, respektive diabetes mellitus, který je z patofyziologického hlediska průnikem diabetu I. a II. typu. Diabetes figuruje jako příznak poruchy funkce ještě před tím, než dojde k manifestaci strukturální. Využití tohoto zjištění pro screening CaP komplikuje skutečnost, že jen malá část nově vzniklých diabetiků onemocní CaP. Jde tedy o příznak s velmi nízkou specificitou a bez určení charakteristické podskupiny vhodné pro screening nemá zatím větší diagnostický přínos.
Pro obtížně diagnostikovatelná raná stadia svědčí to, že více než dvě třetiny nemocných mají v době stanovení diagnózy postiženy regionální uzliny, třetina má metastatické postižení jater, u poloviny nemocných je diagnostikována angioinvaze. Každý desátý nemocný má diseminaci nádoru po peritoneu [2].
Nízké zastoupení I. a II. stadia v důsledku nespecifických a pozdních příznaků je příčnou toho, že ve vyspělých zemích je možné provést radikální resekci pouze u 20 % těchto nemocných. Zbylým 80 % pacientů je možné poskytnout paliativní léčbu v podobě definitivní drenáže žlučovodu (metalický stent) v případě obstrukce, a to většinou endoskopicky, nebo transhepatálně s menším komfortem pro pacienta. Ve specifických případech je možné provést derivaci žlučových cest chirurgicky. Zvážit možnost podání paliativní chemoterapie a poskytnout účinnou analgetickou léčbu [3]. V případě silných bolestí je možné provedení neurolýzy nebo paliativní analgetické radioterapie.
Stanovení stadia onemocnění a indikace k resekčnímu výkonu
Časná stadia jsou vesměs diagnostikována náhodně, incidentálně u asymptomatických nemocných. Rutinně užívané ultrasonografické abdominální vyšetření, které může takovou patologii odhalit, má přesnost pouze 70 %. Přesnější zobrazení se stanovením stagingu však toto vyšetření neumožňuje [4].
Klíčové pro zhodnocení lokálního nálezu a resekability je CT vyšetření provedené dle standardního protokolu (max. 1mm řezy, 3 kontrastní fáze: parenchymatózní, arteriální, portální) bez použití orálně podané kontrastní látky. Nesplňuje-li primární CT vyšetření provedené v rámci stanovení základní diagnózy tato kritéria, pak je nutné je ke správnému stanovení stagingu opakovat. Mimo vyhodnocení lokálních charakteristik tumoru (velikost, lokalizace, vztah k tepnám a žilám) nám přináší informaci o přítomnosti sekundarit, volné tekutiny v dutině břišní nebo ložiskovém postižení peritonea. Tedy o známkách generalizace nemoci a neresekabilitě (Obr. 1–3).
Obr. 1. CT břicha, portální fáze, tumor těla pankreatu s invazí do slezinné žíly 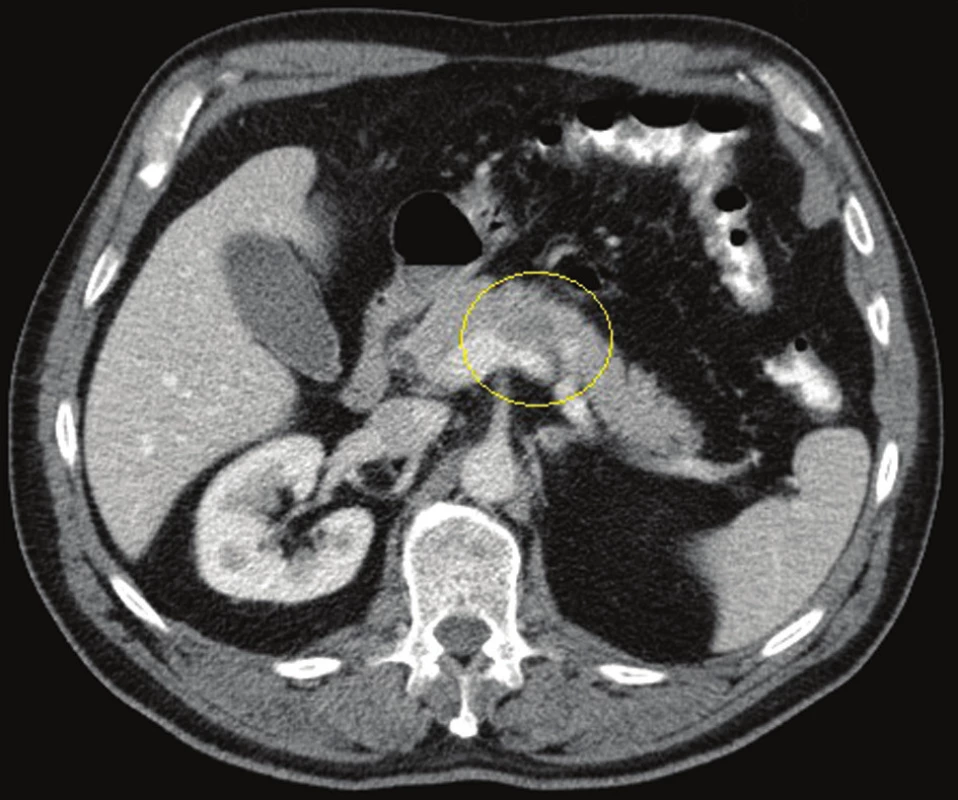
Obr. 2. CT břicha, arteriální fáze, šipka označuje volný kmen AMS, v kruhu tumor hlavy pankreatu s biliárním stentem 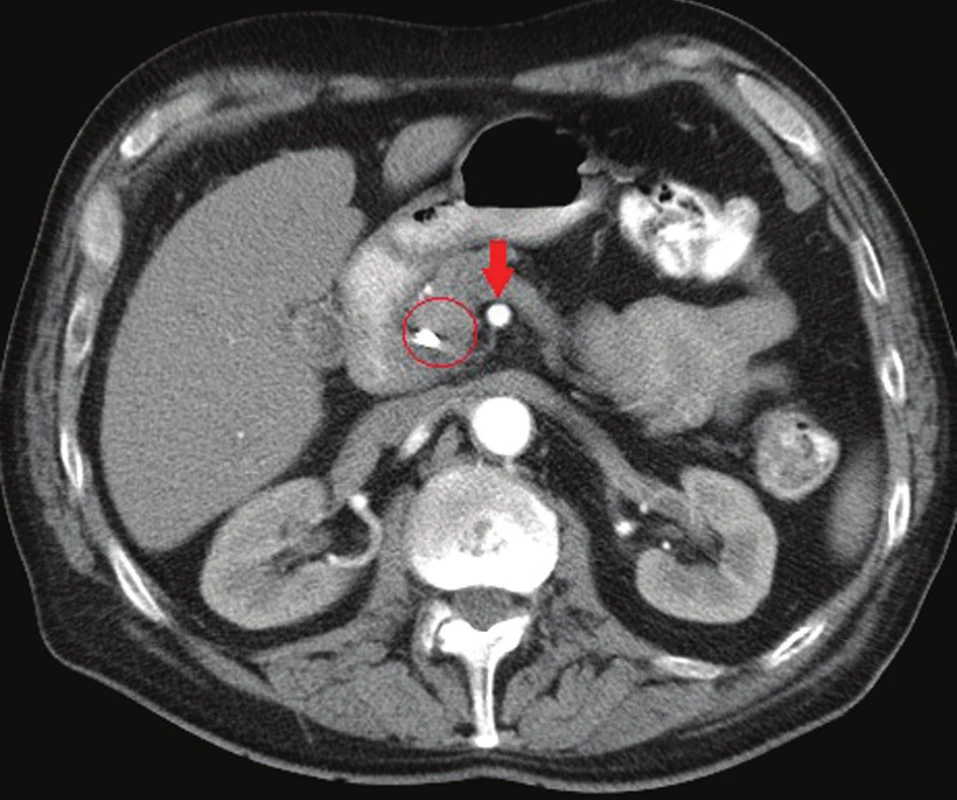
Obr. 3. CT břicha, arteriální fáze, červený kruh: AMS, žlutý: VMS, zelený: tumor hlavy se stentem 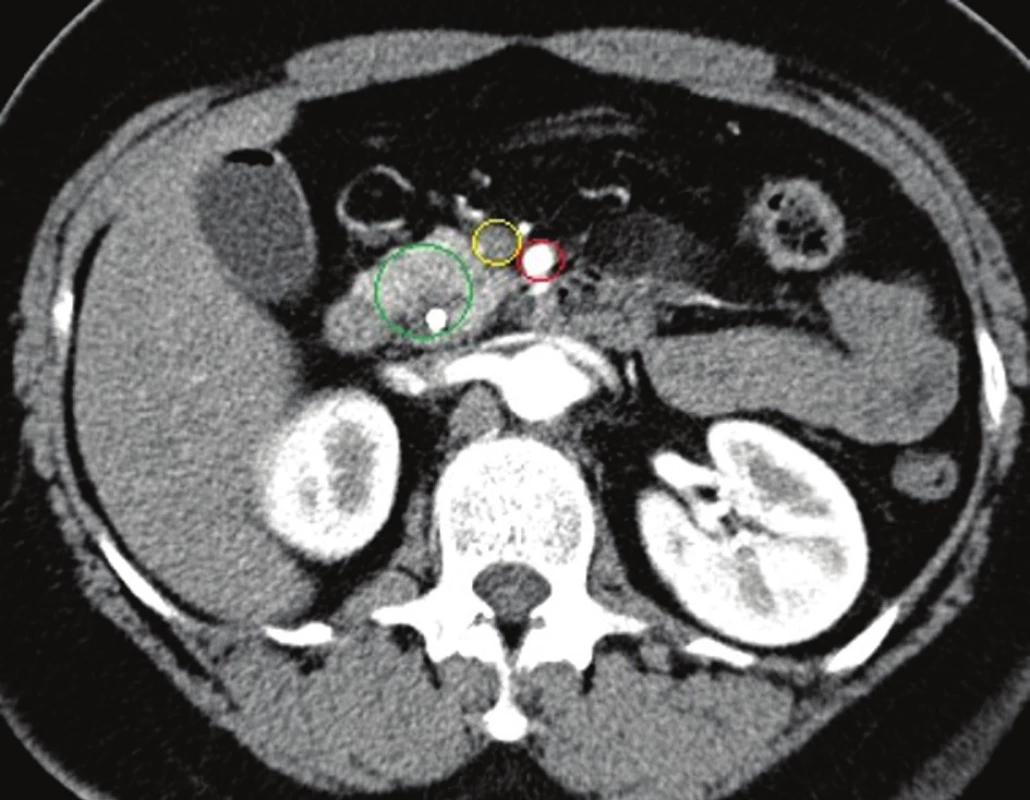
Druhým zásadním vyšetřením stagingu je endosonografie (EUS) doplněná o tenkojehlovou aspirační biopsii (FNA). Mimo lokalizace a velikosti tumoru je endosonografie výrazně přínosná v hodnocení žilní a tepenné angioinvaze, zvláště je-li použito dopplerovské mapování krevního toku. FNA může potvrdit suspekci na malignitu. Není však podmínkou indikace k operačnímu řešení. Naopak podstatná je histologická verifikace u neresekabilních tumorů, která podmiňuje podání paliativní chemoterapie. Limitací FNA je významný podíl nehodnotitelných odběrů. CT a EUS tvoří základní rámec hodnocení stadia onemocnění a resekability. Vyšetření magnetickou rezonancí (MR) umožňuje stanovit lokalizaci a velikost tumoru s přesností dosahující 96 % a většinou i přítomnost angioinvaze, zatím u nás není rutinně používáno [4, 6]. CT a MR jsou vzájemně zastupitelná a není nutné je provádět obě současně.
Endoskopickou retrográdní cholangiopankreatografii (ERCP) nelze v současné době považovat za diagnostický prostředek. V žádném případě nepodává informaci o velikosti tumoru nebo angioinvazi. Výjimkou je histologická verifikace tumorů distálního žlučovodu prováděná kartáčovou biopsií. Hlavní přínos ERCP tkví v terapii obstrukce žlučových cest zavedením duodeno-biliární drenáže. A to buď předoperačně, nebo definitivně jako součást paliativní terapie. Dle některých zpráv přináší předoperační dekomprese žlučových cest signifikantně vyšší výskyt pooperačních komplikací [5]. Naopak přítomnost ikteru v době operačního výkonu výskyt nezvyšuje. Proto některá pracoviště ustupují od předoperační derivace žlučových cest (není-li přítomna cholangoitida). Podmínkou takového postupu je ihned provedené CT a EUS a v několika dnech operační výkon.
Pozitronová emisní tomografie může být přínosná s cílem detekce diseminace onemocnění, nicméně v současné době není uváděna v rámci standardního vyšetřování [7].
U všech nemocných s CaP je nutné před zahájením léčby provést staging, který je u větší části nemocných, u kterých není indikována chirurgická léčba, de facto definitivní, u menší části předoperační. K účinné syntéze provedených vyšetření, stanovení stagingu, resekability a naplánovaní terapie je ideální konfrontace všech zúčastněných odborností v reálném čase formou multidisciplinární indikační skupiny (gastroenterolog, chirurg, onkolog, radiolog, anesteziolog, patolog), která se problematice věnuje systematicky.
Celé období vyšetřování nemocného s podezřením a následně prokázáním diagnózy CaP se stanovením léčebného postupu je nutné provést co nejrychleji, nemělo by být v průměru delší než 2–3 týdny. Skutečnost, že někteří nemocní jsou pro podezření na CaP v ČR vyšetřování řadu měsíců, nesvědčí o dobré organizaci zdravotní péče o tyto nemocné.
K radikální resekci indikujeme nemocné s předoperačním stagingem T1-3, N0-1, M0. Zjištěnou angioinvazi do mezenterikoportálního segmentu nepovažujeme za kontraindikaci k výkonu. Angioinvaze do jaterní tepny, truncus coeliacus či do horní mezenterické tepny svědčí o výrazné lokální pokročilosti onemocnění. I když je technicky u části těchto nemocných resekční výkon proveditelný, v současné době není prokázán jeho jednoznačný vliv na prodloužení života či DFS (disease free survival) [8] – viz níže.
Při podezření na přítomnosti jaterních metastáz či diseminace v dutině břišní je vhodné zahájit operaci laparoskopicky a v pozitivním případě ušetřit pacienta zbytečné laparotomie.
Při pokročilém nálezu, kdy pacient přesahuje velikostí tumoru staging T1-3, N0-1 a M0, indikujeme u některých mladých nemocných či starších nemocných v dobrém biologickém stavu, paliativní resekci, a to především z psychologického hlediska. Plánované provedení biliodigestivní anastomózy indikuje většinou gastroenterolog při obtížích s výměnou stentu při relativně delší prospekci života nemocného. Gastroenteroanastomóza je u těchto nemocných indikována ojediněle, a to v případě obstrukce duodena tumorem. Její průchodnost pooperačně však nemusí znamenat obnovu pasáže. Důvodem přetrvávajících obstrukčních obtíží je porucha motility žaludku a tenkého střeva způsobená základním onemocněním. Alternativou k provedení bypassové operace na horním traktu je zavedení duodenálního stentu. Jeho největší nevýhodou je vysoká cena.
Radikální resekční výkon
Podle lokalizace je v případě duktálního adenokarcinomu indikována proximální pankreatoduodenektomie, levostranná pankreatektomie či zřídka totální pankreatektomie. Centrální segmentální pankreatektomie není u duktálního adenokarcinomu doporučována.
Lymfadenektomie
Infiltrace regionálních lymfatických uzlin nádorem je přítomna až u 70 % resekovaných tumorů a je jedním z hlavních prognostických faktorů. Stav lymfatických uzlin je hlavním prediktorem nepříznivé prognózy. U pacientů s více než 2 pozitivními uzlinami je medián přežití 17 měsíců. Oproti tomu negativní uzlinové postižení vede k přežití 5 let až u 38 %. Rozsah dostatečné a pro pacienta bezpečné lymfadenektomie je stále diskutován. Teoreticky by radikálnější lymfadenektomie, která odstraní všechny infiltrované uzliny, měla přinést delší „disease free interval“. Výsledky jsou ale minimálně kontroverzní. Metodika lymfadenektomie spojené s resekcí hlavy pankreatu je založena na faktu, že klasická Whipple operace vedla k časnějším rekurencím onemocnění. V roce 1973 byla poprvé Fortnerem popsána PDE s lymfadenektomií, která klade větší nároky na chirurgickou dovednost. Tato technika byla standardně akceptována a praktikována zejména v Japonsku. V evropských zemích bylo její praktikování nepravidelné. V 80. a 90. letech tak japonští chirurgové zavedli do praxe koncept tzv. radikální rozšířené lymfadenektomie. Proti stojí evropský koncept standardní radikální lymfadenektomie (rozšířená resekce). V současné době se za standardní radikální resekci považuje odstranění všech měkkých tkání pankreatu a duodena (v přímém kontaktu s pankreatem) s odstraněním tkání a uzlin vpravo od AMS a podél arteria hepatica propria – D2 lymfadenektomie.
Kontroverze mezi standardní a radikální lymfadenektomií prozatím řeší 4 prospektivní randomizované studie s celkem 424 pacienty (Pedrazzoli, Itálie, 1998 / Yeo, USA, 1999 / Nimura, Japonsko, 2004 / Farnell, USA, 2005). Celkem se výsledky dají shrnout do těchto závěrů: rozšíření radikální lymfadenektomie vede k prodloužení operačního času, nezvyšuje mortalitu, nevede ke statisticky významnému prodloužení přežívání. Matematický model určil podskupinu pacientů, kteří profitují z rozšířené resekce. Jsou to pacienti bez metastatického postižení M0, s R0 resekcí a s postižením N2 uzlin. Celkem to ve výše uvedených studiích tvořil 1 pacient z 250 operovaných. Standardně prováděná předoperační stagingová vyšetření ale nedovolují takovou skupinu jednoznačně určit.
V současném pojetí chirurgické terapie CaP hlavy pankreatu není rozšířená radikální resekce doporučována, protože nevede k významnému prodloužení přežití pacientů, má vyšší frekvenci komplikací a vede ke snížení kvality života nemocných. Počet získaných uzlin při standardní radikální resekci by neměl být menší než 10. Toto kritérium nemá terapeutický, ale prognostický dopad.
Proximální pankreatoduodenektomie (PDE)
Je indikována při lokalizaci CaP v oblasti hlavy nebo krčku pankreatu. Na většině pracovišť se dává přednost modifikaci podle Traverso-Longmire se zachováním pyloru s vědomím, že je prokázána stejná onkologická radikalita jako při původní operaci podle Whipple s resekcí distální třetiny žaludku [9].
Standardní resekce představuje vyjmutí žlučníku, ductus choledochus, duodena od linie cca 5 cm aborálně od pyloru a hlavy pankreatu (event. s oblastí krčku – přesahuje-li CaP z hlavy do oblasti krčku). Resekční plocha pankreatu se odesílá k peroperačnímu bioptickému vyšetření k ověření R0 resekce.
Za adekvátní lymfadenektomii se v současné době považuje odstranění pojivové tkáně od jaterního hilu (přesněji od místa disekce ductus hepaticus communis) podél lig. hepatoduodenale a vpravo od v. portae, v. mesenterica sup. a dorzálně ležící a. mesenterica sup. [8]. Dále je nutné odstranit tkáň podél a. hepatica communis až k truncus coeliacus (Obr. 4). Na některých pracovištích se resekční výkon zahajuje provedením tzv. kocherizace duodena a preparací podél pravé strany a. mesenterica sup. – tzv. artery first approach [10]. K bioptickému vyšetření se odebírá vzorek tkáně z retroperitonea z oblasti mezi v. cava inf. a aortou na úrovni hlavy pankreatu. Pokud patolog najde ve vzorku maligní tkáň, resekční výkon neprovádíme nebo v přísně selektovaných případech (většinou u mladého nemocného) provedeme paliativní resekci.
Obr. 4. Pankreatoduodenektomie, stav po odstranění hlavy pankreatu s duodenem (1.v. portae, 2. v. lienalis, 3. v. mesenterica superior, 4. a. hepatica propria, 5. v. cava inferior, 6. pahýl pankreatu s nástrojem v pankreatickém vývodu) 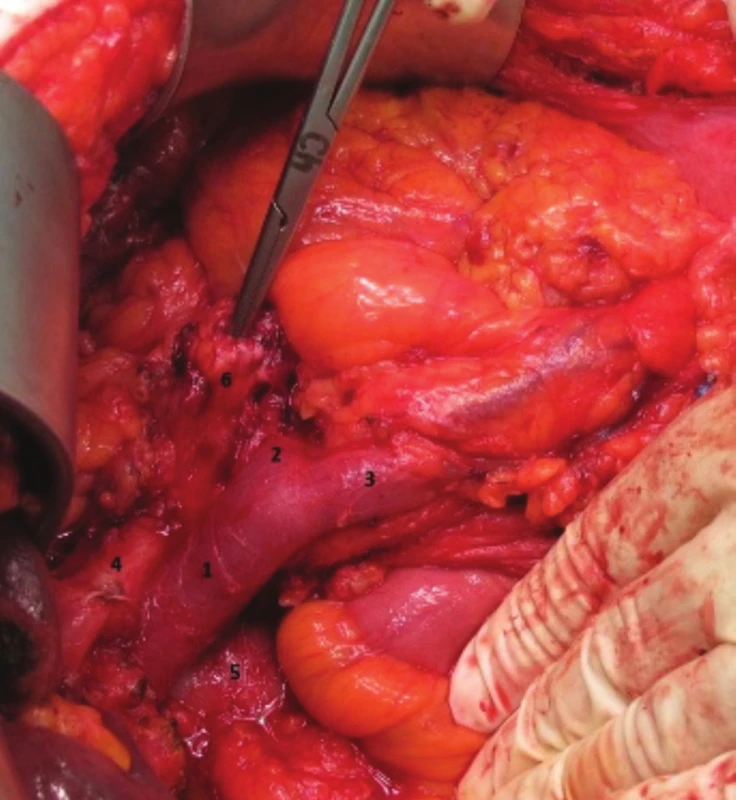
Po dokončení PDE s výše popsanou lymfadenektomií nastupuje fáze rekonstrukční. Existuje mnoho popsaných způsobů, jak rekonstruovat trávicí trakt, žlučové cesty a vyústění slinivky. Bez ohledu na způsob konstrukce je třeba provést pankreatojejuno/gastroanastomózu (PJA, PGA), hepatikojejunoanastomózu (HJA) a duodenojejunoanastomózu (DJA) či gastrojejunoanastomózu (GJA). Technik provedení PJA je publikována celá řada (muko-mukózní anastomóza paraschute technikou, invaginační techniky, stenty zavedené do pankreatického vývodu), žádná ale signifikantně nesnižuje výskyt pankreatických píštělí, respektive dehiscencí PJA. Typ zvolené rekonstrukce nemá vliv na prognózu pacienta [11], i když se vzhledem k 10% výskytu dehiscencí PJA s únikem pankreatické šťávy upřednostňuje v poslední době PGA (D. Jaeck, 2010, osobní sdělení).
Zavedení nasojejunální sondy protažením distálně od DJA k bezprostřednímu podávání enterální výživy považujeme za obligátní. Způsob pojistného drénování dutiny břišní závisí na konkrétním pracovišti.
Levostranná pankreatektomie (DPE)
Při lokalizaci CaP v těle či kaudě pankreatu je indikována levostranná radikální pankreatektomie, dříve označovaná jako distální (Obr. 5 a 6).
Obr. 5. Levostranná resekce se zachováním sleziny, stav po odstranění těla a kaudy pankreatu. (1. pahýl pankreatu oddělený staplerem, 2. v. lienalis, 3. a. lienalis, 4. Slezina) 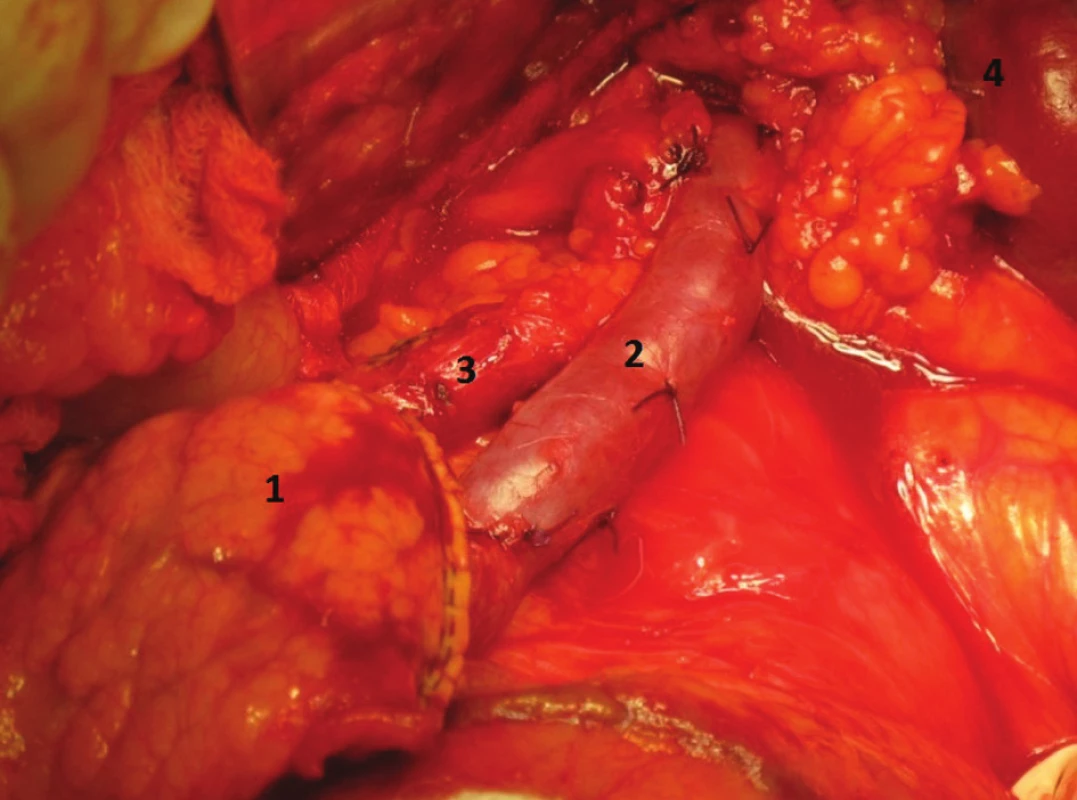
Obr. 6. Levostranná resekce se splenektomií, resekát 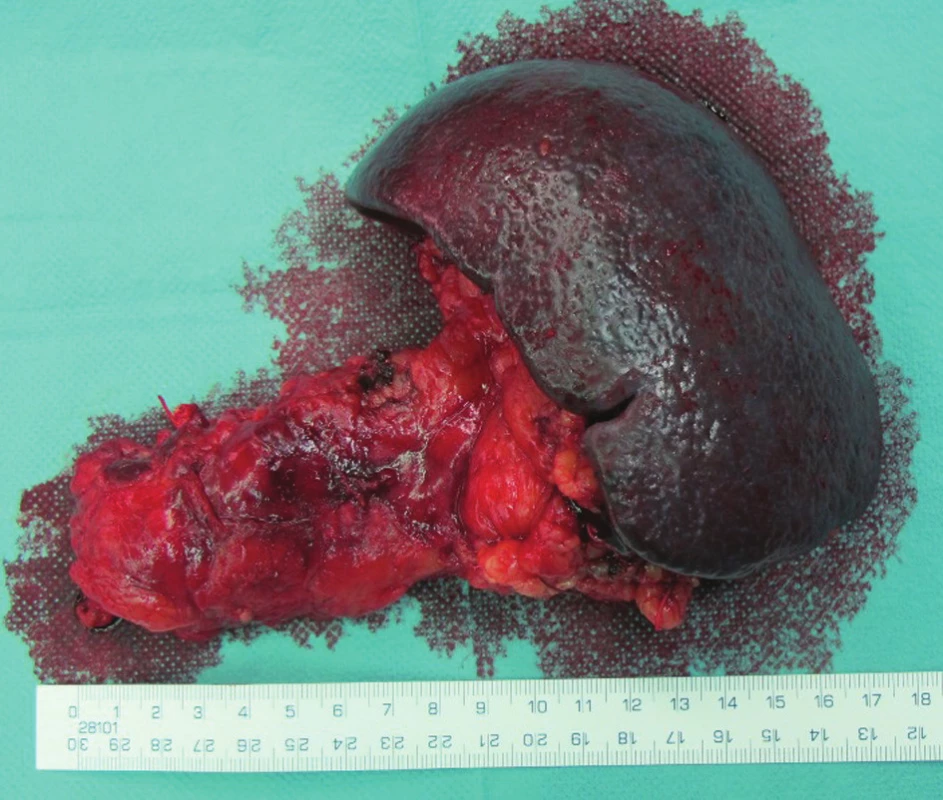
Výkon je ve srovnání s PDE technicky výrazně jednodušší, nicméně indikovaných nemocných s CaP v těle a kaudě pankreatu je zřetelně méně. Žláza se při radikální levostranné resekci protíná v oblasti krčku, pokud je CaP lokalizován v těle a nemáme průkaz postižení uzlin v oblasti hilu sleziny, můžeme provést resekci se zachováním sleziny.
Lymfadenektomie zahrnuje odstranění uzlin N1-2, resekční plochu analogicky vyšetřujeme peroperačním bioptickým vyšetřením. Při dostatečné zkušenosti lze DPE provést u většiny nemocných laparoskopicky. Na resekční ploše ponechané hlavy pankreatu je nutné uzavřít zející ductus pancreaticus a resekční plochu ošetřit v prevenci pooperačního krvácení. Podobně jako u PDE je pankreatická píštěl hlavní komplikací tohoto výkonu. Bezpečná technika ošetření pankreatického pahýlu dosud neexistuje.
Totální pankreatektomie (TPE)
Po počátečním nadšení se od provádění TPE ustoupilo vzhledem k vysokému výskytu pozdních komplikací, především rozvoji diabetu. V posledních letech někteří autoři revokují tento postup s tvrzením, že mortalita a morbidita TPE jsou srovnatelné se segmentárními resekčními výkony. Výhodu TPE spatřují především ve vyšší potenciální onkologické radikalitě při častém multifokálním výskytu CaP v pankreatu a vyloučení rizika vzniku pankreatické píštěle (Obr. 7).
Obr. 7. Preparát po provedení totální pankreatektomie 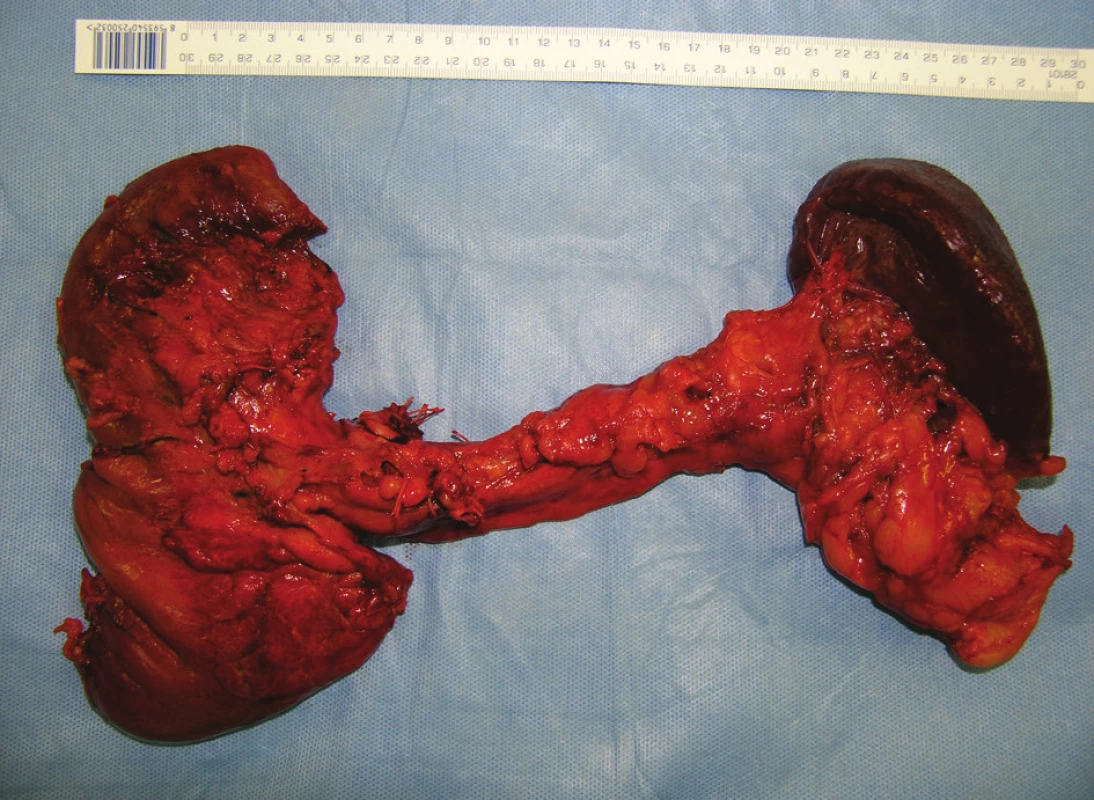
Podle současného názoru, stanoveného na základě několika provedených studií, je TPE vhodná pouze při zjištěné pozitivitě tkáně odebrané peroperačně z resekční plochy či při operační příhodě, která si provedení TPE vynucuje. Elektivní TPE není doporučována [8].
Radikální rozšířené resekce
Resekce portomezenterického segmentu při adherenci či prorůstání CaP do cévní stěny nevede ke zkrácení celkové doby přežívání. Může umožnit provést resekci a tím i prodloužit přežívání [8]. Podmínkou je udržení srovnatelné nízké peroperační mortality (Obr. 8). Postižení žilní stěny tumorem cirkulárně je považováno za špatný prognostický příznak.
Obr. 8. Pankreatoduodenektomie s resekcí porty, stav po odstranění preparátu 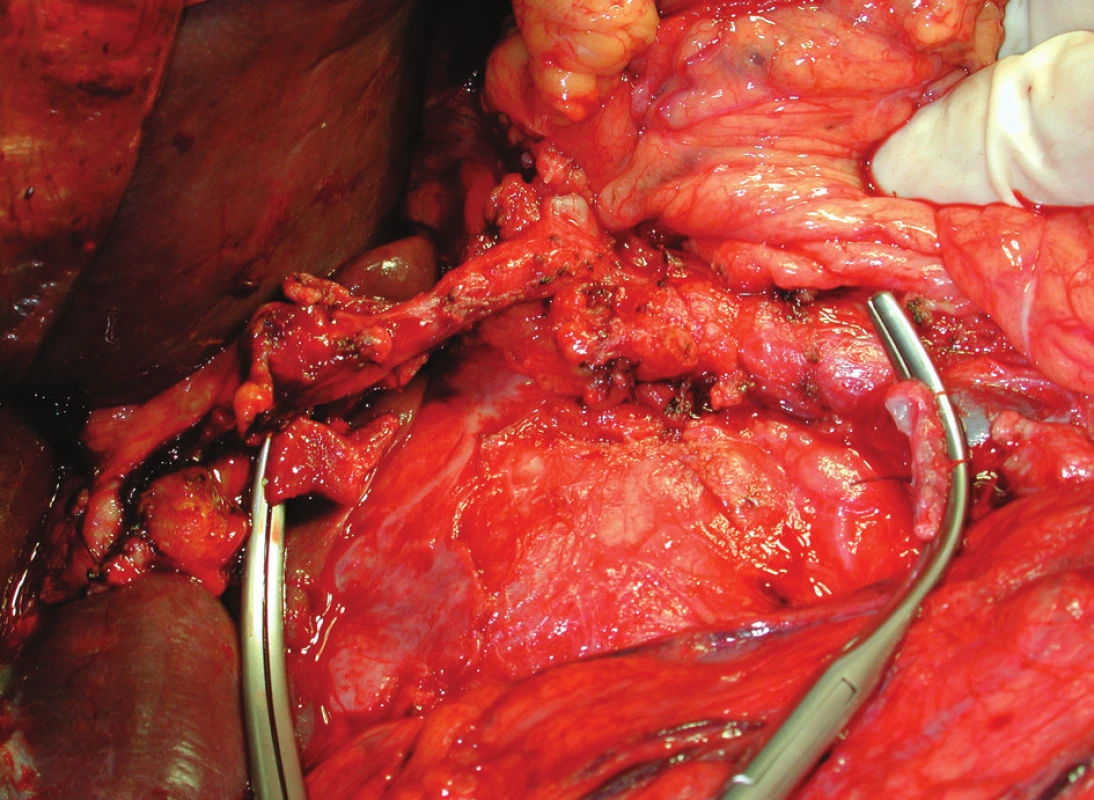
Na rozdíl od resekce portální žíly je arteriální resekce považována za výkon neobvyklý. Obecně je angioinvaze do a. mesenterica sup. považována za kontraindikaci k resekčnímu výkonu.
V literatuře je resekce a. mesenteria sup. uváděna velmi sporadicky [12, 13]. Adherence nebo prorůstání CaP do truncus coeliacus nemusí být považováno jednoznačně za projev neresekability. Celý truncus coeliacus může být odstraněn jako součást výkonu při PDE i DPE s rekonstrukcí pomocí a. hepatica. Disekci a. lienalis a a. gastrica sin. není třeba nahrazovat, je většinou nutné připojit splenektomii. Kontrolu perfuze jater je vhodné provést ještě v průběhu operace.
Přínos arteriálních resekcí pro nemocného s CaP hodnotit nelze. Literárně uvedené malé sestavy to neumožňují. Výhodou agresivního resekčního přístupu je skutečnost, že zvýšíme procento resekabilních nemocných s CaP. Vysoká cena tohoto rozhodnutí může být vyšší počet komplikací ve srovnání s výkonem standardním a nižší kvalita života pacienta po operaci při docílení srovnatelné doby přežití po standardní resekci [14].
Pokud CaP adheruje či zasahuje do sousedních orgánů (např. žaludek, transversum), lze uvažovat o provedení multivescerální resekce. Výsledky těchto operací jsou překvapivé a dobře srovnatelné s resekčním výkonem pouze na slinivce. Podmínkou je dosažení R0 resekce [15].
Zhodnotit přínos rozšířených resekcí s rozsáhle prováděnou lymfadenektomií je v současné době velmi obtížné, až nemožné [16]. Velmi závisí na zkušenosti a odpovědnosti chirurga, který se touto problematikou dlouhodobě zabývá a je schopen posoudit reálný přínos pro pacienta s pokročilým CaP.
Stanovení peroperačního stagingu onemocnění
V průběhu operace porovnáváme rozsah patologického nálezu s předoperačním stagingem a stanovíme staging peroperační. Hodnocení resekability během operačního výkonu znamená vyloučení metastatického rozsevu, vyloučení arteriální angioinvaze do AMS, TC a vyloučení prorůstání do okolních orgánů. Posouzením lokálního nálezu preparací v klíčových místech by měl být operační výkon zahájen. Operační nález se může lišit od předoperačního, stanoveného na základě předoperačních zobrazovacích vyšetření, až u třetiny nemocných. Ve většině případů se jedná o staging vyšší. V této skupině nemocných tak můžeme očekávat neplánované explorace či provedení paliativního výkonu, zejména biliodigestivní anastomózy. V souladu s doporučenou strategií je vhodné biliodigestivní anastomózu provést u nemocných s odhadem delšího přežívání. V opačném případě ponecháváme již endoskopicky zavedený stent a omezíme se na exploraci s transduodenálním odběrem bioptických vzorků Tru-cut jehlou, nebyla-li malignita ověřena FNA. Pokud nenacházíme příznaky významné stenózy duodena, gastrojejunoanastomózu preventivně u nemocných s lokálně pokročilým CaP neprovádíme [11].
Odstranění jaterních metastáz u nemocných s CaP není v rámci standardní terapie indikováno [17].
Komplikace resekčních výkonů a jejich řešení
Ačkoliv se časná mortalita resekce pankreatu v posledních 25 letech výrazně snížila a nepřevyšuje 3–5 % [18], morbidita zůstává vysoká a dosahuje v některých sestavách až 60 % [19]. Vysoké procento morbidity je způsobeno značným rozsahem operačního výkonu a velkým množstvím potenciálních komplikací. Nejzávažnější jsou dehiscence PJA, která vede ke vzniku pankreatické a často i enterální píštěle, krvácení a nitrobřišní infekt. Rizikovým faktorem vzniku dehiscence pankreatické anastomózy je především přítomnost měkké pankreatické tkáně (na rozdíl od fibroticky změněného parenchymu slinivky při chronické pankreatitidě).
Únik pankreatické šťávy (leak) se vyskytuje v 6–24 % a je příčinou nejen zvýšení morbidity, ale i mortality u nemocných po PDE [20]. U části nemocných znamená časnou reoperaci s dlouhodobou pooperační hospitalizací.
Také pooperační pankreatitida představuje jednu z nejzávažnějších komplikací s vysokou mortalitou dosahující až 80 %. Prevencí této komplikace je šetrná operační technika a vyloučení peroperační teplé ischemie pankreatu. Krvácení do GIT nebo do volné dutiny břišní se vyskytuje v 5–16 % po pankreatoduodenektomii nebo paliativní biliodigestivní spojce. Příčinou krvácení bývá peptická ulcerace, krvácení z anastomóz, arodovaný arteriální pahýl s rupturou do tenkého střeva či natrávená stěna cévy pankreatickou šťávou.
Protrahované poruchy vyprazdňování žaludku můžeme sledovat u 25–70 % nemocných po standardní pankreatoduodenektomii [21]. Není rozdíl, zda se jedná o klasický či pylorus šetřící výkon. I když tato častá komplikace není spojena s vyšší mortalitou, je příčinou prodloužené hospitalizace a tím i nákladů na léčbu. Časná enterální výživa se ukazuje jako vhodná prevence této komplikace.
Možnosti tzv. downstagingu – neoadjuvantní léčba
Nízká operabilita nemocných s CaP a skutečnost, že předoperační staging nevystihuje pokročilost onemocnění u značné části nemocných, vedou k úvaze o zhodnocení možnosti neadjuvantní chemoterapie. Nicméně klinické studie věnované zhodnocení přínosu neoadjuvantní chemoterapie či chemoradioterapie doposud neprokázaly významné možnosti, jak u podstatné části nemocných s lokálně pokročilým CaP dosáhnout resekability [22]. Proto se aplikace neoadjuvantní chemoterapie realizuje spíše v rámci klinických studií.
Adjuvantní léčba a její indikace
Byť je přínos pooperační chemoterapie, intraoperační nebo pooperační radioterapie, hormonální terapie nebo imunoterapie v současné době limitován, dokončené randomizované studie (CONKO – 001, ESPAC–3) prokazují její signifikantní přínos u nemocných po radikální resekci [23, 24]. Nebyl prokázán signifikantní rozdíl mezi podáním 5FU/FA a gemcitabinem, gemcitabin je však významně lépe pacientem snášen. Nebyl prokázán signifikantní přínos adjuvantní chemoradioterapie ve studii ESPAC–1 [25]. V posledním období se začíná uplatňovat v indikovaných případech biologická protinádorová léčba (erlotinib) [26].
VÝSLEDKY
Průměrné přežití u neoperovaného nemocného či po paliativním operačním výkonu je uváděno v rozmezí 4–6 měsíců, po resekčním výkonu 11–18 měsíců s mediánem rekurence 8–9 měsíců (11). 5leté přežití u nemocných s CaP po radikální resekci je uváděno v rozmezí 11–28 % s mediánem 12–18 měsíců [27].
Porovnání mediánu přežívání u neresekovaných a radikálně resekovaných nemocných s CaP jednoznačně hovoří ve prospěch radikálně resekovaných.
Peroperační mortalita v současné době na specializovaných pracovištích nepřesahuje 3–5 %, morbidita je udávaná v rozmezí 30–60 % [19].
Adjuvantní chemoterapie signifikantně prodlužuje přežívání u radikálně operovaných. Proto by měla být podávána u všech nemocných po provedené radikální resekci, v ČR v souladu se „Zásadami cytostatické terapie maligních onkologických onemocnění“ (t.č. 11. vydáním).
Faktory ovlivňující přežívání po resekčním výkonu
Z hlediska dlouhodobého přežití existuje vedle stadia onemocnění řada signifikantně významných prognostických faktorů. Negativní vliv na dlouhodobé přežívání signifikantně nemá ani ikterus (bilirubin > 100 μmol/l), ani ztráta na váze převyšující 10 kg, ale lokalizace nádoru, jeho velikost (T > 2 cm), přítomnost N2–3 uzlin a angioinvazivita. Horší prognóza u nemocných s karcinomem v oblasti processus uncinatus je způsobena pozdními klinickými příznaky. Negativními faktory jsou grading nádoru (nízce diferencovaný karcinom) a pozitivita resekční plochy. Perineurální šíření nádoru patří jednoznačně k velmi nepříznivým faktorům u duktálního karcinomu pankreatu. Negativní roli hraje také peroperační převod krve.
Předoperační zavedení stentu [5], předoperační ztráta na váze a provedení rozšířeného operačního výkonu nemají signifikantní význam pro dlouhodobé přežívání nemocného [8].
Nepochybný vliv má biologická povaha nádoru: buněčná diferenciace a přítomnost mutovaných onkogenů a supresorových genů. Jednoznačný je vztah mezi počtem resekčních výkonů provedených na chirurgickém pracovišti a perioperační mortalitou a morbiditou. Je také argumentem pro centralizaci nemocných s CaP do pracovišť, která se této problematice systematicky věnují.
ZÁVĚR
Karcinom pankreatu je šestým nejčastějším nádorem. Medián přežívání u pacientů s neresekabilním nádorem je 6 měsíců. Jde tedy o velmi agresivní onemocnění s nepříznivou prognózou. V současné době je radikální resekce v podobě PDE, LP, nebo TP jedinou potenciálně kurabilní terapeutickou modalitou u nemocného s karcinomem pankreatu, která ve spojení s adjuvantní chemoterapií signifikantně prodlužuje přežití.
Resekční výkon je proveditelný jen u 20 % pacientů. Zbytek je ve stadiu lokálně pokročilého, nebo metastazujícího onemocnění. Kromě paliativní systémové chemoterapie lze těmto pacientům poskytnout endoskopickou, nebo chirurgickou drenáž žlučových cest, eventuálně zajištění průchodnosti trávicího traktu. Samozřejmostí je správně vedená analgetická terapie. K hodnocení stagingu onemocnění jsou obligátní CT a EUS vyšetření. Pro posouzení resekability je klíčový vztah tumoru k přilehlým tepenným strukturám. Arteriální invaze je obecně považována za kontraindikaci k resekčnímu výkonu. ERCP není v případě CaP diagnostickou, ale terapeutickou modalitou. Potřeba derivace žlučových cest před operačním výkonem je sporná. Multioborový indikační tým, který se dlouhodobě problematice věnuje, je podmínkou správného hodnocení a tím snížení počtu explorativních výkonů a zbytečné zátěže nemocného. Poměrně velké nároky, které klade pacient s operabilním karcinomem pankreatu na operační tým, a náklady s výkonem spojené jsou zárukou, že postupně dochází i u nás ke koncentrování těchto nemocných na specializovaná pracoviště, jež jsou schopna nejen správně indikovat chirurgickou léčbu a provést ji, ale i řešit závažné komplikace spojené s chirurgií pankreatu.
MUDr. Pavel Záruba
Chirurgická klinika 2. LF UK a ÚVN Praha
U vojenské nemocnice 1200
160 00 Praha 6
e-mail: pavel.zaruba@uvn.cz
Zdroje
1. Bussom S, Saif MW. Methods and Rationale for the Early Detection of Pancreatic Cancer. JOP 2010;11 : 128–130.
2. Allema JH, Reinders ME, van Gulik TM et al. Prognostic factors for survival after pancreaticoduodenectomy for patients with carcinoma of the pancreatic head region. Cancer 1995 : 75,2069–2076.
3. Beger HG, Rau B, Gansauge F et al. Treatment of pancreatic cancer: challenge of the facts. World J Surg 2003;27 : 1075–1084.
4. Ardengh JC, Malheiros CA, Pereira V et al. Endoscopic Ultrasound-Guided Fine-Needle Aspiration using Helical Computerized Tomography for TN Staging and Vascular Injury in Operable Pancreatic Carcinoma. JOP 2009;10 : 310–317.
5. Petr WT, Pistes MD, Wayne A et al. Effect of praeoperative biliary decompression on pancreaticoduodenectomy – associated morbidity in 300 consecutive patients. Ann Surg 2001;234 : 47–55.
6. Peddu P, Quaglia A, Kane PA et al. Role of imaging in the management of pancreatic mass. Critical Reviews in Oncology/Hematology 2009;70 : 12–23.
7. Nguyen VX, Nguyen CC, Nguyen BD:18F-FDG PET/CT Imaging of the Pancreas: Spectrum of Diseases. J Pancreas 2011;12 : 557–566.
8. Glanemann M, Shi B, Liang F ert al. Surgical strategies for treatment of malignit pancreatic tumors: extended, standard or local surgery? World J Surg Oncol 2008;6 : 123(1-10).
9. Patel AG, Toyama MK, Kusske AM et al Pylorus - preserving Whipple resection for pancreatic cancer. Is it better? Arch Surg 1995;130 : 838–843.
10. Weitz J, Rahbari N, Koch M, Buchler MW. The „artery first“ approach for resection of pancreatic head cancer. J Am Coll Surg 2010;210 : 1–4.
11. Alexakis N, Halloran C, Raraty M et al. Current standard of surgery for pancreatic cancer. BJS 2004;91 : 1410–1427.
12. Koliopanos A, Avgerinos C, Farfaras A et al. Radical resection of pancreatic cancer. Hepatobiliary Pancreat Dis Int 2008;7 : 11–18.
13. Reddy SK, Tyler DS, Pappas TN et al. Extended resection for pancreatic adenocarcinoma. The Oncologist 2007;12 : 654–663.
14. Schniewind B, Bestmann B, Henne – Bruns D et al. Quality of life after pancreaticoduodenectomy for ductal adenocarcinoma of the pancreatic head. Br J Surg 2006;93 : 1099–1107.
15. Nikfarjam M, Sehmbey M, Kimchi ET et al. Additional organ resection combined with pancreaticoduodenectomy does not increase postoperative morbidity and mortality. J Gastrointest Surg 2009;13 : 915–921.
16. Pawlik TM, Abdalla EK, Barnett CC et al. Feasibility of a randomized trial of extended lymfadenectomy for pancreatic cancer. Arch Surg 2005;140 : 584–591.
17. Singh A, Singh T, Chaudhary A. Synchronous Resection of Solitary Liver Metastases with Pancreaticoduodenectomy. JOP 2010;11 : 434–438.
18. Hariharan D, Saied A, Kocher HM. Analysis of mortality rates for pancreatic cancer across the word. HPB 2008;10 : 58–62.
19. Büchler MW, Wagner M. MD, Schmied BM et al. Changes in Morbidity After Pancreatic Resection. Toward the End of Completion Pancreatectomy. Arch Surg 2003;138 : 1210–1314.
20. Pezzilli R. Early Identification of Postoperative Pancreatic Fistula May Reduce the Risk of Postoperative Hemorrhage in Pancreatic Resected Patients. JOP 2007;8 : 637–639.
21. Shan YS, Hsieh YH, Yao WJ et al. Impaired Emptying of the Retained Distal Stomach Causes Delayed Gastric Emptying after Pylorus-preserving Pancreaticoduodenectomy. World J Surg 2007;31 : 1606–1615.
22. Heinemann V. Current adjuvant and neoadjuvant treatment concepts in pancreatic cancer. Eur Surg 2009;41 : 300–307.
23. Oettle H, Post S, Neuhaus P et al. Adjuvant chemotherapy with gemcitabine vs. observation in patiens undergoing curative – intent resection of pancreatic cancer. JAMA 2007;297 : 267–277.
24. Neoptolemos JP, Stocken DD, Bassi C et al. Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. JAMA 2010;304 : 1073–1081.
25. Neoptolemos J, Stocken DD, Friess H et al. A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer. NEJM 2004;350 : 1200–1210.
26. Moore MJ, Goldstein D, Hamm J et al. Erlotinib Plus Gemcitabine Compared With Gemcitabine Alone in Patients With Advanced Pancreatic Cancer: A Phase III Trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 2007; 25 : 1960–1966.
27. Pawlik TM, Gleisner AL, Cameron JL et al. Prognostic relevance of lymph node ratio following pancreaticoduodenectomy for pancreatic cancer. Surgery 2007;141 : 610–618.
28. Ryska M, Strnad R, Belina F et al. Radical resection in patients with pancreatic head carcinomas. A retrospective survival analysis in a group of 307 subjects. Rozhl Chir 2007;86 : 432–439.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Upside down stomachČlánek Pankreatitida
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Impakt radikální resekce v komplexní léčbě nemocných se solidním maligním nádorem
- STARR operace v léčbě rektokély a intususcepce rekta
- Metody odběru vzorku na kultivační vyšetření v chirurgické praxi, otiskové metody
- Centrální kanylace s využitím sonografie a skiaskopie – 2leté zkušenosti
- Klasifikace chirurgických komplikací: analýza vlastní skupiny nemocných
- Upside down stomach
- Pľúcna pneumatokéla u dospelého pacienta – kazuistika
- Pankreatitida
- Chronická pankreatitida – klasifikace, diagnostika a terapie
- Akutní pankreatitida – komplexní problematika
- Chirurgická terapie chronické pankreatitidy
- Chirurgická léčba karcinomu pankreatu
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Upside down stomach
- STARR operace v léčbě rektokély a intususcepce rekta
- Klasifikace chirurgických komplikací: analýza vlastní skupiny nemocných
- Chirurgická terapie chronické pankreatitidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



