-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vyšetření sentinelové uzliny u in situ karcinomu prsu
Sentinel Lymph Node Examination in Breast Carcinoma in Situ
Introduction:
Breast carcinoma in situ is defined as non-invasive form of carcinoma. However, we can see infiltration of sentinel lymph node even in this disease. The aim of this work was to determine indication criteria for detection of sentinel lymph node in breast carcinoma in situ.Materials and methods:
Summary of current knowledge about examination of sentinel lymph node in breast carcinoma in situ. Comparison of the results with our own results.Results:
We summarized the results of 10 trials studying ductal carcinoma in situ (DCIS) and 4 studies with DCIS with microinvasion. Sentinel lymph node infiltration is described in 0 to 7.3%, or 9.3 to 29.4%. In our department during the period of one year, we diagnosed 7 carcinomas in situ, in the final histology examination 5 DCIS, 1 DCIS with microinvasion and 1 lobular carcinoma in situ (LCIS) with microinvasion. Sentinel lymph node infiltration was diagnosed only in LCIS with microinvasion. The other, non-sentinel axillary lymph nodes, were negative in this patient. The indication criteria for sentinel lymph node examination in breast carcinoma in situ in our department include: greater extent of microcalcifications, indication for total mastectomy for diffuse involvement, microcalcifications with palpable resistance, preoperative diagnosis of carcinoma in situ from core-cut biopsy, carcinoma in situ G3 confirmed in open extirpation.Conclusions:
The sentinel lymph node examination in breast carcinoma in situ can change staging of the disease, as well as the treatment modality. In case that the sentinel lymph node is positive, the disease is undoubtedly invasive and the invasive part of the tissue was not seen in the biopsy sample.Key words:
in situ breast cancer – sentinel node – microcalcification
Autoři: Ja. Mergancová; Ji. Mergancová; I. Hrnčířová 1; Z. Kerekes 2; M. Hácová 3
Působiště autorů: Chirurgická klinika, Pardubická krajská nemocnice a. s., přednosta: doc. MUDr. Jiří Šiller, Ph. D. ; Mamodiagnostické centrum Pardubice s r. o. 1; Patologie Litomyšl 2; Patologicko-anatomické oddělení, Pardubická krajská nemocnice a. s., primář: MUDr. Pavel Rothröckel 3
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 7, s. 393-396.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod a cíl:
In situ karcinom prsu je definován jako neinvazivní forma karcinomu. Přesto se i u tohoto typu onemocnění můžeme setkat s postižením sentinelových uzlin. Cílem naší práce je stanovaní indikačních kritérií pro vyšetření sentinelové uzliny u in situ karcinomu prsu v našich podmínkách.Materiál a metodika:
Shrnutí celosvětových poznatků s vyšetřením sentinelové uzliny u in situ karcinomu prsu. Porovnání výsledků s našimi zkušenostmi.Výsledek:
V práci je shrnuto 10 studií s finální diagnózou duktální karcinom in situ (DCIS) a 4 studie DCIS s mikroinvazí. Postižení sentinelové uzliny je popisováno v 0 až 7,3 %, resp. v 9,3 až 29,4 %. Během jednoho roku bylo v Mamodiagnostickém centru Pardubice zachyceno 7 in situ karcinomů, v definitivní histologii 5x DCIS, 1x DCIS s mikroinvazí a 1x lobulární karcinom in situ (LCIS) s mikroinvazí. Postižení sentinelové uzliny bylo pozorováno pouze u LCIS s mikroinvazí. Ostatní, nonsentinelové axilární uzliny, byly u této pacientky negativní. Indikační kritéria na našem pracovišti k vyšetření sentinelové uzliny u in situ karcinomu prsu jsou následující: rozsah mikrokalcifikací na větší ploše, zejména je-li pro difuzní postižení indikace k totální mastektomii; přítomnost mikrokalcifikací s hmatnou rezistencí; předoperační diagnóza in situ karcinomu z core cut biopsie; in situ karcinom G3 histologicky potvrzený diagnostickou exstirpací.Závěr:
Vyšetření sentinelové uzliny u in situ karcinomu prsu může změnit nejen staging choroby, ale i taktiku další léčby. Pokud je sentinelová uzlina pozitivní, jedná se nepochybně o invazivní karcinom, jehož invazivní složka nebyla v preparátu z prsu zachycena.Klíčová slova:
in situ karcinom prsu – sentinelová uzlina – mikrokalcifikaceÚVOD
Skríningové mamografické vyšetření je využíváno ve stále větší míře, v ČR jej podstoupí přes 50 % cílové populace, regionálně se jedná až o 70 %. Tento fakt vede ke zvýšení záchytu časných stadií karcinomu prsu, zvyšuje se i záchyt in situ karcinomu. Incidence in situ karcinomu prsu v ČR je 5–10/100 000 žen.
DCIS je považován za preinvazivní stadium karcinomu prsu. Ve 30–50 % neléčených případů přechází do invazivní formy karcinomu během 10–20 let [1].
Vzhledem k biologickému i patologickému charakteru tumoru s vysokým procentem přežití a nízkým rizikem lokální recidivy jsou v chirurgické léčbě upřednostňovány prs záchovné operace – BCS (breast conservative surgery). Totální mastektomie zůstává vyhrazena pro pacientky s multicentrickým postižením, difuzními mikrokalcifikacemi nebo s nepoměrem rozsahu postižení prsní žlázy k velikosti prsu (nemožnost dosáhnout onkologicky čistých resekčních okrajů a dobrého kosmetického výsledku).
Velikost onkologicky čistých okrajů je stále kontroverzním tématem. Podle „Consensus on DCIS of Philadelphia (1999)“ [2] byl požadován onkologicky čistý okraj minimálně 10 mm. Od té doby bylo publikováno množství článků, ve kterých se autoři přiklánějí i k možnosti menších okrajů. Za bezpečné považují okraje 3 mm [3, 4], 2–3 mm [5], 2 mm [6–8], 1 mm [9]. V roce 2009 byl zrušen konsenzus striktního dodržování 1cm čistého okraje („Saint Galen International Experts Consensus“) [10]. V Miláně byl Onkologickým Evropským Institutem vyhodnocen soubor celkem 24 668 pacientek za období 06/1994–12/2009. V souboru bylo 4 350 (17,6 %) pacientek s in situ karcinomem prsu. S ohledem na tento objemný soubor pacientek považují 1mm okraj za dostatečný a onkologicky bezpečný [11].
Dalším diskutovaným tématem u in situ karcinomu je staging axilárních uzlin. Procento postižení lymfatických axilárních uzlin je v literatuře uváděno různé, nejčastěji mezi 1–5 %. Obecně není doporučována primární exenterace axily. Jednoznačné a ucelené názory však nejsou ani na vyšetření sentinelové uzliny. Někteří autoři jsou přesvědčeni, že sentinelová uzlina nemusí být u všech vyšetřena [12], pro jiné je to součást stagingu a striktně a vždy sentinelovou uzlinu vyšetřují [13, 14]. Většina autorů se snaží nalézt vodítko k odhalení pacientů s DCIS s rizikem k invazivní komponentě. Zjistili zvýšenou frekvenci postižení sentinelové uzliny u pacientů s karcinomem in situ s mikroinvazí, s vysokým gradingem, při hmatném tumoru, pokud je nádorová masa patrná již na mamografii a pokud předoperační diagnóza byla provedena z core cut či mamotomové biopsie. V těchto případech vyšetření sentinelové uzliny doporučují [15].
Poslední nedořešenou otázkou je indikace exenterace axily při pozitivním záchytu v sentinelové uzlině. V několika publikovaných případech, kdy byla exenterace axily pro postiženou sentinelovou uzlinu provedena, byly ostatní, tedy non-sentinelové uzliny, již negativní [16, 17].
MATERIÁL A METODIKA
Pomocí internetového vyhledávače PubMed bylo vyhledáno několik studií publikovaných v posledních deseti letech popisujících přítomnost metastáz v sentinelové uzlině při DCIS. V tabulce 1 a 2 je shrnuto celkem 14 publikovaných studií, 10 z nich popisuje přítomnost metastatického postižení sentinelové uzliny u in situ karcinomu, 4 studie popisují metastatický záchyt v uzlinách při in situ karcinomu s mikroinvazí. V tabulce 3 jsou shrnuty zkušenosti s karcinomem in situ z našeho pracoviště za 12 měsíců.
Tab. 1. Studie popisující pozitivitu SLN při finální diagnóze DCIS Tab. 1. Literature results on SLN positivity rate in patients with a final diagnosis of pure DCIS 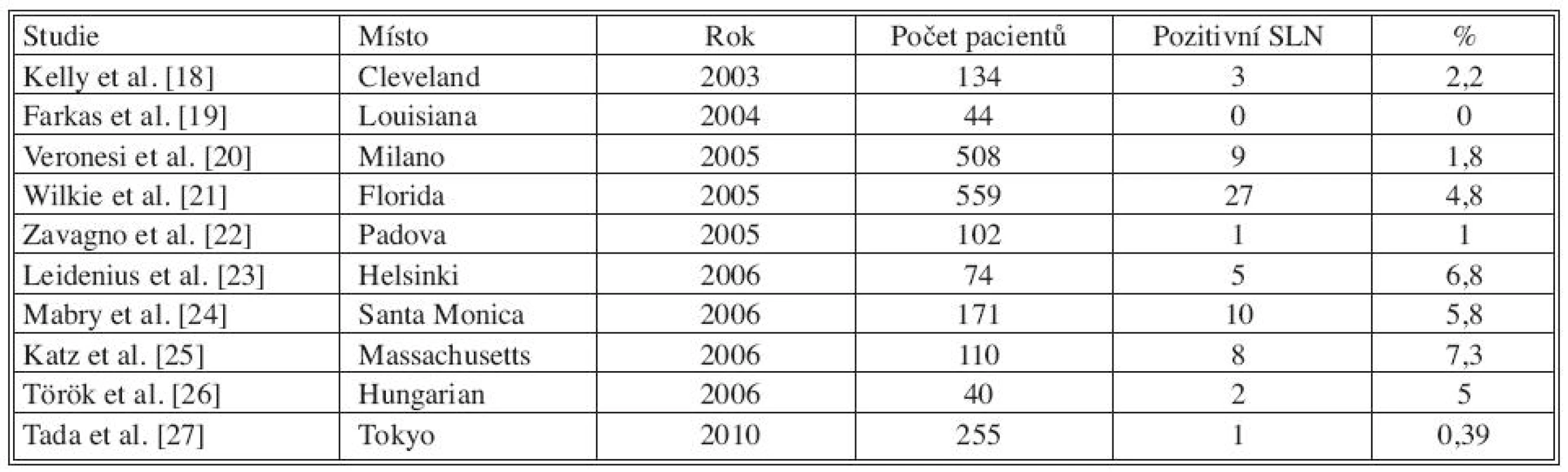
SLN – sentinelová uzlina Tab. 2. Studie popisující pozitivitu SLN při finální diagnóze DCIS s mikroinvazí Tab. 2. Literature results on SLN positivity rate in patients with a final diagnosis of DCIS with microinvasion 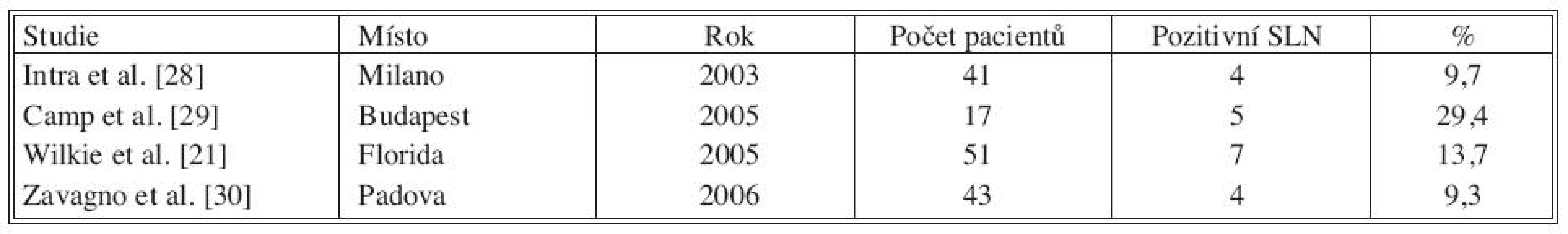
Tab. 3. In situ karcinom zachycený na našem pracovišti za 12 měsíců Tab. 3. In situ breast cancer patients in our department during the period of 12 months 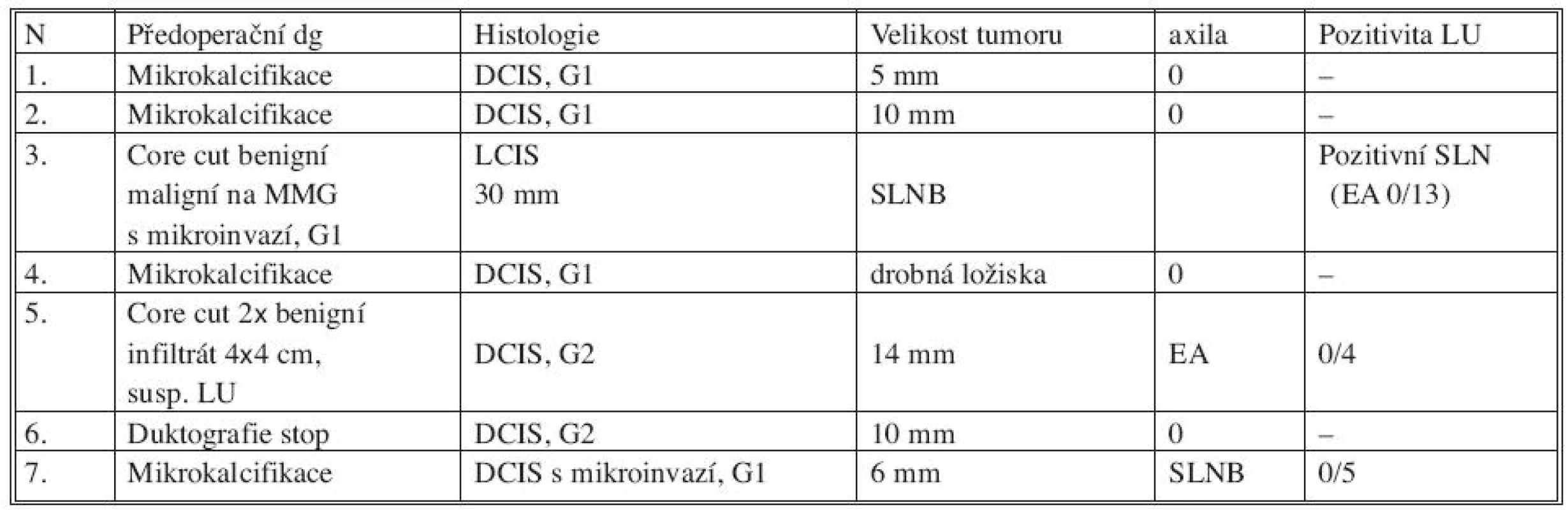
MMG – mamografie, LU – lymfatická uzlina, SLN – sentinelová uzlina, EA – exenterace axily, SLNB – biopsie sentinelové uzliny VÝSLEDEK
Za nejdůležitější faktor invazivity je považován grading tumoru a přítomnost comedo nekróz [31].
V tabulce 1 je shrnuto 10 studií. Největší počet pacientů s DCIS publikoval Wilkie et al., pozitivní sentinelovou uzlinu zachytil u 27 z 559 pacientek (4,8 %). Veronesi et al. popisuje postižení sentinelové uzliny v 1,8 % (9/508). V dalších citovaných studiích kolísá postižení sentinelové uzliny od 0 do 7,3 %. Tabulka 2 udává přítomnost nádorových buněk v sentinelové uzlině u DCIS s mikroinvazí, postižení uzliny se pohybuje od 9 do 30 %.
Na našem pracovišti jsme za 12 měsíců zachytili in situ karcinom u 7 pacientek. Předoperačně core cut biopsií nebyl in situ karcinom zachycen v žádném z těchto 7 případů. Ve 4 případech byla indikována diagnostická exstirpace mikrokalcifikací (Obr. 1) zachycených na mamografickém vyšetření, 2x byl benigní výsledek core cut biopsie při suspektním vzhledu na mamografu, 1x provedena exstirpace ložiska pro patologickou sekreci z bradavky s patologickým duktografickým nálezem. V definitivní histologii patolog popsal DCIS v 5 případech, u dalších dvou pacientek byla zastižena mikroinvaze (1x DCIS s mikroinvazí, 1x LCIS s mikroinvazí). Vyšetření sentinelové uzliny jsme indikovali u obou pacientek s karcinomem s mikroinvazí. Pozitivní záchyt byl pouze při LCIS s mikroinvazí. Následná exenterace axily přinesla 13 negativních uzlin. Jedna pacientka z naší skupiny pacientek podstoupila přímo exenteraci axily pro suspektní vzhled axilárních uzlin na ultrazvukovém předoperačním vyšetření. Patolog popsal jen 4 axilární uzliny, všechny byly negativní.
Obr. 1. DCIS s mikrokalcifikacemi Fig. 1. DCIS with microcalcification 
Indikační kritéria k vyšetření sentinelové uzliny u in situ karcinomu prsu na našem pracovišti jsou shodná s indikacemi v uváděné literatuře, jsou to:
- rozsah mikrokalcifikací na větší ploše, zejména je-li pro difuzní postižení indikace k totální mastektomii,
- přítomnost mikrokalcifikací s hmatnou rezistencí,
- předoperační diagnóza in situ karcinomu z core cut biopsie,
- in situ karcinom G3 histologicky potvrzený diagnostickou exstirpací.
Pokud je palpační a ultrazvuková suspekce na postižení axilárních uzlin, provádíme primárně exenteraci axily.
DISKUSE
Položme si základní otázku – Jak může tumor definovaný jako neinvazivní metastázovat do lymfatických uzlin? Jednou z možností může být nereprezentativní odběr histologického vzorku. Invazivní fokus vedoucí k metastázování nemusí být detekován při předoperačním vyšetření (core cut biopsie). U 5–20 % pacientů s diagnózou DCIS při core cut biopsii je nalezena invaze v definitivní histologii [32]. Je-li ložisko mikrokalcifikací rozsáhlé, je obdobný problém se zachycením invaze i v definitivním histologickém vyšetření. Kdyby patolog kompletně prokrájel a prohlédl celý chirurgem odeslaný materiál, strávil by u jednoho vzorku od jedné pacientky řadu měsíců. Chce-li patolog prohlédnout celý materiál kompletně, pak preparát velikosti 5x3x3 cm přikrojí do 90 bločků velikosti 1x1x0,5 cm. Při tloušťce řezu 5 mm připraví z 90 bločků celkem 90 tisíc řezů na 90 tisíc sklíček k dalšímu zpracování. Pokud bude 1 sklíčko v mikroskopu prohlížet 1 minutu, pak stráví 1 patolog prohlížením 90 tisíc sklíček z preparátu velikosti 5x3x3 cm téměř 9 měsíců (při pracovní době 170 hodin měsíčně). Z uvedeného je více než jasné, že není technicky možné preparát kompletně vyšetřovat. Zachytíme-li metastázu v sentinelové uzlině při definitivní histologické diagnóze in situ karcinomu, je zřejmé, že invaze nebyla z výše uvedených důvodů patologem zachycena. Technicky je jednodušší prokrájet a vyšetřit sentinelovou uzlinu než ložisko rozsáhlých mikrokalcifikací. Proto při obrazu rozsáhlých mikrokalcifikací vždy indikujeme vyšetření sentinelové uzliny.
ZÁVĚR
Názor na vyšetření sentinelové uzliny u karcinomu in situ se neustále vyvíjí a upřesňuje. Postižení sentinelové uzliny znamená upstaging choroby a zřejmě svědčí o nezastižení (mikro)invaze v histologickém vyšetření karcinomu prsu. Technicky je jednodušší imunohistochemicky vyšetřit jednu drobnou sentinelovou uzlinu, než prokrájet a kompletně zhodnotit rozsáhlé mikrokalcifikace prsu.
MUDr. Jana Mergancová
Kyjevská 531
530 03 Pardubice
e-mail: jana.mergancova@centrum.cz
Zdroje
1. Stuart, K., Boyages, J., Brennan, M., et al. Ductal carcinoma in situ – management update. Aus. Fam. Physician, 2005; 34 : 949–954.
2. Schwartz, G. F., Solin, L., Olivotto, I., et al. Consensus conference on the treatment classification of ductal carcinoma in situ of the breast, April 22-25, 1999. Cancer, 2000; 68 : 946–954.
3. Leonard, G., Swain, S. Ductal carcinoma in situ, complexities and challenges. J. Natl. Cancer Inst., 2004; 96 : 906–920.
4. Hughes, L. L., Wang, M., Page, D. L. Local excision alone without irradiation for ductal carcinoma in situ of the breast: a trial of Eastern Cooperative Oncology Group. J. Clin. Oncol., 2009; 27 : 5319–5324.
5. Vincens, E., Alves, K., Lauratet, B., et al. Margin status in ductal carcinoma in situ of the breast. Bull Cancer, 2008; 95 : 1155–1159.
6. Mokbel, K., Cutuli, B. Heterogeneity the ductal carcinoma in situ and its effects of managements. Lancet Oncol., 2006; 7 : 756–765.
7. Morrow, M. Breast conservation and negative margins: how much is enough? Breast, 2009; 18(Suppl 3): S84–S86.
8. Dunne, C., Burke, J. P., Morrow, M., et al. Effect of the margin status on local recurrence after breast conservation and radiation therapy for ductal carcinoma in situ. J. Clin. Oncol., 2009; 27 : 1615–1620.
9. Mansell, R. E. Ductal carcinoma in situ: surgery and radiotherapy. Breast, 2003; 12 : 447–450.
10. Goldhirsch, A., Ingle, J. N., Gerlber, R. D., et al. Thresholds for the therapies: highlights of the Saint Gallen International Experts Consensus, on the primary therapy of early breast cancer. Ann. Oncol., 2009; 20(8): 1319–1329.
11. Farante, G., Zurrida, S., Galimberti, V., et al. The management of ductal intraepithelial neoplasia (DIN): open controversies and guidelines of the Instituto Europeo di Oncologia (IEO), Milan, Italy. Breast cancer Res. Treat., 2010 Aug.
12. Edge, S. B., Sheldon, D. G. Counterpoint: sentinel lymph node biopsy is not indicated for ductal carcinoma in situ. J. Natl. Compr. Canc. Netw., 2003; 1 : 207–212.
13. Pendas, S., Dauway, E., Guiliano, R., et al. Sentinel node biopsy in ductal carcinoma in situ patients. Ann. Surg. Oncol., 2007; 7 : 15–20.
14. Ansari, B., Ogston, S. A., Purdie, C. A., et al. Meta-analysis of sentinel node biopsy in ductal carcinoma in situ of the breast. Br. J. Surg., 2008; 95 : 547–554.
15. Wilkie, C., White, L., Dupont, E., et al. An update of sentinel lymp node mapping in patients with ductal carcinoma in situ. Am. J. Surg., 2005; 190 : 563–566.
16. Murphy, C. D., Jones, J. L., Hughes, J. S., et al. Do sentinel node micrometastases predict recurrence risk in ductal carcinoma in situ and ductal carcinoma in situ with microinvasion? Am. J. Surg., 2008; 196 : 566–568.
17. Moore, K., Sweeney, K., Wilson, M., et al. Outcomes for women with DCIS and positive sentinel node: a multi-institutional audit. Ann. Surg. Oncol., 2005; 14 : 2911–2917.
18. Kelly, T. A., Kim, J. A., Patrick, R., et al. Axillary lymph node metastases in patient with final diagnosis of ductal carcinoma in situ. Am. J. Surg., 2003; 186 : 368–370.
19. Zavagno, G., Belardinelli, V., Marconato, R., et al. Sentinel lymph node metastasis from mammary ductal carcinoma in situ with microinvasion. The Breast, 2007; 16 : 146–151.
20. Veronesi, P., Intra, M., Vento, A. R., et al. Sentinel lymph node biopsy for localised ductal carcinoma in situ? The Breast, 2005; 14 : 520–522.
21. Camp, R., Feezor, R., Kasraeian, A., et al. Sentinel lymph node biopsy for ductal carcinoma in situ: an evolving approach at the University of Florida. Breast J, 2005; 11 : 394–397.
22. Zavagno, G., Carcoforo, P., Marconato, R., et al. Role of axillary sentinel lymph node biopsy in patient with pure ductal carcinoma in situ of the breast. BMC Cancer, 2005; 5 : 28–34.
23. Katz, A., Gage, I., Evans, S., et al. Sentinel lymph node positivity of patients with ductal carcinoma in situ or microinvasive breast cancer. Am. J. Surg., 2006; 191 : 761–766.
24. Wilkie, C., White, L., Dupont, E., et al. An update of sentinel lymph node mapping in patients with ductal carcinoma in situ. Am. J. Surg., 2005; 190 : 563–566.
25. Farkas, E. A., Stolier, A. J., Teng, S. C., et al. An argument against routine sentinel node mapping for DCIS. Am. Surg., 2004; 70 : 13–18.
26. Török, K., Péley, G., Mátrai, Z., et al. The role of sentinel lymph node biopsy for staging patients with ductal carcinoma in situ of the breast. Magy Seb, 2006; 59 : 173–178.
27. Tada, K., Ogiya, A., Kimura, K., et al. Ductal carcinoma in situ and sentinel lymph node metastasis in breast cancer. World J. Surg. Oncol., 2010 Jan; 8 : 6.
28. Intra, M., Zurrida, S., Maffini., F., et al. Sentinel lymph node metastasis in microinvasive breast cancer. Ann. Surg. Oncol., 2003; 10 : 1160–1165.
29. Cserni, G., Ambrózay, É., Serényi, P., et al. A nem operatív patológiai emlödiagnosztika eredményei. Magy. Radiol., 2005; 79 : 178–183.
30. Zujewski, J., Eng-Wong, J. Sentinel lymph node biopsy in the management of ductal carcinoma in situ. Clin. Breast Cancer, 2005; 6 : 216–222.
31. Dupont, E. L., McCann, C., Cox, C. E. Ductal carcinoma in situ of the breast. Cancer Control., 1999; 6(3): 264–271.
32. Silverstein, M. J. Ductal carcinoma in situ of the breast. Annu Rev. Med., 2000; 51 : 17–32.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Komentář ke knize
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2011 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Causae mortis v chirurgii – odkaz monografie prof. Poláka a kolektivu po 50 letech od vydání
- Česká společnost robotické chirurgie zvolila nové členy výboru
- Spektrum poranění bránice ošetřené v traumatologickém centru
- Arthritis sternoclavicularis jako příčina mediastinitidy
- Obrovský Zenkerův divertikl – kazuistika
- Chirurgické řešení perforací při kolonoskopii
- Vyšetření sentinelové uzliny u in situ karcinomu prsu
- Laparoskopická totální gastrektomie
- Antibiotická profylaxe u akutních chirurgických výkonů – současná situace v ČR
- Akutní apendicitis – ranné komplikace a význam antibiotické profylaxe
- 750 spokojených pacientů? 10 let zkušeností a výsledků Longovy metody operace hemoroidů a análních prolapsů
- Obtížná diagnostika karcinomu prsu
- Významné životní jubileum prof. MUDr. Vladimíra Brzka, CSc.
- 100 let od narození prim. MUDr. Aloise Hoňka, chirurga a stavitele houslí
- Komentář ke knize
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antibiotická profylaxe u akutních chirurgických výkonů – současná situace v ČR
- Arthritis sternoclavicularis jako příčina mediastinitidy
- Chirurgické řešení perforací při kolonoskopii
- 750 spokojených pacientů? 10 let zkušeností a výsledků Longovy metody operace hemoroidů a análních prolapsů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



