-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Postavení radioterapie v léčbě karcinomu
The role of radiation therapy in rectal cancer
Background: Currently, surgery is still the only reliable curative procedure at all stages of rectal cancer. Its early stage involving the submucosa may be most effectively managed by local and gentle surgical procedures, without oncology therapy. However, most patients have deeper invading tumors that require radical transabdominal surgery. A large part of these tumors are locally advanced; they need a comprehensive solution consisting of a combination of surgery, radiotherapy and chemotherapy. The surgical and oncology treatment of these patients depends on the stage and location of the rectal tumor. The main goal of radiotherapy is to reduce the risk of local recurrences. Despite evident advances in the treatment, several issues remain unclear. The main subject of discussion is currently the best method of radiotherapy, the sequence of treatment modalities, as well as surgical approach to patients who achieve a clinical complete response after neoadjuvant treatment. The quality of life is considered to be a significant factor in assessing the therapeutic success in addition to the oncological outcome. Radiotherapy does not have the same benefit for all patients with advanced rectal cancer; in addition, it is necessary to take account of its adverse effects, especially late ones. According to current recommendations, radiotherapy may be omitted in some cases, particularly in upper rectal tumors. The tumors in the lower third of the rectum are a difficult issue. This is the main therapeutic challenge in terms of local control and preservation of the anal sphincter.
Purpose: The aim of this paper is to summarize the basic knowledge about radiotherapy of rectal cancer and relevant results of clinical trials and to highlight some controversial or unresolved issues.
Keywords:
radiotherapy – rectal cancer – Chemoradiotherapy – non-surgical – watch and wait – local recurrence
Autoři: P. Pospíšil 1,2
; P. Šlampa 1,2
Působiště autorů: Klinika radiační onkologie MOÚ Brno 1; Klinika radiační onkologie LF MU, Brno 2
Vyšlo v časopise: Klin Onkol 2020; 33(Suppl 1): 38-47
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2020S38Souhrn
Východiska: Operace je v současnosti stále jediným spolehlivě kurativním postupem u nádorů konečníku všech stadií. Časná stadia postihující maximálně submukózu mohou být efektivně a šetrně řešena lokálními chirurgickými postupy, bez nutnosti onkologické léčby. Většina pacientů má ale hlouběji invadující nádory, které vyžadují radikální transabdominální operaci. Velká část těchto nádorů je lokálně pokročilých, které potřebují komplexní řešení spočívající v kombinaci chirurgie, radioterapie a chemoterapie. Chirurgická a onkologická léčba těchto pacientů se liší v závislosti na stadiu a lokalizaci nádoru v konečníku. Hlavním cílem radioterapie je snížení rizika lokálních recidiv. Navzdory znatelným pokrokům v léčbě těchto pacientů zůstává nevyjasněno několik otázek. Hlavními předmětem diskuzí jsou v současnosti optimální způsob radioterapie, posloupnost léčebných modalit, dále pak chirurgický přístup k pacientům, kteří dosáhnou klinické kompletní odpovědí po neoadjuvantní léčbě. Kromě samotného onkologického výsledku je dnes považována za významný faktor pro hodnocení léčebného úspěchu kvalita života. Radioterapie nemá stejný přínos pro všechny pacienty s pokročilým tumorem rekta, navíc je třeba brát v úvahu její nežádoucí efekty, zejména pozdní. Dle současných doporučení v některých případech, zvláště u tumorů horního rekta, lze tedy radioterapii vynechat. Největším problém jsou nádory v dolní třetině konečníku. Představují hlavní terapeutickou výzvu, pokud jde o lokální kontrolu a zachování análního svěrače.
Cíl: Cílem sdělení je shrnout základní poznatky o radioterapii karcinomu rekta, relevantní výsledky z klinických studií a po-ukázat na některé sporné nebo nevyjasněné otázky.
Klíčová slova:
karcinom rekta – radioterapie – chemoradioterapie – neoperativní – sledování – lokální recidiva
Úvod
Karcinom rekta stejně jako ostatní nádory tlustého střeva patří ve vyspělých státech k nejčastějším onkologickým diagnózám. Ve výskytu karcinomu rekta, podobně jako karcinom tračníku, zaujímá ČR v mezinárodním srovnání nelichotivé přední místo. Ročně je u nás diagnostikováno téměř 2 200 nových případů karcinomu konečníku, více než polovina z nich na toto onemocnění umírá. K základním léčebným metodám stále patří chirurgický výkon, radioterapie (RT) a chemoterapie (CHT). Možnosti jednotlivých léčebných modalit stejně jako diagnostických metod zaznamenaly v posledních letech významné zlepšení. Pokrok přináší šetrnější a přitom dostatečně radikální operační výkony, modernější radioterapeutické techniky a komfortnější CHT. Snahou je nalézt optimální léčebné postupy ve vztahu k rozsahu postižení, lokalizaci tumoru a některým známým rizikovým faktorům. Ideální kombinace, sekvence a v neposlední řadě též načasování budou jistě nadále předmětem dalších diskuzí. Radioterapie je dnes nedílnou součástí léčby lokálně pokročilého karcinomu rekta. Předoperační, pooperační, krátký i dlouhý kurz přináší významné snížení rizika lokální recidivy. Avšak nebylo prokázáno jednoznačné zlepšení v parametru přežití. Poté co se stala standardem operace založená na totální mezorektální excizi (TME), kleslo významně i riziko lokálních recidiv. Změnil se tak poměr mezi přínosem a riziky radiační léčby, prospěch RT se tedy už nejeví tak jednoznačný. Zejména u méně pokročilých klinických stadií II je riziko lokálních recidiv relativně nízké. Vedlejší efekty RT nejsou zanedbatelné. Především pozdní následky, jež mohou být i trvalého charakteru, rozhodně nelze opomíjet. Pokud se u karcinomu rekta objeví lokální recidiva, bývá její řešení obvykle velmi obtížné. Pánevní recidivy jsou často inoperabilní, projevující se výraznou morbiditou a zhoršenou kvalitou života. Léčebný postup, jenž kombinuje jednotlivé léčebné modality, je tedy efektivnější a má lepší léčebné výsledky. Rizikem je ovšem možnost kumulace vedlejších efektů s negativním dopadem na kvalitu života. Cílem sdělení je shrnout základní poznatky o RT karcinomu rekta a poukázat na některé nevyjasněné otázky.
Neoadjuvantní a adjuvantní léčba karcinomu rekta
Cílem neoadjuvantní i adjuvantní léčby karcinomu rekta je maximálně omezit riziko reziduální choroby, a tím snížit četnost lokálních recidiv, případně i vzdálené diseminace. Lokální recidivy jsou často obtížně léčitelné a výrazně zhoršují kvalitu života nemocných. Přestože v současnosti existuje účinná léčba metastatického onemocnění, jedná se stále o inkurabilní stav. Obecně se neoadjuvantní terapií rozumí léčba aplikovaná před kurativní metodou a adjuvantní terapie léčba aplikovaná po ní. V případě nádorů konečníku se termín neoadjuvantní rovná předoperační léčbě a pooperační léčbě. Význam radiační léčby u karcinomu konečníku je znám již dlouho. Několik metaanalýz prokázalo významné zlepšení lokální kontroly po aplikaci adjuvantního nebo neoadjuvantního ozáření [1]. Přidání chemoterapie na bázi fluoropyrimidinů do kombinace s ozářením má primárně zvýšit účinek záření, tedy radiosenzitizaci. Podání adjuvantní CHT má za cíl eliminovat mikrometastázy. Neoadjuvantní RT či chemoradioterapie (CHTRT) následovaná radikálním chirurgickým výkonem je dnes běžným postup u většiny nádorů dolní a střední třetiny konečníku klinického stadia T3 a/nebo N1. Neoadjuvantní léčba se stala standardem na základně výsledků studie CAO/ARO/AIO-94, kdy bylo zjištěno, že předoperačně podaná léčba má signifikantně lepší výsledky, co se týče lokální kontroly (redukce rizika lokální recidivy), než léčba pooperační. Závěr vedl ke změně tehdejší praxe [2]. V současnosti jsou akceptovatelné dva způsoby předoperačního ozáření. Jednak je to dlouhý, 5–6 týdnů trvající režim využívající konvenční frakcionace a kombinovaný s CHT, nebo akcelerovaný týdenní režim 5 × 5 Gy. Primárním cílem obou postupů je snížení rizika lokální recidivy. Neoadjuvantní terapií lze také dosáhnout zmenšení nádoru, docílit kompletní patologické odpovědi a umožnit orgán a svěrač záchovný chirurgický výkon. Na základě výsledků randomizovaných studií se obě metody ozáření ukázaly jako podobně efektivní, co se týče redukce rizika lokální recidivy (LR). Obě se dostaly mezi doporučené možnosti léčby pokročilého nádoru konečníku. Obě strategie byly testovány paralelně, tedy nezávisle na sobě již v průběhu 80. a 90. let. Přestože jsou v určitých ohledech obě možnosti srovnatelné, jsou v užívání obou postupů výrazné geografické rozdíly. V USA a ve střední a jižní Evropě je preferovaný způsob CHTRT. Skandinávské státy a země severozápadní Evropy se spíše kloní ke krátkému kurzu RT. Nedávné randomizované klinické studie srovnávající CHTRT a zkrácený režim RT neprokázaly jednoznačnou výhodu žádného ze zkoumaných postupů.
Indikace k neoadjuvantní radioterapii
Pro indikaci neoadjuvantní terapie je zásadní znalost lokalizace tumoru. V praxi je důležité dělení na tumory horního rekta a rektosigmoidálního přechodu a na tumory dolního a středního rekta, které jsou uloženy extraperitoneálně, tedy v malé pánvi. Postup při léčbě nádorů od horního rekta výše je totožný s léčbou nádorů tračníku, a to včetně adjuvantní terapie. V klinické praxi se někdy používá zjednodušování na horní a dolní rektum podle lokalizace nad a pod peritoneální výchlipkou. Vztah k peritoneální výchlipce jako jediná informace se ale nezdá být optimálním kritériem pro určení způsobu léčby [3]. V klíčových studiích s neoadjuvantní terapií byla jako vstupní kritérium definována vzdálenost nádoru od análního okraje. V rámci jednotlivých studií byl horní limit různý, pohyboval se ale většinou od 15 do 16 cm. Důležitá je však informace, že valná většina tumorů byla lokalizována < 10 cm od análního okraje [4,5]. Definitivní rozhodnutí o vhodnosti neoadjuvantní léčby závisí vždy na posouzení multidisciplinárním týmem, jehož nedílnou součástí jsou také radiolog a chirurg. Co se týká stadií určených k neoadjuvanci, je nutno zmínit výraznou heterogenitu pacientů s klinickým stadiem II. U stadia IIB a IIC (tumory cT4) je indikace jasná. V rámci stadia IIA (cT3N0) je možno vymezit „časný T3“ a „pozdní T3“ nádor [6,7]. V závislosti na hloubce infiltrace přesahující muscularis propria, měřené v milimetrech na magnetické rezonanci (MR) v axiální rovině, lze stadium cT3 rozdělit na cT3a–d, přičemž cT3a je < 1 mm, cT3b je 1–5 mm, cT3c je 5–15 mm a cT3d je > 15 mm [6]. Pokud jde o MR vyšetření, panuje poměrně značná nejednotnost ve způsobech jeho hodnocení a popisování. Subklasifikace T3 stadií anebo vzdálenost infiltrace mezorektálního tuku nebývá vždy uváděna, i když by to mělo být věcí samozřejmou. Zajímavé je, že i když se hloubka infiltrace mezorektálního tuku ukázala jako prognostický faktor se vztahem k lokální recidivě [6,7], současná TNM klasifikace (AJCC, 8. vydání) toto dělení T3 nezahrnuje [8]. MR vyšetření hraje důležitou úlohu při určování T stadia, ačkoli přesné rozlišení mezi T2 a časným T3 stadiem je na MR obtížné a mnohdy prakticky nemožné. Toto rozlišení však naštěstí není klinicky významné, v tomto případě nehraje roli při určování léčebné strategie. U T3 nádorů je ale důležitá informace o hloubce infiltrace mezorektálního tuku odečtené na MR [9]. V konečném důsledku se dá říci, že MR staging hraje klíčovou roli, jelikož přímo ovlivňuje léčebnou strategii. Při návrhu primární operace nebo neoadjuvantní terapie mohou mít vliv jednotlivé milimetry.
Doporučení Evropské společnosti pro klinickou onkologii (ESMO) uvádějí, že „časná T3 stadia“ (cT3a) jsou indikací pro primární operační výkon bez neoadjuvantní terapie [10]. Konsenzuální doporučení Evropské organizace pro výzkum a léčbu rakoviny (EORTC) ze St. Gallen z roku 2016 také uvádějí primární resekční výkon jako možnost první volby u časných nízce rizikových karcinomů konečníku. Americká doporučení Národní onkologické sítě (National Comprehensive Cancer Network – NCCN) však nerozlišují mezi jednotlivými nádory stadia T3 a doporučují neoadjuvantní léčbu u všech stadií T3.
V případě karcinomu rekta klinického stadia I (cT1–2, N0, M0) se všechna doporučení shodují, že preferovaným postupem je samotná operace bez neoadjuvantní léčby. Pokud však následně neočekávaně histopatologický nález vede ke zvýšení stadia (pT3 nebo N1–2) nebo najdou-li se rizikové faktory (pozitivní resekční linie nebo lymfovaskulární invaze), měla by být individuálně zvažována adjuvantní terapie.
Americká společnost radiační onkologie (ASTRO) vydala svá stanoviska pro klinickou praxi, kde navrhuje vhodné postupy radiační léčby u nádorů rekta stadia II a III, a to včetně případů, kde není z medicínských důvodů možná radikální operace nebo ji pacient odmítá [11]. Za těchto okolností lze jako potenciálně kurativní metodu použít definitivní RT nebo CHTRT. Tento postup lze v některých případech akceptovat i u klinického stadia I. Ačkoli menší studie přinesly slibné výsledky, tento přístup je nutno považovat stále za experimentální, jelikož pro něho neexistuje opora v podobě dat z randomizovaných klinických studií.
Krátký kurz neoadjuvantní radioterapie
Krátký režim RT (obyčejně 25 Gy v pěti frakcích během 5 dní) byl předmětem zkoumání v mnoha klinických hodnoceních. Několik randomizovaných studií srovnávalo krátký způsob RT s dlouhým režimem, resp. s CHTRT. Cílem jiných randomizovaných studií bylo srovnávání postupu s předoperační RT oproti primárnímu chirurgickému řešení a případné adjuvantní terapie dle rizika. Za účelem zhodnocení přínosu krátkého kurzu RT bylo také zpracováno již několik systematických review a metaanalýz [12,13]. Výsledkem je, že při aplikaci krátké RT se snížila četnost LR ve srovnání s okamžitým chirurgickým výkonem, přestože u nich byla aplikována adjuvantní léčba. Bylo zjištěno hraniční zlepšení celkového přežití při aplikaci RT ve srovnání se samotným chirurgickým zákrokem. Při srovnávání krátkého režimu s CHTRT nebyly nalezeny žádné statisticky významné rozdíly v parametrech celkového přežití (OS), přežití bez progrese (DFS), četnostech LR, svěrač záchovných operací, R0 resekcí ani v pozdní toxicitě.
Swedish Rectal Cancer Trial je první velká randomizovaná studie srovnávající krátký režim (5 × 5 Gy) s následnou časnou operací oproti samotné operaci celkem na 1 168 pacientech [14]. Rameno s RT mělo signifikantně lepší lokální kontrolu (89 vs. 73 %; p < 0,001), pětiletý OS byl 58 vs. 48 %; p = 0,004. Nutno poznamenat, že během prvních šesti měsíců po operaci byla v intervenčním ramenu zaznamenána zvýšená četnost komplikací, a to zejména gastrointestinálních. Nábor do studie probíhal v letech 1987–1990, tedy před zavedením metody totální mezorektální excize (TME). Vzhledem ke skutečnosti, že tehdejší operační řešení neodpovídalo dnešním standardům, je třeba se na závěry dívat s rezervou. Nizozemská TME studie porovnávala předoperační krátký kurz RT s následnou TME oproti samotné TME celkem na 1 861 pacientech [15]. Rameno s RT mělo nižší četnost LR v pěti letech než rameno se samotnou operací (5,6 vs. 10,9 %), nebyl však zjištěn žádný rozdíl v OS. Na základě výsledků dlouhodobějšího sledování bylo dokonce v subanalýze zjištěno lepší přežití pacientů s klinickým stadiem III. Desetileté OS bylo ve skupině s RT 50 vs. 40 % bez RT (p = 0,032) [16]. Nicméně, u pacientů s RT byla po abdominoperineální resekci (APR) zaznamenána vyšší četnost komplikací s hojením rány (29 vs. 18 %), byl zaznamenán vyšší výskyt pozdní toxicity, jako je inkontinence stolice, střevní diskomfort a sexuální dysfunkce, nebyl ale zaznamenán jednoznačný negativní dopad RT na kvalitu života (Health-Related Quality of Life – HRQOL). Ve studii MRC CR07 a NCIC-CTG CO16 byla srovnávána krátká předoperační RT s pooperační CHTRT, jenž byla aplikována selektivně u pacientů s rizikovým faktorem v histopatologickém nálezu, celkem bylo zařazeno 1 350 pacientů [17]. Neoadjuvantní RT byla úspěšnější ve srovnání s adjuvantní léčbou, co se týče snížení rizika LR (HR 0,39; 0,27–0,58; p < 0,0001), rozdíl v četnosti LR po 3 letech stále činil 6,2 %. V neoadjuvantním ramenu byl též lepší 3letý DFS (HR 0,76; p = 0,013), OS bez rozdílu. Nevýhodou neoadjuvantní RT byl vyšší výskyt inkontinence stolice a sexuálních dysfunkcí u mužů. I když byla do všech třech výše uvedených studií zařazována též I. klinická stadia onemocnění, která jsou stran prognózy méně riziková a dle současných standardů mají být řešena pouze samotnou operací, byl sledován pozitivní vliv na lokální kontrolu.
Dvě randomizované studie fáze III porovnávaly krátký kurz RT (5 × 5 Gy) s konvenční CHTRT (50,4 Gy ve 28 frakcích). První z nich byla polská studie z roku 2006 s celkem 312 pacienty s nízce uloženými tumory v dosahu digitálního vyšetření, stadia cT3–4, bez infiltrace análního svěrače [18]. Primárním cílem studie bylo zjistit, zda je CHTRT výhodnější s ohledem na zachování funkce svěrače oproti krátké RT. Přes vyšší procento patologických kompletních odpovědí (pCR) v ramenu s CHTRT (16 vs. 1 %) nebyly zjištěny rozdíly, co se týče stanoveného primárního cíle, ani parametrů LR, ani DFS. Míra pooperačních komplikací a pozdní toxicita byly též bez rozdílů. Studie měly z dnešního pohledu některé nedostatky. K určení stadia postačoval pouze transrektální ultrazvuk a CT, což se při dnešním standardu nepodkročitelnosti MR stagingu jeví jako insuficientní. Použité bolusové podání fluoropyrimidinové CHT se z dnešního pohledu také zdá jako suboptimální. Navíc adjuvantní CHT byla v těchto studiích podávána volitelně, nebyla pro ni jasně stanovena pravidla. Australská a novozélandská studie TROG 01.04 [19] (326 pacientů) měla jako primární cíl nalezení rozdílu v lokální kontrole. Byť byla opět nalezena větší míra pCR v ramenu s CHTRT oproti krátké RT (15 vs. 1 %), rozdíl v míře LR po 3 letech nebyl signifikantní (4,4 vs. 7,5 %; p = 0,24), stejná byla míra vzdálených recidiv, DFS, OS, toxicita i parametry HRQOL. Za zmínku však stojí výsledek subanalýzy vztahující se na podskupinu pacientů s distálními nádory (< 5 cm od análního okraje), kde byl zaznamenán trend nižšího výskytu LR v ramenu s CHTRT, nevýhodou však byla signifikantně vyšší akutní toxicita [20]. Za povšimnutí stojí také menší litevská studie (83 pacientů) z roku 2012, kde se též porovnávala CHTRT a krátká RT. Závěry byly podobné jako v předchozích dvou studiích. Zaznamenána byla vyšší četnost pCR po CHTRT, ale žádné rozdíly v míře R0 resekcí [21]. Polská randomizovaná studie fáze III z roku 2016 zkoumala vliv přidání oxaliplatiny do kombinace s RT u celkem 515 pacientů s pokročilými nádory rekta (cT4 nebo fixovaný cT3) [22]. Porovnávána byla krátká RT (5 × 5 Gy) následovaná chemoterapii FOLFOX4 oproti CHTRT, kdy v konkomitanci byla kromě 5FU podávána též týdenní oxaliplatina. V obou ramenech byly rovnocenné četnosti R0 resekcí, nebyl rozdíl v pCR a DFS. Rameno s krátkou RT mělo signifikantně lepší tříleté OS (73 vs. 65 %; p = 0,046) a nižší míru akutní toxicity, pooperační komplikace a pozdní toxicita byly stejné. Studie byla kritizována za použití nesouměrných režimů CHT, což komplikuje interpretaci jejích výsledků.
Oba způsoby ozáření se tedy jeví podobně efektivní u nádorů konečníku stadia cT3. Zdá se ale, že každý ze zmíněných postupů má své relativní výhody. Na základě výše uvedených studií však nelze posoudit výhody jednoho či druhého přístupu u časných ani pokročilejších nádorů cT3. Důvodem jsou insuficientní informace. Především chybí údaje, které nám dnes poskytuje MR, v naprosté většině nebyly známy informace o cirkumferenčních resekčních okrajích.
Celkově je tedy možno říct, že z pohledu parametrů přežití (OS, DFS) jsou obě metody ozáření prakticky rovnocenné. Přestože dosud nejsou k dispozici žádné přesvědčivé důkazy o výhodách CHTRT oproti krátké RT, praxe je taková, že CHTRT bývá v některých případech preferována. Důvodem jsou obavy stran dosažení R0 resekce a zvýšeného rizika lokální recidivy se všemi negativními dopady na morbiditu a kvalitu života. CHTRT se dává přednost u pacientů s lokálně výrazně pokročilým onemocněním cT3, u cT4 nebo tam, kde je infiltrována mezorektální fascie (MRF+) a je ohrožena negativita cirkumferenčního resekčního okraje. V klinické praxi také existují výrazné regionální i mezinárodní odlišnosti v používání obou způsobů RT. V mezinárodních doporučeních lze sledovat mírně odlišné postoje. Americká doporučení NCCN uvádějí obě možnosti, ale preferují spíše použití CHTRT. Doporučení ESMO rovněž uvádí oba způsoby ozáření, jejich konkrétní použití vztahující se k rozsahu, lokalizaci a některým morfologickým rizikovým faktorům. Konsenzuálních doporučení EORTC ze St. Gallen uvádí CHTRT jako léčbu volby ve většině situací u stadia II a III, s výjimkou časného nádoru T3N0 bez postižení mezorektální fascie.
Při volbě způsobu RT je třeba brát v úvahu i atributy ze strany pacienta jako věk a komorbidity a s tím související sníženou funkční rezervu organismu, která je spojena s vyšší toxicitou RT i CHT. Léčebné postupy u těchto pacientů pak musí s těmito specifiky počítat. Krátký kurz RT je pak v praxi preferovanou metodou u pacientů v horším celkovém stavu, tam, kde z medicínských důvodů je podání CHTRT rizikové, nebo v případě kontraindikace k podání CHT. Určení vhodné léčebné strategie a volba RT režimu pro každého pacienta by ideálně měla být konsenzuálním rozhodnutím multidisciplinárního týmu.
Chemoradioterapie
Dlouhý kurz RT je dnes standardně kombinován s aplikací CHT. Na základě metaanalýzy, v níž bylo zahrnuto šest významných randomizovaných klinických studií, bylo zjištěno, že u pokročilých nádorů rekta s pozitivními lymfatickými uzlinami (III. klinické stadium) je CHTRT efektivnější zejména stran lokální kontroly a DFS než samotná RT [23]. Avšak nebyly pozorovány žádné rozdíly v četnostech svěrač záchovného postupu ani rozdíl v OS. Další metaanalýza, kde byly hodnoceny nádory rekta stadia II a III, dospěla k podobným závěrům. CHTRT je tedy přisuzována nižší míra LR, větší četnost pCR, nebyly ale nalezeny rozdíly ve svěrač šetřících operacích ani v OS [24]. K dispozici jsou výsledky několika recentních randomizovaných studií, kde bylo porovnáváno podání neoadjuvantní léčby oproti adjuvantní nebo proti samotné operaci bez adjuvance.
Velká německá studie CAO/ARO/AIO-94 srovnávala CHTRT předoperační oproti pooperační. Jednalo se o velkou studii, do které bylo zařazeno 823 pacientů s tumory T3–T4 nebo s pozitivními lymfatickými uzlinami [2]. U předoperační léčby byla zaznamenána výrazně nižší četnost LR ve srovnání s pooperační léčbou: po 5 letech 5 vs. 9,7 % a po 10 letech 7,1 vs. 10,1 % (hazard ratio (HR) 0,6 %; p = 0,048), dle intention-to-treat (ITT) analýzy. Přínos předoperační léčby oproti pooperační léčbě byl ještě výraznější, pokud byly hodnoceny výsledky na základě skutečně absolvované léčby (6,8 vs. 10,5 %; HR 0,54; p = 0,02), tedy dle per-protocol (PP) analýzy. Co se týká DFS a OS, ani při desetiletém sledování nebyly zaznamenány žádné statisticky významné rozdíly. Stejně tak mezi oběma skupinami nebyl rozdíl mezi výskytem vzdálených metastáz. Četnost pooperačních komplikací byla mezi skupinami podobná (36 vs. 34 %; p = 0,68), nebyly zjištěny žádné rozdíly v hojení ran, pooperačním krvácení, anastomotickém leaku či výskytu ileózního stavu. Nebyl nalezen rozdíl v perioperační mortalitě. Ve skupině s předoperační CHTRT byla ale zjištěna celkově výrazně nižší toxicita. Celkově 27 vs. 40 % (p = 0,001) u akutní toxicity stupně 3–4 a 14 vs. 24 % (p = 0,01) u chronické toxicity. Ve studii National Surgical Adjuvant Breast and Bowel Project R-03 (NSABP R-03) byla rovněž porovnávána předoperační CHTRT vůči pooperační. Nábor do studie byl výrazně nižší, než se očekávalo, zařazeno bylo pouze 267 z plánovaných 900 pacientů se stadiem II a III [25]. Přestože udávané incidence pětileté LR byly v obou ramenech podobné (23,9 vs. 27,5 %), pětiletý DFS byl lepší ve skupině s předoperační CHTRT (64,7 vs. 53,4 %; p = 0,011). Byla též zaznamenána tendence k lepšímu pětiletému OS u předoperační léčby (74,5 vs. 65,6 %; p = 0,655). Nebyl nalezen rozdíl v pooperačních komplikacích ani toxicitě. Studie z jednoho velkého korejského pracoviště s resekabilními tumory stadia II a III randomizovala 240 pacientů do ramene s předoperační nebo pooperační CHTRT [26]. Tříleté a pětileté DFS mezi oběma rameny bylo podobné, OS a kumulativní incidence LR byly též bez rozdílů. Za zmínku stojí, že u pacientů s nízce uloženými nádory (< 5 cm od análního okraje) byla v rameni s neoadjuvantní léčbou signifikantně vyšší četnost svěrač záchovných operací (68 vs. 42 %; p = 0,008). Míra komplikací, akutních i pozdních vedlejších efektů byly v obou ramenech podobné. Relativně nedávná, rovněž monocentrická studie čínských autorů (184 pacientů) s operabilními tumory dolního a středního rekta randomizovala mezi samostatnou operací ve smyslu TME nebo neoadjuvantní CHTRT, při které byl použit chemoterapeutický režim XELOX [27]. V obou případech pak ještě následovala adjuvantní CHT. Mezi rameny nebyl zjištěn rozdíl v žádném z parametrů přežití (DFS, OS) ani rozdíl v LR. Překvapující bylo, že nebyl zaznamenán žádný rozdíl ve svěrač šetřících operacích. V tomto ohledu se tedy nepotvrdil očekávaný přínos CHTRT, který měl být navíc potencován režimem XELOX.
Radioterapie aplikovaná konkomitantně s CHT fluoropyrimidinovým derivátem může tedy vést k lepší lokální kontrole, nebylo však prokázáno, že by se tato výhoda promítla do zlepšení parametru přežití. Další zvýšení efektu neoadjuvantní léčby se očekávalo od přidání oxaliplatiny. Studie ACCORD 12/0405-Prodige 2, STAR-0 ani novější studie R-04 neprokázaly žádný benefit přidání oxaliplatiny do konkomitance s RT. Je pravda, že ve studii CAO/ARO/AIO-04 bylo v rameni s oxaliplatinou více pCR (17 vs. 13 %; p = 0,038) a lepší tříleté DFS (75,9 vs. 71,2 %; p = 0,03), současně byla sledována výraznější akutní toxicita [28]. Studie NSABP R-04 měla přinést odpověď na otázku, zda by mohl kapecitabin nahradit kontinuální infuzi s 5-fluorouracilem v neoadjuvantním režimu u II. a III. stadia karcinomu konečníku a zda by přidání oxaliplatiny mohlo dál navýšit léčebný efekt [29]. Výsledky této studie a mnoha dalších demonstrovaly, že použití kapecitabinu v konkomitanci s RT je srovnatelné s kontinuální infuzí 5-fluorouracilu [30]. Přidání oxaliplatiny do kombinace ale nevedlo k dalšímu zlepšení výsledků, podstatně však navýšilo toxicitu léčby. Tyto závěry byly následně potvrzeny ještě dalšími randomizovanými studiemi. S ohledem na výsledky všech studií, kdy nebyl prokázán jasný dlouhodobý onkologický benefit, oxaliplatinu nelze doporučovat do režimu s CHTRT.
Na výsledky výše uvedených studií je nutné opět nahlížet kriticky. Mimo největší multicentrické německé studie síla statistických testů nebyla na úrovních, které se očekávaly. Nábory do studií byly vesměs výrazně pod očekáváním. Další významná kritika uváděných studií je možnost systematických chyb. Jde o rizika bias při hodnocení výsledků, jelikož nikde nebylo prováděno zaslepení vůči typu intervence. Také nebyla jasně a jednoznačně specifikována v protokolech studií pravidla pro vyhodnocování výsledků.
Z výsledků studií je možno vyvodit, že absolutní rozdíly mezi neoadjuvantní a adjuvantní CHTRT, co se týče lokálních recidiv, jsou poměrně malé (3 % při desetiletém sledování ve studii CAO/ARO/AIO-94). Avšak s ohledem na významnou morbiditu spojenou se vznikem lokální recidivy je jakékoli zlepšení významné, zvlášť pokud je přijatelný profil toxicity. Dostupné důkazy naznačují, že toxicita je u neoadjuvantní CHTRT nižší než v případě stejné léčby aplikované adjuvantně (tab. 1).
Tab. 1. Výsledky klíčových klinických studií provedených u pacientů s karcinomem rekta stadií II a III léčených předoperační (chemo)radioterapií. 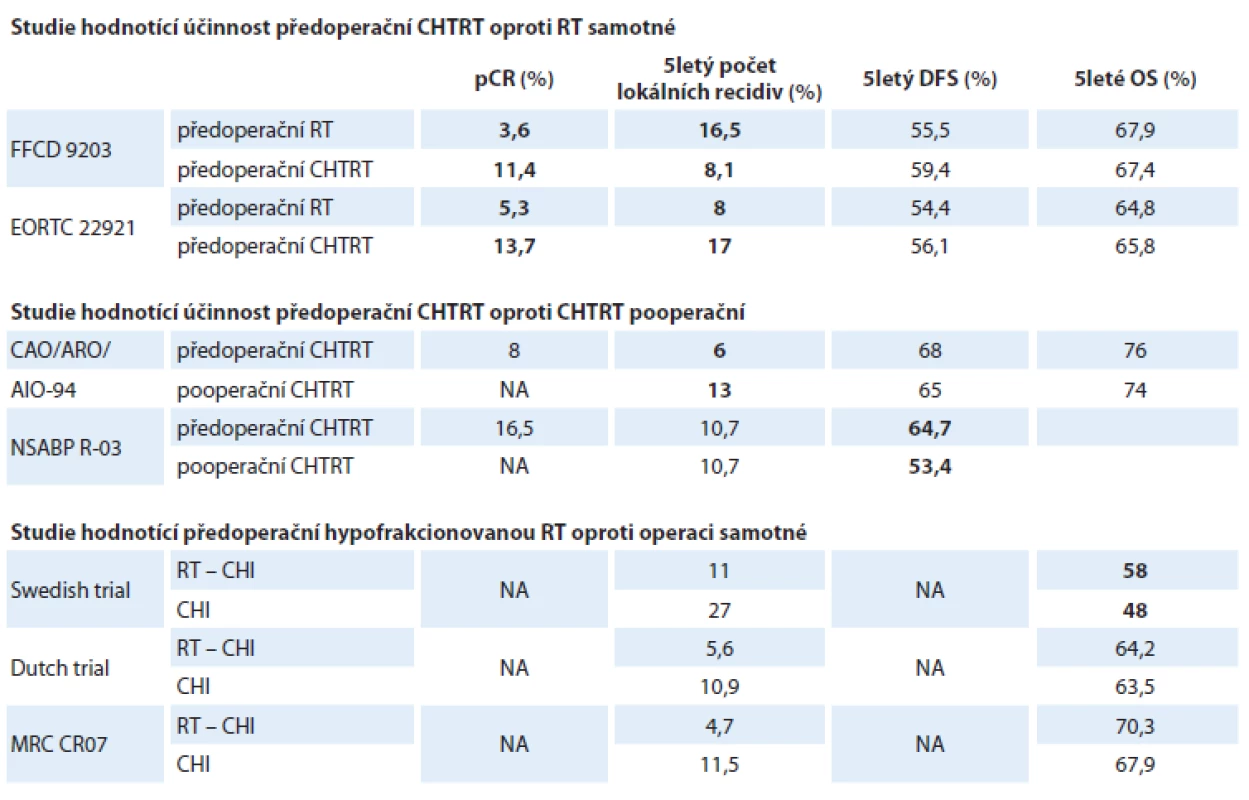
CHTRT – chemoradioterapie, CHI – chirurgický výkon, DSF – přežití bez nemoci, OS – celkové přežití, NA – nedefinováno/nepublikováno, pCR – patologická kompletní odpověď, RT – radioterapie
Tučně jsou zvýrazněny statisticky významné rozdíly.Postupy s vynecháním radikální operace
Je známo, že u části pacientů s lokálně pokročilým tumorem rekta dochází po neoadjuvantní léčbě k velmi výraznému zmenšení nádoru. Dle literárních údajů může být po CHTRT u 15–27 % pacientů dosaženo kompletní patologické odpovědi (pCR) [31]. Nabízí se tedy otázka, jak u těchto pacientů postupovat. Zda by měla následovat radikální operace nebo zda může být proveden pouze lokání zákrok na rektu nebo zda takové pacienty pouze sledovat. Je dobře známo, že prognóza pacientů, kteří dosáhli pCR, je signifikantně lepší ve srovnání s těmi, u kterých bylo dosaženo pouze částečné odpovědi (pětileté DFS u pacientů s nálezem pCR 83,3 vs. 65,5 % u pacientů bez pCR; p < 0,0001) [32]. Chirurgický výkon na rektu, zvláště ve spojení s RT, má nezanedbatelná rizika. Zvýšená morbidita je dána kumulací toxicity operační léčby a RT. Funkční výsledky nemusí být vždy optimální. K nejčastějším patří dysfunkce svěrače, urogenitální dysfunkce, nutnost trvalé kolostomie. To vše pak vede ke snižování celkové kvality života. Z těchto důvodů, jako alternativní postup, bylo navrženo sledování a operace až v případě recidivy. Dle dostupných výsledků se zdá, že tyto postupy nevedou k horším onkologickým výsledkům a přežití. Zatím však chybí důkazy z randomizovaných studií, proto je tento přístup nutno považovat stále za experimentální. V klinické praxi by měl být prováděn jen v rámci striktně definovaných protokolů.
Tento postup „watch and wait“ nelze zaměňovat s neoperativním léčebným postupem u pacientů, kde chirurgický zákrok nebyl indikován z medicínských důvodů nebo pro odmítnutí operace. Důležitá se jeví otázka, do jaké míry komplexní klinická odpověď (cCR) koreluje s patologickou komplexní odpovědí (pCR). Hodnocení odpovědi na léčbu se standardně opírá o nálezy při rektoskopii a o zobrazovací metody. Endoskopický ani MR nález cCR nemusí ještě odpovídat pCR. Dle MR bývá poměrně obtížné rozlišení mezi fibrózou a reziduálním nádorem. Posouzení kompletní uzlinové regrese, s ohledem na možnost přetrvávajících mikrometastáz, je ještě méně spolehlivé [34]. Proto je v případě „watch and wait“ postupu zcela zásadní pečlivé sledování v rámci jasně definovaného protokolu se snahou o včasné zachycení případné recidivy. K dispozici jsou údaje z více než deseti srovnávacích retrospektivních i prospektivních observačních studií a jedné metaanalýzy [34]. Pacienti, u kterých bylo dosaženo po neoadjuvanci cCR, byli zařazeni do orgán záchovného léčebného postupu s vynecháním operace. Nutností bylo pečlivé sledování (watchful waiting).
Dánská prospektivní studie u pacientů s resekabilním karcinomem rekta T2–T3, N0–N1, kteří podstoupili vysokodávkovou CHTRT doplněnou ještě o brachyterapeutický boost, uvádí lokální recidivy u 9 ze 40 pacientů při mediánu sledování 2 roky (riziko LR 26 %) [35]. Parametry přežití nebyly v této studii reportovány. Britská observační studie (OnCoRe) porovnávala kohortu pacientů, kteří po běžné CHTRT dosáhli cCR a následně byli sledováni, oproti pacientům, kteří nedosáhli cCR a podstoupili resekci. Tříletý výskyt LR byl 38 % v rameni se sledováním. Nicméně v parametrech přežití DFS a OS nebyly nalezeny rozdíly [36]. Menší tchajwanská retrospektivní studie (44 pacientů) zaznamenala v kohortě se sledováním v případě cCR po neoadjuvanci pouze dvě LR za dobu čtyřletého sledování, 5letý OS medián DFS 100 % a 69,78 měsíců [37]. V brazilské srovnávací studii byly porovnávány výsledky neoperativního postupu u pacientů, kteří dosáhli cCR po CHTRT, oproti těm, jimž byla ve stejné době po stejné léčbě zjištěna pCR. Během 4letého sledování nastala ve skupině bez operace recidiva ve 28 %, v operované skupině u 11,5 %, DFS bylo též ve prospěch chirurgické léčby (60,9 vs. 82,8 %; p = 0,011), v OS rozdíl nebyl. Největší soubor pacientů léčených neoperativním postupem publikovala Habr-Gama et al. Do studie byli zařazeni pacienti s tumory cT1–4, cN0–1, u kterých došlo ke kompletní klinické odpovědi (cCR), která trvala nejméně 12 měsíců (27 % pacientů). K relapsu došlo celkově u 13 % pacientů, avšak pouze 5 % mělo LR. Všechny LR byly řešitelné záchrannou (salvage) operací [38].
Přestože žádná ze studií neprokázala nijak výrazný rozdíl ve výskytu LR oproti standardnímu postupu, provedená metaanalýza, jež zahrnovala mimo jiné i výše uvedené studie, signifikantní rozdíly nalezla. Ve skupině „watch and wait“ bylo nalezeno významně vyšší riziko LR ve všech hodnocených letech (1., 2., 3. i 5. rok) ve srovnání se skupinou, kde byla provedena standardní operace. Pětileté relativní riziko bylo 5,69 (p = 0,001). Nebyly nalezeny významné rozdíly v DFS ani OS. Aktuálně v Memorial Sloan-Kettering Cancer Center probíhá prospektivní studie fáze II, která má za cíl zhodnocení bezpečnosti a účinnosti neoperativního postupu spočívajícího v kombinaci CHTRT a CHT na bázi oxaliplatiny (FOLFOX nebo CAPEOX) a v případě dosažení cCR dále jen ve sledování.
Přestože se TME stala chirurgickým standardem, je tato operace zatížena poměrně významnou morbiditou (inkontinence stolice, močové a sexuální dysfunkce, kolostomie) a rizikem komplikací, které v určitých případech mohou výrazně narušovat kvalitu života. Několik menších nerandomizovaných studií a retrospektivních prací ukazuje, že pečlivě selektovaná skupina pacientů může profitovat i z méně agresivních chirurgických zákroků (TEM), aniž by to mělo mít negativní dopad na celkový onkologický výsledek. V menší italské prospektivní randomizované studii na 100 pacientech s tumory dolního rekta cT2N0 (do 6 cm od análního okraje), jež podstoupili po neoadjuvantní CHTRT buď endoluminální chirurgický zákrok, nebo TME, nebyly nalezeny rozdíly v LR, výskytu vzdálených metastáz ani DFS [39]. K podobným výsledkům dospěla i nedávná nerandomizovaná studie fáze II na 79 pacientech, též s distálně uloženými tumory cT2N0 léčenými neoadjuvantní CHRT a následnou lokální excizí (tříleté DFS 88,2 %).
Výše uvedené postupy s vynecháním radikální operace zatím není možno považovat za standardní a je třeba vyčkat na výsledky randomizovaných studií. Informace o veškerých orgán šetřících léčebných přístupech jsou shromažďovány v mezinárodní databázi The International Watch & Wait Database (IWWD) for Rectal Cancer. Systematicky jsou tak evidovány onkologické výsledy i vedlejší léčebné efekty těchto metod.
Načasování operačního řešení po neoadjuvantním ozáření
Chirurgický zákrok po neoadjuvantní RT bývá tradičně plánován přibližně 6–8 týdnů po dokončení ozáření. Tento interval má poskytnout dostatek času na regresi nádorové masy (downstaging), zotavení a ústup poradiační reakce zdravých tkání. Na druhou stranu, příliš dlouhý interval by mohl vést k opětovnému růstu tumoru, vzdálenému metastatickému rozsevu nebo rozvoji poradiační fibrózy, která by mohla výrazně komplikovat operační řešení.
Metaanalýza z roku 2016, která zahrnovala 13 studií (prospektivních nerandomizovaných nebo retrospektivních), zkoumala interval mezi CHTRT a chirurgickým zákrokem z pohledu rozdělení na kratší nebo delší čas než tradiční interval 6–8 týdnů. Závěrem bylo, že čekání delší než 8 týdnů bylo spojeno s výraznější regresí tumoru (RR 1,42; p < 0,0001). Nebyly ale nalezeny rozdíly v OS, četnosti resekce R0, svěrače záchovných výkonů ani v počtu komplikací. Limitací metaanalýzy je, že je založena z velké části pouze na retrospektivních datech [40]. Ve studii Lyon R90-01 bylo randomizováno 210 pacientů do ramen s operací 2 týdny nebo 6–8 týdnů od ukončení RT. Ve skupině s delší intervalem byla zaznamenána vyšší míra pCR, ale nebyl pozorován žádný rozdíl v OS. Limitací studie je, že nebyl použit žádný z dnešního pohledu běžných režimů, ale mírná akcelerace [41]. Ve studii GRECCAR-6 bylo 265 pacientů randomizováno k operaci 7 nebo 11 týdnů po skončení CHTRT. Nebyl pozorován žádný rozdíl v četnosti pCR ani svěrač záchovných operacích. Rameno s delším intervalem mělo ale trend k vyšší míře pooperačních komplikací, včetně komplikací hojení rány [42]. Studie UK NCT 01037049 randomizovala 237 pacientů s výrazně pokročilými až hraničně resekabilními nádory k operaci buď 6 týdnů, nebo 12 týdnů po CHTRT. V 12týdenním rameni byl častěji zaznamenán downstagingu (58 vs. 43 %; p = 0,019) a vyšší míra pCR (20 vs. 9 %; p < 0,05). Nebyl pozorován žádný významný rozdíl v chirurgických komplikacích [43]. Americká retrospektivní studie využívající Národní onkologickou databázi zahrnovala 6 397 pacientů, kteří podstoupili neoadjuvantní terapii s následnou radikální operací. Celkem 6,9 % pacientů dosáhlo pCR, z nich 76,2 % bylo operováno do 60 dní. Chirurgický zákrok > 60 dní od skončení RT byl spojen s vyšší mírou pozitivních resekčních okrajů (6,7 vs. 4,8 %; p = 0,009), s nižší četností svěrač záchovných výkonů a s horším celkovým přežitím (HR 1,3; p < 0,001) [44]. Polská studie srovnávala okamžitou operaci s odloženou operací (7–10 dní vs. 4–5 týdnů) po krátkém kurzu RT. Nález většího downstagingu při odložené operaci neměl vliv na četnost R0 resekcí, četnost LR či dobu OS. Studie Stockholm III dělí pacienty do tří ramen: krátkodobá RT s okamžitým chirurgickým zákrokem, krátkodobá RT s operací za 4–8 týdnů nebo CHTRT se zákrokem po 4–8 týdnech. Celkem očekávaně, dle předběžné analýzy, vedl delší interval (4–8 týdnů) k vyšší míře downstagingu a k vyšší četnosti pCR. Zatím není známo, zda se tyto výhody promítnou do zlepšeného přežití. Podstatné bylo zjištění, že delší interval do operace byl spojen s nižší mírou chirurgických komplikací. Naopak největší míru komplikací měli pacienti operovaní mezi 11. a 17. dnem od zahájení RT [45].
Obecně je mezi CHTRT a operací dávána přednost intervalu nejméně 6 týdnů od skončení RT, a to na základě studie Lyon R90-01 z roku 1999. Interval 6–8 týdnů vede k signifikantně výraznějšímu downstagingu ve srovnání s kratším obdobím. Šestitýdenní interval od ukončení RT do operace byl zvolen také v protokolu studie CAO/ARO/AIO-94.
Diskuze
Operace je v současnosti stále jediným spolehlivě kurativním postupem u nádorů konečníku všech stadií. Aktuálním standardem u lokálně pokročilejších nádorů je resekce s kompletním odstraněním mezorekta (TME). Hlavním cílem RT a CHT je snížení rizika lokálních i vzdálených recidiv. Navzdory znatelným pokrokům v léčbě lokálně pokročilého karcinomu konečníku však zůstává nevyjasněno několik otázek. Hlavním předmětem diskuzí jsou v současnosti optimální režim RT (krátký kurz vs. CHTRT), posloupnost léčebných modalit a chirurgický přístup k pacientům s klinickou kompletní odpovědí po neoadjuvantní terapii. Kvalita života se dnes stává významným faktorem při hodnocení léčebného úspěchu. Jak ukazují výsledky některých prací, ne všichni pacienti s karcinomem rekta stadia II a III musí profitovat z aplikace RT. U tumorů orálního rekta a u některých tumorů středního rekta je přínos ozáření zřejmě minimální nebo vůbec žádný. Naproti tomu nežádoucí účinky RT, zvláště pozdní jako dysfunkce svěrače či urogenitální dysfunkce, není možno opomíjet. Možná rizika tedy nejsou vždy vyvážena benefitem RT. Optimálním řešením je tedy v těchto případech samotný radikální chirurgický výkon. Z dnešního pohledu lze neoadjuvantní léčbu vynechat v případech, kdy se u tumorů horního, resp. středního rekta očekává kompletní TME a volný cirkumferenční resekční okraj (CRM). Podmínkou je intaktní mezorektální fascie (MRF–). Pro indikaci neoadjuvantní léčby a výběr vhodného způsobu ozáření je zásadní MR vyšetření, které má u pokročilého tumoru rekta největší senzitivitu a specificitu, co se týče stanovení T a N stadia. Současně dokáže přesně ukázat vztah ke strukturám pánve, MRF, svěračům a levatorům. Na druhou stranu, problémy při indikci RT mohou plynout z nepřesného klinického stagingu. U více než 20 % pacientů s klinickým předoperačním stadiem cT3N0 podle transrektální ultrasonografie nebo MR byly nakonec, i přes provedenou neoadjuvantní léčbu, nalezeny pozitivní lymfatické uzliny. Riziko možného podhodnocení stadia může být jeden z důvodů, proč některá guidelines (např. NCCN) nadále preferují neoadjuvantní léčbu u prakticky všech lokálně pokročilých tumoru rekta, bez ohledu na konkrétní stadium a lokalizaci. O vynechání pooperační RT u lokálně pokročilých tumorů s postižením uzlin nebo bez postižení uzlin je možné uvažovat v případě dobré kvality TME a jasně negativních resekčních okrajích (CRM > 2 mm) a při nepřítomnosti některého z rizikových faktorů (např. extenzivní vaskulární invaze, perineurální invaze).
Neoadjuvantní ozáření má především za cíl redukovat riziko lokální recidivy, zlepšit operabilitu, a snížit tak rizika neradikální resekce. U nízko uložených tumorů může neoadjuvance zvýšit šanci na zachování análního svěrače. Nebyl ale prokázán přínos RT na prodloužení celkového přežití. Výhodou CHTRT je větší možnost redukce objemu tumoru (downstaging) se zvýšením šance na R0 resekci u vstupně velmi pokročilých tumorů. Teoreticky je vyšší šance na svěrač záchovný operační postup. Akcelerovaný režim tedy není vhodný u tumorů s velmi pokročilými tumory (cT4b, cT3 MRF+), v případě infiltrace levátorů, zevního análního svěrače a při extenzivním uzlinovém postižení. Akcelerovaný režim RT má ve srovnání s CHTRT výhodu v kratší celkové době léčby při stejné či nižší akutní toxicitě a při srovnatelné pozdní toxicitě. Efekt na redukci rizika LR se signifikantně neliší. Nejasný je přínos CHTRT ve vztahu k rozvoji vzdálených metastáz. I když se s rozvojem chirurgických technik a implementací CHTRT výrazně snížila četnost lokálních recidiv, vzdálené metastatické onemocnění zůstává nejčastější příčinou úmrtí pacientů s lokálně pokročilým karcinomem konečníku. Ke zlepšení celkového přežití byl vyvinut koncept totální neoadjuvantní terapie, ve kterém jsou CHTRT a CHT podávány před operací. Dostupné výsledky jsou zatím slibné a toxicita je přijatelná. Aktuálně právě probíhají klinické studie fáze II a III, které mají zhodnotit dlouhodobé výsledky a vliv na přežití. Při indikaci neoadjuvantní léčby a volbě režimu musíme brát v úvahu i další parametry ze strany pacienta, jako věk, komorbidity a s tím související klesající funkční rezervu organismu, která je často spojena s vyšší mírou komplikací, pooperační mortalitou a s vyšší toxicitou RT i CHT. Léčebné postupy u těchto pacientů pak musí s těmito specifiky počítat.
Optimální načasování operace po neoadjuvanci je také velmi důležitým tématem, na jedné straně stojí požadavek na dostatečnou regresi nádoru a ústup akutních radiační reakce, na straně druhé nebezpečí rozvoje pozdnějších radiačních změn na tkáni, které jsou příčinou chirurgických komplikací. Jako ideální se dnes jeví interval kolem 8 týdnů od skončení RT, doba by však neměla výrazně překročit 60 dní po RT.
Závěr a interpretace výsledků studií s neoperativním postupem není jednoduchý, jelikož stěžejní charakteristiky jednotlivých studií se od sebe poměrně významně liší. V některých studiích byli v obou kohortách zařazeni pouze pacienti s cCR, v jiných byli do srovnávací kohorty s resekcí zařazeni pouze pacienti s inkompletní klinickou remisí, jinde jako srovnávací kohorta sloužili pacienti s pCR. Značná variabilita mezi studiemi byla i mezi načasováním přešetření a vyšetřovacími metodami, kterými byla odpověď hodnocena. Použity byly endoskopie, MR, CT a PET nebo kombinace těchto metod. Tato značná různorodost znesnadňuje srovnání výsledků studií a komplikuje interpretaci výsledků. Lokální chirurgický zákrok ve spojení s ozářením může být alternativní metodou pro pacienty, kteří nemohou nebo nechtějí podstoupit radikální chirurgický výkon. Všechny postupy s vynecháním radikální operce u lokálně pokročilých nádorů rekta nelze zatím považovat za standardní a je třeba vyčkat na výsledky randomizovaných studií. Databáze nám ale mohou poskytnout řadu relevantních informací, které můžeme mít mnohem dříve než z klasických klinických studií s mnohaletým náborem a sledováním.
Další důležitou okolností pro zlepšování výsledků léčby u karcinomu rekta je nalezení ukazatelů pozitivní odpovědi na léčbu. Nejčastěji jde o snahu identifikovat prediktivní biomarkery pro neoadjuvantní (CHT) RT. Mezi tzv. respondéry a non-respondéry byly popsány odlišné genové profily. Například metodou kvantitativní PCR byl vytvořen model zahrnující sadu 16 různých genů predikujících lepší odpověď na CHTRT. Zatím se však model nepodařilo nezávisle ověřit, takže klinická validace je ještě vzdálená. Další aktuální oblastí zájmu u karcinomu rekta je studium tumorózního mikroprostředí a jeho interakce s imunitním systémem. Infiltrace tumoru buňkami imunitního systému má patrně prognostický význam a může také predikovat odpověď tumoru na terapii. Na základě předběžných údajů, jež ukazují, že neoadjuvantní CHTRT může vést ke zvýšení infiltrace T lymfocytů v nádoru konečníku, je aktuálně předmětem zájmů zkoumání vliv imunoterapie v kombinaci s CHTRT. Příkladem je právě probíhající studie fáze II s pembrolizumabem u pacientů s karcinomem rekta stadia II a III. Cílená léčba nebo moderní imunoterapie s checkpoint inhibitory by mohla v budoucnu pomoci zlepšit léčebné výsledky u pokročilých nádorů rekta.
Závěr
Přes zjevné pokroky v chirurgii, radioterapii i chemoterapie je pravděpodobné, že většina lokálně pokročilých nádorů konečníku bude nadále vyžadovat komplexní přístup. Předoperační ozáření je spojováno s menší četností nežádoucích efektů a lepší lokální kontrolou než léčba pooperační. Dlouhý ozařovací kurz, v praxi chemoradioterapie, nabízí výraznější redukci nádorové masy, zvyšuje tak šanci na radikální resekci u silně pokročilých tumorů, na druhé straně stojí o něco větší akutní nežádoucí účinky. Standardní operační výkon u všech pokročilých tumorů konečníku, bez ohledu na to, zda byla, či nebyla radioterapie provedena, je radikální resekce rekta s totální mezorektální excizí. Vynechání radikální operace při vymizení tumoru po neoadjuvanci nebo provedení pouze lokálního chirurgického zákroku ve spojení s ozářením u mírně pokročilých nálezů jsou možné alternativní postupy. Zatím nejsou považovány za standardní a je třeba vyčkat na výsledky randomizovaných studií.
Práce byla podpořena MZ ČR – RVO (MOÚ, 00209805).
This work was supported by the Ministry of Health of the Czech Republic – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Petr Pospíšil, Ph.D.
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: ppospisil@mou.cz
Obdrženo/Submitted: 29. 2. 2020
Přijato/Accepted: 15. 4. 2020
Zdroje
1. Colorectal Cancer Collaborative Group. Adjuvant radiotherapy for rectal cancer: a systematic overview of 8,507 patients from 22 randomised trials. Lancet 2001; 358 (9290): 1291–304. doi: 10.1016/S0140-6736 (01) 06409-1.
2. Sauer R, Becker H, Hohenberger W et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351 (17): 1731–1740. doi: 10.1056/NEJMoa040694.
3. Salerno G, Sinnatamby C, Branagan G et al. Defining the rectum: surgically, radiologically and anatomically. Colorectal Dis 2006; Suppl 3 : 5–9. doi: 10.1111/j.1463-1318.2006.01062.x.
4. Mulcahy MF. Radiotherapy for cancer of the rectum: which patients stand to benefit? Gastrointest Cancer Res 2009; 3 (2): 81–83.
5. Joshi N, Woody NM, Abdel-Wahab M. Pre-operative chemoradiation for rectosigmoid cancers: Where do we draw the line? [online]. Available from: https: //appliedradiationoncology.com/articles/pre-operative-chemoradiation-for-rectosigmoid-cancers-where-do-we-draw-the-line.
6. Shin R, Jeong SY, Yoo HY et al. Depth of mesorectal extension has prognostic significance in patients with T3 rectal cancer. Dis Colon Rectum 2012; 55 (12): 1220–1228. doi: 10.1097/DCR.0b013e31826fea6a.
7. Merkel S, Mansmann U, Siassi M et al. The prognostic inhomogeneity in pT3 rectal carcinomas. Int J Colorectal Dis 2001; 16 (5): 298–304. doi: 10.1007/s00384-001-0376-1.
8. Amin MB, Edge S, Greene F et al. AJCC Cancer Staging Manual. Springer International Publishing: American Joint Commission on Cancer 2017.
9. Beets-Tan RG, Beets GL, Vliegen RF et al. Accuracy of magnetic resonance imaging in prediction of tumour-free resection margin in rectal cancer surgery. Lancet 2001; 357 (9255): 497–504. doi: 10.1016/s0140-6736 (00) 04040-x.
10. Glimelius B, Tiret E, Cervantes A et al. Rectal cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; Suppl 6: vi81–vi88. doi: 10.1093/annonc/mdt240.
11. Goodman KA, Patton CE, Fisher GA et al. Appropriate customization of radiation therapy for stage II and III rectal cancer: Executive summary of an ASTRO Clinical Practice Statement using the RAND/UCLA Appropriateness Method. Pract Radiat Oncol 2016; 6 (3): 166–175. doi: 10.1016/j.prro.2015.11.014.
12. Zhou ZR, Liu SX, Zhang TS et al. Short-course preoperative radiotherapy with immediate surgery versus long-course chemoradiation with delayed surgery in the treatment of rectal cancer: a systematic review and meta-analysis. Surg Oncol 2014; 23 (4): 211–221. doi: 10.1016/j.suronc.2014.10.003.
13. Wang X, Zheng B, Lu X et al. Preoperative short-course radiotherapy and long-course radiochemotherapy for locally advanced rectal cancer: Meta-analysis with trial sequential analysis of long-term survival data. PLoS One 2018; 13 (7): e0200142. doi: 10.1371/journal.pone.0200142.
14. Cedermark B, Dahlberg M, Glimelius B et al. Improved survival with preoperative radiotherapy in resectable rectal cancer. N Engl J Med 1997; 336 (14): 980–987. doi: 10.1056/NEJM199704033361402.
15. Peeters KC, Marijnen CA, Nagtegaal ID et al. The TME trial after a median follow-up of 6 years: increased local control but no survival benefit in irradiated patients with resectable rectal carcinoma. Ann Surg 2007; 246 (5): 693–701. doi: 10.1097/01.sla.0000257358.56863.ce.
16. van Gijn W, Marijnen CA, Nagtegaal ID et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol 2011; 12 (6): 575–582. doi: 10.1016/S1470-2045 (11) 70097-3.
17. Peeters KC, van de Velde CJ, Leer JW et al. Late side effects of short-course preoperative radiotherapy combined with total mesorectal excision for rectal cancer: increased bowel dysfunction in irradiated patients – a Dutch colorectal cancer group study. J Clin Oncol 2005; 23 (25): 6199–6206. doi: 10.1200/JCO.2005.14.779.
18. Bujko K, Nowacki MP, Nasierowska-Guttmejer A et al. Long-term results of a randomized trial comparing preoperative short-course radiotherapy with preoperative conventionally fractionated chemoradiation for rectal cancer. Br J Surg 2006; 93 (10): 1215–1223. doi: 10.1002/bjs.5506.
19. Ngan SY, Burmeister B, Fisher RJ et al. Randomized trial of short-course radiotherapy versus long-course chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer: Trans-Tasman Radiation Oncology Group trial 01.04. J Clin Oncol 2012; 30 (31): 3827–3833. doi: 10.1200/JCO.2012.42.9597.
20. Ansari N, Solomon MJ, Fisher RJ et al. Acute adverse events and postoperative complications in a randomized trial of preoperative short-course radiotherapy versus long-course chemoradiotherapy for T3 adenocarcinoma of the rectum: Trans-Tasman Radiation Oncology Group trial (TROG 01.04). Ann Surg 2017; 265 (5): 882–888. doi: 10.1097/SLA.0000000000001987.
21. Latkauskas T, Pauzas H, Gineikiene I et al. Initial results of a randomized controlled trial comparing clinical and pathological downstaging of rectal cancer after preoperative short-course radiotherapy or long-term chemoradiotherapy, both with delayed surgery. Colorectal Dis 2012; 14 (3): 294–298. doi: 10.1111/j.1463-1318.2011.02815.x.
22. Bujko K, Wyrwicz L, Rutkowski A et al. Long-course oxaliplatin-based preoperative chemoradiation versus 5 × 5 Gy and consolidation chemotherapy for cT4 or fixed cT3 rectal cancer: results of a randomized phase III study. Ann Oncol 2016; 27 (5): 834–842. doi: 10.1093/annonc/mdw062.
23. McCarthy K, Pearson K, Fulton R et al. Pre-operative chemoradiation for non-metastatic locally advanced rectal cancer. Cochrane Database Syst Rev 2012; 12: CD008368. doi: 10.1002/14651858.CD008368.pub2.
24. De Caluwé L, Van Nieuwenhove Y, Ceelen WP. Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer. Cochrane Database Syst Rev 2013; (2): CD006041. doi: 10.1002/14651858.CD006041.pub3.
25. Roh MS, Colangelo LH, O‘Connell MJ et al. Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum: NSABP R-03. J Clin Oncol 2009; 27 (31): 5124–5130. doi: 10.1200/JCO.2009.22.0467.
26. Park JH, Yoon SM, Yu CS et al. Randomized phase 3 trial comparing preoperative and postoperative chemoradiotherapy with capecitabine for locally advanced rectal cancer. Cancer 2011; 117 (16): 3703–3712. doi: 10.1002/cncr.25943.
27. Fan WH, Wang FL, Lu ZH et al. Surgery with versus without preoperative concurrent chemoradiotherapy for mid/low rectal cancer: an interim analysis of a prospective, randomized trial. Chin J Cancer 2015; 34 (9): 394–403. doi: 10.1186/s40880-015-0024-8.
28. Rödel C, Liersch T, Becker H et al. Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer: initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial. Lancet Oncol 2012; 13 (7): 679–687. doi: 10.1016/S1470-2045 (12) 70187-0.
29. Yang YJ, Cao L, Li ZW et al. Fluorouracil-based neoadjuvant chemoradiotherapy with or without oxaliplatin for treatment of locally advanced rectal cancer: An updated systematic review and meta-analysis. Oncotarget 2016; 7 (29): 45513–45524. doi: 10.18632/oncotarget.9995.
30. Alliance for Clinical Trials in Oncology. Chemotherapy alone or chemotherapy plus radiation therapy in treating patients with locally advanced rectal cancer undergoing surgery. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT01515787.
31. Maas M, Nelemans PJ, Valentini V et al. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data. Lancet Oncol 2010; 11 (9): 835–844. doi: 10.1016/S1470-2045 (10) 70172-8.
32. Smith FM, Wiland H, Mace A et al. Clinical criteria underestimate complete pathological response in rectal cancer treated with neoadjuvant chemoradiotherapy. Dis Colon Rectum 2014; 57 (3): 311–315. doi: 10.1097/DCR.0b013e3182a84eba.
33. Li J, Li L, Yang L et al. Wait-and-see treatment strategies for rectal cancer patients with clinical complete response after neoadjuvant chemoradiotherapy: a systematic review and meta-analysis. Oncotarget 2016; 7 (28): 44857–44870. doi: 10.18632/oncotarget.8622.
34. Appelt AL, Pløen J, Harling H et al. High-dose chemoradiotherapy and watchful waiting for distal rectal cancer: a prospective observational study. Lancet Oncol 2015; 16 (8): 919–927. doi: 10.1016/S1470-2045 (15) 00120-5.
35. Renehan AG, Malcomson L, Emsley R et al. Watch-and-wait approach versus surgical resection after chemoradiotherapy for patients with rectal cancer (the OnCoRe project): a propensity-score matched cohort analysis. Lancet Oncol 2016; 17 (2): 174–183. doi: 10.1016/S1470-2045 (15) 00467-2.
36. Lai CL, Lai MJ, Wu CC et al. Rectal cancer with complete clinical response after neoadjuvant chemoradiotherapy, surgery, or „watch and wait“. Int J Colorectal Dis 2016; 31 (2): 413–419. doi: 10.1007/s00384-015-2460-y.
37. Habr-Gama A, Perez RO, Proscurshim I et al. Patterns of failure and survival for nonoperative treatment of stage c0 distal rectal cancer following neoadjuvant chemoradiation therapy. J Gastrointest Surg 2006; 10 (10): 1319–1329. doi: 10.1016/j.gassur.2006.09.005.
38. Lezoche E, Baldarelli M, Lezoche G et al. Randomized clinical trial of endoluminal locoregional resection versus laparoscopic total mesorectal excision for T2 rectal cancer after neoadjuvant therapy. Br J Surg 2012; 99 (9): 1211–1218. doi: 10.1002/bjs.8821.
39. Petrelli F, Sgroi G, Sarti E et al. Increasing the interval between neoadjuvant chemoradiotherapy and surgery in rectal cancer: a meta-analysis of published studies. Ann Surg 2016; 263 (3): 458–464. doi: 10.1097/SLA.0000000000000368.
40. Francois Y, Nemoz CJ, Baulieux J et al. Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: the Lyon R90-01 randomized trial. J Clin Oncol 1999; 17 (8): 2396. doi: 10.1200/JCO.1999.17.8.2396.
41. Lefevre JH, Mineur L, Kotti S et al. Effect of interval (7 or 11 weeks) between neoadjuvant radiochemotherapy and surgery on complete pathologic response in rectal cancer: A multicenter, randomized, controlled trial (GRECCAR-6). J Clin Oncol 2016; 34 (31): 3773–3780. doi: 10.1200/JCO.2016.67.6049.
42. Evans J, Bhoday J, Sizer B et al. Results of a prospective randomised control 6 vs 12 trial: Is greater tumour downstaging observed on post treatment MRI if surgery is delayed to 12-weeks versus 6-weeks after completion of neoadjuvant chemoradiotherapy? Ann Oncol 2016; 27 (suppl 6): VI149. doi: 10.1093/annonc/mdw370.01.
43. Huntington CR, Boselli D, Symanowski J et al. Optimal timing of surgical resection after radiation in locally advanced rectal adenocarcinoma: an analysis of the national cancer database. Ann Surg Oncol 2016; 23 (3): 877–887. doi: 10.1245/s10434-015-4927-z.
44. Pettersson D, Lörinc E, Holm T et al. Tumour regression in the randomized Stockholm III Trial of radiotherapy regimens for rectal cancer. Br J Surg 2015; 102 (8): 972–978. doi: 10.1002/bjs.9811.
45. Kocáková I, Špelda S, Kocák I et al. Předoperační chemoradioterapie s kapecitabinem v léčbě lokálně pokročilého adenokarcinomu rekta. Klin Onkol 2003; 16 (2): 60–67.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo Suppl 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Genová terapie v radiační onkologii
- Prostorová analýza recidiv glioblastomů v závislost na taktice adjuvantní radioterapie (stanovení cílových objemů dle RTOG vs. EORTC): představení akademické studie
- Výživa během radioterapie u onkologických pacientů
- Rádiobiologické aspekty reožarovania a ich modelovanie pri stanovení tolerančnej dávky u orgánov v riziku
- Postavení radioterapie v léčbě karcinomu
- Sekundární nádory a radioterapie
- Onkologie využívá paprsky X už 125 let…
- Strava a její vliv na karcinom prostaty, se zaměřením na rostlinnou stravu
- Ozařování pacientů s implantovanými elektronickými přístroji
- Cyberknife boost 5–10 Gy u lokálně pokročilých karcinomů nazofaryngu
- TSEI u pacientů s mycosis fungoides – klinické výsledky
- Hypofrakcionovaná akcelerovaná radioterapie karcinomu prostaty
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sekundární nádory a radioterapie
- Výživa během radioterapie u onkologických pacientů
- Strava a její vliv na karcinom prostaty, se zaměřením na rostlinnou stravu
- TSEI u pacientů s mycosis fungoides – klinické výsledky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



