-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prostorová analýza recidiv glioblastomů v závislost na taktice adjuvantní radioterapie (stanovení cílových objemů dle RTOG vs. EORTC): představení akademické studie
Spatial patterns of glioblastoma failure related to contouring strategy of adjuvant radiotherapy (RTOG vs. EORTC target volumes approach): clinical trial introduction
Background: Glioblastoma represents the most common and the most aggressive primary brain tumor in adults. Radiotherapy is indicated in almost all patients suffering with this disease. The importance of valid contouring (target volume definition) in radiotherapy of glioblastomas is currently increasing. The two basic contouring approaches in glioblastoma are the „American“ approach of the Radiation Therapy Oncology Group (RTOG contouring approach defining two target volumes) and the „European“ approach of the European Organization for Research and Treatment of Cancer (EORTC contouring approach with one target volume). Both mentioned approaches are considered standard of radiotherapy care. In daily radiotherapy practice, a specific contouring procedure is often chosen also according to the convention and tradition of the pertinent workplace. An important parameter in assessing the approach to contouring in radiotherapy is the evaluation of patterns of failure (PoF, spatial evaluation of subsequent relapses).
Purpose: The GlioART, academic investigator initiated clinical study, compares the RTOG and EORTC approaches in a prospective setup, taking into account all parameters necessary for valid evaluation of progressions – definition of relapses, MR specification demonstrating progression, planned radiotherapy technique, glioblastoma molecular biological characteristics, resection extent and localization of the original glioblastoma. The aim of this paper is to present the GlioART study and to discuss the associated topics associated with defining the target volumes in radiotherapy.
Conclusion: The results of the GlioART trial may define recommendations influencing daily clinical practice in glioblastoma radiotherapy.
Keywords:
radiotherapy – glioblastoma – contouring – patterns of failure – GlioART
Autoři: R. Hejnová 1; A. Holešovská 1; P. Pospíšil 2,3
; R. Lakomý 4,5; L. Hynková 2,3; I. Selingerová 6; R. Belanová 7,8; M. Standara 7; R. Jančálek 9,10; M. Smrčka 11; P. Fadrus 11; K. Múčková 12; M. Hendrych 13; T. Chodúr 14; K. Šiff Elová 14; J. Šána 4,5,12; T. Prochazka 2; O. Slabý 4,5,12; P. Šlampa 2,3
; T. Kazda 2,3,6
Působiště autorů: Oddělení klinických hodnocení, MOÚ, Brno 1; Klinika radiační onkologie MOÚ, Brno 2; Klinika radiační onkologie LF MU, Brno 3; Klinika komplexní onkologické péče MOÚ, Brno 4; Klinika komplexní onkologické péče LF MU, Brno 5; Výzkumné centrum aplikované molekulární onkologie (RECAMO), MOÚ, Brno 6; Oddělení radiologie, MOÚ, Brno 7; LF MU, Brno 8; Neurochirurgická klinika FN u sv. Anny v Brně 9; Neurochirurgická klinika LF MU a FN U sv. Anny v Brně 10; Neurochirurgická klinika, LF MU a FN Brno 11; Ústav patologie LF MU a FN Brno 12; I. ústav patologie LF MU a FN u sv. Anny v Brně 13; Úsek klinické psychologie, MOÚ, Brno 14
Vyšlo v časopise: Klin Onkol 2020; 33(Suppl 1): 20-26
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2020S20Souhrn
Východiska: Glioblastom představuje nejčastější a zároveň nejagresivnější primární mozkový nádor dospělých. Radioterapii podstupuje naprostá většina pacientů s tímto onemocněním. Význam správného konturingu (stanovení cílových objemů) v radioterapii glioblastomů v současnosti stále stoupá. Dvěma základními přístupy ke konturování glioblastomů jsou postup „americký“ dle Pracovní skupiny pro radioterapii v onkologii (Radiation Therapy Oncology Group – RTOG), tzv. RTOG contouring approach s definicí dvou cílových objemů, a postup „evropský“ dle Evropské organizace pro výzkum a léčbu nádorových onemocnění (European Organisation for Research and Treatment of Cancer – EORTC), tzv. EORTC contouring approach s definicí jednoho cílového objemu. Oba přístupy v definování cílových objemů jsou považovány za standardní a v praxi se výběr konkrétního postupu liší i dle zvyklostí daného pracoviště. Významným parametrem hodnocení přístupu ke konturingu je prostorové hodnocení následných recidiv, tzv. patterns of failure (PoF).
Cíl: Akademická klinická studie GlioART srovnává RTOG a EORTC přístupy v prospektivním nastavení a se zohledněním všech parametrů nutných pro validní hodnocení následných recidiv – definice recidiv, specifikace MR prokazujícího progresi, specifikace techniky plánované radioterapie, molekulárně biologické charakteristiky glioblastomů, rozsah resekce a lokalizace původního glioblastomu. Cílem tohoto textu je představit zmiňovanou studii GlioART a diskutovat přidružená témata spojená s definováním cílových objemů radioterapie.
Závěr: Výsledky akademické studie GlioART mohou definovat doporučení ovlivňující každodenní praxi v radioterapii glioblastomů.
Klíčová slova:
glioblastom – radioterapie – konturování – patterns of failure – GlioART
Úvod
Primární mozkové tumory patří v porovnání s ostatními onkologickými diagnózami se svou incidencí 8/100 000 obyvatel mezi méně časté nádory. Bohužel ty nejagresivnější – glioblastomy – tvoří asi polovinu všech primárních zhoubných nádorů mozku. Pro své biologické chování jsou tyto tumory řazeny mezi nejhůře léčitelná onemocnění vůbec, a tím představují i přes relativně nízkou incidenci závažný zdravotní problém. I přes pokroky v komplexní onkologické léčbě gliomů zůstávají výsledky této léčby neuspokojivé. Udávaný medián přežití 14–17 měsíců s pětiletým přežitím 10 % je pozorován především u pacientů s příznivými prognostickými faktory, kteří absolvují kompletní adjuvantní onkologickou terapii [1]. Medián celkového přežití se přes veškeré úsilí za posledních 30 let prodloužil pouze o několik měsíců [2]. I z tohoto důvodu je nutný další výzkum a vývoj nových terapeutických postupů [3].
Standardní multidisciplinární léčba glioblastomů je založena na kombinaci několika léčebných modalit, kdy je základem maximální možná resekce bez neurologických následků. Následuje intenzivní adjuvantní léčba v podobě adjuvantní konkomitantní chemoradioterapie a adjuvantní chemoterapie alkylačním cytostatikem temozolomidem – tzv. Stuppův režim [1,4]. Cílem této adjuvantní terapie je dosáhnout co nejdelší lokální kontroly onemocnění – oddálení progrese a prodloužení celkového přežití.
Radioterapie zaznamenala v posledním desetiletí bouřlivý rozvoj v souvislosti se zdokonalováním výpočetní techniky, vyšší dostupností zobrazovacích metod a dokonalejšími systémy radioterapie [2,5]. Základní principy a postupy (tzv. workflow) však zůstávají neměnné: lékař-radioterapeut určí pomocí zobrazovacích metod tzv. cílový objem, do kterého je aplikována předepsaná dávka ionizujícího záření pomocí individuálního ozařovacího plánu připraveného radiologickým fyzikem. Stanovení cílových objemů (konturování) je jedním z klíčových momentů celého procesu radioterapie, protože se při nesprávném konturování jedná o systematickou chybu, kterou již nelze v dalším průběhu radioterapie eliminovat. Jinými slovy, pokud jsou na začátku cílové objemy stanoveny nesprávně, bude již celá léčba zářením suboptimální (chybná), i kdyby plánující fyzik vytvořil bezchybný ozařovací plán a ozařování ve všech jednotlivých frakcích probíhalo bez náhodných či systematických chyb na ozařovně. Na druhou stranu nelze v individuálních případech vždy přesně určit, jaký je správný postup konturování cílových objemů. V první řadě je samozřejmě nutné se opřít o publikované konturovací atlasy zohledňující mimo jiné biologické chování daných nádorů, nicméně definování těchto cílových objemů pro ozařování je často také záležitost zrcadlící individuální zkušenost a cit daného radiačního onkologa a jeho detailní znalosti anatomie a radiologie (podle hesla „contouring is sometimes more an art than the science“, tj. konturování je někdy spíše umění než věda). Hodnocení stanovování cílových objemů v radioterapii glioblastomů je cílem prospektivní multicentrické akademické studie GlioART, která je představena v tomto článku.
Cílové objemy v radioterapii glioblastomů
Existuje několik rovnocenných přístupů ve stanovení (konturování) klinických cílových objemů u glioblastomů. Dvěma základními přístupy jsou postup „americký“ dle Pracovní skupiny pro radioterapii v onkologii (Radiation Therapy Oncology Group – RTOG), tzv. RTOG contouring approach s definicí dvou cílových objemů) [6,7], a postup „evropský“ dle Evropské organizace pro výzkum a léčbu nádorových onemocnění (European Organisation for Research and Treatment of Cancer – EORTC), tzv. EORTC contouring approach s definicí jednoho cílového objemu [8]. Cílové objemy dle EORTC jsou obecně menší než dle RTOG, kde je velký objem tkáně ozařován střední dávkou v 1. fázi radioterapie. Obecně se předpokládá, že menší zatížení normální mozkové tkáně vede k menšímu výskytu nežádoucích účinků. Optimální stanovení cílových objemů u glioblastomů vždy představuje nalezení kompromisu mezi možnou toxicitou a lokální kontrolou onemocnění. Existují také další práce popisující jiné strategie stanovení cílových objemů (obecně se jedná o lemy menší než 2 cm při konstrukci klinického cílového objemu) [9]. Téma správného definování cílových objemů v radioterapii glioblastomů je dále vysoce aktuální také ve vztahu k širšímu využití multiparametrického zobrazování mozku, jako je např. i kombinace s vyšetřením pozitronovou emisní tomografií (PET) vč. 11C-methioninového PET [10,11]. Dosud nebylo provedeno žádné randomizované srovnání zmiňovaných dvou hlavních konturovacích strategií, v praxi se často postupuje i dle zvyklostí daného pracoviště. Některé velké multicentrické studie zahrnující radioterapii (CENTRIC, RTOG 0525, RTOG 3508 a další) tak umožňují ozařování oběma postupy se stratifikovanou randomizací dle zvoleného přístupu a z dosud publikovaných dat nevyplývá výrazný rozdíl v základních parametrech přežití – celkové přežití (overall survival – OS) a přežití bez progrese (progression-free survival – PFS) [8].
Patterns of failure
Z pohledu radioterapie (RT) je, kromě hodnocení OS a PFS, také důležité prostorové hodnocení následných recidiv, a to ve vztahu k původní radioterapii, k oblastem, kde byla původně aplikována vysoká dávka záření, tzv. patterns of failure (PoF). Vyhodnocení charakteru recidivy (centrální, marginální, distální atd.) je důležitým nástrojem, jak určit, který konturovací postup je výhodnější. Neexistuje jednotný postup hodnocení recidiv, většina autorů však kategorizuje recidivy ve vztahu k lokalizaci 95% izodózy (oblasti, která obdržela při radioterapii alespoň 95 % předepsané dávky) [9,12,13]. Chang et al kategorizovali rekurence na centrální, in-field, marginální a distální (tab. 1, obr. 1) [14]. Stejné dělení jsme použili i v naší předchozí studii hodnotící recidivy u anaplastických astrocytomů [15] a v představované studii GlioART.
Tab. 1. Hodnocení recidiv dle vztahu k vysoké dávce záření. V případě multicentrické progrese se hodnotí každá recidiva zvlášť, konkrétní pacient tak může mít např. jednu centrální a jednu distální progresi. 
V95% – objem recidivy, kdy pacient obdržel alespoň 95 % z předepsané dávky Obr. 1. Grafické znázornění charakteru recidiv glioblastomů ve vztahu k 95% izodóze (bílá křivka). 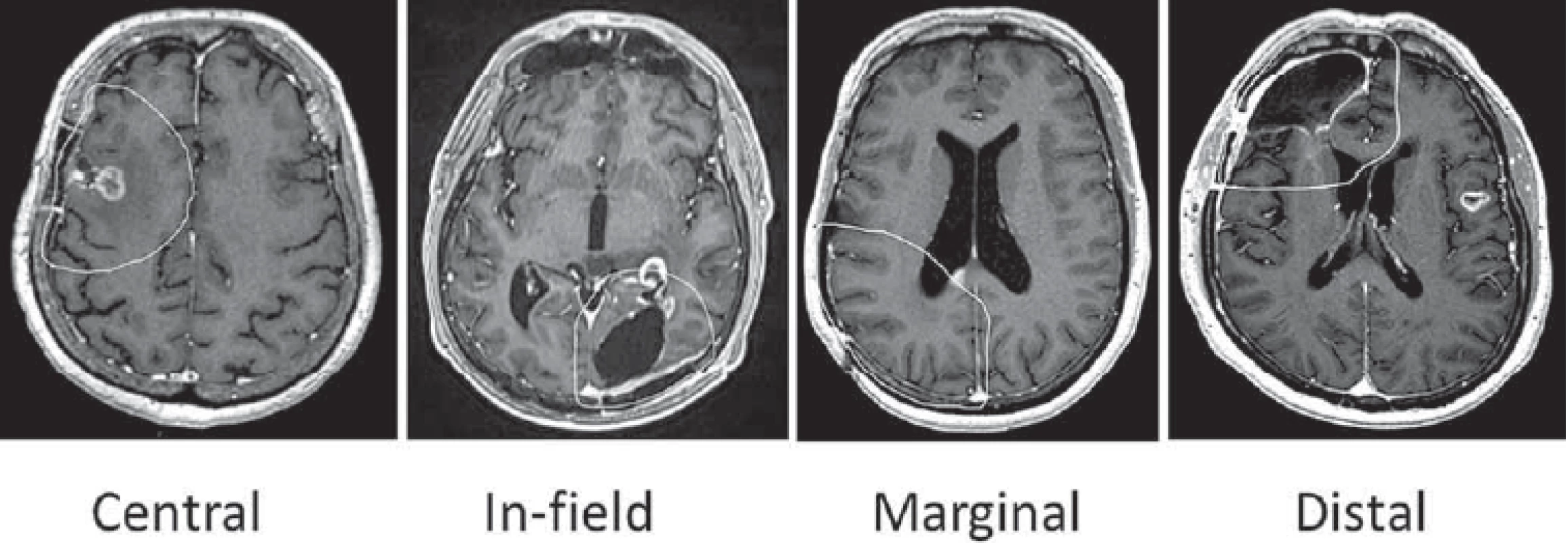
Četné studie (většina retrospektivních) srovnávaly PoF při použití různých konturovacích postupů a výsledky ukázaly vysoké procento centrálních recidiv bez ohledu na zvolený postup konturování. Různé studie používaly různé předpisy RT dávky a různé postupy hodnocení PoF, základním minimálním požadavkem pro validní srovnání však je plánování RT prostřednictvím magnetické rezonance (MR) a provedení RT v kombinaci s chemoterapií (Stuppův režim). Přehled dosavadních studií a výsledků hodnocení PoF je v uvedenv tab. 2.
Tab. 2. Studie hodnotící patterns of failure (radioterapie v těchto studiích byla cílena pomocí magnetické rezonance a pacienti podstupovali konkomitantní léčbu s temozolomidem) [6]. ![Studie hodnotící patterns of failure (radioterapie v těchto studiích byla cílena pomocí magnetické rezonance a pacienti podstupovali konkomitantní léčbu s temozolomidem) [6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/9299a671c5f18941d52abf7eef3d468c.png)
I když lze z výsledků sumarizovaných v tab. 2 usuzovat na menší počet centrálních recidiv (a tím pádem větší počet marginálních nebo distálních recidiv) u kohort pacientů ozařovaných dle EORTC konturovacího postupu (na jeden cílový objem), je nutné vzít v potaz limitace prezentovaných výsledků. Lemy při konstrukci cílových objemů nebyly jednotné, jedná se o retrospektivní studie, ne všichni pacienti byli léčeni moderními konformními technikami radioterapie s modulovanou intenzitou svazku, studie se lišily v postupu hodnocení PoF. Jedině prospektivní randomizovaná studie minimalizující výše zmíněná omezení může jednoznačně popsat charakter recidiv po daném konturovacím postupu. Prozatím retrospektivní studie porovnávající tyto dva postupy neprokázaly obecný předpoklad, že větší celkový plánovací cílový objem (dle RTOG) vede k signifikantní redukci marginálních a distálních recidiv.
Dále je pro validní hodnocení recidiv také nutná jednoznačná specifikace MR vyšetření prokazující progresi. Především u časných MR studií provedených po ukončení konkomitantní chemoradioterapie je častý fenomén tzv. pseudoprogrese (obraz imponující jako progrese, léze však spontánně regreduje i bez léčby). V současné době jsou při hodnocení léčebné odpovědi u vysokostupňových gliomů široce akceptována kritéria RANO (Response Assessment in Neuro-Oncology – hodnocení odpovědi v neuroonkologii) (tab. 3) [16,17].
Tab. 3. RANO kritéria hodnocení léčebné odpovědi gliomů. 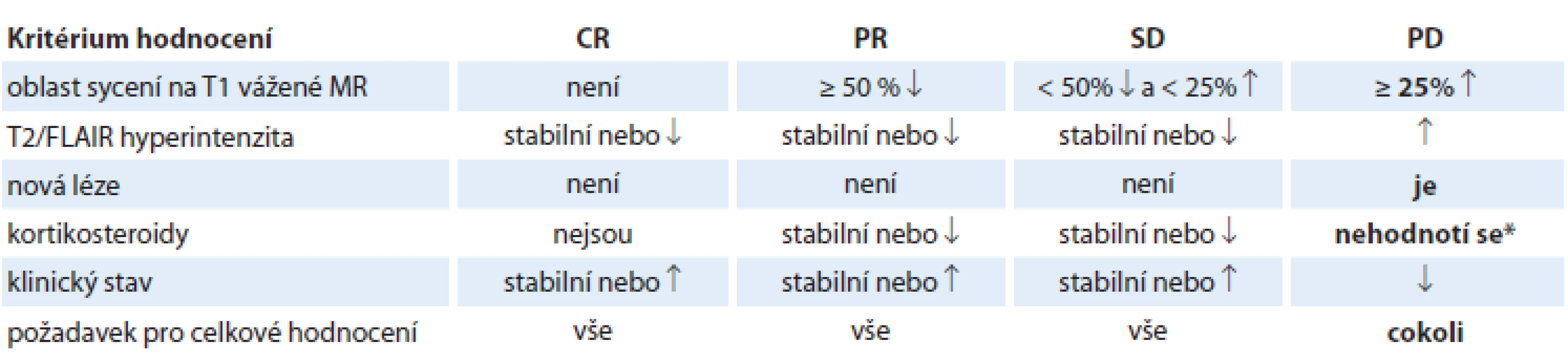
CR – kompletní remise, FLAIR – fl uid attenuated inversion recovery, MR – magnetická rezonance, PR – parciální remise, PD – progrese, RANO – hodnocení odpovědi v neuroonkologii, SD – stabilizované onemocnění Pro validní hodnocení recidiv je také nutná jednoznačná specifikace techniky plánované radioterapie. Mezi v současnosti nejpoužívanější techniky patří 3D konformní radioterapie (3D-CRT) nebo ještě konformnější radioterapie s modulovanou intenzitou svazku (intensity modulated radiation therapy – IMRT), případně pohybová IMRT, tj. objemově modulovaná radioterapie kyvem (volumetric modulated arc radiation therapy – VMAT). Pomocí VMAT lze dosáhnout toho, že předepsaná dávka bude přesně obklopovat plánovací cílový objem (planned target volume – PTV). V případě 3D-CRT se někdy stírají rozdíly mezi stanovením cílového objemu dle jednotlivých konturovacích postupů. Zvláště rozdělení PoF mezi in-field a marginální je extrémně závislé na konformitě radioterapie. Rozdílnou konformitu mezi 3D-CRT a VMAT ukazuje obr. 2. Pro validní hodnocení PoF je také nutná detailní histopatologická a molekulárně biologická charakteristika glioblastomů dle revidované WHO klasifikace z roku 2016 [18]. Dále je nutné zohlednit některé molekulárně biologické charakteristiky, které byly popsány ve vztahu k invazivitě glioblastomů, jako je například mutační stav genů izocitrátdehydrogenázy (IDH) [19] nebo metylační stav promotoru genu pro O6-metylguanin DNA metyltransferázu (MGMT) [20]. Všechny výše uvedené faktory ovlivňující validní hodnocení recidiv jsou v prospektivní studii GlioART zohledněny.
Obr. 2. Ukázky ozařovacích plánů připravených technikou 3D-CRT a technikou pohybové IMRT (arc IMRT – VMAT). Modrá křivka určuje oblast, která má být ozářena předepsanou dávkou. Zelená křivka je 95% izodóza, tedy oblast, která je reálně ozářena vysokou (předepsanou) dávkou záření. Ostatní barevné křivky jsou izodózy ukazující oblasti, které obdrží menší dávky záření. Je vidět, že v případě starších ozařovacích technik (např. u ještě starších technik dvou protilehlých laterolaterálních polí) hrálo konturování mnohem menší roli než u současných vysoce konformních postupů. 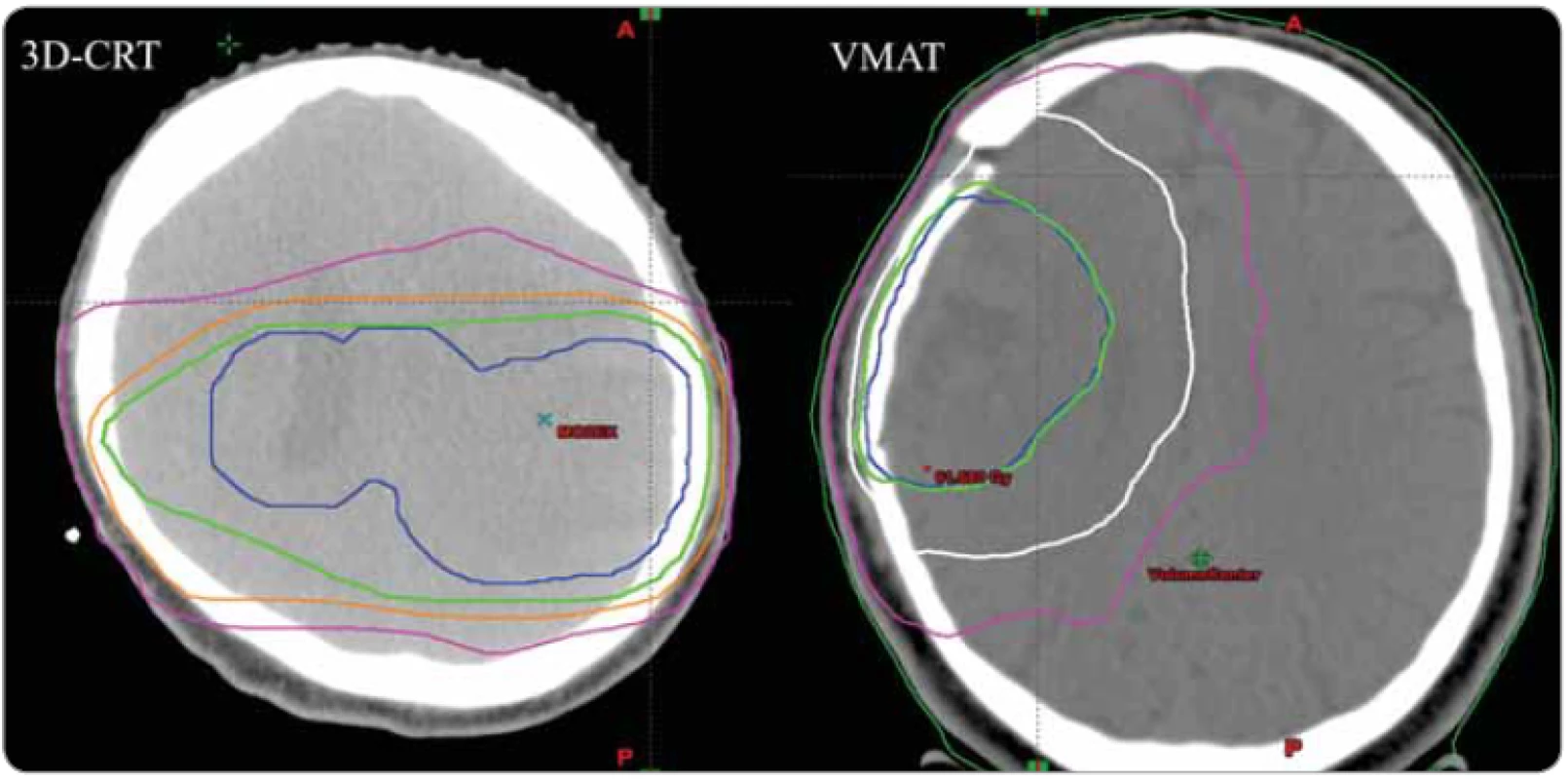
3D CRT – 3D konformní radioterapie, IMRT – radioterapie s modulovanou intenzitou svazku, VMAT – objemově modulovaná radioterapie kyvem GlioART
GlioART (ART – adjuvantní radioterapie) je prospektivní multicentrická randomizovaná analýza závislosti recidiv glioblastomů na taktice adjuvantní radioterapie (stanovení cílových objemů dle RTOG vs. EORTC) (schéma 1). Jedná se o akademickou, investigátorem iniciovanou klinickou studii srovnávající dvě zavedené standardní metody. Studie byla schválena příslušnou etickou komisí (číslo jednací 2018/3257/MOU) a Radou klinického výzkumu Masarykova onkologického ústavu. Všichni pacienti zařazení do studie podepisují informovaný souhlas se svou účastí v této studii.
Schéma 1. Schéma studie GlioART. 
EORTC – Evropská organizace pro výzkum a léčbu nádorových onemocnění, IDH – izocitrátdehydrogenáza, CHRT – chemoradioterapie, MGMT – O6-metylguanin DNA metyltransferázu, RTOG – Pracovní skupina pro radioterapii v onkologii Primárním cílem je explorační hodnocení PoF v závislosti na strategii stanovení cílových objemů v radioterapii glioblastomů s moderní, vysoce konformní radioterapií s modulovanou intenzitou svazku a s validním hodnocením progrese dle RANO kritérií. Cílem studie je prokázat, že při způsobu konturování dle EORTC (na jeden cílový objem) není větší zastoupení marginálních recidiv než při konturování dle RTOG (na dva cílové objemy). Podle dostupné literatury lze při konturování dle RTOG očekávat 5 % marginálních recidiv, klinicky významný rozdíl v počtu marginálních recidiv byl stanoven jako 15 %. Plánovaný celkový počet zařazených pacientů na základě těchto údajů je 190. Oba způsoby konturování (dle RTOG a dle EORTC) jsou standardní zavedené metody v radioterapii glioblastomů. Další tradiční onkologické sledované parametry, jako je OS nebo PFS, jsou pak cíli sekundárními, mezi které také patří hodnocení kvality života a kognitivních funkcí (k potvrzení předpokladu, že u pacientů randomizovaných do ramene s konturováním dle EORTC, kde jsou obecně menší objemy ozařovaného mozku, bude menší deteriorace kognitivních funkcí). Nelze očekávat výraznější rozdíl např. v parametru OS a ani to není cílem této studie.
Hlavním vstupním kritériem je celkový stav pacienta umožňující podání standardní adjuvantní onkologické terapie (normofrakcionovaný režim RT, Stuppův režim) [4]. Jedním z důležitých vylučujících kritérií je časná progrese onemocnění zachycená na plánovacím MR pořízeném pro účely plánování radioterapie nebo menší než subtotální rozsah primární resekce tumoru (obě tyto situace jsou totiž logicky silnými prediktory centrálního charakteru recidivy bez ohledu na konturovací strategii v radioterapii). Další vstupní a vylučující kritéria jsou součástí kompletního studiového protokolu.
Do jednotlivých ramen (ozařování dle RTOG a dle EORTC) budou pacienti randomizováni permutační stratifikovanou blokovou randomizací. Stratifikační kritéria představují faktory pravděpodobně ovlivňující invazivitu glioblastomu, jako je IDH status (lze předpokládat, že u IDH mutovaných glioblastomů bude více noncentrálních recidiv [19]), nebo stav metylace promotoru genu pro MGMT [20] (lze předpokládat, že pacienti s metylovaným promotorem genu pro MGMT mají více vzdálených rekurencí). Důležitý je také rozsah resekce. Lze předpokládat, že u pacientů po subtotální resekci (STR, definované pro účely této studie jako resekce ≥ 90 % tumoru) bude více recidiv centrálních – v místě ponechaného makroskopického rezidua. Posledním stratifikačním faktorem je pak lokalizace původního glioblastomu dle Limovy klasifikace [21]. Lze předpokládat, že glioblastomy skupiny Lim 1 budou vykazovat více distálních recidiv [21] (jedná se o hodnocení nálezu na předoperačním MR; dle kontaktu sytící se léze s kortexem a se subventrikulární zónou se nádory kategorizují na Lim1: kontakt sytící se léze s kortexem i subventrikulární zónou, Lim2: kontakt sytící se léze pouze se subventrikulární zónou, Lim3: kontakt sytící se léze pouze s kortexem a Lim 4: bez kontaktu sytící se léze s kortexem nebo subventrikulární zónou).
Radioterapie
Pacienti zařazení do studie jsou ozařováni IMRT, přičemž je možný libovolný způsob IMRT, např. helikální tomoterapie nebo VMAT. V procesu plánování je nutné dodržení přesného zakreslení cílových objemů dle studiového protokolu a kritických orgánů. Samotné zahájení ozařování musí nastat nejpozději 6 týdnů po operaci (max. 42. den po operaci).
Při konturování dle RTOG jsou definovány dva cílové objemy, radioterapie je rozdělena na dva kurzy a po ozáření prvního většího objemu pokračuje radioterapie jako sekvenční boost (cone-down technika) na druhý, menší cílový objem. Zásadní rozdíl oproti konturování dle EORTC je v zahrnutí oblastí s patologickým signálem (hyperintenzita) na FLAIR (T2) váženém MR zobrazování, což je oblast odpovídající edému, dle některých studií však i oblast s přítomnými nádorovými buňkami migrujícími podél vláken bílé hmoty. Detailnější popis metodiky konstrukce cílových objemů a kritických orgánů [22] je již nad rámec tohoto textu. Kritické orgány jsou u všech pacientů konturovány stejně, bez ohledu na strategii konturování cílových objemů. Struktury jsou konturovány použitím plánovacího CT, resp. MR. Některé struktury jsou preferenčně konturovány prostřednictvím CT (např. oční bulby, kochlea a další), jiné struktury preferenčně prostřednictvím MR (chiazma, mozkový kmen a další).
V obou ramenech je předepsána stejná standardní celková dávka záření 60 Gy, která je normalizována tak, že 95 % plánovacího cílového objemu je pokryto 100 % předepsané dávky. Součástí studiového protokolu pak jsou detailní souhrny dávkově objemových parametrů pro tvorbu ozařovacího protokolu, včetně akceptabilních limitů a prioritizace jednotlivých kritických orgánů.
Konkomitantní temozolomid je podáván perorálně od prvního do posledního dne radioterapie, maximálně však 49 dní. Denní dávka pro tuto konkomitantní fázi je 75 mg/m2. Měsíc (28 ± 3 dny) po ukončení konkomitantní chemoradioterapie pokračuje pacient ve standardní léčbě adjuvantní chemoterapií. Temozolomid je podáván perorálně jednou denně po dobu pěti po sobě jdoucích dní (D1–D5) v 28denním (± 3 dny) cyklu. Dávka v prvním cyklu je 150 mg/m2 a den, s následným navýšením dávky na 200 mg/m2 a den od druhého cyklu za předpokladu žádné toxicity větší než druhého stupně (> grade 2toxicita).
Sledování po léčbě a vyhodnocení patterns of failure
Jako základní srovnávací MR studie (baseline scan) pro další kontrolní MR v rámci follow up slouží plánovací MR pro RT, resp. MR s nadirem sledovaných hodnot (RANO kritéria). Kontrolní MR jsou plánovány po dvou měsících, vždy maximálně 14 dní před zahájením každého sudého cyklu (cyklus 2, 4, 6) adjuvantní terapie. První MR po ukončení chemoradioterapie tak vychází cca 6–8 týdnů po ukončení radioterapie. Dle uvážení ošetřujícího lékaře může být kontrolní MR indikováno kdykoli mimo tento rozpis a snímky jsou také analyzovány dle RANO kritérií. Po ukončení adjuvantní chemoterapie je pacient dále sledován do progrese v rámci běžné klinické praxe. Současně s každým MR je vyhodnocen ošetřujícím lékařem klinický stav a dávka užívaných kortikoidů. Zároveň pacient také absolvuje psychologické vyšetření kognitivních funkcí a vyplní standardizovaný dotazník kvality života (do progrese). Datum MR studie, kde dojde k progresi dle RANO kritérií, je východiskem pro výpočty PFS. S touto MR studií je dále pracováno v rámci vyhodnocení PoF.
Prostorové vyhodnocení recidivy ve vztahu k oblasti ozářené vysokou dávkou záření je prováděno radioterapeutem. MR definující progresi dle RANO (MR_RANO) kritérií je použita k analýze PoF, konkrétně T1 vážená sekvence s podáním kontrastní látky. V plánovacím software radioterapie je provedena standardní fúze obrazů: MR_RANO je registrováno do původního plánovacího CT. Radioterapeut, ev. ve spolupráci s radiologem, provede zakreslení oblasti recidivy pro následné hodnocení PoF. Pomocí běžné funkce plánovacího systému radioterapie, tzv. dávkově objemového histogramu, je vyhodnocena procentuální část recidivy, která byla v oblasti vysoké dávky záření. Vysoká dávka záření je definována jako alespoň 95 % předepsané dávky, tedy 57 Gy. Dle objemu recidivy, který je uvnitř 95% izodózy (izodóza je pomyslná čára spojující body ozářené danou dávkou; definuje oblast, uvnitř které byla aplikována minimálně tato dávka) jsou následně recidivy rozděleny na centrální, in-field, marginální a distální (tab. 1).
Závěr
Glioblastom zůstává nadále jednou z nejfatálnějších onkologických diagnóz. Pokračující výzkum a vývoj či modifikace léčebných metod jsou nutné v hledání cest, jak zlepšit léčbu a péči o tyto pacienty. Radioterapie zůstává jednou ze základních léčebných metod v managementu glioblastomu. S pokračujícím technologickým vývojem radioterapie a s větší dostupností zobrazovacích metod nabývá na významu správná definice cílových objemů jakožto jedna z nejdůležitějších částí procesu léčby zářením. GlioART je prospektivní multicentrická randomizovaná analýza závislosti recidiv glioblastomů na taktice adjuvantní radioterapie. Jedná se o akademickou, investigátorem iniciovanou klinickou studii srovnávající dvě zavedené standardní metody (stanovení cílových objemů dle RTOG vs. EORTC). Výsledky mohou definovat doporučení ovlivňující každodenní praxi v radioterapii glioblastomů.
Zdroje
1. Cabrera AR, Kirkpatrick JP, Fiveash JB et al. Radiation Therapy for Glioblastoma: An ASTRO Evidence-Based Clinical Practice Guideline Conflict of Interest Disclosure Statement. [online]. Available from: https: //www.academia.edu/33797331/SUPPLEMENTAL_MATERIAL_Radiation_Therapy_for_Glioblastoma_An_ASTRO_Evidence-Based_Clinical_Practice_Guideline_Conflict_of_Interest_Disclosure_Statement.
2. Kazda T, Dziacky A, Burkon P et al. Radiotherapy of glioblastoma 15 years after the landmark Stupp’s trial: More controversies than standards? Radiol Oncol 2018; 52 (2): 121–128. doi: 10.2478/raon-2018-0023.
3. Kazda T, Lakomý R, Poprach A et al. Multidisciplinární přístup v léčbě gliomů – astrocytomy a oligodendrogliomy. Postgraduální medicína 2020; 22 (2): 137–142.
4. Stupp R, Mason WP, van den Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352 (10): 987–996. doi: 10.1056/NEJMoa043330.
5. Kazda T, Pospíšil P, Šlampa P. Kontroverze při současné radioterapii high-grade gliomů. Postgraduální medicína 2017; 19 (2): 195–200.
6. Cabrera AR, Kirkpatrick JP, Fiveash JB, et al. Radiation therapy for glioblastoma: Executive summary of an American Society for Radiation Oncology Evidence-Based Clinical Practice Guideline. Pract Radiat Oncol 2016; 6 (4): 217–225. doi: 10.1016/j.prro.2016.03.007.
7. Sulman EP, Ismaila N, Armstrong TS et al. Radiation therapy for glioblastoma: American Society of Clinical Oncology clinical practice guideline endorsement of the American Society for Radiation Oncology guideline. J Clin Oncol 2016; 35 (3): 361–369. doi: 10.1200/JCO.2016.70.7562.
8. Niyazi M, Brada M, Chalmers AJ et al. ESTRO-ACROP guideline “target delineation of glioblastomas.” Radiother Oncol 2016; 118 (1): 35–42. doi: 10.1016/j.radonc.2015.12.003.
9. Wernicke AG, Smith AW, Taube S et al. Glioblastoma: Radiation treatment margins, how small is large enough? Pract Radiat Oncol 2016; 6 (5): 298–305. doi: 10.1016/j.prro.2015.12.002.
10. Kazda T, Pafundi DH, Kraling A et al. Dosimetric impact of amino acid positron emission tomography imaging for target delineation in radiation treatment planning for high-grade gliomas. Phys Imaging Radiat Oncol 2018; 6 : 94–100. doi: 10.1016/j.phro.2018.06.004.
11. Law I, Albert NL, Arbizu J et al. Joint EANM/EANO/RANO practice guidelines/SNMMI procedure standards for imaging of gliomas using PET with radiolabelled amino acids and [ 18 F]FDG: version 1.0. Eur J Nucl Med Mol Imaging 2019; 46 (3): 540–557. doi: 10.1007/s00259-018-4207-9.
12. Ogura K, Mizowaki T, Arakawa Y et al. Initial and cumulative recurrence patterns of glioblastoma after temozolomide-based chemoradiotherapy and salvage treatment: A retrospective cohort study in a single institution. Radiat Oncol 2013; 8 (1): 1–9. doi: 10.1186/1748-717X-8-97.
13. Minniti G, Amelio D, Amichetti M et al. Patterns of failure and comparison of different target volume delineations in patients with glioblastoma treated with conformal radiotherapy plus concomitant and adjuvant temozolomide. Radiother Oncol 2010; 97 (3): 377–381. doi: 10.1016/j.radonc.2010.08.020.
14. Chang EL, Akyurek S, Avalos T et al. Evaluation of peritumoral edema in the delineation of radiotherapy clinical target volumes for glioblastoma. Int J Radiat Oncol Biol Phys 2007; 68 (1): 144–150. doi: 10.1016/j.ijrobp.2006.12.009.
15. Kazda T, Hardie JG, Pafundi DH et al. Evaluation of RANO response criteria compared to clinician evaluation in WHO grade III anaplastic astrocytoma: implications for clinical trial reporting and patterns of failure. J Neurooncol 2015; 122 (1): 197–203. doi: 10.1007/s11060-014-1703-z.
16. Wen PY, Macdonald DR, Reardon D et al. Updated response assessment criteria for high-grade gliomas: response assessment in neuro-oncology working group. J Clin Oncol 2010; 28 (11): 1963–1972. doi: 10.1200/JCO.2009.26.3541.
17. Belanova R, Sprlakova-Pukova A, Standara M et al. In silico study of pseudoprogression in glioblastoma: collaboration of radiologists and radiation oncologists in the estimation of extent of high dose RT region. [online]. Available from: https: //biomed.papers.upol.cz/search.php?q=Belanova.
18. Louis DN, Perry A, Reifenberger G et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol 2016; 131 (6): 803–820. doi: 10.1007/s00401-016-1545-1.
19. Baldock AL, Yagle K, Born DE et al. Invasion and proliferation kinetics in enhancing gliomas predict IDH1 mutation status. Neuro Oncol 2014; 16 (6): 779–786. doi: 10.1093/neuonc/nou027.
20. Brandes AA, Tosoni A, Franceschi E et al. Recurrence pattern after temozolomide concomitant with and adjuvant to radiotherapy in newly diagnosed patients with glioblastoma: Correlation with MGMT promoter methylation status. J Clin Oncol 2009; 27 (8): 1275–1279. doi: 10.1200/JCO.2008.19.4969.
21. Lim DA, Cha S, Mayo MC et al. Relationship of glioblastoma multiforme to neural stem cell regions predicts invasive and multifocal tumor phenotype. Neuro Oncol 2007; 9 (4): 424–429. doi: 10.1215/15228517-2007-023.
22. Scoccianti S, Detti B, Gadda D et al. Organs at risk in the brain and their dose-constraints in adults and in children: a radiation oncologist’s guide for delineation in everyday practice. Radiother Oncol 2015; 114 (2): 230–238. doi: 10.1016/j.radonc.2015.01.016.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo Suppl 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Genová terapie v radiační onkologii
- Prostorová analýza recidiv glioblastomů v závislost na taktice adjuvantní radioterapie (stanovení cílových objemů dle RTOG vs. EORTC): představení akademické studie
- Výživa během radioterapie u onkologických pacientů
- Rádiobiologické aspekty reožarovania a ich modelovanie pri stanovení tolerančnej dávky u orgánov v riziku
- Postavení radioterapie v léčbě karcinomu
- Sekundární nádory a radioterapie
- Onkologie využívá paprsky X už 125 let…
- Strava a její vliv na karcinom prostaty, se zaměřením na rostlinnou stravu
- Ozařování pacientů s implantovanými elektronickými přístroji
- Cyberknife boost 5–10 Gy u lokálně pokročilých karcinomů nazofaryngu
- TSEI u pacientů s mycosis fungoides – klinické výsledky
- Hypofrakcionovaná akcelerovaná radioterapie karcinomu prostaty
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sekundární nádory a radioterapie
- Výživa během radioterapie u onkologických pacientů
- Strava a její vliv na karcinom prostaty, se zaměřením na rostlinnou stravu
- TSEI u pacientů s mycosis fungoides – klinické výsledky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



