-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hypofrakcionovaná akcelerovaná radioterapie karcinomu prostaty
Hypofractionated radiotherapy for prostate cancer
Background: Conventionally fractionated radiotherapy for prostate cancer belongs to the longest radiotherapy courses. Shortening of the overall duration of the course not only brings a benefit to the patients, but also decreases the workload of radiation oncology departments.
Material and methods: A total of 205 patients with prostate cancer were irradiated with the dose of 20 x 3.0 Gy to the prostate, 4 fractions a week (low risk) or 21 × 3.0/2.1 Gy to the prostate / 2/3 of seminal vesicles, 3 and 4 fractions a week alternately (intermediate and high risk).
Results: Early toxicity by Radiation Therapy Oncology Group / European Organisation for Research and Therapy of Cancer (RTOG/EORTC): Genitourinary tract: G0 49%, G1 32%, G2 16%, G3 1% and G4 2%. Gastrointestinal tract: G0 79%, G1 19% and G2 2%. Late toxicity by Radiation Therapy Oncology Group / Fox Chase Cancer Center (RTOG/FC-LENT): The median follow-up is 5,1 years. Patients with the follow-up < 1 year were excluded. Genitourinary tract: G0 71%, G1 21%, G2 5%, G3 1% and G4 2%. Gastrointestinal tract: G0 83%, G1 13%, G2 11% and G3 1%.
Conclusion: The fractionation scheme 20–21 × 3.0 Gy, 3–4-times a week seems to be a safe method according to the toxicity. For biochemical control evaluation, longer follow-up is needed.
Keywords:
prostate cancer – radiotherapy – hypofractionation
Autoři: P. Krupa
Působiště autorů: Klinika radiační onkologie MOÚ Brno
Vyšlo v časopise: Klin Onkol 2020; 33(Suppl 1): 80-85
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2020S80Souhrn
Východiska: Radioterapie karcinomu prostaty patří při použití konvenční frakcionace k nejdelším radioterapeutickým sériím. Snaha o zkrácení celkové doby ozařování přináší benefit nejen pacientům, ale také snižuje zátěž radioterapeutických pracovišť.
Materiál a metody: Bylo ozařováno 205 pacientů s karcinomem prostaty, a to dávkou 20 × 3,0 Gy na oblast prostaty, 4 frakce týdně (nízké riziko) nebo dávkou 21 × 3,0/2,1 Gy na oblast prostaty / 2/3 semenných váčků (střední a vysoké riziko), střídavě 4 a 3 dny v týdnu.
Výsledky: Akutní toxicita podle Radiation Therapy Oncology Group / European Organisation for Research and Therapy of Cancer (RTOG/EORTC): Genitourinární trakt: G0 49 %, G1 32 %, G2 16 %, G3 1 % a G4 2 %. Gastrointestinální trakt: G0 79 %, G1 19 % a G2 2 %. Chronická toxicita podle Radiation Therapy Oncology Group // stupnice Fox Chase Cancer Center (ROTG/FC-LENT): Medián sledování je 5,1 roku. Pacienti s dobou sledování < 1 rok byly z hodnocení vyřazeni. Genitourinární trakt: G0 71 %, G1 21 %, G2 5 %, G3 1 % a G4 2 %. Gastrointestinální trakt: G0 83 %, G1 13 %, G2 11 % a G3 1%.
Závěr: Frakcionace 20–21 × 3,0 Gy 3–4× týdně se jeví z hlediska toxicity jako bezpečná metoda. Ke zhodnocení biochemické kontroly je třeba delší sledování.
Klíčová slova:
radioterapie – hypofrakcionace – karcinom prostaty
Úvod
Karcinom prostaty je po kožních nádorech druhým nejčastějším nádorovým onemocním u mužů. Kurativní radioterapie (RT) je spolu s radikální prostatektomií základní léčebnou modalitou. Pokud je užita konvenční frakcionace s dávkou 40 × 2,0 Gy v průběhu 8 týdnů, jedná se současně zřejmě o časově nejnáročnější ozařovací sérii ve srovnání s jinými diagnózami. Tento typ léčby tak tvoří významný podíl na vytížení radioterapeutických pracovišť. Jakékoli snížení počtu aplikovaných dávek je proto zajímavé pro snížení vytíženosti ozařovacích přístrojů, pro plátce péče a v neposlední řadě také pro zvýšení komfortu pacienta. To platí ve všech případech, pouze pokud současně nedojde k neúměrnému zvýšení akutních či pozdních nežádoucích účinků.
Dva přístupy ke zkrácení doby ozařování
V RT platí obecné pravidlo, že dávka 1,8–2,0 Gy na frakci představuje ideální poměr mezi protinádorovým účinkem na straně jedné a akutní a pozdní toxicitou na straně druhé. Aplikace této dávky 5 dní v týdnu je označováno jako konvenční frakcionace neboli normofrakcionace. Pokud je aplikována vyšší jednotlivá dávka, roste riziko pozdních nežádoucích účinků více než protinádorový efekt. Tato hypofrakcionace (pokud RT probíhá méně než 5× týdně) nebo akcelerovaná hypofrakcionace (5× týdně) tak byla dlouho vyhrazena především pro RT s paliativním záměrem. Možnost používat (akcelerovanou) hypofrakcionaci bez významného navýšení pozdní toxicity dovolují dva základní přístupy, které zde označujeme jako stereotaktický a radiobiologický.
Stereotaktický přístup
Aby došlo k radiačnímu poškození orgánu takovou mírou, že se klinicky projeví jako pozdní toxicita, je třeba ozářit určitou dávkou určitý objem. Tyto parametry se pro různé orgány liší. U převážně sériových orgánů je pro vznik toxicity rozhodující maximální dávka. Příkladem je mícha, kde po překročení limitní dávky strmě roste pravděpodobnost jejího přerušení. Naopak u převážně paralelních orgánů, jako jsou např. plíce nebo játra, je poškození klinicky významné pro ozáření určitého objemu. Příkladem může být ozáření velmi malého okrsku plíce velkou dávkou. I pokud dojde k úplné fibrotizaci a vyřazení tohoto drobného okrsku z funkce, klinicky to pacient nemusí a pravděpodobně nebude vůbec pozorovat. Většina orgánů, kam patří u karcinomu prostaty především močový měchýř a konečník, vykazuje smíšený charakter, kdy je třeba dodržet jak maximální dávku, tak dávku v objemu.
Moderní techniky radioterapie, a nemusí se jednat doslova o stereotaktické ozařování, dosahují velmi dobrého rozložení dávky v těle pacienta. Oblasti vysokých dávek jen v malé míře vybočují mimo stanovený cílový objem, směrem od něj potom dávka strmě klesá. Se vzrůstající přesností obrazové navigace (radioterapie řízená obrazem – image-guided radiation therapy – IGRT) je možné zmenšovat bezpečností lem, a tím také celý cílový objem.
Radiobiologický přístup
Jak již bylo naznačeno výše, při změně velikosti jednotlivé dávky se mění odpověď tkání, a to různou mírou podle svého charakteru. Při navýšení dávky na frakci většinou roste pozdní toxicita výrazně rychleji než protinádorový efekt. Toto všeobecné tvrzení kvantifikuje tzv. lineárně kvadratický (LQ) model. Jeho modifikací lze vypočítat dávku EQD2 (equivalent dose), která vyjadřuje, jak velká dávka aplikovaná frakcionací po 2 Gy, má stejný účinek jako dávka aplikovaná zvoleným frakcionačním režimem. V tomto matematickém vztahu figuruje dávka na frakci, celková dávka a parametr specifikující chování dané tkáně – konstanta á/ â. Z rovnice plyne, že většina nádorů a tkáně zodpovědné za projevy akutní toxicity (á/ â ~ 10 Gy) jsou jen málo závislé na změně frakcionace. Naopak tkáně zodpovědné za pozdní toxicitu (a/ b ~ 3-6 Gy) vykazují s rostoucí jednotlivou dávkou výrazně vyšší EQD2.
Karcinom prostaty (a do určité míry i některé další tumory) vykazují oproti jiným nádorům odlišné vlastnosti. Při zvyšování jednotlivé dávky protinádorový účinek stoupá, a to rychleji než pravděpodobnost pozdních nežádoucích účinků. Nejčastěji udávanou hodnotou á/ â je 1,5 Gy, podle recentní studie je to 2,4 Gy [1]. Alespoň teoreticky by tak zvýšení jednotlivé dávky při zachování celkové ekvivalentní dávky (EQD2) mělo umožnit snížení pozdní toxicity při zachování protinádorového efektu. Tab. 1 ukazuje hodnotu EQD2 pro různé frakcionační režimy a různé tkáně.
Tab. 1. Ekvivalentní dávky pro různé tkáně a frakcionační režimy. 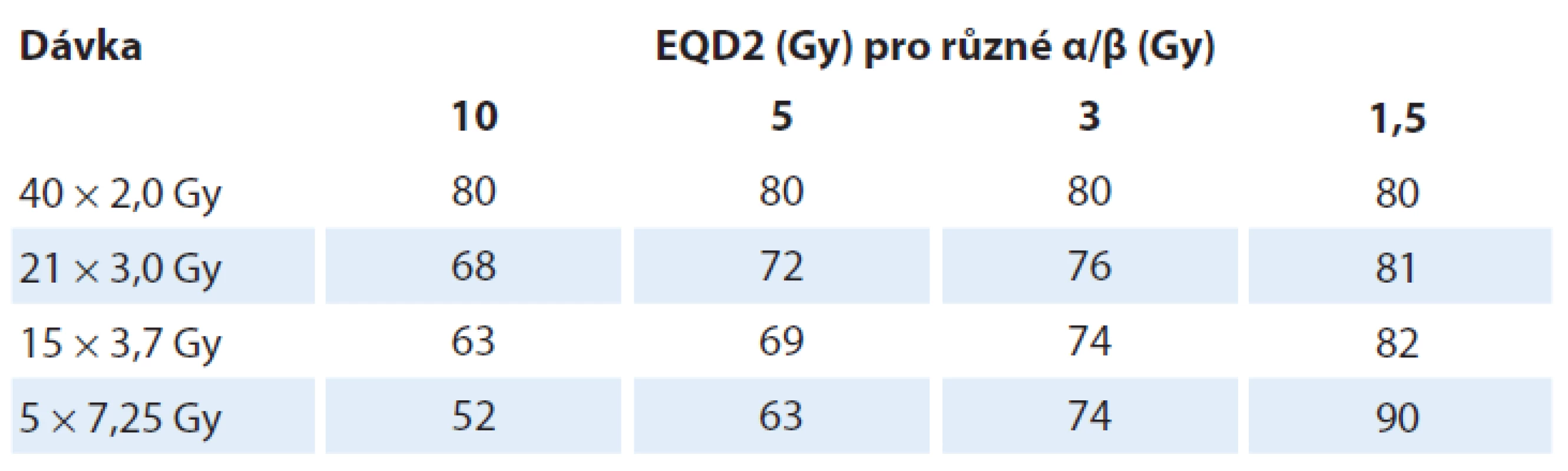
α/β = 10 Gy odpovídá většině nádorů a tkáním zodpovědným za akutní toxicitu.
α/β = 3–5 Gy odpovídá tkáním zodpovědným za pozdní (chronickou) toxicitu.
α/β = 1,5 Gy odpovídá pravděpodobné hodnotě u karcinomu prostaty.Materiál a metody
V roce 2010 byla na našem pracovišti zařazena mezi standardní techniky hypofrakcionovaná akcelerovaná radioterapie karcinomu prostaty (HART).
Návrh protokolu
Při návrhu protokolu bylo stanoveno několik hlavních sledovaných faktorů. Jednalo se o pravděpodobnost lokální kontroly (tumor control probability – TCP), pravděpodobnost akutní a pozdní toxicity (normal tissue complication probability – NTCP) a celková délka ozařování. Bylo požadováno zlepšení ve vypočtených hodnotách všech uvedených parametrů. Na základě analýzy ozařovacích plánů 50 pacientů a následných výpočtech hodnot TCP a NTCP pomocí programu Biogray [2,3] byl stanoven protokol pro ozařování pacientů s nízkým a středním rizikem rekurence. Pacienti s vysokým rizikem byli dle našeho tehdejšího standardu ozařováni včetně pánevních uzlin a do tohoto souboru byli zahrnuti pouze v případě, že ozáření pánve z nějakého důvodu nebylo indikováno. Výsledný protokol byl stanoven takto: Pacienti s nízkým rizikem rekurence byli ozařováni na oblast prostaty dávkou 20 × 3,0 Gy, čtyřikrát týdně. Vložení volného dne mělo zajišťovat udržení nízké míry akutní toxicity. Pacienti středního rizika byli ozařováni na oblast prostaty a bazí (dvou třetin) semenných váčků technikou simultánního integrovaného boostu dávkou 3,0/ 2,1 Gy. Pro zachování nízké úrovně akutní toxicity byly do ozařovacího schématu vloženy střídavě 1 den a 2 volné dny, ozařovalo se tedy střídavě 4 a 3 dny. Volba volných dní se přizpůsobovala provozním potřebám. Podrobnosti byly dříve publikovány ve studii autorů Krupa et al [4].
Technika radioterapie
Přibližně 30 min před plánovacím CT a před každou frakcí vypil pacient 0,5 l vody. Byl také instruován, aby šel na stolici, pokud možno co nejkratší dobu před CT či ozařováním. Současně měl dodržovat nenadýmavou dietu. IGRT byla prováděna před každou frakcí formou CT s kuželovým paprskem (cone beam CT). Pokud byla zjištěna příliš velká odchylka v náplni močového měchýře nebo konečníku ve srovnání s plánovacím CT, nebylo dovoleno pokračovat v ozařování, ale pacient byl instruován ke korekci. Radioterapie samotná byla prováděna technikou objemově modulované terapie kyvem (volumetric modulated arc therapy – VMAT), při ozařování semenných váčků byl využit simultánní integrovaný boost (SIB).
Soubor pacientů
Dle výše uvedeného protokolu bylo ozářeno 205 pacientů, medián věku 74 let (63–85). Pacienti nízkého rizika rekurence tvořili 34 %, středního 55 % a vysokého 11 % souboru. Neoadjuvantní hormonální léčbu užívalo 36 % pacientů nízkého rizika (nasazeno mimo naše pracoviště), 55 % středního a 83 % vysokého rizika rekurence. Medián doby sledování po léčbě činí 55 měsíců. Základní charakteristiku souboru uvádí tab. 2.
Tab. 2. Charakteristika souboru. Pozdní toxicita byla hodnocena pouze u pacientů s dobou sledování > 1 rok. Procentuální hodnota pacientů léčených neoadjuvantní HT je vztažena k počtu pacientů v dané rizikové skupině. 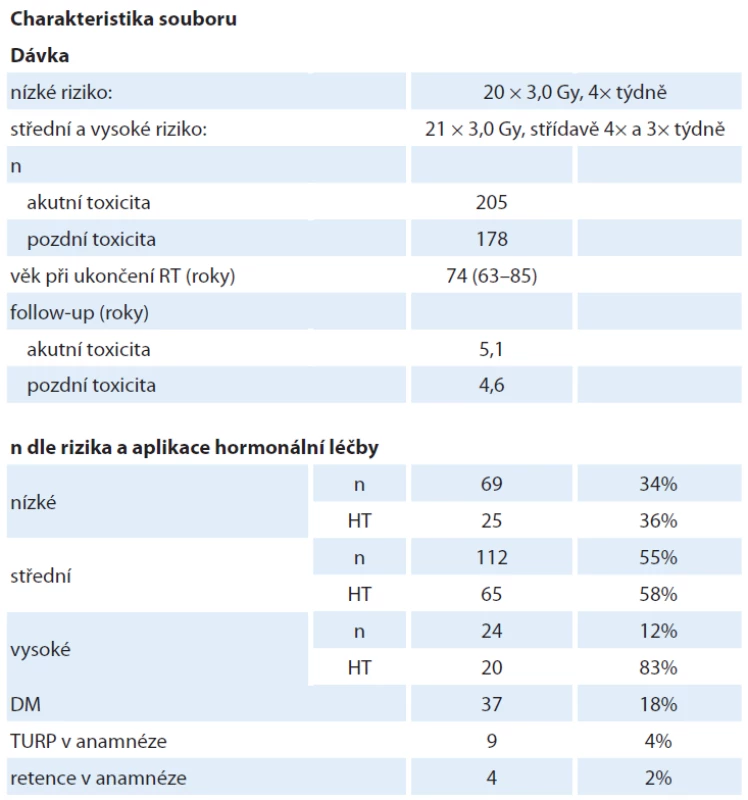
DM – počet pacientů s diabetes mellitus, HT – hormonální léčba, n – počet pacientů, TURP – transuretrální prostatektomie Výsledky
Akutní toxicita
Akutní toxicita byla hodnocena dle Radiation Therapy Oncology Group / European Organisation for Research and Therapy of Cancer (RTOG/ EORTC), viz tab. 3. Zcela bez genito-urinárních (GEU) potíží (G0) bylo 49 % pacientů, toxicita G1 byla zaznamenána u 32 %, G2 u 16 %, G3 u 1 % (2 pacienti) a G4 u 2 % (4 pacienti). Jednalo se o akutní močovou retenci s nutností zavedení permanentního močového katétru. Často uváděná hodnota toxicity shrnutá do jednoho čísla, tedy ≥ G2, je 19 %. Zcela bez gastrointestinálních (GIT) potíží (G0) bylo 79 % pacientů, toxicita G1 byla zaznamenána u 19 %, G2 u 2 % pacientů. Toxicita G2 a 3 zaznamenána nebyla.
Tab. 3. Hodnocení akutních změn po ozáření podle RTOG/EORTC. 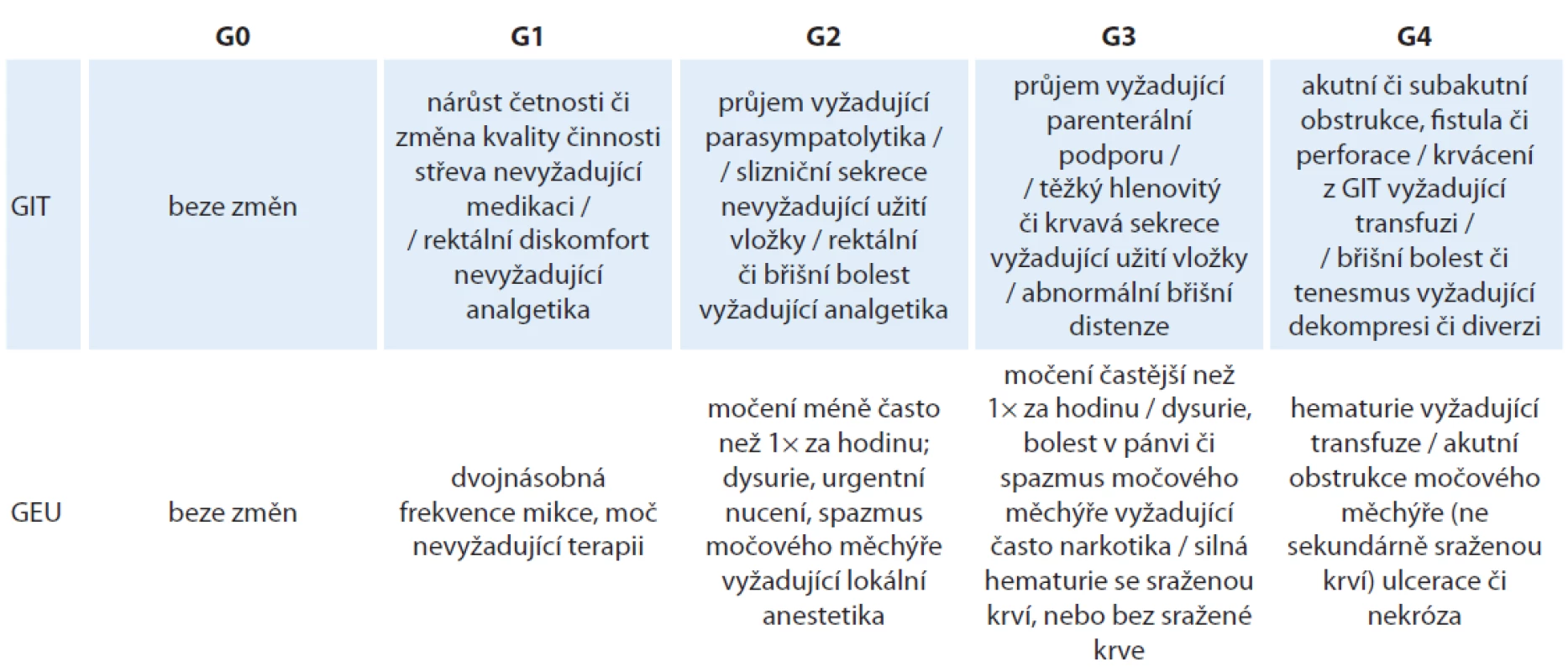
GEU – genito-urinární systém, GIT – gastrointestinální trakt, RTOG/EORTC – Radiation Therapy Oncology Group / European Organisation for Research and Therapy of Cancer Chronická toxicita
Chronická toxicita byla hodnocena podle Radiation Therapy Oncology Group / Fox Chase Cancer Centre (RTOG/ FC-LENT), které považujeme za podrobnější než systém RTOG/ EORTC (tab. 4). Do hodnocení chronické toxicity byli zařazeni pouze pacienti s dobou sledování alespoň 1 rok. Jejich počet je proto nižší než u pacientů hodnocených pro akutní toxicitu. U některých pacientů s vyšším stupněm toxicity byl zaznamenán ústup potíží ať spontánně, nebo v důsledku léčebného zásahu (nejčastěji laserová koagulace). Medián doby sledování je 5,1 roku. Zcela bez chronických GEU potíží bylo 71 % pacientů, toxicita G1 byla zaznamenána u 21 %, G2 u 5 %, G3 u 1 % a G4 u 2 % pacientů. U závažnějších stupňů toxicity se jednalo především o strikturu uretry vyžadující dilataci, inkontinenci nebo o nutnost dlouhodobého zavedení močového katétru. Zcela bez chronických GIT potíží bylo 83 % pacientů, toxicita G1 byla zaznamenána u 13 %, G2 u 11 %, u jednoho pacienta byla zaznamenána toxicita G3 (krvácení vyžadující více než tři koagulace). Výsledky toxicity shrnuje tab. 5.
Tab. 4. Hodnocení pozdních změn po ozáření podle RTOG/FC-LENT. 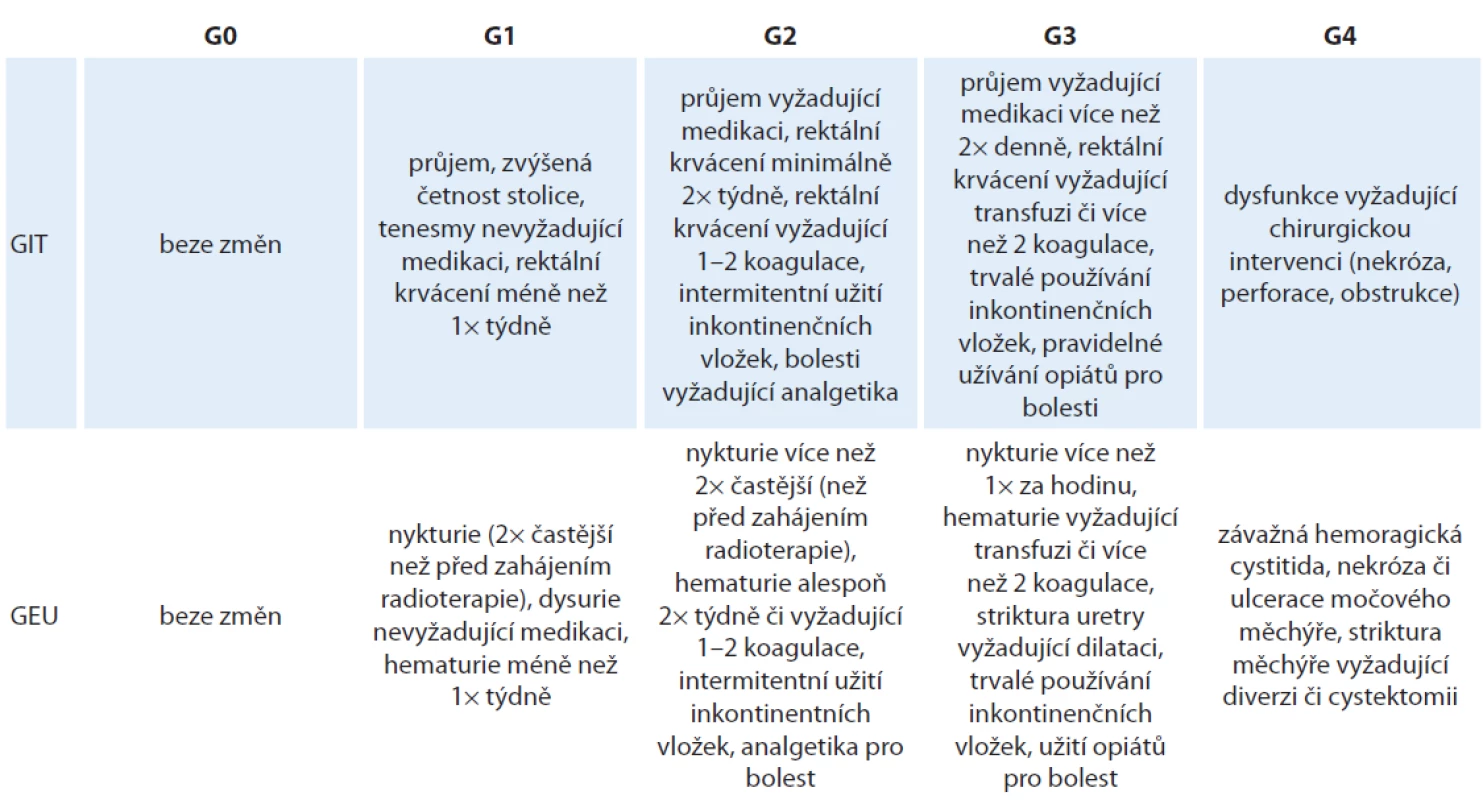
GEU – genito-urinární trakt, RTOG/FC-LENT – Radiation Therapy Oncology Group / Fox Chase Cancer Centre Tab. 5. Akutní a pozdní toxicita. 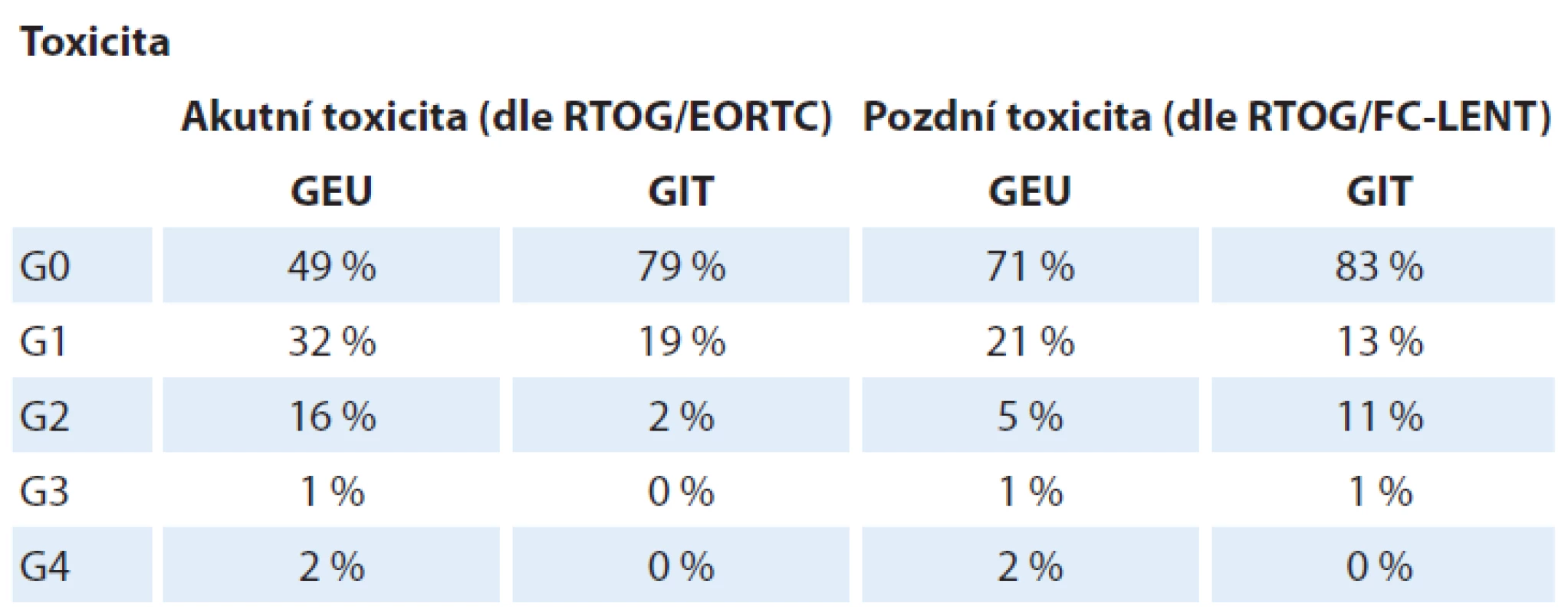
GEU – genito-urinární trakt, GIT – gastrointestinální trakt, RTOG/EORTC – Radiation Therapy Oncology Group / European Organisation for Research and Therapy of Cancer, RTOG/FC-LENT – Radiation Therapy Oncology Group / Fox Chase Cancer Centre Diskuze
Karcinom prostaty se od většiny ostatních nádorů liší svou citlivostí k vyšším dávkám záření charakterizovanou hodnotou konstanty á/ â v lineárně kvadratickém (LQ) modelu. Ten je obecně přijímanou rovnicí pro hodnocení biologického účinku dávky ionizujícího záření ve vztahu k celkové dávce, velikosti jednotlivé dávky a dané tkáně (nádoru či zdravé) charakterizované právě hodnotou á/ â. LQ model pro karcinom prostaty předpovídá, že pokud je RT prováděna dávkami vyššími než 2 Gy, mělo by dojít při stejné pravděpodobnosti lokální kontroly ke snížení výskytu pozdních nežádoucích účinků. To zatím nebylo prokázáno žádnou dostatečně velkou randomizovanou studií fáze III. Přesto jsou různé hypofrakcionované režimy již zahrnuty do standardů velkých organizací, jako je National Comprehensive Cancer Network (NCCN).
Přímé srovnání mezi studiemi je obtížné, neboť využívají různé techniky radioterapie (trojrozměrná konformní radioterapie, radioterapie s modulovanou intenzitou, objemově modulovaná radioterapie kyvem, helikální terapie, protonová léčba aj.), různé techniky obrazové navigace (IGRT), různé systémy hodnocení toxicity atd. Svůj význam pro akutní toxicitu může mít také zařazení různého počtu volných dní do ozařovacího schématu.
Řada observačních studií ukázala obdobné riziko akutní a pozdní toxicity ve srovnání s konvenční frakcionací. Několik randomizovaných studií si kladlo za cíl prokázat superioritu hypofrakcinačních režimů vůči konvenční frakcionaci [5–7]. Selhání těchto studií lze vysvětlit nedostatečnou statistickou silou zaznamenat malé rozdíly nebo nižší ekvivalentní biologickou dávkou v hypofrakcionovaném rameni [8].
V roce 2016 byly publikovány výsledky tří rozsáhlých, statisticky silných noninferioritních studií. Studie CHHiP (n = 3 216, medián follow-up = 62 měsíců) ukázala, že frakcionace 20 × 3,0 nemá horší výsledky než 39 × 2,0 Gy, dávka 19 × 3,0 Gy však takových výsledků již nedosahuje [9].
V roce 2016 byly publikovány výsledky tří rozsáhlých, statisticky. Frakcionaci 20 × 3,0 Gy tak doporučuje jako nový standard. Studie RTOG 0415 [10] (n = 1 115, medián follow-up = 69 měsíců) randomizovala pacienty nízkého rizika rekurence. Prokázala noninferioritu režimu 28 × 2,5 Gy oproti 41 × 1,8 Gy za určitého navýšení pozdní GIT a GEU toxicity. Studie PROFIT [11] (n = 1 206, medián follow up = 72 měsíců) randomizovala pacienty středního rizika rekurence. Jedna polovina pacientů byla ozařována dávkou 39 × 2,0 Gy, druhá pak dávkou 20 × 3,0 Gy. Byla zjištěna noninferiorita hypofrakcionovaného režimu. Současně nebyl zaznamenán vzestup pozdní toxicity. Souhrn nejdůležitějších studií uvádí tab. 6.
Tab. 6. Výběr randomizovaných studií prokazujících noninferiotitu hypofrakcionovaných režimů vůči konvenční frakcionaci. 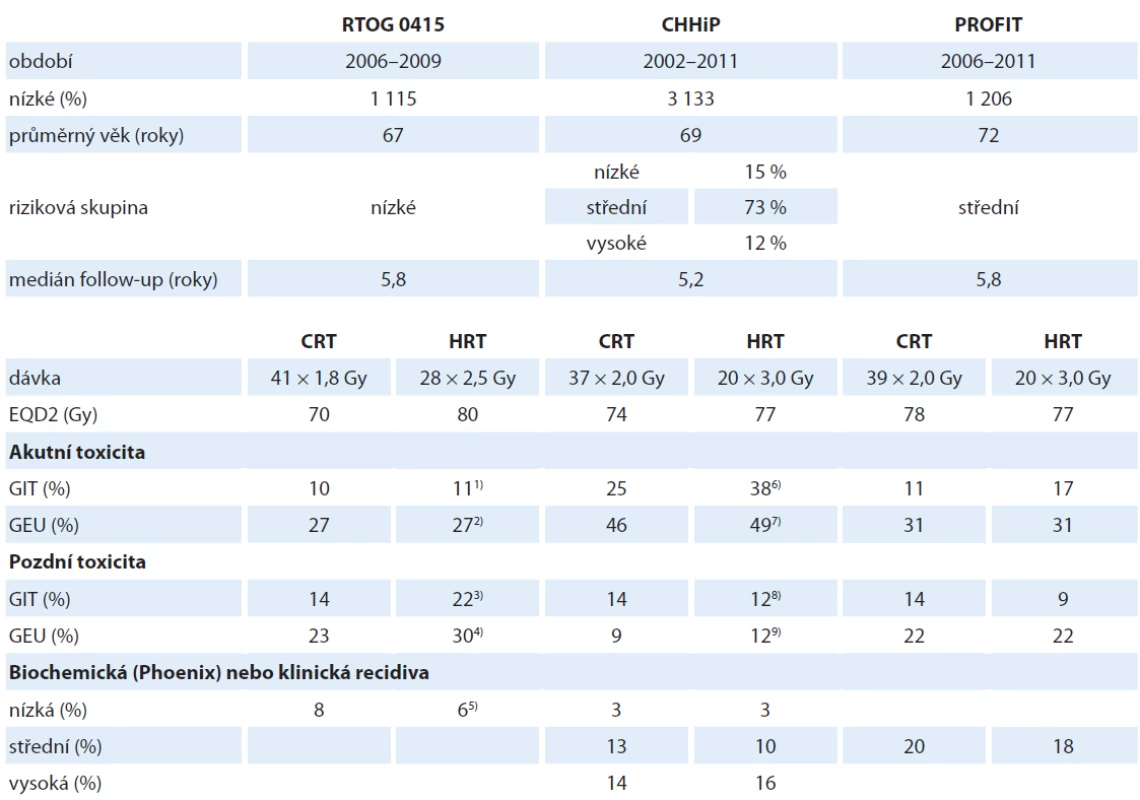
CRT – rameno s konvenční frakcionací, EQD2 – ekvivalentní dávka přepočtená na frakcionaci po 2 Gy, GEU – genito-urinární trakt, GIT – gastrointestinální trakt, HRT rameno s hypofrakcionací, n – počet účastníků.
1) p = 0,85, 2) p = 0,95, 3) p = 0,005, 4) p = 0,009, 5) p < 0,001, 6) p < 0,0001, 7) p = 0,34, 8) p = 0,65, 9) p = 0,07Závěr
Mírná hypofrakcionace 20–21 × 3,0 Gy s každodenní kontrolou cílového objemu a náplně močového měchýře a konečníku se jeví jako bezpečná metoda z hlediska akutní i pozdní toxicity.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products,
or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do
biomedicínských časopisů.The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical
papers.MUDr. Pavel Krupa, Ph.D.
Klinika radiační onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: krupa@mou.cz
Obdrženo/Submitted: 29. 2. 2019
Přijato/Accepted: 15. 6. 2020
Zdroje
1. Vogelius IR, Bentzen SM. Dose response and fractionation sensitivity of prostate cancer after external beam radiation therapy: A meta-analysis of randomized trials. Int J Radiat Oncol Biol Phys 2018;100(4): 858–865. doi:10.1016/ j.ijrobp.2017.12.011.
2. Matula P, Koncik J, Dubinsky P et al. Biogray – a tool for simultaneous modelling Tcp/ Ntcp; evaluation of Dvh and Quantec data. Radiother Oncol 2011; 98(0): S26. doi:10.1016/ s0167-8140(11)71766-2.
3. Schmidt WFO, Wegerer J, Riedmann E. Biogray – a biological radiation treatment planning programme. Experiences and comments. Strahlentherapie Und Onkol 2006; 182 : 200–201.
4. Krupa P, Ticha H, Kazda T et al. Early toxicity of hypofractionated radiotherapy for prostate cancer. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2016; 160(3): 435–441. doi:10.5507/ bp.2016.008.
5. Hoffman KE, Voong KR, Pugh TJ et al. Risk of late toxicity in men receiving dose-escalated hypofractionated intensity modulated prostate radiation therapy: results from a randomized trial. Int J Radiat Oncol 2014; 88(5): 1074–1084. doi:10.1016/ j.ijrobp.2014.01.015.
6. Pollack A, Walker G, Horwitz EM et al. Randomized trial of hypofractionated external-beam radiotherapy for prostate cancer. J Clin Oncol 2013; 31(31): 3860–3868. doi:10.1200/ JCO.2013.51.1972.
7. Incrocci L, Wortel RC, Alemayehu WG et al. Hypofractionated versus conventionally fractionated radiotherapy for patients with localised prostate cancer (HYPRO): final efficacy results from a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol 2016; 17(8): 1061–1069. doi:10.1016/ S1470-2045(16)30070-5.
8. Royce TJ, Lee DH, Keum NN et al. Conventional versus hypofractionated radiation therapy for localized prostate cancer: a meta-analysis of randomized noninferiority trials. Eur Urol Focus 2019; 5(4): 577–584. doi:10.1016/ j.euf.2017.10.011.
9. Dearnaley D, Syndikus I, Mossop H, et al. Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol 2016; 17 : 1047–1060. doi: 10.1016/ S1470-2045(16)30102-4.
10. Lee WR, Dignam JJ, Amin MB et al. Randomized phase III noninferiority study comparing two radiotherapy fractionation schedules in patients with low-risk prostate cancer. J Clin Oncol 2016; 34(20): 2325–2332. doi:10.1200/ JCO.2016.67.0448.
11. Catton CN, Lukka H, Gu CS et al. Randomized trial of a hypofractionated radiation regimen for the treatment of localized prostate cancer. J Clin Oncol 2017; 35(17): 1884–1890. doi:10.1200/ JCO.2016.71.7397.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo Suppl 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Genová terapie v radiační onkologii
- Prostorová analýza recidiv glioblastomů v závislost na taktice adjuvantní radioterapie (stanovení cílových objemů dle RTOG vs. EORTC): představení akademické studie
- Výživa během radioterapie u onkologických pacientů
- Rádiobiologické aspekty reožarovania a ich modelovanie pri stanovení tolerančnej dávky u orgánov v riziku
- Postavení radioterapie v léčbě karcinomu
- Sekundární nádory a radioterapie
- Onkologie využívá paprsky X už 125 let…
- Strava a její vliv na karcinom prostaty, se zaměřením na rostlinnou stravu
- Ozařování pacientů s implantovanými elektronickými přístroji
- Cyberknife boost 5–10 Gy u lokálně pokročilých karcinomů nazofaryngu
- TSEI u pacientů s mycosis fungoides – klinické výsledky
- Hypofrakcionovaná akcelerovaná radioterapie karcinomu prostaty
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sekundární nádory a radioterapie
- Výživa během radioterapie u onkologických pacientů
- Strava a její vliv na karcinom prostaty, se zaměřením na rostlinnou stravu
- TSEI u pacientů s mycosis fungoides – klinické výsledky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



