-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam membránových proteinů v léčbě nádorových onemocnění a možnosti jejich dalšího studia
Importance of Membrane Proteins in the Treatment of Tumor Diseases and the Possibilities of Their Further Study
Background:
The proteins of the cellular cytoplasmic membrane represent a heterogeneous group of proteins with different structures, localizations, and functions. They participate in many cellular processes including cellular signaling and communication with the external environment and communication between cells. Mutations and post-translational modifications alter the chemical-physical properties of membrane proteins and thus significantly affect the process of carcinogenesis. Therefore, membrane proteins represent important targets for the diagnosis and treatment of cancer. Nowadays, treatment in the form of monoclonal antibodies or low molecular weight inhibitors targets mainly receptors of growth factors on the surface of tumor cells and various types of molecules including the targets of the so-called checkpoint inhibitors on the surface of the cells of the immune system. In order to better understand the properties and functions of membrane proteins, especially with the perspective of developing new targeted approaches in therapy, mainly proteomic and molecular biological approaches are currently being used.
Aim:
The aim of this article is to describe the properties and functions of different groups of membrane proteins and to summarize their current relevance and potential for use in oncology. Attention is focused on those groups that regulate the proliferation of tumor cells, affect the immune response, cause drug resistance and metastasis, and are already used or accepted as potential targets of biological therapy. Glycosylation and phosphorylation are described in detail as the most studied post-translational modification of membrane proteins, and mass spectrometry is presented as an effective tool for the identification and quantification of membrane proteins.
Key words:
membrane proteins – glycosylation – phosphorylation – proteomic analysis – targeted therapy
This work was supported by the project MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Accepted: 3. 8. 2018
Autoři: Dosedělová Lenka; Nekulová Marta; Zahradníková Martina; Faktor Jakub; Vojtěšek Bořivoj; Hernychová Lenka
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2018; 31(Supplementum 2): 32-40
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20182S32Souhrn
Východiska:
Proteiny buněčné cytoplazmatické membrány představují heterogenní skupinu proteinů s odlišnou strukturou, lokalizací a funkcí. Účastní se mnoha buněčných procesů, mezi něž patří zprostředkování buněčné signalizace nebo komunikace s vnějším prostředím i mezi buňkami samotnými. Mutace a posttranslační modifikace mění fyzikálně-chemické vlastnosti membránových proteinů a tím výrazně zasahují i do procesu kancerogeneze. Membránové proteiny tak představují důležité cíle pro diagnostiku a léčbu nádorových onemocnění. V současnosti je cílená léčba v podobě monoklonálních protilátek nebo nízkomolekulárních inhibitorů namířena především na receptory růstových faktorů na povrchu nádorových buněk a různé typy molekul vč. cílů tzv. checkpoint inhibitorů na povrchu buněk imunitního systému. K lepšímu poznání vlastností a funkcí membránových proteinů v souvislosti s vývojem nových cílených přístupů v terapii jsou v současnosti intenzivně využívány proteomické a molekulárně biologické přístupy.
Cíl:
Cílem tohoto článku je přiblížit vlastnosti a funkce různých skupin membránových proteinů a přehledně shrnout jejich aktuální význam a potenciál využití v onkologii. Pozornost je zaměřena na ty skupiny proteinů, které se podílejí na regulaci proliferace nádorových buněk, ovlivňují imunitní odpověď, lékovou rezistenci a metastazování a představují již běžně využívané nebo potenciální cíle biologické léčby. Podrobněji jsou popsány glykosylace a fosforylace jako typické a nejvíce prostudované posttranslační modifikace membránových proteinů a dále hmotnostní spektrometrie jako efektivní nástroj pro identifikaci a kvantifikaci membránových proteinů.
Klíčová slova:
membránové proteiny – glykosylace – fosforylace – proteomická analýza – cílená léčba
Úvod
Jako membránové se označují všechny proteiny, které procházejí jakoukoliv membránou v buňce nebo jsou s ní asociovány. Představují asi 30 % z celkového počtu lidských proteinů [1] a jsou nezbytné pro zprostředkování buněčné signalizace, interakcí mezi buňkami a interakcí buněk s okolním prostředím [2]. Z hlediska nádorové biologie mají největší význam proteiny lokalizované ve vnější buněčné cytoplazmatické membráně, které hrají důležitou roli v průběhu vzniku a progrese primárního nádoru a při metastazování nádorových buněk [2]. Studium membránových proteinů se tak ukázalo být nezbytné pro pochopení procesu kancerogeneze a získané poznatky mohou být využity v cílené léčbě nádorových onemocnění.
V obraně proti nádorovým buňkám je důležité zapojení imunitního systému. Imunitní reakce proti nádorové buňce vzniká, pokud jsou na povrchu buňky prezentovány nádorové antigeny. V případě, že jsou nádorové buňky podobné buňkám normálním, jsou imunitním systémem tolerovány. V mechanizmech úniku nádorových buněk před imunitní odpovědí hrají podstatnou úlohu membránové proteiny, které jsou nádorovými buňkami využívány např. při ztrátě imunogenicity (expresí povrchových ligandů inhibujících T lymfocyty imunitního systému, např. PD-L1) nebo při ztrátě antigenicity (snížením exprese či mutací imunogenních nádorových antigenů, např. změnou funkce hlavního imunohistokompatibilního systému) [3]. Kromě změny exprese povrchových proteinů důležitých pro reakci imunitního systému mohou mít nádorové buňky i pozměněnou expresi receptorů růstových faktorů (např. zvýšená exprese receptoru 2 pro lidský epidermální růstový faktor (human epidermal growth factor receptor-2 – HER2) u karcinomu prsu) nebo povrchových strukturních proteinů (např. ztráta adhezních molekul v procesu metastazování) [4].
Membránové proteiny lze rozdělit do skupin na základě jejich lokalizace, funkce či struktury [1]. Podle rozdílného napojení na fosfolipidovou dvojvrstvu cytoplazmatické membrány se dále dělí na periferní a integrální (jejich lokalizace je znázorněna na obr. 1). Integrální membránové proteiny ve většině případů interagují s fosfolipidovou dvojvrstvou, některé se připojují pouze k jedné vrstvě fosfolipidů (proteiny ukotvené lipidy). Periferní membránové proteiny neinteragují s hydrofobní částí fosfolipidové membrány a vážou se pomocí specifických protein-proteinových interakcí [5].
Obr. 1. Struktura cytoplazmatické membrány a umístění periferních a integrálních membránových proteinů. Cytoplazmatická membrána je tvořena dvěma fosfolipidovými vrstvami. Jejich hydrofobní vnitřní část je tvořena řetězci mastných kyselin a polární část představují hydrofi lní hlavičky fosfolipidů. Integrální (transmembránové) proteiny interagují s hydrofobní částí fosfolipidové membrány, periferní membránové proteiny s touto částí neinteragují. 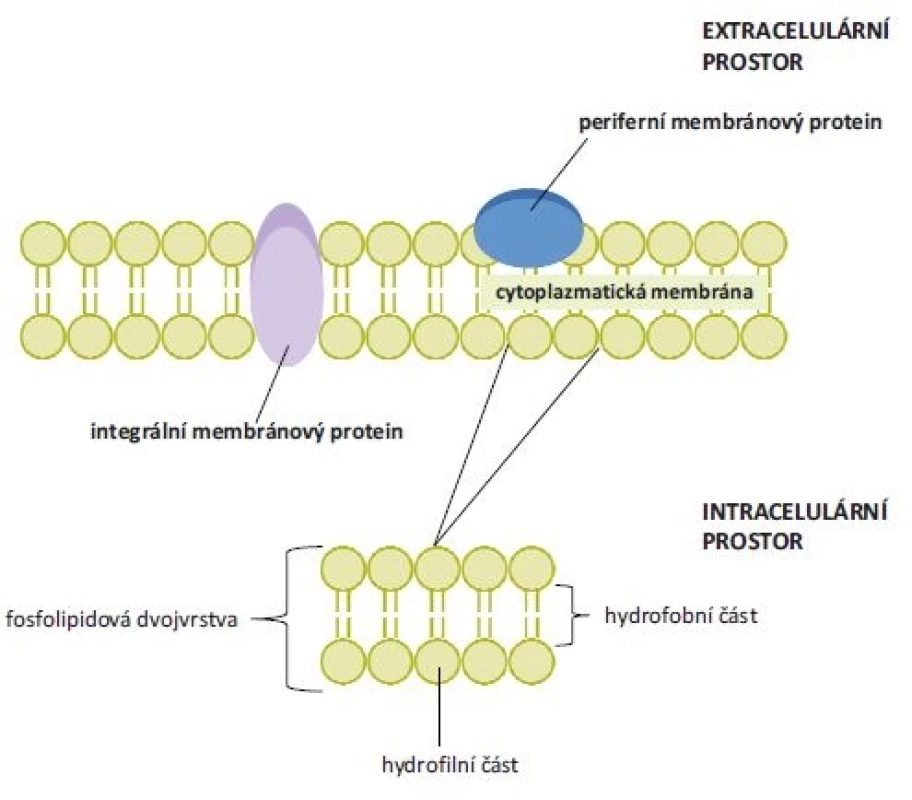
Dle funkce lze membránové proteiny dělit do několika základních skupin – 1. receptory spojené s a) G-proteiny, b) iontovými kanály a c) tyrozinkinázami; 2. transportní proteiny; 3. strukturní proteiny a 4. proteiny s enzymatickou aktivitou (obr. 2) [1].
Obr. 2. Rozdělení membránových proteinů podle funkce. Membránové receptory přenáší signál z extracelulárního prostoru dovnitř buňky po navázání ligandu. Transportní membránové proteiny tvoří hydrofilní kanály procházející cytoplazmatickou membránou, k přenosu látek mohou využívat energii z hydrolýzy adenozintrifosfátu. Membránové proteiny s enzymatickou aktivitou se podle polohy enzymaticky aktivního místa mohou označovat jako ektoenzymy či endoenzymy (na obrázku znázorněn ektoenzym). Strukturní membránové proteiny zajišťují protein-proteinové a protein-lipidové interakce. 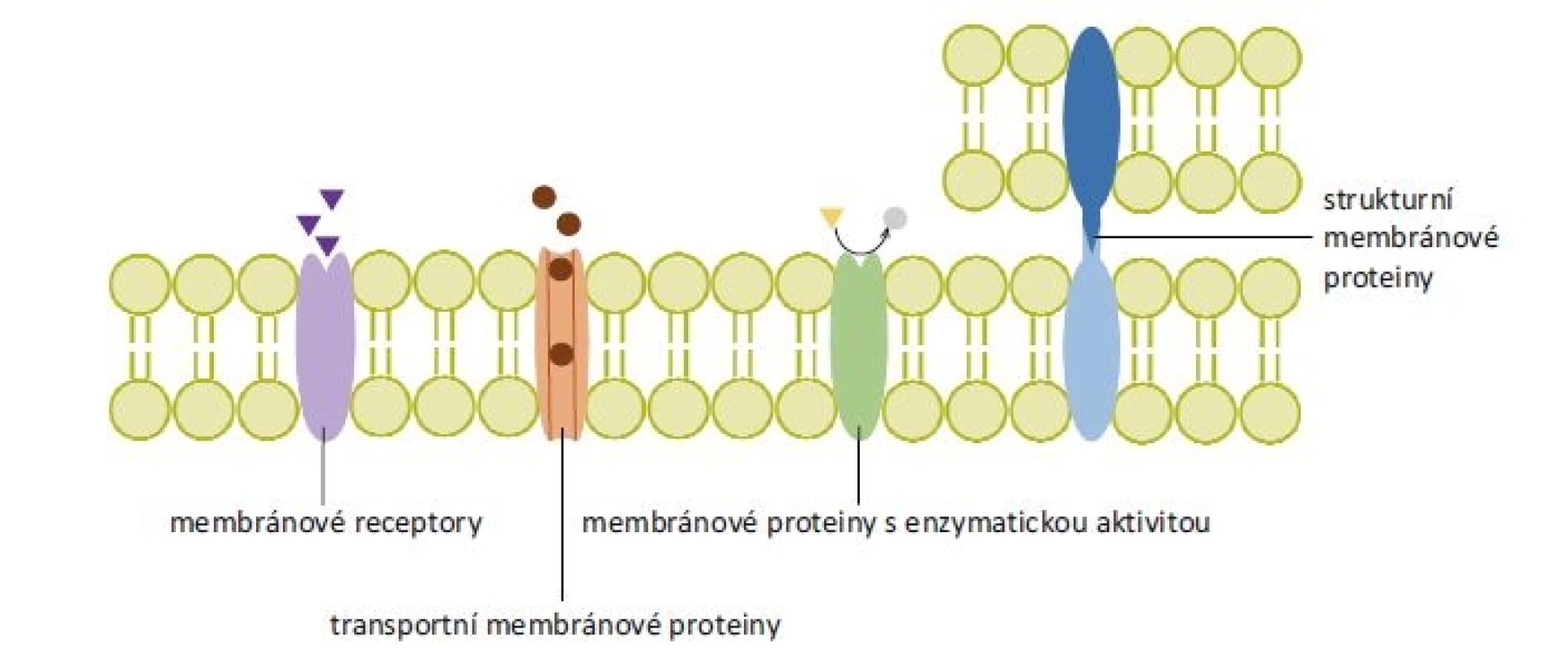
Membránové proteiny a jejich význam
Nejlépe charakterizovanou skupinou membránových proteinů jsou receptory spojené s G-proteiny, iontovými kanály a tyrozinkinázami [1]. Receptory spojené s tyrozinkinázami jsou hlavními mediátory signálních drah, přenášejí extracelulární signál do buňky a řídí např. buněčnou diferenciaci a proliferaci [6]. Typickým znakem nádorových buněk je zvýšená proliferace, která nastává mimo jiné v důsledku nadměrné aktivace těchto receptorů. Ta je obvykle způsobena různými typy mutací, příkladem jsou receptory pro růstové faktory, jako je EGFR (epidermal growth factor receptor), HER2, VEGFR (vascular endothelium growth factor receptor), PDGFR (platelet-derived growth factor receptor) a IGFR (insulin-like growth factor 1 receptor). Druhá možnost, která vede ke konstitutivní aktivaci těchto receptorů a následnému neregulovanému růstu buněk, je nadměrná produkce jejich ligandů, tj. růstových faktorů [6]. Cílem léčby zaměřené na tento typ membránových proteinů je inhibice receptorů spojených s tyrozinkinázami pomocí monoklonálních protilátek, antagonistických ligandů nebo nízkomolekulárních inhibitorů tyrozinkinázové aktivity [6]. Příklady léčiv zaměřených na tento typ receptorů jsou dnes už běžně používané monoklonální protilátky trastuzumab (Herceptin®), cetuximab (Erbitux®) a panitumumab (Vectibix®). Ke známým zástupcům nízkomolekulárních inhibitorů patří např. gefitinib (Iressa®), lapatinib (Tykerb®, Tyverb®), sunitinib (Sutent®), sorafenib (Nexavar®) a další (kompletní přehled všech monoklonálních protilátek a nízkomolekulárních inhibitorů schválených The Food and Drug Administration (FDA) nebo The European Medicines Agency (EMA) pro použití v onkologii je uveden v tab. 1 a tab. 2).
Tab. 1. Monoklonální protilátky schválené FDA nebo EMA pro použití v onkologii [52–54]. ![Tab. 1. Monoklonální protilátky schválené FDA nebo EMA pro použití v onkologii [52–54].](https://pl-master.mdcdn.cz/media/image/e428951f437c0ba867f761aae491309a.jpeg?version=1539694058)
Tab. 1 – pokračování. Monoklonální protilátky schválené FDA nebo EMA pro použití v onkologii [52–54]. ![Tab. 1 – pokračování. Monoklonální protilátky schválené FDA nebo EMA pro použití v onkologii [52–54].](https://pl-master.mdcdn.cz/media/image/ecdcf3859b7876cc37b5abb5efc88f99.jpeg?version=1539694069)
FDA – Food and Drug Administration, EMA – European Medicines Agency, mBC – metastatický karcinom prsu, mNSCLC – metastatický nemalobuněčný karcinom plic, mCRC – metastatický kolorektální karcinom, MM – mnohočetný myelom, CLL – chronická lymfocytární leukemie, ALL – akutní lymfoblastická leukemie, AML – akutní myeloidní leukemie, RCC – karcinom ledviny Tab. 2. Nízkomolekulární inhibitory tyrozin kinázových receptorů schválené FDA pro použití v onkologii [53,55]. ![Tab. 2. Nízkomolekulární inhibitory tyrozin kinázových receptorů schválené FDA pro použití v onkologii [53,55].](https://pl-master.mdcdn.cz/media/image/fc2ba12537e02d7d70df656d45064992.jpeg?version=1539694082)
FDA – Food and Drug Administration, NSCLC – nemalobuněčný karcinom plic, RCC – karcinom ledviny, mCRC – metastatický kolorektální karcinom, BC – karcinom prsu, AML – akutní myeloidní leukemie Ze skupiny membránových transportních proteinů mají v onkologii význam především tzv. ABC (ATP-binding cassette) transportéry. Jedná se o transmembránové proteiny, které využívají energii z rozkladu adenozintrifosfátu (adenosine triphosphate – ATP) pro přenos různých substrátů přes buněčnou membránu. Transportéry ze skupiny ABC B jsou zodpovědné za vznik tzv. mnohočetné lékové rezistence (multidrug resistence – MDR), tedy rezistence vůči léčivům s různou strukturou i funkcí. Léčiva jsou pomocí transportérů vylučována z buněk a dochází ke snížení jejich intracelulární hladiny, přičemž tuto lékovou rezistenci nelze překonat zvýšením dávky terapeutika [7]. Nejvíce studovanými proteiny, které se podílejí na vzniku rezistence, jsou ABCB1 (P-glycoprotein – MDR1), ABCC1 (multi drug resistance associated protein – MRP1) a ABCG2 (breast cancer resistance protein – BCRP) [8]. Jediným možným řešením takto vzniklé rezistence je nasazení jiného typu léčiva, které není substrátem pro ABC transportéry (např. alkylační látky nebo antimetabolity) nebo použití tzv. MDR modulátorů jako chemosenzibilizátorů. MDR modulátory jsou podávány společně s chemoterapeutikem a fungují převážně jako konkurenční substráty ABC transportérů. V současnosti pokračuje výzkum a klinické testování druhé generace MDR modulátorů, které by měly vykazovat vyšší účinnost a nižší toxicitu oproti MDR modulátorům první generace [7].
Významné cíle protinádorové léčby představují i tzv. CD (cluster of differentiation) molekuly. CD nomenklatura byla původně zavedena pro epitopy monoklonálních protilátek používaných pro imunofenotypizaci leukocytů, dnes je takto označována heterogenní skupina přibližně 400 membránových proteinů s různou strukturou a funkcí [9]. Pro označení CD je třeba prokázat, že danou molekulu vážou spolehlivě alespoň dvě monoklonální protilátky. Protože se jedná o molekuly na povrchu buněk dobře dostupné pro vazbu protilátek, jsou některé z nich vhodné pro cílenou léčbu zvláště v hematoonkologii (tab. 1). Typickým příkladem je CD20 na povrchu B lymfocytů, který je cílem monoklonálních protilátek, jako jsou např. rituximab, ofatumumab a obinutuzumab při léčbě B-buněčných lymfomů a leukemií (tab. 1).
Nádorové buňky mají vyvinuty různé mechanizmy, které jim umožňují uniknout imunitní odpovědi. Jedním z nich je exprese povrchových proteinů, které interagují s buňkami imunitního systému (T lymfocyty) a tím blokují jejich proliferaci a spouštějí apoptózu. V současnosti jsou intenzivně zkoumány a v onkologické léčbě stále více využívány tzv. checkpoint inhibitory. Jedná se o látky (obvykle monoklonální protilátky), které blokují interakce mezi nádorovými buňkami a buňkami imunitního systému a tím brání utlumení imunitní odpovědi. Jde především o zablokování interakce proteinu PD1 (programmed cell death 1, CD279) na povrchu lymfocytů a PD-L1 (programmed cell death-ligand 1, CD274) na povrchu nádorových buněk protilátkami nivolumab, pembrolizumab a atezolizumab (tab. 1). Na stejném principu funguje i blokáda CTLA-4 (cytotoxic T-lymphocyte associated antigen 4, CD152) protilátkou ipilimumab.
Také membránové strukturní proteiny mají svůj význam v onkologii, zatím se je však nepodařilo účinně využít pro cílenou léčbu. Jedná se především o tzv. buněčné adhezní molekuly (cell adhesion molecules – CAMs), jako jsou např. kadheriny, integriny nebo selektiny [1]. Změny ve složení a funkci adhezních molekul hrají zásadní roli v procesu metastazování. Podílejí se na regulaci buněčné adheze, migrace a invaze, ale i proliferace a apoptózy (integriny), na tvorbě mezibuněčných spojů, tvorbě krevních cév a jejich stabilizaci (kadheriny) [10], na vazbě sacharidových struktur, a tedy i na extravazaci nádorových buněk z krevního oběhu do tkáně (selektiny) [11]. Význam tohoto typu membránových proteinů potvrzuje i fakt, že v 90 % případů je příčinou úmrtí onkologických pacientů metastazování primárního nádoru a nikoliv samotný primární nádor [12]. V preklinických studiích byly testovány protilátky, specifické peptidy a dalších molekuly cílící na adhezní molekuly s cílem blokovat metastazování nádorových buněk, žádná z těchto látek však zatím není běžně používaná v klinické praxi [13–15].
Posttranslační modifikace
Posttranslační modifikace jsou kovalentní modifikace proteinů vznikající v průběhu nebo po ukončení jejich syntézy a ovlivňují jejich fyzikální a chemické vlastnosti, a tedy i stabilitu a molekulární funkce. Rozmanitost modifikací rozšiřuje spektrum funkčních vlastností proteinů a liší se u normálních a nádorových buněk [4]. Za posttranslační modifikace označujeme fosforylace, hydroxylace, glykosylace, alkylace, acylace, sumoylace, ubikvitinace, neddylace, ISGylace a další méně časté typy modifikací. Nejčastěji studovanými posttranslačními modifikacemi membránových proteinů v nádorové biologii jsou pak fosforylace a glykosylace.
Fosforylace proteinu vzniká kovalentním připojením zbytku kyseliny fosforečné k postranním řetězcům různých aminokyselin nejčastěji tyrozinu, serinu a threoninu. Jedná se o reverzibilní posttranslační modifikaci, která hraje klíčovou roli v regulaci buněčné signalizace a metabolizmu. Fosforylace je velice přísně regulovaná působením enzymů kináz a fosfatáz [16,17]. Fosfoproteiny jsou obecně přítomny v buňce jen ve velmi nízkých koncentracích, přesto reverzibilní fosforylace/defosforylace umožňuje buňce rychle reagovat na vnitřní a vnější stimuly. Pro nádorové buňky je typická abnormální fosforylace proteinů [18,19], projevující se např. konstitutivní aktivací receptorových tyrozinkináz [6]. Pro identifikaci nových, dosud nepopsaných fosfoproteinů a konkrétních změn fosforylace specifických pro nádorové buňky lze využít kvantitativní proteomickou analýzu [20].
Glykosylace je další častou posttranslační modifikací membránových proteinů, glykosylováno je až 70 % všech lidských proteinů [21]. Za glykoprotein je považován posttranslačně modifikovaný protein, k němuž jsou enzymaticky připojeny oligosacharidové struktury nazývané glykany. Proces glykosylace probíhá převážně v endoplazmatickém retikulu nebo Golgiho aparátu. Pro nádorové buňky je ve srovnání s normálními buňkami typická zvýšená produkce větvených glykanových struktur (tzv. tří a více antennární) a/nebo změněné hladiny glykoproteinů [22]. Za změny v glykosylačním profilu jsou nejčastěji odpovědné N-glykany, kovalentně vázané N-glykosidickou vazbou na dusík postranního řetězce asparaginu [22], a O-glykany, kovalentně připojené k postranní hydroxylové skupině serinu nebo threoninu [23]. Větvené glykany nabízejí více možností pro navázání sialové kyseliny, která obvykle ukončuje jednotlivé větve glykanové struktury [24,25]. Změny v sialylaci membránových proteinů nádorových buněk ovlivňují jejich interakce s dalšími buňkami a s extracelulární matrix a tím i schopnost metastazovat [26]. Zvýšená exprese terminální α-2-6 vázané sialové kyseliny v N-glykanech a sialyl-Lewis-X v O-glykanech (typicky v mucinózním typu O-glykanů) často koreluje se špatnou prognózou onemocnění, protože podporuje invazivitu a metastazování nádorových buněk [27–29].
Analyzovat glykanové struktury není jednoduchý úkol. Na rozdíl od proteinů probíhá syntéza glykanů beztemplátovým procesem a výsledná glykanová struktura je produktem působení mnoha vysoce specifických a striktně regulovaných glykosidáz a glykosyltransferáz. Nádorová buňka obvykle vykazuje významně pozměněnou expresi a aktivitu obou typů enzymů podílejících se na tvorbě glykanových struktur, čímž dochází ke zvýšení glykosylace a změně zastoupení jednotlivých glykanů. Nejvýznamnější změny byly zaznamenány u sialyltranferáz a fukosyltransferáz, jejichž produkty jsou polysialylované a polyfukosylované glykanové struktury. Dobře charakterizované jsou změny N-glykosylace v séru pacientek s diagnostikovaným karcinomem prsu spočívající v markantním nárůstu sialylace a fukosylace glykanových struktur ve srovnání se zdravou populací [30,31].
Velkou skupinu silně glykosylovaných proteinů syntetizovaných epiteliálními buňkami reprezentují muciny. Pro muciny je charakteristická vysoká molekulová hmotnost, z níž 50–80 % zaujímá hmotnost glykanů, nejčastěji O-glykanů. Muciny tvoří významnou komponentu mukózních sekretů, které pokrývají epiteliální buňky gastrointestinálního, urogenitálního, dýchacího, očního a sluchového systému, ale současně bývají nadměrně syntetizovány i u většiny karcinomů [32]. Některé muciny jsou vázané v plazmatické membráně díky svému hydrofobnímu charakteru. Většina z nich je však sekretována, a může proto sloužit jako ligand adhezních receptorů jako např. selektinů, které podporují schopnost nádorových buněk interagovat s hostitelskými leukocyty, endotelovými buňkami nebo s krevními destičkami [33].
Mnohé glykoproteiny jsou v klinické praxi využívány jako diagnostické markery nebo markery progrese nádorových onemocnění, např. prostatický specifický antigen (prostate-specific antigen – PSA) u karcinomu prostaty [34], CA125 (carcinoma antigen 125) v případě karcinomu vaječníku [35], CEA (carcinoembryonic antigen) u kolorektálního karcinomu [36], CA19-9 (carcinoma antigen 19-9) u metastatického karcinomu slinivky břišní [34] nebo MUC1 (mucin 1). Membránový protein MUC1 je ukotven na vnějším povrchu epiteliálních buněk a je nadměrně exprimován u nádorů prsu, tlustého střeva, plic, slinivky břišní nebo vaječníku, a to současně s vysokou produkcí zkrácených O-glykanových struktur [37]. Syntetický peptid odvozený od MUC1 představuje hlavní složku vakcíny Tecemotide (Stimuvax), která stimuluje imunitní odpověď proti nádorovým buňkám exprimujícím MUC1. Vakcína je v současné době hodnocena ve dvou studiích fáze III u nemalobuněčného karcinomu plic a u estrogen receptor-pozitivních karcinomů prsu [38].
Identifikace a studium membránových proteinů pomocí proteomických metod
Membránové proteiny na povrchu nádorových buněk byly dříve obvykle identifikovány pomocí monoklonálních protilátek. V současnosti je proteomika moderním nástrojem pro studium změn proteomu vč. exprese či posttranslačních modifikací membránových proteinů [39]. Vstupním materiálem pro izolaci a detekci membránových proteinů mohou být stabilní buněčné linie, primokultury, nádorová tkáň, sérum či další tělní tekutiny [4]. Samotná analýza membránových proteinů je rozdělena do několika kroků – 1. obohacení vzorku a purifikace proteinů, 2. solubilizace a 3. separace, identifikace a charakterizace. Základní purifikační metody jsou chemická precipitace [40] a hustotní gradientová ultracentrifugace [40]. Další možností purifikace nebo obohacení membránových proteinů je využití rozsáhlé glykosylace membránových proteinů (magnetické kuličky s konkanavalinem A), elektrostatických interakcí (kladně nabité křemíkové kuličky a záporně nabité proteiny plazmatické membrány), chemické značení intaktních membránových proteinů nebo např. inkorporace do polymerů [40–44].
Moderní metoda izolace membránových proteinů využívá vysoké afinity a specificity biotinu a glykoproteinu vaječného bílku avidinu nebo příbuzného bakteriálního proteinu streptavidinu. Membránové proteiny jsou označeny modifikovaným biotinem (aminooxy-biotin, sulfo-NHS-SS-biotin) [45] a následně precipitovány kuličkami s navázaným streptavidinem [46]. Výsledkem je vzorek obohacený o membránové proteiny, jejichž koncentrace by jinak byla nedostatečná pro další analýzu. Pro následnou solubilizaci membránových proteinů se nejčastěji používají detergenty (např. dodecylsíran sodný – SDS) [40]. V závislosti na typu použitého detergentu se mohou projevit různé nežádoucí účinky při dalším zpracování vzorku. Jedná se např. o interferenci s kapalinovou chromatografií, inaktivaci proteázy během enzymatického štěpení, potlačení ionizace peptidů či kontaminace hmotnostního spektrometru [47]. Detergenty je tedy nutné před použitím tandemové hmotnostní spektrometrie (liquid chromatography-tandem mass spectrometry – LC-MS/MS) ze vzorku odstranit [40].
V posledním kroku separace, charakterizace a identifikace membránových proteinů se v případě proteomické analýzy obvykle využívá LC-MS/MS. Pro identifikaci a charakterizaci membránových proteinů lze použít dva hlavní proteomické přístupy. První přístup „top-down“ je založen na analýze proteinů nebo jednoduché proteinové směsi bez použití enzymatického štěpení. Naopak druhý „shotgun“ přístup se využívá pro identifikaci proteinů v komplexních biologických vzorcích a součástí tohoto přístupu je enzymatické štěpení všech proteinů s následným měřením na hmotnostním spektrometru [48].
Kvantifikaci membránových proteinů lze provést relativním nebo absolutním způsobem. V případě relativní kvantifikace lze porovnávat kvantitu proteinů dvou či více biologických systémů, např. metodou izotopového značení (label-based) [4,49]. Mezi label-based kvantifikační metody lze zařadit i metody s chemickým typem značení jako např. iTRAQ (isobaric tag for relative and absolute quantification) [49], TMT (tandem mass tag) [50] nebo často využívanou metodu s metabolickým typem značení SILAC (stable isotope amino acids in cell culture). Metodu SILAC lze aplikovat pouze na živé organizmy in vitro, in vivo nebo ex vivo. Modifikovanou formu tohoto typu izotopového značení, tzv. super-SILAC, lze využít i pro vzorky tkání [49]. Další možností relativní kvantifikace je i tzv. label-free metoda bez využití izotopového značení [51].
Druhý, absolutní způsob kvantifikace přímo určuje koncentraci analyzovaného proteinu [51]. Před samotnou analýzou je však nutné znát konkrétní protein/peptid, který má být kvantifikován [49], protože principem metody je využití izotopově značeného syntetického peptidu jako vnitřního standardu [51].
Kvantitativní proteomika je moderním a důležitým nástrojem pro identifikaci a charakterizaci membránových proteinů izolovaných z definovaných buněčných linií nebo biologického materiálu, a tedy přispívá k pochopení funkce s nimi spojených signálních drah, jejich zapojení do procesu metastazování či regulace imunitní odpovědi.
Závěr
V současnosti dochází v onkologii k intenzivnímu rozvoji cílené léčby, což potvrzuje mimo jiné i narůstající počet nově schválených léčebných preparátů a rozšiřující se spektrum nádorových onemocnění, pro která je cílená léčba dostupná. Proteiny vnější cytoplazmatické membrány zde hrají ústřední roli jako cíle tohoto typu léčby. Proteomické přístupy ke studiu membránových proteinů mohou přinést nové znalosti vlastností a funkcí membránových proteinů, které v budoucnosti přispějí k vývoji nových monoklonálních protilátek, syntetických peptidů a nízkomolekulárních inhibitorů umožňujících rozšířit personalizovanou léčbu nádorových onemocnění.
Tato práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Lenka Dosedělová
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: lenka.dosedelova@mou.cz
Přijato: 3. 8. 2018
Zdroje
1. Várady G, Cserepes J, Németh A et al. Cell surface membrane proteins as personalized biomarkers: where we stand and where we are headed. Biomark Med 2013; 7 (5): 803–819. doi: 10.2217/bmm.13.90.
2. Wu CC, Yates JR. The application of mass spectrometry to membrane proteomics. Nat Biotechnol 2003; 21 (3): 262–267. doi: 10.1038/nbt0303-262.
3. Beatty GL, Gladney WL. Immune escape mechanisms as a guide for cancer immunotherapy. Clin Cancer Res 2015; 21 (4): 687–692. doi: 10.1158/1078-0432.CCR-14-1860.
4. Leth-Larsen R, Lund RR, Ditzel HJ. Plasma membrane proteomics and its application in clinical cancer biomarker discovery. Mol Cell Proteomics 2010; 9 (7): 1369–1382. doi: 10.1074/mcp.R900006-MCP 200.
5. Lodish H, Berk A, Zipursky SL (eds). Molecular cell biology. 4. vydání. New York: W. H. Freeman 2000.
6. Bennasroune A, Gardin A, Aunis D et al. Tyrosine kinase receptors as attractive targets of cancer therapy. Crit Rev Oncol Hematol 2004; 50 (1): 23–38. doi: 10.1016/j.critrevonc.2003.08.004.
7. Choi CH. ABC transporters as multidrug resistance mechanisms and the development of chemosensitizers for their reversal. Cancer Cell Int 2005; 5 : 30. doi: 10.1186/1475-2867-5-30.
8. Fletcher JI, Haber M, Henderson MJ et al. ABC transporters in cancer: more than just drug efflux pumps. Nat Rev Cancer 2010; 10 (2): 147–156. doi: 10.1038/nrc2789.
9. Clark G, Stockinger H, Balderas R et al. Nomenclature of CD molecules from the tenth human leucocyte differentiation antigen workshop. Clin Transl Immunol 2016; 5 (1): e57. doi: 10.1038/cti.2015.38.
10. Blaschuk OW, Devemy E. Cadherins as novel targets for anti-cancer therapy. Eur J Pharmacol 2009; 625 (1–3): 195–198. doi: 10.1016/j.ejphar.2009.05.033.
11. Barthel SR, Gavino JD, Descheny L et al. Targeting selectins and selectin ligands in inflammation and cancer. Expert Opin Ther Targets 2007; 11 (11): 1473–1491. doi: 10.1517/14728222.11.11.1473.
12. Karhemo PR, Hyvönen M, Laakkonen P. Metastasis-associated cell surface oncoproteomics. Front Pharmacol 2012; 3 : 192. doi: 10.3389/fphar.2012.00192.
13. Bendas G, Borsig L. Cancer cell adhesion and metastasis: selectins, integrins, and the inhibitory potential of heparins. Int J Cell Biol 2012; 2012 : 676731. doi: 10.1155/2012/676731.
14. Okegawa T, Pong RC, Li Y et al. The role of cell adhesion molecule in cancer progression and its application in cancer therapy. Acta Biochim Pol 2004; 51 (2): 445 –457. doi: 035001445.
15. Huang YW, Baluna R, Vitetta ES. Adhesion molecules as targets for cancer therapy. Histol Histopathol 1997; 12 (2): 467–477.
16. Chong PK, Lee H, Kong JW et el. Phosphoproteomics, oncogenic signaling and cancer research. Proteomics 2008; 8 (21): 4370–4382. doi: 10.1002/pmic.200800051.
17. Sefton BM. Current Protocols in Cell Biology. 1. vydání. West Sussex: John Wiley & Sons 1998.
18. Castellvi J, Garcia A, Ruiz-Marcellan C et al. Cell signaling in endometrial carcinoma: phosphorylated 4E-binding protein-1 expression in endometrial cancer correlates with aggressive tumors and prognosis. Hum Pathol 2009; 40 (10): 1418–1426. doi: 10.1016/j.humpath. 2008.
19. McArdle L, Rafferty M, Maelandsmo GM et al. Protein tyrosine phosphatase genes downregulated in melanoma. J Invest Dermatol 2001; 117 (5): 1255–1260. doi: 10.1046/j.0022-202x.2001.01534.x.
20. Pjechová M, Hernychová L, Tomašec P et al. Analysis of phosphoproteins and signalling pathways by quantitative proteomics. Klin Onkol 2014; 27 (Suppl 1): 116–120. doi: 10.14735/amko20141S116.
21. Mechref Y, Muddiman DC. Recent advances in glycomics, glycoproteomics and allied topics. Anal Bioanal Chem 2017; 409 (2): 355–357. doi: 10.1007/s00216-016-0093-9.
22. Helenius A, Aebi M. Intracellular functions of N-linked glycans. Science 2001; 291 (5512): 2364–2369.
23. Li H, d’Anjou M. Pharmacological significance of glycosylation in therapeutic proteins. Curr Opin Biotechnol 2009; 20 (6): 678–684. doi: 10.1016/j.copbio.2009.10.009.
24. Blomme B, Van Steenkiste C, Callewaert N et al. Alteration of protein glycosylation in liver diseases. J Hepatol 2009; 50 (3): 592–603. doi: 10.1016/j.jhep.2008.12.010.
25. Kim YJ, Varki A. Perspectives on the significance of altered glycosylation of glycoproteins in cancer. Glycoconj J 1997; 14 (5): 569–576.
26. Schultz MJ, Swindall AF, Bellis SL. Regulation of the metastatic cell phenotype by sialylated glycans. Cancer Metastasis Rev 2012; 31 (3–4): 501–518. doi: 10.1007/s10555-012-9359-7.
27. Seales EC, Jurado GA, Brunson BA et al. Hypersialylation of beta1 integrins, observed in colon adenocarcinoma, may contribute to cancer progression by up-regulating cell motility. Cancer Res 2005; 65 (11): 4645–4652. doi: 10.1158/0008-5472.CAN-04-3117.
28. Hedlund M, Ng E, Varki A et al. alpha 2-6-Linked sialic acids on N-glycans modulate carcinoma differentiation in vivo. Cancer Res 2008; 68 (2): 388–394. doi: 10.1158/0008-5472.CAN-07-1340.
29. Varki NM, Varki A. Diversity in cell surface sialic acid presentations: implications for biology and disease. Lab Investig 2007; 87 (9): 851–857. doi: 10.1038/labinvest.3700656.
30. Kyselova Z, Mechref Y, Kang P et al. Breast cancer diagnosis and prognosis through quantitative measurements of serum glycan profiles. Clin Chem 2008; 54 (7): 1166–1175. doi: 10.1373/clinchem.2007.087148.
31. Arnold JN, Saldova R, Hamid UM et al. Evaluation of the serum N-linked glycome for the diagnosis of cancer and chronic inflammation. Proteomics 2008; 8 (16): 3284–3293. doi: 10.1002/pmic.200800163.
32. Hollingsworth MA, Swanson BJ. Mucins in cancer: protection and control of the cell surface. Nat Rev Cancer 2004; 4 (1): 45–60. doi: 10.1038/nrc1251.
33. Fuster MM, Esko JD. The sweet and sour of cancer: glycans as novel therapeutic targets. Nat Rev Cancer 2005; 5 (7): 526–542. doi: 10.1038/nrc1649.
34. Maryáš J, Faktor J, Dvořáková M et al. Proteomics in investigation of cancer metastasis: functional and clinical consequences and methodological challenges. Proteomics 2014; 14 (4–5): 426–440. doi: 10.1002/pmic.201300264.
35. Streppel MM, Vincent A, Murkerjee R et al. Mucin 16 (cancer antigen 125) expression in human tissues and cell lines and correlation with clinical outcome in adenocarcinomas of the pancreas, esophagus, stomach, and colon. Hum Pathol 2012; 43 (10): 1755–1763. doi: 10.1016/j.humpath.2012.01.005.
36. Duffy MJ. Carcinoembryonic antigen as a marker for colorectal cancer: is it clinically useful? Clin Chem 2001; 47 (4): 624–630.
37. Burchell JM, Mungul A, Taylor-Papadimitriou J. O-linked glycosylation in the mammary gland: changes that occur during malignancy. J Mammary Gland Biol Neoplasia 2001; 6 (3): 355–364.
38. Sangha R, Butts C. L-BLP25: a peptide vaccine strategy in non small cell lung cancer. Clin Cancer Res 2007; 13 (15 Pt 2): s4652–s4654. doi: 10.1158/1078-0432.CCR-07-0213.
39. Mermelekas G, Zoidakis J. Mass spetrometry-based membrane proteomics in cancer biomarker discovery. Expert Rev Mol Diagn 2014; 14 (5): 549–563. doi: 10.1586/14737159.2014.917965.
40. Cordwell SJ, Thingholm TE. Technologies for plasma membrane proteomics. Proteomics 2010; 10 (4): 611–627. doi: 10.1002/pmic.200900521.
41. Lee YC, Block G, Chen H et al. One-step isolation of plasma membrane proteins using magnetic beads with immobilized concanavalin A. Protein Expr Purif 2008; 62 (2): 223–229. doi: 10.1016/j.pep.2008.08.003.
42. Kim Y, Elschenbroich S, Sharma P et al. Use of colloidal silica-beads for the isolation of cell-surface proteins for mass spectrometry-based proteomics. Methods Mol Biol 2011; 748 : 227–241. doi: 10.1007/978-1-61779-139-0_16.
43. Miki T, Fujishima S, Komatsu K et al. LDAI-based chemical labeling of intact membrane proteins and its pulse-chase analysis under live cell conditions. Chem Biol 2014; 21 (8): 1013–1022. doi: 10.1016/j.chembiol.2014.07.013.
44. Lee SC, Knowles TJ, Postis VL et al. A method for detergent-free isolation of membrane proteins in their local lipid environment. Nat Protoc 2016; 11 (7): 1149–1162. doi: 10.1038/nprot.2016.070.
45. Hörmann K, Stukalov A, Müller AC et al. A surface biotinylation strategy for reproducible plasma membrane protein purification and tracking of genetic and drug-induced alterations. J Proteomoe Res 2016; 15 (2): 647–658. doi: 10.1021/acs.jproteome.5b01066.
46. Rybak JN, Scheurer SB, Neri D et al. Purification of biotinylated proteins on streptavidin resin: a protocol for quantitative elution. Proteomics 2004; 4 (8): 2296–2299. doi: 10.1002/pmic.200300780.
47. Vít O, Petrák J. Integral membrane proteins in proteomics. How to break open the black box? J Proteomics 2017; 153 : 8–20. doi: 10.1016/j.jprot.2016.08.006.
48. Dvořáková P, Hernychová L, Vojtěšek B. Analysis of Protein Using Mass Spectrometry. Klin Onkol 2014; 27 (Suppl 1): 104–109. doi: 10.14735/amko20141S104.
49. Hernychová L, Dvořáková P, Michalová E et al. Quantitative mass spectrometry and its utilization in oncology. Klin Onkol 2014; 27 (Suppl 1): 98–103. doi: 10.14735/amko20141S98.
50. Gao W, Xu J, Wang F et al. Plasma membrane proteomic analysis of human Gastric Cancer tissues: revealing flotillin 1 as a marker for Gastric Cancer. BMC Cancer 2015; 15 : 367. doi: 10.1186/s12885-015-1343-5.
51. Schey KL, Grey AC, Nicklay JJ. Mass Spectrometry of membrane proteins: a focus on aquaporins. Biochemistry 2013; 52 (22): 3807–3817. doi: 10.1021/bi301604j.
52. actip.org. [online]. Monoclonal Antibodies Approved by the EMA and FDA for Therapeutic Use (status 2017). Avaible from: http: //www.actip.org/products/monoclonal-antibodies-approved-by-the-ema-and-fda-for-therapeutic-use/.
53. fda.gov. [online]. USA: U. S. Food and Drug Administration. Avaible from: https: //www.fda.gov/. https: //www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ default.htm
54. ema.europa.eu. [online]. European public assessment reports. Avaible from: http: //www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/landing/epar_search.jsp&mid=WC0b01ac058001d12.
55. brimr.org. [online] From the Blue Ridge Institute for Medical Research in Horse Shoe, North Carolina USA. Avaible from: http: //www.brimr.org/PKI/PKIs.htm.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2018 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Proteogenomická platforma na identifikáciu nádorovo špecifických antigénov
- Využití mitochondriálních procesů v cílené terapii nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Význam membránových proteinů v léčbě nádorových onemocnění a možnosti jejich dalšího studia
- Vliv metylace DNA na vznik nádorových onemocnění
- Úloha proteinu HSP70 v nádorech a jeho využití jako terapeutický cíl
- Variabilita buněčné populace solidních nádorů a její význam pro diagnostiku a terapii nádorových onemocnění
- Úloha proteínu HSF1 v nádorovej transformácii
- Proteíny HDM2 a HDMX v ľudských nádoroch
- Prima-1 a APR-246 v léčbě nádorových onemocnění
- Acetylsalicylová kyselina a její potenciál v chemoprevenci kolorektálního karcinomu
- Exprese a funkční charakterizace miR-34c u karcinomu děložního hrdla
- Subpopulace cirkulujících myeloidních supresových buněk u pacientů s kolorektálním karcinomem – explorativní analýza jejich potenciálu jako biomarkeru
- Současné metody analýzy mikroRNA
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv metylace DNA na vznik nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Současné metody analýzy mikroRNA
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



