-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Proteíny HDM2 a HDMX v ľudských nádoroch
HDM2 and HDMX Proteins in Human Cancer
Background:
HDM2 and HDMX proteins are key negative regulators of the tumor suppressor p53. Under normal conditions, p53 protein expression is maintained at a low level, whereas under stress conditions, this negative regulation is alleviated to increase the p53 level. HDM2 and HDMX are overexpressed in many cancer types, mainly in tumors with wild type p53, such as sarcomas. In addition to an inactivating mutation in the TP53 gene, HDM2 and HDMX overexpression represents another kind of p53 inactivation pathway.
Aim:
In this review, we first briefly describe the roles of HDM2 and HDMX proteins and then the increased occurrence of their overexpression and the possible causes of this overexpression in different human cancer types as well as therapeutic approaches targeting HDM2 and HDMX for the treatment of human cancer.
Conclusion:
HDM2 and HDMX are important therapeutic targets. The interruption of their negative effect on p53 pathway by compounds such as nutlins, leads to the reactivation of the p53 pathway. However, a deeper understanding of HDM2-HDMX-p53 structure and function will enable the identification of new therapeutic strategies that could help to provide more specific and more efficient therapies for cancer patients. Several small molecules and peptides are the subject of clinical testing in phase I, II and even III trials.
Key words:
HDM2 – HDMX – p53 signalling pathway – oncogenes – MDM2 – MDMX
This work was supported by the project MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Accepted: 16. 7. 2018
Autoři: Hároníková Lucia; Vojtěšek Bořivoj
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2018; 31(Supplementum 2): 63-70
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20182S63Souhrn
Východiská:
Proteíny HDM2 a HDMX sú hlavné negatívne regulátory tumorového supresoru p53. Ich úlohou je udržiavať nízku hladinu proteínu p53 za normálnych podmienok. V stresových podmienkach je však táto negatívna regulácia prerušená, čo umožní aktiváciu p53 dráhy. V mnohých ľudských nádoroch, ktoré si zachovávajú wild type p53, bola nájdená nadmerná expresia proteínov HDM2 a HDMX, ako napr. v sarkóme. A tak okrem inaktivujúcej mutácie v géne pre proteín p53, modulácia expresie proteínov HDM2 a HDMX predstavuje alternatívny mechanizmus inaktivácie signálnej dráhy p53.
Cieľ:
V tomto zhrnutí stručne predstavíme funkciu proteínov HDM2 a HDMX, zhrnieme informácie o zvýšenom výskyte proteínov HDM2 a HDMX v ľudských nádoroch, jeho možné príčiny a predstavíme rôzne prístupy k potenciálnej liečbe nádorov založenej na cielení na proteíny HDM2 a HDMX.
Záver:
HDM2 a HDMX sa stali zaujímavými cieľmi protinádorovej terapie, kedy prerušenie negatívnej regulácie p53 pomocou látok, ako napr. nutlinov, môže viesť k reaktivácii p53 odpovede a k potlačeniu rakovinového bujenia. Nové poznatky o funkcii a štruktúre proteínov HDM2, HDMX a p53 umožňujú návrh nových druhov terapeutík, čo môže prispieť k špecifickej liečbe a efektívnejšej odpovedi pacientov. Mnohé z látok sú už testované v rámci klinických štúdií fáze I, II a III.
Kľúčové slová:
HDM2 – HDMX – signálna dráha p53 – onkogény – MDM2 – MDMX
Úvod
Proteíny HDM2 (human double minute 2 proteín, nazývaný aj MDM2) a HDMX (human double minute X proteín, nazývaný aj MDMX, MDM4, HDM4) sú paralógne proteíny patriace do rodiny MDM (mouse double minute). Obidva proteíny hrajú nezastupiteľnú úlohu v regulácii stability p53, ale podieľajú sa aj na mnohých iných procesoch, ako napr. opravách poškodenej DNA, translačnej regulácii, regulácii ribozomálneho stresu [1]. Významný vplyv proteínov HDM2 a HDMX bol preukázaný in vivo na myších modeloch. Myši s MDM2–/ – a MDMX–/ – vykazovali veľmi skorú embryonálnu letalitu a zároveň bolo zistené, že tejto letalite sa dá zabrániť, pokiaľ je vyradený aj proteín p53 [2,3]. Sú to onkogénne proteíny, ktoré sú často nadmerne exprimované, najmä v tumoroch s wild type p53. Pri nadmernej expresii sú zodpovedné za nadmerné odbúravanie proteínu p53, obmedzenie jeho transkripčnej funkcie, ale spôsobujú aj genómovú nestabilitu a tým všetkým prispievajú ku vzniku nádorov. Dlhodobý výskum v oblasti MDM proteínov poukazuje na ich neprekrývajúce sa, ale doplňujúce sa funkcie v regulácií p53 signálnej dráhy a iných. Vďaka novým poznatkom sú vyvíjané liečivá, ktoré špecificky cielia na obmedzenie funkcie nie len HDM2 proteínu, ale aj HDMX.
Funkcia proteínov HDM2 a HDMX
Najlepšie preštudovanou a pravdepodobne aj najdôležitejšou úlohou proteínov HDM2 a HDMX je ich regulácia proteínu p53, a to skrz vplyv na stabilitu, ale aj transkripčnú aktivitu proteínu p53. Hladina proteínu p53 musí byt prísne regulovaná v závislosti na podmienkach. V normálnych podmienkach je potrebné, aby bola hladina p53 nízka a bunka mohla prechádzať bunkovým cyklom. V tomto prípade proteíny HDM2 a HDMX interagujú s proteínom p53 a spôsobujú jeho proteazomálnu degradáciu. Proteín HDM2 svojou E3-ligázovou aktivitou v súčinnosti s E2-ligázou katalyzuje polyubikvitináciu proteínu p53 na lyzínoch v DNA-väzbovej a C-terminálnej doméne. Takto označený proteín p53 je odbúraný pomocou proteazómu [4]. Proteín HDMX nie je funkčnou E3 ligázou, ale svojou schopnosťou tvoriť heterodiméry s proteínom HDM2 priamo zvyšuje účinnosť ubikvitinácie proteínu p53 [5,6]. Ďalší mechanizmus, akým môže HDM2 a HDMX ovplyvniť funkciu p53, je skrz blokovanie transkripčnej aktivity p53. Proteín HDM2 aj HDMX sa viaže do N-terminálnej transaktivačnej domény p53. Naviazanie proteínu HDM2 skrz transaktivačnú doménu p53 blokuje možnosť proteínu p53 viazať sa s transkripčnou mašinériou [7,8]. Avšak s využitím myších modelov, ktoré exprimovali HDM2 s mutovanou RING (really interesting new gene) doménou bez schopnosti ubikvitinácie, bolo preukázané, že hlavný mechanizmus, akým HDM2 potláča funkciu p53, je skrz jeho odbúravanie cez proteazóm, a nie cez blokovanie transkripčnej aktivity [9]. Proteín HDMX sa viaže s proteínom p53 taktiež cez svoju N-terminálnu doménu. Tejto väzbe bola taktiež pripisovaná schopnosť blokovať transkripčnú aktivitu proteínu p53 [10]. Neskôr boli identifikované aj interakcie ďalších domén vedúcich k ovplyvneniu transkripčnej aktivity proteínu p53, a to kyslej domény HDM2 a DNA-väzbovej domény p53 [11,12] a taktiež kyslej domény HDMX a DNA-väzbovej domény p53, čo vedie k inhibícii väzby p53 k DNA [13]. Interakcia HDM2-HDMX-p53 je veľmi komplexná a je závislá na alosterických zmenách všetkých troch proteínov [14].
V prípade stresových podmienok, ako je napr. poškodenie DNA, je potrebné, aby sa rýchlo zvýšila hladina proteínu p53 a ten mohol vykonať svoju funkciu (zastavenie bunkového cyklu v prípade menšieho poškodenia alebo vyvolanie apoptózy v prípade väčšieho poškodenia). V tomto prípade je nevyhnutné, aby bola interakcia p53 s proteínmi HDM2 a HDMX prerušená. V prípade poškodenia DNA je aktivovaná ATM kináza (ataxia-telangiectasia mutated), ktorá vedie k fosforylácii proteínu p53 na Ser15 a proteínov HDM2 na Ser395 a HDMX na Ser403. Proteíny HDM2 a HDMX sú po fosforylácii schopné efektívnejšie viazať p53 mRNA a prerušuje sa interakcia s proteínom p53 [15–17]. Ubikvitinačná aktivita proteínu HDM2 je presmerovaná na samotný proteín HDM2 a HDMX, čím dochádza k ich odbúravaniu [18].
Po odpovedi p53 je nutné, aby sa hladina proteínu p53 opäť znížila. K tomu je potrebné, aby bola obnovená dostatočná hladina proteínov HDM2 a HDMX. To je zabezpečené spätno-väzbovou reguláciou, kedy zvýšená hladina p53 vedie k aktivácii transkripčného programu p53. Dochádza k prepisu génov HDM2 a HDMX a novo vzniknuté proteíny HDM2 a HDMX sa môžu opäť podieľať na odbúraní proteínu p53 [19–21].
Interakcia proteínu p53 s HDM2 a HDMX je regulovaná mnohými proteín-proteínovými interakciami. Proteín HDM2 interaguje s plejádou rôznych proteínov, ktoré majú dopad na funkciu proteínu p53. Napríklad proteín ARF (alterante reading frame protein) sa viaže do kyslej domény HDM2, blokuje E3-ligázovú aktivitu HDM2 voči p53 a blokuje export proteínu p53 z jadra závislý na HDM2 [22]. HDMX taktiež interaguje s proteínom ARF, čím ovplyvňuje stabilitu proteínu HDM2 [23,24]. Medzi ďalšie interagujúce proteíny patria ribozomálne proteíny, ako napr. RPL5, RPL11, RPL23, ktoré taktiež limitujú E3-ligázovú funkciu HDM2 [25]; proteín p300, ktorý tvorí komplex s HDM2 aj HDMX a umožňuje aktiváciu p53 v stresových podmienkach [26,27] a mnohé iné.
Okrem vplyvu proteínov HDM2 a HDMX na aktiváciu p53 odpovede bola popísaná aj ich funkcia nezávislá na proteíne p53. Obidva proteíny inhibujú opravu poškodenia DNA skrz ich asociáciu s DNA-reparačným komplexom MRN tvoreným proteínmi MRE11/RAD50/NBS1 (meiotic recombination 11 homolog 1/DNA repair protein RAD50/DNA repair and telomere maintenance protein NBS1). HDM2 aj HDMX sú viazané ku komplexu skrz proteín NBS1 a spôsobujú spomalenie opráv DNA. Takýmto spôsobom obidva proteíny môžu prispievať ku genómovej nestabilite a tumorigenéze [28]. Taktiež bola popísaná ich účasť v kontrole translácie určitých proteínov skrz ich väzbu k mRNA. V prípade HDM2 tak bol popísaný okrem kontroly translácie proteínu p53 [16] aj vplyv na transláciu proteínov XIAP (X-linked inhibitor of apoptosis protein) [29], SLUG (taktiež nazývaný SNAI2 – protein snail homolog 2) [30], MYCN (N-myc proto-oncogene protein) [31], VEGF (vascular endothelial growth factor) [32].
Štruktúra proteínov HDM2 a HDMX
Proteíny HDM2 a HDMX sú paralógne proteíny zhodné na 30 % svojou sekvenciou. Obidva proteíny sú zložené zo 4 usporiadaných domén, medzi ktorými sa nachádzajú veľké úseky vnútorne neusporiadaných častí (obr. 1).
Obr. 1. Schématické znázornenie štruktúry proteínov HDM2 a HDMX a ich homológie. 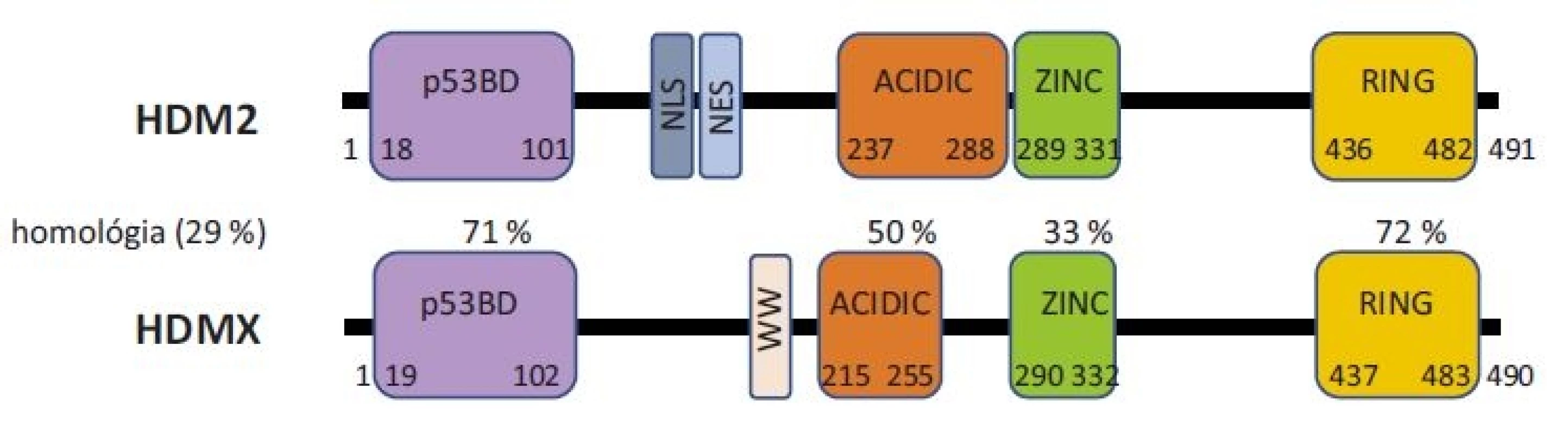
p53BD – p53 väzbová doména, ACIDIC – kyslá doména, ZINC – doména zinkového prstu, RING – RING doména, NLS – jadrový lokalizačný signál, NES – signál pre export z jadra, WW – autoregulačný motív Na N-terminálnom konci obidvoch proteínov sa nachádza p53 väzbová doména, ktorá je v proteínoch zhodná z 71 % a je zodpovedná za väzbu a reguláciu proteínu p53. Aminokyseliny, ktoré sú nevyhnutné pre väzbu s proteínom p53, sú konzervované u obidvoch proteínov [10] a taktiež proteín p53 využíva na väzbu k obidvom proteínom rovnaké aminokyseliny [33]. Avšak dôkladná röntgenová štruktúrna analýza odhalila rozdiely v usporiadaní p53 väzobnej kapsy u proteínu HDM2 a HDMX. V prípade proteínu HDMX postranné reťazce dvoch aminokyselín spôsobujú uzavretejšiu konformáciu hydrofóbnej štrbiny, ktorá sa viaže k p53 [34].
Za N-terminálnou doménou sa nachádzajú neusporiadané časti proteínov. Proteín HDM2 obsahuje sekvenciu nazývanú jadrový lokalizačný signál (nuclear localization signal – NLS), ktorá umožňuje premiestenie proteínu do jadra. Za ňou sa nachádza sekvencia nazývaná signál pre export z jadra (nuclear export signal – NES), umožňujúca naopak export proteínu z jadra do cytoplazmy. Proteín HDMX tieto signály neobsahuje. Je primárne lokalizovaný v cytoplazme bunky, avšak na základe interakcií s inými proteínmi, ako napr. s HDM2, môže byť premiestnený do jadra a späť [35]. Proteín HDMX naviac obsahuje za N-terminálnou doménou autoregulačný sekvenčný motív (aminokyseliny TRP200 a TRP201) nazývaný aj WW motív. Ten sa viaže k p53 väzbovej doméne na N-terminálnom konci samotného HDMX a tým blokuje schopnosť proteínu viazať sa k p53. Strata tohto motívu vedie až k 32-násobnému navýšeniu väzby HDMX s proteínom p53 [36].
V centrálnej časti proteínov sa nachádza kyslá doména (acidic), kde je prítomných viacero kyslých aminokyselín. V proteíne HDM2 hrá táto doména pomocnú úlohu pri degradácii proteínu p53 [37,38]. Najnovšie poznatky ukazujú, že kyslá doména proteínu HDMX je taktiež dôležitá pri regulácií p53, a to cez väzbu kyslej domény HDMX k centrálnej DNA väzbovej doméne proteínu p53, čím dochádza k zablokovaniu funkcie proteínu p53 [13,39]. Za kyslou doménou sa nachádza doména zinkového prstu. Tvorí miesto pre interakciu s mnohými proteínmi, napr. s inhibítorom proteínu HDM2, proteínom ARF [40]. Táto doména je taktiež kľúčová pri väzbe s ribozomálnymi proteínmi RPL5, RPL11, RPL23. Mutácie v zinkovom prste (najmä v jednom z cysteínov, ktoré tvoria štruktúru C4 zinkového prstu) narúšajú správnu funkciu proteínu HDM2 a sú spájané s predispozíciou vzniku rakoviny [41].
Na C-konci proteínov HDM2 a HDMX sa nachádza RING doména, ktorá je opäť veľmi konzervovaná. RING doména proteínu HDM2 je priamo zodpovedná za degradáciu p53, a to svojou E3-ubikvitin ligázovou aktivitou. Napriek veľkej sekvenčnej homológii RING domény (72 %), HDMX nie je funkčnou E3 ligázou. RING doména obidvoch proteínov slúži aj k proteín-proteínovým interakciám s inými RING-obsahujúcimi proteínmi. Dochádza najmä k interakcii medzi proteínmi HDM2 a HDMX, tzv. heterodimerizácii, ktorá zvyšuje stabilitu proteínov HDM2 a HMDX [42]. Proteín HDM2 vytvára cez RING doménu aj homodiméry. Táto vlastnosť nebola u HDMX pozorovaná. Obidva proteíny obsahujú v svojej RING doméne P-slučku, ktorá umožňuje väzbu molekúl adenosintriphosphate (adenozíntrifosfátu – ATP) [43,44]. RING doméne je pripisovaná aj schopnosť viazať sa špecificky k určitému typu RNA, ako napr. k p53 mRNA [15,17], k XIAP mRNA [45].
Proteíny HDM2 a HDMX majú v plnej dĺžke 491 a 490 aminokyselín. Skrz alternatívny zostrih sú v bunkách prítomné aj rôzne izoformy proteínov, čo predstavuje ďalšiu rovinu regulácie nie len ich možnej štruktúry, ale aj ich funkcie [46].
Hladina proteínov HDM2 a HDMX v nádoroch
Proteín MDM2 (mouse double minute 2, myší homológ ľudského proteínu HDM2) bol prvýkrát objavený v myších bunkách 3T3-DM na základe zvýšeného výskytu amplifikácie génu MDM2 [47]. Neskôr bola popísaná jeho asociácia s proteínom p53 a bol pozorovaný represívny vplyv proteínu MDM2 na transkripčnú aktivitu proteínu p53 [48]. Už v roku 1992 Oliner et al pozorovali zvýšenú hladinu proteínu HDM2 u približne jednej tretiny prípadov ľudského sarkómu. Zaujímavou skutočnosťou je, že tieto prípady sarkómu si zachovávali wild type formu proteínu p53 [49]. Neskoršie štúdie na väčšom počte vzoriek potvrdili amplifikáciu HDM2 v mnohých podtypoch sarkómu, ako napr. v osteosarkóme, liposarkóme, lipóme [50–54]. Zvýšená hladina HDM2 bola pozorovaná na úrovni proteínu aj na úrovni mRNA. Mnohé štúdie preukázali zvýšenú hladinu proteínu HDM2 v rôznych typoch rakoviny, ako napr. v malignom glióme [55], v rakovine prsníka [56,57], v rakovine pľúc [58].
Proteín HDMX bol objavený ako ďalší regulátor p53 na základe svojej podobnosti na proteín HDM2 a svojej schopnosti priamo interagovať s proteínom p53 [10]. Tak ako HDM2, aj HDMX je nadmerne exprimovaný v niektorých typoch rakoviny. Jeho zvýšený výskyt bol pozorovaný u podobných typov rakoviny ako v prípade HDM2, napr. v glioblastóme [59], v sarkóme [60] a v rakovine prsníka [61,62]. Naviac bol pozorovaný zvýšený výskyt proteínu HDMX aj v retinoblastóme, kde môže zohrávať hlavnú úlohu v inaktivácii signálnej dráhy p53 v RB1-deficientných bunkách (retinoblastoma protein 1 – RB1) [63].
Stanovenie hladiny proteínov HDM2 a HMDX odhalilo, že proteíny sú exprimované rôzne v závislosti na type tkaniva a podmienok. Avšak porovnaním normálnych a rakovinových buniek sa preukázala nadmerná expresia týchto onkoproteínov takmer vo všetkých typoch nádorov a môže byť spôsobená skrz génovú alteráciu amplifikáciou génov, alebo nadmernou transkripčnou aktiváciou, transláciou a post-translačnými modifikáciami.
Z hľadiska génovej alterácie proteíny HDM2 a HDMX, na rozdiel od ich hlavného interakčného partnera p53, sú mutované len výnimočne. Najčastejšou alteráciou je už zmienená génová amplifikácia. V roku 2016 Oliner et al analyzovali dostupné dáta týkajúce sa alterácie génu HDM2 z databázy The Cancer Genome Atlas. Kritérium pre relevantnú HDM2 amplifikáciu autori nastavili ako vzájomnú výhradnosť s mutáciou proteínu p53. To znamená, že za amplifikáciu HDM2 bol považovaný taký počet kópií génu, kedy zvýšená hladina HDM2 a mutácia p53 sa nevyskytovali zároveň v tej istej vzorke. Takto bola stanovená amplifikácia HDM2 u 1,2 % vzoriek primárnych tumorov, avšak distribúcia medzi typmi tumorov bola veľmi rozdielna s najčastejším výskytom v sarkóme (18,7 %), glioblastóme (7,2 %) a uroteliálnom karcinóme (2,9 %) [64].
Podľa portálu cbioportal.org [65] sú gény HDM2 a HDMX spolu s génom TP53 (kódujúcim proteín p53) alterované až v 43 % skúmaných vzoriek. TP53 je alterovaný v 39 % skúmaných vzoriek, s najčastejším výskytom mutácií. V 3 % vzoriek bola nájdená alterácia HDM2 a v 4 % vzoriek bola nájdená alterácia HDMX (obr. 2A). Zastúpenie daných alterácií sa výrazne líši podľa typu rakoviny (obr. 2B). Gén TP53 je alterovaný výrazne v mnohých typoch rakoviny najmä skrz mutácie, s najvyšším výskytom v ovariálnom a cervikálnom karcinóme. V prípade cervikálneho karcinómu môžeme pozorovať, že amplifikácia HDM2 a HDMX je takmer výnimočná. Najvýraznejšia amplifikácia HDM2 sa vyskytuje v sarkóme mäkkých tkanív (takmer 20 %). HDMX je amplifikovaný najčastejšie v karcinóme prsníka (takmer 14 %).
Obr. 2. Frekvencia alterácie a výskyt alterácie génov TP53, HDM2 a HDMX u vybraných typov karcinómov 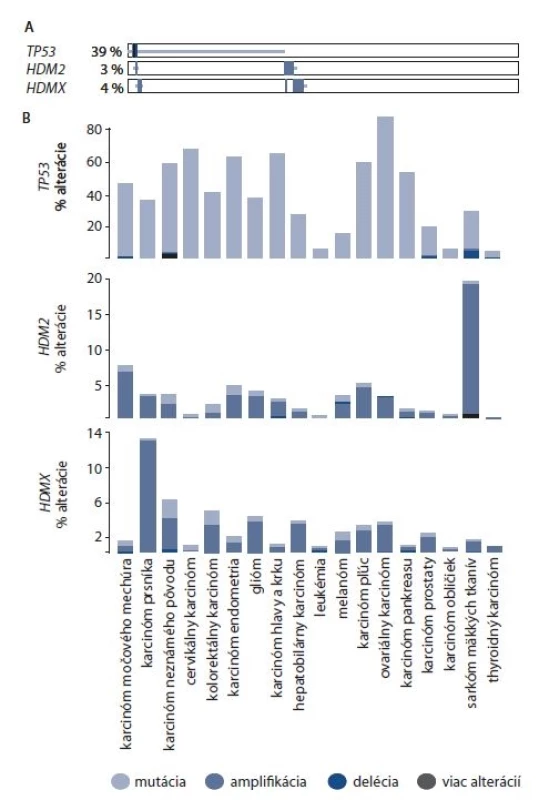
A. Percentuálne znázornenie alterácie pre TP53, HDM2 a HDMX. B. Výskyt alterácie pre TP53, HDM2 a HDMX v typoch karcinómov, kde bolo evaluovaných 500 a viac vzoriek [65]. Ďalšou príčinou zvýšenej hladiny proteínov HDM2 a HDMX môže byť aj polymorfizmus jedného nukleotidu (single nucleotide polymorphism – SNP). V géne HDM2 bol dôkladne skúmaný polymorfizmus na dvoch miestach, SNP309 a SNP285. Polymorfizmus v mieste 309 sa nachádza v prvom intróne promótora HDM2 P2. Promótor P2 vo variante SNP309 G/G vykazuje 2× vyššiu afinitu pre transkripčný faktor Sp1 a vedie k efektívnejšej transkripcii génu v porovnaní s formou promótora SNP309 T/T [66]. Variant alel SNP309 G/G bol spojovaný s vyššou pravdepodobnosťou nádorových ochorení [66,67], avšak mnohé štúdie na rôznych typoch rakoviny poukazujú na nejednoznačnú spojitosť polymorfizmu SNP309 s nádorovými ochoreniami [68–71]. Naopak polymorfizmus SNP285 je spájaný s nižším výskytom rakoviny. Prítomnosť alely SNP285C potláča zvýšenú afinitu Sp1 vyvolanú variantou SNP309G [72]. Avšak táto súvislosť nebola pozorovaná napr. v karcinóme pľúc [73]. Novšie štúdie naznačujú, že vzájomné porovnanie výskytu jedného a druhého polymorfizmu v konkrétnych tkanivách a vztiahnutie výsledkov na konkrétny typ populácie môže prispieť k jednoznačnejším výsledkom [74]. V géne HDMX boli taktiež sledované polymorfizmy jedného nukleotidu spájané s inaktiváciou proteínu p53, a to SNP1, SNP7, SNP9 a SNP12 [75]. Ďalším študovaným polymorfizmom HDMX je SNP34091 A > C, avšak jednoznačné spojenie s výskytom v určitých typoch rakoviny zatiaľ nebolo preukázané [76,77].
Regulácia hladiny proteínov HDM2 a HDMX
Hladina proteínov HDM2 a HDMX je regulovaná na úrovni transkripcie, translácie a posttranslačných procesov. Medzi transkripčné procesy vedúce k nadmernej expresii proteínov HDM2 a HDMX patrí signalizácia skrz dráhu Ras, ktorá aktivuje transkripčný faktor ETS, a ten vedie k prepisu génov HDM2 a HDMX [78,79]. Na transkripčnej regulácii génu pre HMD2 sa podieľa aj hlavný interakčný partner, proteín p53. Aktivácia proteínu p53 vedie k spusteniu transkripcie génu HDM2, a tak dochádza k spätnoväzbovej regulácii. HDM2 môže opäť ubikvitinovať p53, čím zníži jeho hladinu. V prípade proteínu HDMX dlho nebol pozorovaný priamy vplyv proteínu p53 na transkripciu tohto génu. Neskôr bola aj u HDMX, tak ako predtým u HDM2, popísaná transkripčná aktivácia proteínom p53 z miesta druhého promótora, na rozdiel od bazálnej transkripcie začínajúcej z prvého promótora [20,21]. Boli popísané aj ďalšie transkripčné faktory podieľajúce sa na regulácii transkripcie HDM2, ako napr. IRF8, Sp1 [80].
Ako jedným z posttranskripčných procesov ovplyvňujúcich hladinu proteínov HDM2 a HDMX boli popísané rôzne mikroRNA. Napríklad mir-192, mir-194 a mir-215, ktoré sú ovplyvňované proteí-nom p53, znižujú hladinu HDM2 [81]. mir-34a sa viaže do miesta SNP34091 v mRNA pre HDMX a vedie k zníženej hladine proteínu HDMX [82]. Vplyv týchto interakcií však nebol zatiaľ potvrdený v in vivo experimentoch, a preto sú ďalšie štúdie nutné k objasneniu významu a možnému využitiu [83].
Posttranslačné modifikácie tvoria významný mechanizmus regulácie proteínov HDM2 a HDMX skrz vplyv na ich stabilitu a funkciu. Dôležitú úlohu zohrávajú mnohé kinázy vedúce k fosforylácii na špecifických miestach proteínov. Medzi kinázy, ktoré vyvolávajú zvýšenú stabilitu proteínov HMD2 a HDMX a následnú inaktiváciu p53, patria najmä Akt kinázy (thymomas of AKR mice) HDM2 je fosforylovaný Akt kinázou na Ser166 a Ser186 [84], HDMX na Ser367 [85]. ATM kináza naopak reprezentuje fosforylačný enzým vedúci k odbúravaniu proteínov HDM2 a HDMX. Proteín HDM2 je primárne fosforylovaný na Ser395 [86] a HDMX na Ser403 [87]. Takto fosforylované proteíny HDM2 a HDMX majú zvýšenú afinitu voči p53 mRNA [15,17,88]. Fosforylácia a zároveň väzba s p53 mRNA znemožnia ich schopnosť viazať p53 proteín, a tak dochádza k aktivácii p53 dráhy [18]. Fosforylácia taktiež mení ubikvitinačnú aktivitu proteínu HDM2, pretože namiesto ubikvitinácie p53, proteín HDM2 ubikvitinuje sám seba a proteín HDMX [18]. Fosforylácie v týchto miestach boli skúmané aj na myších modeloch a bolo ukázané, že skutočne hrajú úlohu v odpovedi na poškodenie DNA [89,90].
Z uvedených príkladov je zrejmé, že hladina proteínov HDM2 a HDMX je regulovaná na viacerých úrovniach. Narušenie správnej regulácie môže viesť k nadmernej expresii HDM2 a HDMX. Avšak zatiaľ nie je úplne známe, akým podielom sa môžu rôzne mechanizmy účastniť na onkogénnom pôsobení HDM2 a HDMX.
Využitie HDM2 a HDMX v liečbe ľudských nádorov
Proteíny HDM2 a HDMX sú kľúčové regulátory proteínu p53 s neprekrývajúcou sa funkciou. Zásah do regulačnej osy proteínu p53 cez tieto dva negatívne regulátory je tak prirodzenou možnosťou, ako potenciovať proteín p53 k vykonávaniu jeho protinádorovej aktivity. Vďaka dôkladnému poznaniu štruktúry a funkcie proteínov HDM2 a HDMX bolo navrhnutých viacero liečebných prístupov:
- cielenie na proteín-proteínovú interakciu medzi HDM2-p53 a HDMX-p53;
- cielenie na zmenu transkripčnej aktivity pre gény HDM2 a HDMX;
- cielenie na ubikvitinačnú funkciu RING domény;
- cielenie na heterodimerizáciu proteínov HDM2 s HDMX;
- cielenie na translačnú kontrolu sprostredkovanú proteínom HDM2.
Jeden z prvých prístupov aktivujúcich p53 dráhu skrz inhibíciu proteín-proteínovej interakcie medzi HDM2 bol popísaný už v roku 2004 Vassilevom et al za použitia nízkomolekulárnych látok, nutlinov [91]. Nutliny sa špecificky viažu do hydrofóbnej kapsy proteínu HDM2, a tak znemožňujú naviazanie proteínu p53. Tým dochádza k akumulácii proteínu p53, aktivácii dráhy p53, zástave bunkového cyklu a apoptóze. Tieto látky prešli aj do klinických štúdií fázy I pod názvom RG7112 alebo RO5045337 (klinické štúdie č. NCT01677780, NCT01164033, NCT01605526, NCT01143740, NCT0062 3870, NCT00559533, NCT01635296). Boli testované na rôznych solidných tumoroch, leukémii a i. ako monoterapia, ale aj v kombinácii s liečivami ako doxorubicin či cytarabin. Avšak bola zaznamenaná vysoká hematologická toxicita tejto látky [92]. Neskôr boli vyvinuté nutliny druhej generácie s vyššou účinnosťou a menšími vedľajšími efektmi, ako napr. idasanutlin [93]. Tieto látky boli testované ako monoterapia, ale aj ako kombinovaná liečba s inými liečivami, napr. s cisplatinou, s Poly (ADP-ribóza) polymerázou (PARP) inhibítormi v preklinických štúdiách [94,95]. Pod názvom RG7388 alebo RO5503781 sú zaradené aj v klinických štúdiách fázy I a II opäť ako monoterapia alebo v kombinácii s liečivami, ako napr. obinutuzumab, idarubicin a i. (fáza I – NCT01462175, NCT01773408, NCT01901172, NCT033 62723, NCT02828930, NCT02624986, NCT02633059; fáza II – NCT03287245, NCT02624986, NCT02633059). Napríklad v prípade akútnej myeolidnej leukémie (AML) pacientov bola pozorovaná dobrá znášanlivosť liečby sprevádzaná klinickou odpoveďou aj ako monoterapie, ale aj v kombinácií s cytarabinom [96]. Idasanutlin sa dostal aj do klinických testov fáze III pre pacientov s AML v kombinácii s cytarabinom (NCT 02545283).
Mnohé ďalšie liečivá využívajú stratégiu blokovania p53 väzby s proteínom HDM2. Patria sem nízkomolekulárne látky z rady spiro-oxindolov ako MI-7730, imidazothiazolov ako DS-3032b, piperidinonov ako AMG232 a mnohé ďalšie [97]. Okrem nízkolmolekulárnych látok sa ako inhibítory HDM2 využívajú aj peptidy, ktoré mimikujú tri hlavné aminokyseliny p53 interagujúce s HDM2 (Phe19,Trp23,Leu26). Takýto peptid sa špecificky viaže do hydrofóbnej kapsy p53-väzbovej domény. Na rozdiel od malých molekúl ponúka možnosť blokovať nielen interakciu s HDM2, ale zároveň aj s HDMX [98,99]. Peptid s názvom ALRN-6924 vstúpil aj do klinických štúdií zameraných na solidné tumory, lymfómy a AML (NCT02909972, NCT02264613).
Iné prístupy aktivácie p53 dráhy skrz HMD2 a HDMX boli zatiaľ ukázané v predklinických štúdiách. Na blokovanie transkripcie génov boli popísané látky účinkujúce na expresiu HDM2 [100,101] alebo na HDMX [102]. Blokátory ubikvitinačnej aktivity proteínu HDM2 boli nájdené pomocou screeningu látok ubikvitinačným testom v bunkách a bol ukázaný ich synergistický efekt na apoptózu s DNA-poškodzujúcimi látkami [103]. Keďže HDM2 dimerizácia s HDMX stabilizuje proteín HDM2 a tým zvyšuje jeho účinnosť v ubikvitinácii p53, narušenie tejto interakcie pomocou mimikujúcich peptidov ponúka alternatívu k aktivácii signálnej dráhy p53 [104]. Schopnosť HDM2 viazať mRNA XIAP bola tiež využitá pri návrhu liečiv. HDM2 sa za normálnych podmienok viaže k mRNA XIAP, inhibítoru apoptózy, a zvyšuje jeho transláciu. Pôsobením látky MX69, ktorá blokuje interakciu HDM2 s mRNA XIAP, sa zníži hladina proteínu HDM2 a taktiež translácia proteínu XIAP, stabilizuje sa proteín p53 a dochádza k zástave bunkového cyklu [105].
Záver
Proteíny HDM2 a HDMX patria medzi onkogénne proteíny. V normálnych podmienkach sú dôležitými regulátormi hladiny proteínu p53, ale hrajú aj významnú úlohu v opravách poškodenej DNA. Pri nadmernej expresii HDM2 alebo HDMX dochádza k nadmernému blokovaniu odpovede skrz p53 signálnu dráhu, čo vedie k vzniku nádorov. Zvýšená hladina proteínov HDM2 a HDMX bola pozorovaná takmer u všetkých typoch nádorov a je spojovaná s inaktiváciou signálnej dráhy p53 v nádoroch, ktoré si zachovávajú wild type p53. Hladina proteínov HDM2 a HDMX je zvýšená najmä skrz génovú amplifikáciu, ale bol popísaný aj vplyv polymorfizmov jedného nukleotidu, príp. zmeny v regulácii transkripcie, posttranskripčných procesov, translácie a posttranslačných procesov. Výskum v oblasti štruktúry proteínov HDM2 a HDMX, ich interakcie s proteínom p53 a poznanie funkcie jednotlivých domén dovolil vzniknúť mnohým prístupom k ovplyvneniu p53 dráhy. Niektoré látky vstúpili do klinických štúdií fázy I, II a III a predstavujú sľubnú možnosť liečby určitých typov rakoviny, ako napr. AML.
Práca bola podporená projektom MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Lucia Hároníková, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: lucia.haronikova@mou.cz
Přijato: 16. 7. 2018
Zdroje
1. Karni-Schmidt O, Lokshin M, Prives C. The Roles of MDM2 and MDMX in Cancer. Annu Rev Pathol 2016; 11 : 617–644. doi: 10.1146/annurev-pathol-012414-040 349.
2. Jones SN, Roe AE, Donehower LA et al. Rescue of embryonic lethality in Mdm2-deficient mice by absence of p53. Nature 1995; 378 (6553): 206–208. doi: 10.1038/378206a0.
3. Parant J, Chavez-Reyes A, Little NA et al. Rescue of embryonic lethality in Mdm4-null mice by loss of Trp53 suggests a nonoverlapping pathway with MDM2 to regulate p53. Nat Genet 2001; 29 (1): 92–95. doi: 10.1038/ng 714.
4. Brooks CL, Gu W. p53 regulation by ubiquitin. FEBS Lett 2011; 585 (18): 2803–2809. doi: 10.1016/j.febslet.2011.05.022.
5. Wang X. p53 regulation: teamwork between RING domains of Mdm2 and MdmX. Cell Cycle 2011; 10 (24): 4225–4229. doi: 10.4161/cc.10.24.18662.
6. Wang X, Wang J, Jiang X. MdmX protein is essential for Mdm2 protein-mediated p53 polyubiquitination. J Biol Chem 2011; 286 (27): 23725–23734. doi: 10.1074/jbc.M110.213868.
7. Chen J, Lin J, Levine AJ. Regulation of transcription functions of the p53 tumor suppressor by the mdm-2 oncogene. Mol Med 1995; 1 (2): 142–152.
8. Thut CJ, Goodrich JA, Tjian R. Repression of p53-mediated transcription by MDM2: a dual mechanism. Genes Dev 1997; 11 (15): 1974–1986.
9. Itahana K, Mao H, Jin A et al. Targeted inactivation of Mdm2 RING finger E3 ubiquitin ligase activity in the mouse reveals mechanistic insights into p53 regulation. Cancer Cell 2007; 12 (4): 355–366. doi: 10.1016/j.ccr.2007.09.007.
10. Shvarts A, Steegenga WT, Riteco N et al. MDMX: a novel p53-binding protein with some functional properties of MDM2. EMBO J 1996; 15 (19): 5349–5357.
11. Shimizu H, Burch LR, Smith AJ et al. The conformationally flexible S9-S10 linker region in the core domain of p53 contains a novel MDM2 binding site whose mutation increases ubiquitination of p53 in vivo. J Biol Chem 2002; 277 (32): 28446–28458. doi: 10.1074/jbc.M202296 200.
12. Yu GW, Rudiger S, Veprintsev D et al. The central region of HDM2 provides a second binding site for p53. Proc Natl Acad Sci U S A 2006; 103 (5): 1227–1232. doi: 10.1073/pnas.0510343103.
13. Wei X, Wu S, Song T et al. Secondary interaction between MDMX and p53 core domain inhibits p53 DNA binding. Proc Natl Acad Sci U S A 2016; 113 (19): E2558–E2563. doi: 10.1073/pnas.1603838113.
14. Medina-Medina I, Martinez-Sanchez M, Hernandez-Monge J et al. p53 promotes its own polyubiquitination by enhancing the HDM2 and HDMX interaction. Protein Sci 2018; 27 (5): 976–986. doi: 10.1002/pro.3405.
15. Malbert-Colas L, Ponnuswamy A, Olivares-Illana V et al. HDMX folds the nascent p53 mRNA following activation by the ATM kinase. Mol Cell 2014; 54 (3): 500–511. doi: 10.1016/j.molcel.2014.02.035.
16. Candeias MM, Malbert-Colas L, Powell DJ et al. P53 mRNA controls p53 activity by managing Mdm2 functions. Nat Cell Biol 2008; 10 (9): 1098–1105. doi: 10.1038/ ncb1770.
17. Gajjar M, Candeias MM, Malbert-Colas L et al. The p53 mRNA-Mdm2 interaction controls Mdm2 nuclear trafficking and is required for p53 activation following DNA damage. Cancer Cell 2012; 21 (1): 25–35. doi: 10.1016/j.ccr.2011.11.016.
18. Medina-Medina I, Garcia-Beltran P, de la Mora-de la Mora I et al. Allosteric interactions by p53 mRNA govern HDM2 E3 ubiquitin ligase specificity unde different conditions. Mol Cell Biol 2016; 36 (16): 2195–2205. doi: 10.1128/MCB.00113-16.
19. Ponnuswamy A, Hupp T, Fahraeus R. Concepts in MDM2 signaling: allosteric regulation and feedback loops. Genes Cancer 2012; 3 (3–4): 291–297. doi: 10.1177/1947601912454140.
20. Phillips A, Teunisse A, Lam S et al. HDMX-L is expressed from a functional p53-responsive promoter in the first intron of the HDMX gene and participates in an autoregulatory feedback loop to control p53 activity. J Biol Chem 2010; 285 (38): 29111–29127. doi: 10.1074/jbc.M110.129726.
21. Barak Y, Gottlieb E, Juven-Gershon T et al. Regulation of mdm2 expression by p53: alternative promoters produce transcripts with nonidentical translation potential. Genes Dev 1994; 8 (15): 1739–1749.
22. Zhang Y, Xiong Y. Control of p53 ubiquitination and nuclear export by MDM2 and ARF. Cell Growth Differ 2001; 12 (4): 175–186.
23. Ghosh M, Weghorst K, Berberich SJ. MdmX inhibits ARF mediated Mdm2 sumoylation. Cell Cycle 2005; 4 (4): 604–608.
24. Jackson MW, Lindstrom MS, Berberich SJ. MdmX binding to ARF affects Mdm2 protein stability and p53 transactivation. J Biol Chem 2001; 276 (27): 25336–25341. doi: 10.1074/jbc.M010685200.
25. Nag S, Qin J, Srivenugopal KS et al. The MDM2-p53 pathway revisited. J Biomed Res 2013; 27 (4): 254–271. doi: 10.7555/JBR.27.20130030.
26. Ferreon JC, Lee CW, Arai M et al. Cooperative regulation of p53 by modulation of ternary complex formation with CBP/p300 and HDM2. Proc Natl Acad Sci U S A 2009; 106 (16): 6591–6596. doi: 10.1073/pnas.0811023106.
27. Sabbatini P, McCormick F. MDMX inhibits the p300/CBP-mediated acetylation of p53. DNA Cell Biol 2002; 21 (7): 519–525. doi: 10.1089/104454902320219077.
28. Eischen CM. Role of Mdm2 and Mdmx in DNA repair. J Mol Cell Biol 2017; 9 (1): 69–73. doi: 10.1093/jmcb/mjw052.
29. Gu L, Zhu N, Zhang H et al. Regulation of XIAP translation and induction by MDM2 following irradiation. Cancer Cell 2009; 15 (5): 363–375. doi: 10.1016/j.ccr.2009.03.002.
30. Jung CH, Kim J, Park JK et al. Mdm2 increases cellular invasiveness by binding to and stabilizing the Slug mRNA. Cancer Lett 2013; 335 (2): 270–277. doi: 10.1016/j.canlet.2013.02.035.
31. Gu L, Zhang H, He J et al. MDM2 regulates MYCN mRNA stabilization and translation in human neuroblastoma cells. Oncogene 2012; 31 (11): 1342–1353. doi: 10.1038/onc.2011.343.
32. Zhou S, Gu L, He J et al. MDM2 regulates vascular endothelial growth factor mRNA stabilization in hypoxia. Mol Cell Biol 2011; 31 (24): 4928–4937. doi: 10.1128/MCB.06085-11.
33. Bottger V, Bottger A, Garcia-Echeverria C et al. Comparative study of the p53-mdm2 and p53-MDMX interfaces. Oncogene 1999; 18 (1): 189–199. doi: 10.1038/sj.onc.1202281.
34. Popowicz GM, Czarna A, Holak TA. Structure of the human Mdmx protein bound to the p53 tumor suppressor transactivation domain. Cell Cycle 2008; 7 (15): 2441–2443. doi: 10.4161/cc.6365.
35. Miller KR, Kelley K, Tuttle R et al. HdmX overexpression inhibits oncogene induced cellular senescence. Cell Cycle 2010; 9 (16): 3376–3382. doi: 10.4161/cc.9.16.12779.
36. Bista M, Petrovich M, Fersht AR. MDMX contains an autoinhibitory sequence element. Proc Natl Acad Sci U S A 2013; 110 (44): 17814–17819. doi: 10.1073/pnas.1317398110.
37. Kawai H, Wiederschain D, Yuan ZM. Critical contribution of the MDM2 acidic domain to p53 ubiquitination. Mol Cell Biol 2003; 23 (14): 4939–4947.
38. Meulmeester E, Frenk R, Stad R et al. Critical role for a central part of Mdm2 in the ubiquitylation of p53. Mol Cell Biol 2003; 23 (14): 4929–4938.
39. Huang Q, Chen L, Yang L et al. MDMX acidic domain inhibits p53 DNA binding in vivo and regulates tumorigenesis. Proc Natl Acad Sci U S A 2018; 115 (15): E3368–E3377. doi: 10.1073/pnas.1719090115.
40. Manfredi JJ. The Mdm2-p53 relationship evolves: Mdm2 swings both ways as an oncogene and a tumor suppressor. Genes Dev 2010; 24 (15): 1580–1589. doi: 10.1101/gad.1941710.
41. Lindstrom MS, Deisenroth C, Zhang Y. Putting a finger on growth surveillance: insight into MDM2 zinc finger-ribosomal protein interactions. Cell Cycle 2007; 6 (4): 434–437. doi: 10.4161/cc.6.4.3861.
42. Linares LK, Hengstermann A, Ciechanover A et al. HdmX stimulates Hdm2-mediated ubiquitination and degradation of p53. Proc Natl Acad Sci U S A 2003; 100 (21): 12009–12014. doi: 10.1073/pnas.2030930100.
43. Stevens C, Pettersson S, Wawrzynow B et al. ATP stimulates MDM2-mediated inhibition of the DNA-binding function of E2F1. FEBS J 2008; 275 (19): 4875–4886. doi: 10.1111/j.1742-4658.2008.06627.x.
44. Priest C, Prives C, Poyurovsky MV. Deconstructing nucleotide binding activity of the Mdm2 RING domain. Nucleic Acids Res 2010; 38 (21): 7587–7598. doi: 10.1093/nar/gkq669.
45. Liu T, Zhang H, Xiong J et al. Inhibition of MDM2 homodimerization by XIAP IRES stabilizes MDM2, influencing cancer cell survival. Mol Cancer 2015; 14 : 65. doi: 10.1186/s12943-015-0334-0.
46. Jacob AG, Singh RK, Comiskey DF Jr. et al. Stress-induced alternative splice forms of MDM2 and MDMX modulate the p53-pathway in distinct ways. PLoS One 2014; 9 (8): e104444. doi: 10.1371/journal.pone.0104444.
47. Cahilly-Snyder L, Yang-Feng T, Francke U et al. Molecular analysis and chromosomal mapping of amplified genes isolated from a transformed mouse 3T3 cell line. Somat Cell Mol Genet 1987; 13 (3): 235–244.
48. Momand J, Zambetti GP, Olson DC et al. The mdm-2 oncogene product forms a complex with the p53 protein and inhibits p53-mediated transactivation. Cell 1992; 69 (7): 1237–1245.
49. Oliner JD, Kinzler KW, Meltzer PS et al. Amplification of a gene encoding a p53-associated protein in human sarcomas. Nature 1992; 358 (6381): 80–83. doi: 10.1038/358080a0.
50. Forus A, Florenes VA, Maelandsmo GM et al. Mapping of amplification units in the q13-14 region of chromosome 12 in human sarcomas: some amplica do not include MDM2. Cell Growth Differ 1993; 4 (12): 1065–1070.
51. Ladanyi M, Cha C, Lewis R et al. MDM2 gene amplification in metastatic osteosarcoma. Cancer Res 1993; 53 (1): 16–18.
52. Leach FS, Tokino T, Meltzer P et al. p53 Mutation and MDM2 amplification in human soft tissue sarcomas. Cancer Res 1993; 53 (Suppl 10): 2231–2234.
53. Miller CW, Aslo A, Won A et al. Alterations of the p53, Rb and MDM2 genes in osteosarcoma. J Cancer Res Clin Oncol 1996; 122 (9): 559–565.
54. Patterson H, Barnes D, Gill S et al. Amplification and over-expression of the MDM2 gene in human soft tissue tumours. Sarcoma 1997; 1 (1): 17–22. doi: 10.1080/13577149778434.
55. Reifenberger G, Liu L, Ichimura K et al. Amplification and overexpression of the MDM2 gene in a subset of human malignant gliomas without p53 mutations. Cancer Res 1993; 53 (12): 2736–2739.
56. Quesnel B, Preudhomme C, Fournier J et al. MDM2 gene amplification in human breast cancer. Eur J Cancer 1994; 30A (7): 982–984.
57. Marchetti A, Buttitta F, Girlando S et al. mdm2 gene alterations and mdm2 protein expression in breast carcinomas. J Pathol 1995; 175 (1): 31–38. doi: 10.1002/path. 1711750106.
58. Marchetti A, Buttitta F, Pellegrini S et al. Mdm2 gene amplification and overexpression in non-small cell lung carcinomas with accumulation of the p53 protein in the absence of p53 gene mutations. Diagn Mol Pathol 1995; 4 (2): 93–97.
59. Riemenschneider MJ, Buschges R, Wolter M et al. Amplification and overexpression of the MDM4 (MDMX) gene from 1q32 in a subset of malignant gliomas without TP53 mutation or MDM2 amplification. Cancer Res 1999; 59 (24): 6091–6096.
60. Bartel F, Schulz J, Bohnke A et al. Significance of HDMX-S (or MDM4) mRNA splice variant overexpression and HDMX gene amplification on primary soft tissue sarcoma prognosis. Int J Cancer 2005; 117 (3): 469–475. doi: 10.1002/ijc.21206.
61. Haupt S, Vijayakumaran R, Miranda PJ et al. The role of MDM2 and MDM4 in breast cancer development and prevention. J Mol Cell Biol 2017; 9 (1): 53–61. doi: 10.1093/jmcb/mjx007.
62. Miranda PJ, Buckley D, Raghu D et al. MDM4 is a rational target for treating breast cancers with mutant p53. J Pathol 2017; 241 (5): 661–670. doi: 10.1002/path.4877.
63. Laurie NA, Donovan SL, Shih CS et al. Inactivation of the p53 pathway in retinoblastoma. Nature 2006; 444 (7115): 61–66. doi: 10.1038/nature05194.
64. Oliner JD, Saiki AY, Caenepeel S. The role of MDM2 amplification and overexpression in tumorigenesis. Cold Spring Harb Perspect Med 2016; 6 (6): pii: a026336. doi: 10.1101/cshperspect.a026336.
65. Cerami E, Gao J, Dogrusoz U et al. The cBio cancer genomics portal: an open platform for exploring multidimensional cancer genomics data. Cancer Discov 2012; 2 (5): 401–404. doi: 10.1158/2159-8290.CD-12-0095.
66. Bond GL, Hu W, Bond EE et al. A single nucleotide polymorphism in the MDM2 promoter attenuates the p53 tumor suppressor pathway and accelerates tumor formation in humans. Cell 2004; 119 (5): 591–602. doi: 10.1016/j.cell.2004.11.022.
67. Hu Z, Jin G, Wang L et al. MDM2 promoter polymorphism SNP309 contributes to tumor susceptibility: evidence from 21 case-control studies. Cancer Epidemiol Biomarkers Prev 2007; 16 (12): 2717–2723. doi: 10.1158/1055-9965.EPI-07-0634.
68. Economopoulos KP, Sergentanis TN. Differential effects of MDM2 SNP309 polymorphism on breast cancer risk along with race: a meta-analysis. Breast Cancer Res Treat 2010; 120 (1): 211–216. doi: 10.1007/s10549-009-0467-1.
69. Wilkening S, Bermejo JL, Hemminki K. MDM2 SNP309 and cancer risk: a combined analysis. Carcinogenesis 2007; 28 (11): 2262–2267. doi: 10.1093/carcin/bgm 191.
70. Krekac D, Brozkova K, Knoflickova D et al. MDM2S NP309 does not associate with elevated MDM2 protein expression or breast cancer risk. Oncology 2008; 74 (1–2): 84–87. doi: 10.1159/000139135.
71. Wilkening S, Hemminki K, Rudnai P et al. No association between MDM2 SNP309 promoter polymorphism and basal cell carcinoma of the skin. Br J Dermatol 2007; 157 (2): 375–377. doi: 10.1111/j.1365-2133.2007.079 94.x
72. Knappskog S, Bjornslett M, Myklebust LM et al. The MDM2 promoter SNP285C/309G haplotype diminishes Sp1 transcription factor binding and reduces risk for breast and ovarian cancer in Caucasians. Cancer Cell 2011; 19 (2): 273–282. doi: 10.1016/j.ccr.2010.12.019.
73. Ryan BM, Calhoun KM, Pine SR et al. MDM2 SNP285 does not antagonize the effect of SNP309 in lung cancer. Int J Cancer 2012; 131 (11): 2710–2716.
74. Wang P, Wang M, Li S et al. Association of the MDM2 SNP285 polymorphism with cancer susceptibility: a meta-analysis. Dis Markers 2016; 2016 : 4585484. doi: 10.1155/2016/4585484.
75. Atwal GS, Kirchhoff T, Bond EE et al. Altered tumor formation and evolutionary selection of genetic variants in the human MDM4 oncogene. Proc Natl Acad Sci U S A 2009; 106 (25): 10236–10241. doi: 10.1073/pnas.0901298106.
76. Gansmo LB, Romundstad P, Birkeland E et al. MDM4 SNP34091 (rs4245739) and its effect on breast-, colon-, lung-, and prostate cancer risk. Cancer Med 2015; 4 (12): 1901–1907. doi: 10.1002/cam4.555.
77. Gansmo LB, Bjornslett M, Halle MK et al. The MDM4 SNP34091 (rs4245739) C-allele is associated with increased risk of ovarian-but not endometrial cancer. Tumour Biol 2016; 37 (8): 10697–10702. doi: 10.1007/s13277-016-4940-2.
78. Gilkes DM, Pan Y, Coppola D et al. Regulation of MDMX expression by mitogenic signaling. Mol Cell Biol 2008; 28 (6): 1999–2010. doi: 10.1128/MCB.01633-07.
79. Ries S, Biederer C, Woods D et al. Opposing effects of Ras on p53: transcriptional activation of mdm2 and induction of p19ARF. Cell 2000; 103 (2): 321–330.
80. Wade M, Li YC, Wahl GM. MDM2, MDMX and p53 in oncogenesis and cancer therapy. Nat Rev Cancer 2013; 13 (2): 83–96. doi: 10.1038/nrc3430.
81. Pichiorri F, Suh SS, Rocci A et al. Downregulation of p53-inducible microRNAs 192, 194, and 215 impairs the p53/MDM2 autoregulatory loop in multiple myeloma development. Cancer Cell 2010; 18 (4): 367–381. doi: 10.1016/j.ccr.2010.09.005.
82. Mandke P, Wyatt N, Fraser J et al. MicroRNA-34a modulates MDM4 expression via a target site in the open reading frame. PLoS One 2012; 7 (8): e42034. doi: 10.1371/journal.pone.0042034.
83. Concepcion CP, Han YC, Mu P et al. Intact p53-dependent responses in miR-34-deficient mice. PLoS Genet 2012; 8 (7): e1002797. doi: 10.1371/journal.pgen.1002797.
84. Mayo LD, Donner DB. A phosphatidylinositol 3-kinase/Akt pathway promotes translocation of Mdm2 from the cytoplasm to the nucleus. Proc Natl Acad Sci U S A 2001; 98 (20): 11598–11603. doi: 10.1073/pnas.181181198.
85. Lopez-Pajares V, Kim MM, Yuan ZM. Phosphorylation of MDMX mediated by Akt leads to stabilization and induces 14-3-3 binding. J Biol Chem 2008; 283 (20): 13707–13713. doi: 10.1074/jbc.M710030200.
86. Maya R, Balass M, Kim ST et al. ATM-dependent phosphorylation of Mdm2 on serine 395: role in p53 activation by DNA damage. Genes Dev 2001; 15 (9): 1067–1077. doi: 10.1101/gad.886901.
87. Chen L, Gilkes DM, Pan Y et al. ATM and Chk2-dependent phosphorylation of MDMX contribute to p53 activation after DNA damage. EMBO J 2005; 24 (19): 3411–3422. doi: 10.1038/sj.emboj.7600812.
88. Naski N, Gajjar M, Bourougaa K et al. The p53 mRNA-Mdm2 interaction. Cell Cycle 2009; 8 (1): 31–34. doi: 10.4161/cc.8.1.7326.
89. Gannon HS, Woda BA, Jones SN. ATM phosphorylation of Mdm2 Ser394 regulates the amplitude and duration of the DNA damage response in mice. Cancer Cell 2012; 21 (5): 668–679. doi: 10.1016/j.ccr.2012.04.011.
90. Wang YV, Leblanc M, Wade M et al. Increased radioresistance and accelerated B cell lymphomas in mice with Mdmx mutations that prevent modifications by DNA-damage-activated kinases. Cancer Cell 2009; 16 (1): 33–43. doi: 10.1016/j.ccr.2009.05.008.
91. Vassilev LT, Vu BT, Graves B et al. In vivo activation of the p53 pathway by small-molecule antagonists of MDM2. Science 2004; 303 (5659): 844–848. doi: 10.1126/science.1092472.
92. Ray-Coquard I, Blay JY, Italiano A et al. Effect of the MDM2 antagonist RG7112 on the P53 pathway in patients with MDM2-amplified, well-differentiated or dedifferentiated liposarcoma: an exploratory proof-of-mechanism study. Lancet Oncol 2012; 13 (11): 1133–1140. doi: 10.1016/S1470-2045 (12) 70474-6.
93. Ding Q, Zhang Z, Liu JJ et al. Discovery of RG7388, a potent and selective p53-MDM2 inhibitor in clinical development. J Med Chem 2013; 56 (14): 5979–5983. doi: 10.1021/jm400487c.
94. Zanjirband M, Curtin N, Edmondson RJ et al. Combination treatment with rucaparib (Rubraca) and MDM2 inhibitors, Nutlin-3 and RG7388, has synergistic and dose reduction potential in ovarian cancer. Oncotarget 2017; 8 (41): 69779–69796. doi: 10.18632/oncotarget.19 266.
95. Zanjirband M, Edmondson RJ, Lunec J. Pre-clinical efficacy and synergistic potential of the MDM2-p53 antagonists, Nutlin-3 and RG7388, as single agents and in combined treatment with cisplatin in ovarian cancer. Oncotarget 2016; 7 (26): 40115–40134. doi: 10.18632/oncotarget.9499.
96. Reis B, Jukofsky L, Chen G et al. Acute myeloid leukemia patients‘ clinical response to idasanutlin (RG7388) is associated with pre-treatment MDM2 protein expression in leukemic blasts. Haematologica 2016; 101 (5): e185–e188. doi: 10.3324/haematol.2015.139717.
97. Burgess A, Chia KM, Haupt S et al. Clinical overview of MDM2/X-targeted therapies. Front Oncol 2016; 6 : 7. doi: 10.3389/fonc.2016.00007.
98. Chang YS, Graves B, Guerlavais V et al. Stapled alphahelical peptide drug development: a potent dual inhibitor of MDM2 and MDMX for p53-dependent cancer therapy. Proc Natl Acad Sci U S A 2013; 110 (36): E3445–E3454. doi: 10.1073/pnas.1303002110.
99. Madden MM, Muppidi A, Li Z et al. Synthesis of cell-permeable stapled peptide dual inhibitors of the p53-Mdm2/Mdmx interactions via photoinduced cycloaddition. Bioorg Med Chem Lett 2011; 21 (5): 1472–1475. doi: 10.1016/j.bmcl.2011.01.004.
100. Huang M, Zhang H, Liu T et al. Triptolide inhibits MDM2 and induces apoptosis in acute lymphoblastic leukemia cells through a p53-independent pathway. Mol Cancer Ther 2013; 12 (2): 184–194. doi: 10.1158/1535-7163.MCT-12-0425.
101. Qin JJ, Wang W, Voruganti S et al. Inhibiting NFAT1 for breast cancer therapy: New insights into the mechanism of action of MDM2 inhibitor JapA. Oncotarget 2015; 6 (32): 33106–33119. doi: 10.18632/oncotarget.5851.
102. Wang H, Ma X, Ren S et al. A small-molecule inhibitor of MDMX activates p53 and induces apoptosis. Mol Cancer Ther 2011; 10 (1): 69–79. doi: 10.1158/1535-7163.MCT-10-0581.
103. Herman AG, Hayano M, Poyurovsky MV et al. Discovery of Mdm2-MdmX E3 ligase inhibitors using a cell-based ubiquitination assay. Cancer Discov 2011; 1 (4): 312–325. doi: 10.1158/2159-8290.CD-11-0104.
104. Pellegrino M, Mancini F, Luca R et al. Targeting the MDM2/MDM4 interaction interface as a promising approach for p53 reactivation therapy. Cancer Res 2015; 75 (21): 4560–4572. doi: 10.1158/0008-5472.CAN-15-0439.
105. Gu L, Zhang H, Liu T et al. Discovery of dual inhibitors of MDM2 and XIAP for cancer treatment. Cancer Cell 2016; 30 (4): 623–636. doi: 10.1016/j.ccell.2016.08.015.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2018 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Proteogenomická platforma na identifikáciu nádorovo špecifických antigénov
- Využití mitochondriálních procesů v cílené terapii nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Význam membránových proteinů v léčbě nádorových onemocnění a možnosti jejich dalšího studia
- Vliv metylace DNA na vznik nádorových onemocnění
- Úloha proteinu HSP70 v nádorech a jeho využití jako terapeutický cíl
- Variabilita buněčné populace solidních nádorů a její význam pro diagnostiku a terapii nádorových onemocnění
- Úloha proteínu HSF1 v nádorovej transformácii
- Proteíny HDM2 a HDMX v ľudských nádoroch
- Prima-1 a APR-246 v léčbě nádorových onemocnění
- Acetylsalicylová kyselina a její potenciál v chemoprevenci kolorektálního karcinomu
- Exprese a funkční charakterizace miR-34c u karcinomu děložního hrdla
- Subpopulace cirkulujících myeloidních supresových buněk u pacientů s kolorektálním karcinomem – explorativní analýza jejich potenciálu jako biomarkeru
- Současné metody analýzy mikroRNA
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv metylace DNA na vznik nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Současné metody analýzy mikroRNA
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



