-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prenatální kardiologie
Prenatal cardiology
Prenatal cardiology is a subspecialty of pediatric cardiology focused mainly on the diagnosis and treatment of heart lesions, predominantly congenital heart defects. A nationwide prenatal detection of major congenital heart defects in the Czech Republic exceeded 80 % in the current era. Termination of pregnancy of major heart defects has decreased from 70 % in 1991 to 43 % in 2023 but remains high in fetuses with univentricular heart and those major heart defects with associated comorbidities. The introduction of first trimester screening resulted in higher termination rate at early stage but did not revert the overall decreasing trend in termination of pregnancy. In cardiac abnormalities with favorable outcome, the termination rate decreased significantly, becoming rather exceptional in recent years. This review focuses on advances in prenatal detection of heart anomalies and treatment of arrhythmias and some specific heart defects that are increasingly used in clinical practice.
Autoři: Tomek Viktor
Působiště autorů: Dětské kardiocentrum, 2. lékařská fakulta, Univerzita Karlova a FN v Motole, Praha
Vyšlo v časopise: Čes-slov Pediat 2024; 79 (1): 9-16.
Kategorie: Prevence v pediatrii
doi: https://doi.org/10.55095/CSPediatrie2024/001Souhrn
Prenatální kardiologie je specializovaná oblast dětské kardiologie, která se zaměřuje na diagnostiku a léčbu onemocnění srdce u plodu, nejčastěji srdečních vad. Prenatální detekce významných srdečních vad v České republice je vysoká a její úspěšnost převyšuje v současnosti 80 %. Ukončení těhotenství z důvodu významných srdečních vad pokleslo ze 70 % v roce 1991 na 43 % v roce 2023, ale zůstává vysoké u jednokomorových vad a přítomných extrakardiálních anomálií. Zahájení screeningu srdce v 1. trimestru vedlo ke zvýšenému ukončování vad v nízkém gestačním stáří, ale neovlivnilo celkově klesající trend v ukončování těhotenství. U srdečních vad s příznivou prognózou frekvence ukončení těhotenství významně poklesla a v dnešní době je zcela výjimečná. Tento článek podává přehled o pokroku v prenatální detekci srdečních onemocnění a léčbě arytmií a některých specifických srdečních vad, které se staly rutinní součástí klinické praxe.
ÚVOD
Prenatální kardiologie je specializovaná oblast dětské kardiologie, která se zaměřuje na diagnostiku a léčbu onemocnění srdce u plodu, nejčastěji srdečních vad. Vrozené srdeční vady (VSV) jsou nejčastějšími vývojovými vadami postihujícími 0,6–2,2 % živě narozených dětí a často se kombinují s vadami genetickými nebo anomálií jiných orgánů.(1,2)
Méně často se fetálně setkáváme s jinými onemocněními srdce, jako jsou poruchy srdečního rytmu nebo nádory srdce. Rozvoj prenatální kardiologie souvisí s technologickým zlepšením ultrazvukových přístrojů v 80. letech 20. století. Od té doby se diagnostika srdečních onemocnění stala zcela rutinní součástí screeningového vyšetření ve 2. trimestru těhotenství, orientačně již v 1. trimestru.Cílem prenatální kardiologie je odhalení srdečních vad, které jsou svojí povahou kritické a mohly by bez včasné diagnózy ohrozit novorozence na životě. Rovněž je důležitá intrauterinní diagnóza komplexních vad, které není možné zcela vyléčit, vyžadují dlouhodobou paliativní léčbu a nemají příznivou prognózu. Diagnóza srdeční vady u plodu je předpokladem pro stanovení prognózy a konzultaci s rodiči o dalším osudu těhotenství včetně možnosti jeho ukončení při nálezu vady s velmi nepříznivou prognózou.
Prenatální kardiologie má roli zejména diagnostickou a konzultační. Přesto je v některých indikacích možná intrauterinní léčba. Léčba některých závažných poruch srdečního rytmu je úspěšná a umožňuje záchranu života plodu. Katetrizační intervence u těžkých aortálních a pulmonálních stenóz dávají naději na možné zlepšení vývoje a funkce srdečních komor.
ORGANIZACE PRENATÁLNÍHO SCREENINGU
V současnosti je prenatální echokardiografie prováděna ve většině vyspělých zemí plošně.(3) V České republice je každá těhotná žena dispenzarizovaná u svého registrujícího gynekologa a absolvuje několik screeningových ultrazvukových vyšetření zajišťovaných gynekology.
Screeningové vyšetření srdce a velkých cév se provádí standardně mezi 18.–22. týdnem těhotenství. Od roku 2007 je základní vyšetření srdce součástí kombinovaného prvotrimestrálního screeningu (11.–14. týden gestace). Ten však neabsolvují všechny těhotné ženy, neboť tento screening není všemi prenatálními centry z důvodu personálního a technického vybavení prováděn (ne všichni to umí), a také zřejmě z toho důvodu, že není plně hrazen ze zdravotního pojištění. Indikací ke kardiologickému vyšetření v 1. trimestru je nejčastěji zvýšené nuchální projasnění, trikuspidální regurgitace nebo podezření na jiné postižení plodu, někdy i nález srdeční vady.
Cílem screeningového vyšetření je odlišení fyziologického nálezu od srdečních abnormalit a následné zajištění další péče o plod s diagnózou srdeční abnormality nebo podezřením na ni. Dle doporučených postupů pro ultrazvukové vyšetření v těhotenství by takový screening měl být dostatečný k vyloučení srdeční vady.
Diagnostika srdeční vady je zajištěna koordinací screeningového a specializovaného vyšetření.
Cílem specializovaného vyšetření je přesné určení srdeční vady nebo poruchy srdečního rytmu, adekvátní informování rodičů o povaze a prognóze onemocnění a léčebných možnostech se znalostí jejich výsledků, návrh a zajištění správné léčby v indikovaných případech, organizace porodu a následné postnatální léčby.(4) Specializované vyšetření srdce plodu provádí dětský kardiolog, který je vysoce erudován v oblasti prenatální kardiologie. Při specializovaném vyšetření srdce je cílem určení anatomie srdce a cév spolu s posouzením stavu fetoplacentární cirkulace. K vyšetření srdce fetálně používáme obdobné projekce, jak je známe z vyšetřování u dětí. Nikdy se však nelze obejít bez řádně zobrazené čtyřdutinové projekce v transverzálním řezu, zobrazení aortálního oblouku v sagitální rovině a pro vyloučení cévní anomálie bez projekce 3 cév a trachey (obr. 1).
Specializované vyšetření je indikováno gynekologem nebo jiným odborným lékařem (např. genetikem) na základě jasných indikačních kritérií. Těmi jsou přítomné rizikové faktory a/nebo nález srdeční vady (nebo podezření na ni).
Etiologii vrozených srdečních vad přesně neznáme. Protože ani identifikace rizikových faktorů nevyloučí možnost přítomnosti srdeční vady u plodu, je screeningové vyšetření všech těhotných v prenatální diagnostice klíčové. Nález nebo podezření na vadu při screeningovém vyšetření je nejsilnějším „rizikovým faktorem“ přítomnosti srdeční vady. Existuje ale celá řada vlivů, které riziko přítomnosti VSV u plodu dále zvyšují. Rizikové faktory zahrnují vlivy ze strany matky (např. autoimunní onemocnění, in vitro fertilizace, užívání některých léků v těhotenství, prodělané infekce), rodiny (přítomnost vrozených vad nebo kardiomyopatie) a plodu (abnormální nález při screeningu, srdeční arytmie nebo abnormální srdeční frekvence, extrakardiální vrozená vývojová vada, chromozomální vada, hydrops, zvýšená nuchální translucence, absence ductus venosus, vícečetné těhotenství, nevysvětlitelný polyhydramnion). Tato rizika, spadající do kategorie I a IIa (level of evidence) a zvyšující riziko VSV o ≥ 3 %, jsou tedy logicky i indikacemi ke specializovanému prenatálnímu kardiologickému vyšetření tak, jak vycházejí z doporučení mnoha odborných společností.(5,6) Absolutní indikací ke specializovanému echokardiografickému vyšetření dětským kardiologem je nález srdeční vady, nebo i podezření na ni.
Součástí specializovaného vyšetření je adekvátní informování rodičů o povaze, léčebných možnostech a prognóze onemocnění s návrhem a zajištěním správné léčby včetně organizace porodu a následné postnatální léčby.
Rozhodnutí o dalším osudu plodu včetně eventuální úvahy o ukončení gravidity má být plně v kompetenci rodičů, kteří jsou zodpovědní za své dosud nenarozené dítě. Finální diagnostika a s ní související informování o možnostech léčby a prognóze srdeční vady má tedy zcela zásadní význam pro další osud těhotenství.
Obr. 1. Ultrazvukové vyšetření srdce v transverzální čtyřdutinové projekci (A), sagitální projekci na aortální oblouk (B) a projekci 3 cév a trachey (C). 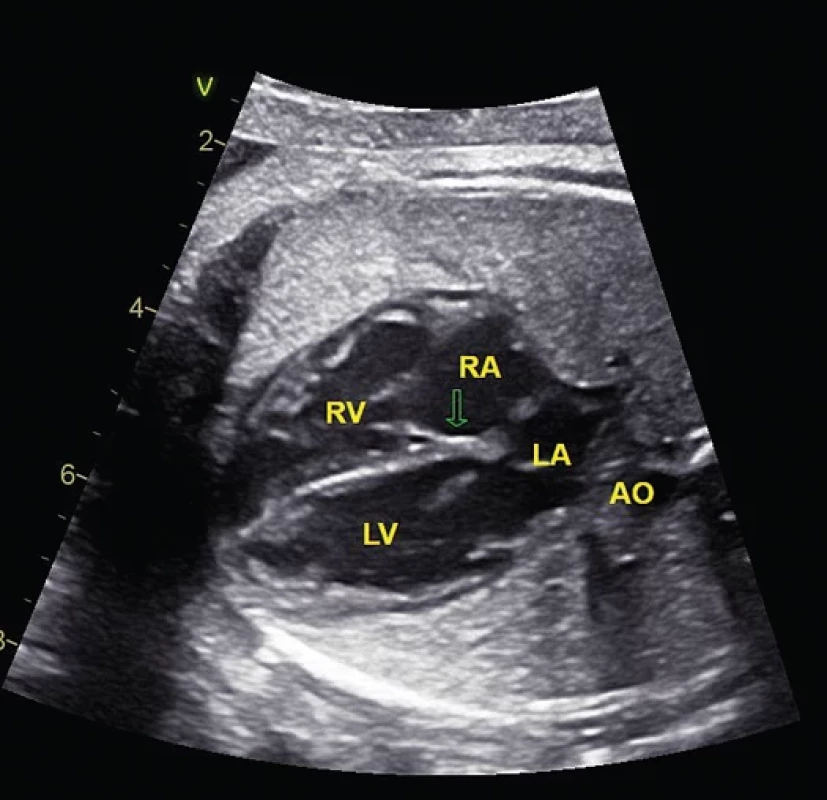

AO – aorta, AOA– aortální oblouk, DA – duktální oblouk, LA – levá síň, LV – levá komora, RA – pravá síň, RV – pravá komora, SVC – horní dutá žíla, T – trachea. VÝSLEDKY DETEKCE VÝZNAMNÝCH SRDEČNÍCH VAD V ČESKÉ REPUBLICE
Cílem fetálního vyšetření je detekce významných srdečních vad. Pojmem významná srdeční vada rozumíme malformaci srdce a cév vyžadující intervenci v prvním roce života. Česká republika patří mezi první země, kde byl zahájen celoplošný prenatální screening srdečních vad. Centralizace péče, dobrá kvalita primárního screeningu prováděného gynekology a spolupráce s dětskými kardiology specializujícími se na prenatální echokardiografii vede k vysokému záchytu VSV, který patří mezi nejvyšší v rámci celé Evropy.(7,8)
V letech 1991–2021 se v ČR živě narodilo 3 300 068 dětí a intrauterinně byl dokumentován nález srdeční vady celkem u 5625 plodů, z nichž 3827 bylo významných. Z celkem 3827 významných VSV se 1646 živě narodilo (43 %), 2069 (54,1 %) bylo na základě rozhodnutí rodičů ukončeno a 112 (2,9 %) zemřelo intrauterinně. Ve stejném období 1991–2021 se narodilo 5454 dětí s významnou VSV. Vzhledem k centralizaci prenatální péče v ČR a existenci jediného pracoviště, kde se léčí děti se srdeční vadou, je možné na základě přesné znalosti o počtu fetálně a postnatálně odhalených vad stanovit úspěšnost fetální detekce významných VSV.(9) Úspěšnost fetální detekce určujeme jako poměr fetálně detekovaných vad versus součet novorozenců s VSV a intrauterinně ukončených VSV. Prenatální detekce se průběžně zvyšovala z 6,2 % v roce 1991 na 82,9 % v roce 2021 (p < 0,001) (obr. 2). Prenatální detekce vad s jednokomorovou cirkulací (mitrální a trikuspidální atrezie, dvojvtoková komora a syndrom hypoplastického levého srdce) se pohybuje mezi 71–100 %. Původně málo úspěšné detekce koarktace aorty a transpozice velkých tepen zásadně stouply na 50 %, resp. 70 % (obr. 3). Nejméně často fetálně detekovanou vadou zůstává izolovaný nález totálního anomálního návratu plicních žil. Vzhledem k tomu, že je snaha o detekci srdeční vady v 1. trimestru poměrně úspěšná, gestační stáří detekovaných významných vad signifikantně kleslo z 23. týdne v roce 1991 na 16. týden v roce 2021 (p < 0,001), medián 18. gestační týden (rozmezí 11.–41. týden).
Další extrakardiální vývojová vada byla přítomna u 1113 z 3827 plodů (29,1 %) s významnou srdeční vadou. Chromozomální anomálie byla odhalena u 811 z 3827 (21,2 %) a strukturální vada u 562 z 3827 plodů (14,7 %).
Ve sledovaném období 31 let bylo ukončeno těhotenství v 54,1 % případů. Relativní četnost ukončení těhotenství ale významně poklesla ze 70 % v roce 1991 na 43 % v roce 2021 (p < 0,001) (obr. 4). Vysoké procento ukončení těhotenství bylo dokumentováno u plodů s jednokomorovou cirkulací (HLH, TA, MA, DIV) a srdečních vad často spojených s významnou extrakardiální vadou (PTA, AVSD, IAA). Právě přítomnost extrakardiální vady má přímý vliv na rozhodnutí pro ukončení těhotenství, nejvýznamněji u vad s jinak příznivou prognózou – TOF, COA, AVSD a TGA (tab. 1).
Od oficiálního zahájení vyšetřování srdce při prvotrimestrálním screeningu v roce 2007 v ČR detekce srdečních vad v 1. trimestru stoupla ze 7,1 % na 26,7 % v roce 2013 (p < 0,001) a dále se již četnost záchytu výrazněji nemění. Extrakardiální anomálie v 1. trimestru jsou 9,5× častější než při detekci srdeční vady ve 2. trimestru. Rovněž nález vady s jednokomorovým srdcem byl častější při diagnóze v 1. trimestru než ve 2. trimestru. Diagnóza srdeční vady v 1. trimestru vede k výrazně vyššímu rozhodnutí pro ukončení těhotenství než nález vady ve 2. trimestru (tab. 2).
Obr. 2. Úspěšnost detekce vrozených srdečních vad, vzestup z 6,2 % v roce 1991 na 82,9 % v roce 2021 (p < 0,001) 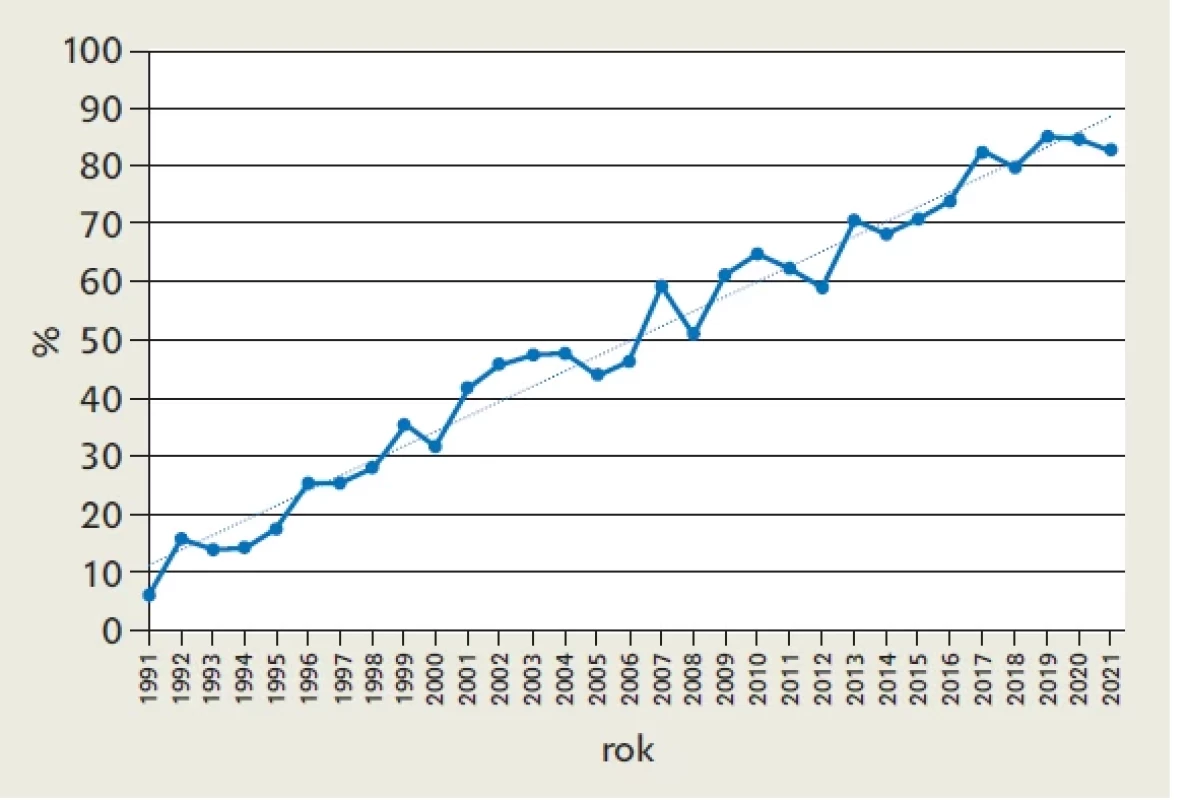
Obr. 3. Prenatální detekce jednotlivých srdečních vad. Úspěšnost detekce je vypočtena jako známý počet plodů se srdeční vadou vs. součet prenatálního a postnatálního záchytu jednotlivých srdečních vad. 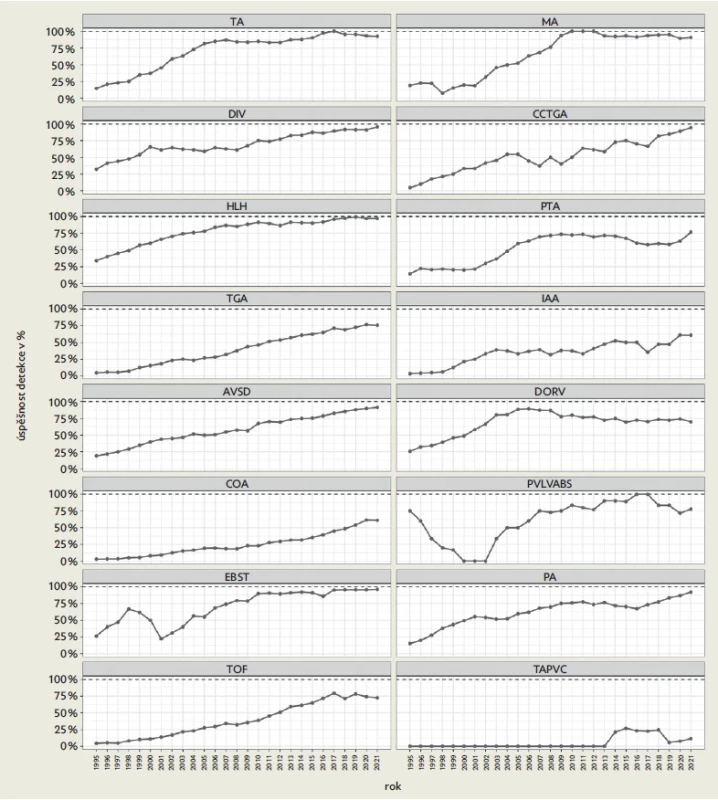
TA – trikuspidální atrezie, MA – mitrální atrezie, DIV – dvojvtoková komora, CCTGA – kongenitálně korigovaná transpozice velkých tepen, HLH – syndrom hypoplazie levého srdce, PTA – perzistující arteriální trunkus, TGA – transpozice velkých tepen, IAA – interrupce aortálního oblouku, AVSD – atrioventrikulární defekt, DORV – dvojvýtoková pravá komora, COA – koarktace aorty, PVLVABS – syndrom aplazie chlopně plicnice, EBST – Ebsteinova anomálie, PA – atrezie plicnice, TOF – Fallotova tetralogie, TAP VC – totální anomální návrat plicních žil. Obr. 4. Relativní četnost umělých ukončení těhotenství u plodů s významnou vrozenou srdeční vadou 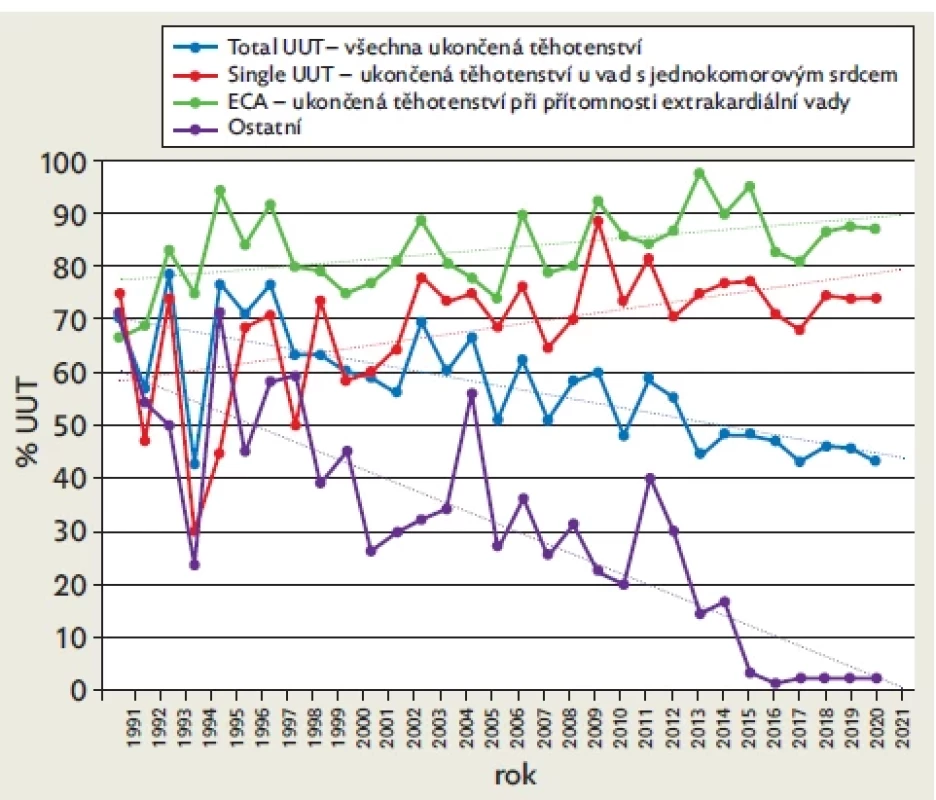
Tab. 1. Vliv přítomné extrakardiální vady (ECA) na ukončení těhotenství (UUT) u jednotlivých vad 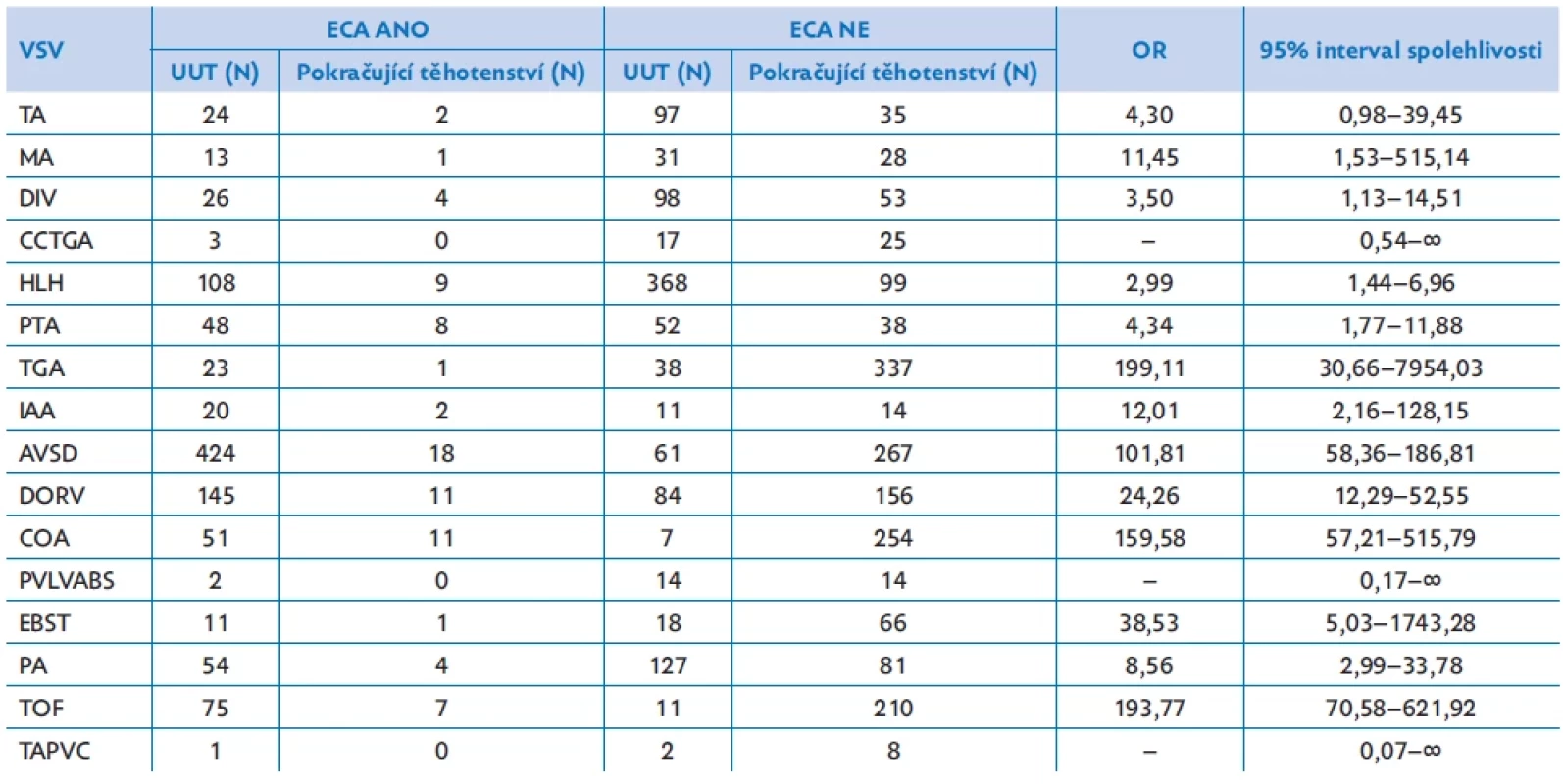
AVSD – atrioventrikulární defekt; CCTGA – kongenitálně korigovaná transpozice velkých tepen; COA – koarktace aorty; DIV – dvojvtoková komora; DORV – dvojvýtoková pravá komora; EBST – Ebsteinova anomálie; ECA – extrakardiální anomálie; HLH – syndrom hypoplazie levého srdce; IAA – interrupce aortálního oblouku; MA – mitrální atrezie; PA – atrezie plicnice; PVLVABS – syndrom aplazie chlopně plicnice; TA – trikuspidální atrezie; TAP VC – totální anomální návrat plicních žil; TGA – transpozice velkých tepen; TOF – Fallotova tetralogie Tab. 2. Srovnání detekovaných srdečních vad v 1. a 2. trimestru, umělého ukončení těhotenství (UUT), nálezu extrakardiální vady (ECA) a vad s jednokomorovým srdcem (SINGLE) v období 2007–2021 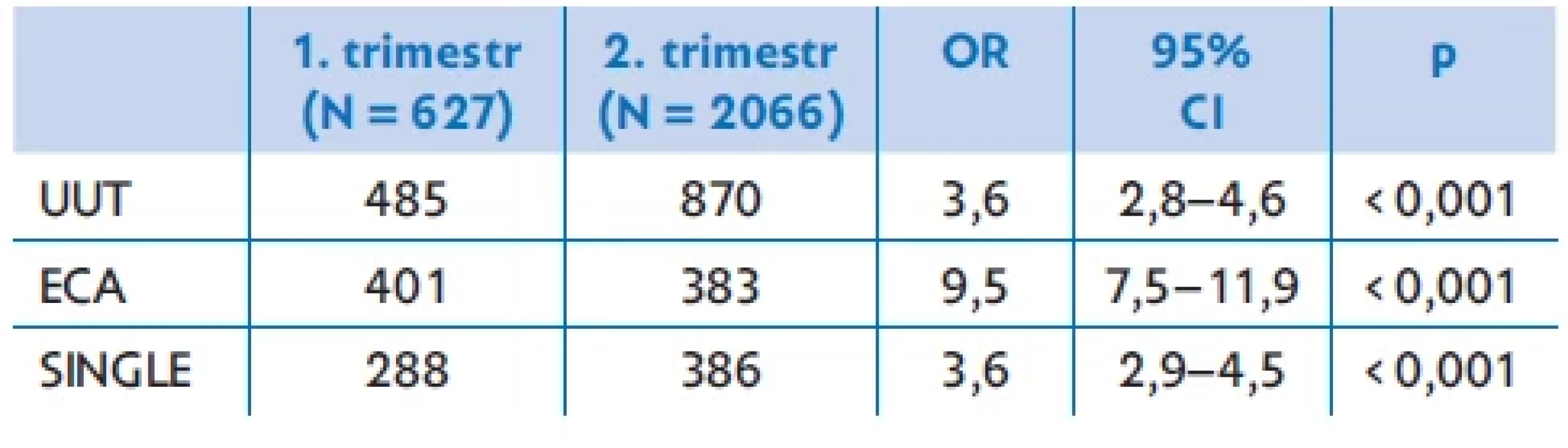
JAKÝ JE DŮSLEDEK PRENATÁLNÍ DETEKCE SRDEČNÍCH VAD?
Hlavní přínos prenatální kardiologie spočívá v detekci kritické vady plodu s následným porodem dítěte s VSV ve specializovaném centru („transport in utero“). To umožní okamžitou péči o nemocného novorozence, který by byl při postnatální diagnóze a zdlouhavém transportu v bezprostředním ohrožení života, a vede zároveň ke zlepšení celkové prognózy.(10)
Variantou při nálezu závažné diagnózy se špatnou nebo nejistou prognózou dítěte je rozhodnutí rodičů graviditu ukončit. Rozhodnutí o dalším osudu těhotenství je ale plně v kompetenci rodičů nebo alespoň těhotné ženy. Role lékaře spočívá v diagnostice, vysvětlení podstaty vady, možného způsobu léčby a informování o očekávatelné prognóze. Informace mají být podány srozumitelně a s náležitou empatií. První informace sdělená rodičům hraje významnou roli v rozhodování o dalším osudu těhotenství.(11,12) Z toho důvodu je nutné, aby informaci o VSV poskytoval zkušený prenatální kardiolog se zkušenostmi s léčbou dětí a nikoliv gynekolog. Většinou lze na základě diagnózy a zkušenosti správně odhadnout osud dítěte. Ale ani tak není přesnost diagnózy absolutní, a někdy je proto obtížné sdělit rodičům, jaká bude přesně postnatální léčba a prognóza.(13) Diagnóza srdeční vady plodu je pro rodiče (zejména matku) velmi traumatizující a stresující záležitost. Je proto nutné při pohovoru s rodiči jednat citlivě a být připraven na to, že takový „counselling“ vyžaduje dostatek času, mnohdy opakované návštěvy a konzultace s dalšími lékaři, někdy i s jinými zdravotnickými specialisty (kontaktní sestra, psycholog).
Četnost ukončení těhotenství v ČR postupně klesá z původních 70 % na současných 43 %. Důvody pro pokles jsou spekulativní, ale mohou souviset s nárůstem věku těhotných, obtížemi otěhotnět a i větší důvěrou ve zlepšující se prognózu dětí s VSV. V posledních letech zaznamenáváme zvýšený počet VSV detekovaných v prvním trimestru.(14) Známým faktem je, že prevalence VSV v nízkém gestačním stáří je vyšší a přítomnost srdeční vady je i častou příčinou intrauterinního úmrtí. Úspěšnou detekcí vad v 1. trimestru se však může falešně zvyšovat záchyt vad u plodů, se kterými bychom se již při druhotrimestrálním vyšetření nesetkali.(15) Na druhé straně se v 1. trimestru odhalí řada plodů s chromozomálními anomáliemi a/nebo závažnými VSV, často s „jednokomorovým srdcem“. I proto je ukončení těhotenství v 1. trimestru výrazně vyšší než v druhém. Přesto ale má celková četnost ukončení těhotenství klesající trend a je obdobně vysoká jako v mnoha jiných zemích.(8,16) Pro některé těhotné je ukončení gravidity obtížně akceptovatelné, zároveň ale připouštějí možnost neléčení dítěte s kritickou komplexní vadou. V zájmu prenatální kardiologie je tak i rozvoj paliativní péče, aby se o novorozence s infaustní prognózou a jeho rodiče pečovalo kvalifikovaně a s náležitou citlivostí.
MOŽNOSTI INTRAUTERINNÍ LÉČBY SRDEČNÍCH ONEMOCNĚNÍ
Možnost intrauterinní léčby srdečních onemocnění je velmi limitovaná a diskutabilní. V situaci, kdy současná postnatální léčba má výborné výsledky s velmi nízkou mortalitou (v Dětském kardiocentru okolo 1 %) a dobrou dlouhodobou prognózou, se úvahy o prenatální léčbě týkají jen výjimečných situací. Tyto situace zahrnují stavy, kdy by plod bez intrauterinní léčby zemřel (srdeční arytmie) nebo přirozený vývoj srdečního onemocnění výrazně zhoršuje prognózu narozeného dítěte (aortální stenóza).
Srdeční arytmie
Nejčastější poruchou srdečního rytmu u plodu je supraventrikulární tachykardie (SVT). K ní dochází na podkladě reentry mechanismu, síňové ektopie nebo síňového flutteru a je nejčastější příčinou neimunního hydropsu plodu.(17) Vyznačuje se patologicky rychlou srdeční frekvencí > 200/min, která bez úspěšného a včasného ovlivnění často vede k úmrtí plodu. Na rozvoji srdečního selhání plodu se podílí řada patofyziologických odlišností fetálních myocytů. Fetální myokard má nižší kontrakční a relaxační schopnost v důsledku menšího aktivního a většího pasivního napětí myofibril. To je způsobeno velkým podílem nekontraktilních proteinů – 60 % ve fetálních myocytech v porovnání s 30 % u dospělých. Při rychlé srdeční frekvenci u SVT dochází k nedostatečnému plnění komor v diastole, sníženému srdečnímu výdeji a zvýšení centrálního žilního tlaku.(18) Vzestup hydrostatického tlaku má za následek únik intravaskulárního objemu přes cévní membránu do intersticia a preformovaných tělních dutin.(19) Hydrops plodu je finální fází selhání fetoplacentárního oběhu. Při intrauterinní léčbě obvykle volíme tzv. transplacentární cestu, spočívající v podávání antiarytmika matce intravenózně nebo perorálně. Při neúspěchu transplacentární léčby lze ve výjimečných případech podat léky přímo plodu – nejčastěji intraumbilikálně, event. intramuskulárně, intraperitoneálně nebo intrakardiálně injekcí. S progresí selhání fetoplacentárního oběhu však efekt léčby klesá. Iniciálně v léčbě supraventrikulární tachykardie nyní používáme převážně perorální flekainid, který je těhotnou obvykle dobře snášen a z komparativní studie je jeho účinnost signifikantně vyšší než dříve používaného digoxinu.(20) Úspěšnost léčby supraventrikulární tachykardie je vysoká a konverze na sinusový rytmus dosahujeme ve více než 90 % léčených případů. Při léčbě flutteru síní používáme obvykle kombinaci digoxinu a sotalolu.
Kompletní atrioventrikulární blokáda se vyskytuje izolovaně nebo u plodů s komplexní srdeční vadou (korigovaná transpozice velkých tepen, atrioventrikulární defekt při izomerismu). Izolovaná blokáda je nejčastěji projevem závažného kardiálního postižení u lupus neonatorum, které může vést k rozvoji srdečního selhání a k intrauterinnímu úmrtí plodu. Transplacentární přenos mateřských autoprotilátek, ke kterému dochází typicky mezi 20.–24. gestačním týdnem, vyvolává zánět a následnou fibrotickou přestavbu v oblasti AV uzlu.(21) Diagnostika atrioventrikulární blokády 1. až 3. stupně je pomocí ultrazvukového vyšetření poměrně snadná. K rozvoji AV blokády může dojít velmi rychle i v průběhu několika hodin, navíc ani podání kortikoidů a imunoglobulinů matce nemusí zabránit rozvoji v kompletní formu.(22)
Možnost terapeuticky ovlivnit kompletní atrioventrikulární blokádu je v prenatálním období (až na přechodný efekt podání betamimetik) nemožná, proto má AV blokáda vysoké riziko intrauterinní, ale i perinatální mortality – zvláště v kombinaci s nezralostí a nízkou porodní hmotností nedonošeného novorozence. Konverze úplné formy atrioventrikulární blokády na sinusový rytmus není možná. Léčba plodů s již vzniklou kompletní blokádou pomocí glukokortikoidů (dexamethason) nepřináší prokazatelný pozitivní efekt pro plod ani novorozence.(23) Nejlepší možností je zábrana vzniku atrioventrikulární blokády vyžadující správnou stratifikaci vysoce rizikové skupiny těhotných, významným rizikem je vysoký titr anti-Ro52 kDa.(24) Velmi slibným lékem v prevenci vzniku atrioventrikulární blokády je hydroxychlorochin.(25)
Srdeční vady
Možnost intrauterinní léčby srdečních vad je (a zřejmě i v budoucnu bude) velmi limitovaná. Provádí se fetální balon-
ková valvuloplastika aortální, nebo i pulmonální chlopně, jejímž cílem je podpora růstu a/nebo úprava funkce komory při významné stenóze. Předpokladem je, že zlepšení průtoku komorou má být podnětem pro správný vývoj komory umožňující biventrikulární cirkulaci.(26) Výsledky jsou sice povzbudivé, ale obtížně porovnatelné s plody bez zákroku.(27)
Dalším možným fetálním zákrokem je balonková atrioseptostomie u kritické aortální stenózy nebo hypoplazie levého srdce. Smyslem uvolnění síňové komunikace je docílit poklesu postkapilární plicní hypertenze, a tím úpravy vývoje plic zlepšující prognózu dítěte. Žádný z těchto zákroků se v ČR neprovádí a fetální intervence referujeme do rakouského Lince.Výsledky této fetální katetrizační intervence nejsou jednoznačné a jsou zatíženy vysokou mortalitou a morbiditou plodů i narozených dětí.(28) Nepochybně proto, že se jedná o velmi závažná srdeční postižení, jejichž léčebné výsledky nejsou ani postnatálně povzbudivé. Obdobnou možností je katetrizační valvuloplastika u kritické pulmonální stenózy. Intrauterinní katetrizační intervence vyžaduje další studie pro prokázání dlouhodobého efektu. Je ale příslibem toho, že existuje varianta ovlivnění nepříznivého vývoje srdeční vady již před narozením a není nutné čekat na porod dítěte s již hypoplastickou nebo dysfunkční dilatovanou komorou.
Závěr
Prenatální detekce významných srdečních vad v České republice je díky vybudovanému screeningu vysoká a její úspěšnost detekce převyšuje 80 %. Tendence rodičů k ukončení těhotenství při nálezu srdeční vady má klesající trend a rozhodne se pro něj 43 % těhotných. Ukončování těhotenství je vysoké u komplexních srdečních vad a při nálezu extrakardiální (obvykle genetické) vady. Možnost léčby vad intrauterinně je (a v dohledné době nejspíše i zůstane) velmi limitovaná. Transplacentární léčba život ohrožujících tachydysrytmií je běžná a velmi úspěšná. |
Podpořeno MZ ČR – RVO, FN v Motole 00064203.
Korespondenční adresa:
MUDr. Viktor Tomek, Ph.D.
Dětské kardiocentrum 2. LF UK a FN v Motole
V úvalu 84 150 06, Praha 5
viktor.tomek@fnmotol.cz
Zdroje
1. Samánek M, Vorísková M. Congenital heart disease among 815,569 children born between 1980 and 1990 and their 15-year survival: a prospective Bohemia survival study. Pediatr Cardiol 1999; 20 : 411–417.
2. van der Linde D, Konings EE, Slager MA, et al. Birth prevalence of congenital heart disease worldwide: a systematic review and meta-analysis. J Am Coll Cardiol 2011; 58(21): 2241–7.
3. Donofrio MT, Moon-Grady AJ, Hornberger LK, et al. Diagnosis and treatment of fetal cardiac disease: a scientific statement from the American Heart Association. Circulation 2014; 129 : 2183–2242.
4. Tomek V, Jičínská H, Klásková E, et al. Odborné stanovisko k organizaci prenatální kardiologie v České republice. Vypracované Pracovní skupinou dětské kardiologie České kardiologické společnosti. Cor Vasa 2020; 62 : 60–62.
5. Moon-Grady, Anita J, et al. Guidelines and recommendations for performance of the fetal echocardiogram: an update from the American Society of Echocardiography. J Am Soc Echocardiogr 2023; 36(7): 769–723.
6. International Society of Ultrasound in Obstetrics and Gynecology; Carvalho JS, Allan LD, Chaoui R, et al. ISUOG Practice Guidelines (updated): sonographic screening examination of the fetal heart. Ultrasound Obstet Gynecol 2013; 41 : 348–359.
7. Jørgensen DE, Vejlstrup N, Jørgensen C, et al. Prenatal detection of congenital heart disease in a low risk population undergoing first and second trimester screening. Prenat Diagn 2015; 35(4): 325–330.
8. Lytzen R, Vejlstrup N, Bjerre J, et al. Live-born major congenital heart disease in Denmark: incidence, detection rate, and termination of pregnancy rate from 1996 to 2013. JAMA Cardiol 2018; 3(9): 829–837.
9. Tomek V, Jičínská H, Pavlíček J, et al. Pregnancy termination and postnatal major congenital heart defect prevalence after introduction of prenatal cardiac screening. JAMA Netw Open 2023; 6(9): e2334069.
10. Quartermain MD, Hill KD, Goldberg DJ, et al. Prenatal diagnosis influences preoperative status in neonates with congenital heart disease: an analysis of the Society of Thoracic Surgeons Congenital Heart Surgery Database. Pediatr Cardiol 2019; 40(3): 489–496.
11. Rempel GR, Cender LM, Lynam MJ, et al. Parents’ perspectives on decision making after antenatal diagnosis of congenital heart disease. J Obstet Gynecol Neonatal Nurs 2004; 33(1): 64–70.
12. Larsson AK, Svalenius EC, Marsal K, et al. Parents’ worried state of mind when fetal ultrasound shows an unexpected finding: a comparative study. J Ultrasound Med 2009; 28 : 1663–1670.
13. Bensemlali M, Stirnemann J, Le Bidois J, et al. Discordances between pre-natal and post-natal diagnoses of congenital heart diseases and impact on care strategies. J Am Coll Cardiol 2016; 68 : 921–30.
14. Persico N, Moratalla J, Lombardi CM, et al. Fetal echocardiography at 11-13 weeks by transabdominal high-frequency ultrasound. Ultrasound Obstet Gynecol 2011; 37(3): 296–301.
15. Zidere V, Bellsham-Revell H, Persico N, Allan LD. Comparison of echocardiographic findings in fetuses at less than 15 weeks‘ gestation with later cardiac evaluation. Ultrasound Obstet Gynecol 2013; 42(6): 679–86.
16. Khoshnood B, Lelong N, Andrieu T, et al.; EPICARD Study Group. Assessing sociodemographic differences (or lack thereof) in prenatal diagnosis of congenital heart defects: a population-based study. BMJ Open 2016; 6(3): e009353.
17. Fouron JC, Proulx F, Gosselin J, Infante-Rivard C. Investigation of fetal arrhythmias by simultaneous recording of ascending aortic and superior vena caval blood flow. Arch Mal Coeur Vaiss 2001; 94 : 1063–1071.
18. Simpson JM, Sharland GK. Fetal tachycardias: management and outcome of 127 consecutive cases. Heart 1998; 79 : 576–581.
19. Naheed ZJ, Strasburger JF, Deal BJ, et al. Fetal tachycardia: mechanisms and predictors of hydrops fetalis. J Am Coll Cardiol 1996; 27(7): 1736–40.
20. Sridharan S, Sullivan I, Tomek V, et al. Flecainide versus digoxin for fetal supraventricular tachycardia: Comparison of two drug treatment protocols. Heart Rhythm 2016; 13(9): 1913–1919.
21. Ho YS, Esscher E, Anderson RH, et al. Anatomy of congenital complete heart block and relation to maternal anti-Ro antibodies. Am J Cardiol 1986; 58 : 291–294.
22. Cuneo BF, Sonesson SE, Levasseur S, et al. Home monitoring for fetal heart rhtyhm during anti-Ro pregnancies. J Am Coll Cardiol 2018; 72(16): 1940–51.
23. Eliasson H, Sonesson SE, Sharland G, et al; for the Fetal Working Group of the European Associaion of Pediatric Cardiology. Isolated atrioventricular block in the fetus: a retrospective, multinational, multicenter study of 175 patients. Circulation 2011; 124(18): 1919–1926.
24. Jaeggi E, Kulasingam V, Chen J, et al. Maternal anti-Ro antibody titers obtained with commercially available immunoassays are strongly associated with immune-mediated fetal heart disease. Arthritis Rheumatol 2023; 75(9): 1556–1565.
25. Izmirly PM, Custodeat-Chalumeau N, Pisoni CN, et al. Maternal use of of hydroxychloroquine is associated with a reduced risk of recurrent anti-SSA/Ro-antibody-associated cardiac manifestation of neonatal lupus. Circulation 2012; 125 : 76–82.
26. Sedmera D, Pexieder T, Rychterova V, et al. Remodeling of chick embryonic ventricular myoarchitecture under experimentally changed loading conditions. Anat Rec 1999; 254 : 238–252.
27. Tulzer A, Arzt W, Gitter R, et al. Valvuloplasty in 103 fetuses with critical aortic stenosis: outcome and new predictors for postnatal circulation. Ultrasound Obstet Gynecol 2022; 59(5): 633–641.
28. Pickard SS, Wong JB, Bucholz EM, et al. Fetal aortic valvuloplasty for evolving hypoplastic left heart syndrome: A decision analysis. Circ Cardiovasc Qual Outcomes 2020; 13(4): e006271.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2024 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Prevence poškození zdraví při sportu
- Současný pohled na prevenci infekční endokarditidy v dětství v České republice
- Z Lobkowiczké sbírky na Pražském hradě
- Porucha příjmu potravy kojenců a batolat
- Diferenciální diagnostika polyurie-polydipsie
- Úrazy břicha u dětí – identifikace, základní principy klinické rozvahy a léčby
- Co jsme psali
- Chemická pleurodéza s použitím jodovaného povidonu (Betadine) u vrozeného chylothoraxu: vlastní zkušenost a přehled literatury
- Cena ministra zdravotnictví za zdravotnický výzkum a vývoj
- 70 let Fakulty dětského lékařství Univerzity Karlovy v Praze
- Zemřel profesor MUDr. Bohumil Hučín, DrSc.
- Humor & poezie
- Editorial
- Preventivní kardiologie v pediatrii
- Prenatální kardiologie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika polyurie-polydipsie
- Úrazy břicha u dětí – identifikace, základní principy klinické rozvahy a léčby
- Současný pohled na prevenci infekční endokarditidy v dětství v České republice
- Porucha příjmu potravy kojenců a batolat
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




