-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Spinálna muskulárna atrofia u novorodenca
Spinal muscular atrophy in newborn
Spinal muscular atrophy (SMA) is an autosomal recessive inheritable neurodegenerative disease caused by mutation of the SMN1 gene encoding a protein essential for the survival of motoneurons of the anterior corners of the spinal cord and brainstem nuclei. The disease leads to progressive muscle weakness, skeletal muscle atrophy, and respiratory insufficiency, while sensory sensitivity and cognitive functions remain preserved. The disease is classified based on the age of onset of symptoms, the highest level of psychomotor development achieved, and expected life expectancy. The diagnostic standard is a molecular-genetic examination. In recent years, causal disease-modifying treatment has been introduced into clinical practice, thanks to which patients with SMA can reach higher motor milestones. A pilot study of neonatal screening for SMA was launched last year in Czech Republic and Slovakia, which can detect the disease in an asymptomatic stage. Early recognition and initiation of therapy leads to significant improvement of prognosis and quality of life in patients. The collective of authors presents a case report of a newborn transferred to the Neonatology Clinic of the University Hospital in Martin, who was diagnosed with the most severe form of SMA type 0 with symptoms present since birth, with an inauspicious prognosis.
Keywords:
spinal muscular atrophy – newborn – hypotonus – SMA type 0
Autoři: Kuderavá Zuzana 1; Kozár Marek 1; Jurko Tomáš 1; Lenhartová Nina 2; Suroviaková Stanislava 3; Zibolen Mirko 1
Působiště autorů: Neonatologická klinika, Jesseniova lekárska fakulta v Martine, Univerzitná nemocnica Martin, Slovensko 1; Oddelenie lekárskej genetiky, Jesseniova lekárska fakulta v Martine, Univerzitná nemocnica Martin, Slovensko 2; K linika detí a dorastu, Jesseniova lekárska fakulta v Martine, Univerzitná nemocnica Martin, Slovensko 3
Vyšlo v časopise: Čes-slov Pediat 2023; 78 (4): 206-209.
Kategorie: Kazuistika
doi: https://doi.org/10.55095/CSPediatrie2023/036Souhrn
Spinálna muskulárna atrofia (SMA) je autozómovo recesívne dedičné neurodegeneratívne ochorenie spôsobené mutáciou SMN1 génu kódujúceho proteín, ktorý je nevyhnutný pre prežívanie motoneurónov predných rohov miechy a jadier mozgového kmeňa. Ochorenie vedie k progresívnej svalovej slabosti, atrofizácii kostrových svalov a respiračnej insuficiencii, pričom senzitívna citlivosť a kognitívne funkcie ostávajú zachované. Ochorenie je klasifikované na základe veku nástupu symptómov, najvyššieho dosiahnutého stupňa psychomotorického vývinu a predpokladanej dĺžky života. Diagnostickým štandardom je molekulovo-genetické vyšetrenie. V posledných rokoch bola do klinickej praxe zavedená kauzálna liečba zásadne modifikujúca ochorenie, vďaka ktorej sú pacienti s SMA schopní dosiahnuť vyššie motorické míľniky. V priebehu minulého roka bola v Českej republike a na Slovensku spustená pilotná štúdia novorodeneckého skríningu SMA, ktorým je možné zachytiť ochorenie ešte v asymptomatickom štádiu. Včasné rozpoznanie a zahájenie terapie vedie k signifikantnému zlepšeniu prognózy a kvality života pacientov. Kolektív autorov predkladá kazuistiku novorodenca preloženého na Neonatologickú kliniku Univerzitnej nemocnice v Martine, u ktorého bola diagnostikovaná najťažšia forma SMA typu 0 so symptómami prítomnými už od narodenia, s infaustnou prognózou.
Klíčová slova:
novorodenec – spinálna muskulárna atrofia – hypotonus – SMA typu 0
ÚVOD
Spinálna muskulárna atrofia (SMA) je závažné hereditárne neurodegeneratívne ochorenie spôsobené stratou buniek predných rohov miechy a jadier mozgového kmeňa s následnou stratou funkcie motoneurónov. Ochorenie vedie k progresívnej svalovej slabosti, hypotónii a atrofii kostrových svalov.(1) V literatúre sa udáva incidencia SMA 1 : 10 000 – 11 000 živonarodených detí.(2,3)
Z genetického hľadiska ide o autozómovo recesívne ochorenie, ktoré je výsledkom poškodenia SMN1 génu lokalizovaného na dlhom ramienku chromozómu 5. Tým dochádza k neadekvátnej produkcii proteínu nazývaného survival motor neuron (SMN), nevyhnutného pre prežívanie motorických neurónov.(1,3) SMN proteín je prítomný v každej bunke tela s najvyššou koncentráciou v mozgu, mieche a obličkách.(1)
Približne 95 % pacientov s SMA je nositeľom homozygotnej delécie exónu 7 v SMN1 géne, zvyšných 5 % pacientov má heterozygotnú mutáciu, a to deléciu kombinovanú s bodovou mutáciou. Uvádza sa, že 1 z 50–200 ľudí je nositeľom mutácie génu SMN1.(1) Vo väčšine prípadov sú rodičia zdravými prenášačmi ochorenia, pričom každý rodič má jednu normálnu a jednu mutovanú kópiu génu. Len 2 % prípadov tvoria de novo mutácie.(1,2)
Variabilita ochorenia a jeho klinická prezentácia závisia od prítomnosti adjuvantného a takmer identického génu SMN2, ktorý dokáže čiastočne nahradiť funkciu poškodeného génu. Pri 10–15 % jeho transkriptov nedochádza k zostrihu (splicingu) exónu 7, čo umožňuje tvorbu plnohodnotného, funkčného SMN proteínu. Čím viac kópií tohto génu u pacienta existuje, tým miernejšie sú prejavy ochorenia.(1)
Tradičná klasifikácia SMA, ktorá vznikla v čase nedostupnosti kauzálnej terapie, rozlišuje jednotlivé typy SMA na základe veku nástupu symptómov, ich závažnosti, najvyššieho dosiahnutého stupňa psychomotorického vývinu a predpokladanej dĺžky života (tab. 1). Táto klasifikácia sa bude pravdepodobne meniť, pretože kauzálna liečba mení doposiaľ známe fenotypy ochorenia.
Tab. 1. Klasifikácia spinálnej muskulárnej atrofie(1,3) 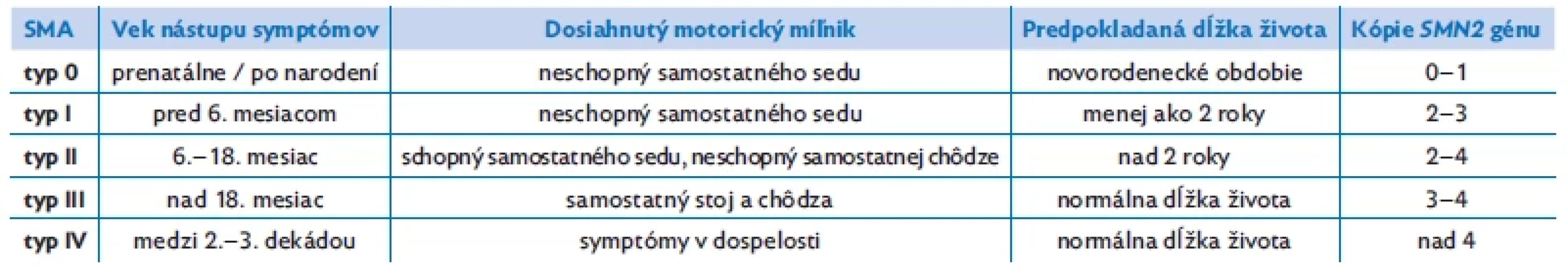
Spoločným znakom všetkých typov SMA je progredujúca svalová slabosť. Závažne denervované svaly môžu obsahovať niekoľko reziduálnych motorických jednotiek, ktoré sú sporadicky aktivované, čo sa v klinickom obraze prejaví napríklad ako fascikulácie jazyka alebo zášklby prstov.(4) Senzitívna citlivosť a kognitívne funkcie u pacientov s SMA ostávajú zachované. Okrem neurologickej symptomatiky sa u týchto pacientov vyskytujú srdcové arytmie, gastrointestinálne ťažkosti, abnormality glukózového metabolizmu a poruchy kostného metabolizmu. Celkový stav môže byť komplikovaný hypoventiláciou a respiračnou insuficienciou.(1,4,5)
KAZUISTIKA
Donosený eutrofický chlapec (pôrodná hmotnosť 3620 g) narodený spontánne záhlavím v ukončenom 39. gestačnom týždni v spádovej nemocnici. Jedná sa o dieťa z 2. nekomplikovanej gravidity, so starším zdravým súrodencom (sestra). Prenatálne bol ultrasonograficky popisovaný nuchálny edém a dominancia pravých oddielov srdca, inak bez iných zjavných vývojových chýb. Rast plodu bol proporčný, symetrický. Neinvazívny prenatálny genetický test z periférnej krvi (NIFTY – neinvazívny fetálny trisomy test) bol negatívny, amniocentéza nebola realizovaná pre nesúhlas rodičov. Pôrod dieťaťa bol nekomplikovaný, avšak bezprostredná popôrodná adaptácia bola významne zhoršená (Apgarovej skóre 2/5/5 bodov) s potrebou stabilizácie vitálnych funkcií na pôrodnej sále a následne s pretrvávajúcou potrebou neinvazívnej ventilačnej podpory formou CPAP s oxygenoterapiou do 45 %. Vo vstupnom vyšetrení acidobázickej rovnováhy (v prvej hodine života) bola zaznamenaná kombinovaná acidóza s významnejšou respiračnou zložkou. Vzhľadom na významnú poruchu popôrodnej adaptácie, pretrvávajúcu potrebu ventilačnej podpory (už bez oxygenoterapie) a výrazný hypotonus bol indikovaný preklad dieťaťa na naše pracovisko.
Pri príjme na Novorodeneckú kliniku UNM malo dieťa nasledovné neurologické príznaky: absencia spontánnej pohybovej aktivity – prítomné iba minimálne pohyby prstov na rukách, dominuje výrazný hypotonus celého tela, fascikulácie jazyka a výrazné slinenie, kašľací a dávivý reflex boli nevýbavné. Chlapček spontánne otváral oči a sledoval okolie, očné štrbiny boli symetrické, zrenice izokorické, fotoreakcia bilaterálne výbavná. Chrbtica bez defektu neurálnej trubice. Zo somatických príznakov boli prítomné pterygium colli, hypotrofické svaly predkolenia s výraznou hypertrichózou na lýtkach a incipientné kontraktúry lakťov a kolien (obr. 1). Pre rozvoj respiračnej insuficiencie pri nedostatočnej spontánnej dychovej aktivite vyžadoval umelú pľúcnu ventiláciu. Pre auskultačne zachytený systolický šelest a prenatálny USG nález realizovaná echokardiografia s nálezom defektu predsieňového septa s ľavo – pravým skratom, dieťa bolo počas hospitalizácie kardiálne kompenzované. Výživa bola zabezpečená parenterálne, s postupným zahájením kŕmenia gastrickou sondou. Z úst bolo pravidelne odsávané veľké množstvo slín pri poruche prehĺtania.
Na základe neurologického vyšetrenia bol stav hodnotený ako generalizovaný hypotonický syndróm s nevýbavnými šľachovookosticovými reflexami. Ultrasonografické vyšetrenie mozgu bolo bez jednoznačného patologického nálezu. Magnetická rezonancia mozgu a spinálneho kanála (v rozsahu po Th7) vylúčila transverzálnu léziu miechy, na mozgu bol popísaný hemoragický lem v okcipitálnych rohoch postranných komôr a lem degradačných produktov hemoglobínu pozdĺž falx cerebri dorzálne, pozdĺž tentoria a sinus rectus a okolo dorzálnej časti mozočka, parenchým bol bez hypoxicko-ischemických zmien. V laboratórnych vyšetreniach bola zaznamenaná mierna elevácia svalových enzýmov a amoniaku, ostatné parametre boli v medziach normy.
Obr. 1. Novorodenec s SMA typu 0 (zdroj: archív autorov) 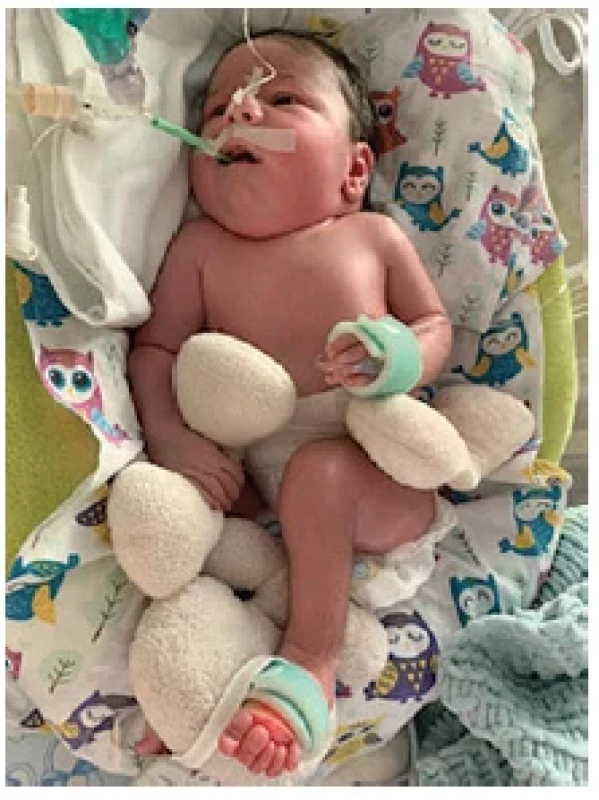
Vzhľadom na neurologický nález a výsledok MR vyšetrenia bolo vyjadrené podozrenie na spinálnu muskulárnu atrofiu (SMA). Cytogenetické vyšetrenie vylúčilo chromozómovú aberáciu. DNA analýzou génov SMN1 a SMN2 bola potvrdená SMA so závažným fenotypom (fetálna SMA typu 0) s homozygotnou deléciou exónu 7 a 8 génu SMN1, v genóme bola prítomná iba jedna kópia exónov 7 a 8 génu SMN2.
Za účelom škálovania ochorenia a zváženia terapeutických možností bolo dieťa preložené do Neuromuskulárneho centra v Banskej Bystrici. Elektromyografickým vyšetrením bola diagnostikovaná ťažká axonálna motorická lézia bez známok aktívne prebiehajúcej reinervácie. Po multidisciplinárnom konzíliu nebolo dieťa indikované na špecifickú liečbu spinálnej muskulárnej atrofie. Rodičia boli následne informovaní o infaustnej prognóze ochorenia. Súhlasili s paliatívnou starostlivosťou, ktorá bola ďalej realizovaná na Neonatologickej klinike UNM a po dosiahnutí 44. postkoncepčného týždňa na Klinike detskej anesteziológie a intenzívnej medicíny UNM, kde chlapček exitoval vo veku 2 mesiacov následkom opakovaných infektov, progredujúcej respiračnej insuficiencie a kardiálneho zlyhania.
U rodičov dieťaťa bola realizovaná DNA analýza, kde u otca aj matky je prítomná iba 1 kópia exónu 7 SMN1 génu. U otca sú prítomné dve kópie SMN2 génu, u matky jedna kópia SMN2 génu. DISKUSIA Najzávažnejšími formami spinálnej muskulárnej atrofie sú typ 1 s nástupom symptómov pred 6. mesiacom života dieťaťa a fetálna SMA typu 0, kedy sú symptómy pozorované už tesne po narodení. SMA typu 0 je veľmi zriedkavá, incidencia sa uvádza menej ako 5 %.(1,4) Matky týchto detí často udávajú zníženú pohybovú aktivitu plodu počas 3. trimestra, čo poukazuje na fakt, že k ireverzibilným stratám motoneurónov dochádza už in utero alebo v skorom perinatálnom období.(6,7) U pacientov s SMA je popisovaný vyšší výskyt nuchálnej translucencie počas prenatálneho USG skríningu.(2,8)
Novorodenci s SMA majú nízku spontánnu pohybovú aktivitu končatín, často obmedzenú na prsty a palce. Dominuje hypotónia, pričom proximálne svaly sú viac postihnuté ako distálne, nohy sú viac postihnuté ako ruky. Šľachovookosticové reflexy bývajú nevýbavné.(3,9) U veľmi závažných prípadov sa novorodenec s SMA môže narodiť s artrogryposis multiplex congenita, kde sú končatiny deformované kongenitálnymi svalovými kontraktúrami. Mimické svaly sú relatívne zachované, preto tieto deti vyzerajú byť čulé a reagujúce na podnety z okolia. Slabosťou sú však postihnuté svaly jazyka a žuvacie svaly, oslabený je sací reflex. Kŕmenie novorodenca s SMA je tak sťažené pre poruchu sania a prehĺtania, čo spolu s gastroezofageálnou dysmotilitou a refluxom býva príčinou častých aspirácií.(2,8) Napriek zachovanej funkčnosti bránice, slabosť interkostálnych svalov vedie k respiračnej nedostatočnosti s častou potrebou ventilačnej podpory. Typický je zvonovitý tvar hrudníka. Niekoľko štúdií tiež ukázalo vyššiu incidenciu kardiologických malformácií u pacientov s SMA, a to hlavne štrukturálnych zmien s prevahou septálnych defektov a abnormalít výtokového traktu. Popisovaný je aj vyšší výskyt srdcových arytmií.(8,10)
Prognóza detí s SMA typu 0 je veľmi nepriaznivá s dĺžkou prežitia v priemere 1 mesiac. Príčinou smrti býva aspirácia, respiračné zlyhanie alebo infekcia. Deti s SMA typu 1, u ktorých sa ochorenie prezentuje pred 6. mesiacom života, sa zvyčajne dožívajú 1–2 rokov. Najčastejšou príčinou úmrtia býva taktiež respiračné zlyhanie.(2,11)
Diagnostika ochorenia sa opiera o anamnézu a klinický obraz, pričom zlatým štandardom je molekulovo-genetické vyšetrenie metódou MLPA (multiplex ligation-dependent probe amplification).(11,12) Vyšetrenie je zamerané na určenie počtu kópií exónov 7 SMN1 a SMN2 génu. Rozhodujúci pre diagnózu SMA je nález delécie oboch kópií exónu 7. U prenášačov sa zachytí iba 1 kópia exónu 7 SMN1 génu (rodičia nášho pacienta). Ak je však prítomná iba 1 kópia a klinický nález je typický pre SMA, môže ísť o heterozygota s ďalším typom mutácie, preto je indikovaná sekvenčná analýza génu, ktorá je schopná odhaliť aj bodovú mutáciu.(3) K pomocným vyšetreniam patrí stanovenie sérových hladín kreatínkinázy (elevácia až do 5-násobku referenčnej hodnoty) a elektromyografia. Svalová biopsia je realizovaná len v ojedinelých prípadoch.(2,12)
Koncom minulého roka bola na Slovensku (pod záštitou Ministerstva zdravotníctva v spolupráci so Skríningovým centrom) spustená pilotná štúdia novorodeneckého skríningu SMA a ťažkej kombinovanej imunodeficiencie (SCID – severe combined immunodeficiency disease). U nášho pacienta bola však SMA diagnostikovaná ešte pred jej zahájením. Skríning SMA u novorodencov sa realizuje v rámci celoplošného metabolického skríningu pri odbere suchej kvapky krvi z päty dieťaťa (aktuálne bol na Slovensku ukončený v apríli tohto roku), a to genetickou metódou PCR. Skríning je schopný detegovať delécie exónov v SMA1 géne, a teda zachytiť 95 % všetkých prípadov. Zvyšných 5 % pacientov s heterozygotnou mutáciou skríning nezachytí. Rovnako nedokáže určiť čas nástupu symptómov a typ SMA. Výhodou však ostáva skorá diagnostika ochorenia ešte v asymptomatickom štádiu a možnosť terapeuticky zasiahnuť už pri objavení sa prvých príznakov ochorenia.(13) Pri včasnom rozpoznaní ochorenia a včasnom zahájení terapie môžu pacienti dosiahnuť vývojové motorické míľniky, ktoré by bez liečby nedosiahli, čím sa výrazne zlepší kvalita ich života.(3,13)
Za posledné roky boli uvedené do praxe kauzálne liečivá zásadne modifikujúce ochorenie. Patria k nim nusinersen, onasemnogen abeparvovec a risdiplam (tab. 2). Aj keď sa ukázala ich bezpečnosť a účinnosť, ich dlhodobé benefity ostávajú otázne a vyžadujú si ďalšie štúdium. Dôležité je včasné zahájenie liečby. Naďalej sú snahy o optimalizáciu génovej terapie, skúmanie efektu kombinovanej terapie a vo fáze výskumu sú látky na zlepšenie funkcie svalovej hmoty (inhibítory myostatínu a FSTA – fast skeletal muscle troponin activator, teda rýchle troponínové aktivátory kostrových svalov).(3,12) Kľúčovou ostáva podporná liečba s cieľom prevencie alebo liečby vzniknutých komplikácií SMA, a to predovšetkým podporná ventilačná liečba, dychová rehabilitácia a rehabilitácia s prevenciou vzniku kontraktúr. Pre bulbárnu slabosť a gastrointestinálnu dysmotilitu je potrebné sledovanie nutričného statusu. Dôležité je aj sledovanie denzity kostí a koncentrácie vitamínu D.(14,15)
Tab. 2. Aktuálne dostupné možnosti liečby SMA(3,12) 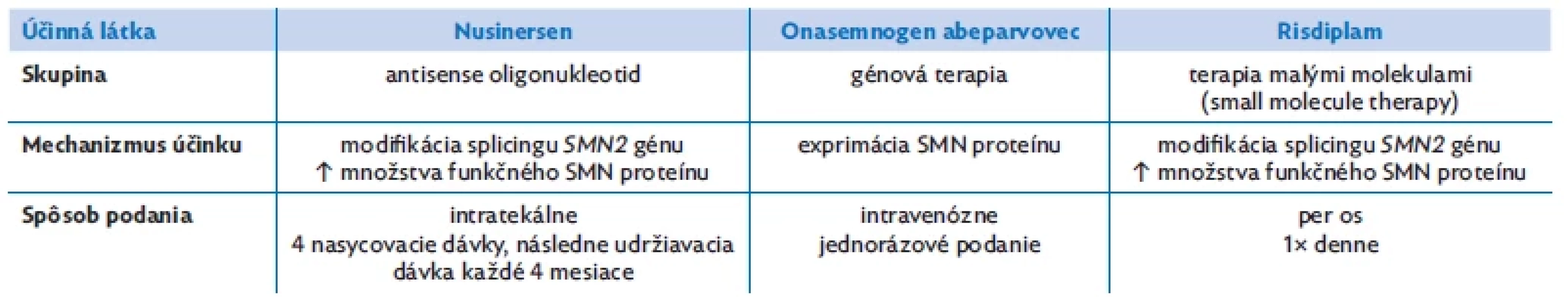
Pri pacientoch s SMA typu 0, ktorí sú symptomatickí už pri narodení, zvažujeme benefit voči riziku liečby. Pacient prezentovaný v našej kazuistike, ktorý mal v čase prehodnocovania liečby dva týždne života, mal plne rozvinuté symptómy svedčiace pre rozsiahle nezvratné poškodenie motoneurónov a závažnú respiračnú insuficienciu vyžadujúcu nepretržitú umelú pľúcnu ventiláciu. Vzhľadom na nedostatok údajov o efekte liečby nusinersenom a onasemnogen abeparvovecom u symptomatických pacientov s SMA typu 0 nebola uňho táto liečba indikovaná.(7) Liečba risdiplamom je indikovaná až od veku 2 mesiacov, ktorý pacient dosiahol v deň úmrtia.
ZÁVER
Spinálna muskulárna atrofia je neurodegeneratívne ochorenie negatívne ovplyvňujúce funkciu motoneurónov. Najzávažnejší a zároveň aj najvzácnejší je SMA typu 0 s klinickou manifestáciou už v novorodeneckom období. Diagnostika sa opiera o typický klinický obraz a cielené genetické vyšetrenie. Novozavedený novorodenecký skríning SMA dokáže zachytiť väčšinu pacientov (95 %) ešte v asymptomatickom štádiu, čo výrazne zlepšuje vyhliadky a kvalitu života pacienta. V prípade potvrdenia diagnózy je dôležitá včasná kauzálna liečba, ktorá dokáže stabilizovať progresiu ochorenia a umožňuje dosiahnuť motorické míľniky, ktoré by pacient bez liečby nedosiahol. Dôležitá je tiež podporná terapia s multiodborovým prístupom. V predkladanej kazuistike sme odprezentovali chlapčeka s typickým klinickým obrazom spinálnej muskulárnej atrofie typu 0, u ktorého boli symptómy ochorenia prítomné už od narodenia, so skorým fatálnym koncom.
Korešpondenčná adresa:
MUDr. Marek Kozár, PhD.
Neonatologická klinika JLF UK a UNM
Kollárova 2
036 59 Martin
Slovensko
1marekkozar1@gmail.comCes-slov Pediat 2023; 78(4): 206–209
Zdroje
1. R oss LF, Kwon JM. Spinal muscular atrophy: past, present and future. Neo - Reviews 2019; 20(8): 437–451.
2. M arkowitz JA, Tinkle MB, Fischbeck KH. Spinal muscular atrophy in neonate. JOGNN 2003; 33(1): 12–20.
3. N icolau S, Waldrop MA. Spinal muscular atrophy. Semin Pediatr Neurol 2021; 37 : 1–7.
4. A rnold AS, Fischbeck KH. Spinal muscular atrophy. In: Geschwind DH, et al. Handbook of Clinical Neurology. United States: Elsevier 2018 : 591–601.
5. H amilton G, Gillingwater TH. Spinal muscular atrophy: going beyond the motor neuron. Trends Mol Med 2013; 19(1): 40–50.
6. F idzianska A, Rafalowska J. Motoneuron death in normal and spinal muscular atrophy-affected human fetuses. Acta Neuropathologica (Berlin) 2002; 104(4): 363–368.
7. Glascock J, Sampson J, et al. Treatment algorithm for infants diagnosed with spinal muscular atrophy through newborn screening. J Neuromuscul Dis 2018; 5 : 145–158.
8. Grotto S, Cuisset JM, et al. Type 0 spinal muscular atrophy: Further delineation of prenatal and postnatal features in 16 patients. J Neuromuscul Dis 2016; 29(4): 487–495.
9. Č ičová S, Oríšková E, et al. Predčasne narodený novorodenec s hypotonickým syndrómom a kryptorchizmom. Čes-slov Pediat 2019; 74(5): 271–274.
10. Wijngaarde CA, Blank AC. Cardiac pathology in spinal muscular atrophy: a systematic review. Orphanet J Rare Dis 2017; 12 : 67.
11. Balážová P, Kolníková M. Spinálna muskulárna atrofia, diagnostické možnosti a liečba. Pediatr Prax 2019; 20(6): 239–242.
12. K olníková M, Viestová K, et al. Spinálna muskulárna atrofia – prvé skúsenosti s liečbou nusinersenom na Slovensku. Neurol Praxi 2021; 22(2): 114–120.
13. K napková M, Okáľová K, et al. Nové ochorenia vhodné na novorodenecký skríning na Slovensku. Pediatr Prax 2020; 21(2): 52–54.
14. M ercuri E, Finkel RS, et al. Diagnosis and management of spinal muscular atrophy: Part 1 Recommendation for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul Disord 2018; 28 : 103–115.
15. F inkel RS, Mercuri E, et al. Diagnosis and management of spinal muscular atrophy: Part 2 Pulmonary and acute care, medications, supplements and immunization, other organ systems and ethics. Neuromuscul Disord 2018; 28 : 197–207.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2023 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Jindřich Štyrský: Člověk nesený větrem
- Co jsme psali
- Dopis redakci
- Editorial
- Periodické horečky, autoinflamatorní nemoci
- Spinálna muskulárna atrofia u novorodenca
- Využitie kontrastnej ultrasonografie v diagnostike hepatálnych tumorov u novorodencov
- Trendy v liečbe inguinálnej hernie u detí
- Distribuce tuku podle obvodu pasu a poměru pas/výška u českých sedmiletých dětí – projekt COSI 2016–2019
- Evaluácia programu sociálneho a emocionálneho učenia Zippyho kamaráti
- Úloha neutrofilov a neutrofilných extracelulárnych pascí pri renálnych ochoreniach bakteriálneho pôvodu
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Periodické horečky, autoinflamatorní nemoci
- Trendy v liečbe inguinálnej hernie u detí
- Spinálna muskulárna atrofia u novorodenca
- Využitie kontrastnej ultrasonografie v diagnostike hepatálnych tumorov u novorodencov
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



