-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Periodické horečky, autoinflamatorní nemoci
Periodic fever syndrome, autoinflammatory diseases
Autoinflammatory diseases (AID) include a diverse group of diseases defined by dysregulation of the innate immune system. Clinical manifestations of sterile inflammation include usually episodic fever with variable presence of organ involvement. A more detailed understanding of the etiopathogenetic background of AID opens new perspectives for targeted therapies. Disease activity control and prevention of organ damage are the main treatment goals. Multidisciplinary management of AID should be concentrated in specialised centers.
The best known group of AIDs,periodic fever syndromes,include Familial Mediterranean fever (FMF), Mevalonate kinase deficiency (MKD), Tumor necrosis factor receptor-associated periodic syndrome (TRAPS), Cryopyrin-associated periodic syndromes (CAPS) and Periodic fever with aphthae, pharyngitis and cervical adenitis (PFAPA ).
The article provides general information about the group of autoinflammatory diseases and the most common types of periodic fevers.
Keywords:
interleukin 1 – next generation sequencing (NGS) – Cytokines – fever – gene – autoinflammatory diseases – periodic fever syndrome
Autoři: Fingerhutová Šárka; Doležalová Pavla
Působiště autorů: Klinika pediatrie a dědičných poruch metabolismu, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze ; Centrum vysoce specializované péče pro vzácná dětská revmatická a autoinflamatorní onemocnění ERN RITA
Vyšlo v časopise: Čes-slov Pediat 2023; 78 (4): 199-205.
Kategorie: Kapitoly k atestaci z pediatrie
doi: https://doi.org/10.55095/CSPediatrie2023/035Souhrn
Autoinflamatorní onemocnění (AID) zahrnují pestrou skupinu chorob definovaných porušenou regulací vrozeného imunitního systému. Rychlost rozvoje této oblasti umožňují především citlivější metody genetického vyšetření. Klinickým projevem sterilního zánětu bývá epizodická horečka v doprovodu různého orgánového postižení. Detailnější pochopení etiopatogenetického pozadí AID otevírá nové perspektivy cílené terapii. Cílem léčby je kontrola aktivity onemocnění a prevence poškození orgánů. Péče o pacienty s AID by měla být vedena multidisciplinárním týmem v rámci centra vysoce specializované péče.
Nejdéle známou skupinou AID jsou syndromy periodické horečky, kam řadíme familiární středomořskou horečku (FMF), deficit mevalonátkinázy (MKD), periodický syndrom asociovaný s receptorem pro tumor nekrotizující faktor (TRAPS), periodické horečky asociované s kryopyrinem (CAPS) a periodickou horečku s afty, faryngitidou a krční adenitidou (PFAPA ).
Článek poskytuje základní obecné informace o skupině autoinflamatorních nemocí a nejčastějších typech periodických horeček.
Klíčová slova:
cytokiny – sekvenování nové generace (NGS) – horečka – autoinflamatorní onemocnění – gén – periodické horečky – interleukin 1
ÚVOD
Termín autoinflamatorní onemocnění (autoinflammatory diseases, AID) byl v literatuře poprvé použit roku 1999, kdy jej Kastner a OʼShean zmínili v kontextu objevu prvních dvou genů způsobujících syndromy periodických horeček. Jednalo se konkrétně o gen pro familiární středomořskou horečku (FMF) a periodický syndrom asociovaný s receptorem pro tumor nekrotizující faktor (TRAPS).(1)
Z historického pohledu medicíny se jedná o poměrně novou skupinu chorob, nicméně projevy těchto syndromů lze v literárních pramenech dohledat již mnohem dříve. Za dvacet let existence pojmu AID došlo k odhalení řady nových klinicky a geneticky definovaných chorob, další jednotky této skupiny však i nadále přibývají. Citlivější molekulárně genetické metody (např. sekvenování nové generace – NGS) s využitím funkčních (zejména imunologických) studií pomáhají odhalovat taje patofyziologických mechanismů a potvrzovat unikátní a velmi vzácné nozologické jednotky, které svou prevalencí bohatě naplňují definici vzácných onemocnění dle WHO. Kromě frekvence jednoho a méně nemocných na 2000 jedinců jsou vzácná onemocnění charakterizována svým závažným chronickým, často celoživotním průběhem limitujícím kvalitu a mnohdy i délku života postižených.(2,3)
Navzdory četnosti výskytu AID musel být pohled na řadu jiných prozánětlivých stavů a jejich diferenciální diagnostiku v kontextu této skupiny pozměněn hned v celé řadě oborů.
AUTOINFRAMATORNÍ VERSUS AUTOIMUNITNÍ
Imunitní systém je souhrn homeostatických pochodů, které zajišťují integritu organismu mechanismem odlišení cizích struktur od tělu vlastních. U zdravých jedinců se tato funkce projevuje jako obranyschopnost, autotolerance a imunitní dohled. Imunitní systém dělíme na vrozený (nespecifický) a získaný (specifický/adaptivní).(4) Zatímco nespecifické imunitní mechanismy se objevují již u fylogeneticky nejstarších druhů (např. houbovci), specifická složka imunitního systému je přítomna až u obratlovců.(5)
Dysregulací imunitního systému dochází k různým typům onemocnění. Autoimunitní onemocnění či alergie vznikají na základě abnormální aktivace imunitního systému v závislosti na antigenu/alergenu. Mylné rozpoznání vlastní tkáně za cizorodou zprostředkují antigenně specifické složky adaptivní imunity (T lymfocyty, B lymfocyty, autoprotilátky). U alergií tyto složky nadměrně reagují na jinak neškodné součásti vnějšího prostředí. Onemocnění na podkladě dysregulace vrozeného imunitního systému (neutrofily, makrofágy, žírné buňky, NK buňky, buněčné povrchy, intracelulární receptory pro rozeznávání patogenních vzorů – PPR, pathogen pattern receptors, komplement) vznikají v důsledku nepřiměřené aktivace vrozené imunity, bez přímé závislosti na specifickém antigenu, odlišují se také nepřítomností autoprotilátek. Imunodeficity zahrnují možnou poruchu v obou větvích imunitního systému a vedou k nedostatečné obraně proti patogenům a k dalším projevům souvisejícím s kompenzatorními regulačními mechanismy, jako jsou některé autoimunitní fenomény.(5)
Zjednodušeně lze tedy shrnout, že autoinflamatorní onemocnění odrážejí převážně poruchy vrozené imunity, zatímco autoimunitní a alergická onemocnění reprezentují poruchy imunity adaptivní. Vzhledem k četnému propojení mechanismů obou větví imunitního systému však dysfunkce jedné složky imunitního systému narušuje často funkci i té druhé. Černobílé dělení chorob na skupiny čistě autoinflamatorní a autoimunitní je tedy zavádějící a nepřesné.(5)
PATOFYZIOLOGIE
Imunitní reakce se vyvinula za účelem zachování integrity organismu navzdory působení exogenních nebo endogenních faktorů. Nespecifický imunitní systém využívá k rozpoznání těchto struktur rozličné receptory, po jejichž aktivaci dochází k produkci prozánětlivých cytokinů a chemokinů, které rekrutují imunitní buňky do tkání, a organizují tak jejich obranu. Pro každý krok této kaskády existuje množství regulačních mechanismů, které brání nepřiměřeným a škodlivým reakcím vedoucím k poškození organismu. AID jsou způsobena abnormitami, které se mohou vyskytovat v jakékoliv fázi imunitní odpovědi a její regulace. Klasická monogenní onemocnění jsou reprezentována loss of function mutacemi v genech, které potlačují zánět, nebo mutacemi typu gain of function, které zánět naopak posilují. Tyto změny ústí ve spontánní aktivaci imunitního systému či jeho aktivaci s minimální potřebou jiného spouštěče. Jiné z řady onemocnění AID nemají jednoznačně daný monogenní původ a na jejich vzniku se může podílet více faktorů (genetické pozadí, faktory prostředí, mikrobiom).(5,6)
Nejdéle studovaným mechanismem vzniku AID jsou tzv. inflamazomopatie, kam se řadí i syndromy periodické horečky. Nález je odvozen od nitrobuněčných multiproteinových komplexů (inflamazomů) složených z receptorů rozeznávajících patogenní struktury (PRR) a enzymu kaspázy 1. Kaskáda nitrobuněčných dějů vede k aktivaci kaspázy 1, která štěpí neaktivní pro-interleukin 1 a pro-interleukin 18 na jejich aktivní složky. Klíčovým cytokinem těchto onemocnění je především interleukin 1, jehož blokáda je zásadní v řadě terapeutických strategií.(7) Technické pokroky a s nimi spojené nové možnosti bioinformatického zpracování získaných dat umožnily pochopit celou řadu dalších mechanismů účastnících se etiopatogeneze AID, které však přesahují rámec tohoto sdělení. Příklady dalších mechanismů zahrnují dysregulaci transkripčního faktoru NF-κB (tzv. relopatie), poruchy struktury cytoskeletu, chybné složení proteinů či poruchy interferonové signalizace (tzv. interferonopatie).( 6)
DEFINICE
Původní definice z roku 1999 charakterizovala AID jako systémová zánětlivá onemocnění bez jasného provokujícího momentu, u kterých nenacházíme autoprotilátky ani antigen specifické T lymfocyty.(1) S vývojem poznání v této oblasti byla v roce 2018 na základě konsenzu odborníků tato definice upravena. AID jsou podle ní klinickými poruchami způsobenými defekty nebo dysregulací vrozené imunity, pro něž je typický setrvalý nebo opakovaný zánětlivý stav (reaktanty akutní fáze) a absence primární patogenní role získané imunity (autoreaktivní T lymfocyty nebo autoprotilátky).(8)
KLINICKÉ A LABORATORNÍ PROJEVY
Společným rysem onemocnění je systémový zánět v nepřítomnosti infekční etiologie. K manifestaci dochází především v dětství, pozdější nástup obtíží je možný, ale vzácnější (polygenní dědičnost, vliv prostředí, kumulace somatických mutací v průběhu času).(9,10) Sterilní zánět doprovázejí epizodické (pravidelné nebo nepravidelné) či protrahované horečky.
U nejčastějšího typu AID – syndromů periodické horečky (inflamazomopatií) – dochází ke spontánnímu odeznění zánětlivé epizody a poklesu zánětlivých parametrů bez závislosti na antibiotické terapii, stav pacienta se v afebrilním období normalizuje. Spektrum klinických projevů bývá vysoce variabilní, jsou popisovány celkové i lokální zánětlivé příznaky. K častým manifestacím patří postižení kůže a sliznic, lymfatického systému, kloubů, svalů, serózních membrán, gastrointestinálního traktu nebo očí. Vzácněji se setkáváme se zánětlivým postižením centrálního nervového systému, kostí či cév. Laboratoř v době febrilních epizod je nespecificky zánětlivá, diferenciálně diagnosticky nedokáže odlišit případnou bakteriální infekci. Typicky nacházíme elevaci zánětlivých parametrů, jako je C-reaktivní protein (CRP), sedimentace erytrocytů, leukocytóza (obvykle s převahou neutrofilů), trombocytóza. Nález v krevním obraze může doprovázet anemizace. Sérový amyloid A (SAA) jako další protein akutní fáze odráží zánět citlivěji než CRP, a hodí se tak k monitoraci aktivity onemocnění. Detailnější pohled na zánětlivý stav nabízí většinou stále ještě málo dostupná vyšetření – elevace prozánětlivých cytokinů či S100 proteinů.(11–13)
Významně odlišný obraz onemocnění nacházíme u interferonopatií. Na jejich možnou přítomnost nás může upozornit výskyt nekrotizující vaskulitidy, intersticiálního plicního postižení v kontextu zánětlivého stavu, panikulitidy, lipodystrofie nebo manifestace trombotických příhod v časném dětství. Na rozdíl od inflamazomopatií se u interferonopatií objevuje kolísavá přítomnost některých autoprotilátek.(11)
Obávanou chronickou komplikací AID je sekundární AA amyloidóza, jejíž vznik je zapříčiněn dlouhodobě prozánětlivým stavem. Riziko vzniku amyloidózy koreluje s hladinou sérového amyloidu A, která by měla být u pacientů v době afebrilního mezidobí velmi pečlivě monitorována. Nejčastější primární lokalizací amyloidózy jsou ledvinné glomeruly.(14)
KLASIFIKACE
Autoinflamatorní onemocnění lze klasifikovat podle řady kritérií (fenotypu, dědičnosti, etiopatogeneze, chronologie jejich objevu, terapie). Některé z prací nadále upřednostňují kategorizaci na základě klinických projevů, nicméně zlatým standardem se stává dělení dle etiopatogeneze.
Klinické projevy AID charakterizují především nejdéle známou a nejčastější skupinu syndromů periodické horečky. Jedná se o familiární středomořskou horečku (FMF), deficit mevalonátkinázy (MDK), periodické horečky asociované s kryopyrinem – kryopyrinopatie (CAPS), periodický syndrom asociovaný s receptorem pro tumor nekrotizující faktor (TRAPS) a periodickou horečku s afty, faryngitidou a krční adenitidou (PFAPA ). Další skupiny tohoto dělení tvoří syndromy s pyogenní složkou (tzv. pustulární dermatózy, např. syndrom pyogenní artritidy, pyoderma gangrenosum, akné – PAPA ), onemocnění s kožní a kostní manifestací (např. chronická rekurentní multifokální osteomyelitida – CRMO), granulomatózní onemocnění (např. Blauův syndrom – juvenilní sarkoidóza) nebo autoinflamatorní onemocnění asociovaná s vaskulopatiemi (infantilní vaskulopatie asociovaná se stimulátorem interferonových genů STING – SAVI, vaskulopatie typu nodózní polyarteriitidy / deficit adenosindeaminázy 2 – DADA2).(7)
Klasifikace dle etiopatogeneze je i nadále upravována na základě nejnovějších poznatků. Mezi inflamazomopatie řadíme obvykle syndromy periodické horečky. Syndrom TRAPS může být nicméně řazen i mezi onemocnění s chybným složením proteinu či poruchou receptoru pro TNF-α. Zcela odlišnou skupinu pak představují interferonopatie (např. SAVI). Kategorie relopatií označuje onemocnění s dysregulací transkripčního faktoru NF-κB (např. Blauův syndrom – juvenilní sarkoidóza). Název této skupiny se odvíjí od komponent RelA a RelB, ze kterých je tento faktor složen. Mezi polygenní onemocnění řadíme syndrom PFAPA nebo CRMO.(7,11) Detailní klasifikace ani kompletní výčet AID neodpovídá rozsahu připraveného článku ani nezbytným znalostem potřebným k úspěšnému složení atestační zkoušky. Další uvedené syndromy v tabulce 1 slouží především k demonstraci šíře klinického spektra AID.
Tab. 1. Přehled vybraných AID a jejich základní charakteristiky, upraveno podle(5,6,11,21,22) 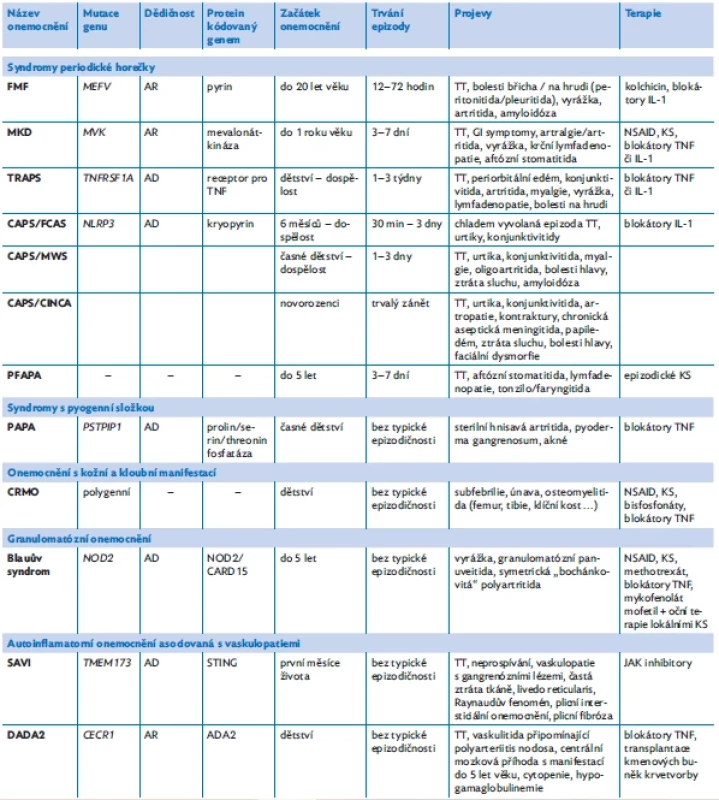
FMF – familiární středomořská horečka, MKD – deficit mevalonátkinázy, TRAPS – periodický syndrom asociovaný s receptorem pro tumor nekrotizující faktor, CAPS – periodické horečky asociované s kryopyrinem, FCAS – familiární chladová urtika, MWS – Muckleův–Wellsův syndrom, CINCA – chronický infantilní neurologický, kožní a kloubní syndrom, PFAPA – periodická horečka s afty, faryngitidou a krční adenitidou, PAPA – syndrom pyogenní artritidy, pyoderma gangrenosum, akné, CRMO – chronická rekurentní multifokální osteomyelitida, SAVI – infantilní vaskulopatie asociovaná se stimulátorem interferonových genů STING, DADA2 – vaskulopatie typu nodózní polyarteriitidy / deficit adenosindeaminázy 2, AD – autozomálně dominantní dědičnost, AR – autozomálně recesivní dědičnost, GI symptomy – gastrointestinální symptomy, TT – febrilie, KS – kortikosteroidy, NSAID – nesteroidní antirevmatika, TNF – tumor nekrotizující faktor, IL-1 – interleukin 1 DIAGNOSTIKA A DIFERENCIÁLNÍ DIAGNOSTIKA
Základem stanovení správné diagnózy je především detailní anamnéza pacienta. Nejen u suspektně monogenních onemocnění dbáme na pečlivé hodnocení anamnézy celé rodiny, často i v rámci několika generací. Důležitou informací je pro nás i etnický původ rodin, u Turků, Arabů či Arménů je výskyt FMF mnohonásobně vyšší.(7) U některých syndromů lze pozorovat klinickou variabilitu manifestací AID v závislosti na věkových kategoriích nebo místě pobytu. Je známo, že pacienti s FMF žijící ve Středomoří mají horší projevy onemocnění než jedinci se stejnou mutací žijící mimo tuto geografickou lokalitu.(15) K provedeným tonzilektomiím nebo anamnéze recidivujících angin rodičů/prarodičů přistupujeme v souvislosti s poznatky o AID mnohem obezřetněji. Rodinným příslušníkům pacientů se suspektním PFAPA syndromem důsledně vysvětlujeme naše podezření o jeho možné manifestaci v rámci předchozích generací. V kontextu možného výskytu renální amyloidózy pátráme v rodině po onemocnění ledvin či nutnosti dialýzy. Důležitou informací je pro bližší určení onemocnění také věk začátku projevů.
Rutinní praxí je vyhodnocení pravidelnosti a četnosti jednotlivých epizod s přihlédnutím ke klinickým projevům a jejich proměnlivosti v průběhu stárnutí dítěte. Ke snazšímu zorientování lékaře ve frekvencích epizod a jejich projevech mohou posloužit záznamové archy s kalendářem. V pestré historii a často i bohaté dokumentaci febrilních epizod pátráme po vyloučených či potvrzených infekčních fokusech. Detailně hodnotíme klinické a laboratorní nálezy v době febrilních epizod a mimo ně. Otázky cílíme také na efekt antibiotické terapie či skutečnost spontánního odeznění zánětlivého stavu bez antimikrobní či antivirové terapie. Nezapomínáme na pečlivé zhodnocení růstu a vývoje dítěte.
U monogenních onemocnění můžeme podezření na AID potvrdit genetickou analýzou. Mutaci v konkrétním genu lze odhalit Sangerovým sekvenováním zvoleného genu. U ne zcela vyhraněných fenotypů onemocnění dáváme přednost vyšetření celého panelu genů metodou sekvenování nové generace (NGS). Při neúspěchu můžeme analýzu rozšířit na celoexomovou nebo celogenomovou úroveň.(5) Nejasné nálezy v genomu mohou být osvětleny doplňujícím vyšetřením imunofenotypu (např. cytokiny, chemokiny, S100 proteiny, vyšetření genové exprese).(5) Přesto u řady pacientů s podezřením na AID není v současnosti možné stanovit genetickou příčinu onemocnění (mutace pod rozlišovací schopností metody, multifaktoriální etiologie, dosud nepopsaná nozologická jednotka).
Diferenciální diagnostika AID je velmi široká. Její zhodnocení vyžaduje bohaté (nejen pediatrické) znalosti jiných prozánětlivých febrilních stavů a patří beze sporu do rukou specialisty, který má s těmito vzácnými diagnózami nejen teoretické zkušenosti. Mezi pacienty s AID je nutno odlišit především infekční, imunodeficitní, maligní a systémová autoimunitní onemocnění. Infekční původ obtíží může být velmi různorodý, neměli bychom zapomínat ani na méně časté patogeny, přítomnost různých antropozoonóz nebo tropických onemocnění. Opakovaná infekční etiologie může naše diagnostické rozvahy posunout k širokému spektru různě závažných imunodeficitů (humorální deficity, chronická granulomatóza atd.). V kontextu klinické manifestace je vždy nutné pomyslet i na možnost systémových malignit a zajistit odpovídající vyšetření k jejich vyloučení. Některá autoinflamatorní onemocnění (např. TRAPS) mohou v začátku manifestace napodobovat jiné autoimunitní systémové choroby (např. systémovou formu juvenilní idiopatické artritidy, systémové vaskulitidy). V případě pravidelně recidivujících febrilií nesmíme pominout možnost vzácné nozologické jednotky cyklické neutropenie. U pacientů s PFAPA syndromem je nutné důslednými kultivacemi vyloučit recidivující či chronickou bakteriální tonzilitidu.
OBECNÉ PRINCIPY TERAPIE
Péče o pacienty s AID by měla být vedena multidisciplinárním týmem v rámci vysoce specializovaného centra pro autoinflamatorní onemocnění. Jeho součástí by měla být nejen expertíza týmu odborníků různých oborů včetně genetického poradenství, ale i špičkové laboratorní zázemí. V určitých případech je třeba zajistit celé rodině i odpovídající psychosociální podporu.(16,17)
Cílem léčby je kontrola aktivity onemocnění a prevence poškození orgánů. Pacient by měl být schopen zapojení do běžného života s účastí na všech denních aktivitách. Odpovídajícími dotazníky bychom měli sledovat i jeho celkovou kvalitu života. K hodnocení průběhu nemoci a efektu zvolené terapie je vhodná monitorace aktivity pomocí indexu aktivity autoinflamatorních onemocnění (Auto-Inflammatory Diseases Activity Index, AIDAI) a indexu poškození při autoinflamatorním onemocnění (Autoinflammatory Disease Damage Index, ADDI).(16,17)
V léčbě AID využíváme pestrou paletu protizánětlivých léků. Dle konkrétního onemocnění a jeho projevů volíme nesteroidní antirevmatika, epizodické či kontinuální podávání kortikosteroidů, většina pacientů s FMF dobře odpovídá na podávání kolchicinu. U AID spojených s nadprodukcí interleukinu 1 (většina monogenních syndromů periodické horečky) je v závislosti na fenotypu i genotypu zvažována jeho cílená blokáda. Ve vybraných případech může být alternativou blokáda jiných zánětlivých molekul (interleukin 6, tumor nekrotizující faktor) či jejich skupin (prostřednictvím blokády Janusových kináz).(11)
SYNDROMY PERIODICKÉ HOREČKY
Periodická horečka s afty, faryngitidou a krční adenitidou (PFAPA – periodic fever, aphtae, pharyngitis, cervical adenitis)
PFAPA syndrom je nejčastější periodickou horečkou u dětí. Genetické pozadí onemocnění se navzdory časté pozitivní rodinné anamnéze dosud nepodařilo jednoznačně definovat, onemocnění je řazeno mezi polygenní. K jeho manifestaci dochází obvykle do pěti let věku, obtíže zcela vymizí do puberty. V průběhu stárnutí dítěte pozorujeme postupné snižování frekvence epizod. Akronym PFAPA definuje hlavní projevy syndromu. Recidivující epizody febrilií se vyskytují s frekvencí 2–8 týdnů, trvají 3–7 dní a jsou oddělovány zcela asymptomatickým obdobím. Nález faryngitidy či tonzilofaryngitidy může napodobovat streptokokovou anginu. K jejímu odlišení neexistuje jiný způsob než mikrobiologické vyšetření na přítomnost pyogenního streptokoka (výtěr krku ráno nalačno). Lymfadenopatie postihuje především příslušné regionální uzliny (horní přední krční), nedochází k jejich fluktuaci a kůže nad nimi je zcela klidná. Aftózní léze jsou malé, mělké a po skončení epizody se dobře hojí. Další nespecifické obtíže, jako je únava, nechutenství, bolesti břicha, myalgie nebo artralgie, závisí na schopnosti dítěte tyto stesky verbalizovat. Laboratorní vyšetření odhalí nespecificky zánětlivou laboratoř, která se v afebrilním mezidobí zcela normalizuje. Vývoj a růst dítěte s PFAPA syndromem jsou zcela normální. Terapeuticky se uplatňuje především epizodické podávání prednisonu v dávce 1–2 mg/kg jednorázově v začátku febrilní ataky. Provedení tonzilektomie vede u více než 90 % dětí k trvalému ústupu onemocnění.(7,12,13,18–20)
Familiární středomořská horečka (FMF – familial Mediterranean fever)
FMF je celosvětově nejčastější monogenní horečkou s nejvyšší prevalencí v oblastech kolem Středozemního moře a v populacích Arménů, Turků, Arabů nebo neaškenázských Židů. Onemocnění je způsobeno mutací v genu MEFV, který kóduje protein pyrin. FMF se dědí typicky autozomálně recesivně, vzácněji se však může manifestovat i u nositelů jedné mutace. K manifestaci onemocnění dochází v dětství či mladém dospělém věku, 90 % jedinců se manifestuje do 20 let života. Recidivující febrilní epizody trvají 12–72 hodin a jsou doprovázeny projevy serozitid. Pacienti přicházejí nejčastěji s krutými bolestmi břicha při akutní peritonitidě, méně často s bolestmi na hrudi z důvodu pleuritidy. Klinický obraz může doplňovat akutní artritida velkých kloubů nebo vyrážka na dolních končetinách připomínající erysipel. Méně často se objevuje perikarditida nebo orchitida. Nejtěžší komplikací FMF je vznik sekundární AA amyloidózy. Léčebně se uplatňuje kolchicin či blokátory IL-1.(7,11,12,21)
Periodické horečky asociované s kryopyrinem, kryopyrinopatie (CAPS – cryopyrin-associated periodic syndromes)
Kryopyrinopatie tvoří spojité kontinuum zánětlivých onemocnění různé závažnosti. Jedná se o syndromy s autozomálně dominantní dědičností, jejichž příčinou je mutace v genu NLRP3, kódujícím protein kryopyrin. Dle závažnosti onemocnění definujeme tři hlavní fenotypy. Familiární chladová urtika (FCAS – familial cold autoinflammatory syndrome) odpovídá nejméně závažnému fenotypu. Teplotní epizody jsou vyvolávány chladovým stimulem a doplňuje je přítomnost urtikariální vyrážky, konjunktivitidy nebo myalgií. Teplota se manifestuje 6–24 hodin po provokaci chladem, celá zánětlivá epizoda ustupuje v rozmezí 30 minut až 3 dní. Nejtěžší fenotyp charakterizuje chronický infantilní neurologický, kožní a kloubní syndrom (CINCA syndrom – chronic infantile neurologic cutaneuous articular syndrome). Onemocnění se projevuje zpravidla v průběhu prvních dní života a je doprovázeno urtikariální vyrážkou, konjunktivitidou, progresivní deformující artropatií dolních končetin, kostními abnormalitami s přerůstem epifýz a kloubními kontrakturami. K nejtěžšímu postižení při CINCA syndromu dochází manifestací zánětu v centrálním nervovém systému. Pacienti trpí chronickou aseptickou meningitidou se zvýšeným intrakraniálním tlakem, který se manifestuje papiledémem a bolestmi hlavy. Onemocnění nevykazuje známky epizodičnosti, zánětlivé postižení je přítomno kontinuálně. Někde uprostřed závažnosti mezi výše zmíněnými jednotkami stojí Muckleův–Wellsův syndrom. Jedná se o epizodické vzplanutí zánětu charakterizované febrilními špičkami, únavou, konjunktivitidou, myalgií, artralgií, oligoartritidou a bolestmi hlavy. Komplikací tohoto syndromu bývá progredující ztráta sluchu či vznik amyloidózy. Terapeuticky volíme blokátory interleukinu 1.(7,11,22)
Obr. 1. Kožní projev kryopyrinopatie u 6 leté dívky 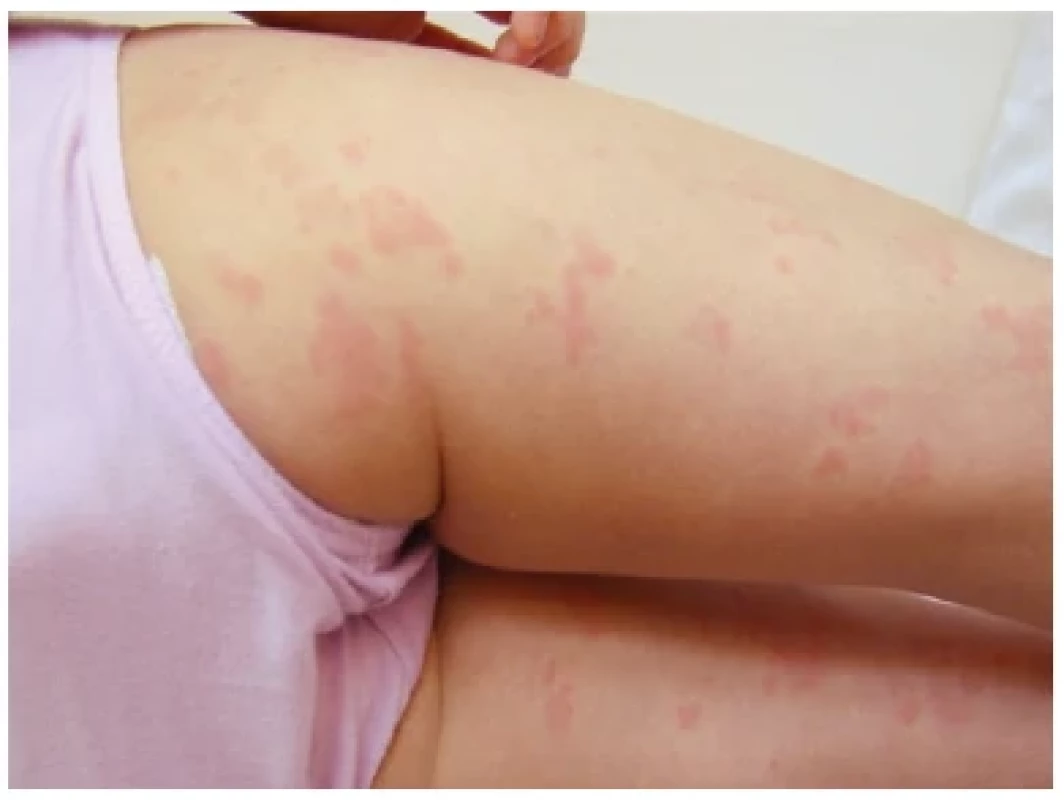
Periodický syndrom asociovaný s receptorem pro tumor nekrotizující faktor (TRAPS – TNF receptor-associated periodic syndrome)
TRAPS je autozomálně dominantní onemocnění způsobené mutací podjednotky A1 receptoru pro tumor nekrotizující faktor (TNF). Tato mutace ústí v poruchu ukončení stimulace zánětlivé kaskády buňky a odštěpení části receptoru, který má protizánětlivou regulační funkci. Hromaděním mutovaného proteinu TNFR1 v endoplazmatickém retikulu dochází k dalšímu prozánětlivému působení. Onemocnění je charakterizováno protrahovanými recidivujícími febriliemi (1–3 týdny), které jsou často vyšetřované jako horečka neznámého původu. Teploty doprovází přítomnost myalgií, artralgií, bolestí břicha, akutní konjunktivitidy, periorbitálního edému, vyrážky, artritidy, bolestí břicha nebo bolestí na hrudi z důvodu přítomnosti serozitid. Nejvážnější komplikací neléčeného onemocnění je vznik amyloidózy. V léčbě se uplatňují především blokátory TNF nebo IL-1, epizody febrilií lze symptomaticky tlumit epizodickým podáváním kortikosteroidů.(11,23)
Deficit mevalonátkinázy / syndrom hyperIgD (MKD/HIDS – mevalonate kinase deficiency / hyperimmunoglobulinemia D syndrome)
Onemocnění způsobuje autozomálně recesivní mutace v genu pro mevalonátkinázu (MVK). Tento enzym se účastní biosyntézy cholesterolu a míra jeho zbytkové aktivity určuje fenotyp onemocnění. Kompletní absence MVK způsobuje těžké metabolické onemocnění, které nazýváme mevalonovou acidurií. Kromě febrilií doprovází její projevy také růstová retardace, dysmorfie a těžké neurologické postižení. Projevy zbytkové aktivity MVK (1,8–28 %) odpovídají syndromu periodické horečky nazývanému MKD či HIDS. Jedná se o zánětlivé epizody horečky, které trvají 3–7 dní a jsou doprovázeny především gastrointestinálními symptomy (bolesti břicha, průjmy, zvracení). Klinický obraz doplňují artralgie nebo artritidy, vyrážka, aftózní stomatitida, bolestivá lymfadenopatie nebo bolesti hlavy. Genetickému potvrzení onemocnění často předchází pozitivní nález mevalonáturie, zachycené obvykle v době febrilní epizody, která je citlivým diagnostickým biomarkerem MKD. Dle tíže onemocnění volíme terapeuticky nesteroidní antirevmatika, epizodické podávání kortikosteroidů či blokádu IL-1.(11,24)
ZÁVĚR
Skupina autoinflamatorních onemocnění a jejich klasifikace se i nadále rychle rozrůstá, stejně jako se prohlubují vědomosti o etiopatogenezi těchto stavů, jejichž detailní popis je nad rámec tohoto pojednání. Problematika AID nabyla v poslední dekádě takových rozměrů, že si vyžádala založení samostatné odborné společnosti – International Society for Systemic Auto-Inflammatory Diseases (ISSAID, https:// www.issaid.org/). Je součástí spektra vzácných onemocnění imunity koordinovaných na evropské úrovni Evropskou referenční sítí RITA (https://ern-rita.org/). Nejdůležitějším praktickým výstupem pro oblast AID je přijetí autoinflamatorní etiologie do diferenciální diagnostiky, zejména v případě opakovaných epizodických prozánětlivých stavů v nepřítomnosti infekční etiologie, a včasné odeslání pacienta do specializovaných center s možností cílené léčby.
Poděkování
Práce vznikla za podpory projektu NU21-05-00522 a RVO-VFN64165.
Korespondenční adresa:
MUDr. Šárka Fingerhutová
Klinika pediatrie a dědičných poruch metabolismu 1. LF UK a VFN
Ke Karlovu 2
120 00 Praha 2
sarka.fingerhutova@vfn.czCes-slov Pediat 2023; 78(4): 199–205
Zdroje
1. M cDermott MF, et al. Germline mutations in the extracellular domains of the 55 kDa TNF receptor, TNFR1, define a family of dominantly inherited autoinflammatory syndromes. Cell 1999; 97(1): 133–44.
2. de Jesus AA, et al. Distinct interferon signatures and cytokine patterns define additional systemic autoinflammatory diseases. J Clin Invest 2020; 130(4): 1669–1682.
3. Baldovino S, et al. Rare diseases in Europe: from a wide to a local perspective. Isr Med Assoc J 2016; 18(6): 359–63.
4. S attler S. The role of the immune system beyond the fight against infection. Adv Exp Med Biol 2017; 1003 : 3–14.
5. N igrovic PA , Lee PY , Hoffman HM. Monogenic autoinflammatory disorders: Conceptual overview, phenotype, and clinical approach. J Allergy Clin Immunol 2020; 146(5): 925–937.
6. S avic S, Caseley EA, McDermott MF. Moving towards a systems-based classification of innate immune-mediated diseases. Nat Rev Rheumatol 2020; 16(4): 222–237.
7. S angiorgi E, Rigante D. The clinical chameleon of autoinflammatory diseases in children. Cells 2022; 11(14).
8. Ben-Chetrit E, et al. Consensus proposal for taxonomy and definition of the autoinflammatory diseases (AIDs): a Delphi study. Ann Rheum Dis 2018; 77(11): 1558–1565.
9. L i Y, Yu M, Lu M. Pathophysiology, clinical manifestations and current management of IL-1 mediated monogenic systemic autoinflammatory diseases, a literature review. Pediatr Rheumatol Online J 2022; 20(1): 90.
10. R owczenio DM, et al. Late-onset cryopyrin-associated periodic syndromes caused by somatic NLRP3 mosaicism-UK single center experience. Front Immunol 2017; 8 : 1410.
11. D i Donato G, et al. Monogenic autoinflammatory diseases: state of the art and future perspectives. Int J Mol Sci 2021; 22(12).
12. F ingerhutova S, et al. Periodické horečky a jiná autoinflamatorní onemocnění. Cas Lek Cesk 2018; 157(3): 122–129.
13. F ingerhutova S, Krol P, Dolezalova P. Diagnostická úskalí PFAPA syndromu. Vox pediatriae 2017; 6 : 24–28.
14. O bici L, Merlini G. Amyloidosis in autoinflammatory syndromes. Autoimmun Rev 2012; 12(1): 14–7.
15. O zen S, et al. Results from a multicentre international registry of familial Mediterranean fever: impact of environment on the expression of a monogenic disease in children. Ann Rheum Dis 2014; 73(4): 662–7.
16. R omano M, et al. The 2021 EULAR/American College of Rheumatology points to consider for diagnosis, management and monitoring of the interleukin - 1 mediated autoinflammatory diseases: cryopyrin-associated periodic syndromes, tumour necrosis factor receptor-associated periodic syndrome, mevalonate kinase deficiency, and deficiency of the interleukin-1 receptor antagonist. Arthritis Rheumatol 2022; 74(7): 1102–1121.
17. F ingerhutova S, et al. Péče o pacienty s autoinflamatorními onemocněními: Česko-slovenská adaptace překladu evropských doporučení SHARE. Čes - -slov Pediatr 2018; 73(4): 209–220.
18. A marilyo G, et al. Consensus treatment plans for periodic fever, aphthous stomatitis, pharyngitis and adenitis syndrome (PFAPA ): a framework to evaluate treatment responses from the childhood arthritis and rheumatology research alliance (CARRA) PFAPA work group. Pediatr Rheumatol Online J 2020; 18(1): 31.
19. L antto U, et al. Long-term outcome of classic and incomplete PFAPA (periodic fever, aphthous stomatitis, pharyngitis, and adenitis) syndrome after tonsillectomy. J Pediatr 2016; 179 : 172–177 e1.
20. Vanoni F, Theodoropoulou K, Hofer M. PFAPA syndrome: a review on treatment and outcome. Pediatr Rheumatol Online J 2016; 14(1): 38.
21. M arino A, et al. Periodic fever syndromes and the autoinflammatory diseases (AIDs). J Transl Autoimmun 2020; 3 : 100031.
22. Welzel T, Kuemmerle-Deschner JB. Diagnosis and management of the cryopyrin-associated periodic syndromes (CAPS): What do we know today? J Clin Med 2021; 10(1).
23. C udrici C, Deuitch N, Aksentijevich I. Revisiting TNF receptor-associated periodic syndrome (TRAPS): current perspectives. Int J Mol Sci 2020; 21(9).
24. Georgin-Lavialle S, et al. Systemic autoinflammatory diseases: Clinical state of the art. Best Pract Res Clin Rheumatol 2020; 34(4): 101529.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2023 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Jindřich Štyrský: Člověk nesený větrem
- Co jsme psali
- Dopis redakci
- Editorial
- Periodické horečky, autoinflamatorní nemoci
- Spinálna muskulárna atrofia u novorodenca
- Využitie kontrastnej ultrasonografie v diagnostike hepatálnych tumorov u novorodencov
- Trendy v liečbe inguinálnej hernie u detí
- Distribuce tuku podle obvodu pasu a poměru pas/výška u českých sedmiletých dětí – projekt COSI 2016–2019
- Evaluácia programu sociálneho a emocionálneho učenia Zippyho kamaráti
- Úloha neutrofilov a neutrofilných extracelulárnych pascí pri renálnych ochoreniach bakteriálneho pôvodu
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Periodické horečky, autoinflamatorní nemoci
- Trendy v liečbe inguinálnej hernie u detí
- Spinálna muskulárna atrofia u novorodenca
- Využitie kontrastnej ultrasonografie v diagnostike hepatálnych tumorov u novorodencov
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



