-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sideropenická anémie u dětských pacientů s vrozenými srdečními vadami
Iron deficiency in pediatric patients with congenital heart defects
Care for patients with congenital heart defects should be comprehensive and targeted not only to the defect itself but also to the diverse range of associated diagnoses that can fundamentally affect morbidity and mortality. Iron deficiency anaemia is an affiliated serious diagnosis that exacerbates tissue hypoxia in patients with cyanotic heart defects and contributes to the development of heart failure in defects with significant left-to-right shunt.
The authors present a brief overview article on this issue.
Keywords:
Iron deficiency anemia – Iron deficiency – congenital heart defects with left-to-right shunt – cyanotic congenital heart defects
Autoři: S. Kaprálová; B. Ludíková; E. Klásková; A. Palátová
Působiště autorů: Dětská klinika Fakultní nemocnice a Lékařské fakulty Univerzity Palackého, Olomouc
Vyšlo v časopise: Čes-slov Pediat 2021; 76 (6): 330-334.
Kategorie: Přehledový článek
Souhrn
Péče o pacienty s vrozenými srdečními vadami by měla být komplexní a cílená nejen na vadu samotnou, ale i na rozmanité spektrum přidružených diagnóz, které mohou zásadně ovlivnit morbiditu a mortalitu. Sideropenická anémie je závažnou přidruženou diagnózou, která u pacientů s cyanotickými srdečními vadami prohlubuje hypoxii tkání a u vad s významným levopravým zkratem přispívá k rozvoji srdečního selhání.
Autoři předkládají stručný přehledový článek této problematiky.
Klíčová slova:
sideropenie – sideropenická anémie – vrozené srdeční vady s levopravým zkratem – cyanotické vrozené srdeční vady
ÚVOD
Vrozené srdeční vady (VSV) patří mezi nejčastější kongenitální defekty v lidské populaci [1]. V České republice se jejich prevalence před plošným rozšířením prenatální diagnostiky pohybovala přibližně kolem 6 novorozenců na 1000 živě narozených, v posledních letech výskyt VSV z tohoto důvodu zaznamenává klesající trend [2, 3]. Díky špičkové kardiochirurgické operativě a perioperační péči o tyto pacienty došlo k signifikantnímu poklesu jejich mortality.
Úkolem pediatra je ve spolupráci s dětským kardiologem a kardiochirurgem léčit také přidružená onemocnění, která mohou zhoršovat kvalitu života a prognózu pacienta s vrozenou srdeční vadou. To je klíčové zejména u pacientů s kritickými srdečními vadami (30 % všech VSV), které se manifestují projevy srdečního selhání, centrální cyanózou nebo jejich kombinací a musí být chirurgicky vyřešeny v prvním roce života [3]. Jednou z přidružených diagnóz, která prokazatelně zhoršuje mortalitu i morbiditu těchto pacientů, je sideropenická anémie [3, 4].
Sideropenická anémie vzniká poruchou syntézy hemoglobinu v důsledku vyčerpání zásob železa. Řadí se tak mezi anémie z poruchy erytroidní maturace a je vůbec nejčastějším typem anémie dětského věku v celosvětovém měřítku [5, 6]. Nejčastější příčinou deplece zásobního železa je jeho nedostatečný přívod ve stravě v situaci jeho zvýšené spotřeby v důsledku vyšších nároků na tvorbu hemoglobinu. Prvního vrcholu dosahuje výskyt sideropenické anémie mezi šesti měsíci až třetím rokem života bez rozdílu pohlaví, druhý vrchol připadá na období puberty s vyšším zastoupením u dívek [6]. K typickým projevům sideropenické anémie patří bledost kůže a sliznic, únava, slabost, vertigo, padání vlasů, snížená kvalita nehtů, atrofie papil jazyka a zvýšená náchylnost k rozvoji infekcí [6]. U kojenců vede sideropenická anémie k opoždění psychomotorického vývoje, u starších dětí je popisováno snížení intelektuální výkonosti či poruchy pozornosti [7].
V případě kritických srdečních vad má udržení optimální hladiny hemoglobinu zásadní vliv na hemodynamiku VSV, který se liší podle typu vady. Ve skupině vad s významným levopravým zkratem sideropenická anémie vede k hyperkinetické cirkulaci, která navyšuje metabolické nároky myokardu a potencuje tak rozvoj srdečního selhání, u cyanotických VSV prohlubuje anémie tkáňovou hypoxii [3].
SIDEROPENICKÁ ANÉMIE U VROZENÝCH SRDEČNÍCH VAD S VÝZNAMNÝM LEVOPRAVÝM ZKRATEM
Vznik sideropenické anémie u pacientů s VSV s významným levopravým zkratem je multifaktoriální etiologie. Uplatňují se mechanismy platné v obecné populaci, jako je vyčerpání zásob železa typicky v kojeneckém věku vlivem tělesného růstu, spolu s fyziologickým poklesem hemoglobinu kolem třetího měsíce života (tzv. anémie tříměsíčního období) [3, 8]. Na druhou stranu existují i mechanismy specifické pro pacienty s VSV, jako je malnutrice způsobená vlivem zvýšených metabolických nároků daných vadou samotnou v kombinaci se sníženým perorálním příjmem, jehož limitací je především tachydyspnoe jako jeden z projevů počínajícího selhání levé komory při významném levopravém zkratu [9].
Diagnostika sideropenické anémie ve skupině pacientů s významným levopravým zkratem se neliší od diagnostických kritérií, která jsou platná v běžné populaci. Deficit zásobního i erytrocytárního železa se v krevním obraze manifestuje sníženou hladinou hemoglobinu, hematokritu, počtu erytrocytů, dále mikrocytózou a hypochromii erytrocytů. Jednoznačně potvrdí diagnózu sideropenické anémie alterované parametry metabolismu železa (pokles hladiny sérového železa, zvýšení celkové vazebné kapacity transferinu, nízká hladina feritinu a zvýšená hladina solubilních transferinových receptorů). V recentně publikované studii z roku 2020, která se zabývá vztahem sideropenie a srdečního selhání v dětském věku, bylo zjištěno, že pouze u poloviny pacientů s laboratorně prokázanou sideropenií nakonec došlo k poklesu hladiny hemoglobinu a k mikrocytóze. Na základě tohoto závěru autoři doporučují u pediatrických pacientů se srdečním selháním, což je i případ vad s významným levopravým zkratem (např. hemodynamicky významný defekt komorového septa), cíleně vyšetřovat panel parametrů metabolismu železa za účelem časného záchytu sideropenie před případným rozvojem anémie [10].
Substituci preparáty železa je doporučeno zahájit perorálně v dávce 3–6 mg/kg/den již při laboratorních známkách sideropenie, a to až do operační korekce vady. Preparáty, které lze využít v pediatrické populaci k substituci, jsou uvedeny v tabulce 1.
Tab. 1. Přehled běžně používaných přípravků obsahující železo v pediatrické praxi.
(Převzato a upraveno dle: Alušíková M, Petráček J, Kotulková M et al. Léčba sideropenické anémie v dětském věku. Farmakoterapeutické informace. Měsíčník pro lékaře a farmaceuty 2015; 12: 1–4.)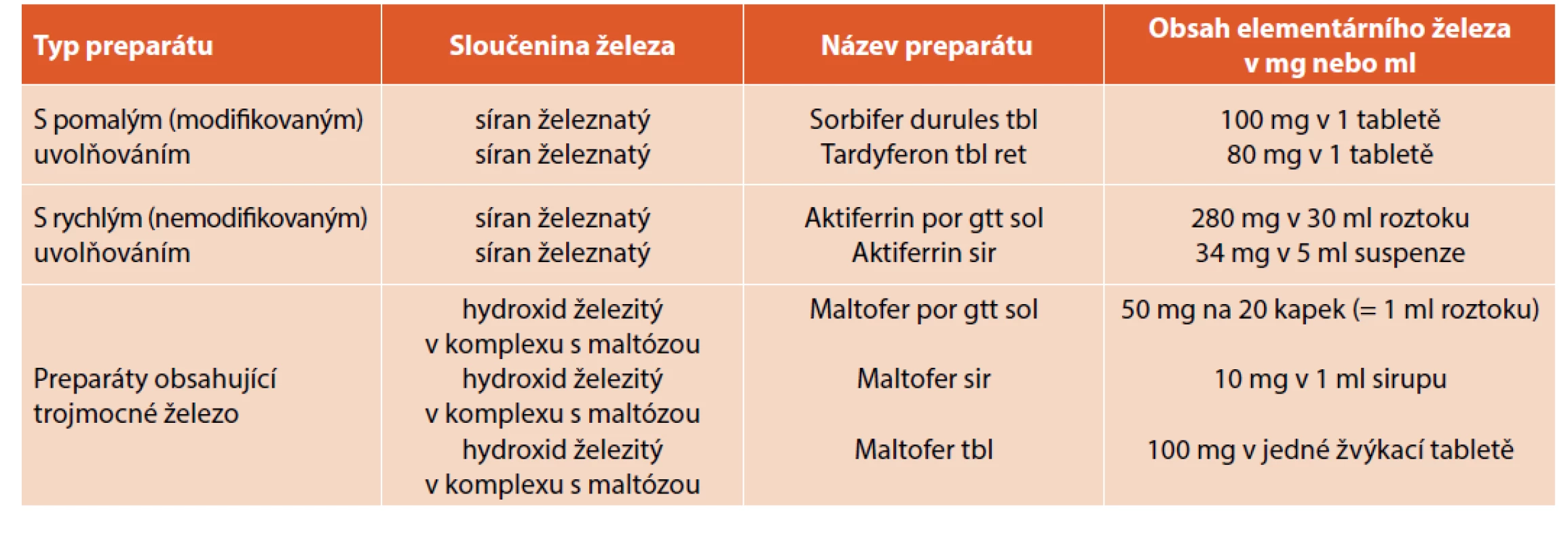
SIDEROPENICKÁ ANÉMIE U VROZENÝCH SRDEČNÍCH VAD CYANOTICKÝCH
V případě cyanotických VSV se na vzniku sideropenické anémie navíc, mimo již zmíněné příčiny, podílí mechanismus sekundární erytropoézy. Vlivem chronické hypoxie stoupá produkce erytropoetinu v ledvinách, jejímž cílem je udržet adekvátní oxygenaci tkání [11]. Vystupňovaná sekundární erytropoéza v kombinaci s deficitem zásob železa vede k rozvoji anémie. S tímto mechanismem vzniku sideropenické anémie se setkáváme v našich podmínkách u pacientů s cyanotickou VSV, jejíž řešení je pouze paliativní (tzn. že nebylo dosaženo plné saturace hemoglobinu v systémovém oběhu, na obrázku 1 je zachycen typický příznak chronické hypoxie u pacienta po paliativním operačním řešení komplexní cyanotické VSV) a u skupiny pacientů s nepoznanou srdeční vadou s původně levopravým zkratem, vedoucí v čase k rozvoji plicní cévní choroby s plicní hypertenzí a změnou zkratu na pravolevý při suprasystémových hodnotách tlaku v plicním řečišti, tzv. Eisenmengerův syndrom [12].
Obr. 1. Paličkovité prsty s nehty tvaru hodinového sklíčka jako projev chronické hypoxie u pacienta s komplexní cyanotickou vrozenou srdeční vadou po paliativní operační korekci.
Fig. 1. Clubbed fingers as a symptom of chronic hypoxia in patient with complex cyanotic congenital heart defect after palliative cardiac surgery.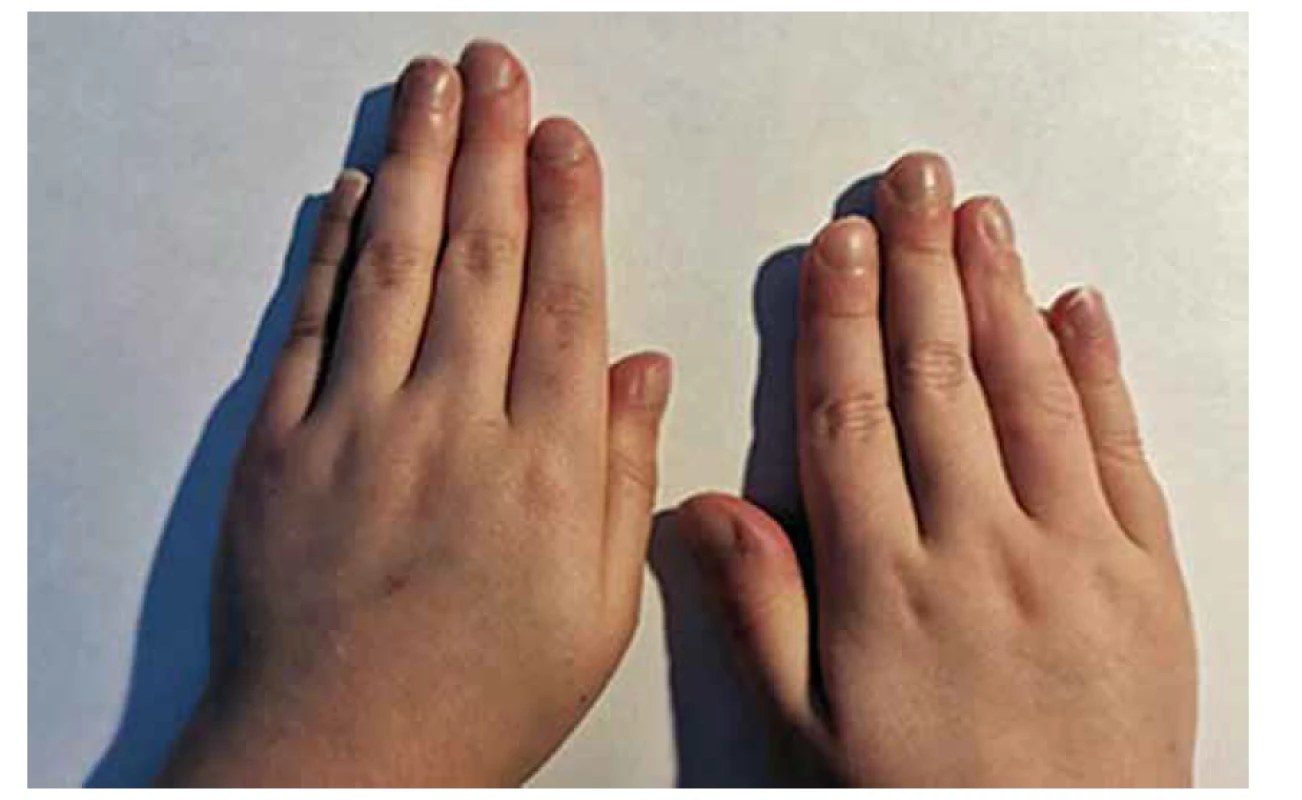
Sekundární erytropoéza u cyanotických VSV ohrožuje pacienta kromě sideropenické anémie také rizikem hyperviskózního syndromu, v jehož důsledku se oxygenace cílových tkání nadále zhoršuje. Navíc mikrocytární populace červených krvinek při sideropenické anémii je méně deformabilní během průchodu mikrocirkulací, čímž dál narušuje již alterované reologické vlastnosti krve a prohlubuje hypoxii tkání, vede k metabolické acidóze, hypoxickým záchvatům nebo tromboembolickým komplikacím, a to zejména ve věkové skupině dětí mladší čtyř let [11, 13].
Literatura zabývající se výskytem sideropenické anémie u pediatrických pacientů s cyanotickými VSV poskytuje rozmanitá data. Stejně jako v obecné populaci závisí její výskyt na úrovni životních podmínek dané země, na věku studované populace a také na stáří publikovaných studií a v neposlední řadě také na definici, v řadě studií je vyjádřena prevalence nikoliv sideropenické anémie, ale pouze sideropenie. Turecká studie z roku 2016 prokázala sideropenii až u poloviny pacientů s cyanotickými VSV (průměrný věk pacientů ve studii byl 10 roků), recentní studie z Nigérie publikovaná v roce 2019 odhalila významně nižší prevalenci pouze kolem 10 % (průměrný věk pacientů ve studii byl 4 roky) [14, 15].
Diagnostická kritéria sideropenické anémie se v případě cyanotických VSV na rozdíl od skupiny VSV s levopravým zkratem liší. Určující není počet erytrocytů, hladina hemoglobinu nebo hematokritu, i v případě již přítomné anémie se pohybují vlivem chronické hypoxie často v rozmezích fyziologických pro danou věkovou skupinu [16]. Navíc žádoucí je zachytit sideropenii ještě před rozvojem anémie. Terlemez et al. ve své práci navrhuje pro detekci sideropenie u pediatrických pacientů s cyanotickými VSV využít kombinaci parametrů MCH (průměrné množství hemoglobinu v buňce), MCV (střední objem erytrocytu) a hladiny feritinu. MCH pod 28 pg, MCV pod 82,8 fl a hladinu feritinu pod 12 μg/l s vysokou senzitivitou a specificitou detekuje dle publikované studie přítomnost sideropenie [14]. Za spolehlivý ukazatel časné fáze sideropenie je uváděna také vysoká hodnota RDW (šíře distribuce erytrocytů odrážející míru anizocytózy), vyšetření RDW je jednoduché a také ekonomicky nenáročné, vhodné jako screeningové vyšetření především pro rozvojové země [17]. V našich podmínkách by mělo být součástí rutinní diagnostiky především kompletní vyšetření parametrů metabolismu železa [18, 19].
Léčebnou strategií je v případě průkazu sideropenické anémie i sideropenie substituce preparáty železa. Diskutovaným rizikem této léčby je u pacientů s cyanotickými VSV možné prohloubení hyperviskózního syndromu při dostatečné nabídce železa organismu. Ve studii autorky Terlemez et al. perorální substituce preparáty železa v dávce 4 mg/kg/den rozdělené do dvou dávek po dobu tří měsíců vedla k vzestupu hladiny hemoglobinu a hematokritu, přičemž nedošlo ke zhoršení projevů hyperviskózního syndromu, naopak byl zaznamenán ústup symptomů (např. rozmazaného vidění, tinnitu nebo bolesti hlavy) [14]. Srovnatelné výsledky přinesla i studie u dospělých pacientů s cyanotickými VSV [20]. Dříve užívaná metoda venepunkce ke zmírnění příznaků hyperviskózního syndromu je ve světle recentních poznatků považována za obsolentní [21].
Otázkou pro další výzkum zůstává, zda by ze substituce železem neprofitovala i skupina pacientů s cyanotickými VSV bez laboratorních známek sideropenie. Dvě turecké studie věnující se této problematice prokázaly depleci zásob železa v čase u pediatrických pacientů s cyanotickými VSV a navrhují i při absenci sideropenie zahájit substituci preparáty železa [14, 16]. Substituce železem průkazně zmírňuje příznaky hyperviskózního syndromu, vede tak ke zlepšení kvality života, k lepší výkonnosti a nárůstu saturací u pacientů s plicní arteriální hypertenzí [14, 20].
Diskutován je také způsob substituce, zatímco ve studiích u pediatrických pacientů je voleno perorální podání, ve studii Blanche et al. u dospělých pacientů z roku 2018 je doporučeno parenterální podání železa [19]. Za důvod neefektivní perorální substituce se považuje neadekvátně zvýšená hladina hepcidinu, který plní roli významného regulátoru v metabolismu železa prostřednictvím snížení absorpce železa z gastrointestinálního traktu a zvýšení jeho ukládání do buněk [22]. Za příčinu neadekvátně zvýšené hladiny hepcidinu u cyanotických VSV je považována chronická hypoxie [19].
ZÁVĚR
Sideropenická anémie u pacientů s VSV s významným levopravým zkratem i s vadami cyanotickými může významně ovlivňovat jejich další prognózu. Mechanismus vzniku sideropenické anémie je u pacientů s VSV komplexní a kromě obecně dobře známých faktorů (progresivní růst v kojeneckém věku, anémie tříměsíčního období) se u pacientů s VSV na jejím vzniku uplatňují i specifické příčiny, jako je malnutrice a v případě cyanotických VSV sekundární erytropoéza vyvolaná vlivem chronické hypoxie [11].
Optimální je u obou skupin VSV detekovat nedostatek železa ještě před rozvojem anémie. U vad s významným levopravým zkratem by tak měl být pravidelně kontrolován nejen krevní obraz, ale i panel parametrů metabolismu železa až do operační korekce vady. Ve skupině cyanotických VSV na základě recentně publikovaných studií lze doporučit k diagnostice využívat rovněž parametrů metabolismu železa (především hladinu feritinu a saturaci transferinu) v kombinaci s MCH (průměrné množství hemoglobinu v buňce), MCV (střední objem erytrocytu) a RDW (šíře distribuce erytrocytů odrážející míru anizocytózy) [14, 17–19].
V případě prokázané sideropenie nebo již rozvinuté sideropenické anémii je doporučeno zahájit substituci preparáty železa u obou skupin VSV, a to bez rizika zhoršení projevů hyperviskózního syndromu v případě vad cyanotických [14]. Preferováno je perorální podání substituce v dávkách odpovídajících všeobecným doporučením 3–6 mg/kg/den.
Tato práce byla podpořena grantem IGA_ LF_2002_045.
Došlo: 20. 1. 2021
Přijato: 24. 2. 2021
Korespondující autorka:
MUDr. Sabina Kaprálová
Dětská klinika FN
a Lékařské fakulty Univerzity Palackého
I. P. Pavlova 6
779 00 Olomouc
e-mail: sabina_s@email.cz
Zdroje
1. van der Linde D, Konings E, Slager M, et al. Birth prevalence of congenital heart disease worldwide. J Am Coll Cardiol 2011; 58 (21): 2241–2247.
2. Šamánek M, Voříšková M. Congenital heart disease among 815,569 children born between 1980 and 1990 and their 15-year survival: a prospective Bohemia survival study. Pediatr Cardiol 1999 Nov-Dec; 20 (6): 411–417.
3. Chaloupecký V, et al. Dětská kardiologie. 1. vyd. Praha: Galén, 2006 : 1–437.
4. Carson JA, Duff A, Poses RM, et al. Effect of anemia and cardiovascular disease on surgical mortality and morbidity. Lancet 1996; 348 : 1055–1060.
5. Wang M. Iron deficiency and other types of anemia in infants and children. Am Fam Physician 2016; 93 (4): 270–278.
6. Lebl J, et al. Klinická pediatrie. 2. vyd. Praha: Galén, 2014 : 1–698.
7. Pospíšilová D. Sideropenická anémie v dětském věku. Pediatr Praxi 2001; 6 : 269–273.
8. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anaemia. Lancet 2016; 27 : 907–916.
9. Tsintoni A, Dimitriou G, Karatza AA. Nutrition of neonates with congenital heart disease: existing evidence, conflicts and concerns. J Matern Fetal Neonatal Med 2020; 33 : 2487–2492.
10. Puri K, Price JF, Spinner JA, et al. Iron deficiency is associated with adverse outcomes in pediatric heart failure. J Pediatr 2020; 216 : 58–66.
11. Zabala LM, Guzzetta N. Cyanotic congenital heart disease (CCHD): focus on hypoxemia, secondary erythrocytosis, and coagulation alterations. Paediatr Anaesth 2015; 25 : 981–989.
12. Jansa P. Plicní arteriální hypertenze u vrozených srdečních vad. Interní Med 2006; 6 : 266–269.
13. Olcay L, Ozer S, Gurgey A, et al. Parameters of iron deficiency in children with cyanotic congenital heart disease. Pediatr Cardiol 1996; 17 : 150–154.
14. Terlemez S, Tunaoğlu FS, Göktaş T, et al. The effects of iron treatment on viscosity in children with cyanotic congenital heart disease. Hematology 2017; 22 : 30–35.
15. Itiola AY, Animasahun BA, Njokanma OF. Serum iron status of children with cyanotic congenital heart disease in Lagos, Nigeria. Sultan Qaboos Univ Med J 2019; 19 : 345–351.
16. Onur CB, Sipahi T, Tavil B, et al. Diagnosis iron deficiency in cyanotic heart disease. Indian J Pediatr 2003; 70 : 29–31.
17. Martinez-Quintana E, Rodriguez-Gonzalez F. Iron deficiency anemia detection from hematology parameters in adult congenital heart disease patients. Congenit Heart Dis 2013; 8 : 117–123.
18. Kaemmerer H, Fratz S, Braun SL. Erythrocyte indexes, iron metabolism, and hyperhomocysteinemia in adults with cyanotic congenital cardiac disease. Am J Cardiol 2004; 94 : 825–828.
19. Blanche C, Alonso-Gonzalez R, Uribarri A, et al. Use of intravenous iron in cyanotic patients with congenital heart disease and/or pulmonary hypertension. Int J Cardiol 2018; 15 : 79–83.
20. Tay EL, Peset A, Papaphylactou M, et al. Replacement therapy for iron deficiency improves exercise capacity and quality of life in patients with cyanotic congenital heart disease and/or the Eisenmenger syndrome. Int J Cardiol 2011; 15 : 301–312.
21. Broberg CS. Challenges and management issues in adults with cyanotic congenital heart disease. Heart 2016; 102 : 720–725.
22. Hentze MW, Muckenthaler MU, Galy B, Camaschella C. Two to tango: regulation of Mammalian iron metabolism. Cell 2010; 142 : 24–38.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2021 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Vplyv gastroezofágového refluxu na riasinky horných dýchacích ciest u pediatrických pacientov
- Systémový lupus erythematodes s hematologickými projevy – nemoc mnoha tváří: kazuistiky a shrnutí pro praxi
- BRDLÍKOVA CENA
- Narkolepsia v detskom veku – naše skúsenosti
- Nie každý hemangióm je hemangióm...
- Sideropenická anémie u dětských pacientů s vrozenými srdečními vadami
- Edwardsův syndrom – fenotyp, prognóza, etické postoje, odborná a paliativní péče
- Jak komunikovat s pacienty a jejich rodiči na dálku a mít vše efektivně hrazeno?
- Specifika péče o tracheostomované dětské pacienty – stále živé téma
- List redakcii
- Mavena B12 přináší nové možnosti v léčbě chronických zánětů kůže
- Německá pediatrie v Praze – profesor Dr. med. Berthold EPSTEIN (1890–1962) (přednosta německé univerzitní kliniky v Praze na Karlově v letech 1932–1939 a po válce primář Dětského oddělení Nemocnice Bulovka v Praze)
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Edwardsův syndrom – fenotyp, prognóza, etické postoje, odborná a paliativní péče
- Nie každý hemangióm je hemangióm...
- Systémový lupus erythematodes s hematologickými projevy – nemoc mnoha tváří: kazuistiky a shrnutí pro praxi
- Specifika péče o tracheostomované dětské pacienty – stále živé téma
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



