-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Systémový lupus erythematodes s hematologickými projevy – nemoc mnoha tváří: kazuistiky a shrnutí pro praxi
Systemic lupus erythematosus with hematological symptoms – a multifaceted disease: case reports and summary for clinical practice
Systemic lupus erythematosus (SLE) is a severe highly heterogenous multisystemic inflammatory disease, characterized by a combination of clinical and immunological criteria.
The aim of a paper is to show variability of clinical and hematological findings, that could be first symptoms of developing SLE and might precede diagnosis by different time ranging from weeks to many years. These findings encompasses immune thrombocytopenic purpura (ITP), autoimmune hemolytic anemia, and asymptomatic strong positivity of anticardiolipine antibodies, which lasted from one month to 7 years in our patients. We highlight an importance of early assessment of autoantibodies in patients with these hematologic diseases and need for a deep collaboration between hematologist and rheumatologist, which is a quarantee of early SLE diagnosis and therapy initiation.
Keywords:
arthritis – Systemic lupus erythematosus – Hemolytic anemia – therapy – diagnostics – 2019 EULAR/ACR classification criteria – SLICC classification criteria – antiphospholipid antibodies – immune thrombocytopenic purpura
Autoři: K. Bouchalova 1; H. Flögelová 1; P. Horák 2; M. Skácelová 2; D. Dvořák 1; M. Schüller 3; D. Pospíšilová 1
Působiště autorů: Dětská klinika, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc 1; III. interní klinika NRE, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc 2; Pediatrická klinika, Lékařská fakulta, Masarykova univerzita a Fakultní nemocnice Brno 3
Vyšlo v časopise: Čes-slov Pediat 2021; 76 (6): 304-312.
Kategorie: Původní práce
Souhrn
Systémový lupus erythematodes (SLE) je závažné vysoce heterogenní multisystémové zánětlivé onemocnění pojiva, charakterizované kombinací velmi pestrých klinických projevů a postupným rozvojem specifických imunologických změn s manifestací plně rozvinutého SLE.
Cílem práce je upozornit na variabilitu klinických a laboratorních hematologických nálezů, které mohou být prvním příznakem postupně se rozvíjejícího SLE a mohou předcházet manifestaci SLE po různě dlouhou dobu od týdnů po několik let. Patří k nim imunitní trombocytopenická purpura (ITP), autoimunitní hemolytická anémie a bezpříznaková výrazná pozitivita antikardiolipinových protilátek. V našem souboru tyto trvaly jeden měsíc až 7 let. Upozorňujeme na význam včasného vyšetření autoprotilátek u těchto hematologických onemocnění a nutnost úzké spolupráce hematologa a revmatologa, které jsou zárukou včasného stanovení diagnózy SLE a zahájení léčby.
Klíčová slova:
diagnostika – léčba – artritida – imunitní trombocytopenická purpura – systémový lupus erythematodes – 2019 EULAR/ACR klasifikační kritéria – SLICC klasifikační kritéria – antifosfolipidové protilátky – hemolytická anémie
ÚVOD
Charakteristika onemocnění
Systémový lupus erythematodes (SLE) je vysoce heterogenní multisystémové zánětlivé onemocnění pojiva, které se u části pacientů může vyvíjet zpočátku s nenápadnými klinickými příznaky, avšak již se závažnými laboratorními nálezy. Naopak u jiných nemocných se může vstupně jednat o alarmující klinické projevy, včetně hematologických, jako je výrazná anemizace v důsledku hemolýzy nebo katastrofický antifosfolipidový syndrom. Další závažné projevy představují neurolupus nebo těžká artritida [1–4].
Mezi obvyklé klinické manifestace SLE podle postižení orgánových systémů náleží: systémové projevy (horečka, nevolnost, hmotnostní úbytek, nechutenství), kožní (motýlový erytém, fotosenzitivita, slizniční ulcerace, erytém okolo nehtů, alopecie), muskuloskeletální (polyartralgie/artritida, ranní ztuhlost, tenosynovitidy, myozitidy), renální (glomerulonefritida, nefrotický syndrom, hypertenze), neurologické (akutní stav konfuze/ /zmatenosti, křeče, psychóza, kognitivní deficit, chorea, cévní mozková příhoda, pseudotumor cerebri), srdeční (perikarditida a výpotek, bolesti na hrudi, Libmanova-Sacksova endokarditida), plicní (pleuritida, abnormální plicní funkční testy, pneumonitida, plicní krvácení, infekce), gastrointestinální (ascites, bolest břicha, peritonitida, kolitida, abnormální jaterní testy), retikuloendoteliální (hepatomegalie, splenomegalie, difuzní lymfadenopatie, Kikuchiho lymfadenitida), cévní/vaskulární (Raynaudův fenomén, trombóza, livedo retikularis) a oční (exsudáty, edém papil, retinopatie) [1]. Pro prognózu nemoci je zásadní přítomnost postižení ledvin či dalších závažných orgánových projevů [1–4].
Epidemiologie
Jedná se o onemocnění s roční incidencí v dětském věku 0,3 až 2,5 na 100 000 dětí a prevalencí 1,89 až 25,7 na 100 000 dětí. Asi 15–20 % případů SLE je diagnostikováno před 16. rokem života. Převažuje ženské pohlaví, v dětském věku s poměrem 4,5–5 : 1, u dospělých se tento poměr zvyšuje na 9–10 : 1. Častější výskyt je popisován u černochů, v hispánské a asijské populaci [1, 2, 5]. Pozitivní rodinná anamnéza SLE je u 10 % pacientů [1].
Diagnóza
Stanovení diagnózy vyžaduje správnou interpretaci řady klinických a laboratorních nálezů. Hlavní projevy SLE jsou shrnuty v klasifikačních kritériích [1, 5–7]. V roce 2019 byla publikována klasifikační kritéria European League Against Rheumatism/American College of Rheumatology (EULAR/ACR), založená na klinických a imunologických doménách, jak ukazuje přehledně tabulka 1A [6]. Tato klasifikační kritéria se vyznačují vysokou senzitivitou (> 95 %) i specificitou (> 93 %) [6]. Stále používaná klasifikační kritéria Systemic Lupus International Collaborating Clinics (SLICC) z roku 2012 jsou založena na kombinaci klinických a laboratorních kritérií (tab. 1B) [7]. SLICC kritéria jsou srovnatelně senzitivní jako EULAR/ACR, avšak méně specifická (83 %) [7, 8]. Klasifikační kritéria mají sloužit pro klasifikaci choroby, ne pro rutinní diagnostiku. Nesplnění klasifikačních kritérií diagnózu SLE nevylučuje [5].
Tab. 1. A. Klasifikační kritéria EULAR/ACR (Aringer et al. 2019). 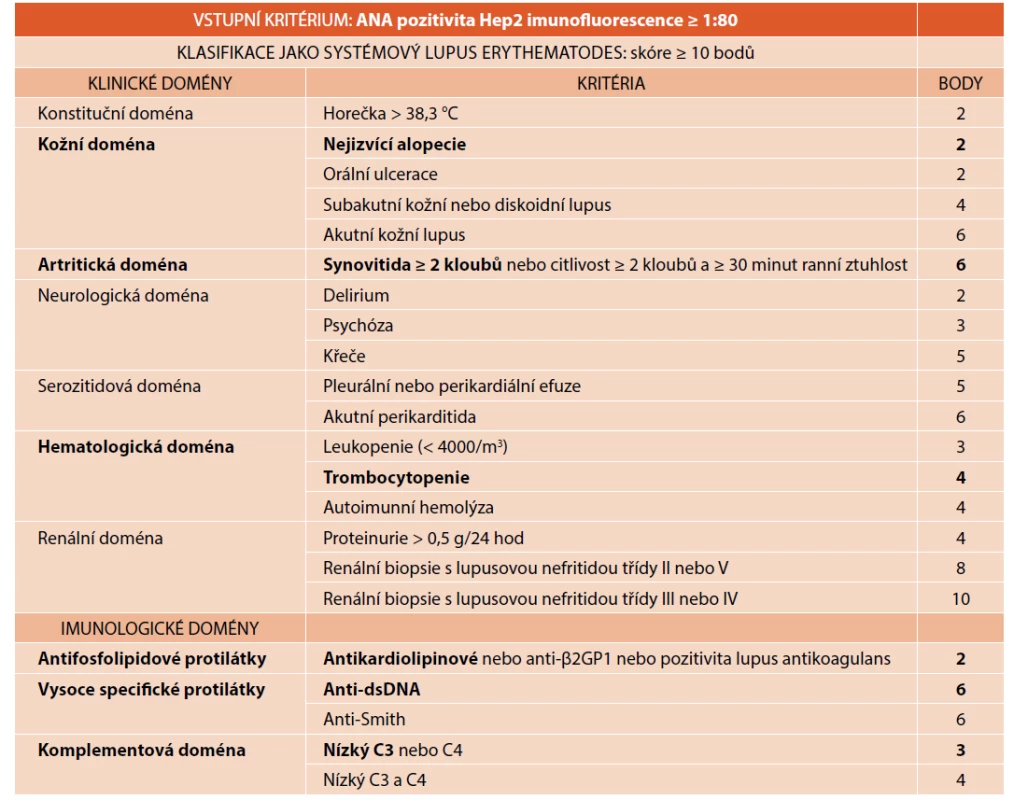
Tučně jsou zvýrazněna kritéria, která splnila pacientka 1. Tab. 1B. Klasifikační kritéria SLICC (Systemic Lupus International Collaborating Clinics). 
Tučně jsou zvýrazněna kritéria, která splnila pacientka 1.
*poznámky ke kritériím jsou k dispozici v originální publikaci Petri et al., 2012Mezi klinické projevy SLE se mimo výše uvedené manifestace řadí i anémie, trombocytopenie a leukopenie. Incidence anémie a leukopenie u dětí je podle některých autorů dokonce vyšší než u dospělých [9]. Pacienti mohou mít v předchorobí jeden nebo více těchto hematologických projevů. Může se vyskytovat například kombinace hemolytické anémie a imunitní trombocytopenie, nazývaná Evansův syndrom [1]. Přítomnost antifosfolipidových protilátek se stanovuje testy na přítomnost lupus antikoagulans, antikardiolipinových protilátek (ACA) či protilátek proti β2-glykoproteinu 1 (anti-β2GP1). Jako imunologický znak postačuje pozitivita kteréhokoli z nich [1, 2], je však požadován opakovaný průkaz ve dvou odběrech v rozmezí nejméně 12 týdnů. Stupeň postižení ledvin stanoví zkušený histopatolog z bioptických vzorků použitím ISN/RNP klasifikace pomocí světelné a imunofluorescenční mikroskopie či elektronového mikroskopu [1, 4].
Léčba
Nutná je časná léčba ihned po stanovení diagnózy. Vzhledem k heterogenitě onemocnění a jeho různé závažnosti je léčebný postup zvolen individuálně podle typu orgánové manifestace. Léčbu SLE shrnují doporučení vytvořená pracovními skupinami v rámci Single Hub and Access point for paediatric Rheumatology in Europe (SHARE) a EULAR [1–4, 10]. U všech pacientů je indikován hydroxychlorochin, který zasahuje do zánětlivé kaskády, včetně toll-like receptorů 7/9 a má prokázaný antitrombotický efekt [1]. Podle tíže orgánového postižení jsou použity glukokortikoidy v různých dávkovacích schématech a další imunosupresiva, jako jsou azathioprin, mykofenolát mofetil, cyklofosfamid, metotrexát, intravenózní imunoglobuliny, či kalcineurinové inhibitory.
Do terapie vstoupila i biologická léčba: nejprve monoklonální protilátka rituximab, blokující funkci B lymfocytů vazbou na CD20 receptory, která však nemá schválenou indikaci SLE, a později belimumab, zamezující navázání faktoru stimulujícího B lymfocyty (BLyS/ /BAFF, oficiálně nazývaného TNFSF13B – TNF Superfamily Member 13b), který je již schválen pro léčbu SLE u dospělých i dětí. Řada nových léčiv biologické i syntetické povahy, cílících na zánětlivé molekuly SLE, je ve fázi klinického hodnocení. Jedná se např. o nový kalcineurinový blokátor voclosporin, inhibitor Janusových kináz baricitinib, monoklonální protilátky blokující interferony (anifrolumab, sifalimumab, rontalizumab) a interleukiny 12/23 (ustekinumab), rovněž tak inhibitory proteasomu [1].
KAZUISTIKY
Pacientka 1
Šestnáctiletá vietnamská dívka byla odeslána hematologem k vyloučení SLE. Od devíti let věku byla sledována hematologem pro imunitní trombocytopenii s pozitivitou protilátek proti GP Ib/IX, IIb/IIIa, Ia/IIa vyšetřených metodou MAIPA a pozitivitou ANA, které se u chronické ITP vyšetřují pravidelně a jejichž pozitivita je u části pacientů s ITP popisována. Byla léčena opakovanou aplikací vysoce dávkovaných intravenózních imunoglobulinů s nedostatečnou odpovědí, poté přechodně kortikoidy s částečným efektem. Od 13 let byla léčena mimetiky trombopoetinového receptoru (TPO) s příznivou odpovědí (eltrombopag, romiplostim). Od 14 let byla sledována dětským psychiatrem pro suspektní mentální anorexii. Pro bolesti břicha podstoupila gastroskopii s normálním nálezem. Alergologické vyšetření zjistilo lehké zvýšení celkového IgE a pozitivitu IgE na pyly trav. Ve 4. roce hematologického sledování dívka nově zaznamenala bolesti kotníků při přetrvávající pozitivitě ANA protilátek. Revmatologické vyšetření prokázalo pozitivitu dalších autoprotilátek (anti-dsDNA, anti-ENA a anti-Ro). Diagnóza SLE byla stanovena v 16 letech (3/2017), kdy hematolog konstatoval zhoršení odpovědi na léčbu TPO (pokles trombocytů až na 5x109/l, sedimentace erytrocytů FW 43/75 mm/h/2 h, CRP < 0,6 mg/l) a vyšetřovaný panel autoprotilátek již svědčil jednoznačně pro SLE.
Pacientka dle SLICC splňovala následující kritéria: trombocytopenii, artritidu, pozitivitu anti-dsDNA a ANA. Byla předána do péče revmatologa. Dívka se cítila dobře, pouze občas pociťovala zažívací potíže s bolestmi břicha. Později se objevilo nadměrné padání vlasů. Klinicky se jednalo o eutrofickou dívku (výška 152 cm, hmotnost 42,5 kg, BMI 18,40 kg/m2) s dobrou komunikací a fyziologickým nálezem, včetně normálního TK 100/70 mmHg. Ultrazvukové vyšetření břicha bylo bez patologie. V laboratorních výsledcích byla nápadná hypovitaminóza D (25-hydroxyvitamin D 20,9 nmol/l), lehce nižší komplement C3 0,73 g/l, pozitivita antikardiolipinových protilátek (ACA) ve třídě IgG 63,5 IU/ml. U pacientky byl ke kortikoidní terapii indikované hematologem přidán azathioprin. Bylo provedeno genetické vyšetření thiopurin metyltransferázy (TPMT) s normálním nálezem. Dávka azathioprinu byla titrována s ohledem na hladinu leukocytů. Do medikace byl dále doplněn hydroxychlorochin. Doplňkovou léčbu představovaly omeprazol, KCl a Mg lacticum. Pro rozvoj hepatopatie byl azathioprin přechodně ukončen, po provedení jaterní biopsie s normálním nálezem byl tento lék znovu nasazen, dívka ho nadále dobře toleruje. V 17 letech byla dívce diagnostikována autoimunitní tyreoiditida s hypotyreózou, přičemž pozitivita autoprotilátek proti štítné žláze byla zaznamenána poprvé již ve 12 letech. Vývoj počtu trombocytů ukazuje obrázek 1. Přehled klinických a imunologických kritérií a dalších laboratorních nálezů dívky v porovnání s ostatními nemocnými zachycuje tabulka 2. Klasifikační kritéria SLICC, která dívka splňovala v této době, jsou uvedena v tabulce 1B. V tabulce 1A ukazujeme také splněná klasifikační kritéria EULAR/ACR.
Obr. 1. Vývoj parametru krevního obrazu (trombocyty) v čase u dívky s ITP předcházející SLE (pacientka 1). 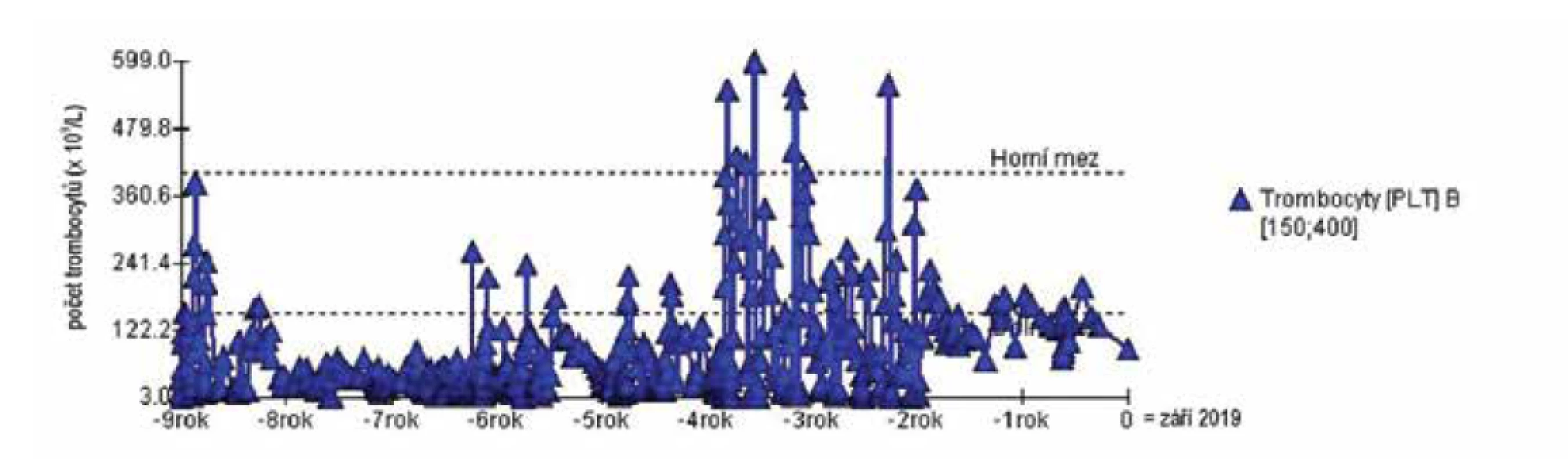
Tab. 2. Přehled klinických a imunologických kritérií a dalších laboratorních nálezů tří dětských sledovaných pacientek se SLE. 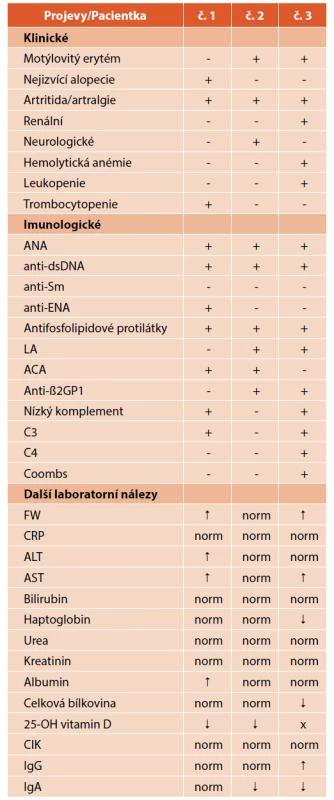
Symboly: + pozitivní; – negativní; norm – normální hodnoty;
↑↓ – zvýšené nebo snížené hodnoty; x – nevyšetřeno
Zkratky: ANA – antinukleární protilátky; anti-dsDNA – protilátky proti dvoušroubovici DNA; anti-Sm – anti-Smith protilátky;
anti-ENA – protilátky proti extrahovatelným nukleárním antigenům;
LA – lupus antikoagulans; ACA – antikardiolipinové protilátky;
anti-ß2GP1 – protilátky proti β2-glykoproteinu 1; C3 – C3 složka komplementu;
C4 – C4 složka komplementu; CIK – cirkulující imunokomplexyPřed předáním do péče revmatologa pro dospělé se znovu objevily občasné nevolnosti, jinak se dívka cítila dobře, nadměrné padání vlasů se upravilo, občas se jí tvořily spontánní hematomy. Objektivní nález byl fyziologický. Laboratorně byla přítomna hraniční trombocytopenie, lehce vyšší FW 16/33 mm/h/2 h, normální CRP, lehká anémie Hb 112 g/l s hraniční makrocytózou MCV 97,7 fl, hypomagnezémie 0,70 mmol/l, vitamin D byl upraven substitucí do normy, byla hraniční elevace amylázy 1,74 μkat/l při normální lipáze, normální hormony štítné žlázy a protilátky proti štítné žláze. V celkově dobrém stavu byla mladá žena předána do péče revmatologa pro dospělé. Pacientka studuje střední školu, absolvovala autoškolu, vede aktivní život.
Pacientka 2
Sedmnáctiletá dívka, sledovaná od 12 let hematologem pro vysoce pozitivní antifosfolipidové protilátky zjištěné při koagulačním vyšetření pro bolesti kloubů a břicha, s prodloužením aPTT. Laboratorní vyšetření bylo jinak bez jakéhokoliv dalšího patologického nálezu. Dívka byla bez potíží, jen občas si stěžovala na bolesti kloubů, které vždy spontánně zcela vymizely. Osobní i rodinná anamnéza byly bez pozoruhodností. Pacientka byla poslána k revmatologickému vyšetření pro suspektní SLE poté, co byla pro záchvat tonicko-klonických křečí v 17 letech věku (2/2018) hospitalizována ve spádové nemocnici, kde bylo provedeno CT mozku s normálním nálezem. Neurolog zahájil antiepileptickou léčbu lamotriginem pro aktivitu na EEG.
Při revmatologickém vyšetření si stěžovala na lehčí bolesti hlavy frontálně až frontotemporálně, byla bez nauzey. Na cílený dotaz uváděla artralgie kloubů (kolena) asi od jara 2017, byla bez otoků, ranní ztuhlosti, erytému, fotosenzitivity či aft. Rovněž stolice a močení byly normální, padání vlasů negovala. Pozorovala však únavnost, kdy po návratu ze školy spala 2 hodiny. V objektivním nálezu byla přítomna obezita (výška 162 cm, váha 82 kg, BMI 31,25 kg/m2), byl lehce naznačen motýlovitý erytém obličeje, kloubní i ostatní nález fyziologický. Na RTG plic byla popsána mírně hrubší kresba plicní, bez ložiskových změn a infiltrace. Byly doplněny plicní funkční testy. Pacientka je bez zjevného plicního postižení, zůstává v péči pulmologa. RTG kolenních kloubů byl normální. Laboratoř nevykazovala elevaci zánětlivých znaků, v krevním obraze byla zaznamenána pouze hraniční mikrocytóza MCV 79,6 fl. Biochemické parametry byly v normě, bez průkazu hemolýzy. D dimery byly negativní. Rovněž moč byla normální, včetně protein/kreatininového poměru. I u této pacientky byla nalezena nízká hladina 25-hydroxyvitaminu D 30,4 nmol/l. Imunologie až na hraniční hypogamaglobulinémii A byla normální. Antifosfolipidové protilátky zahrnovaly středně silně zvýšené lupus antikoagulans, pozitivní antikardiolipinové protilátky ACA IgG 344,0 IU/ml a pozitivní anti-β2GP1 IgG 1840,9 IU/ml. Autoprotilátky ANA byly hraniční, anti-dsDNA 30 (N do 20 IU/ml), antinukleozomové protilátky (ANUC) 35 (N do 20 ml U/ml), další protilátky negativní (anti-ENA, anti-Ro, anti-La, anti-Sm, anti-Scl, anti-RNP, anti-Jo1, anti-Centr, HIST, RF, aCCP). Coombsův test, MAIPA a protilátky proti leukocytům byly také negativní, rovněž hormony štítné žlázy a autoprotilátky proti štítné žláze.
Pro velmi suspektní SLE bylo doporučeno došetření CNS včetně MR mozku a vyšetření likvoru, které vyloučilo infekci či jinou patologii. Kapilaroskopický nález koreloval s iniciální fází systémového onemocnění pojiva. Dívka byla konzultována s ohledem na věk s revmatologem pro dospělé. Na léčbě hydroxychlorochinem, nízce dávkovaným prednisonem, kyselinou acetylsalicylovou v antiagregační dávce, lamotriginem a substituci vitaminem D byla subjektivně bez potíží, zhubla při změně životního stylu. V rámci psychologického vyšetření 6/2018 byl proveden screeningový dotazník pro přítomnost neuropsychiatrických symptomů u pacientů se SLE [10] s normálním výsledkem. Matka i dívka velmi chválily péči psychologa. Rovněž objektivní nález byl příznivý: hyperstenická dívka, výška 164 kg, hmotnost 78 kg (minus 3 kg/6 měs.), BMI 29,00 kg/m2, bez erytému s fyziologickým nálezem.
Dívka splnila SLICC kritéria (neurologické projevy – křeče, artritida, pozitivní antifosfolipidové protilátky, pozitivní anti-dsDNA, hraničně pozitivní ANA, anamnesticky nižší C4). Pokračuje v zavedené léčbě, nadále je v dobrém klinickém stavu. Pacientce se podařilo redukovat hmotnost, vede aktivní život: studuje střední školu, cestuje.
Pacientka 3
Téměř 16letá dívka byla odeslána na hematologické vyšetření pro lehkou anémii se zavádějící anamnézou – dva roky byla veganka, původně vyvstalo podezření na sideropenickou anémii a deficit vitaminu B12. Při vyšetření krevního obrazu zjištěny Hb 109 g/l, lehká trombocytopenie 101x109/l a leukocytopenie 3,70x109/l, v diferenciálním rozpočtu lymfopenie 15,9 % a absolutní počet lymfocytů 0,59x109/l. Retikulocyty byly normální. Byl vyloučen deficit železa. Po týdnu začaly bolesti a otok drobných kloubů prstů rukou. Dále se přidaly bolesti v loktech a prstech nohou s ranní ztuhlostí. Objevila se teplota do 38,1 °C a bolesti v krku při polykání. U PLDD zjištěna vysoká FW 130 mm/h při nízkém CRP, lehká erytrocyturie, leukocyturie a lehká proteinurie (B1), anémie s hladinou Hb 74 g/l a lehká trombocytopenie 123x109/l, a proto odesílá pacientku k hospitalizaci pro podezření na lupusovou nefritidu.
Osobní anamnéza byla bez nápadností, sledování pro vysoké IgE při alergii na penicilin. V čase diagnózy studovala 1. ročník střední školy. Objektivně se při přijetí jednalo o eutrofickou (výška 165 cm, hmotnost 63 kg) nápadně bledou dívku s otoky kloubů na prstech rukou, náznakem motýlovitého erytému, zvětšenými submandibulárními uzlinami. Ultrazvukem byla detekována lehká splenomegalie a menší množství tekutiny v dutině břišní v rámci serozitidy. Oční vyšetření odhalilo třískovité hemoragie na pravé sítnici. Mimo nálezy od PLDD byly zjištěny hypergamaglobulinémie ve třídě IgG 17,8 g/l, hypogamaglobulinémie ve třídě IgA 0,26 g/l, snížený komplement C3 0,40 g/l a C4 0,08 g/l, zatímco CIK byly v normě. Z autoprotilátek dominovaly pozitivní ANA homogenní typ a pozitivní MAIPA (anti GPIb/IIb, IIIa na trombocytech i v séru, hraniční anti GPV na trombocytech). Progredovala normocytární anémie (Hb 62…39 g/l) s retikulocytózou, byla přítomna lehká trombocytopenie 115x109/l a relativní lymfopenie 17,9 % při normálním celkovém počtu leukocytů. Vývoj hodnot hemoblobinu v čase ukazuje obrázek 2. Koagulační vyšetření popsalo lehce prodloužený aPTT 40,4 s, aPTT R 1,44, normální fibrinogen, pozitivní lupus antikoagulans. Biochemické abnormity zahrnovaly elevaci LDH 7,67 μkat/l, hypoproteinémii 61,7 g/l při normálním albuminu, ostatní parametry včetně CRP a prokalcitoninu byly bez pozoruhodností. Sérový kreatinin byl normální. Močové nálezy ukazovaly hraničně vyšší celkový odpad bílkoviny močí 0,21 g/d, hraniční elevaci protein/kreatininového poměru v jednorázové moči 21,9 g/mol, vyšší odpad albuminu močí 40 mg/d. Moč chemicky a sediment byly s lehkou hematurií.
Obr. 2. Vývoj parametru krevního obrazu (hemoglobin) v čase u dívky s výraznou anemizací (pacientka 3). 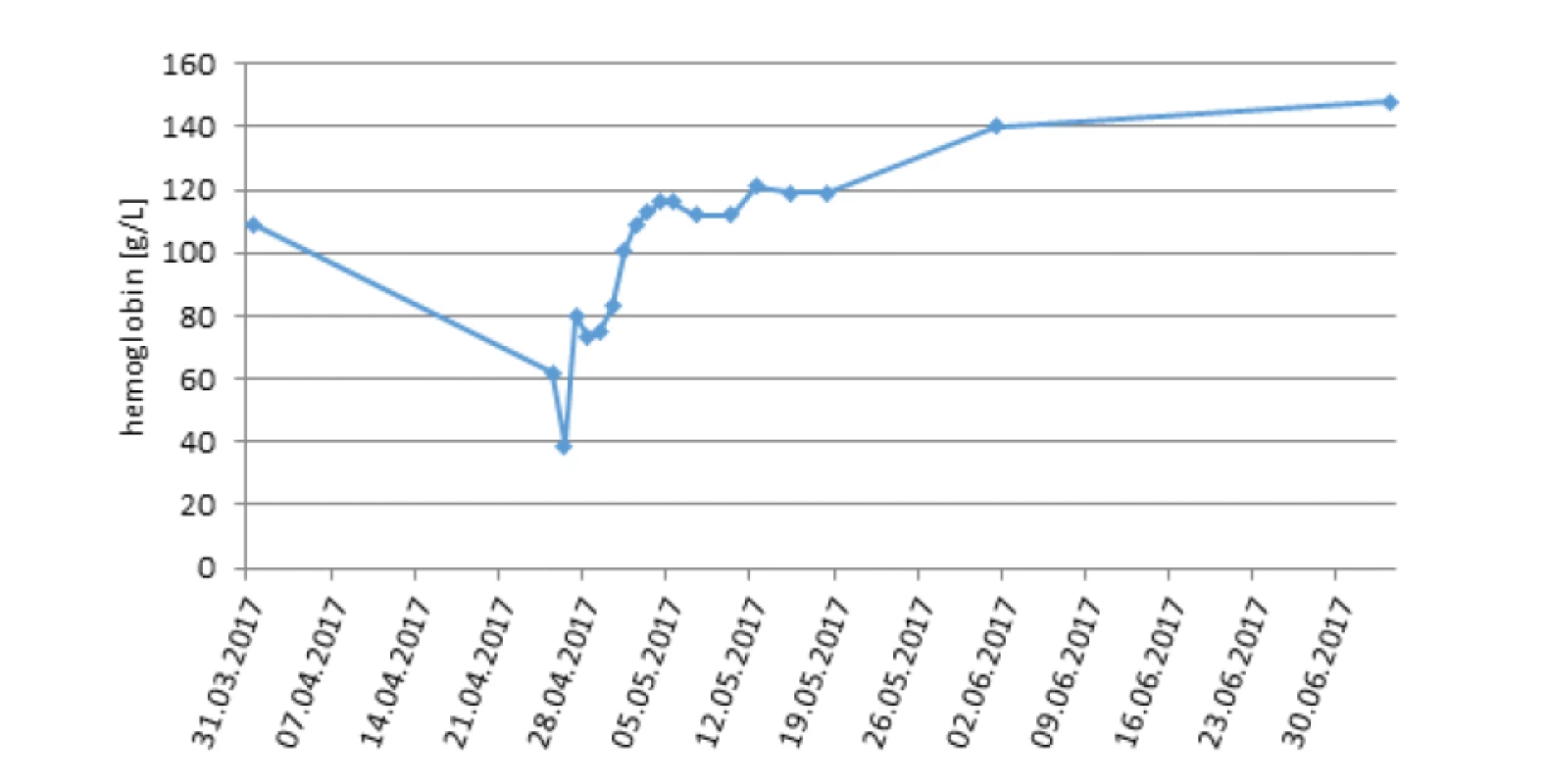
Dívka byla přeložena k léčbě na dětskou revmatologii jiného univerzitního pracoviště. Byla zahájena léčba SLE s klinickými a laboratorními projevy motýlovitého exantému, artritidou, mírnou proteinurií, serozitidou a očním postižením (hemoragie) a zejména výraznou autoimunitní anémií se známkami hemolýzy (haptoglobin, volný hemoglobin) bez zvýšení bilirubinu. Byly potvrzeny nízké C3, C4, pozitivita ANA, anti-dsDNA, lupus antikoagulans a anti-β2GP1, vysoká FW, hypoalbuminémie, zvýšené IgG, přechodně elevace jaterních transamináz. Pacientce byly podány 2 transfuzní jednotky erymasy 0 Rh negativní z vitální indikace. Byla zahájena terapie 5 intravenózními pulzy 1000 mg metylprednisolonu s přechodem na perorální prednison. Byla provedena renální biopsie s nálezem aktivní difuzní segmentální lupusové nefritidy (třída IV-S). S ohledem na lupusovou nefritidu IV-S byl ke kortikoidům přidán mykofenolát mofetil. Další medikace zahrnovala hydroxychlorochin, kyselinu acetylsalicylovou, vitamin D. Celková doba léčby je v čase přípravy publikace 2 roky a 9 měsíců. Dívka je aktuálně v dobrém stavu na kombinované medikaci metylprednisolon 4 mg denně, mykofenolát mofetil 1,5 g denně, kyselina acetylsalicylová 25 mg denně, hydroxychlorochin 200 mg a s ohledem na věk je plánováno předání revmatologovi pro dospělé.
DISKUSE
Popsané klinické případy demonstrují velmi rozmanitý průběh SLE.
U první pacientky se vyvinul SLE po mnohaletém sledování a léčbě hematologem pro ITP. Tyto případy jsou v literatuře popisovány relativně často, pro časné zachycení je nutné pečlivé klinické sledování včetně anamnézy a jsou nezbytné periodické odběry imunologických parametrů. Vyšetření ANA proto také patří do algoritmu vyšetření ITP u dětí.
Druhá pacientka dospěla k diagnóze SLE po dlouhodobém sledování hematologem pro izolovanou laboratorní pozitivitu antifosfolipidových protilátek. První klinický projev byl neurologický v podobě generalizovaných křečí.
Naopak u třetí nemocné byl SLE diagnostikován po rozvoji akutní hemolytické anémie s perakutní anemizací. V diferenciální diagnostice hemolytické anémie je třeba vždy pomýšlet na možnost přítomnosti systémového autoimunitního onemocnění typu SLE.
Porovnání klinických a imunologických projevů (kritérií), známek zánětu a dalších laboratorních ukazatelů pacientek přináší tabulka 2. Rozdílnost klinických a laboratorních manifestací choroby demonstruje její velkou heterogenitu.
Diagnóza SLE stanovená na základě kombinace klinických a imunologických kritérií akcentuje význam vyšetření autoprotilátek, včetně stanovení Coombsova testu. Tato pozitivita je přítomna podle literárních údajů u 30–40 % nemocných se SLE, zatímco laboratorně i klinicky vyjádřená hemolýza pouze u 10 % pacientů se SLE [1, 9, 12–16]. Výrazná hemolýza s retikulocytózou, spotřebovaným haptoglobinem, avšak normální hladinou bilirubinu byla přítomna u třetí pacientky.
Trombocytopenie byla přítomna u dvou zde referovaných pacientek. ITP může předcházet SLE až o 10 let [1]. V rámci komplexního vyšetření pacientů se suspektním SLE musí laboratorní panel obsahovat rovněž stanovení složek komplementu C3, C4, jejichž snížené hladiny jsou typickým nálezem u aktivní choroby [1] a slouží jako jedno z klasifikačních kritérií choroby jak u EULAR/ACR [6], tak u SLICC kritérií [7].
Postižení ledvin přispívá významným způsobem k morbiditě nemocných se systémovým lupusem, na čemž se podílí jak samotné renální postižení, tak toxicita používaných léků. Klinicky relevantní postižení ledvin se vyskytuje asi u 50 % nemocných se SLE. U zde prezentovaných nemocných bylo potvrzeno renální postižení pouze u třetí pacientky. První pacientka měla lehce nižší C3 při normálních močových nálezech. Biopsie ledviny je invazivní výkon a indikací k ní je snížená glomerulární filtrace a/nebo zvýšená proteinurie. Nicméně postižení ledvin u SLE může být někdy horší, než by odpovídalo močovým nálezům. Pro zpřesnění indikace k biopsii, která představuje pro diagnostiku ledvinných manifestací choroby zlatý standard, je proto snaha využívat neinvazivní prediktivní ukazatele poškození ledvin. Ty však nejsou dostupné v běžné klinické praxi. V současnosti je biopsie ledvin indikovaná na základě interpretace rutinních laboratorních nálezů (proteinurie, analýza močového sedimentu, sérový kreatinin, C3 a C4 komplement, přítomnost anti-dsDNA protilátek) [17, 18]. Při biopsii lze nalézt jistý stupeň postižení ledvin téměř u všech nemocných se SLE. Histologická klasifikace WHO rozlišuje 6 základních tříd glomerulonefritid a je v současnosti doplněna o semikvantitativní indexy aktivity a chronicity navržené NIH (National Institute of Health) dle poslední revize z roku 2018 [19]. Mezi zkoumané potenciální ukazatele přítomnosti závažné formy lupusové nefritidy patří například detekce zvýšených hladin proteinu S100A4 či HER2 v moči [20–22]. První dvě dívky nepodstoupily renální biopsii pro malou pravděpodobnost lupusové nefritidy třídy II a vyšší, která by ovlivnila imunosupresivní léčbu.
Onemocnění SLE může předcházet či doprovázet také autoimunitní (AI) tyreoiditida. Z našich nemocných má AI tyreoiditidu první pacientka, u níž nález autoprotilátek proti štítné žláze předcházel diagnózu SLE o 4 roky. U ostatních dívek byly hormony štítné žlázy a autoprotilátky proti štítné žláze normální.
ZÁVĚR
Cílem práce je upozornit nejen na výraznou variabilitu úvodních klinických a laboratorních příznaků SLE, ale i na jejich rozmanitou kombinaci a rychlost jejich nástupu a vývoje u jednotlivých pacientů. U všech tří pacientek byly prvním příznakem hematologické změny, proto byl prvním ošetřujícím lékařem dětský hematolog.
Kožní projevy v podobě motýlovitého erytému byly při diagnóze SLE přítomny u dvou pacientek (2 a 3), alopecie u jedné dívky, artritida nebo artralgie dolních končetin u tří dívek, proliferativní glomerulonefritida u jedné pacientky. Antifosfolipidové protilátky byly potvrzeny u všech tří dívek. Byla indikována léčba podle doporučení SHARE [3–4]. Dívky jsou ve stabilizovaném stavu, jedna z nich byla předána do péče revmatologa pro dospělé, další bude předána v blízké budoucnosti.
S ohledem na závažnost onemocnění SLE je u dětských pacientů nutná včasná diagnostika a léčba. Významně k ní přispívá mezioborová spolupráce, a to především dětského hematologa, nefrologa, imunologa, neurologa a revmatologa. Spolupráce odborníků jednotlivých oborů je zárukou stanovení včasné a správné diagnózy a zahájení indikované léčby, což významně zlepšuje prognózu pacientů.
Zkratky:
ACA antikardiolipinové protilátky
ACR American College of Rheumatology
AI autoimunitní
ALT alaninaminotransferáza
ANA antinukleární protilátky
ANUC antinukleozomové protilátky
anti-β2GP1 protilátky proti β2-glykoproteinu 1
anti-dsDNA protilátky proti dvoušroubovici DNA
anti-ENA protilátky proti extrahovatelným nukleárním antigenům
anti-Sm anti-Smith
AST aspartátaminotransferáza
CIK cirkulující imunokomplexy
CRP C-reaktivní protein
ENA extrahovatelné nukleární antigeny
EULAR European League Against Rheumatism
FW sedimentace erytrocytů podle Farhaeus a Westergren
Hb hemoglobin
ITP imunitní trombocytopenická purpura
LDH laktátdehydrogenáza
MAIPA monoclonal antibody immobilization of platelet antigens
SHARE Single Hub and Access point for paediatric Rheumatology in Europe
SLE systémový lupus erythematodes
SLICC Systemic Lupus International Collaborating Clinics
TPMT thiopurin metyltransferáza
Podpořeno grantem MZ ČR – RVO (FNOl, 00098892).
Došlo: 12. 2. 2021
Přijato: 7. 7. 2021
Korespondující autorka:
MUDr. Kateřina Bouchalová, Ph.D.
Dětská klinika LF UP a FN Olomouc
Puškinova 6
775 15 Olomouc
e-mail: katerina.bouchalova@upol.cz
Zdroje
1. Klein-Gitelman MS, Beresford MW. Systemic lupus erythematosus. In: Petty RE, Laxer RM, Lindsley CB, Wedderburn LR, Mellins ED, Fuhlbrigge RC. Textbook of Pediatric Rheumatology. 8th ed. Elsevier, 2021 : 295–329.
2. Groot N, de Graeff N, Avcin T, et al. European evidence-based recommendations for diagnosis and treatment of paediatric antiphospholipid syndrome: the SHARE initiative. Ann Rheum Dis 2017; 76 (10): 1637–1641.
3. Groot N, de Graeff N, Avcin T, et al. European evidence-based recommendations for diagnosis and treatment of childhood-onset systemic lupus erythematosus: the SHARE initiative. Ann Rheum Dis 2017; 76 (11): 1788–1796.
4. Groot N, de Graeff N, Marks SD, et al. European evidence-based recommendations for diagnosis and treatment of childhood-onset lupus nephritis: the SHARE initiative. Ann Rheum Dis 2017; 76 (12): 1965–1973.
5. Malcova H, Vargova V. Juvenilní systémový lupus erytematodes. In: Doležalová P, Dallos T. Dětská revmatologie v praxi. 1. vyd. Praha: Mladá fronta, 2019 : 300–311.
6. Aringer M, Costenbader K, Daikh D, et al. 2019 European League Against Rheumatism/American College of Rheumatology Classification Criteria for Systemic Lupus Erythematosus. Arthritis Rheum 2019; 71 (9): 1400–1412.
7. Petri M, Orbai AM, Alarcon GS, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012; 64 : 2677–2686.
8. Laxer RM, Cellucci T, Rozenblyum E, et al. A Residents’s Guide to Pediatric Rheumatology. 4th rev ed. Toronto: The Hospital For Sick Children, 2019 : 35–38.
9. Rood MJ, ten Cate R, van Suijlekom-Smit LWA, et al. Children – onset lupus erythematosus. Scand J Rheumatol 1999; 28 : 222–226.
10. Fanouriakis A, Kostopoulou M, Alunno A, et al. 2019 Update of the EULAR recommendations for the management of systemic lupus erythematosus. Ann Rheum Dis 2019; 78 : 736–745.
11. Henyšová V, Olejárová M, Moravcová R. Validizace screeningového dotazníku pro přítomnost neuropsychiatrických symptomů u pacientů se systémovým lupusem erythematodem v klinické praxi. Čes Revmatol 2016; 24 (4): 154–161.
12. Holers VM. Systemic lupus erytematosus. The complement system. In: Klippel J, Dieppe P (Eds). Rheumatology. 2nd ed. London: Mosby, 1998.
13. Silverman E. Systemic lupus erythematosus in children. In: Madison PJ, Isenberg DA, Woo P, Glass DN. Oxford Textbook of Rheumatology. 2nd ed. Oxford University Press, 1998.
14. Schett G, Firbas U, Fureder W, et al. Decreased resum erythropoietin and its relation to anti-erythropoietin antibodies in anemia of systemic upus erythematosus. Rheumatology 2001; 40 : 424–431.
15. Doležalová P, Hoza J. Systémový lupus erythematodes. In: Havelka S, Hoza J a kol. Revmatologie období růstu. Praha: Maxdorf, 2004 : 107–136.
16. Benseler SM, Silverman ED. Systemic lupus erythematosus. Pediatr Clin North Am 2005; 52 : 443–467.
17. Smith EMD, Yin P, Jorgensen AL, et al. Clinical predictors of active LN development in children – evidence from the UK JSLE Cohort Study. Lupus 2018; 27 : 2020–2028.
18. Fanouriakis A, Kostopoulou M, Cheema K, et al. 2019 Update of the Joint European League Against Rheumatism and European Renal Association – European Dialysis and Transplant Association (EULAR/ERA–EDTA) recommendations for the management of lupus nephritis. Ann Rheum Dis 2020; 79 : 713–723.
19. Bajema IM, Wilhelmus S, Alpers CE, et al. Revision of the International Society of Nephrology/Renal Pathology Society classification for lupus nephritis: classification of definitions, and modified National Institutes of Health activity and chronicity indices. Kidney Int 2018; 93 : 789–796.
20. Turnier JL, Fall N, Thornton S, et al. Urine S100 proteins as potential biomarkers of lupus nephritis activity. Arthritis Res Ther 2017; 19 : 242.
21. Costa-Reis P, Russo PA, Zhang Z, et al. The role of microRNAs and human epidermal growth factor receptor 2 in proliferative lupus nephritis. Arthritis Rheumatol 2015; 67 : 2415–2426.
22. Costa-Reis P, Maurer K, Schanberg LE, et al. HER2 as a urinary biomarker of lupus nephritis aktivity: results of a multicenter pediatric prospective study and an adult study. Pediatr Rheumatol 2018; 16 (Suppl 2): P266.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2021 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Vplyv gastroezofágového refluxu na riasinky horných dýchacích ciest u pediatrických pacientov
- Systémový lupus erythematodes s hematologickými projevy – nemoc mnoha tváří: kazuistiky a shrnutí pro praxi
- BRDLÍKOVA CENA
- Narkolepsia v detskom veku – naše skúsenosti
- Nie každý hemangióm je hemangióm...
- Sideropenická anémie u dětských pacientů s vrozenými srdečními vadami
- Edwardsův syndrom – fenotyp, prognóza, etické postoje, odborná a paliativní péče
- Jak komunikovat s pacienty a jejich rodiči na dálku a mít vše efektivně hrazeno?
- Specifika péče o tracheostomované dětské pacienty – stále živé téma
- List redakcii
- Mavena B12 přináší nové možnosti v léčbě chronických zánětů kůže
- Německá pediatrie v Praze – profesor Dr. med. Berthold EPSTEIN (1890–1962) (přednosta německé univerzitní kliniky v Praze na Karlově v letech 1932–1939 a po válce primář Dětského oddělení Nemocnice Bulovka v Praze)
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Edwardsův syndrom – fenotyp, prognóza, etické postoje, odborná a paliativní péče
- Nie každý hemangióm je hemangióm...
- Systémový lupus erythematodes s hematologickými projevy – nemoc mnoha tváří: kazuistiky a shrnutí pro praxi
- Specifika péče o tracheostomované dětské pacienty – stále živé téma
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



