-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Ťažká kombinovaná imunodeficiencia v súbore pacientov liečených v Národnom ústave detských chorôb
Severe combined immunodeficiency in set of patients from national institute of children’s diseases
Severe combined immunodeficiency (SCID) is a life-threatening condition characterized by impaired cellular and humoral immune responses. SCID represents one of the most severe forms of primary immunodeficiency (PID) disorders. As a result of severe infection can lead to early infant death.
Objective: The aim of the study was to analyze the individual characteristics in the group of patients with SCID in Slovakia and to evaluate the results of treatment with hematopoietic stem cell transplantation in order to map the overall state of diagnosis, therapy and prognosis of patients diagnosed with SCID.
Methods: In clinical part we have retrospectively evaluated the group of pediatric patients with severe combined immunodeficiency. In the period of 15 years (2003–2017), a total of 16 patients with SCID were treated in National Institute of Children´s Diseases. Of the 16 patients 11 underwent hematopoetic stem cell transplantation.
Results: 2-year overall survival rate of children with SCID was 68.8%. Genetic defect was confirmed in 13 children with IL2RG as the most common mutation. The median age at the diagnosis was 122 days which was associated with higher incidence of infection before HSCT. Infection before HSCT was confirmed in 73% of patients. Due to infectious complications four patients died before HSCT. 100% patients had absence of TREC episomes which was eluated by analysis of dry blood spots. 2-year overall survival rate of children after HSCT was 90.9%.
Conclusion: Early diagnosis of SCID, before the onset of severe infections, increases the chances of getting the patients safely to HSCT. The TREC diagnosis in our sample confirmed the excellent sensitivity and specificity of the method and its implementation in neonatal screening, following the example of many countries around the world, would be beneficial in improving the morbidity and mortality of patients diagnosed with SCID. Until its introduction it is necessary to streamline early diagnosis based on characteristic clinical symptoms and the subsequent centralization of patients into centers with experience in the treatment of SCID patients.
Keywords:
severe combined immunodeficiency – hematopoietic stem cell transplantation – TREC – early diagnosis – survival
Autoři: V. Urdová 1; J. Horáková 1; P. Švec 1; I. Boďová 1; S. Šufliarska 1; M. Makohusová 1; D. Dóczyová 1; M. Pozdechová 1; A. Kolenova 1; M. Jeseňák 3
; A. Šoltýsová 4; A. Ficek 4; Z. Tkáčová Tomečková 4; P. Čižnár 2
Působiště autorů: Transplantačná jednotka kostnej drene Kliniky detskej hematológie a onkológie, NÚDCH, Bratislava, Slovensko 1; Detská klinika NÚDCH a LF Univerzity Komenského, Bratislava, Slovensko 2; Centrum pre vrodené poruchy imunity, Klinika detí a dorastu, Jesseniova lekárska fakulty v Martine, Univerzita Komenského, v Bratislave, Univerzitná nemocnica Martin, Slovensko 3; Katedra molekulárnej biológie Prírodovedeckej fakulty UK, Bratislava, Slovensko 4
Vyšlo v časopise: Čes-slov Pediat 2021; 76 (4): 184-193.
Kategorie: Sympozium: Imunologie
Souhrn
Ťažká kombinovaná imunodeficiencia (Severe combined immunodeficiency – SCID) je život ohrozujúce ochorenie, ktoré je charakterizované poruchou bunkovej a humorálnej imunity. Je jednou z najzávažnejších ochorení v skupine primárnych imunodeficiencií. V dôsledku závažnej infekcie môže viesť k úmrtiu už v skorom dojčenskom období.
Cieľ štúdie: Cieľom práce bolo analyzovanie jednotlivých charakteristík v skupine pacientov so SCID na Slovensku a vyhodnotenie výsledkov liečby transplantáciou krvotvorných buniek za účelom zmapovania celkového stavu diagnostiky, terapie a prognózy pacientov s diagnózou SCID.
Metódy: Retrospektívne bol hodnotený súbor pacientov s ťažkou kombinovanou imunodeficienciou. Za obdobie 15 rokov (2003–2017) bolo celkovo liečených v Národnom ústave detských chorôb (NÚDCH) 16 detí s diagnózou SCID. Z toho 11 podstúpilo alogénnu transplantáciu krvotvorných buniek (TKB) na Transplantačnej jednotke kostnej drene NÚDCH v Bratislave.
Výsledky: Pravdepodobnosť 2-ročného celkového prežívania bola v celom súbore pacientov SCID 68,8 %. V súbore 16 detí bol genetický defekt potvrdený u 13 pacientov s najčastejšou mutáciou v géne IL2RG. Medián veku stanovania diagnózy SCID bol 122 dní, s čím je asociovaný aj vyšší výskyt infekčných komplikácií. U 73 % pacientov bola potvrdená infekcia pred TKB. V súbore sme zaznamenali 4 úmrtia v dôsledku infekcie pred TKB. Analýza suchej kvapky krvi, získaná eluáciou skríningovej karty, potvrdila retrospektívne nízke hodnoty TREC u 100 % pacientov. Pravdepodobnosť 2-ročného celkového prežívania v skupine pacientov SCID po TKB bola 90,9 %.
Záver: Včasné stanovenie diagnózy SCID, pred objavením sa infekčných komplikácií, zvyšuje šance pripraviť pacienta bezpečne k transplantácii krvotvorných buniek. Diagnostika TREC v našom súbore potvrdila výbornú senzitivitu a špecificitu metodiky a jej implementácia do novorodeneckého skríningu podľa vzoru mnohých krajín vo svete by bola prínosom pre zlepšenie morbidity a mortality pacientov s diagnózou SCID. Do jej zavedenia je nevyhnutné zefektívnenie skorej diagnostiky na základe charakteristických klinických príznakov a následné centralizovanie pacientov do centier so skúsenosťami s liečbou SCID pacientov.
Klíčová slova:
ťažká kombinovaná imunodeficiencia – transplantácia krvotvorných buniek – TREC – skorá diagnostika – prežívanie
ÚVOD
Vrodené poruchy imunity predstavujú dynamicky sa rozvíjajúcu oblasť medicíny z pohľadu diagnostiky aj terapie. V ľudskom genóme je identifikovaných viac ako 22 000 génov, pričom doteraz bolo opísaných viac ako 400 génov podieľajúcich sa na vzniku PID [1]. Jednou z najzávažnejších foriem primárnej imunodeficiencie je ťažká kombinovaná imunodeficiencia (SCID). Syndróm ťažkej kombinovanej imunodeficiencie je heterogénna skupina ochorení charakterizovaná poruchou vývoja a funkcie imunitného systému. Bez ohľadu na charakter genetického defektu, u všetkých pacientov je prítomná porucha vývoja, maturácie alebo funkcie T lymfocytov. Populačný skríning potvrdil takmer dvojnásobne vyššiu incidenciu, ako sa pôvodne predpokladalo. Na základe štúdie, kde boli zhrnuté výsledky z 11 skríningových programov v Spojených štátoch, bola zistená incidencia 1 : 58 000. Do obdobia zavedenia skríningu bola predpokladaná incidiencia 1 : 100 000 [2].
Klasická forma SCID bez skorej intervencie končí fatálne v prvých rokoch života v dôsledku infekcií. Deti s týmito poruchami sa po narodení javia ako zdraví novorodenci. Priemerný vek stanovenia diagnózy u pacientov so SCID je 4. mesiac života.
Do typického klinického obrazu patrí chronická perzistujúca hnačka, neprospievanie, orálna kandidóza, dermatitída a komplikované respiračné recidivujúce infekcie (otitídy, pneumónie a i.). Etiologické agens infekčných komplikácií býva rôznorodé. Charakteristickou a závažnou komplikáciou je infekcia Pneumocystis jirovecii, jej potvrdenie je významným klinickým markerom. Najčastejšie sa vyskytujúcim typom SCID je X-viazaná forma, kde dochádza k mutácii v géne kódujúcom gamma reťazec receptora interleukínu 2 (IL2RG), ktorý tvorí asi 50–60 %. Všetky ostatné formy SCID majú autozómovo recesívnu dedičnosť. Medzi často identifikované genetické defekty patrí gén receptora alfa interleukínu 7 (IL7RA), Janus kinázy 3 (JAK3), Artemis (DCLRE1C), adenozín deaminázy (ADA), deficit rekombinázy aktivujúcej gény 1 (RAG1) a deficit rekombinázy aktivujúcej gény 2 (RAG2). V prospektívnej štúdií, kde bolo analyzovaných 100 pacientov so SCID liečených TKB, bol genetický defekt potvrdený v 87 % prípadov a identifikovalo sa 12 rôznych génov [3].
Novšiu skupinu SCID tvoria tzv. atypické formy. Hypomorfné mutácie vedú k parciálnej poruche T bunkového vývoja a spôsobujú tzv. leaky SCID, ktoré sú charakteristické oneskoreným nástupom závažných infekcií a autoimunitnými fenoménami. Príkladom špecifickej formy sú pacienti s Omennovým syndrómom, ktorí laboratórne spĺňajú kritériá leaky SCID [4]. Omennov syndróm je autozómovo recesívne ochorenie, vo väčšine prípadov spôsobené mutáciou v génoch RAG1 alebo RAG2. Počet lymfocytov v krvnom obraze tu môže byť znížený, normálny alebo aj zvýšený, počet B lymfocytov je variabilný, najčastejšie nízky, prítomná je oligoklonálna expanzia autoreaktívnych T lymfocytov. V klinickom obraze je prítomná erytrodermia, hepatosplenomegália a lymfadenopatia či hypertrofia sekundárnych lymfatických tkanív (ktorá pri iných formách SCID naopak absentuje) [5].
Celkovým problémom u pacientov s diagnózou SCID je asymptomatické obdobie v prvých mesiacoch po narodení, pacienti sú najčastejšie diagnostikovaní až na základe oportúnnej infekcie. Zároveň u viac ako 80 % SCID prípadov chýba pozitívna rodinná anamnéza. Toto ochorenie je vhodným kandidátom na vyšetrovanie v rámci novorodeneckého skríningu. V roku 2005 Kee Chan a Jennifer Puck prvýkrát preukázali, že absencia epizómov receptora T lymfocytov TREC izolovaných zo suchej kvapky krvi novorodencov umožňuje identifikáciu SCID pacientov. TREC (T cell receptor excision circles) sú stabilné, nereplikujúce sa DNA krúžky vznikajúce počas procesu rekombinácie alfa reťazca T bunkového receptora v týmuse. Konkrétne δRec-φJα TREC vzniká v neskorej fáze maturácie u 70 % vyvíjajúcich sa TCRαβ T buniek [6]. Zvláštnosťou rekombinácie alfa reťazca TCR je excízia D kódujúceho segmentu, ktorý je umiestnený v rámci TCA lokusu medzi génmi TRAV a TRAJ (obr. 1). Vystrihnuté epizomálne DNA segmenty sa cirkularizujú ligáciou ich signálnych koncov, čím dochádza k tvorbe excíznych krúžkov TCR (TREC) [7]. Na diagnostiku TREC sa využíva buď plná krv v EDTA alebo suchá kvapka krvi nanesená na filtračný papier Guthrieho kartičky, ktorá sa štandardne využíva v rámci novorodeneckého skríningu.
Obr. 1. TREC vznikajú počas procesu V(D)J rekombinácie génu pre alfa reťazec T bunkového receptora (upravené podľa Somech & Etzioni, 2014).
Fig. 1. TRECs are formed during the V(D)J recombination process of the T cell receptor alpha chain gene (adjusted from Somech & Etzioni, 2014).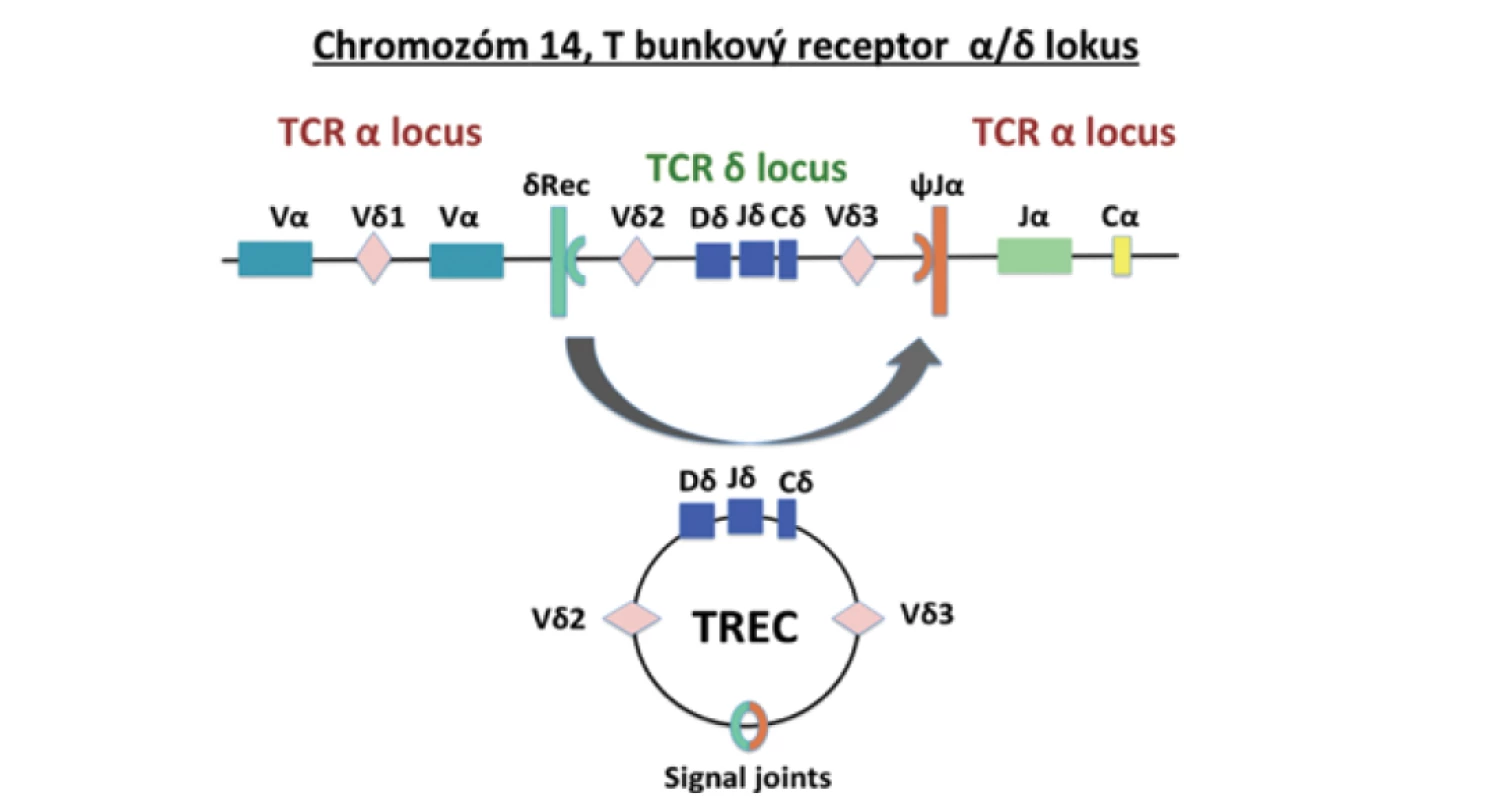
Toto vyšetrenie bolo implementované do novorodeneckého skríningu vo všetkých štátoch USA, pričom 100 % amerických novorodencov je skrínovaných. Dosiaľ zaviedli celoplošný skríning SCID tiež Nórsko, Dánsko, Nemecko, Island, Holandsko, Švédsko, Švajčiarsko, Katalánsko v Španielsku, Taiwan, Singapur, Brazília, Izrael, Libanon, Nový Zéland, v ďalších krajinách prebiehajú pilotné programy a/alebo skríning vo vybraných oblastiach [8]. Pri zavedenom screeningu je výsledok nízkeho počtu kópií TREC nasledovaný vyšetrením prietokovou cytometriou a definitívna diagnóza je stanovená pomocou genetických vyšetrení s identifikovaním kauzálneho variantu mutácie. Implementácia tohto ochorenia do slovenského skríningového programu zatiaľ nebola realizovaná, preto je nevyhnutná edukácia pediatrov prvého kontaktu o tejto diagnóze, aby bolo možné čo najskôr zabezpečiť adekvátne preventívne a liečebné procesy.
Hlavnou liečebnou modalitou SCID je transplantácia krvotvorných buniek, ktorá za posledné dekády zaznamenala významné pokroky a stala sa bezpečnejšou kuratívnou metódou. Bez TKB končí toto ochorenie infaustne. Potvrdilo sa, že pacienti transplantovaní pred dovŕšením 3,5 mesiaca života mali štatisticky menej infekcií (66 %) v porovnaní s pacientami transplantovanými po 3,5 mesiaci života (46 %, p < 0,001) [9]. V otázke výberu darcu je prvou voľbou vo väčšine centier zhodný rodinný darca, najčastejšie súrodenec (matched sibling donor – MSD). HLA identického súrodeneckého darcu má len 25–30 % pacientov [10]. Väčšinou je potrebné vyhľadať alternatívneho nepríbuzného darcu (matched unrelated donor – MUD), prípadne je možné použiť haploidentického darca (mismatched related donor – MMRD) alebo nepríbuznú pupočníkovú krv (umbilical cord blood – UCB).
V posledných rokoch sa v skupine vrodených ochorení dostáva stále viac do popredia génová terapia. Génová terapia je molekulárna terapeutická metóda, ktorej hlavným princípom je úprava defektného génu a následné vloženie opravenej kópie génu do somatických buniek jedinca za účelom vyliečenia alebo zmiernenia ochorenia [11]. V prípade diagnózy SCID je registrovaná génová terapia u podtypu ADA SCID. U X SCID a Artemis SCID prebiehajú klinické štúdie. V pláne je klinická štúdia u RAG1 SCID (informácia z konferencie IEWP EBMT 2019).
Cieľom našej práce bolo zmapovanie súčasného stavu diagnostiky a liečby SCID na Slovensku za účelom identifikovania možností na eventuálne zlepšenie v budúcnosti. Zároveň sme porovnávali náš súbor pacientov s publikovaným dátami. Považujeme za nevyhnutné vyzdvihnúť raritnosť týchto ochorení, preto komunikácia a koordinácia pri ceste pacienta zdravotným systémom má veľmi podstatnú úlohu. V prípade podozrenia na diagnózu SCID je potrebné informovať existujúce Centrá pre primárne imunodeficiencie (Bratislava, Martin, Košice), ktoré indikujú včasné a správne intervencie a preberajú komunikáciu s jediným transplantačným centrom krvotvorných buniek na Slovensku (TJKD NÚDCH Bratislava) v otázke iniciácie procesu organizácie TKB.
SÚBOR PACIENTOV A METÓDY
Hodnotili sme súbor 16 pacientov, ktorí boli diagnostikovaní a liečení v NÚDCH v Bratislave alebo iniciálne diagnostikovaní v mieste bydliska či PID centre a následne preložení do NÚDCH za účelom ďalšej diagnostiky a liečby od 1. 1. 2003 do 31. 12. 2017.
Prvý pacient s diagnózou SCID bol na Slovensku diagnostikovaný v roku 2003. Alogénnu TKB na Transplantačnej jednotke kostnej drene (TJKD) NÚDCH v Bratislave podstúpilo 11 pacientov. Medián engrafmentu neutrofilov sme hodnotili ako prvý deň po TKB v troch na seba nadväzujúcich dňoch, kde hodnota ANC bola viac ako 0,5 x 109/l . Klinické údaje sme získali zo zdravotnej dokumentácie pacientov.
Štatistická analýza pozostávala z deskriptívnej charakteristiky súboru a samotnej štatistickej analýze predchádzala prieskumová analýza dát. Analýzou prežívania (Kaplanova-Maierova analýza) sme hodnotli celkové prežívanie pacientov [12]. Rozdiely medzi prežívaniami v dvoch porovnávaných skupinách boli hodnotené Log-Rankovým testom [13]. Jednotlivé analýzy boli vykonané softvérovým balíkom IBM SPSS Statistics 19.0 [14].
VÝSLEDKY
Celý sledovaný súbor pozostával zo 16 detí – 5 dievčat (31 %) a 11 chlapcov (69 %). Za jeden kalendárny rok sa narodili 1–3 pacienti s diagnózou SCID (graf 1). V súbore boli 3 páry súrodencov. Jedenásť pacientov (69 %) podstúpilo transplantáciu krvotvorných buniek. V súbore exitovalo celkovo 5 pacientov (31 %), pričom 4 pacienti zomreli pred TKB v dôsledku infekcie, jedna pacientka v dôsledku komplikácií TKB.
Graf 1. Frekvencia prípadov diagnózy SCID na Slovensku za obdobie 15 rokov. 
Najviac zastúpenou skupinou v súbore pacientov bol X viazaný SCID s mutáciou v géne IL2RG, ktorý bol molekulárnou genetikou potvrdený u 5 pacientov (31 %), z toho boli 2 páry súrodencov – chlapcov. Zo 16 pacientov 4 (25 %) mali diagnostikovanú mutáciu génu ADA. Do tejto skupiny patrí 1 pár súrodencov – dievčat. Mutáciu génu RAG1 mali v pozorovanej skupine 2 pacienti (13 %). U 3 pacientov (19 %) nebola zistená konkrétna genetická mutácia, diagnóza bola stanovená na základe klinických a laboratórnych nálezov. U jedného pacienta bola v neskoršom veku potvrdená zriedkavá mutácia FOXN1, kde na základe patogenézy ochorenia je preferovaná transplantácia týmusu pred transplantáciou krvotvorných buniek (ktorá bola následne realizovaná v nemocnici GOSH v Londýne v roku 2019). Do súboru bol zaradený aj pacient s kompletným DiGeorgovým syndrómom, kde v dôsledku poruchy vývoja týmusu dochádza k rozvoju imunodeficitu (tab. 1). Kompletná forma tohto syndrómu má charakter ťažkej kombinovanej imunodeficiencie (SCID). Vo februári 2019 podstúpila na oddelení TJKD transplantáciu kostnej drene ešte jedna pacientka s Omennovým syndrómom, ktorá ale vzhľadom na dátumové vymedzenie súboru do analýzy už nebola zaradená.
Práve počiatočné asymptomatické obdobie je jedným z dôvodov neskorej diagnostiky u detí postihnutých ťažkým imunodeficitom. Diagnóza bola v našom súbore stanovená na základe rodinnej anamnézy len u 3 pacientov (19 %). V sledovanom súbore bol medián veku stanovenia diagnózy SCID 122 dní (rozsah 3–336 dní). U pacientov s pozitívnou rodinnou anamnézou (potvrdené ochorenie SCID u staršieho súrodenca) bola diagnóza stanovená už v prvom týždni života. Jeden pacient bol diagnostikovaný až vo veku 8 rokov po liečbe Burkittovho lymfómu a manifestácii autoimunitných fenoménov (pacient č. 16 – mutácia FOXN1). Medián obdobia od stanovenia diagnózy po začatie liečby (deň TKB) bol v súbore pacientov 74 dní (rozsah 51–1534 dní).
Hodnotili sme charakter klinických prejavov, na základe ktorých bola stanovená diagnóza SCID. Medzi najčastejšie klinické prejavy patrili neprospievanie (44 %), hnačky (44 %) a recidivujúce respiračné infekcie (31 %). Jedným z dominantných príznakov bola pneumónia (44 %), ktorá zásadne ovplyvnila klinický priebeh ochorenia detí. V skupine s prekonanou pneumóniou sme potvrdili horšie celkové prežívanie (OS 42,9 %), v skupine bez potvrdenej pneumónie to bolo 88,5 % (p = 0,033).
Do 31. 12. 2011 sa v rámci celoplošného vakcinačného programu aplikovala všetkým novorodencom živá BCG vakcína, čo významne ovplyvnilo klinický priebeh u pacientov pre komplikácie spojené s BCG-itídou. V krajinách, kde sa vykonáva BCG vakcinácia novorodencov, je závažná BCG-itída často prvou infekciou, ktorou sa SCID manifestuje. Najzávažnejšia komplikácia BCG vakcinácie – diseminovaná BCG-itída, ktorá postihuje najmä deti s vrodenou imunodeficienciou, nie je častá, má však vysokú, až 80% mortalitu [15]. Prejavy diseminovanej BCG infekcie sa v našej skupine objavili celkovo u 19 % detí (obr. 2). Porovnávali sme dĺžku hospitalizácie u pacientov, u ktorých stav ovplyvnila BCG infekcia, so skupinou bez spomenutej komplikácie. U pacientov s BCG infekciou bol medián počtu dní hospitalizácie významne vyšší (99 dní vs 43 dní; p = 0,03) (graf 2).
Obr. 2. Prejavy BCG-itídy u pacienta so SCID s nepotvrdenou mutáciou (pacient č. 4).
Fig. 2. Manifestations of BCG in SCID patient with an unconfirmed mutation (patient 4).
Graf 2. Porovnanie počtu dní hospitalizácie v skupinách BCG+/BCG 
V rámci imunodysregulácie pri potvrdenom imunodeficite sa autoimunitné fenomény objavili u 13 % pacientov (pacienti s ADA-SCID a FOXN1-SCID). Bola potvrdená celiakia, autoimunitná cytopénia a tyreoiditída. Dermatitída sa vyskytla u dvoch pacientov, z toho 1 pacient mal potvrdený Omennov syndróm, kde práve dermatitída je jedným z charakteristických klinických prejavov (obr. 3).
Obr. 3. Erytrodermia u pacienta s Omennovým syndrómom (pacient č. 12).
Fig. 3. Erythroderma in patient with Omenn syndrome (patient 12).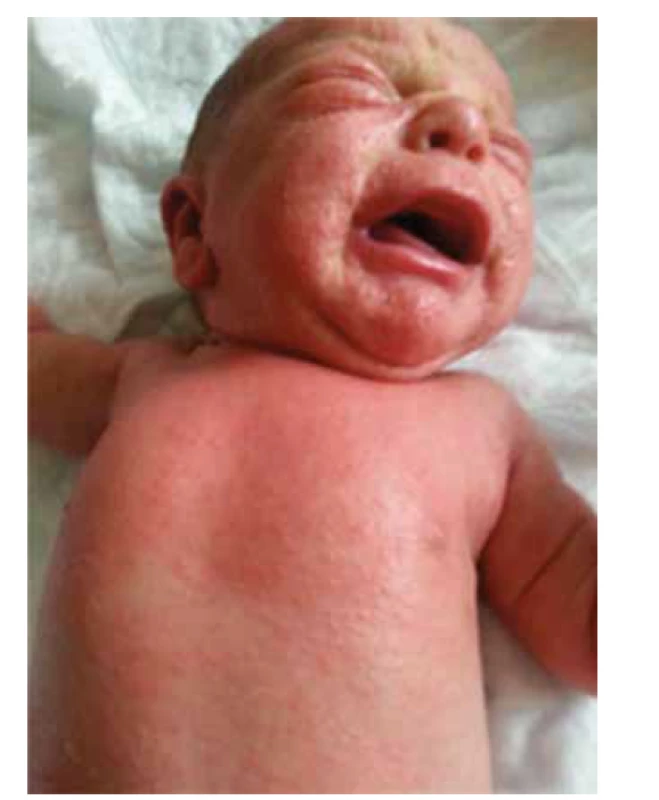
V analýze laboratórnych výsledkov iniciálneho vyšetrenia pacientov bola leukopénia prítomná len u 27 % pacientov. Spracovaním výsledkov laboratórnych vyšetrení sme zistili, že z počtu 15 hodnotených pacientov malo 73 % pacientov znížené absolútne hodnoty lymfocytov (pre chýbanie údajov sme do hodnotenia nezahrnuli jedného pacienta). Diferenciálny leukogram preto nie je považovaný za adekvátnu a dostatočne senzitívnu skríningovú a diagnostickú metódu.
Na Slovensku nie je ochorenie SCID zaradené do novorodeneckého skríningového programu, preto sme vyšetrenie TREC u pacientov realizovali buď retrospektívne, alebo v prípade pozitívnej rodinnej anamnézy ihneď po narodení, alebo prospektívne v prípade podozrenia na diagnózu SCID nám metóda TREC uľahčila diagnostický proces do obdržania genetických výsledkov. V prípade analýzy TREC sme spolupracovali so zahraničnými pracoviskami a s Prírodovedeckou fakultou Univerzity Komenského v Bratislave. Analýza bola vykonaná u 11 pacientov retrospektívne, po genetickom stanovení diagnózy. U 5 pacientov bol test vykonaný ešte pred realizáciou genetického vyšetrenia. Analýza potvrdila nízke až nedetekovateľné hladiny epizómov TREC u 100 % pacientov so SCID (tab. 1). U všetkých pacientov sme zároveň vyžiadali Guthrieho kartu zo Skríningového centra novorodencov v Banskej Bystrici a následne analyzovali počty kópií TREC. Rovnako sme potvrdili nízke až nedetekovateľné hladiny epizómov TREC u 100 % pacientov. Pravdepodobnosť 2-ročného prežívania pacientov v celom súbore SCID bola 68,8 % (graf 3).
Tab. 1. Charakteristika pacientov so SCID. 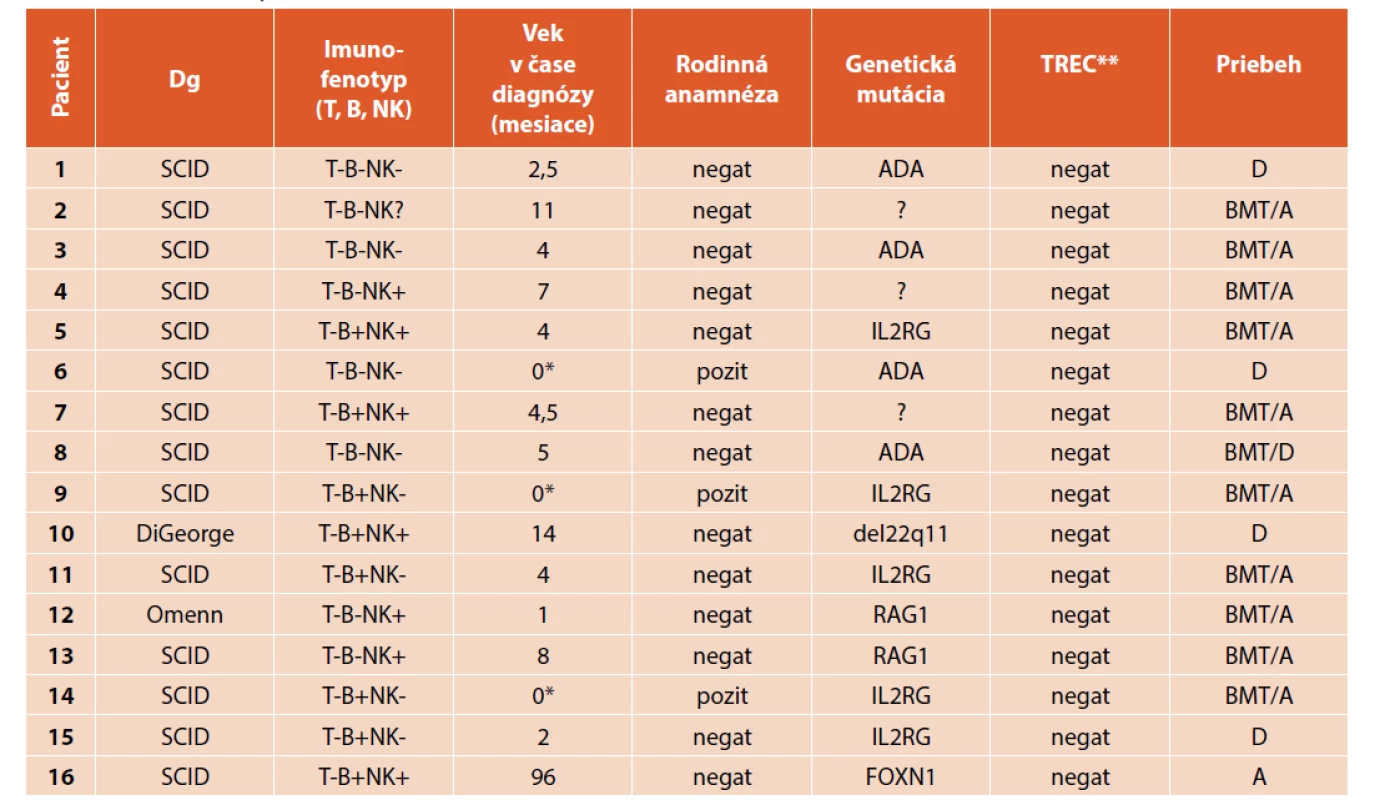
Poznámky: Dg – diagnóza, negat -, pozit + BMT bone marrow transplantation (pacient po TKB), A alive (pacient žije), D died (pacient zomrel); * pacienti diagnostikovaní v 1. týždni života na základe rodinnej anamnézy, t.j. vek < 1 mesiac, ** v prípade hodnoty TREC negatívna hodnota znamená nízke až nedetekovateľné hodnoty TREC kópií Graf 3. Kaplanova-Maierova krivka celkového prežívania v celom súbore pacientov so SCID na Slovensku. 
SE – štandardná odchýlka (z angl. standard error), OS – celkové prežívanie TRANSPLANTÁCIA KRVOTVORNÝCH BUNIEK
Z celkového súboru 16 pacientov podstúpilo TKB 11 pacientov (69 %). Všetci pacienti, ktorí neboli liečení TKB, exitovali v dôsledku infekcie. Jedinou výnimkou bol pacient s atypickou formou SCID (s mutáciou FOXN1), ktorému bola indikovaná transplantácia týmusu.
Pravdepodobnosť celkového 2-ročného prežívania pacientov v našom súbore pacientov SCID s TKB bola 90,9 % (graf 4) s mediánom sledovania pacientov 59,9 mesiaca. Medián veku v čase TKB bol 217 dní (rozsah 69–1870). Vyšší vek v čase TKB bol ovplyvnený hlavne neskorším vekom diagnózy. Infekcia pred TKB sa v našom súbore vyskytla v 73 % prípadoch. 45 % pacientov vstupovalo do procesu TKB s aktívnou infekciou, ktorá sa považuje za nepriaznivý prognostický faktor.
Graf 4. Kaplanova-Maierova krivka pravdepodobosti celkového prežívania v skupine pacientov so SCID s TKB na Slovensku. 
SE – štandardná odchýlka (z angl. standard error), OS – celkové prežívanie Súrodeneckého darcu (MSD) malo v súbore 5 pacientov (45 %). Zo skupiny pacientov s nepríbuzenským darcom (MUD) bola prítomná HLA zhoda 9–10/10 u 5 pacientov (45 %), 1 pacient mal nepríbuzenského darcu s HLA zhodou 8/10. U tohto pacienta sa po TKB rozvinula extenzívna chronická GvHD (kožná a črevná forma). Ako profylaxia GvHD bol použitý cyklosporín A (CS-A) v 9 prípadoch (82 %) od dňa D-1 pred TKB, v 2 prípadoch v kombinácii s mykofenolát mofetilom (MMF) (18 %). V prípade nepríbuzenských transplantácií bol pridaný nízkodávkovaný metotrexát na D +1, +3, +6. Pre zníženie rizika GvHD bola pred TKB pridaná séroterapia, v 4 prípadoch (36 %) antitymocytárny globulín (ATG), alemtuzumab (monoklonálna anti-CD52 protilátka) v 3 prípadoch (27 %).
Vzhľadom na exitus u jedného pacienta sme GvHD hodnotili v skupine 10 pacientov. Akútna GvHD sa rozvinula u 5 pacientov (45 %), pričom u všetkých týchto pacientov išlo o nezávažné formy akútnej GvHD stupňa I–II s dobrou odpoveďou na kortikoidnú terapiu. Ako zdroj krvotvorných buniek pre TKB dominovala v súbore kostná dreň (n = 7, 64 %) a periférne krvotvorné bunky boli použité u 4 pacientov (36 %). Pupočníková krv v prípade diagnózy SCID na Slovensku nebola použitá.
Najčastejším prípravným režimom bol redukovaný prípravný režim (RIC) (treosulfan a fludarabin u 7 pacientov, melfalan a fludarabin u 1 pacienta), použitý u 73 % pacientov. Do popredia v liečbe SCID sa dostávajú aj TKB bez použitia prípravného režimu. Je avšak dôležité prehodnotenie, ktorá konkrétna forma SCID by z tejto možnosti mohla profitovať. Najlepšie výsledky boli popísané v prípade TKB bez prípravného režimu u príbuzenských TKB, najmä v prípade ADA-SCID. U T-B+ imunofenotypoch (konkrétne IL2RG, JAK3 a IL-7) bol popísaný vyhovujúci T bunkový engrafment, avšak s variabilnou obnovou humorálnej imunity. V prípade porúch VDJ rekombinácie vrátanie mutácie RAG1/2 bolo prihojenie aj u MSD TKB bez prípravného režimu suboptimálne a zatiaľ nie je odporúčané [16]. Medián engrafmentu neutrofilov bol v sledovanom súbore 12,5 dňa (rozsah 12–21dní). Vírusové infekcie po TKB sa vyskytli u 2 pacientov (18 %), u oboch týchto pacientov sa jednalo o EBV reaktiváciu. Pokles EBV kopií bol dosiahnutý redukovaním imunosupresívnej liečby, ani v jednom prípade nebola indikovaná biologická liečba rituximabom.
DISKUSIA
SCID je heterogénnou skupinou genetických ochorení charakterizovaná vážnym poškodením vývoja a funkcie imunitného systému. Bez intervencie klasické formy SCID končia fatálne najčastejšie už v priebehu 1. roku života. Liečebnými možnosťami u týchto pacientov sú transplantácia krvotvorných buniek (TKB), enzýmová a génová terapia. Enzýmová terapia v prípade ADA – SCID je tzv. premosťujúcou liečbou do obdobia TKB alebo génovej terapie. Génová terapia je zatiaľ indikovaná len v prípade nedostupnosti TKB. TKB ostáva hlavnou kauzálnou liečebnou modalitou pre pacientov so SCID. Jediným centrom pre TKB u detských pacientov na Slovensku je Transplantačná jednotka kostnej drene NÚDCH v Bratislave. Pravdepodobnosť dvojročného celkového prežívania v súbore TKB pacientov bola 90,9 %, čo pri porovnaní s medzinárodnými centrami poukazuje na veľmi dobré výsledky (tab. 2).
Tab. 2. Medzinárodná skúsenosť – porovnanie našich výsledkov s publikovanými údajmi. 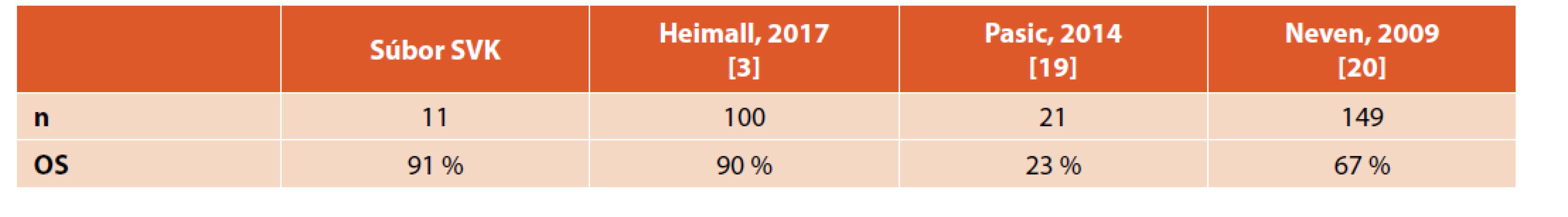
V slovenskom súbore pacientov bola zistená aj zriedkavá mutácia génu FOXN1, ktorá bola podľa publikácie Rota a kol. z roku 2017 potvrdená na svete len u 9 pacientov [17]. Veľmi dôležitým laboratórnym výsledkom v našom súbore boli nízke až nedetekovateľné hodnoty TREC kópií u 100 % pacientov nie len v čase stanovenia diagnózy, ale aj zo vzorky z novorodeneckého skríningu. Dostupnosť tohto vyšetrenia na Slovensku je významným krokom v diagnostike pacientov SCID. Implementovanie tohto vyšetrenia do slovenského novorodeneckého skríningového programu je veľkou výzvou do budúcnosti.
Zvyšovanie povedomia o diagnóze SCID a charaktere klinických príznakov by aj v našej krajine mohlo zabezpečiť skorší záchyt diagnózy. V sledovanom súbore bol medián veku stanovenia diagnózy SCID 122 dní (rozsah 3–336 dní) a medián obdobia od stanovenia diagnózy po začatie liečby (deň TKB) bol 74 dní (rozsah 51–1534 dní). V porovnaní so štúdiou PIDTC 6901, v ktorej analyzovali po zavedení novorodeneckého skríningu (NBS) 100 liečených detí so SCID v 25 centrách v Spojených štátoch, bol medián veku stanovenia diagnózy v skupine klasických SCID pacientov 27 dní (z toho 59 % pacientov diagnostikovaných na základe NBS alebo rodinnej anamnézy). Výsledky poukazujú na vyšší vek pacientov v čase stanovenia diagnózy v súbore, ktorý súvisí aj s chýbaním novorodeneckého skríningu v našej krajine, ale i pravdepodobne s menšími skúsenosťami s touto diagnózou u pediatrov. Pri incidencii 1 prípadu na 30–50 tisíc živonarodených detí a malej početnosti rodinných príslušníkov, ako je tomu vo väčšine vyspelých štátov, je pravdepodobnosť predvídania poruchy na základe rodinnej anamnézy veľmi nízka, a to napriek tomu, že takmer polovica prípadov sa dedí spôsobom viazaným na chromozóm X [18].
Významným problémom ostáva výskyt infekcií u SCID pred TKB. V našom súbore 73 % pacientov prekonalo infekciu pred TKB. V porovnaní so štúdiou autorov Heimall et al. bol výskyt infekcie v skupine pacientov diagnostikovaných na základe NBS/RA 42 %, avšak u skupiny diagnostikovanej na základe klinických príznakov bol výskyt infekcie tiež vysoký (92 %) [3].
V otázke celkovej morbidity a mortality hrajú významnú úlohu opatrenia obmedzujúce mikróbnu expozíciu bakteriálneho, vírusového a fungálneho pôvodu od včasného obdobia veku, podľa zavedených štandardných postupov. Zavedené štandardy sa odlišujú v jednotlivých krajinách so zavedeným skríningovým programom. Pre naliehavosť a zachovanie jednotlivých diagnostických a terapeutických postupov v prípade podozrenia na SCID preto odporúčame urgentne kontaktovať jedno z troch existujúcich PID centier (Bratislava, Martin, Košice).
ZÁVER
V prípade diagnózy SCID hrá čas významnú úlohu, preto sa táto diagnóza v literatúre zaraďuje medzi pediatrickú emergenciu. Pre zlepšenie prežívania týchto pacientov považujeme za potrebné zvyšovanie povedomia o tejto diagnóze, aby sa zabezpečil správny diagnostický a terapeutický postup s promptnou organizáciou TKB u všetkých pacientov so SCID.
Korespondující autorka:
MUDr. Veronika Urdová Dobšinská
Transplantačná jednotka kostnej drene
Klinika detskej hematológie a onkológie
Národný ústav detských chorôb,
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: nikaurdova@gmail.com
Zdroje
1. Tangye SG, Al-Herz W, Bousfiha A. Human inborn errors of immunity: 2019 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol 2020; 40 (1): 24–64.
2. Kwan A. Newborn screening for severe combined immunodeficiency in 11 screening programs in the United States. JAMA 2014; 312 (7): 729–738.
3. Heimall J. Immune reconstitution and survival of 100 SCID patients post-hematopoietic cell transplant: a PIDTC natural history study. Blood 2017; 130 (25): 2718–2727.
4. Fischer A, Notarangelo LD, Neven B, et al. Severe combined immunodeficiencies and related disorders. Nat Rev Dis Prim 2015; 1 : 15061.
5. Gennery AR. Omenn’s syndrome occurring in patients without mutations in recombination activating genes. Clin Immunol 2005; 116 (3): 246–256.
6. Chan K, Puck JM. Development of population-based newborn screening for severe combined immunodeficiency. J Allergy Clin Immunol 2005; 115 (2): 391–398.
7. Douek DC. Changes in thymic function with age and during the treatment of HIV infection. Nature 1998; 396 (6712): 690–695.
8. http://www.info4pi.org/town-hall/newborn-screening. Jeffrey Model Foundation.
9. Heimall J, Cowan MJ. Long term outcomes of severe combined immunodeficiency: therapy implications. Expert Rev Clin Immunol 2017; 13 (11): 1029–1040.
10. Šufliarska S, Horáková J, Boďová I. Transplantácia krvotvorných buniek v pediatrickej onkológii. Onkológia 2006; 1 (2): 93–97.
11. Cavazzana M, Six E, Lagresle-Peyrou C, André-Schmutz I. Gene therapy for X-linked severe combined immunodeficiency: Where do we stand? Hum Gene Ther 2016; 27 (2): 108–116.
12. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457–481.
13. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep 1966 Mar; 50 (3): 163–170.
14. IBM Corp. Released, IBM SPSS Statistics for Windows, Version 20.0, 2011.
15. Šufliarska S, Horáková J, Boďová I. Závažná BCG-itída u detí s vrodenou imunodeficienciou. Pediatr pre prax 2012; 13 (6): 268–270.
16. Gaspar HB. Long-term persistence of a polyclonal T cell repertoire after gene therapy for X-linked severe combined immunodeficiency. Sci Transl Med 2011 Aug; 3 (97).
17. Rota IA, Dhalla F. FOXN1 deficient nude severe combined immunodeficiency. Orphanet J Rare Dis 2017; 12 (1): 6.
18. Čižnár P, Horáková J. Novorodenecký skríning primárnych imunodeficiencií. Pediatr pre prax 2014; 15 (2): 52–56.
19. Pasic S, Vujic D, Veljković D. Severe combined immunodeficiency in Serbia and Montenegro between years 1986 and 2010: a single-center experience. J Clin Immunol 2014; 34 (3): 304–308.
20. Neven B, Leroy S, Decaluwe H, et al. Long-term outcome after hematopoietic stem cell transplantation of a single-center cohort of 90 patients with severe combined immunodeficiency. Blood 2009; 113 (17): 4114–4124.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2021 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- EDITORIAL Vrodené poruchy imunity – najväčší učitelia modernej imunológie
- Ťažká kombinovaná imunodeficiencia v súbore pacientov liečených v Národnom ústave detských chorôb
- Kombinované imunodeficience spojené se syndromickými příznaky
- Kongenitálne neutropénie v detskom veku
- Komplementový systém I: vrozené poruchy komplementové kaskády vyjma hereditárního angioedému
- Vrozené poruchy komplementu II. – hereditární angioedém
- Autoinflamačné ochorenia v klinickej praxi pediatra – kazuistická séria
- Ako hľadali názov choroby. Münchhausenov syndróm
- MUDr. Pavel Frühauf, CSc., emeritní primář, sedmdesátníkem
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Autoinflamačné ochorenia v klinickej praxi pediatra – kazuistická séria
- MUDr. Pavel Frühauf, CSc., emeritní primář, sedmdesátníkem
- Kongenitálne neutropénie v detskom veku
- Komplementový systém I: vrozené poruchy komplementové kaskády vyjma hereditárního angioedému
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



