-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kombinované imunodeficience spojené se syndromickými příznaky
Autoři: A. Klocperk 1; M. Bloomfield 1,2; A. Šedivá 1
Působiště autorů: Ústav imunologie 2. LF UK a FN Motol, Praha 1; Pediatrická klinika 1. LF UK a Fakultní Thomayerovy nemocnice, Praha 2
Vyšlo v časopise: Čes-slov Pediat 2021; 76 (4): 194-201.
Kategorie: Sympozium: Imunologie
ÚVOD
U většiny onemocnění spadajících do ostatních kategorií primárních imunodeficiencí zásadním způsobem dominuje postižení imunitního systému a s ním spojená zvýšená náchylnost k infekcím či v některých případech projevy autoimunitního či autoinflamatorního onemocnění. V kategorii kombinovaných imunodeficiencí spojených s dalšími či systémovými příznaky (dále syndromické imunodeficience) však nalezneme takové nozologické jednotky, u nichž je významně ovlivněn nejen systém imunitní, ale například též muskulo-skeletální, centrální nervový, endokrinní, oběhový, hematopoetický či koagulační [1]. Klasické jednotky spadající do této kategorie bývají také často spojeny s typickými somatickými dysmorfiemi. Konkrétní příklady neimunologických postižení naleznete níže u popisu jednotlivých onemocnění či jejich skupin. Projevy těchto onemocnění často zachytí nejdříve lékař jiné specializace než imunolog či alergolog a péče o pacienty trpící kombinovanou imunodeficiencí spojenou s dalšími či systémovými příznaky tak jednoznačně vyžaduje úzkou mezioborovou spolupráci odborníků různých specializací.
Mezi syndromické imunodeficience patří řada známých genetických syndromů (například DiGeorgův syndrom, hyper-IgE syndrom, ataxia teleangiectasia), ale také nově definovaná onemocnění způsobená mutacemi v jediném genu (tab. 1). Příčinu postižení více různých systémů je nutno hledat v pleiotropních rolích proteinů, jejichž funkce jsou zasaženy. Není výjimkou, že jeden protein kódovaný mutovaným genem plní za fyziologických okolností funkce nejen v lymfocytech či jiných buňkách imunitního systému, ale též ve fibroblastech, chondrocytech, ve zpracování signálů růstových faktorů, koordinaci embryonálního vývoje, opravě DNA a podobně.
Tab. 1. Přehled onemocnění v kategorii syndromických imunodeficiencí. 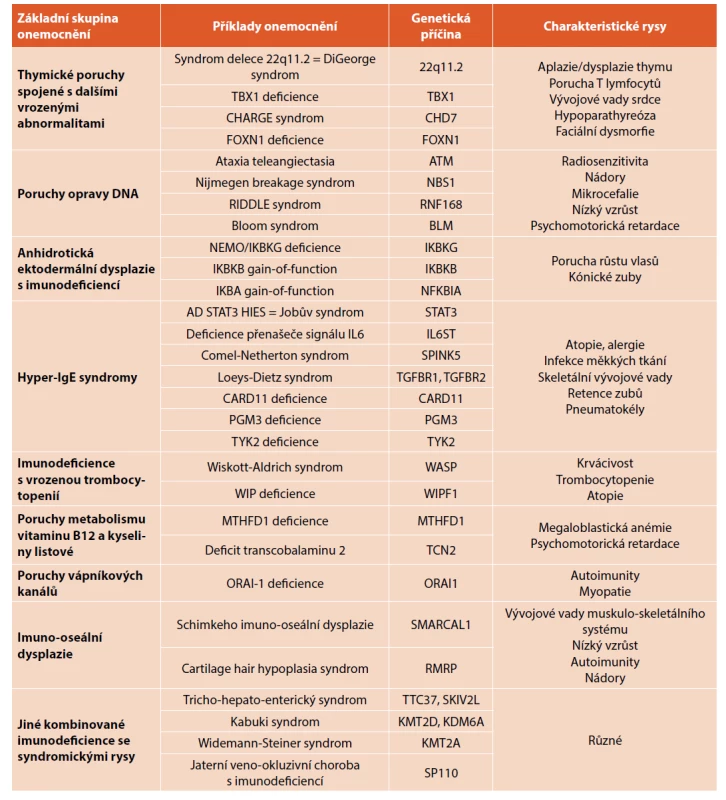
Ve většině případů je terapie syndromických imunodeficiencí symptomatická, a to jak farmakologická, tak režimová. Její specifika udává charakter postižených systémů a orgánů a konkrétní patofyziologie onemocnění. U některých onemocnění je terapeutickou možností transplantace kmenových buněk krvetvorby, která však z pochopitelných důvodů neovlivní muskulo-skeletální, neurologické či jiné orgánové projevy. V některých případech je nutná chirurgická korekce vrozených vad. Pro pacienty s Wiskottovým-Aldrichovým syndromem je v současné době vyvíjena genová terapie [2] a pro pacienty s poruchou vývoje thymu, například při kompletním DiGeorgově syndromu, se nabízí možnost transplantace thymu [3, 4].
PŘÍKLADY ONEMOCNĚNÍ
DiGEORGŮV SYNDROM
DiGeorgův syndrom (DGS) je jednou z nejčastějších syndromických imunodeficiencí, která je v naprosté většině případů způsobena delecí na 22. chromosomu v regionu 22q11.2. Populační incidence této delece je cca 1 : 4000, pouze cca 30 % pacientů však trpí imunodeficiencí, která splňuje diagnostická kritéria DGS [5].
U pacientů s DGS dochází k poruše prenatálního vývoje 3. a 4. faryngeálního oblouku, z nichž se vyvíjí thymus, příštítná tělíska a jejichž migrace též ovlivňuje utváření velkých cév. Pacienti s DGS proto trpí dysplazií brzlíku – hypothymií nebo kompletní athymií. Porucha thymické funkce vede ke snížení počtu cirkulujících T lymfocytů, pro jejichž vývoj je brzlík nezbytný. Dalšími příznaky jsou hypokalcémie a nízká hladina parathormonu způsobená dysplazií příštítných tělísek, vrozené srdeční vady (nejčastěji Fallotova tetralogie) a charakteristická facies s nízko položenými ušními boltci, atrézií choan a velofaryngeální insuficiencí. Řada pacientů též vykazuje mírnou formu psychomotorické retardace [6].
Ačkoliv snížený počet či chybění T lymfocytů jsou pro DiGeorgův syndrom charakteristické, většina pacientů má funkci thymu alespoň částečně zachovanou – spekuluje se o existenci lymfopoézy v tonzilách či ektopicky uložené thymické tkáni, např. v mediastinu, na pleurách a podobně. V takovém případě hovoříme o parciálním DGS. Imunokompetence těchto pacientů se od kojeneckého věku, kdy jsou tyto děti nejohroženější, do puberty se zlepšuje spolu se stoupajícím počtem T lymfocytů. Protilátková imunita a odpověď na vakcinaci bývá normální. Zhruba u 3 % DGS pacientů však T lymfocyty v periferní krvi chybí zcela a tito pacienti trpí de facto T-B+ formou závažné kombinované imunodeficience (severe combined immunodeficiency, SCID), stav pak nazýváme kompletní DGS. Pozoruhodnou a diferenciálně diagnosticky obtížnou formou je tzv. atypický kompletní DiGeorgův syndrom, o němž pojednává kazuistika 2.
Pacienti s parciálním DGS zpravidla nevyžadují kauzální terapii, v případě častějších infekcí užívají profylakticky antibiotika (např. kotrimoxazol) a někteří, zejména v dětství, též substituční imunoglobulinovou léčbu. Pro tyto pacienty je velmi důležitá péče kardiologická, psychologická, logopedická, případně endokrinologická.
Naopak kompletní DGS je život ohrožujícím onemocnění, jehož urychlená kauzální terapie je jediným předpokladem dlouhodobého přežití. Pacienti jsou od narození ohrožení zejména herpetickými (především cytomegalovirovými) infekcemi či oportunními patogeny, jako jsou např. kandidy či Pneumocystis jirovecii. V současné době je kauzální terapie kompletního DGS, kterou je transplantace thymu, možná ve dvou centrech na světě, v USA a ve Velké Británii. Dlouhodobá prognóza transplantovaných pacientů je výborná [3, 4, 6]. Od transplantace hematopoetických kmenových buněk, v minulosti využívané, se v současné době ustupuje vzhledem ke špatné prognóze takto léčených pacientů – z podstaty onemocnění vyplývá, že kostní dřeň nemůže nahradit funkci thymu.
Kazuistika 1
Kompletní DiGeorgův syndrom
První kazuistika pojednává o pacientce s kompletním DiGeorgovým syndromem, která ilustrativně dokumentuje fenotypické spektrum tohoto onemocnění, včetně přístupu k terapii.
U dívky narozené zdravým rodičům byla ihned po fyziologickém porodu pozorována anorektální atrézie, pro níž byla ve věku 7 dnů provedena posteriorní sagitální anorektoplastika, a obtížný příjem per os způsobený stenózou pravé choany. Během pooperační péče byly opakovaně zachyceny laboratorní známky hypoparathyreózy a hypothyreózy, které vyžadovaly substituci kalcia, magnézia, léčbu levothyroxinem a podávání vitaminu D (kalcidiolu i kalcitriolu). Pacientka byla faciálně stigmatizována s krátkými očními štěrbinami, naznačenými telekanty (rozšířená vzdálenost mediálních očních koutků), širokým prominujícím nosem a dysplastickými, nízko položenými ušními boltci. Na obličeji byla patrná periferní paréza dolní větve n. facialis l. dx.
Pro zachycený srdeční šelest byla provedena echokardiografie, která odhalila komplexní srdeční vadu s komorovým i síňovým septální defektem, pravostranným aortálním obloukem a dalšími atypiemi. Korektivní kardiochirurgická operace byla provedena ve věku 22 dní. Během operace nebyl operatéry nalezen thymus, který je jinak běžně resekován v rámci zpřístupnění velkých cév.
Komplexní symptomatologie pacientky s charakteristickou faciální stigmatizaci (zřetelnou např. na obrázku 1 ve věku 2 let) a absencí thymu vedla k provedení cíleného genetického vyšetření, které potvrdilo přítomnost mikrodelece 22q11.2. Současně provedené imunologické vyšetření prokázalo kompletní absenci T lymfocytů v periferní krvi a nulové hodnoty TREC (T-cell receptor excision circles, vyšetření detekující funkční thymopoézu využívané v některých státech k neonatálnímu screeningu vrozených poruch imunity [7], v České republice zatím dostupné pouze na některých pracovištích na vyžádání [8, 9]). Dítě bylo ihned izolováno v chráněném prostředí izolačního boxu, bylo ukončeno kojení k prevenci potenciálního přenosu CMV a zahájeno profylaktické podávání antibiotik (kotrimoxazol), antimykotik (flukonazol) a subkutánních imunoglobulinů. Po konzultaci s kolegy ve Velké Británii byla pacientka zařazena na čekací listinu k transplantaci thymu.
Obr. 1. Pacientka s kompletním DiGeorgovým syndromem.
Fig. 1. Patient with complete DiGeorge syndrome.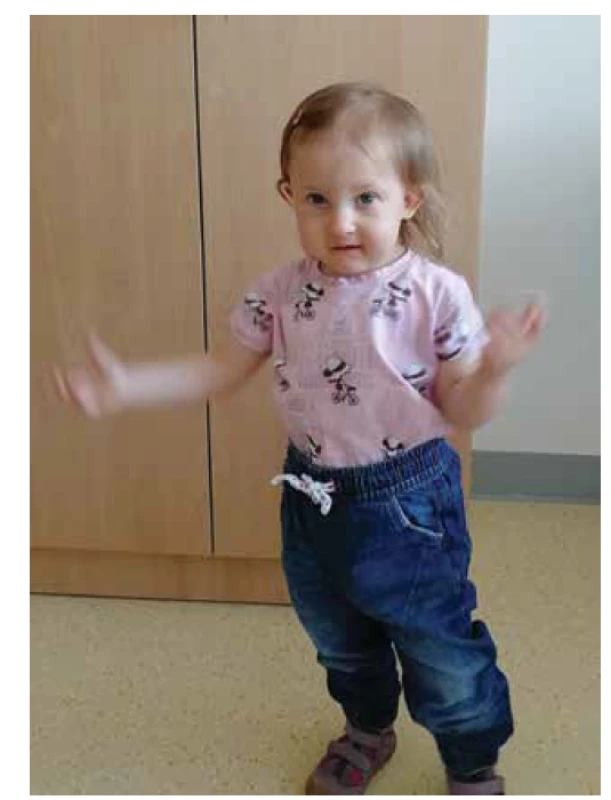
Dárcovský thymus je získáván od dětských pacientů podstupujících kardiochirurgické operace, u nichž je vyloučeno imunologické onemocnění.
Nutná je shoda v AB0 krevní skupině a preferuje se částečná shoda v HLA typizaci. Vhodný dárce byl pro naši pacientku nalezen velmi rychle, cca do 2 týdnů od rozhodnutí k transplantaci. Pacientka byla převezena na zahraniční pracoviště, kde proběhla nekomplikovaná bilaterální implantace štěpu do m. quadriceps femoris (obr. 2). Po necelých dvou týdnech postoperační dispenzarizace byla převezena zpět do ČR a propuštěna do domácí péče.
Obr. 2. Jizva po implantaci thymu do stehenního svalu.
Fig. 2. Scar after implantation of thymic stroma into the femoral muscle.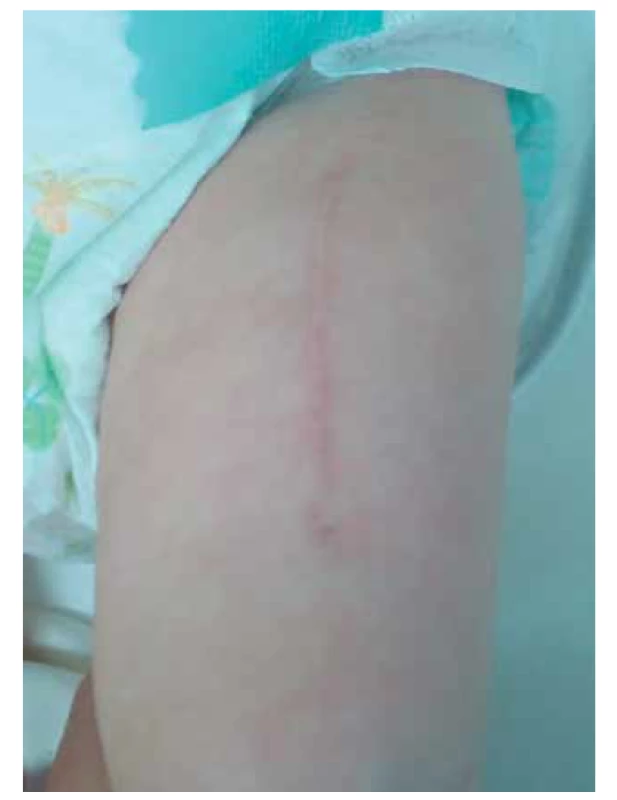
V týdnech následujících po transplantaci došlo k rapidnímu zlepšení výživového stavu dítěte, od 5. měsíce po transplantaci k postupnému obnovení vyzrávání T lymfocytů v thymu manifestujícím se jejich přítomností v periferní krvi. Tyto T lymfocyty tak pochází z kostní dřeně pacientky a prošly vývojem v dárcovském thymu implantovaném ve stehenních svalech.
Třicet šest měsíců po transplantaci se pacientce klinicky daří výborně, hmotnostně prospívá a její infekční nemocnost je minimální. Bylo možné vysadit substituci imunoglobulinů, antibiotická a antimykotická profylaxe je titrována k postupnému vysazení. Bylo zahájeno očkování neživými vakcínami a v periferní krvi pacientky nyní nacházíme (sice proti zdravým normám mírně snížené, ale zjevně přítomné) T lymfocyty se zastoupením všech jejich vývojových stadií.
Kazuistika 2
TBX1 deficience, atypický DiGeorgův syndrom s Omenn-like příznaky
Jiným velmi pozoruhodným příkladem syndromické imunodeficience spojené s aplazií thymu je 9měsíční pacient narozený z fyziologické gravidity zdravým rodičům, u něhož byla ihned po narození zaznamenána kraniofaciální dysmorfie a který od narození trpí řídkou stolicí neinfekční etiologie.
Ve třech a půl měsících byl pacient poprvé hospitalizován pro progredující respirační insuficienci při pneumonii. Při příjmu do nemocnice měl pacient dále nápadný soor v dutině ústní a dermatitidu v anogenitální oblasti a tříslech (obr. 3), dále byla zachycena hypokalcémie s hypoparathyreózou, pro niž byla nutná trvalá substituce kalcia a magnézia.
Obr. 3. Vyrážka pacienta s Omenn-like příznaky při TBX1 deficienci.
Fig. 3. Rash in a patient with Omenn-like syndrome caused by TBX1 deficiency.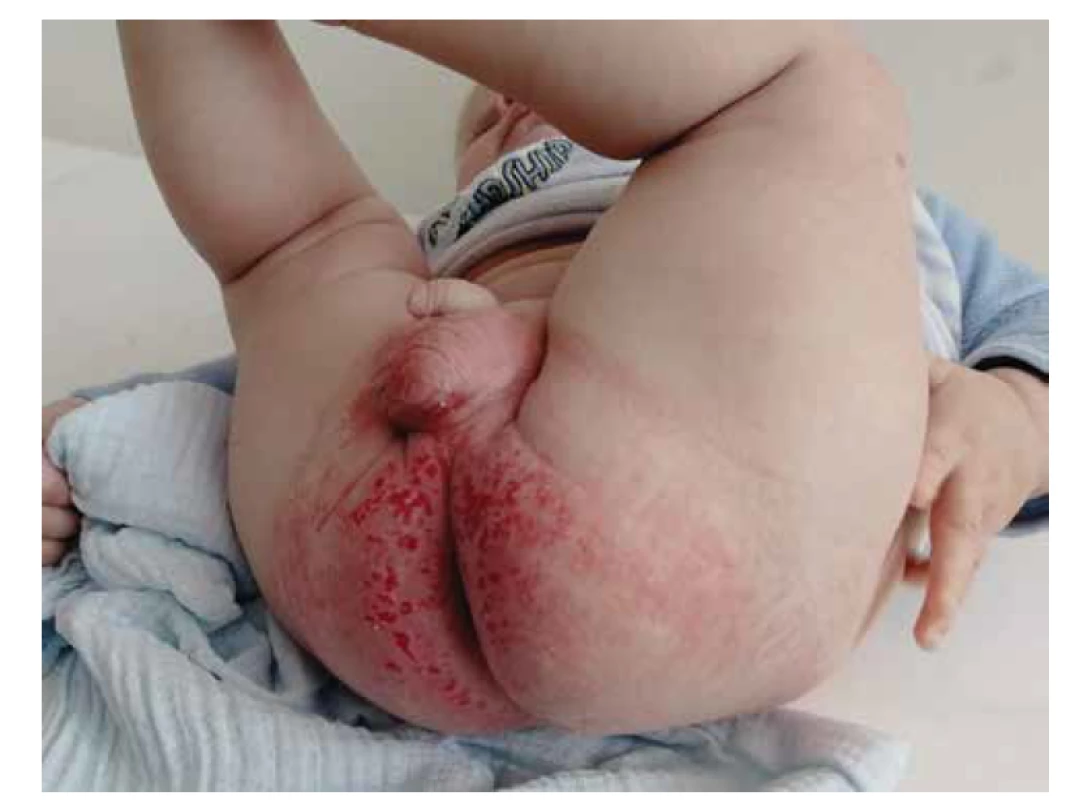
Respirační insuficience si postupně vyžádala umělou plicní ventilaci. Na rtg hrudníku nebyl patrný stín thymu, jehož absence byla následně definitivně potvrzena magnetickou rezonancí. Kombinace těžkého průběhu infekčního onemocnění, absence thymu a kraniofaciální dysmorfie vzbudila podezření na DiGeorgův syndrom, avšak genetické vyšetření vyloučilo přítomnost delece 22q11.2. Pacient měl přesto významné snížení T lymfocytů s nulovou hodnotou TREC, potvrzující zcela chybějící populaci naivních T lymfocytů při absenci thymu a deficit IgA s hraničními hodnotami IgG, proto u něj po rezoluci respiračního infektu bylo zahájeno profylaktické podávání imunoglobulinů a konzultováno naše pracoviště.
Vzhledem k velmi podezřelé kombinaci příznaků bylo doplněno sekvenování panelu genů asociovaných s primárními imunodeficiencemi, které odhalilo mutaci v genu TBX1, jehož funkce je nezbytná ke správnému vývoji thymu a jehož monogenní mutace způsobují DiGeorgův syndrom podobně jako obvyklejší 22q11.2 delece. Detailnější imunofenotypizace T lymfocytů přítomných v krvi pacienta prokázala, že tyto buňky jsou téměř všechny aktivované, jeví známky abnormálního vývoje a jsou oligoklonální. Jedná se tedy velmi pravděpodobně o malou populaci T lymfocytů, která prošla nedokonalým vývojem, v periferní krvi pak buňky expandovaly a pravděpodobně se podílely na závažnosti kožních manifestací a enteropatii, čímž vedly k rozvoji tzv. Omenn-like syndromu v rámci atypického DiGeorgova syndromu. Omennův syndrom je obvykle způsoben hypomorfickými mutacemi v genech způsobujících SCID, při nichž také dochází k proliferaci oligoklonální aktivované autoreaktivní populace T lymfocytů a projevům imunitní dysregulace.
Pacient byl ihned indikován k transplantaci thymu taktéž na londýnském pracovišti. Na rozdíl od pacientky v předchozí kazuistice mu však musel být před samotnou transplantaci podán cyklosporin a antithymocytární globulin, které eliminují z těla abnormální populaci autoreaktivních T lymfocytů a umožní engraftment thymového štěpu a následnou tvorbu zdravých T lymfocytů. Pacient byl úspěšně transplantován s dobrým perioperačním průběhem, probatorní biopsie po 3 měsících ukázala kompletní přihojení štěpu a cca půl roku po transplantaci již byly v periferní krvi pacienta zachyceny naivní formy T lymfocytů.
HYPER-IgE SYNDROMY
Hyper-IgE syndromy (HIES) jsou geneticky heterogenní skupina onemocnění, která spojuje eozinofilie, vysoké hladiny imunoglobulinu E a atopická predispozice. Historicky první, a zároveň nejčastější, identifikovanou genetickou příčinou hyper-IgE syndromu byla autosomálně dominantně dědičná mutace signálového přenašeče STAT3 (AD HIES), způsobující tzv. Jobův syndrom [10–12].
Pro pacienty s AD-HIES jsou charakteristické závažné ekzematiformní dermatitidy s časným nástupem již v novorozeneckém období [13], které jsou doprovázeny opakovanými hlubokými infekcemi měkkých tkání s tvorbou abscesů vyvolanými zejména Staphylococcus aureus. Na kůži jsou tyto abscesy popisované jako „chladné“ pro absenci lokálních známek zánětu (zarudnutí/proteplení). Přítomná může být také chronická mukokutánní kandidóza způsobená infekcí Candida albicans či jiné mykotické infekce. Jedním z nálezů charakteristických pro AD-HIES je kraniofaciální dysmorfie někdy popisovaná jako tzv. facies leontina s hrubými rysy, hypertelorismem a prognacií, jež se prohlubují s věkem. Dalšími diagnostickými klinickými vodítky mohou být tvorba pneumatokél v terénu opakovaných infekcí dýchacích cest, dentální či skeletální abnormity, zvýšená lomivost kostí a atypicky nízké hodnoty C-reaktivního proteinu (CRP) při bakteriálních infektech.
Při laboratorním vyšetření pacientů s AD-HIES zjišťujeme vysokou sérovou hladinu IgE (někdy až v desetitisícových hodnotách, ale u dětí nemusí být nápadně vyjádřena) a eozinofilii, při detailnější imunofenotypizaci můžeme pozorovat snížení Th17 lymfocytů. Přesný imunopatologický mechanismus zodpovědný za projevy AD-HIES však není dosud zcela dokonale objasněn. Předpokládá se podíl dysfunkce Th17 lymfocytů a cytokinová dysbalance (mimo jiné zvýšení IL-4, IL-21) vedoucí k preferenční Th2 odpovědi a tím k elevaci IgE a „atopické“ reaktivitě.
Terapeuticky se uplatňují profylaktické režimy protistafylokokovými antibiotiky a antimykotiky, v některých případech mohou pacienti profitovat ze substituce imunoglobulinů. Transplantace kmenových buněk krvetvorby může vést k částečnému zlepšení imunitních funkcí, ke snížení hladin IgE a zmírnění atopického fenotypu, nicméně dosud chybí informace o dlouhodobé prognóze a robustnosti imunitních změn po transplantaci.
Důležité je, že ne každá vyšší elevace sérového IgE u dítěte s ekzémem má vzbudit podezření na HIES. U kojenců a batolat, především jsou-li rodiče sami atopici, však může být rozhodnutí obtížné, nicméně brzká diagnóza je pro management HIES zásadní. Proto byla vypracovaná kritéria, která zohledňují věk pacienta a usnadňují správnou indikaci imunologického, potažmo genetického vyšetření [12].
Kazuistika 3
Autosomálně dominantní hyper-IgE syndrom
Zdravý novorozenec nepříbuzných rodičů z fyziologické gravidity byl porozený ve 36. gestačním týdnu sekcí pro elevaci CRP u matky. V šesti týdnech věku se objevila výrazná papulopustulóza v obličeji (obr. 4) a průjmovité stolice. Z kožních stěrů byl zjištěn Staphylococcus aureus, Enterococcus faecalis a Escherichia coli. V krevním obraze byla přítomna leukocytóza 24,6x109/L (norma 5,0–19,5x109/L) bez neutropenie, dále eozinofilie 5,7x109/L (norma 0,0–1,4x109/L) a jen mírně zvýšené celkové IgE 24 IU/mL (norma 0,0 až 18,0 IU/mL). Histologické vyšetření kožní biopsie bylo s obrazem eozinofilní folikulitidy. Od třetího měsíce života se na kalvě objevovaly stafylokokové abscesy velikosti až 2x3 cm bez výrazné lokální reakce („chladné abscesy“) či systémových příznaků zánětu. Chirurgická drenáž, lokální antiseptická a celková antibiotická léčba měly dobrý okamžitý efekt, ale obtíže urputně recidivovaly.
Obr. 4. AD hyper-IgE syndrom, folikulární papulopustulóza v kojeneckém věku.
Fig. 4. AD hyper-IgE syndrome, follicular papulopustulosis in infancy.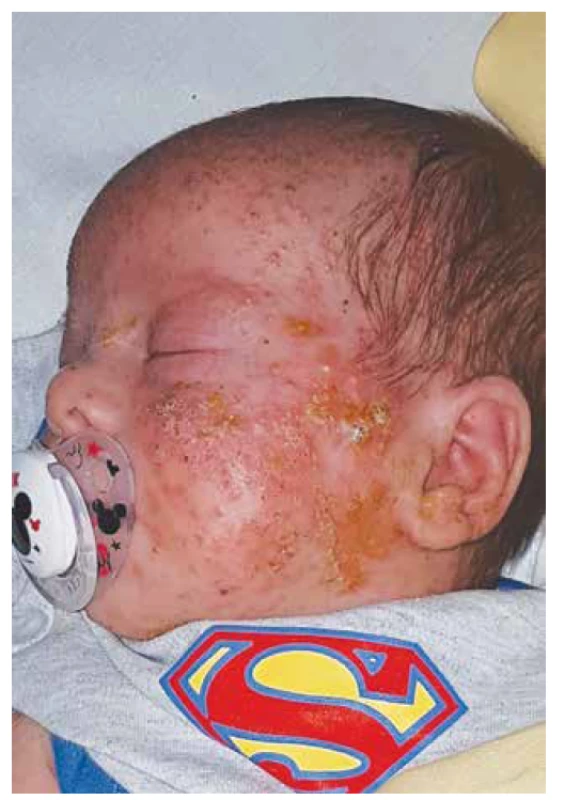
V dalším průběhu se u chlapce zvýrazňovala typická syndromická faciální dysmorfie, především hrubé rysy obličeje, výrazné nadočnicové oblouky, široký rozestup očních štěrbin a široký kořen nosu (obr. 5). Prodělal několik akutních zánětů zevního zvukovodu a středouší kandidové etiologie a jednu pneumonii bez elevace CRP. Vynikajícím úsudkem dermatologa a ošetřujících chirurgů bylo indikováno imunologické vyšetření. Základní imunologické parametry byly s výjimkou zvýšení IgE a mírné hypogamaglobulinémie ve třídě IgG (2,06 g/L, norma 3,65–6,37 g/L) v normě, podrobnějším vyšetřením, zaměřeným již směrem k AD-HIES, bylo detekováno snížení Th17 lymfocytů. Cílené genetické vyšetření potvrdilo přítomnost mutace ve STAT3 genu. Bylo zahájeno profylaktické podávání kotrimoxazolu a antimykotika itrakonazolu, což významně minimalizovalo infekční nemocnost dítěte. Chlapec byl nekomplikovaně naočkován neživými vakcínami.
Obr. 5. AD hyper-IgE syndrom, somatofenotyp téhož dítěte ve 2 letech věku s již vyjádřenými charakteristickými dysmorfickými rysy.
Fig. 5. AD hyper-IgE syndrome, somatophenotype of the child at 2 years of age with pronounced characteristic dysmorphic features.
Od počátku třetího roku se u chlapce zhoršoval charakter stolic, které byly průjmovité s příměsí většího množství hlenu, přesto dlouhodobě uspokojivě prospíval a neměl zjevné bolesti. Endoskopické vyšetření gastrointestinálního traktu však prokázalo výraznou eozinofilní enterokolitidu. Pro podezření na non-IgE mediovanou potravinovou reaktivitu jsme přistoupili k eliminační dietě, nejprve s omezením šesti základních potravinových alergenových skupin (mléko, vejce, pšenice, sója, ryby, ořechy) a následně i lipid transfer protein (LTP) homologních potravin, což vedlo k významnému zlepšení průjmů, ovšem za cenu mimořádných omezení ve stravě. Snaha o opětovné zařazení jednotlivých potravin vedla bohužel k okamžitému zhoršení stolic, léčba střevního zánětu vyžadovala následně nízkou dávku kortikosteroidu. Jako typická komplikace AD-HIES se ve 4 letech dítěte objevuje první fraktura nártu po minimálním traumatu. Chlapec je kromě imunologa dispenzarizován gastroenterologem, pneumologem, ortopedem, stomatologem a fyzioterapeutem, který se zaměřuje na pohybový aparát a dýchací svaly. Jeho psychomotorický vývoj je nadstandardní.
ZÁVĚR
Syndromické imunodeficience tvoří rozsáhlou, geneticky i klinicky různorodou skupinu onemocnění, která vyžadují úzkou mezioborovou spolupráci jak při stanovení diagnózy, tak při následné optimalizaci terapie a dlouhodobém sledování pacientů. Díky nově se zpřístupňujícím možnostem genetického vyšetření pomocí sekvenování nové generace je možná cílená diagnostika ve stále nižším věku, z níž pacienti profitují jak lepší prognózou při včasné kauzální léčbě, tak důslednější prevencí sekundárních komplikací onemocnění. Předpokladem úspěšné péče však jako vždy zůstává rozpoznání v bodě primární péče a reference na specializované pracoviště.
Poděkování a finanční podpora
• Děkujeme za spolupráci rodičům pacientů a týmu lékařů pečujících o pacienty popisované v tomto textu, především MUDr. Štěpánce Mikulové z Oddělení klinické imunologie a alergologie Masarykovy nemocnice v Ústí nad Labem, MUDr. Zuzaně Plzákové, Ph.D., z Dermatovenerologické kliniky 1. LF UK a VFN a celému týmu skupiny pro primární imunodeficience Ústavu imunologie 2. LF UK a FN Motol, laboratoře CLIP, Centra kardiovaskulární a transplantační chirurgie v Brně a řadě dalších.
• Text popisující kazuistiku pacientky s kompletním DiGeorgovým syndromem byl adaptován z rozsáhlejší publikace prvního autora pojednávající o transplantaci thymu [14].
• Fotografie jsou publikovány se souhlasem zákonných zástupců dětí.
Podpořeno projekty NV18-05-00162 a NU20-05--00282.
Korespondující autor:
MUDr. Adam Klocperk, Ph.D.
Ústav imunologie 2. LF UK
a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: adam.klocperk@fnmotol.cz
Zdroje
1. Tangye SG, Al-Herz W, Bousfiha A, et al. Human Inborn Errors of Immunity: 2019 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol 2020; 40 : 24–64. doi: 10.1007/s10875-019-00737-x.
2. van Zelm MC, Szczepanski T, van der Burg M, et al. Replication history of B lymphocytes reveals homeostatic proliferation and extensive antigen-induced B cell expansion. J Exp Med 2007 Mar 19; 204 (3): 645–655.
3. Markert ML, Devlin BH, Alexieff MJ, et al. Review of 54 patients with complete DiGeorge anomaly enrolled in protocols for thymus transplantation: outcome of 44 consecutive transplants. Blood 2007; 109 : 4539–4547.
4. Davies EG, Cheung M, Gilmour K, et al. Thymus transplantation for complete DiGeorge syndrome: European experience. J Allergy Clin Immunol 2017; 140 : 1660–1670. doi: 10.1016/j.jaci.2017.03.020.
5. Ryan AK, Goodship JA, Wilson DI, et al. Spectrum of clinical features associated with interstitial chromosome 22q11 deletions: a European collaborative study. J Med Genet 1997; 34 : 798–804.
6. Sullivan KE. Chromosome 22q11.2 deletion syndrome and DiGeorge syndrome. Immunol Rev 2019; 287 (1): 186–201.
7. King JR, Hammarström L. Newborn screening for primary immunodeficiency diseases: History, current and future practice. J Clin Immunol 2018 Jan; 38 (1): 56–66.
8. Froňková E, Klocperk A, Svaton M, et al. The TREC/KREC assay for the diagnosis and monitoring of patients with DiGeorge syndrome. PLoS One 2014 Jan; 9 (12): 1–13.
9. Šedivá A, Zachová R, Klocperk A, et al. Závažné primární imunodeficience a možnosti jejich časné diagnostiky, uvedení testu TREC/KREC. Čes-slov Pediat 2019; 74 (3): 182–187.
10. Ponsford MJ, Rae W, Klocperk A. What’s new in HIES? Recent insights from the interface of primary immune deficiency and atopy. Curr Opin Allergy Clin Immunol 2018; 18 : 445–452.
11. Ponsford MJ, Klocperk A, Pulvirenti F, et al. Hyper-IgE in the allergy clinic - when is it primary immunodeficiency? Allergy 2018 Nov 25; 73 (11): 2122–2136.
12. Grimbacher B, Holland SM, Gallin JI, et al. Hyper-IgE syndrome with recurrent infections – an autosomal dominant multisystem disorder. N Engl J Med 1999; 340 (9): 692–702.
13. Plzáková Z, Bloomfield M, Polášková S, et al. An eosinophilic papulopustular rash in a baby. Pediatr Dermatol 2020; 37 : 32–34. doi: 10.1111/pde.14164.
14. Klocperk A, Šedivá A. První transplantace thymu v České republice jako nová terapeutická možnost pro pacienty s kompletním syndromem DiGeorge. Alergie 2019; 4 : 200–205.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2021 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- EDITORIAL Vrodené poruchy imunity – najväčší učitelia modernej imunológie
- Ťažká kombinovaná imunodeficiencia v súbore pacientov liečených v Národnom ústave detských chorôb
- Kombinované imunodeficience spojené se syndromickými příznaky
- Kongenitálne neutropénie v detskom veku
- Komplementový systém I: vrozené poruchy komplementové kaskády vyjma hereditárního angioedému
- Vrozené poruchy komplementu II. – hereditární angioedém
- Autoinflamačné ochorenia v klinickej praxi pediatra – kazuistická séria
- Ako hľadali názov choroby. Münchhausenov syndróm
- MUDr. Pavel Frühauf, CSc., emeritní primář, sedmdesátníkem
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Autoinflamačné ochorenia v klinickej praxi pediatra – kazuistická séria
- MUDr. Pavel Frühauf, CSc., emeritní primář, sedmdesátníkem
- Kongenitálne neutropénie v detskom veku
- Komplementový systém I: vrozené poruchy komplementové kaskády vyjma hereditárního angioedému
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



