-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Enterální výživa v léčbě idiopatických střevních zánětů
Enteral nutrition in the treatment of inflammatory bowel disease
The article is trying to provide a comprehensive view of the role of enteral nutrition in patients with inflammatory bowel disease (IBD). By influencing nutrition, we can not only induce remission of Crohn's disease, or supplement the nutritional deficiency in patients with IBD, but we can influence one of the key factors in the pathogenesis of this disease. The complex pathophysiological mechanisms involved in the development of IBD include interactions between genetic factors, diet, intestinal microbiom and mucosal immune system. Current knowledge suggests, that by modifying eating habits we can not only change the development of an already ongoing disease, but also influence the risk of developing IBD.
Key words:
inflammatory bowel disease, Crohn's disease, children, exclusive enteral nutrition, diet
Autoři: J. Schwarz; J. Sýkora; D. Cvalínová
Působiště autorů: Dětská klinika FN Plzeň ; Univerzita Karlova, LF v Plzni
Vyšlo v časopise: Čes-slov Pediat 2017; 72 (5): 276-280.
Kategorie: Sympozium: Idiopatické střevní záněty
Souhrn
Cílem článku je podat ucelený pohled na roli enterální výživy u pacientů s idiopatickým střevním zánětem (IBD). Ovlivněním výživy máme nejen možnost indukovat remisi Crohnovy choroby či doplnit nutriční deficit pacientů s IBD, ale můžeme působit na jeden z klíčových faktorů patogeneze tohoto onemocnění. Složité patofyziologické mechanismy, které se podílejí na rozvoji IBD, zahrnují interakce mezi genetickými faktory, stravou, střevním mikrobiomem a slizniční imunitou. Současné znalosti naznačují, že úpravou stravovacích návyků můžeme nejenom změnit vývoj již probíhajícího onemocnění, ale i ovlivnit riziko rozvoje IBD.
KLÍČOVÁ SLOVA:
idiopatický střevní zánět, Crohnova choroba, děti, exkluzivní enterální výživa, stravaÚVOD
Dvěma hlavními představiteli skupiny idiopatických střevních zánětů (IBD) jsou Crohnova choroba (CD) a ulcerózní kolitida (UC). Zatímco u pacientů s UC je zánět omezen na sliznici tlustého střeva, pro CD je charakteristickým rysem granulomatózní zánět prostupující celou šíří stěny libovolných úseků gastrointestinálního traktu (GIT) od dutiny ústní po konečník. Až 47 % pacientů s IBD může mít současně extraintestinální manifestaci [1], jejíž problematika je však nad rámec našeho sdělení.
EPIDEMIOLOGIE A PATOGENEZE IBD
IBD patří mezi autoimunitní onemocnění, jehož patogeneze není doposud zcela objasněna. Klíčovou úlohu v rozvoji zánětu má dysregulace slizničního imunitního systému, který u geneticky predisponovaných jedinců patologicky reaguje na střevní mikrobiom. Je známo téměř 200 mutací, které by mohly hrát v patogenezi IBD roli [2].
Incidence IBD stoupá celosvětově [3] včetně České republiky [4, 5]. Vzhledem k tomu, že k nárůstu dochází především v rozvinutých zemích [6], předpokládá se významný vliv faktorů zevního prostředí [7, 8]. Mezi hlavní a ovlivnitelné faktory patří způsob stravování [9], který má vliv na střevní mikrobiom [10] a následný rozvoj střevního zánětu [11, 12]. Jednou z cest, která vede k tomuto zánětlivému pochodu, je zvýšená střevní permeabilita. Není zcela jasné, zda je tato změna u pacientů s IBD primární nebo sekundární. Víme však, že některé složky běžné stravy mohou poškozovat epiteliální buňky střeva a zvyšovat tak jeho propustnost. V důsledku porušení intestinální bariéry dochází k nadměrnému přestupu střevních bakterií a jejich produktů, které svými antigeny stimulují imunitní systém. To vede ke ztrátě tolerance střevního mikrobiomu a rozvíjí se zánět [13].
Střevní mikrobiom a slizniční imunitní systém jsou úzce spojeny. Vzájemné interakce mohou být tělu prospěšné, ale mohou být i příčinou zánětlivých změn. Dysbióza je tak důležitým faktorem ovlivňujícím rozvoj IBD [14, 15]. Je třeba poznamenat, že až 60 % střevní mikroflóry může být ovlivnitelné stravou [16]. Interakce mezi genetickými faktory, stravou, střevním mikrobiomem a slizniční imunitou střeva jsou velmi složité [17] a zde prezentovaný model je jen zjednodušenou výsečí komplexní problematiky.
LÉČBA IBD
Kauzální léčba IBD dosud není známá. Základem symptomatické terapie jsou léky modulující zánětlivou odpověď organismu (biologická léčba, kortikosteroidy, imunosupresiva, aminosalicyláty, probiotika, exkluzivní enterální výživa) a podpůrná léčba substituující karence v nutrici (doplňková enterální výživa, vitamin D, vápník, vláknina, omega-3 mastné kyseliny). Chirurgická léčba má své místo při selhání medikamentózní léčby a při řešení komplikací (stenóza, píštěl, absces, perforace, nezvladatelné krvácení).
EXKLUZIVNÍ ENTERÁLNÍ VÝŽIVA V LÉČBĚ CD
První volbou léčby aktivní luminální formy CD v pediatrické populaci je exkluzivní enterální výživa (EEN) [18, 19]. Je možné ji využít k indukci remise i léčbě relapsů. Oproti kortikosteroidům má EEN celou řadu předností [20–23]. EEN je spojena s minimálním množstvím nežádoucích účinků [24], zlepšuje nutriční stav pacientů [25, 26], vede k navození slizničního hojení [27, 28], zlepšuje kostní denzitu [29, 30] a nevede ke zpomalení růstu. Účinnost EEN je srovnatelná s kortikosteroidy, což dokazuje i v průměru 85% pravděpodobnost navození remise [24, 31, 32]. Nejlépe na léčbu odpovídají pacienti s krátkou anamnézou trvání onemocnění a pacienti naivní k léčbě. Lokalizace zánětu podle meta-analytických studií nemá vliv na účinnost terapie EEN [33, 34], ačkoli dřívější studie poukazovaly na vyšší účinnost u pacientů s postižením tenkého střeva oproti izolovanému postižení kolon [35].
Velice důležitým faktorem je exkluzivita enterální výživy. Řada studií prokázala, že EEN je významně účinnější než parciální enterální výživa (PEN) [36]. Po zahájení EEN se enterální výživa stává výlučným zdrojem makro - i mikronutrientů a pacientům je povoleno pouze popíjení neochucené vody. Vyloučením jiných zdrojů výživy dochází k omezení antigenní nálože v lumen střeva a tím se snižuje antigenní stimulace imunitního systému gastrointestinálního traktu. Na zmírnění zánětlivých procesů se podílí i eliminace rizikových faktorů běžné stravy, mezi které patří aditivní látky (stabilizátory, emulzifikátory), zvýšené množství síry či nadměrný přísun nasycených mastných kyselin [9]. Působení EEN vede ke specifickým změnám v mikrobiální tkáni pacienta a dochází tak k potlačení střevní dysbiózy. Tyto pozitivní změny ve střevním mikrobiomu korelují se zánětlivou aktivitou onemocnění [37].
DRUH VÝŽIVY
Řada studií se snažila odpovědět na otázku, zda není možné dosáhnout lepších výsledků dalším snižováním antigenní nálože pomocí štěpení mléčné formule. Výsledky však neprokázaly rozdílnou účinnost EEN při použití polymerní, oligomerní nebo elementární diety [33, 38]. Polymerní preparáty mají mnohem lepší chuť, jsou dětmi lépe tolerovány a jejich cena je nižší. Spektrum preparátů enterální výživy v současné době plně pokryje nejen nutriční, ale i chuťové požadavky pediatrických pacientů. Na trhu jsou preparáty v tekuté formě (lahvičky určené k popíjení, sondová výživa balená v lahvích či vacích do objemu 1 litru) anebo práškové (Modulen, který je navíc obohacen o protizánětlivě působící transforming growth factor beta).
MNOŽSTVÍ
K dosažení hmotnostních přírůstků a růstu je nutné podávat dostatečné množství enterální výživy, které pokryje alespoň 120 % kalorické potřeby pacienta. Pokud podávané dávky nevedou ke zlepšení nutričního stavu anebo pacient pociťuje hlad, je možné postupné navýšení až do 1,7násobku vypočtené hodnoty. Pro běžnou praxi postačuje k výpočtu kalorické potřeby zjednodušený vzorec (tab. 1), ve kterém je však nutno počítat s ideální hmotností (50. percentil) k dané výšce pacienta.
Tab. 1. Denní potřeba tekutin (ml) a energie (kcal) v závislosti na tělesné hmotnosti (zjednodušený výpočet). 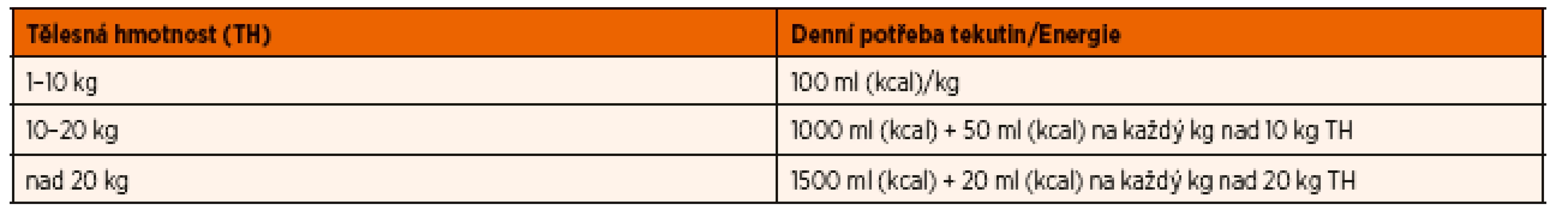
ZPŮSOB PODÁVÁNÍ
EEN je možné podávat perorálně formou sippingu (popíjení) nebo pomocí nazogastrické sondy (NGS). Výhodou p.o. podávání je větší komfort pacienta a nižší cenové náklady. Nevýhodou je omezená tolerance chuťových vlastností výživových preparátů, kterou můžeme překonat zavedením NGS. Touto cestou lze výživu podávat v bolusech nebo pomocí enterální pumpy. Oba způsoby podávání mají stejnou účinnost [39]. Při výběru sondy dáváme přednost polyuretanové sondě se zavaděčem, která je tenká, měkká, nepůsobí otlaky a je možné ji ponechat i 3 měsíce bez výměny.
Velikost bolusů je limitována tolerancí pacienta. Ideálně se pohybuje v rozmezí 1–5 ml/kg, avšak někteří pacienti zvládají i vyšší dávky. V prvních dnech EEN je vhodná kontrola žaludečního rezidua před aplikací dalšího bolusu. Interval mezi bolusy se odvíjí od celkové denní dávky enterální výživy a velikosti jednotlivých bolusů. Optimální je rozmezí 2–4 hodin.
Ke kontinuálnímu podávání výživy používáme nejčastěji nutriční pumpy, které jsou malé, lehké a v kombinaci s batohem umožňují být pacientům mobilní. Výživu můžeme podávat přerušovaně nebo kontinuálně během 24 hodin. Řada pacientů preferuje noční podávání, neboť přestávka během dne jim umožňuje minimalizovat omezení běžných aktivit. Přerušované podávání je však limitováno tolerancí rychlosti výživy. Enterální výživu zahajujeme dávkou, která odpovídá 50 % vypočítaného množství. Plné dávky dosahujeme během 2–3 dnů postupným navyšováním rychlosti.
EEN většinou zahajujeme krátkou hospitalizací, během které nastavujeme nutriční režim a v případě zavedení NGS edukujeme pacienta i jeho rodinu v péči o sondu, nutriční pumpu a set. Po stabilizaci režimu výživy pacienta propouštíme a vybavíme jej odpovídajícím preparátem enterální výživy, příslušným materiálovým a technickým vybavením, návodem k použití a kontaktem pro případné řešení komplikací.
DÉLKA PODÁVÁNÍ A UKONČOVÁNÍ EEN
Délka podávání EEN je obvykle 6–8 týdnů [18]. Účinnost léčby je vhodné ověřit klinicky i laboratorně. Pokud nedojde ke zlepšení stavu během 2–3 týdnů od zahájení EEN, je třeba terapii změnit.
Zavádění bezezbytkové stravy po ukončování EEN provádíme postupně. Neexistuje žádný předepsaný protokol, který by upravoval přechod na běžnou stravu. Studie, porovnávající délku trvání remise při rychlém ukončování EEN během 3 dnů a pomalého převádění po dobu 5 týdnů, neprokázala signifikantní rozdíl mezi těmito dvěma skupinami [32]. K prvnímu relapsu po ukončení EEN dochází v průměru za 4–6 měsíců [40, 41]. Prodloužení efektu léčby je možné docílit PEN, kterou můžeme navázat na EEN [42–46].
STRAVA U PACIENTŮ S IBD
Složení následné výživy může významně ovlivnit další průběh onemocnění, neboť vyváženou a pestrou stravou lze snížit pravděpodobnosti dalšího relapsu. Západní styl stravování, bohatý na příjem kalorií a sladkých nápojů, vede k menší rozmanitosti střevního mikrobiomu. Naproti tomu středomořská dieta, bohatá na čerstvé ovoce, zeleninu, ryby a červené víno, vede k vyšší pestrosti střevního mikrobiomu a zvýšení počtu bakterií (Faecalibacterium prausnitzii), které mají protizánětlivé vlastnosti [47]. Vyšší riziko relapsu přináší strava se zvýšeným zastoupením tuků (hlavně omega-6), jednoduchých cukrů a zvýšeným množstvím červeného masa. Byla navržena celá řada diet: low FODMAP (dieta se sníženým množstvím fermentovatelných oligo-, di - a monosacharidů a polyolů), SCD (specifická karbohydrátová dieta), paleolitická dieta, IBD-AID (protizánětlivá dieta), CDED (Crohn’s disease exclusion diet), které vedou ke zlepšení stavu u pacientů s IBD. Jejich účinnost však nebyla dosud dostatečně prokázána, aby bylo možné jejich použití jednoznačně doporučit. Společným rysem těchto diet je nutnost připravit si jídlo z čerstvých ingrediencí a bez konzervantů či aditivních látek.
Eliminace potravin v dietě pacientů s IBD by měla být individuální. Racionální podklad má omezování potravin, které pacientům působí zhoršení příznaků (nadýmání, četnost stolic, bolesti břicha). Problematika imunomodulačního účinku potravin a diet je intenzivně zkoumána probíhajícími studiemi. Předpokládá se, že jejich výsledky budou mít dopad na nutriční doporučení nejen pro pacienty s IBD.
VLÁKNINA
Omezování vlákniny se u pacientů s IBD doporučuje jen v období relapsu nebo u pacientů se strikturující formou IBD. V období remise není třeba příjem vlákniny omezovat. Dostatečný příjem vlákniny (hlavně rozpustné) podporuje střevní mikrobiom, který vlákninu fermentuje a tvoří mastné kyseliny s krátkým řetězcem (SCFA), které jsou nejenom důležitým zdrojem živin pro kolonocyty, ale mají i protizánětlivý účinek (zprostředkovaný vazbou na GPR4 receptor). U některých pacientů však může zvýšený příjem vlákniny způsobovat vyšší počet stolic a tím subjektivní pocit zhoršení.
ENTERÁLNÍ VÝŽIVA U PACIENTŮ S UC
Úloha enterální výživy u pacientů s UC nebyla dostatečně studována, a to je pravděpodobně důvod, proč plní jen podpůrnou funkci. Podávání enterální výživy se doporučuje ke zlepšení celkového nutričního stavu např. před operačním výkonem.
ZÁVĚR
Složité patofyziologické mechanismy, které se podílejí na rozvoji IBD, zahrnují interakce mezi stravou, střevním mikrobiomem a slizniční imunitou. Rychlé zvyšování incidence IBD především v rozvinutých zemích svědčí pro významný vliv faktorů zevního prostředí. Řada klinických výzkumů prokázala vliv způsobu stravování na riziko rozvoje IBD u geneticky predisponovaných jedinců.
Úpravou stravovacích návyků můžeme nejenom změnit riziko rozvoje IBD, ale i vývoj již probíhajícího onemocnění. Účinnost EEN k navození remise CD je prokázána řadou studií. Doporučováno je použití polymerních preparátů podávaných po dobu 6–8 týdnů, během kterých pacient nepřijímá jiné potraviny či ochucené tekutiny. Po ukončení EEN je třeba pacienty motivovat ke změně způsobu stravování ve prospěch vyvážené stravy ve středomořském stylu. V přípravě pokrmů by měli omezit použití polotovarů a upřednostňovat čerstvé suroviny. Vyloučeny by měly být potraviny, které pacientům působí zhoršení příznaků. Domníváme se, že úloze stravy by mělo být věnováno více pozornosti jak ze strany lékařů a nutričních terapeutů, tak i pacientů samotných.
MUDr. Jan Schwarz
Univerzita Karlova, LF v Plzni
Dětská klinika FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: schwarzj@fnplzen.cz
Zdroje
1. Vavricka SR, Schoepfer A, Scharl M, et al. Extraintestinal manifestations of inflammatory bowel disease. Inflamm Bowel Dis 2015; 21 : 1982–1992.
2. Liu JZ, van Sommeren S, Huang H, et al. Association analyses identify 38 susceptibility loci for inflammatory bowel disease and highlight shared genetic risk across populations. Nat Genet 2015; 47 : 979–986.
3. Molodecky NA, Soon IS, Rabi DM, et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology 2012; 142 : 46–54.
4. Pozler O, Maly J, Bonova O, et al. Incidence of Crohn disease in the Czech Republic in the years 1990 to 2001 and assessment of pediatric population with inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2006; 42 : 186–189.
5. Schwarz J, Sýkora J. Incidence idiopatických střevních zánětů u dětí a dospívajících v Plzeňském kraji v letech 2001–2011 Prospektivní studie. Čes-slov Pediat 2013; 68 (3): 149–156.
6. Kaplan GG, Ng SC. Understanding and preventing the global increase of inflammatory bowel disease. Gastroenterology 2017; 152 : 313–321.
7. Ananthakrishnan AN. Environmental risk factors for inflammatory bowel diseases: A review. Dig Dis Sci 2015; 60 : 290–298.
8. Abegunde AT, Muhammad BH, Bhatti O, et al. Environmental risk factors for inflammatory bowel diseases: Evidence based literature review. World J Gastroenterol 2016; 22 : 6296.
9. Lee D, Albenberg L, Compher C, et al. Diet in the pathogenesis and treatment of inflammatory bowel diseases. Gastroenterology 2015; 148 : 1087–1106.
10. Chapman-Kiddell CA, Davies PSW, Gillen L, et al. Role of diet in the development of inflammatory bowel disease. Inflamm Bowel Dis 2010; 16 : 137–151.
11. Kostic AD, Xavier RJ, Gevers D. The microbiome in inflammatory bowel disease: current status and the future ahead. Gastroenterology 2014; 146 : 1489–1499.
12. Lewis JD, Chen EZ, Baldassano RN, et al. Inflammation, antibiotics, and diet as environmental stressors of the gut microbiome in pediatric Crohn’s disease. Cell Host Microbe 2015; 18 : 489–500.
13. Levine A, Wine E. Effects of enteral nutrition on Crohn’s disease. Inflamm Bowel Dis 2013; 19 : 1322–1329.
14. Burman S, Hoedt EC, Pottenger S, et al. An (anti)-inflammatory microbiota: Defining the role in inflammatory bowel disease? Dig Dis 2016; 34 : 64–71.
15. Miyoshi J, Chang EB. The gut microbiota and inflammatory bowel diseases. Transl Res 2017; 179 : 38–48.
16. Faith JJ, McNulty NP, Rey FE, et al. Predicting a human gut microbiota’s response to diet in gnotobiotic mice. Science 2011; 333 : 101–104.
17. Basson A, Trotter A, Rodriguez-Palacios A, et al. Mucosal interactions between genetics, diet, and microbiome in inflammatory bowel disease. Front Immunol 2016; 7 : 290.
18. Ruemmele FM, Veres G, Kolho KL, et al. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease. J Crohn Colitis 2014; 8 : 1179–1207.
19. Adamcová M, Bajer M, Bajerová K, et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu nespecifických střevních zánětů u dětí. Čes-slov Pediat 2012; 67 : 3–48.
20. Levine A, Sladek M, Shaoul R, et al. P255 Exclusive enteral nutrition is superior to corticosteroids and mesalamine for achieving remission with normalization of CRP in new onset pediatric Crohn’s disease. J Crohn Colitis 2012; 6: S111.
21. Grover Z, Lewindon P. Two-year outcomes after exclusive enteral nutrition induction are superior to corticosteroids in pediatric Crohn’s disease treated early with thiopurines. Dig Dis Sci 2015; 60 : 3069–3074.
22. Heuschkel RB, Menache CC, Megerian JT, et al. Enteral nutrition and corticosteroids in the treatment of acute Crohn’s disease in children. J Pediatr Gastroenterol Nutr 2000; 31 : 8–15.
23. Levine A, Turner D, Pfeffer Gik T, et al. Comparison of outcomes parameters for induction of remission in new onset pediatric Crohn’s disease. Inflamm Bowel Dis 2014; 20 : 278–285.
24. Day AS, Lopez RN. Exclusive enteral nutrition in children with Crohn’s disease. World J Gastroenterol 2015; 21 : 6809–6816.
25. Gerasimidis K, Talwar D, Duncan A, et al. Impact of exclusive enteral nutrition on body composition and circulating micronutrients in plasma and erythrocytes of children with active Crohn’s disease. Inflamm Bowel Dis 2012; 18 : 1672–1681.
26. Cameron FL, Gerasimidis K, Papangelou A, et al. Clinical progress in the two years following a course of exclusive enteral nutrition in 109 paediatric patients with Crohn’s disease. Aliment Pharmacol Ther 2013; 37 : 622–629.
27. Borrelli O, Cordischi L, Cirulli M, et al. Polymeric diet alone versus corticosteroids in the treatment of active pediatric Crohn’s disease: A randomized controlled open-label trial. Clin Gastroenterol Hepatol 2006; 4 : 744–753.
28. Grover Z, Burgess C, Muir R, et al. Early mucosal healing with exclusive enteral nutrition is associated with improved outcomes in newly diagnosed children with luminal Crohn’s disease. J Crohn Colitis 2016; 10 : 1159–1164.
29. Werkstetter KJ, Schatz SB, Alberer M, et al. Influence of exclusive enteral nutrition therapy on bone density and geometry in newly diagnosed pediatric Crohn’s disease patients. Ann Nutr Metab 2013; 63 : 10–16.
30. Whitten KE, Leach ST, Bohane TD, et al. Effect of exclusive enteral nutrition on bone turnover in children with Crohn’s disease. J Gastroenterol 2010; 45 : 399–405.
31. Heuschkel RB, Menache CC, Megerian JT, et al. Enteral nutrition and corticosteroids in the treatment of acute Crohn’s disease in children. J Pediatr Gastroenterol Nutr 2000; 31 : 8–15.
32. Lafferty L, Tuohy M, Carey A, et al. Outcomes of exclusive enteral nutrition in paediatric Crohn’s disease. Eur J Clin Nutr 2017; 71 : 185–191.
33. Zachos M, Tondeur M, Griffiths AM. Enteral nutritional therapy for induction of remission in Crohn’s disease. In: Zachos M (ed). Cochrane Database of Systematic Reviews. Chichester, UK: John Wiley & Sons, Ltd, 2007, CD000542.
34. Buchanan E, Gaunt WW, Cardigan T, et al. The use of exclusive enteral nutrition for induction of remission in children with Crohn’s disease demonstrates that disease phenotype does not influence clinical remission. Aliment Pharmacol Ther 2009; 30 : 501–507.
35. Afzal NA, Davies S, Paintin M, et al. Colonic Crohn’s disease in children does not respond well to treatment with enteral nutrition if the ileum is not involved. Dig Dis Sci 2005; 50 : 1471–1475.
36. Johnson T, Macdonald S, Hill SM, et al. Treatment of active Crohn’s disease in children using partial enteral nutrition with liquid formula: a randomised controlled trial. Gut 2006; 55 : 356–361.
37. Kaakoush NO, Day AS, Leach ST, et al. Effect of exclusive enteral nutrition on the microbiota of children with newly diagnosed Crohn’s disease. Clin Transl Gastroenterol 2015; 6: e71.
38. Grogan JL, Casson DH, Terry A, et al. Enteral feeding therapy for newly diagnosed pediatric Crohn’s disease: a double-blind randomized controlled trial with two years follow-up. Inflamm Bowel Dis 2012; 18 : 246–253.
39. Rubio A, Pigneur B, Garnier-Lengliné H, et al. The efficacy of exclusive nutritional therapy in paediatric Crohn’s disease, comparing fractionated oral vs. continuous enteral feeding. Aliment Pharmacol Ther 2011; 33 : 1332–1339.
40. Faiman A, Mutalib M, Moylan A, et al. Standard versus rapid food reintroduction after exclusive enteral nutritional therapy in paediatric Crohn’s disease. Eur J Gastroenterol Hepatol 2014; 26 : 276–281.
41. Grogan JL, Casson DH, Terry A, et al. Enteral feeding therapy for newly diagnosed pediatric Crohn’s disease: a double-blind randomized controlled trial with two years follow-up. Inflamm Bowel Dis 2012; 18 : 246–253.
42. Kim HJ, Kim Y, Cho JM, et al. Therapeutic efficacy of oral enteral nutrition in pediatric Crohn’s disease: A single center non-comparative retrospective study. Yonsei Med J 2016; 57 : 1185.
43. Yamamoto T, Nakahigashi M, Saniabadi AR, et al. Impacts of long-term enteral nutrition on clinical and endoscopic disease activities and mucosal cytokines during remission in patients with Crohn’s disease: a prospective study. Inflamm Bowel Dis 2007; 13 : 1493–1501.
44. Yamamoto T, Nakahigashi M, Umegae S, et al. Impact of long-term enteral nutrition on clinical and endoscopic recurrence after resection for Crohn’s disease: A prospective, non-randomized, parallel, controlled study. Aliment Pharmacol Ther 2007; 25 : 67–72.
45. Duncan H, Buchanan E, Cardigan T, et al. A retrospective study showing maintenance treatment options for paediatric CD in the first year following diagnosis after induction of remission with EEN: supplemental enteral nutrition is better than nothing! BMC Gastroenterol 2014; 14 : 50.
46. Takagi S, Utsunomiya K, Kuriyama S, et al. Effectiveness of an “half elemental diet” as maintenance therapy for Crohn’s disease: a randomized-controlled trial. Aliment Pharmacol Ther 2006; 24 : 1333–1340.
47. Lewis JD, Abreu MT. Diet as a trigger or therapy for inflammatory bowel diseases. Gastroenterology 2017; 152 : 398–414
Štítky
Chirurgie všeobecná Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Seriál o EET
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2017 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Editorial: Idiopatické střevní záněty v dětském věku
- Enterální výživa v léčbě idiopatických střevních zánětů
- Seriál o EET
- Identifikace prediktivních faktorů časného relapsu onemocnění u dětských pacientů s Crohnovou chorobou léčených thiopuriny
- Perianálne lézie – kondylómy alebo prejav Crohnovej choroby?
- Monogénová obezita u detí na Slovensku
- Uzlinový syndrom u nemoci z kočičího škrábnutí u dětí ošetřených na Klinice infekčního lékařství v Ostravě
- Zemřel prof. MUDr. László Kovács, DrSc., MPH
- Korekce vrozených vývojových vad prsu a hrudníku technikou lipomodelace
- Histamínová intolerancia v detskom veku – kazuistiky z praxe
- Fatální meningokoková sepse způsobená Neisseria meningitidis séroskupiny W
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Histamínová intolerancia v detskom veku – kazuistiky z praxe
- Enterální výživa v léčbě idiopatických střevních zánětů
- Korekce vrozených vývojových vad prsu a hrudníku technikou lipomodelace
- Perianálne lézie – kondylómy alebo prejav Crohnovej choroby?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



