-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Historie glukokortikoidní terapie v léčbě akutních leukemií u dětí
History of glucocorticoid therapy in the treatment of children acute leukemia
Glucocorticoids (GCc) play an important role in the treatment of various diseases and their implication in clinical oncology is valuable for decades. For the ability to induce apoptosis, GCs are predominantly used in the treatment of the acute lymphoblastic leukemia (ALL) the most common malignancy in childhood. GCs were the subject of many research projects designed to characterise the chemical properties, synthesis of new analogues, to clarify the mechanisms of action on the cellular and molecular level and to analyse the mechanism of resistance to glucocorticoid therapy.
Their importance in the treatment of childhood leukemia has increased during this period, so they become integral part of all treatments protocols for childhood ALL. Initially used cortisone and adrenocorticotropin hormone (corticotropin, ACTH) were replaced by other synthetic´s analogues, particularly prednisone (PRED) and dexamethasone (DEXA). Properties of individual GCs determine their use in different phases of the therapy. In addition, the response to corticosteroids became an independent prognostic factor in childhood ALL. Due to the variability of the in vivo response to GC´s therapy, there is a significant intention to adapt GC´s therapy for individual patients to achieve the maximum beneficial effect while minimizing the side.Key words:
acute leukemia, glucocorticoids, prednisone, dexamethasone
Autoři: M. Špenerová 1; J. Srovnal 1,2; J. Potešil 1; M. Hajdúch 2
; V. Mihál 1; P. Džubák 1,2
Působiště autorů: Dětská klinika LF UP a FN, Olomoucpřednosta prof. MUDr. V. Mihál, CSc. 1; Laboratoř experimentální medicíny, Ústav molekulární a translační medicíny, LF UP, Olomoucředitel doc. MUDr. M. Hajdúch, Ph. D. 2
Vyšlo v časopise: Čes-slov Pediat 2014; 69 (6): 350-362.
Kategorie: Přehledový článek
Souhrn
Glukokortikoidy (GK) jsou posledních šest dekád významnou součástí terapie široké škály nemocí. V pediatrické onkologii nalezly uplatnění především v léčbě nejčastější malignity dětského věku, akutní lymfoblastické leukemie (ALL). Pro svou schopnost indukovat apoptózu v lymfatických buňkách sehrávají v chemoterapeutické léčbě dětské ALL klíčovou roli. Během posledních desetiletí se GK staly předmětem studií vedoucích k definování jejich chemických vlastností, syntéze nových glukokortikoidních analogů, objasnění mechanismu účinků a rezistence GK na buněčné a molekulární úrovni.
Význam kortikoterapie v léčbě dětských leukemií vzrostl za toto období natolik, že se stala nedílnou součástí léčebných protokolů všech mezinárodních pracovních skupin pro dětskou ALL. Historicky používaný kortizon a adrenokortikotropní hormon (kortikotropin, ACTH) postupně nahradila syntetická glukokortikoidní analoga, především prednison (PRED) a dexamethason (DEXA). Vlastnosti jednotlivých GK determinovaly jejich uplatnění v jednotlivých fázích léčby ALL. Odpověď na glukokortikoidní léčbu se stala nezávislým prognostickým faktorem dětské ALL. Vzhledem k individuální variabilitě in vivo odpovědi na kortikoterapii je v současnosti jedním z důležitých cílů individualizovat glukokortikoidní léčbu tak, aby byl dosažený maximální příznivý účinek se současnou minimalizací těch nežádoucích.Klíčová slova:
akutní leukemie, glukokortikoidy, prednison, dexamethasonÚvod
Cesta vedoucí k prvním úspěchům v léčbě hematologických malignit byla zdlouhavá a vyvíjela se ruku v ruce s postupným objasňováním podstaty nemoci, ale také s objevy nových skupin protinádorových léčiv. Mezi tato léčiva patřily také glukokortikoidy (GK). Historie kortikoidní léčby sahá do první poloviny 20. století, kdy se v roce 1929 dvěma nezávislým skupinám amerických vědců pod vedením Franka A. Hartmanna a Wilbura W. Swingleho podařilo získat extrakt ze zvířecí kůry nadledvin. Tento extrakt získaný z adrenální kůry koček, psů a potkanů úspěšně kompenzoval funkci nadledvin u adrenalektomovaných zvířat a umožnil jejich přežívání [1, 2]. Tímto extraktem připraveným vědci z Princetonské univerzity (Swingle a Pfiffner) léčil o rok později Leonard G. Rowntree několik pacientů s Addisonovou nemocí, přičemž pozoroval nápadně příznivé ovlivnění průběhu nemoci u většiny pacientů se současným zlepšením celkového stavu a ústupem subjektivních obtíží [3]. Předpokládalo se, že v nadledvinách nevzniká pouze jedna substance. V následujících letech byl tento předpoklad potvrzen a z extraktů kůry nadledvin se podařilo izolovat téměř tři desítky různých složek [4, 5]. Přestože se svou strukturou odlišovaly, tak všechny tyto látky byly steroidní povahy. Zjistilo se, že tyto extrakty mají biologickou aktivitu ovlivňující metabolické děje, především metabolismus sacharidů a proteinů.
Dalším cílem byla izolace chemicky čistých látek, které by si zachovávaly biologickou aktivitu původního extraktu, s již přesně popsanou chemickou strukturou, která by byla výchozí pro syntézu v laboratorních podmínkách. Na izolaci a identifikaci těchto sloučenin se během roku 1935 podílelo souběžně a nezávisle několik vědeckých týmů. Tyto skupiny byly vedeny Edwardem C. Kendallem, Josephem J. Pfiffnerem a Tadeuschem Reichsteinem [6, 7]. Za účelem jednoduchého rozlišení byly chemické struktury (compounds) abecedně označeny. Potenciální využití v humánní medicíně vycházelo ze slibně se vyvíjejících experimentů na adrenalektomovaných zvířatech, kde především sloučeniny A, B, E a F zvyšovaly odolnost těchto zvířat vůči toxickým vlivům (tyfová vakcinace) [4]. Věřilo se, že by tyto účinky mohly pomoci pacientům s různým typem traumat (včetně popálenin) nebo infekcí. Bohužel, po dalších nepřesvědčivých výsledcích (rezistence k hypoxickým a traumatickým vlivům) nebyl ze strany velkých farmaceutických společností zájem o zahájení syntézy těchto sloučenin a tak se během dalších let jejich příprava omezila na experimentální syntézu v laboratoři, přičemž se zkoumání zaměřilo pouze na některé z nich. Jako nejslibnější se jevila „compound E”, která byla po jednom ze svých objevitelů označena jako Kendallova sloučenina [7], později známá pod názvem kortizon (17-hydroxy-11-dehydrokortikosteron) [8].
Za první syntézou malého, pouze několikamiligramového množství kortizonu v laboratorních podmínkách stál Lewis H. Sarett (Merck and Company) [7, 8]. Zdálo se, že Kendallova sloučenina nalezne své uplatnění v humánní medicíně pouze jako substituent adrenální funkce při jejím selhávání. Když však revmatolog Philip S. Hench podal v roce 1948 syntetický kortizon mladé pa-cientce s revmatoidní artritidou a pozoroval jeho výrazný protizánětlivý účinek [9], zřejmě netušil, že tím zahajuje éru nové skupiny léčiv, která nalezne uplatnění v téměř všech medicínských oblastech. Samotný Kendall později o potenciálu kortizonu řekl: „I shall venture a word about the future place of cortisone in clinical medicine. There is no doubt that the use of this hormone of the adrenal cortex will continue to increase“ [4].
Aplikace kortizonu se tak postupně rozšířila do dalších rozvíjejících se medicínských oborů, především oftalmologie, dermatologie, alergologie, endokrinologie a onkologie, kde nalezla své uplatnění v léčbě solidních nádorů a především hematologických malignit [10, 11, 12, 13]. Přibližně ve stejném období, ve kterém probíhala izolace extraktů ze zvířecí nadledvinové kůry, se Jamesovi B. Collipovi a jeho kolegům podařilo poprvé získat adrenokortikotropní substanci z hypofýzy [14]. O několik let později, v roce 1943, publikovala skupina vědců z University of California, (Choh H. Li, Herbert M. Evans a Miriam E. Simpson) metodiku izolace ACTH z ovčích hypofyzárních žláz [15]. Tyto extrakty byly později dodávány pro výzkumné účely prostřednictvím farmaceutických společností (Armour and Company).
Zavedení glukokortikoidů do hematoonkologické léčby
Vztah mezi lymfatickou tkání (thymem) a hormonální funkcí nadledvin popsal jako první Hans Selye. Na zvířecím modelu pozoroval změny velikosti thymu u potkanů se zachovanou adrenální funkcí ve srovnání se zvířaty po adrenalektomii. Zjistil, že u potkanů po odstranění nadledvin nedochází k involuci thymu ve srovnání se zdravými zvířaty [16]. Otázkou zůstávalo, které hormony nadledvin jsou odpovědné za tento účinek, kterým nadledvina ovlivňuje lymfatickou tkáň thymu. Vliv hormonu stimulujícího nadledviny – kortikotropinu (adrenokortikotropního hormonu; ACTH) – na lymfatickou tkáň pozorovali také Thomas F. Dougherty a Abraham White. V roce 1943 publikovali práci zaměřenou na sledování účinku ACTH na lymfatickou tkáň. U testovaných myší došlo po aplikaci ACTH ke zmenšení velikosti lymfatických uzlin a thymu a současně bylo pozorováno snížení počtu cirkulujících lymfocytů v periferní krvi (PK) [17]. Vztah mezi kůrou nadledvin a lymfatickou tkání ve vztahu k nádorovým onemocněním pozorovali také John B. Murphy a Ernest Sturm. Po intraperitoneální aplikaci leukemických buněk potkanům prodloužila aplikace ACTH jejich přežívání [18]. Tyto závěry podporovaly tvrzení, že hormony kůry nadledvin mohou inhibovat rozvoj nádorového onemocnění. Fordyce R. Heilmann a Edward C. Kendall potvrdili o rok později příznivé výsledky kortikoidního účinku u myší s transplantovanými lymfatickými nádory, kdy po aplikaci kortikosteronu pozorovali regresi nádorové hmoty [19].
Nebylo to však pouze zmenšení nádorů, které bylo pozorováno v souvislosti s podáváním hormonů kůry nadledvin, ale také změny v periferním krevním obrazu, především leukogramu. Podobné změny, jaké pozorovali Dougherty a White u zvířat, popsal A. Gorman Hill u pacientů s širokým spektrem nemaligních onemocnění, avšak při zachované funkci nadledvin. U těchto pacientů pozoroval pokles lymfocytů a eozinofilů v periferní krvi po podání ACTH [20]. Shrneme-li tyto výsledky, aplikace ACTH a kortizonu způsobovaly významnou depleci cirkulujících lymfocytů a také regresi lymfatických tkání a orgánů při jejich nádorovém postižení. Tyto výsledky se staly základem pro možné využití kortikoidní terapie při léčbě lymfoidních nádorů.
Koncem 40. let 20. století se podařilo americkým vědcům pod vedením Sidneyho Farbera (The Children´s Medical Center, Boston) dosáhnout převratných výsledků v léčbě dětských leukemií, nikoliv však zásluhou kortikoidů. Ve své práci z roku 1948 popsali Farber a kolegové příznivé ovlivnění průběhu akutních leukemií u dětí podáním antagonistů kyseliny listové. Prvním pacien-tem, který spustil zájem o tuto skupinu léčiv, byla 4letá dívenka s akutní myeloidní leukemií (AML). Přesto, že po aplikaci diopterinu (kyselina pteroyldiglutamová) nebyl pozorován příznivý klinický ani hematologický efekt, hledala se další účinnější analoga těchto léčiv. V září 1947 byl na popud biochemika Yellapragady SubbaRowa, Seegerem v Calco laboratořích nasyntetizován aminopterin (4-aminopteroyl-glutamová kyselina), který byl následně použitý v léčbě 16 dětí s akutní leukemií [21]. Přesto, že aminopterin příznivě ovlivnil průběh nemoci u 10 nemocných dětí, a to především zmenšením lymfatických orgánů (lymfatických uzlin, jater a sleziny) a úpravou hematologických parametrů (snížení počtu nezralých leukocytů, vymizení blastů, úprava anemie a trombocytopenie), účinek byl pouze přechodný [22]. Přes Farberovy převratné výsledky a neuvěřitelné odhodlání zvrátit průběh dosud nevyléčitelného onemocnění zůstala jeho zásluha nedoceněna. Odbornou veřejností byly jeho výsledky přijaty s nedůvěrou až pobouřením a přes prokazatelný efekt se nevěřilo, že by léčba aminopterinem mohla mít kurabilní charakter. Pro pacienty a jejich rodiče však znamenala naději v boji s nevyléčitelnou nemocí [23].
Paralelně se zahájením léčby leukemií antifoláty se Howard A. Pearson se svými spolupracovníky zaměřil na účinek steroidní hormonální léčby (kortizon a ACTH). Zjistil, že kortikoidy mají u lidí příznivý účinek především na lymfoidní nádory. Soubor testovaných pacientů nebyl velký, zahrnoval skupinu celkem 6 pacientů s různým typem lymfatických nádorů. Kortikotropním hormonem byli léčeni 3 pacienti s chronickou lymfatickou leukemií (CLL), po jednom pa-cientovi s Hodgkinovým lymfomem a lymfosarkomem, další 1 pacient s CLL byl léčen kortizonem. U všech 6 pacientů došlo k významné regresi velikosti lymfatických uzlin a sleziny, tento stav popsal jako částečnou (parciální) remisi. K obnovení nádorového růstu došlo nejpozději do 10 týdnů od ukončení hormonální terapie. U jednoho CLL pacienta bylo po opětovném se objevení nemoci (relapsu) pozorováno 2. úspěšné potlačení nádorového růstu poté, co byl po iniciální léčbě ACTH do dosažení druhé klinické remise léčen kortizonem. Pearson již v této době popsal vedlejší účinky léčby kortikoidy důležité z pohledu udržení homeostázy organismu, jako jsou iontová dysbalance, zejména deplece kalia, chloridů a kalcia a zvýšení hladin natria a vody s odpovídajícími klinickými změnami [24]. Nutno říci, že u žádného z pacientů nebylo dosaženo kompletní remise, která by zahrnovala současné zlepšení klinického stavu a příznivou laboratorní odezvu v PK a kostní dřeni (KD) s úpravou hematologických parametrů. O rok později Pearson a kolegové na tyto výsledky navázali dalším pozorováním 5 pacientů s akutní leukemií (2 dospělí a 3 dě-ti) léčených ACTH. U všech nemocných bylo pozorováno klinické zlepšení a tentokrát i hematologická odpověď. Kromě zmenšení lymfatických orgánů došlo ke zvýšení počtu zralých cirkulujících leukocytů, retikulocytů a trombocytů. KD vykazovala známky zlepšení erytropoézy a dozrávání myeloidní řady. U žádného z pacientů však nedošlo k úplnému vymizení blastických elementů z PK a KD [25].
Začátkem 50. let 20. století se glukokortikoidy společně s antifoláty staly centrem zájmu při optimalizaci hematoonkologické terapie. Na rozdíly mezi účinností kortikoidní léčby u dětských a dospělých pacientů poukázal v roce 1951 Martin C. Rosenthal. Z 15 případů dospělých a dětských nemocných s akutními a subakutními leukemiemi 3 pa-cienti zemřeli v průběhu léčby a ze zbývajících 12 nemocných jich 9 dosáhlo remise (69 %). Počet dětí a dospělých ve své práci přesně nespecifikoval, ale uvádí, že dětští leukemičtí pacienti dosáhli lepších výsledků ve srovnání s dospělými [26]. Použití kortikoidní léčby u hematoonkologických nemocných s sebou také přinášelo nezodpovězené otázky týkající se mechanismu vlastního působení léčiv. Rosenthal předpokládal, že kortikoidy přímo ovlivňují enzymatické děje v proliferujících a dozrávajících buňkách, v případě leukemií lymfoblastů a myeloblastů, v KD stimulují produkci všech krvetvorných buněk a v lymfatických tkáních a orgánech naopak indukují jejich involuci. Přes tyto příznivé výsledky byla problémem krátká délka trvání remise jako rozhodujícího faktoru pro vyhodnocení efektivnosti léčby.
Howard R. Bierman pozoroval u dětí s akutní leukemií po léčbě kortikoidy zlepšení celkového stavu projevující se zvýšenou chutí k jídlu, poklesem teplot a zlepšením psychické kondice pacientů. Objektivně došlo ke zmenšení lymfatických orgánů, poklesu počtu leukemických buněk v PK a KD a normalizaci hematopoézy ve všech krevních řadách. Medián přežití u těchto dětí byl 6,8 měsíce od zahájení kortikoterapie, tudíž byla remise pouze krátkodobá a léčba významně neprodloužila přežívání těchto pacientů [27]. Přesto se díky novým léčebným přístupům založených na léčbě glukokortikoidy a antifoláty podařilo dosáhnout zlepšení léčebných výsledků u pacientů s lymfoidními nádory.
Tyto úspěchy shrnul ve své práci Joseph H. Burchenal. Porovnal výsledky léčby maligních lymfoproliferativních onemocnění před érou antagonistů kyseliny listové a kortikoidů s novými terapeutickými přístupy kombinujícími aminopterin a kortizon. Lymfatické nádory představovaly v tomto období skupinu nemocí se 100% mortalitou. Zásluhou nových léčebných přístupů se prodloužilo přežívání nemocných až o 30 % [28]. V souladu se světovými standardy byli pacienti s leukemií léčeni také na našem území. Vladimír Jedlička publikoval v roce 1955 léčebné výsledky 4 pacientů s CLL, které léčil v období 1950–1954. Své výsledky hodnotil i přes malý soubor pacientů a s ohledem na dosud omezené terapeutické možnosti. U všech 4 pacientů pozoroval bezprostřední, ale pouze krátkodobou klinickou remisi, bez pozitivního ovlivnění PK obrazu. Popsal také insuficienci kůry nadledvin po náhlém vysazení GK léčby a přínosným bylo také zjištění, že pacienti s relapsem příznivě zareagovali na opětovné nasazení terapie [29]. Podobně publikoval své zkušenosti s využitím kortizonu u akutních dětských leukemií profesor Hrodek v roce 1954, a to u 4 pacientů, kdy pozoroval ve třech případech dosažení téměř úplné klinické i hematologické remise trvající 5 týdnů, a to jak v monoterapii, tak i v kombinaci s léčbou aminopterinem [30].
Účinky kortikoidní léčby nebyly spolehlivě hodnotitelné především pro výraznou heterogenitu pacientů, s rozdílnými typy leukemií, a to přesto, že u většiny nemocných bylo pozorováno zlepšení klinického stavu společně s dobrou hematologickou odezvou. Problémem zůstávalo, že zlepšení bylo krátkodobé a pouze přechodné. Proto se hledala účinnější kortikoidní analoga s dlouhodobějším účinkem. K významnému pokroku v syntéze kortikoidních léčiv došlo začátkem 50. let 20. století. Jak bylo uvedeno, mezi první dostupná syntetická glukokortikoidní analoga patřil kortizon poprvé připravený v roce 1944 zásluhou Lewise H. Sarreta [31]. V hematoonkologické léčbě nalezla postupně uplatnění především dvě nová syntetická glukokortikoidní analoga – prednison (PRED) a dexamethason (DEXA). Syntézu PRED uskutečnil v roce 1950 Arthur Nobile. PRED vyrobil z hydrokortizonu (kortizolu) pomocí bakteriální metabolické transformace a pod názvem Medicorten se dostal v roce 1955 do komerční výroby (Schering Corporation, USA) [32]. Další syntetický analog DEXA se stal komerčně dostupným od roku 1958 pod označením Decadron (Merck Company, USA) [33]. Mezi první publikované výsledky o léčebném efektu PRED u dětí s ALL patřila studie kalifornského pracoviště z roku 1956 pod vedením Hymena a Sturgeona. Byl pozorován léčebný efekt PRED monoterapie u 21 dětí ve věku 5 měsíců až 10 let s diagnózou ALL. Hodnocení léčby bylo posuzováno podle subjektivního zlepšení celkového stavu, klinického nálezu s posouzením velikosti lymfatických orgánů, změn v PK a redukce blastů v KD. Tři pacienti dosáhli kompletní remise (absence, resp. redukce blastů v KD pod 10 %, normalizace hodnot krevního obrazu s redukcí počtu blastů v PK, asymptomatický status, normální fyzikální nález). Dvanáct dětí dosáhlo částečné remise, kdy blasty v KD byly nad 10 % [34].
Glukokortikoidy jako součást kombinované chemoterapie ALL
Od 50. let 20. století prakticky dodnes jsou PRED a DEXA součástí léčby hematologických malignit. Protinádorová léčiva byla ve svých počátcích podávána pacientům téměř výhradně v monoterapii. Až ve druhé polovině 50. let byly iniciovány první studie zaměřené na kombinaci léčiv s protinádorovým účinkem, s cílem prodloužit přežívání pacientů [35]. GK sehrály klíčovou roli již v počátcích zahájení kombinované léčby, a to i přesto, že mechanismus jejich účinků nebyl v této době dostatečně objasněn. Významný klinický dopad zaznamenaly experimenty na myších leukemiích pod vedením Howarda Skippera, který v roce 1964 pozoroval příznivý účinek protinádorové léčby kombinací různých léčiv a formuloval principy kombinované chemoterapie na zvířecím modelu. Pozoroval, že léčiva mohou být kombinována paralelně, aniž by se tím snižovala jejich individuální aktivita, přičemž procento usmrcených buněk záviselo na dávce protinádorových léčiv. frakce nádorových buněk přežívajících chemoterapii byla nezávislá na primární velikosti nádorové populace, přitom léčba musí být zahájena v co nejkratší době od diagnózy [36]. Na základě těchto výsledků postavil ve stejném roce Emil J. Freireich a kolegové z NIH (National Institute of Health) koncept prvního kombinovaného protokolu použitého v léčbě akutní lymfoblastické leukemie. Souběžnou kombinaci čtyř cytostatik nazvali „VAMP“ protokol, kde jde o kombinací vinkristinu, amethopterinu (metotrexátu; MTX), 6-merkaptopurinu (6-MP) a prednisonu. Tímto protokolem dosáhli kompletní remise u 14 z 16 dětí s ALL [37]. O rok později, v roce 1965, Emil Frei III a kolegové publikovali výsledky studie, které se účastnilo 10 léčebných center z USA. Do studie bylo zařazeno 166 pacientů s ALL do 20 let, z toho nejvíce byly zastoupeny děti do 4 let. V indukci remise byl pacientům podán PRED společně s 6-merkaptopurinem v terapeutických dávkách (obr. 1). Významné redukce lymfoblastů v KD dosáhlo 82 % pa-cientů, kteří zahájili indukci remise kombinací PRED a 6-merkaptopurinu [38].
Obr. 1. Prednison a 6-merkaptopurin v kombinaci v rámci indukční fáze léčby, 82 % pacientů dosáhlo kompletní remise (upraveno podle Rosenthal et al, 1965). 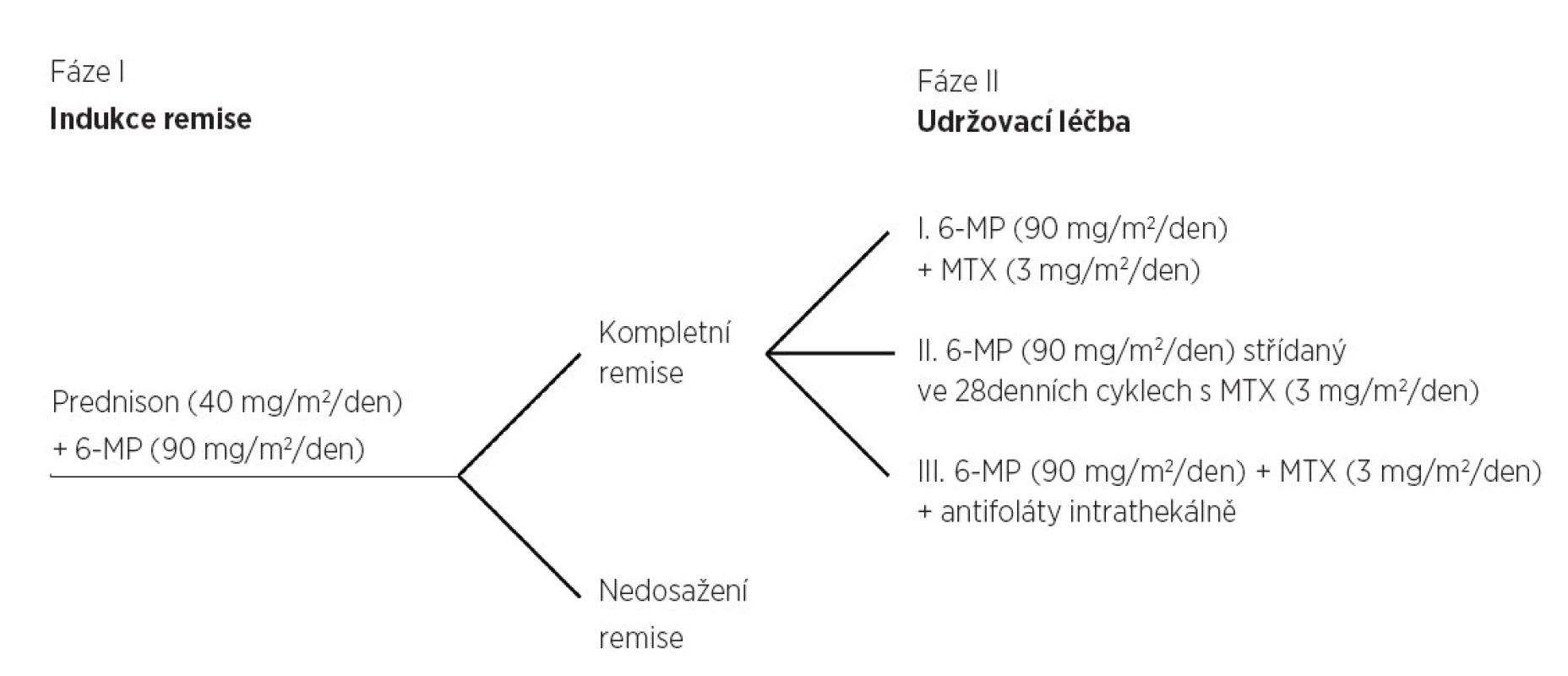
Joseph H. Burchenal a M. Lois Murphy potvrdili tyto výsledky ve stejném roce u 71 pacientů (53 dětí a 18 dospělých) s akutní leukemií. Více než 5 let od stanovení diagnózy přežilo 36 dětí (67,9 %) a 6 dospělých (33,3 %). Jeden dětský pacient přežil dokonce 12 let [39]. V roce 1968 publikovala americká pracovní skupina pod vedením Donalda Pinkela z univerzity v Memphisu první ucelený pohled z hlediska komplexního přístupu v léčbě dětských AL, tzv. „totální léčbu“. Cílem studie nebylo jen prodloužení přežití nemocných dětí, ale především pokus o jejich úplné vyléčení. Základním konceptem totální terapie byl třífázový přístup a v rámci indukční fáze snaha o úplnou eliminaci nádorových buněk, přičemž PRED byl součástí indukce remise (tab. 1). Pacienti, kteří v indukci dosáhli kompletní remise (fáze I), pokračovali v léčbě krátkým intenzivním blokem vysoce dávkované kombinované chemoterapie (fáze II) a následně udržovací léčbou (fáze III) zahrnující také iradiaci centrálního nervového systému (CNS) jako profylaxi leukemického postižení.
Tab. 1. Léčba dětí s ALL podle léčebného protokolu St. Jude Children´s Research Hospital and the Department of Pediatrics, University of Tenesse College of Medicine (upraveno podle George et al., 1968). 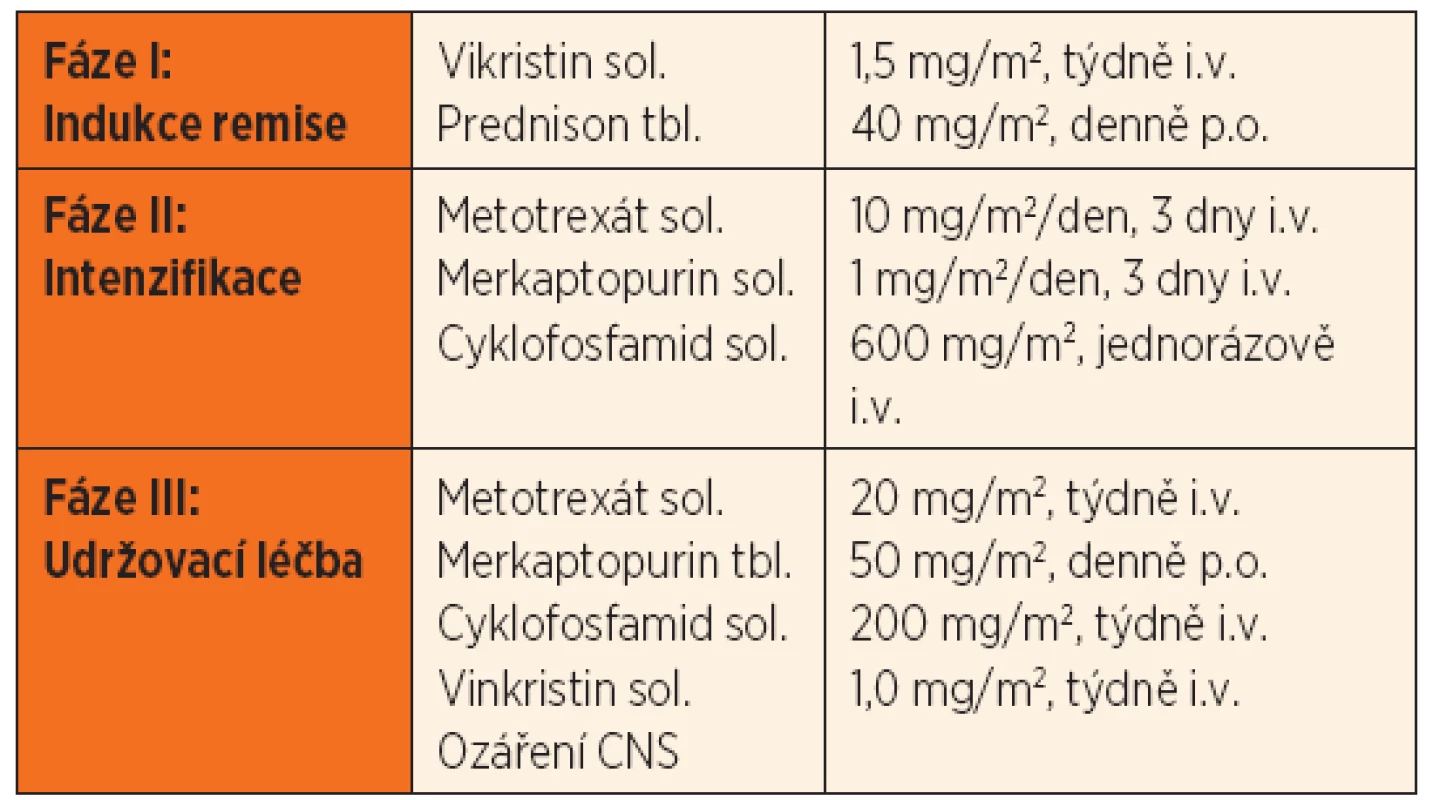
Studie na souboru 31 pacientů s ALL navrženým způsobem navodila remisi u 87 % dětí. Délka trvání remise od vstupu do udržovací fáze terapie byla v trvání od 11 do 177 týdnů, s mediánem 78 týdnů [40]. Autoři významným prodloužením trvání remise prokázali účinnost kombinované léčby s budoucím potenciálem úplného vyléčení nemoci. Paralelně s Pinkelovou pracovní skupinou rozvíjela kombinovanou chemoterapeutickou léčbu skupina Berlin – Frankfurt – Münster (BFM) pod vedením Hansjörga Riehma. PRED se stal v roce 1970 v kombinaci s dalšími protinádorovými léčivy (vinkristin, daunorubicin, 6-merkaptopurin, asparagináza, cytosin arabinozid, cyklofosfamid, metotrexát) součástí čtyřtýdenní indukční fáze v dávce 60 mg/m2. Také DEXA byl již součástí protokolární BFM léčby. Koncept protokolu ALL-BFM 76 s DEXA v postindukční fázi výrazně zlepšil přežívání dětí s ALL [41]. Také v tehdejší ČSSR se převzetím léčebných schémat ze zahraničních center (USA, NDR) postupně začaly zlepšovat léčebné výsledky ALL dětí. Protokolární léčba byla u nás zahájena v roce 1985 na Dětské klinice FN v Praze-Motole protokolem ALL-BFM 83. V průběhu roku 1986 byla protokolární léčba převzata všemi centry, čímž se sjednotil terapeutický přístup ke všem nově diagnostikovaným pacientům na našem území [42].
Prednison response, prognostický faktor dětské ALL
GK tedy měly nejen terapeutický přínos, ale také se staly významným prediktorem odpovědi na léčbu. Od roku 1983 je dětským ALL pacientům v tzv. prednisonové předfázi léčby, před zahájením indukční fáze terapie, podáván PRED po dobu 7 dnů společně s jednou intrathekální dávkou MTX (obr. 2). Riehm a kolegové zjistili, že vymizení/přetrvávání blastů v PK (resp. KD), tzv. in vivo odpověď na prednisonovou předfázi léčby, je nezávislým prognostickým znakem úspěšnosti léčby ALL. Pacienti byli podle iniciální odpovědi na PRED terapii rozděleni na dobré a špatné respondéry a i na základě PRED response stratifikováni do léčebných schémat. Redukce blastů v PK <1000 na µl byla definována jako dobrá odpověď na prednisonovou předfázi (prednison good response – PGR), resp. špatná odpověď (prednisone poor response – PPR >1000 na µl). PRED response jako nezávislý prediktivní faktor odpovědi na léčbu se stal součástí protokolu ALL/NHL-BFM 86 a definoval pacienty s vysokým rizikem relapsu [43]. PRED response byla definována jako nejsilnější prediktor odpovědi na terapii také u kojeneckých ALL [44].
Obr. 2. Zařazení PRED-předfáze do protokolární léčby ALL, upraveno podle protokolu ALL-BFM 86, Rhiem et al., 1987; MR: medium risk, HR: high risk). 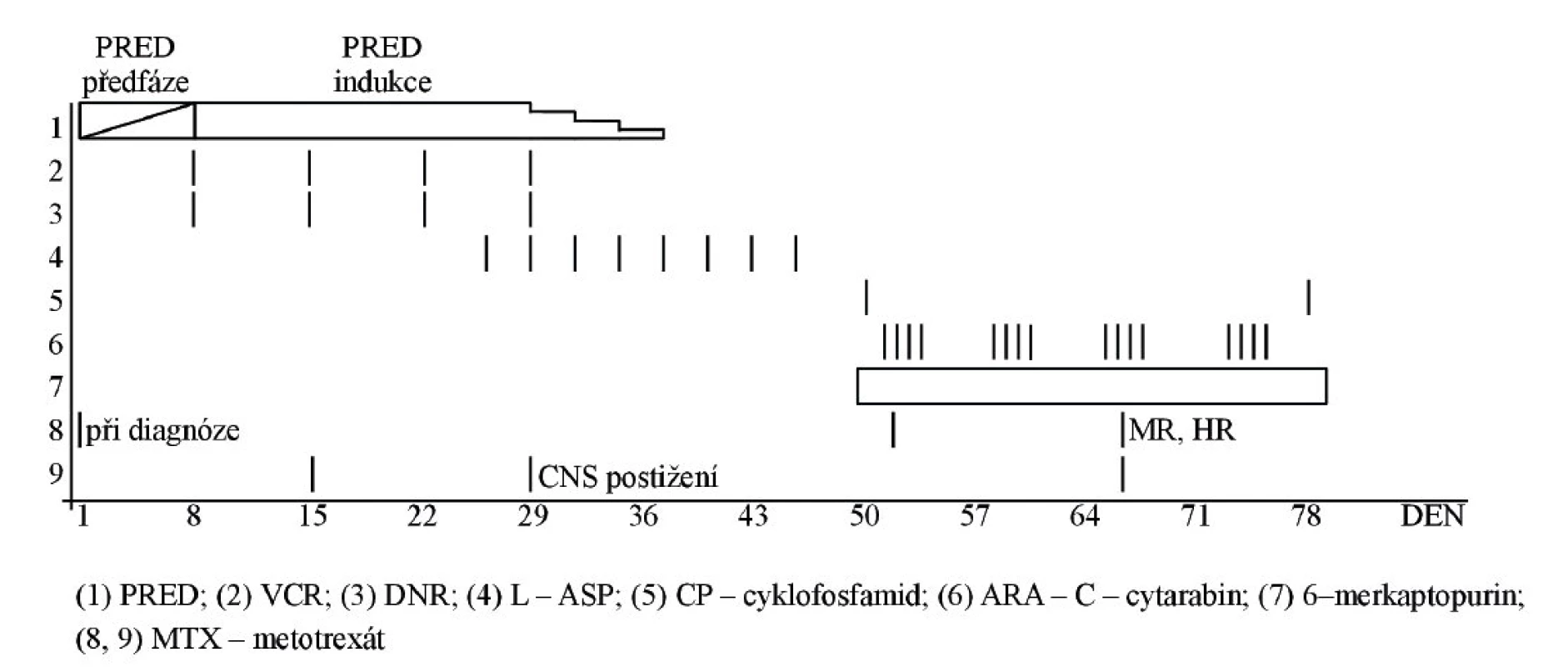
Testování glukokortikoidní senzitivity a rezistence in vitro
Účinnost jednotlivých protinádorových léčiv, včetně GK, lze posuzovat v laboratorních podmínkách pomocí cytotoxického, tzv. MTT (3-[4,5-dimethyltiazol-2-yl]-2,5-difenyltetrazolium bromide) testu. Metodu měření cytotoxicity léčiv in vitro dobře srovnatelnou s odpovědí na léčbu in vivo popsal v roce 1983 Timothy R. Mossman [45]. Metoda byla několik let optimalizována na buněčných nádorových liniích a za účelem potenciálního využití v klinické praxi i na pacientských nádorových buňkách. Tento jednoduchý kolorimetrický test umožňuje stanovit senzitivitu nebo rezistenci lymfoblastů k jednotlivým GK [46]. Gertjan J. L. Kaspers a kolegové v roce 1996 publikovali studii o rozdílné antileukemické aktivitě PRED a DEXA in vitro na souboru 133 ALL dětí. Zjistili až 16,2násobně vyšší antileukemickou aktivitu DEXA ve srovnání s PRED [47]. Rozdílnou antileukemickou odpověď prokázali také Mihál a kolektiv v roce 1999 srovnáváním antileukemické aktivity PRED a DEXA u 69 dětí s ALL. Pomocí cytotoxického MTT testu zjistili rozdílnou in vitro odpověď u 30 % dětí. Citlivost k DEXA a rezistenci k PRED vykazovalo 16 % dětí (11/69), PRED-senzitivních a DEXA-rezistentních bylo 14 % pacientů [48]. Tyto výsledky byly zajímavé především proto, že při spolehlivé predikci in vitro/in vivo odpovědi na léčbu by individualizace kortikoidní terapie mohla vést ke zlepšení léčebných výsledků. Schrappe a kolegové publikovali velkou randomizovanou klinickou studii (3655 dětí s ALL), která byla zaměřena na srovnání účinku PRED a DEXA v indukční fázi léčby, přičemž studie zachovala koncept sedmidenní PRED preindukce zavedené Riehmem (obr. 3). V rámci indukční fáze byli pacienti rozděleni do dvou ramen: rameno PRED a rameno DEXA. Po PRED předfázi byli léčeni buď PRED (60 mg/m2/den), nebo DEXA (10 mg/m2/den).
Obr. 3. Randomizovaná studie AEIOP – BFM-ALL 2000 (upraveno podle Schrappe et al., 2008). 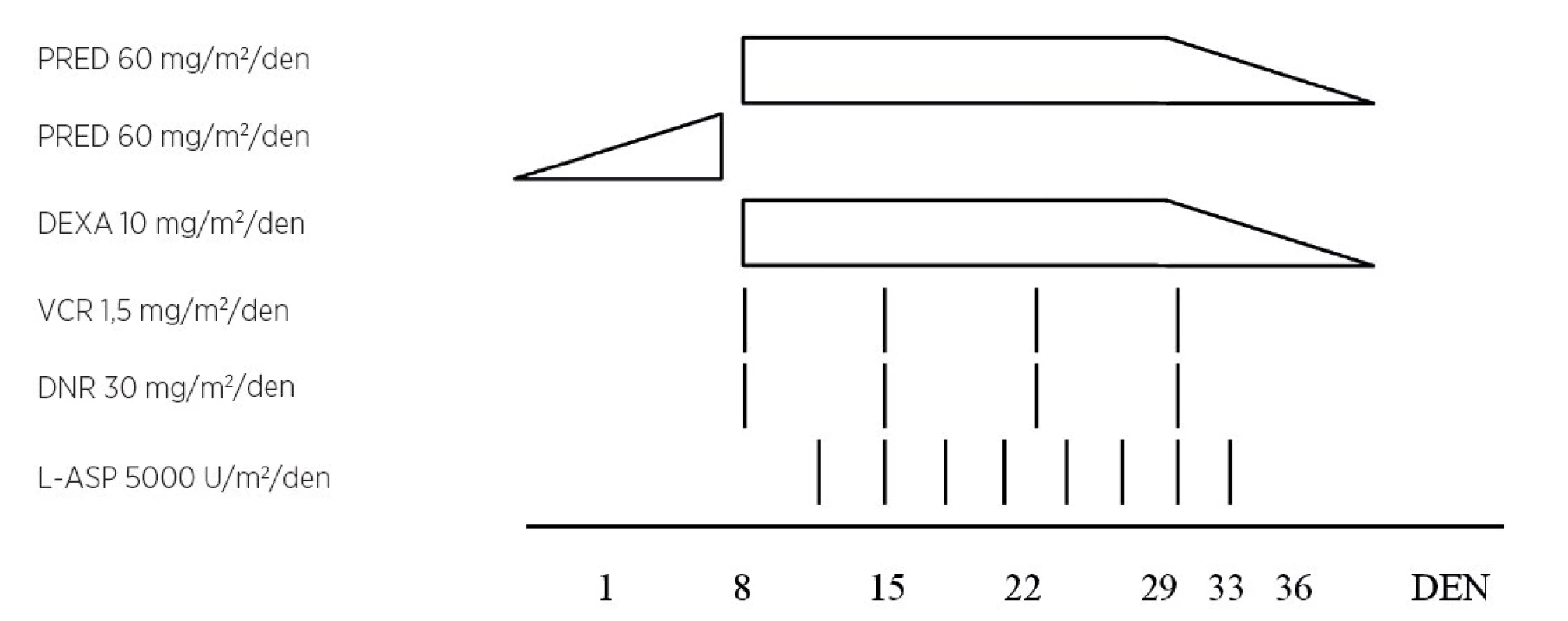
Bylo zjištěno, že DEXA významně snižuje riziko relapsu a má také prokazatelně lepší průnik do CNS, ale ve srovnání s PRED vykazuje vyšší toxicitu a výraznější nežádoucí účinky. Dlouhodobá expozice DEXA je prokazatelně spojena s myelosupresí a doprovázejícími těžkými infekcemi. Šestiletý EFS (event-free survival; přežití bez příznaků nemoci) byl 79,1 % PRED vs. 84,1 % DEXA (p = 0,0083). Izolovaných dřeňových relapsů bylo 12 % PRED vs. 8 % DEXA, CNS relapsů 4 % vs. 2 % [49].
Glukokortikoidy a jejich současné postavení v léčbě ALL
V současnosti jsou děti s ALL léčeny podle mezinárodních protokolárních schémat. Postavení GK terapie v rámci těchto léčebných režimů se v jednotlivých zemích lehce různí, a to především v souvislosti s dávkováním jednotlivých léčiv a jejich uplatněním v jednotlivých fázích terapie [50]. Prednison (obr. 4a), prednisolon (obr. 4b) a dexamethason (obr. 4c) jsou hlavními GK zástupci v terapii dětských ALL [51].
Obr. 4. a, b, c. Struktura 4a) prednisonu, 4b) prednisolonu a 4c) dexamethasonu. 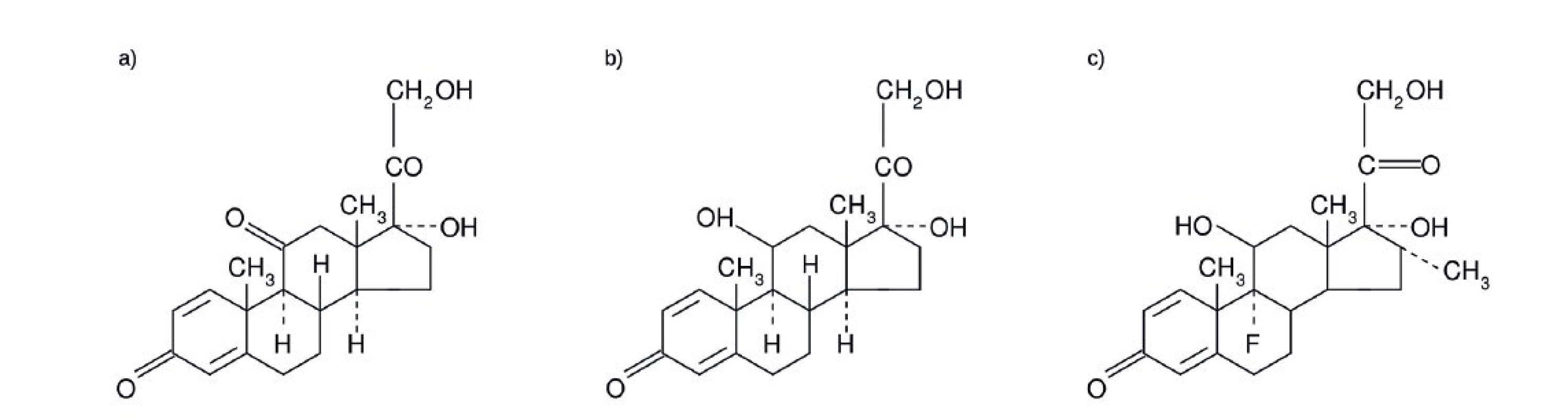
GK, tak jako ostatní léčiva, podléhají základním farmakokinetickým procesům. Absorpce PRED a DEXA je ovlivněna aplikační formou (perorální, intravenózní), místem aplikace, absorpční plochou a prokrvením. DEXA se do organismu dostává v aktivní formě, zatímco PRED jako proléčivo, které musí v metabolicky aktivních orgánech, zejména játrech, podstoupit metabolickou transformaci na biologicky aktivní metabolit prednisolon (obr. 4b) pomocí cytochromu P450 3A4 za vzniku příslušných β-hydroxymetabolitů. V krvi mohou být oba GK distribuovány ve volné nebo vázané formě. V plazmě představuje transkortin neboli corticosteroid binding globulin (CBG) hlavní transportní protein GK [52]. Distribuce GK krevním řečištěm je dynamický děj závislý na perfuzi jednotlivých orgánů. Metabolity GK se v těle rovněž nacházejí ve formě volné nebo vázané a mohou následně podléhat eliminaci z organismu. V cílových tkáních a orgánech se vážou na intracelulární glukokortikoidní receptory (GR) obsažené ve všech buňkách lidského organismu [53]. Vazbou GK na GR vzniká komplex, který po translokaci do buněčného jádra aktivuje buněčnou, tkáňovou nebo systémovou odpověď [54]. Strukturálně se DEXA a PRED od sebe liší umístěním methylové skupiny a přítomností atomu fluoru, který zpomaluje metabolismus DEXA a prodlužuje tím jeho biologický poločas [55]. Umístění methylové skupiny (C16) DEXA minimalizuje jeho mineralokortikoidní efekt, zejména retenci natria a vody v organismu ve srovnání s PRED. Obecně je akceptován téměř sedminásobně vyšší účinek DEXA ve srovnání s PRED, který doložila řada studií [55, 56]. Někteří autoři uvádí až 16,2násobně vyšší antileukemickou aktivitu DEXA ve srovnání s PRED [47]. Proč DEXA vykazuje vyšší cytotoxický účinek na lymfoblastické buňky oproti PRED, není zatím zcela objasněno. Některé studie spekulují o možné vyšší afinitě GR leukemických buněk k DEXA, další studie však toto tvrzení oponují a poukazují na stejnou, resp. vyšší afinitu GR k PRED [57, 58, 59].
Úspěšnost léčby leukemií je také závislá na efektivní CNS profylaxi, ve které se GK významným způsobem uplatňují jak v rámci penetrace GK do cerebrospinální tekutiny (cerebrospinal fluid, CSF) při systémové chemoterapii, tak i v rámci přímé intrathekální GK léčby. Frank M. Balis v experimentech na primátech (Macaca mulatta) potvrdil prokazatelně lepší CNS průnik a delší CSF-poločas DEXA ve srovnáni s PRED [60]. Schrappe a kolegové prokázali, že DEXA v indukci remisi prokazatelně snižuje riziko CNS relapsu u ALL dětí [49]. Hydrokortizon, společně s metotrexátem a cytosinarabinosidem použila jako součást cílené intrathekální CNS profylaxe Children´s Cancer Group. „Triples“ (kombinace metotrexátu, hydrokortizonu a cytozinarabinosidu) ve srovnání s monoterapií metotrexátem (intrathekálně) snížila riziko izolovaného CNS relapsu (3,4 % vs. 5,9 %), avšak byl zde pozorován vyšší výskyt dřeňových a testikulárních relapsů a nezlepšila celkové přežívání pacientů [61, 62].
Závěr
Glukokortikoidní léčba se stala od 50. let 20. století součástí moderního chemoterapeutického přístupu v léčbě dětské ALL. Pozorování příznivého ovlivnění průběhu nemoci vedlo k zařazení glukokortikoidní terapie do randomizovaných klinických pokusů a podrobnému studiu jejich cytotoxického účinku na nádorové buňky. Po úspěšné syntéze nových analogů glukokortikoidních léčiv patřily GK prakticky od začátku chemoterapeutické léčby mezi klíčová léčiva v hematoonkologické terapii, přičemž jejich úloha v léčbě dětských malignit je v současnosti nezastupitelná. GK jsou součástí léčebných protokolů všech mezinárodních pracovních skupin pro dětskou ALL. Díky rozvoji nových analytických a molekulárně genetických metod se podařilo také objasnit mechanismus jejich účinku na buněčné a molekulární úrovni. Senzitivita//rezistence nádorových buněk k jednotlivým GK u dětí s ALL je rozdílná a je ovlivněna biologickými vlastnostmi organismu a řadou zev-ních i vnitřních faktorů. Odpověď na glukokortikoidní (prednisonovou) léčbu se ukázala být významným nezávislým prognostickým faktorem pro dětskou ALL. Rezistence na kortikoterapii v iniciální fázi léčby je negativním prognostickým znakem a v současnosti představuje aktuální terapeutický problém u přibližně 10 % dětí. Identifikace prediktivních faktorů odpovědných za kortikorezistenci by mohla v budoucnu představovat významný nástroj k přizpůsobení terapie pro jednotlivé pacienty. Vhodnou cílenou léčbou by bylo možné zlepšit prognózu těchto kortikorezistentních dětí.
Další perspektivy glukokortikoidní terapie dětských leukemií jsou zaměřeny na výběr vhodné léčby pro jednotlivé pacienty, s cílem minimalizovat vedlejší nežádoucí účinky kortikoterapie. Snaha je proto zaměřena na hledání spolehlivého prediktoru odpovědi na GK léčbu.
Poděkování
Práce byla podpořena vnitřními granty Univerzity Palackého v Olomouci IGA UP 2014_19 a 2014_10. Infrastrukturní část byla podpořena Národním programem udržitelnosti NPUI LO1304 a grantem České technologické agentury TE02000058.
Došlo: 29. 4. 2014
Přijato: 25. 6. 2014
Korespondující autor
MUDr. Petr Džubák, Ph.D.
Ústav molekulární a translační medicíny
Hněvotínská 5
775 15 Olomouc
e-mail: dzubakp@gmail.com
Zdroje
1. Hartman FA, Brownell KA. The hormone of the adrenal cortex. Science 1930; 72 : 76.
2. Swingle WW, Pfiffner JJ. The revival of comatose adrenalectomized cats with an extract of the suprarenal cortex. Science 1930; 72 : 75–76.
3. Rowentree LG, Greene CH, Ball RG, et al. Treatment of Addison‘s with the cortical hormone of the suprarenal gland, summary of immediate results in twenty cases treated with the preparation made by Swingle and Pfiffner. JAMA 1931; 97 : 1446–1453.
4. Kendall EC. The development of cortisone as a therapeutic agent. Indian Med J 1951; 45 : 239–241.
5. Hillier SG. Diamonds are forever: the cortisone legacy. J Endocrinol 2007; 195 : 1–6.
6. Pfiffner JJ, Wintersteiner O, Vars HM. Chemical studies on the adrenal cortex: I. fractination studies on hormone concentrates. J Biol Chem 1935; 111 : 585–597.
7. Mason HL, Myers CS, Kendall EC. The chemistry of crystalline substances isolated from the suprarenal gland. J Biol Chem 1936; 114 : 613–631.
8. Kendall EC. Hormones of the adrenal cortex. Bull N Y Acad Med 1953; 29 : 91–100.
9. Hench PS. The reversibility of certain rheumatic and non-rheumatic conditions by the use of cortisone or of the pituitary adrenocorticotropic hormone. Ann Intern Med 1952; 36 : 1–38.
10. Engleman EP, Krupp MA, Saunders WW, et al. Rheumatoid arthritis – an evaluation of long-term treatment with cortisone. Calif Med 1954; 80 : 369–374.
11. Farber EM, Walton RG. Experiences with ACTH and cortisone in selected dermatoses. Calif Med 1952; 76 : 149–154.
12. Ormsby HL, Shirley SY, Aikenhead JF, et al. ACTH and cortisone therapy in eye disease. CMAJ 1952; 66 : 62–66.
13. Rowe AH Jr, Rowe AH. Cortisone and corticotropin in allergic disease. Calif Med 1952; 77 : 387–390.
14. Collip JB, Anderson EM, Thomson DL. The adrenocorticotropic hormone of the anterior pituitary lobe. Lancet 1933; 222 : 347–348.
15. Li ChH, Evans HM, Simpson ME. Adrenocorticotropic hormone. J Biol Chem 1943; 149 : 413–424.
16. Selye H. Thymus and adrenals in the response of the organism to injuries and intoxications. Br J Exp Pathol 1936; 17 : 234–248.
17. Dougherty TF, White A. Effect of pituitary adrenotropic hormone on lymphoid tissue. Exp Biol Med 1943; 53; 132–133.
18. Murphy JB, Sturm E. The effect of adrenal cortical and pituitary adrenotropic hormones on transplanted leukemia in rats. Science 1944; 99 : 303.
19. Heilman FR, Kendall EC. The influence of 11-dehydro-17-hydroxycorticosterone (compound E) on the growth of a malignit tumor in the mouse. Endocrinol 1944; 34 : 416–420.
20. Hills AG, Forsham PH, Finch CA. Changes in circulatinkg leukocytes induced by the administrativ of pituitary adrenocorticotrophic hormone (ACTH) in man. Blood 1948; 3 : 755–768.
21. Hutchings BL, Mowat JH, Oleson JJ, et al. Pteroylaspartic acid, an antagonist for pteroylglutamic acid. J Biol Chem 1947; 170 : 323–328.
22. Farber S, Diamond LK, Mercer RD, et al. Temporary remissions in acute leukemia in children produced by folic acid antagonist, 4.aminopteryl-glutamic acid (aminopterin). NEJM 1948; 238 : 787–793.
23. Miller DR. A tribute to Sidney farber – the father of modern chemotherapy. Brit J Haematol 2006; 134 : 20–26.
24. Pearson OH, Eliel LP, Rulon WR, et al. ACTH and cortisone-induced regression of lymphoid tumors in man. Cancer 1949; 2 : 943–945.
25. Pearson OH, Eliel LP, Talbot TR Jr. The use of ACTH and kortisone in neoplastic disease. Bull NY Acad Med 1950; 26 : 235–239.
26. Rosenthal MC, Saunders RH, Schwartz LI, et al. The use of adrenocorticotropic hormone and cortisone in the treatment of leukemia and leukosarcoma. Blood 1951; 6 : 804–823.
27. Bierman HR, Kelly KH, Petrakis NL, et al. Duration of life in children treated with corticotropin and corticosterone. Calif Med 1952;77 : 238–241.
28. Burchenal JH. Present status of ACTH, cortisone and the antimetabolites in the treatment of leukemia and related disease. Acta Haematol 1952; 7 : 193–204.
29. Jedlicka V. Adrenokortikotropní hormon (ACTH) a kortizon v léčení chronické lymfatické leukemie. Čes--slov Onkol 1955; 2 : 274–290.
30. Hrodek O, Janele J, Mitera M, et al. Novější pokusy o vyvolávání remisí u akutních leukemií. Čas Lék čes 1954; 43 : 917–921.
31. Sarett LH. Partial synthesis of pregnene-4-triol-17(b), 20(b), 21-dione-3, 11 and pregnene-4-diol-17(b),21-trione-3,11,20 monoacetate. J Biol Chem 1946; 162 : 601–-632.
32. Raviňa E, et al. The Evolution of Drug Discovery; from Traditional Medicines to Modern Drugs. Germany, Wiley-VCH Verlag GmbH & Co. KGaA, 2011 : 1–511. ISBN 978-3-527-32669-3.
33. Walton CHA. Clinical experience with dexamethasone. CMAJ 1959; 81 : 724–726.
34. Hyman CB, Sturgeon P, et al. Prednisone therapy of acute lymphatic leukemia in children. Cancer 1956; 9 : 965–970.
35. Frei E III. Confrontation, passion, and personalization. Cli Cancer Res 1997; 3 : 2554–2562.
36. Skipper H, Schabel F, Wilcox WS. Experimental evaluation of potential anticancer agents. On the criteria and kinetics associated with „curability” of experimental leukemia. Cancer Chemother Rep 1964; 35 : 1–111.
37. Freireich EJ Karon M, Frei E III. Quadruple combination therapy (VAMP) for acute lymphoblastic leukemia of childhood. Proc Am Assoc Cancer Res 1964; 5 : 20.
38. Frei E III, Karon M, Levin RH, et al. The effectiveness of combinations of antileukemic agents in inducing and maintaining remission in children with acute leukemia. Blood 1965; 26 : 642–656.
39. Burchenal JH, Murphy ML. Long term survivors in acute leukemia. Cancer Res 1965; 25 : 1491–1495.
40. George P, Hernandez K, Hustu O, et al. A study of „total therapy” of acute lymphocytic leukemia in children. J Pediatr 1968; 72 : 399–409.
41. Henze G, Langermann HJ, Ritter J, et al. Treatment strategy for different risk groups in childhood acute lymphoblastic leukemia: A report from the BFM Study Group. Haematology Blood Transfusion 1981; 26 : 87–93.
42. Starý J. Výsledky léčby dětí s akutní lymfoblastickou leukemií dle protokolu BFM 83 v České republice, Kooperativní skupina pro dětskou leukemii České republiky. Čes-slov Pediat 1993; 7 : 391–397.
43. Riehm H, Reiter A, Schrappe M, et al. Corticosteroid-dependent reduction of leukocyte count in blood as a prognostic factor in acute lymphoblastic leukemia in childhood (therapy study ALL-BFM 83). Klinische Pädiatrie 1987; 199 : 151–160.
44. Dördelmann M, Reiter A, Borkhardt A, et al. Prednisone response is the strongest predictor of treatment outcome in infant acute lymphoblastic leukemia. Blood 1999; 15 : 1209–1217.
45. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 1983; 65 : 55–63.
46. Mihal V, Hajduch M, Janostakova A, et al. Využití in vitro analýzy lékové rezistence v léčbě leukemií dětského věku. Klin Onkol 2000; 2 : 39–42.
47. Kaspers GJL, Veerman AJP, Popp-Snijders C, et al. Comparison of the antileukemic activity in vitro of dexamethasone and prednisolone in childhood acute lymphoblastic leukemia. Med Pediatr Oncol 1996; 27 : 114–121.
48. Mihal V, Hajduch M, Noskova V, et al. Differential antileukemic activity of prednisolone and dexamethasone in freshly isolated leukemic cells. Adv Exp Med Biol 1999; 457 : 461–471.
49. Schrappe M, Zimmermann M, Moricke A, et al. Dexamethasone in induction can eliminace one third of relapses in childhood acute lymphoblastic leukemia (ALL): resultes of an international randomized trial in 3655 patients (trial AIEOP – BFM ALL, 2000). Blood 2008; 112 : 9.
50. International register of current randomised trials in childhood acute lymphoblastic leukemia. Childhood ALL Collaborative Group, 1996.
51. International collaborative treatment protocol for children and adolescent with acute lymphoblastic leukemia. AIEOP – BFM ALL, 2010.
52. Klieber MA, Underhill C, Hammond GL, et al. Corticosteroid-binding globulin, a structural basis for steroid transport and proteinase-triggered release. J Biol Chem 2007; 282 : 29594–29603.
53. Tissing WJE, Meijerink JPP, Den Boer ML, et al. Genetic variations in the glucocorticoid receptor gene are not related to glucocorticoid resistance in childhood acute lymphoblastic leukemia. Clin Cancer Res 2005; 11 : 6050–6056.
54. Ploner CH, Schmidt S, Presula E, et al. Glucocorticoid-induced apoptosis and glucocorticoid resistance in acute lymphoblastic leukemia. J Steroid Biochem Mol Biol 2005; 93 : 153–160.
55. Inaba H, Pui ChH. Glucocorticoid use in acute lymphoblastic leukemia. Lancet Oncol 2010; 1 : 1096–1106.
56. Nachman JB, McNeer JL. The optimal use of steroids in paediatric acute lymphoblastic leukaemia: no easy answers. Brit J Haematol 2010; 149 : 638–652.
57. Lippman ME, Halterman RH, Leventhal BG, et al. Glucocorticoid binding proteins in human acute lymphoblastic leukemic leukemic blast cells. J Clin Invest 1973; 52 : 1715–1725.
58. Kontula K, Andersson LC, Paavonen T, et al. Glucocorticoid receptors and glucocorticoid sensitivity of human leukemic cells. Int J Cancer 1980; 26 : 177–183.
59. Ponec M, Kempenaar J, Shroot B, et al. Glucocorticoids: Binding affinity and lipophilicity. J Pharm Sci 1986; 75 : 973–975.
60. Balis FM, Lester CM, Chrousos GP, et al. Differences in cerebrospinal fluid penetration of corticosteroids: possible relationship to the prevention of meningeal leukemia. J Clin Oncol 1987; 5 : 202–207.
61. Sullivan MP, Chen T, Dyment PG, et al. Equivalence of intrathecal chemotherapy and radiotherapy as central nervous system prophylaxis in children with acute lymphatic leukemia: a pediatric oncology group study. Blood 1982; 60 : 948–958.
62. Matloub Y, Lindemulder S, Gaynon PS, et al. Intrathecal triple therapy decreases central nervous system relapse but fails to improve event-free survival when compared with intrathecal methotrexate: results of the Children’s Cancer Group (CCG) 1952 study for standard-risk acute lymphoblastic leukemia, reported by the Children’s Oncology Group. Blood 2006; 108 : 1165–1173.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek REJSTŘÍK AUTORŮ SUPPLEMENTAČlánek Věcný rejstříkČlánek OBSAHČlánek DORASTOVÉ LEKÁRSTVOČlánek Zácpa (obstipace)
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2014 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- REJSTŘÍK AUTORŮ SUPPLEMENTA
- Věcný rejstřík
- OBSAH
- Rozštěpové vady břišní stěny a močového měchýře
-
Onychomadesis po onemocnění ruka-noha-ústa
(hand-foot-mouth disease) - Neonatální hemochromatóza asociovaná s renální tubulární dysgenezí
- Historie glukokortikoidní terapie v léčbě akutních leukemií u dětí
- Refeeding syndrom v dětském věku
- Informace k nutričnímu programování tvoří základ nutriční prevence
- Bolesti břicha u kojence („koliky“)
- Zácpa (obstipace)
- Dextrometorfán v rukách adolescenta – lacný a legálny lístok na „výlet“
- Zemřel docent MUDr. Jiří Vyhnálek, CSc.
- DORASTOVÉ LEKÁRSTVO
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dextrometorfán v rukách adolescenta – lacný a legálny lístok na „výlet“
- Neonatální hemochromatóza asociovaná s renální tubulární dysgenezí
- Zácpa (obstipace)
-
Onychomadesis po onemocnění ruka-noha-ústa
(hand-foot-mouth disease)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



