-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRefeeding syndrom v dětském věku
Refeeding syndrome in childhood
Refeeding syndrome is a complex of metabolic abnormalities that arises as a result of too rapid initial phase of realimentation for chronic and/or sever malnourished patients. It is necessary to think about the possibility of refeeding syndrome in these cases, monitor the patient at the start of realimentation, administer reduced doses of the nutrition and adequately substitute deficient substrates as recommended.
Key words:
refeeding syndrome, malnutrition, hypophosphatemia
Autoři: E. Karásková 1; D. Vydra 1; V. Smolka 1; M. Véghová-Velgáňová 1; O. Tkachyk 1; L. Ťoukálková 2; V. Mihál 1
Působiště autorů: Dětská klinika LF UP a FN, Olomoucpřednosta prof. MUDr. V. Mihál, CSc. 1; Dětské oddělení, Krajská nemocnice T. Bati, Zlínprimářka MUDr. L. Svitálková 2
Vyšlo v časopise: Čes-slov Pediat 2014; 69 (6): 363-369.
Kategorie: Přehledový článek
Souhrn
Refeeding syndrom je soubor metabolických abnormalit, které vznikají jako následek příliš rychlé úvodní fáze realimentace u dlouhodobě a/nebo těžce malnutričních pacientů. V těchto případech je nutné na možnost vzniku refeeding syndromu myslet. Při zahájení realimentace je třeba pacienta monitorovat, podat výživu v redukovaných dávkách a adekvátně suplementovat deficitní substráty podle doporučení.
Klíčová slova:
refeeding syndrom, malnutrice, hypofosfatémieDefinice
Refeeding syndrom (RFS) neboli realimentační syndrom je soubor metabolických abnormalit, které vznikají jako následek příliš rychlé úvodní fáze realimentace u dlouhodobě a/nebo těžce malnutričních pacientů.
Výskyt
RFS se vyskytuje u 0,8 % všech dospělých hospitalizovaných pacientů [1] a až u 48 % těžce malnutričních pacientů [2]. U dětí výskyt onemocnění není známý, uváděna jsou jednotlivá kazuistická sdělení [3].
Historie
Onemocnění bylo popisováno již během druhé světové války u japonských zajatců [4] nebo u lidí z obléhaného Leningradu [5], kteří po dlouhé době hladovění dostali dostatečné množství stravy a záhy se u nich objevily kardiovaskulární a neurologické komplikace. Někteří z nich následně zemřeli. Příčina tehdy nebyla známa. S rozvojem podávání parenterální výživy v letech 1970–1980 bylo onemocnění v literatuře opakovaně dokumentováno [5]. Později byla popsána souvislost RFS s hypofosfatémií a v následujících letech byly postupně objasňovány další patogenetické souvislosti RFS.
Patogeneze
Při dlouhodobé malnutrici dochází postupně k úbytku energetických rezerv, redukci zásob iontů, zejména intracelulárních (fosfor, kalium, magnézium) [6]. Ubývají rovněž zásoby vitaminů, především vitaminu B1 (thiaminu). Sérové hladiny uvedených substancí zůstávají dlouhodobě v mezích normy, ačkoliv jejich celotělové zásoby jsou výrazně redukovány. U takto těžce malnutričního pacienta s vyčerpanými energetickými a iontovými rezervami může příliš rychle zahájená realimentace vést k závažným laboratorním a klinickým potížím s ri-zikem úmrtí. Onemocnění refeeding syndromem může nastat zejména po zahájení výživy parenterální, ale také enterální nebo perorální.
Patogeneze onemocnění je komplexní, podílí se na ní více činitelů (obr. 1). Roli hraje dysbalance iontů (nízké hladiny fosforu, kalia a magnézia), retence natria se vznikem edémů, nízká hladina vitamínu B1 a metabolická acidóza. Nejde tedy jen o izolovanou hypofosfatémii, ačkoliv ta je dominantním patologickým ukazatelem.
Obr. 1. Komplexní patogeneze refeeding syndromu. 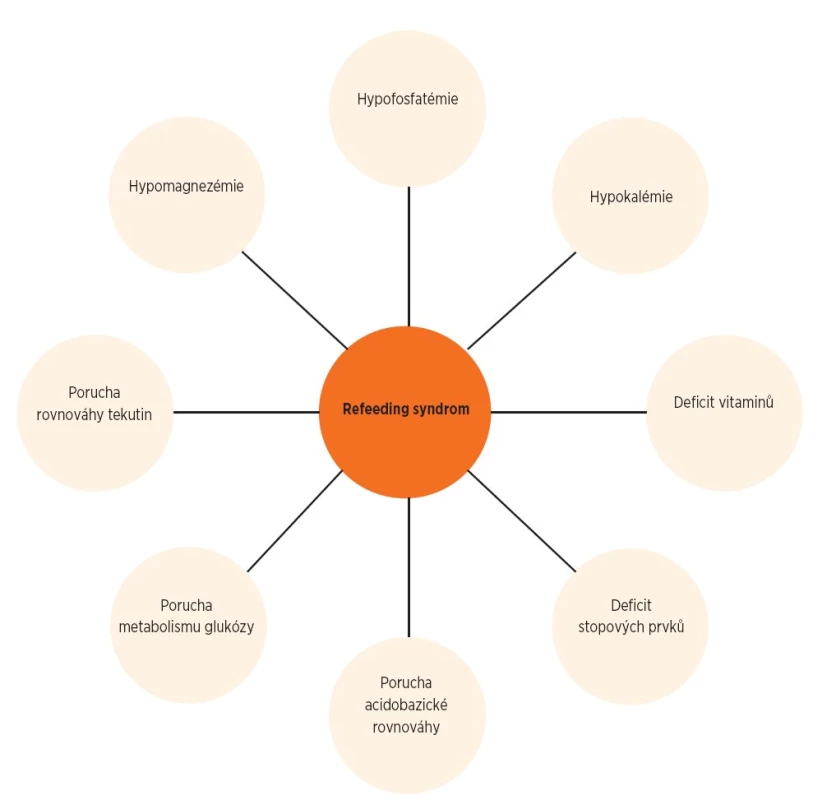
Podáním energetických substrátů dojde k postupnému obnovení fosforylačních procesů. V tomto období mají buňky vysoké nároky na přísun fosforu a ostatních iontů. Realimentaci sacharidy provází vzestup hladiny inzulinu s následným zvýšením transportu glukózy, fosforu, kalia a vody z extracelulárního prostoru do buněk. Tak vzniká sérová deplece iontů, zejména fosforu [3]. U nemocných s malnutricí situaci dále potencuje častý deficit vitaminu B1, který je kofaktorem intermediárního metabolismu sacharidů.
Při akcentovaném přesunu iontů do buněk organismus retinuje v extracelulárním prostoru natrium a vodu. Je to důsledek snahy o udržení izoosmolarity mezi extracelulární a intracelulární tekutinou. Stoupající hladina inzulinu při realimentaci vede v ledvinách k další retenci natria a vody s následným vznikem edémů a rizikem rozvoje městnavého srdečního selhání [1]. V případě kalia dochází k jeho transportu do buněk s možností vzniku hypokalémie.
Podání vyšších dávek glukózy může vést k hyperglykemii, osmotické diuréze, dehydrataci a prerenálnímu selhání ledvin. Hyperglykemie působí také zvýšenou produkci oxidu uhličitého (hyperkapnii), která se v kombinaci se slabostí dýchacích svalů (při hypokalémii a hypofosfatémii) může podílet na vzniku globálního respiračního selhání.
Rizikoví pacienti
Mezi rizikové pacienty pro rozvoj RFS patří všeobecně ti, kteří trpí chronickou a/nebo závažnou formou nutriční deprivace (tab. 1). V dnešní době jsou nejohroženější skupinou pacientky s pokročilou formou mentální anorexie, dále malnutriční pacienti s nespecifickými střevními záněty, chronickou pankreatitidou, syndromem krátkého střeva, někteří onkologičtí pacienti a nemocní s neurologickým postižením, zejména s dětskou mozkovou obrnou [7, 8].
Tab. 1. Obecné rizikové faktory pro rozvoj refeeding syndromu. 
Děti mají vysoké riziko rozvoje RFS v případě, že mají minimální nebo žádný perorální příjem déle než 5–10 dnů, BMI pod 16 a ztrátu hmotnosti větší než 15 % v posledních 3–6 měsících nebo nízkou hladinu kalia, fosforu či magnézia ještě před zahájením realimentace [12]. Myslet na možnost vzniku RFS musíme také u syndromu týraného dítěte v případě, že dítě strádalo hladem.
Klinický obraz
Klinický obraz onemocnění je variabilní (tab. 2). Nejčastěji zjišťujeme pouze laboratorní změny bez klinických potíží. V některých případech se onemocnění projevuje neurologickými projevy: parestéziemi, parézami, poruchou chování, apatií nebo naopak agresivitou, event. křečemi. Pacient může upadnout do kómatu. Z kardiovaskulárních a plicních projevů to jsou: porucha srdečního rytmu, srdeční selhání a respirační selhání s nutností umělé plicní ventilace. Při retenci tekutin pozorujeme edémy.
Tab. 2. Klinická manifestace refeeding syndromu (upraveno podle [6]). ![Klinická manifestace refeeding syndromu (upraveno podle [6]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/cb3211d16402701b8be89985339d8540.png)
Laboratorní nálezy
Hladiny iontů mohou být na počátku realimentace v mezích normy. Míru jejich deficitu lépe odhadneme podle odpadů iontů do moči. Laboratorní změny se většinou vyvíjí mezi druhým až pátým dnem po zahájení nutriční podpory. Nejvýraznější laboratorní abnormalitou je pokles hladiny sérového fosforu (pod 0,5 mmol/l). Závažná hypofosfatémie (pod 0,3 mmol/l) je často již provázena klinickými symptomy. Dalším nálezem je hypokalémie a hypomagnezémie. Častá je metabolická acidóza a diluční hyponatrémie. Deplece vitaminu B1 a dalších vitaminů skupiny B, kterou většinou laboratorně nemonitorujeme, je u malnutričních pacientů vysoce pravděpodobná. Porucha fosforylačních procesů v erytrocytech vede k hemolýze [9]. Při snížení hladiny 2,3-difosfoglycerátu v erytrocytech je posunuta disociační křiv-ka hemoglobinu doleva. Kyslík se hůře uvolňuje z erytrocytů a dochází ke tkáňové hypoxii.
Prevence a léčba
Preventivní opatření jsou nutná vždy, pokud je realimentován pacient s rizikem vzniku RFS. U dospělých a adolescentních pacientů vychází prevence a léčba z NICE Guidelines publikovaných v roce 2006 [10]. Před zahájením nutriční podpory a v průběhu prvních deseti dnů realimentace je doporučeno podávat thiamin v dávce 200–300 mg denně perorálně nebo parenterálně. Suplementovány by měly být i ostatní vitaminy a stopové prvky. U rizikových pacientů je doporučeno začínat nutriční podporu dávkou celkové energie maximálně 10 kcal/kg/den a postupně během 4–7 dnů zvyšovat do plných dávek. U extrémně podvyživených pacientů (BMI pod 14, žádný nebo minimální perorální příjem déle než 15 dnů) pak začínat dávkou 5 kcal/kg/den. Je nezbytná přísná bilance tekutin. Při realimentaci je třeba substituovat fosfor (0,3–0,6 mmol/kg//den), kalium (2–4 mmol/kg/den), magné-zium (0,2 mmol/kg/den intravenózně nebo 0,4 mmol/kg/den perorálně). Fosfatémie pod 0,5 mmol/l je považována za závažnou a v tomto případě může pacient vyžadovat i vyšší dodávku fosforu, než je uvedeno v doporučeních. Brown v roce 2006 publikoval práci [11], kde podával v prvních 2–3 dnech realimentace fosfor podle tíže hypofostatémie až v dávce 1 mmol/kg/den bez nežádoucích účinků (tab. 3). Před podáním těchto dávek bylo vyloučeno renální selhání. Dodávka tekutin a natria by měla vycházet z přesně vedené bilance tekutin a denní monitorace hmotnosti pacienta tak, aby se předešlo přetížení organismu vodou a natriem.
Tab. 3. Dávky fosforu podle hladiny fosforu v séru (podle [11]). ![Dávky fosforu podle hladiny fosforu v séru (podle [11]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9d3a6c088321046a9764696a809d656c.png)
Doporučení Evropské společnosti pro dětskou gastroenterologii, hepatologii a výživu (ESPGHAN) pro léčbu a prevenci RFS u dětí bylo publikováno v roce 2010 [12]. Dodávka energie v úvodní fázi realimentace je 75 % doporučené celkové denní dávky (tab. 4), u vysoce rizikových pacientů pak 50 %. Dávky se zvyšují během prvních 3–5 dnů. Pokud pa-cient toleruje stravu per os nebo enterální výživu, jsou doporučeny malé, frekventní dávky výživy s obsahem energie alespoň 1 kcal//ml, aby se předešlo přetížení tekutinami. Dodávka proteinů začíná na dávce 0,6–1,0 g//kg/den s postupným zvyšováním až na 1,2–1,5 g/kg/den. Suplementaci iontů uvádí tabulka 5. Substituováno má být také kalcium, thiamin, riboflavin, pyridoxin, vitamin C, kyselina listová, vitaminy rozpustné v tucích a stopové prvky.
Tab. 4. Doporučená dávka dodané energie u dětí s rizikem refeeding syndromu. 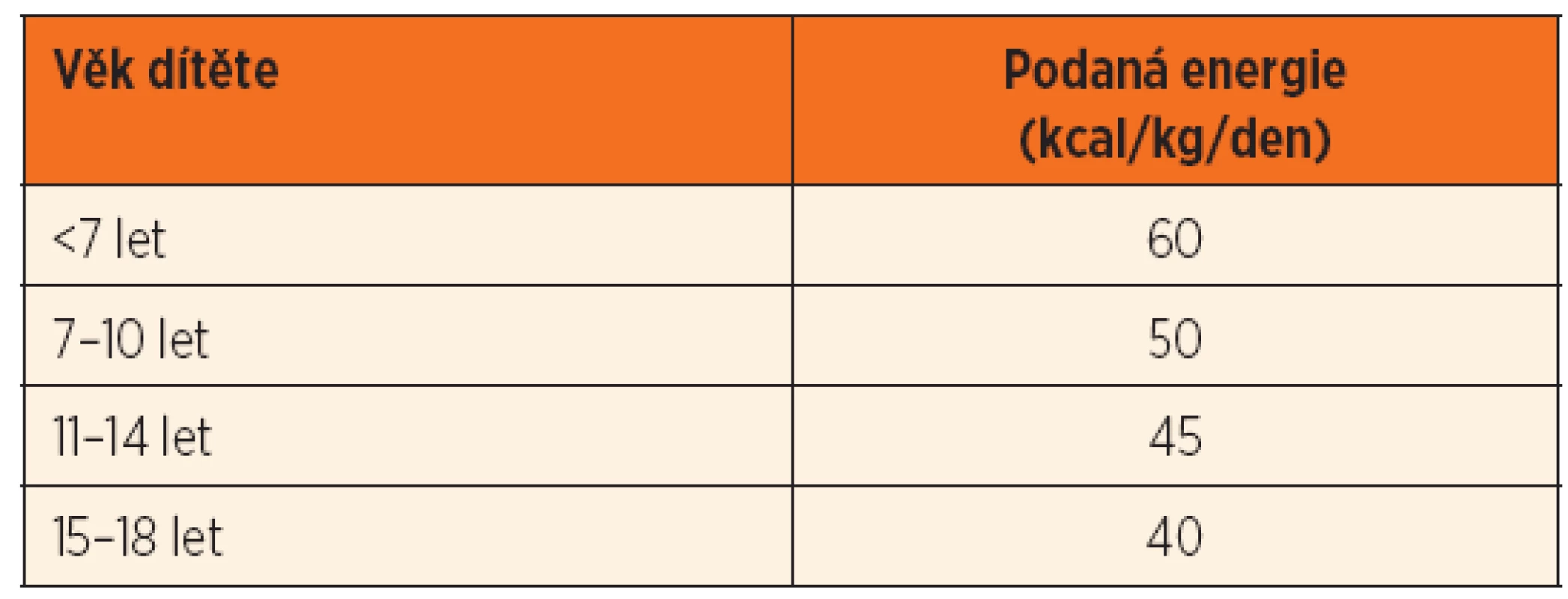
Tab. 5. Dávky suplementovaných iontů u dětí s refeeding syndromem. 
Po zahájení realimentace zejména během prvních 3–5 dnů je nezbytná pečlivá monitorace klinického a laboratorního stavu pa-cienta. Je třeba sledovat hladinu elektrolytů, glukózy, urey, kreatininu a albuminu v séru. Z klinických parametrů je nejdůležitější monitorace srdečního pulzu, krevního tlaku a bilance tekutin.
Prognóza
Pokud je RFS zjištěn včas a adekvátně léčen, odeznívají laboratorní abnormality a event. klinické příznaky během několika dnů. Dále je většinou možné podávat výživu v plných dávkách. Pokud se na onemocnění nemyslí a nejsou realizována preventivní opatření, může dojít k závažnému poškození zdraví nebo i úmrtí.
Kazuistika 1
Dvanáctiletého chlapce s negativní rodinnou a osobní anamnézou jsme vyšetřovali pro bolesti břicha, příměs krve ve stolici a váhový úbytek 5 kg za poslední 4 měsíce. Pomocí endoskopického vyšetření a MR enterografie jsme diagnostikovali Crohnovu chorobu s postižením terminálního ilea, céka a perianální oblasti. V době diagnózy byla jeho hmotnost 29 kg (2. percentil, -2,08 SDS), výška 147 cm (24. percentil, -0,71 SDS) a BMI 13,4.
K indukci remise onemocnění byla podána exkluzivní enterální výživa v kombinaci s thiopuriny. Chlapec perorálně výživu netoleroval, takže jsme ji podali sondou v dávce 62 kcal/kg/den. Během úvodní fáze realimentace jsme monitorovali klinický stav a laboratorní parametry. V průběhu 2. až 3. dne aplikace došlo k očekávatelnému poklesu hladiny fosforu v séru na hodnotu 0,58 mmol/l (fyzio-logické rozmezí 1,45–1,78 mmol/l). Hladiny ostatních iontů, glykemie a parametry acidobazické rovnováhy byly v normě. Klinické potíže pacient neměl. Vzhledem k tomuto nálezu jsme zpomalili aplikaci enterální výživy na poloviční rychlost, fosfor substituovali parenterálně a podali jsme vitaminy skupiny B. Hladiny fosforu v séru se poté normalizovaly. Postupně, během 5 dnů, jsme dávku výživy opět zvýšili až na 68 kcal/kg/den (2000 kcal/den), tedy 120 % celkové denní dávky energie, což je doporučená dávka exkluzivní enterální výživy pro indukci remise Crohnovy choroby u dětí.
Kazuistika 2
Druhý je případ šestnáctiletého chlapce, který má rovněž negativní rodinnou a osobní anamnézu. Pacient byl vyšetřován pro závažný váhový úbytek 12 kg za poslední dva roky. Jeho hmotnost byla 44 kg (0. percentil, -2,93 SDS) při výšce 176 cm (34. percentil, -0,43 SDS), BMI 14,6. Neměl žádné gastrointestinální symptomy. Gastroskopické a koloskopické vyšetření včetně histologického zhodnocení bylo zcela negativní. Chlapec měl zvýšené jaterní a svalové enzymy. Krevní obraz, C-reaktivní protein a sedimentace erytrocytů byly v normě.
Vzhledem k protrahované elevaci jaterních testů jsme po ultrasonografickém vyšetření provedli necílenou jaterní biopsii s nálezem střádání glykogenu v cytosolu hepatocytů. Primární glykogenózy byly vyloučeny. Nález jsme zhodnotili jako sekundární střádání glykogenu při těžké kachexii a malnutrici pacienta [13, 14]. Při hospitalizaci zjišťujeme závislost chlapce na excesivním fyzickém cvičení. Psychiatr diagnostikuje obsedantně kompulzivní poruchu v kombinaci s atypickou poruchou příjmu potravy.
Perorální výživa není efektivní, pacient dále ubývá na hmotnosti, proto zavádíme nazogastrickou sondu, kterou podáváme enterální výživu (EV) v dávce 1000 kcal/den, tj. 22 kcal/kg/den. Podle ESPGHAN je pro prevenci refeeding syndromu u rizikových dětí [12] ve věku 15–18 let doporučen iniciální energetický příjem 40 kcal/kg/den. Dávku jsme u našeho pacienta ještě zredukovali téměř o 50 %. Přesto, vzhledem k těžké protrahované kachexii, se i při nízké dávce energie rozvinuly závažné laboratorní známky RFS. Hladina sérového fosforu poklesla až na 0,16 mmol/l. Dále byla přítomna hypokalé-mie 2,51 mmol /l (fyziologické rozmezí 3,5 až 5,1 mmol/l) a hypomagnezémie 0,59 mmol/l (fyziologické rozmezí 0,8–0,94 mmol/l). Glykemie a parametry acidobazické rovnováhy byly v normě. Chlapec neměl naštěstí žádné klinické příznaky. Aplikace enterální výživy byla ihned zastavena, chybějící ionty a vitaminy skupiny B jsme substituovali parenterálně. Hladina sérového fosforu byla i přes substituci ještě několik dnů nízká, ale již nedosáhla závažné hypofosfatémie pod 0,5 mmol/l (graf 1).
Graf 1. Sérové hladiny fosforu v úvodu realimentace pacienta. 
Při trvalé suplementaci iontů postupně podáváme vzestupné dávky EV již bez dalších komplikací.
Závěr
Refeeding syndrom je onemocnění, které může nastat v případě příliš rychlého zahájení realimentace u každého malnutričního pacienta. Projevuje se především laboratorními změnami, zejména hypofosfatémií. Ve vážnějších případech se mohou objevit klinické příznaky kardiovaskulární, neurologické a další. Proto je třeba u rizikových pacientů zahájit realimentaci zpočátku v redukovaných dávkách, suplemento-vat deficitní substráty a pacienta moni-torovat. Neuváženě rychlá realimentace může u malnutričního pacienta vést k závažným zdravotním komplikacím s rizikem úmrtí.
Došlo: 7. 7. 2014
Přijato: 29. 8. 2014
MUDr. Eva Karásková
Dětská klinika FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: Eva.Karaskova@fnol.cz
Zdroje
1. Bureš J, Kopáčová M, Rejchrt S. Realimentační syndrom. Folia Gastroenterol Hepatol 2006; 4 (4):157–167.
2. Boateng AA, Sriram K, Meguid MM, et al. Refeeding syndrome: treatment considerations based on collective analysis of literature case reports. Review. Nutrition 2010 Feb; 26 (2): 156–167.
3. Afzal NA, Addai S, Fagbemi A, et al. Refeeding syndrome with enteral nutrition in children: a case report, literature review and clinical guidelines. Review. Clin Nutr 2002 Dec; 21 (6): 515–520.
4. Schnitker MA, Mattman PE, Blues TL. A clinical study of malnutrition in Japanese prisoners of war. Ann Intern Med 1951; 35 : 69–96.
5. Solomon SM, Kirby DF. The refeeding syndrome: a review. JPEN J Parenter Enteral Nutr 1990 Jan-Feb; 14 (1): 90–97.
6. Khan LU, Ahmed J, Khan S, et al. Refeeding syndrome: a literature review. Gastroenterol Res Pract 2011 : 1–6.
7. Mehanna HM, Moledina J, Travis J. Refeeding syndrome: what it is, and how to prevent and treat it. BMJ 2008 Jun 28; 336 (7659): 1495–1498.
8. Weinsier RL, Krumdieck CL. Death resulting from overzealous total parenteral nutrition: the refeeding syndrome revisited. Am J Clin Nutr 1981 Mar; 34 (3): 393–399.
9. Plášek J, Hrabovský V, Martínek A. Refeeding syndrom – skrytá klinická hrozba. Interní Med 2010; 12 (9): 439–441.
10. National Institute for Clinical Excellence. Nutrition Support for Adults: Oral Nutrition Support, Enteral tube Feeding and Parenteral Nutrition. London:National Institute for Clinical Excellence, 2006.
11. Brown KA, Dickerson RN, Morgan LM, et al. A new graduated dosing regimen for phosphorus replacement in patients receiving nutrition support. JPEN J Parenter Enteral Nutr 2006 May-Jun; 30 (3): 209–214.
12. Braegger C, Decsi T, Dias JA, et al. ESPGHAN Committee on Nutrition: Practical approach to paediatric enteral nutrition: a comment by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr 2010 Jul; 51 (1): 110–122.
13. Sasano H. Glycogen and Liver dysfunction in anorexia nervosa. Intern Med 1998 Aug; 37 (8): 652.
14. Komuta M, Harada M, Ueno T, et al. Unusual accumulation of glycogen in liver parenchymal cells in a patient with anorexia nervosa. Intern Med 1998 Aug; 37 (8): 678–682.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek REJSTŘÍK AUTORŮ SUPPLEMENTAČlánek Věcný rejstříkČlánek OBSAHČlánek DORASTOVÉ LEKÁRSTVOČlánek Zácpa (obstipace)
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2014 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Orální lichen planus v kostce: Jak v praxi na toto multifaktoriální onemocnění s různorodými symptomy?
-
Všechny články tohoto čísla
- REJSTŘÍK AUTORŮ SUPPLEMENTA
- Věcný rejstřík
- OBSAH
- Rozštěpové vady břišní stěny a močového měchýře
-
Onychomadesis po onemocnění ruka-noha-ústa
(hand-foot-mouth disease) - Neonatální hemochromatóza asociovaná s renální tubulární dysgenezí
- Historie glukokortikoidní terapie v léčbě akutních leukemií u dětí
- Refeeding syndrom v dětském věku
- Informace k nutričnímu programování tvoří základ nutriční prevence
- Bolesti břicha u kojence („koliky“)
- Zácpa (obstipace)
- Dextrometorfán v rukách adolescenta – lacný a legálny lístok na „výlet“
- Zemřel docent MUDr. Jiří Vyhnálek, CSc.
- DORASTOVÉ LEKÁRSTVO
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dextrometorfán v rukách adolescenta – lacný a legálny lístok na „výlet“
- Neonatální hemochromatóza asociovaná s renální tubulární dysgenezí
- Zácpa (obstipace)
-
Onychomadesis po onemocnění ruka-noha-ústa
(hand-foot-mouth disease)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



