-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diferenciální diagnostika nenádorových onemocnění duodena
Pattern-based approach to duodenitis and duodenopathy
Duodenum is currently the most popular site to obtain samples of intestinal mucosa for recognition of a disorder leading to malabsorption. Although there are significant overlaps between histological findings described in various non-neoplastic diseases of the duodenum, recognition of one of the six basic morphologic patterns, namely coeliac disease-like pattern, active chronic duodenitis, acute GvHD-like pattern, enteritis with predominant eosinophilic infiltration, enteritis with predominant infiltration by macrophages, and non-inflammatory enteropathy, usually allows diagnostic separation, especially if subtle histological details, clinical setting and serological investigation are taken into account.
Keywords:
endoscopy – Biopsy – duodenum – pattern – duodenitis – duodenopathy
Autoři: Ondřej Daum 1,2
; Magdaléna Daumová 1,2; Marián Švajdler 1,2
Působiště autorů: Šiklův ústav patologie LF UK a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň 2
Vyšlo v časopise: Čes.-slov. Patol., 58, 2022, No. 2, p. 88-99
Kategorie: Přehledový článek
Souhrn
Duodenum je v současné době nejoblíbenější lokalizací pro odběr vzorků sliznice tenkého střeva k objasnění příčiny malabsorpce. Přestože jsou značné překryvy mezi histologickými nálezy charakterizujícími různá nenádorová onemocnění duodena, rozpoznání jednoho ze šesti základních morfologických obrazů, jmenovitě obrazu charakteru celiakie, aktivní chronické duodenitidy, obrazu charakteru akutní GvHD, enteritidy s dominantní účastí eozinofilů, enteritidy s dominantní účastí makrofágů a nezánětlivé enteropatie, obvykle umožní významné zúžení diferenciálně diagnostické rozvahy, zejména při zohlednění specifičtějších histologických detailů, klinického stavu a výsledků serologických a dalších pomocných vyšetření.
Klíčová slova:
endoskopie – Biopsie – duodenum – histologický obraz – duodenitida – duodenopatie
Podobně jako je tomu při hodnocení žaludečních nenádorových lézí (viz druhý článek v tomto čísle časopisu s názvem Diferenciální diagnostika nenádorových onemocnění žaludku), i při vyšetřování endoskopických biopsií duodena se patolog opírá především o mikroskopické hodnocení preparátů v konvenčním barvení hematoxylinem a eozinem (HE), které může být doplněno některým ze speciálních barvících technik (nejčastěji PAS), případně i imunohistochemickým vyšetřením. Elektronová mikroskopie je v současné době i v této lokalizaci užívána pouze v ojedinělých případech a do značné míry byla (zejména při detekci mikroorganismů) nahrazena metodami molekulární biologie. Dříve hojně užívaná enzymová histochemie je dnes (zejména v anglosaském prostředí) v duodenální oblasti považována za metodu, která nepatří do laboratoře histopatologické, ale biochemické. Důvodem není pouze vyšší spolehlivost biochemických metod a možnost přesnější kvantifikace enzymové aktivity, ale i prozaická problematika dostupnosti kontrolních tkání a akreditace této metody.
V malém zvětšení lze nejprve hodnotit výskyt erozí či vředů, výraznější změny architektury klků a krypt, přítomnost či absenci zánětlivého infiltrátu v proprii a difúzní nebo ložiskový charakter těchto změn. Střední až velké zvětšení pak umožňuje specifikovat typ slizničního infiltrátu podle jeho složení, blíže určit jeho lokalizaci ve sliznici (stroma klků, proprie mezi kryptami), stanovit množství (případně i přesný počet) intraepiteliálních lymfocytů, a dále hodnotit morfologické změny epitelu svědčící pro jeho poškození (oploštění epitelových buněk, narušení kartáčového lemu enterocytů a/nebo deplece mucinu v pohárkových buňkách; případně redukce pohárkových a/nebo Panethových buněk) nebo metaplastické změny. V některých případech může být mikroskopicky zastiženo i etiologické agens.
Na podkladě základního histopatologického vyšetření lze nález zařadit do jednoho ze šesti základních morfologických obrazů: vzhledem k nejčastější indikaci endoskopické biopsie duodenální sliznice, kterou je celiakie, je základním obrazem soubor změn charakteristických pro toto onemocnění, který lze pracovně nazvat obrazem charakteru celiakie; dále může být přítomna aktivní chronická duodenitida; změny typicky popisované při akutní reakci štěpu proti hostiteli, tedy obraz charakteru akutní GvHD; podobně jako v jiných částech GIT i enteritida s dominantní účastí eozinofilů; potom poměrně patognomonický obraz enteritidy s dominantní účastí makrofágů; a konečně i nezánětlivá enteropatie, jestliže postižená sliznice postrádá zánětlivou infiltraci. Nosologická diagnóza v rámci těchto morfologických obrazů může být umožněna nálezem specifických histologických znaků, ve většině případů je však závislá na klinické informaci a výsledcích serologického, mikrobiologického, virologického, případně i biochemického vyšetření. Mezi specifické histologické znaky umožňující etiologickou diagnózu patří i nebiologické cizorodé útvary, jejichž problematika v duodenu se však prakticky neliší od žaludeční lokalizace, proto zde pouze odkazujeme na příslušný oddíl v předcházejícím článku Diferenciální diagnostika nenádorových onemocnění žaludku.
NORMÁLNÍ SLIZNICE DUODENA
Základními znaky, které se histologicky hodnotí v duodenálních biopsiích, jsou výška klků, hloubka krypt, celulizace proprie a počet intraepiteliálních lymfocytů. Poměr výška klků/hloubka krypt má být vyšší než 3/1, s výjimkou bulbu duodena, kde je 2/1, a to v důsledku oploštění klků nad většími lymfoidními folikly a Brunnerovými žlázkami, snad i v důsledku kontaktu s kyselejší žaludeční šťávou (1,2). Na rozdíl od žaludku, jehož normální sliznice skutečně (téměř) žádné zánětlivé buňky v proprii neobsahuje, je určitá míra „modrého tečkování“ duodenální sliznice lymfocyty a plazmatickými buňkami normálním nálezem. Samozřejmě neexistuje kvantitativní práh této „normální“ zánětlivé celulizace, což komplikuje diagnostiku mírných zánětů. Mohou být přítomny ojedinělé eozinofily, ale neutrofily by se neměly vyskytovat v proprii ani v povrchovém epitelu (3). Maximální počet intraepiteliálních lymfocytů v epitelu klků by měl být 25/100 epitelových buněk, za prahovou hodnotu patologického zvýšení jejich počtu je pak považován počet 30/100 epitelových buněk (4-9). Dále se uvádí, že normální distribuce intraepiteliálních lymfocytů podél klků má charakter „decrescenda“, tedy jejich denzita stoupá od vrcholu klku k jeho bazi (10).
1. OBRAZ CHARAKTERU CELIAKIE
Jedná se o morfologickou kompozici sestávající z intraepiteliální lymfocytózy, hyperplázie krypt, atrofie klků a zánětlivé celulizace proprie v různém zastoupení. Hodnocení zásadních diagnostických znaků (intraepiteliální lymfocytózy a výšky klků) vyžaduje splnění určitých technických parametrů. Žádoucí je, aby rovina řezu byla kolmá na povrch sliznice (a pokud možno rovnoběžná s dlouhou osou klků), protože výrazněji šikmý řez může vést k chybnému hodnocení jak výšky klků, tak počtu intraepiteliálních lymfocytů (nepřítomnost vrcholu klku v řezu vede k počítání lymfocytů pouze v bazálnější zóně klku, a tedy, vzhledem k normální „decrescendo“ distribuci intraepiteliálních lymfocytů, potenciálně k falešně vyššímu celkovému počtu intraepiteliálních lymfocytů) (11). Počítání intraepiteliálních lymfocytů může být také ovlivněno tloušťkou histologických řezů, protože „do tlustších řezů se vejde více lymfocytů“. Za adekvátní vzorek je považován takový, který obsahuje alespoň tři přilehlé správně orientované klky (12). Metodika počítání intraepiteliálních lymfocytů není jednoznačně standardizována. Klasická metoda počítání v rozsahu 300-500 epitelových buněk je pro svou časovou náročnost poněkud nepraktická (4,5,7,13-16). Rozumným kompromisem je počítání lymfocytů v rozsahu 20 epitelií při vrcholu klku, a to v 5 dobře orientovaných klcích. Celkově jde tedy o nesouvislý úsek tvořený 100 epitelovými buňkami, v jehož rozsahu by mělo být zastiženo maximálně 25 intraepiteliálních lymfocytů (6,17). Ještě rychlejší metodou je pouhé hodnocení ztráty normální „decrescendo“ distribuce intraepiteliálních lymfocytů podél klku (10), ačkoli ojedinělé hlasy validitu této metody zpochybňují (18). Konečně, v plně vyvinutých případech, kdy je epitel klků „pocukrován“ lymfocyty a navíc jsou přítomny další znaky doprovázející obraz charakteru celiakie (regresivní změny epitelu, atrofie klků a zánětlivá celulizace proprie), není samozřejmě počítání nutné.
Celiakie (gluten-senzitivní enteropatie, GSE)
Požadavek na potvrzení či vyloučení diagnózy celiakie je v současné době nejčastějším důvodem pro odběr duodenální biopsie. S ohledem na ložiskový charakter postižení duodenální sliznice při celiakii by měly být odebrány alespoň 4 vzorky z postbulbárního duodena a 2 z duodenálního bulbu (19-24). Sliznice duodenálního bulbu je sice, vzhledem k přítomnosti některých „fyziologických artefaktů“ zmíněných výše, obtížněji hodnotitelná, ale bylo prokázáno, že až u 25 % pacientů jsou morfologické známky celiakie vyjádřeny pouze v bulbu duodena (25-33).
Z morfologických znaků celiakie je nejčasnější (a tedy nejvíce senzitivní a nejméně specifický) znak intraepiteliální lymfocytóza. Poškození sliznice je zprvu kompenzováno hyperplázií krypt, insuficience této kompenzace potom vede k atrofii klků, spolu se stupňující se lymfoplazmocytární zánětlivou celulizací proprie na pozadí těchto změn (obr. 1). Tato sekvence změn je základem morfologického gradingu celiakie, který lze vyjádřit různými klasifikacemi, jejichž srovnání demonstruje tab. 1 (11,15,34,35). Vzhledem k tomu, že mezi jednotlivými klasifikacemi jsou pouze formální rozdíly, není důležité, kterou z nich patolog používá, ale aby byl s používaným typem klasifikace srozuměn gastroenterolog (36). Z praktického hlediska je samozřejmě vhodné, aby všichni spolupracující gastroenterologové souhlasili s používáním stejné klasifikace. Detailnější rozbor problematiky celiakie je dostupný v publikacích v českém i slovenském jazyce (37,38). Opomíjeným faktem je častá přítomnost neutrofilních granulocytů v zánětlivém infiltrátu při celiakii, zejména u dětí, kde je signifikantní příměs neutrofilů až v 56 % případů (39,40). Navzdory obecnému přesvědčení tedy jejich přítomnost diagnózu celiakie nevylučuje.
Obr. 1. Morfologický obraz celiakie. 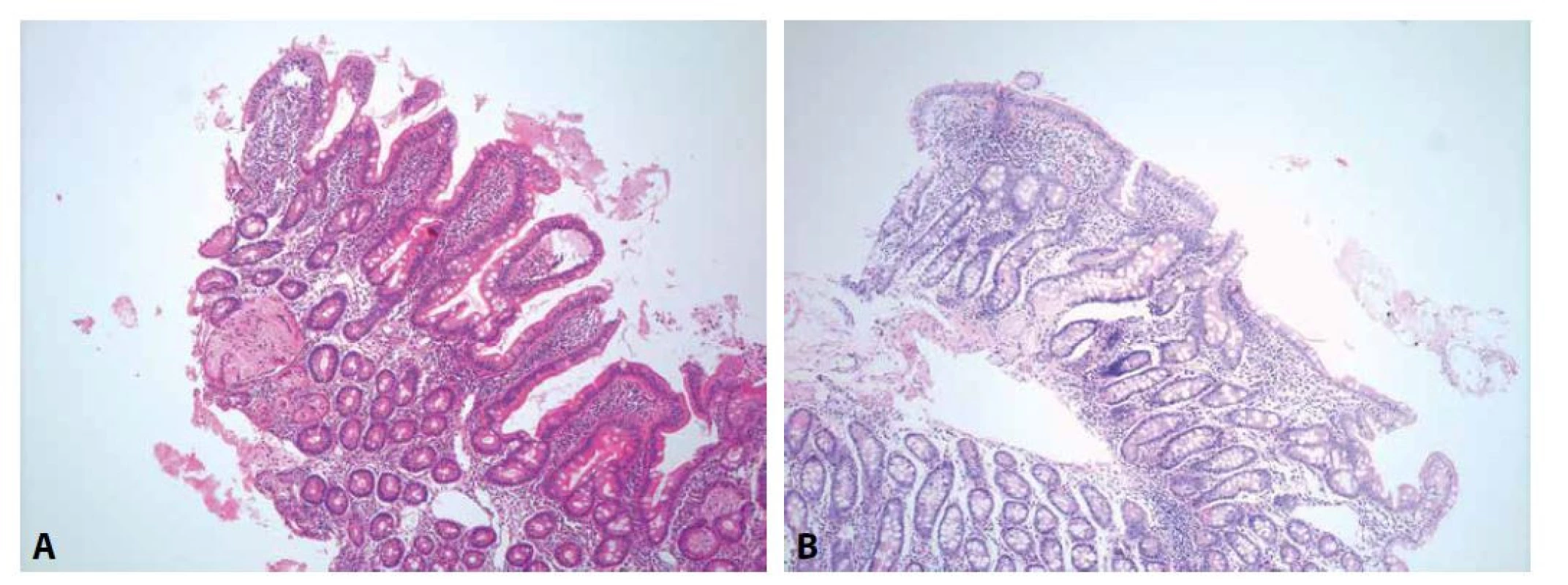
V typických případech histologický obraz celiakie sestává z intraepiteliální lymfocytózy, lymfoplazmocytární zánětlivé infiltrace proprie, hyperplázie krypt a mírnou (A; HE, 100x) či výraznou (B; HE, 100x) atrofií klků. Tab. 1. Porovnání klasifikací morfologického gradingu celiakie. 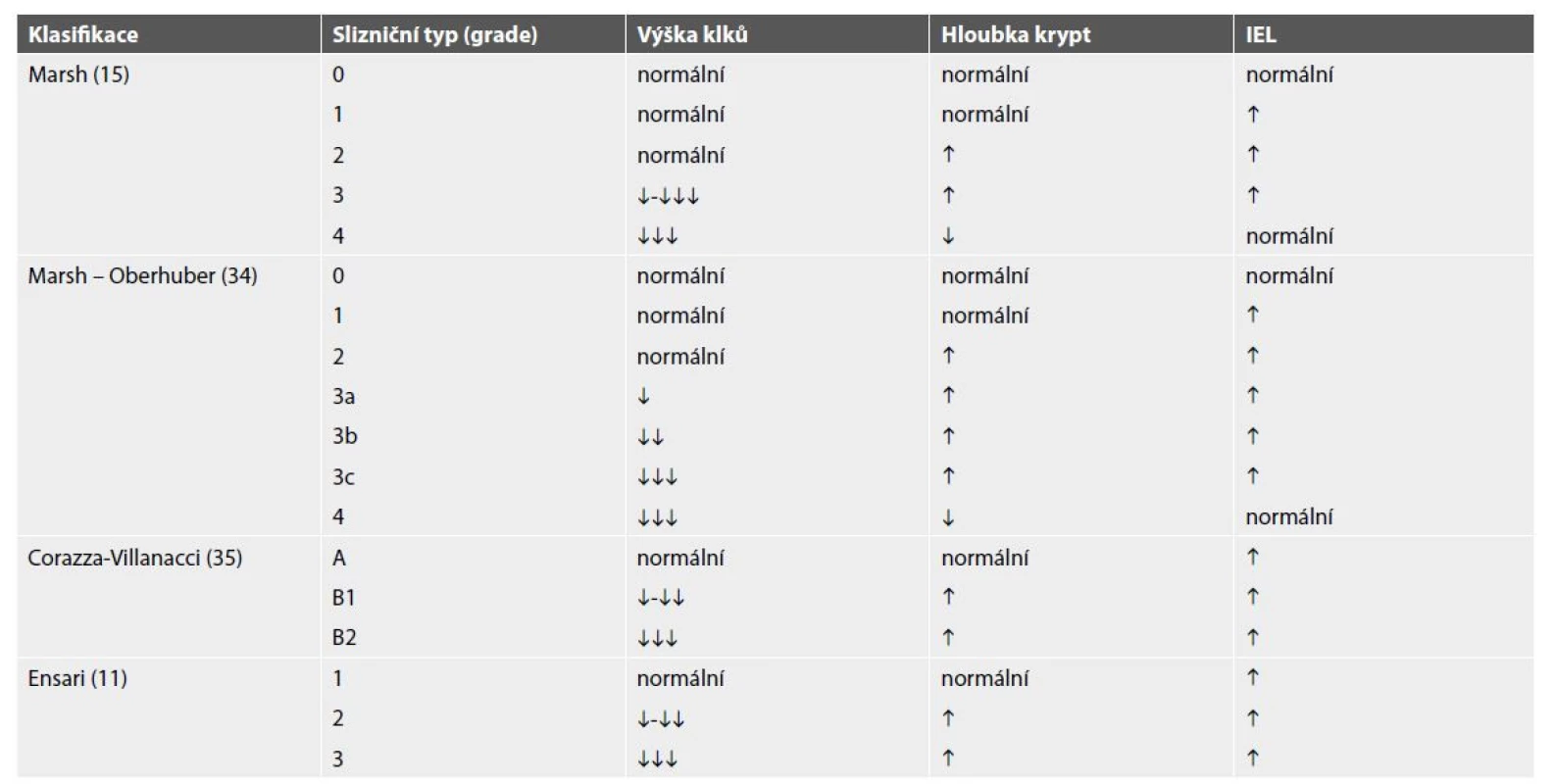
IEL: počet intraepiteliálních lymfocytů
výška klků ↓: mírná atrofie
výška klků ↓↓: výrazná atrofie
výška klků ↓↓↓: úplná atrofie (plochá sliznice)Z hlediska diferenciální diagnostiky je však třeba zdůraznit, že samotná morfologie není dostačující ke stanovení diagnózy celiakie. Je nutné zohledňovat též klinický obraz a výsledky serologického vyšetření. V současné době jsou primárně stanovovány hladiny protilátek proti tkáňové transglutamináze (anti-tTG) ve třídě IgA. Senzitivita a specificita tohoto vyšetření je přibližně 95 % (41), normální hladiny bývají zejména při izolované intraepiteliální lymfocytóze (slizniční typ 1 dle Marsh-Oberhuberovy klasifikace) (42,43), falešná negativita při vyšším histologickém gradeu je asociována především s deficitem IgA, který se vyskytuje přibližně u 7 % pacientů s celiakií. V takovém případě je nutné stanovit hladinu anti-tTG ve třídě IgG (44,45). Vzhledem k tomu, že jde o „gluten-senzitivní enteropatii“, měl by být výskyt projevů asociován s požíváním glutenu (a jejich ústup po nasazení bezglutenové diety). Ve sporných případech může možnost celiakie vyloučit negativní průkaz genotypu HLA DQ-2 a DQ-8 (46,47).
Refrakterní celiakie (refractory celiac disease, RCD) je charakterizovaná perzistentními nebo rekurujícími symptomy a příznaky malabsorpce asociovanými s atrofií klků u pacienta s potvrzenou celiakií, a to i přes adherenci ke striktní bezglutenové dietě trvající 6-12 měsíců, nebo přítomností těžkých symptomů perzistujících bez ohledu na dobu trvání bezlepkové diety, s vyloučením možnosti jiné etiologie (48,49). Stanovení této diagnózy vyžaduje zodpovězení tří otázek: Je onemocnění skutečně refrakterní vůči bezglutenové dietě? Jinými slovy: Opravdu nedochází k žádné ingesci glutenu? Tato otázka se naštěstí netýká histopatologické diagnostiky, ale musí být řešena klinikem (50). Je toto refrakterní onemocnění skutečně celiakie? V tomto případě je úlohou patologa potvrdit, že jsou přítomny morfologické změny kompatibilní s diagnózou celiakie, případně zrevidovat i starší biopsie. Navíc by pochopitelně měl mít klinik diagnózu potvrzenou na základě serologického vyšetření, případně i analýzy HLA (50). Jde o refrakterní celiakii 1., nebo 2. typu? Zatímco RCD 1. typu odpovídá na terapii nízkými dávkami kortikoidů, neprogreduje do T-lymfomu asociovaného s enteropatií (EATL) a nesnižuje signifikantně délku přežití, je RCD 2. typu považovaná za premaligní stav („lymfom in situ“), s vysokým rizikem progrese v EATL a s nutností agresivní imunosuprese a hematoonkologické terapie. Za diagnostické znaky RCD 2. typu je považována ztráta povrchového CD8 na membráně intraepiteliálních lymfocytů (což vede ke zvýšení poměru CD3/CD8 na přibližně 2/1) a klonální rearanže genu kódujícího receptor T buněk (TcR) (21,51-56), nicméně recentní analýza zpochybňuje specificitu těchto znaků RCD 2. typu, takže je otázkou, zda v budoucnosti bude v její diagnostice hrát patolog podstatnou roli (57).
Neceliakální glutenová senzitivita (NCGS) je jednotka kontroverzní, nedostatečně vysvětlená a provizorně definovaná. Projevuje se nespecifickými intestinálními i extraintestinálními symptomy, které do značné míry připomínají projevy syndromu dráždivého tračníku a jiných gastrointestinálních funkčních onemocnění a reagují na expozici/odnětí glutenu, přičemž nesplňují diagnostická kritéria celiakie a nelze je vysvětlit ani jiným onemocněním (58,59). Mezi histopatologické nálezy popsané u pacientů, splňujících výše uvedená kritéria (58), patří zvýšení počtu eozinofilů v proprii (> 5/HPF), lineárně uspořádané skupinky 6-7 T-lymfocytů v hluboké proprii a disperzní klastry 4-5 T-lymfocytů v povrchovém epitelu klků při nezvýšeném celkovém počtu intraepiteliálních lymfocytů, nelze však vyloučit, že jde o nálezy v rámci normální variability, případně nálezy indukované jinou, nediagnostikovanou příčinou (60-62).
Helicobacterová gastritida a peptická duodenitida
Helicobacterová gastritida sama o sobě může způsobovat izolované zvýšení počtu intraepiteliálních lymfocytů bez architektonických změn sliznice proximálního duodena (tzv. lymfocytární duodenóza, duodenální intraepiteliální lymfocytóza nebo duodenální IELóza), a to téměř v polovině případů (63-65), přestože Helicobacter není v duodenu v případech čisté IELózy přítomen. Helicobacterová gastritida je příčinou asi 14 % případů duodenální IELózy a řadí se tak mezi její 3 nejčastější příčiny (66). Pokud je gastritida doprovázena hypersekrecí žaludeční šťávy (pravděpodobně v důsledku zánětlivé destrukce somatostatin-produkujících D buněk), rozvíjejí se navíc v bulbu duodena i známky peptické duodenitidy zahrnující poškození epitelu, smíšenou zánětlivou celulizaci proprie, v těžších případech i gastrickou metaplázii, hyperplázii Brunnerových žlázek, a atrofii klků, přičemž metaplastickou sliznici může kolonizovat Helicobacter (67-70). Asociace peptické duodenitidy s IELózou závisí na její příčině. Kromě helicobacterové gastritidy může být také způsobena např. nesteroidními antirevmatiky (a být doprovázena IELózou) nebo Zollinger-Ellisonovým syndromem (při němž nebývá IELóza přítomna).
Polékové duodenopatie/duodenitidy
Nesteroidní antirevmatika mohou způsobit jak peptickou duodenitidu, tak izolovanou duodenální IELózu, podobně jako helicobacterová gastritida, s níž se řadí mezi její nejčastější příčiny (43,71-74).
Blokátory receptorů pro angiotenzin II (ABR, sartany), především olmesartan, mohou způsobovat těžké průjmy. V duodenu bývá nejčastěji obraz charakteru celiakie, od duodenální IELózy po výraznou atrofii klků zánětlivě infiltrované sliznice (75 - 77). Na rozdíl od celiakie bývá pravidelně přítomna signifikantní příměs eozinofilů (78). Častěji také bývají v kryptách přítomny apoptózy, nicméně většinou nedominují celkovému obrazu duodenitidy (75). V pětině případů lze také zastihnout ztluštění subepiteliálního pruhu kolagenu vytvářející obraz kolagenní sprue (viz níže) (79).
Imunomodulační protinádorové léky, mezi něž se řadí protilátky proti receptoru smrti a jeho ligandu PD-1/PD-L1 (nivolumab, pembrolizumab, atezolizumab); protilátky proti proteinu 4 asociovanému s cytotoxickými T lymfocyty, CTLA-4 (ipilimumab) a inhibitory fosfatidylinositol-3-kinázy, PI3K (idelasilib), převážně vyvolávají obraz obdobný celiakii, někdy s vyšší, avšak nikoli markantní apoptotickou aktivitou (80-82). Někdy není přítomna signifikantní intraepiteliální lymfocytóza a nález pak má spíše charakter aktivní chronické duodenitidy, často s neutrofilní vilitidou (83).
Imunopatologická onemocnění
Běžná variabilní imunodeficience (common variable immunodeficiency, CVID) je heterogenní skupina stavů prezentujících se hypogamaglobulinémií, rekurentními infekcemi, zvýšeným výskytem autoimunitních onemocnění a lymfoproliferací, s prevalencí 1/10000 a gastrointestinální manifestací u poloviny pacientů (84-86). V tenkém střevě CVID běžně napodobuje obraz celiakie. Mezi znaky, které umožňují navrhnout diagnózu CVID, patří přítomnost lymfoidních foliklů v proprii a deplece až absence plazmatických buněk, ale bohužel nejsou přítomny ve všech případech (obr. 2) (87-91). V pětině případů může být přítomna výraznější apoptotická aktivita, i tehdy však většinou převažuje celkový obraz napodobující celiakii nad podobností se změnami při GvHD (89). Vzhledem k hypogamaglobulinémii, postihující zejména IgA, je typickou klinickou manifestací infekční průjem způsobený banálními bakteriálními (campylobacterovými a salmonelovými) a virovými (zejména norovirovými) infekcemi. Až v pětině případů je CVID doprovázen chronickou infekcí Giardia lamblia, která může být v histologickém preparátu zastižena (viz níže) a může přispívat k rozvoji malabsorpčního syndromu (85,92).
Obr. 2. CVID. 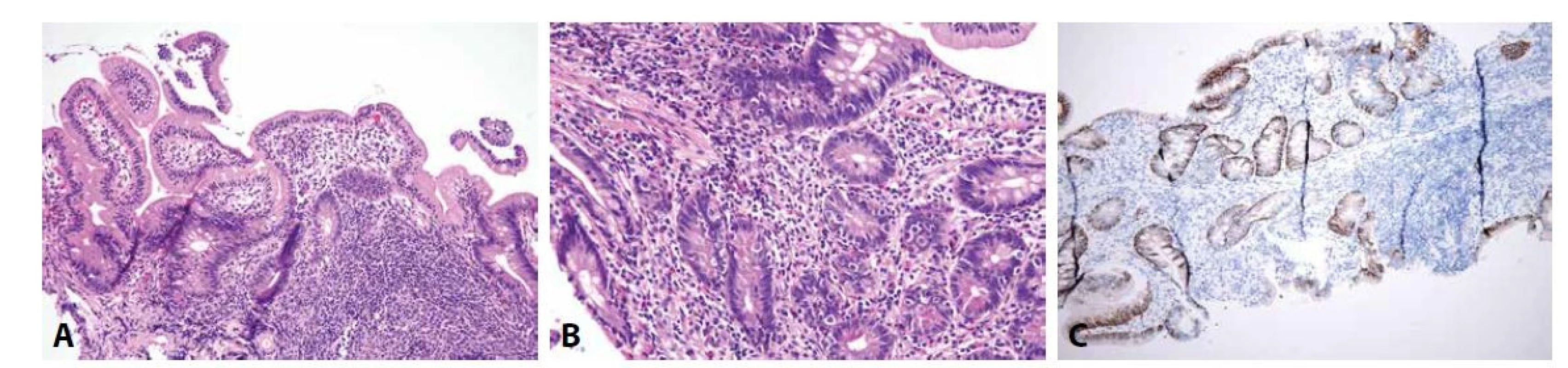
Je patrná zánětlivá celulizace proprie regionálně alternující intenzity, zde s přítomností lymfatického folikulu (A; HE, 150x), která však postrádá plazmatické buňky (B; HE, 200x), což lze demonstrovat absencí reakce zánětlivých buněk s protilátkou proti syndecanu 1 (C; CD138, 100x) (membránová pozitivita epitelových buněk krypt představuje vnitřní pozitivní kontrolu). Hypersenzitivní (alergické) reakce cílené proti nejrůznějším antigenům v potravě mohou být zprostředkovány humorální (především protilátkami IgE) nebo buněčnou (s centrální rolí T-lymfocytů) imunitou. Ve druhém případě mohou být v duodenální sliznici zastiženy změny připomínající celiakii, v případě IgE-zprostředkované hypersenzitivní reakce nálezu dominuje eozinofilní zánětlivý infiltrát proprie (93-95).
Autoimunitní enteropatie (AIE) jsou z uvedených imunopatologických onemocnění nejvzácnější. Jde o heterogenní skupinu chorob projevujících se (běžnou terapií) neovlivnitelnými těžkými průjmy způsobenými imunitně zprostředkovaným poškozením sliznice, ale lišících se genetickým podkladem i histopatologickým nálezem. V současné době se rozeznává v této skupině onemocnění 5 klinických podkategorií: primární pediatrická AIE, syndromická AIE, primární adultní (sporadická) AIE, sekundární iatrogenní adultní AIE a paraneoplastická AIE (96). Většinou jsou postiženy děti a navzdory původním názorům (založeným na zjednodušené hypotéze, že imunodeficience vylučuje možnost autoimunitní reakce) je AIE často asociována s některou z primárních imunodeficiencí (97-99). Obraz podobný celiakii je druhou nejčastější morfologickou prezentací AIE v duodenu, vyskytující se asi ve 20 % případů (98-100). Uvádí se, že diagnózu AIE podporuje průkaz protilátek proti enterocytům a/nebo proti pohárkovým buňkám, ale anti-enterocytární protilátky jsou negativní až polovině případů AIE a protilátky proti pohárkovým buňkám až v 70 % (98-100). Navíc se (i když v nižších koncentracích) mohou vyskytovat i za jiných stavů, jako při celiakii (101), IBD (102,103) nebo u pacientů s infekcí HIV (104). A naopak, protilátky proti tkáňové transglutamináze byly prokázány i v některých případech AIE (98). Deplece až absence Panethových a/nebo pohárkových buněk, další literárně oblíbený diagnostický znak AIE, je podobně nespolehlivý, vyskytuje se maximálně v 60 % případů (98-100).
Infekční onemocnění
Z protozoárních infekcí již byla výše zmíněna Giardia lamblia v souvislosti s CVID. Predispozice k infekci je však zvýšená i za jiných imunodeficientních stavů (např. při selektivním deficitu IgA nebo při infekci HIV). V asociaci s imunodeficitem je také častější chronický průběh infekce a rozvoj malabsorpčního syndromu (105). Ačkoli Česká republika nepatří mezi oblasti s endemickým výskytem giardiázy, vzhledem k rozvoji turistiky je Giardia lamblia jedním z důvodů, proč u pacientů s CVID (i s pouhým podezřením na možnost této diagnózy) pečlivě vyšetřit i povrch duodenální sliznice, i když bohužel Giardia v praxi nemívá dokonale vyjádřenou charakteristickou morfologii známou z učebnic a spolehlivé potvrzení diagnózy tak často vyžaduje ještě kultivační průkaz ve stolici. Podobně se může obrazem podobným celiakii projevovat chronická infekce Cryptosporidium parvum u pacientů s AIDS, ale i při imunodeficienci jiného původu (105).
Virové infekce, především noroviry, jsou podezřívány z toho, že mohou vyvolat enteropatii napodobující celiakii (tzv. „self-limited celiac-like enteropathy“) s uzdravením do 6 měsíců (106-109).
K syndromu bakteriálního přerůstání (small intestinal bacterial overgrowth, SIBO), definovanému jako zvýšený počet a/ nebo abnormální složení bakterií v horní části gastrointestinálního traktu, predisponují stavy vedoucí ke snížení střevní motility, anatomické abnormality střeva, zvýšení pH žaludeční šťávy, onemocnění pankreatu, jater a ledvin, a imunodeficientní stavy (110,111). Duodenální sliznice může být morfologicky intaktní, může však být také přítomno oploštění klků a intraepiteliální lymfocytóza, ačkoli většinou s více vyjádřenou fokalitou distribuce než při celiakii (74,112-114). Problémem je, že mezi příčiny SIBO patří i celiakie, takže může docházet ke kombinaci příznaků a k nedostatečné odpovědi na bezglutenovou dietu (115,116).
Pro infekční etiologii tropické sprue svědčí její výskyt v tropických oblastech s vysokou incidencí gastrointestinálních infekcí a účinnost širokospektrých antibiotik (v kombinaci s foláty a vitamínem B12) (117-121). Postižení duodena je obdobné jako při celiakii, lze však očekávat výraznější zánětlivý infiltrát. Na rozdíl od celiakie je také postiženo ileum. S postižením ilea též souvisí deficit vitamínu B12, který u celiakie nebývá. Diagnózu tropické sprue dále podporuje cestovatelská anamnéza, negativní průkaz anti-tTG protilátek a účinnost antibiotické léčby (122-124).
Kolagenní sprue
Definujícím znakem kolagenní sprue je přítomnost ztluštělého subepiteliálního pruhu kolagenu, pro nějž platí stejná kritéria jako v případě kolagenní gastritidy (diskutované v článku Diferenciální diagnostika nenádorových onemocnění žaludku v tomto čísle), tedy diskutabilní kvantitativní kritérium tloušťky alespoň 10 μm a kvalitativní kritéria zahrnující nepravidelnost hranice kolagenního pruhu, jeho infiltrace zánětlivými buňkami a zavzetí kapilár do jeho hmoty), spolu s intraepiteliální lymfocytózou, atrofií klků a lymfoplazmocytární celulizací proprie, často s výraznější příměsí eozinofilů (125). Pouze asi čtvrtina případů představuje variantu celiakie (se zvýšeným zastoupením v kategorii refrakterní celiakie), ostatní jsou asociovány s farmakoterapií (zejména sartany), poruchami imunity (např. CVID) nebo jsou součástí kolagenóz (3,79,126-130).
2. AKTIVNÍ CHRONICKÁ DUODENITIDA
Obraz aktivní chronické duodenitidy je charakterizován zánětlivou lymfoplazmocytární infiltrací proprie s příměsí neutrofilů a eozinofilů, která bývá doprovázena různě významnou atrofií klků. V souvislosti s infiltrací neutrofily se může vyskytovat i kryptitida a kryptové abscesy. Nebývá přítomna intraepiteliální lymfocytóza, i když ložiskově mohou být zastiženy nápadnější shluky intraepiteliálních lymfocytů. Zánětlivá infiltrace proprie i architektonické změny mohou vykazovat ložiskovou alternaci intenzity. Mohou být přítomny i epiteloidní granulomy.
Idiopatický střevní zánět (inflammatory bowel disease, IBD)
Postižení duodena Crohnovou chorobou je celkem pochopitelné a očekávatelné, vyskytuje se asi u čtvrtiny pacientů s tímto onemocněním (131). Postižení sliznice mívá charakteristicky ložiskový charakter, granulomy bohužel bývají přítomny pouze asi v desetině případů (obr. 3) (132). Přestože ulcerózní kolitida by dle názvu měla postihovat pouze tlusté střevo, zánětlivé změny mohou být přítomny i v duodenu (přibližně v 10 % případů). Jejich charakter je podobný jako v tlustém střevě, tedy difúzní chronická zánětlivá sliznice s bazální plazmocytózou, kryptitidou, kryptovými abscesy a narušením architektoniky klků a krypt (133,134).
Obr. 3. Postižení duodena Crohnovou chorobou. 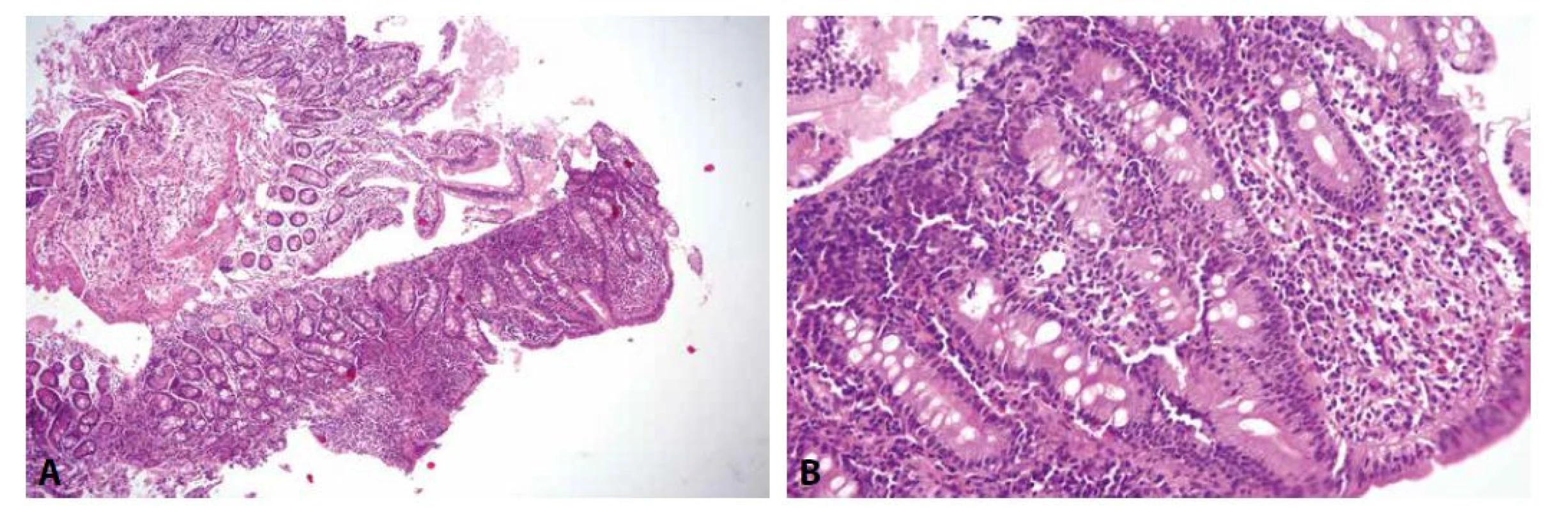
Charakteristickým projevem Crohnovy choroby v duodenu je fokální aktivní chronická duodenitida, která je již v přehledném zvětšení patrná jako výrazná heterogenita vzhledu jednotlivých vzorků či segmentů jednoho vzorku v preparátu (A; HE, 100x). Ve větším zvětšení jsou patrné fokusy akcentace zánětlivé celulizace, hlavně v bazální části proprie, často s příměsí neutrofilů, případně i kryptitidou. Granulomy většinou zastiženy nejsou (B; HE, 200x). Peptická duodenitida
Peptická duodenitida asociovaná s helicobacterovou gastritidou a s intraepiteliální lymfocytózou byla popsána výše. Jiné příčiny hyperacidity žaludeční šťávy (např. Zollinger-Ellisonův syndrom) však nemusí indukovat intraepiteliální lymfocytózu, takže se pak projevují obrazem zahrnujícím poškození epitelu, smíšenou zánětlivou celulizaci proprie, v těžších případech i gastrickou metaplázii, hyperplázii Brunnerových žlázek, a atrofii klků (obr. 4) (67,135).
Obr. 4. Peptická duodenitida. 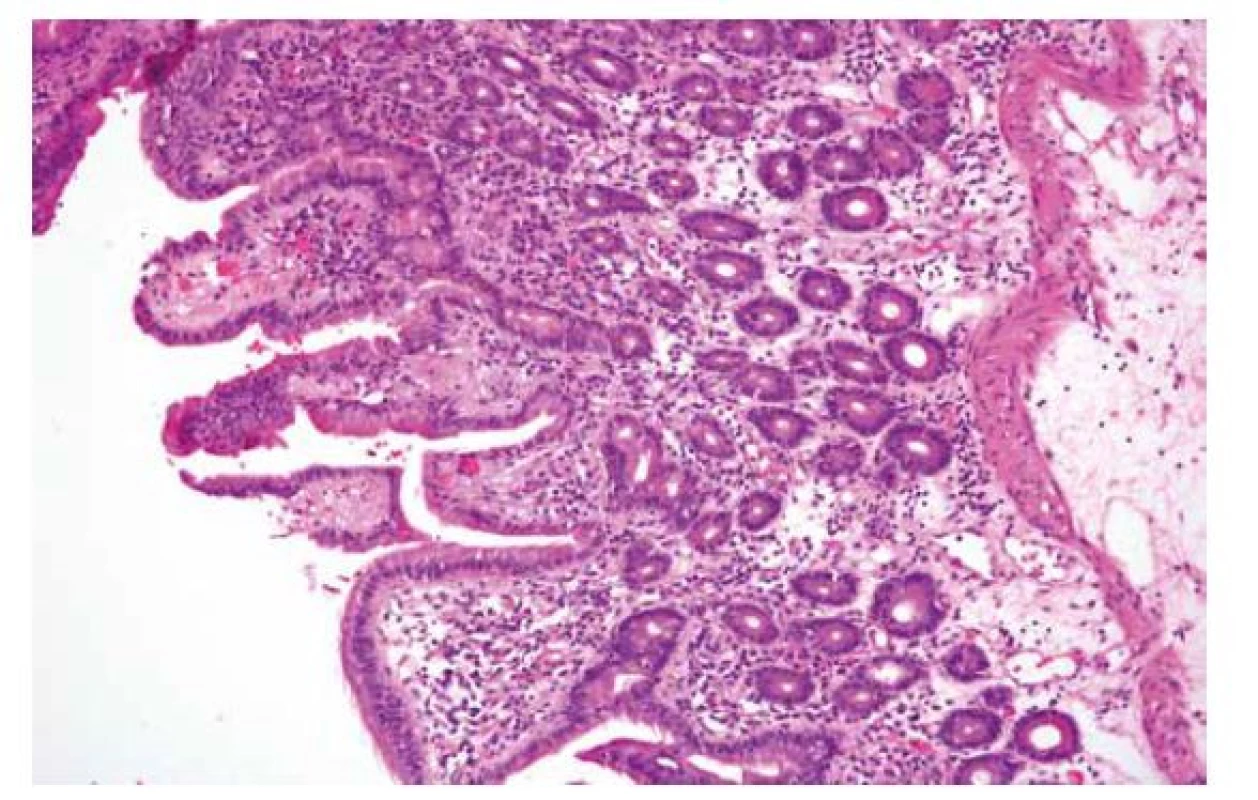
V tomto případě peptické duodenitidy za gastroenteroanastomózou po resekci žaludku 1. typu jsou přítomny především ložiskové regresivní změny epitelu klků, fokální atrofie klků, edém a mírná smíšená zánětlivá celulizace proprie. Na rozdíl od peptického poškození asociovaného s helicobacterovou infekcí není přítomna intraepiteliální lymfocytóza (HE; 180x). Polékové duodenopatie/duodenitidy
Nesteroidní antirevmatika nemusí vždy vést k obrazu připomínajícímu celiakii, někdy bývá přítomna smíšená zánětlivá celulizace proprie s povrchovými erozemi, bez signifikantní intraepiteliální lymfocytózy (136,137).
Imunomodulační protinádorové léky, jak bylo uvedeno výše, se někdy prezentují zánětlivou celulizací proprie bez signifikantní intraepiteliální lymfocytózy, spíše s infiltrací epitelu neutrofily, někdy dokonce s přítomností granulomů (82,83).
Imunopatologická onemocnění
Běžná variabilní imunodeficience (common variable immunodeficiency, CVID) se v nečetných případech může projevovat i nevýrazným narušením architektoniky duodenální sliznice bez intraepiteliální lymfocytózy, s chronickou zánětlivou celulizací proprie, někdy dokonce s tvorbou granulomů, takže nález může připomínat prezentaci IBD v duodenu. V typických případech je však v zánětlivém infiltrátu redukována přítomnost plazmatických buněk, případně tyto zcela chybí (89).
Autoimunitní enteropatie (AIE) byly detailněji popsány výše v souvislosti s morfologickým obrazem charakteru celiakie, který je jejich druhým nejčastějším projevem. Ještě častější jsou případy autoimunitní enteropatie odpovídající histologicky aktivní chronické duodenitidě bez signifikantní intraepiteliální lymfocytózy a markantní apoptotické aktivity. Součástí tohoto obrazu může být i kryptitida a kryptové abscesy (98-100,138).
Infekční onemocnění
Obraz aktivní chronické duodenitidy samozřejmě může doprovázet různé akutní i protrahovaně probíhající infekce, především virového a bakteriálního původu. Nicméně, není-li doprovázen specifičtějšími znaky (např. virovými inkluzemi), neumožňuje bližší etiologickou diagnózu (obr. 5). Kromě samostatných infekčních enteritid se tímto obrazem může prezentovat i SIBO, pokud v epitelovém kompartmentu dominuje infiltrace neutrofily místo intraepiteliální lymfocytózy (113,115).
Obr. 5. Cytomegalovirová duodenitida. 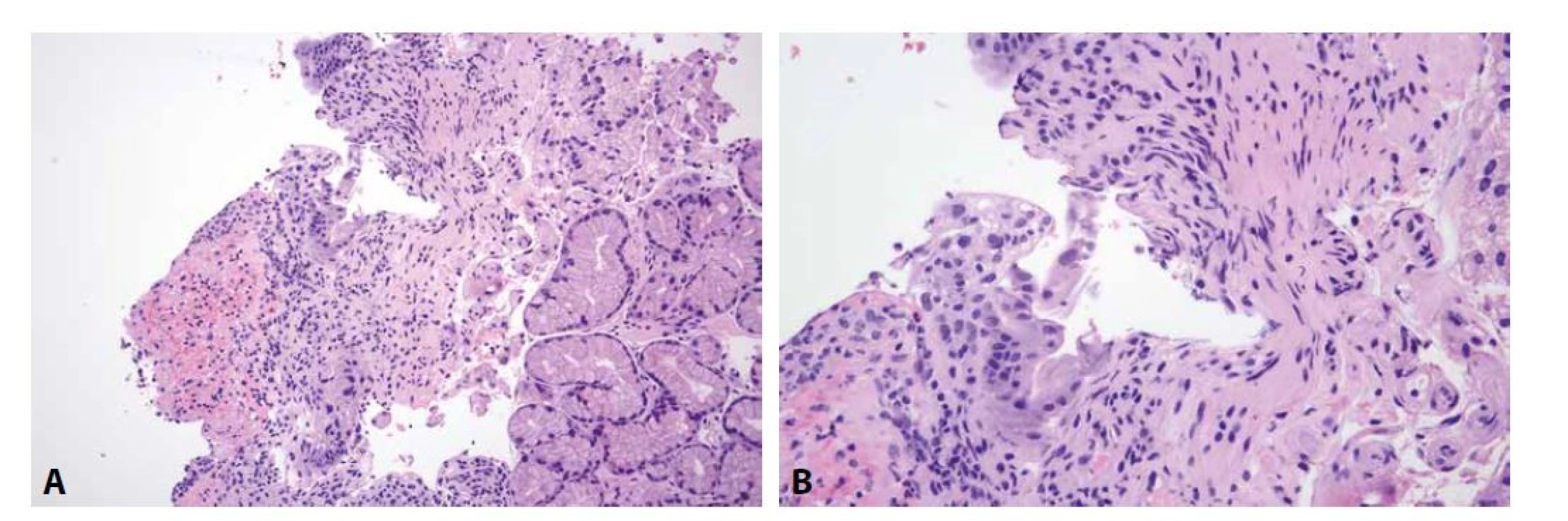
Ve spodině ulcerace je mírná smíšená zánětlivá celulizace, v okolí atypie epitelových i některých mezenchymálních buněk (A; HE, 150x). Suspekce na přítomnost virových inkluzí však nemohla být s jistotou konfirmována ani ve velkém zvětšení (B; HE, 250x). Přítomnost CMV byla potvrzena molekulárně genetickým vyšetřením. 3. OBRAZ CHARAKTERU AKUTNÍ GVHD
Tento obraz by se dal také označit jako obraz apoptotické enteropatie, protože jeho hlavním znakem je signifikantní zvýšení apoptotické aktivity, v těžších stupních i se zánikem krypt až jejich vymizením a ulcerací sliznice, samozřejmě s doprovodným oploštěním klků. Naopak zánětlivá celulizace proprie nebývá významně zvýšena, často sliznice působí spíše hypocelulárním dojmem (139). Abnormální apoptotická aktivita byla v několika studiích stanovena jako > 2/100 krypt (zatímco fyziologicky k apoptóze dochází na vrcholcích klků) (140-143). Samotné zvýšení apoptotické aktivity není nikterak specifické, může doprovázet i jiné morfologické obrazy. Vyskytuje se např. v některých případech IBD, při celiakii nebo některých infekčních onemocněních, zejména infekci CMV nebo adenoviry (141,144-147). Je tedy nutné posuzovat apoptotickou aktivitu v kontextu celkového obrazu.
GvHD
Reakce štěpu proti hostiteli je samozřejmě prototypickým zástupcem této skupiny stavů, nicméně vzhledem k tomu, že duodenální biopsie nebývají za této situace standardním diagnostickým výkonem, nepatří mezi nejčastější duodenální onemocnění prezentující se tímto obrazem. Stanovení této diagnózy pochopitelně podmiňuje anamnestický údaj o transplantaci (a to nejen hemopoetických kmenových buněk, ale i solidních orgánů, vzácně dokonce i v případě autotransplantace).
Polékové duodenopatie/duodenitidy
Nesteroidní antirevmatika mohou způsobit zvýšený apoptotický zánik buněk krypt, což v kombinaci s častou doprovodnou ischemizací sliznice vede i k degeneraci krypt a hypocelularitě proprie, tedy k obrazu připomínajícímu GvHD.
Mycofenolát, který se používá k prevenci rejekce solidních orgánových transplantátů i GvHD, patří mezi příčiny apoptotické enteropatie, což je obzvláště nepříjemné v situaci, kdy připadá u pacienta v úvahu možnost jak GvHD, tak mycofenolátové toxicity. Mycofenolát je však častěji než GvHD asociován se zánětlivou celulizací proprie, někdy i s intraepiteliální lymfocytózou (140,141,148). GvHD se také projevuje dříve než mycofenolátová toxicita, navíc i v extraintestinálních lokalizacích (149).
Cytoreduktivní chemoterapie vyvolává změny podobné GvHD, které by však neměly, na rozdíl od GvHD, přetrvávat 3 týdny po indukci (150).
Z imunomodulačních protinádorových léků bylo zvýšení apoptotické aktivity v duodenální sliznici popsáno pouze v několika případech léčených anti-PD1 protilátkami, i v nich byl však tento znak doprovázen signifikantní zánětlivou celulizací proprie (83).
Imunopatologická onemocnění
CVID se kromě výše uvedených obrazů může projevovat i obrazem napodobujícím GvHD (88,151), podobně jako minoritní skupina případů AIE detailněji popsané výše (96,100).
4. ENTERITIDA S DOMINANTNÍ ÚČASTÍ EOZINOFILŮ
Eozinofilní granulocyty jsou normální součástí duodenální sliznice, kde se vyskytují zejména v hlubší zóně proprie mezi kryptami, přičemž jejich počet vykazuje individuální, geografické a sezónní rozdíly (152-155). V duodenu byla eozinofilie definována jako počet eozinofilů > 22/5 HPF u dospělých (156) a > 10/HPF u dětí (157). Nicméně, pro stanovení eozinofilní zánětlivé infiltrace duodenální sliznice by měla být kvantitativně definovaná eozinofilie doplněna také kvalitativními znaky, mezi něž patří degranulace eozinofilů, tvorba klastrů eozinofilů až eozinofilních mikroabscesů a atypická lokalizace eozinofilů (v povrchové proprii, v epitelu nebo uvnitř krypt) (158).
Primární eozinofilní gastroenteritida je, kromě výše uvedených obecných kritérií duodenální slizniční eozinofilie, definována dominancí eozinofilů v zánětlivém infiltrátu bez signifikantního zvýšení zastoupení jiných typů buněk zánětlivého infiltrátu. Jako dolní hranice počtu eozinofilů pro tuto diagnózu se většinou uvádí > 20 eozinofilů/HPF alespoň v jednom vzorku (159,160). Samozřejmě je také nutné vyloučit možné známé příčiny eozinofilie, tedy sekundární eozinofilní gastroenteritidu.
Sekundární eozinofilní gastroenteritida je asociovaná se známou příčinou. Tou může být specifická alergická reakce zprostředkovaná IgE (hypersenzitivní reakce I. typu), ale i celiakie, při níž také může být signifikantně zvýšený počet slizničních eozinofilů (40,161). Z dalších imunopatologických onemocnění jde především o IBD (významněji při Crohnově chorobě než při ulcerózní kolitidě); vaskulitidy, zejména eozinofilní granulomatózu s polyangiitidou (162); a systémová onemocnění pojiva, která se mohou manifestovat i postižením hlubších vrstev střevní stěny, jež nemusí být v endoskopické biopsii zastiženy (163). Konečně je nutné vyloučit možnost eozinofilní infiltrace asociované s nádorem, ať již přímo nádorovou proliferací eozinofilů (164), nebo jinými nádory, typicky systémovou mastocytózou (165-168), méně významně různými lymfomy, ale i karcinomy. Jako znak toxicity léků byla eozinofilie duodenální sliznice popsána při užívání mycofenolátu (140, 141,148), sartanů (78), tacrolimu (169), enalaprilu (170) nebo preparátů zlata (171). Z infekčních onemocnění lze signifikantní eozinofilní zánětlivý infiltrát zastihnout zejména při parazitárních infekcích, v našich podmínkách nejspíše při enterobióze, askarióze, trichinelóze či strongyloidóze (172,173), vzhledem ke vzrůstající oblibě sushi restaurací i anisakiáze (174). U pacientů s AIDS se lze i ve střední Evropě setkat s isosporiázou (175), u cestovatelů i s ancylostomiázou (176) nebo schistosomiázou (177).
5. ENTERITIDA S DOMINANTNÍ ÚČASTÍ MAKROFÁGŮ
Infiltrace střevní sliznice makrofágy, resp. histiocyty, může mít ložiskový charakter s tvorbou granulomů, anebo může jít o difúzní infiltraci, při níž makrofágy vytvářejí plošné špatně ohraničené infiltráty.
Granulomy a granulomatózní enteritida
Problematika granulomů ve sliznici duodena se neliší významně od žaludeční lokalizace, proto zde pouze odkazujeme na příslušnou pasáž v předcházejícím článku Diferenciální diagnostika nenádorových onemocnění žaludku.
Difúzní histiocytární infiltráty
Whippleova choroba je ve své klasické formě charakteristická postižením sliznice tenkého střeva, která má rozšířené a oploštělé klky, a jejíž proprie je plošně infiltrována pěnitými makrofágy, jejichž cytoplazma je vyplněna PAS-pozitivními srpkovitými granuly představujícími heterolyzozómy obsahující fagocytované mikroorganismy Tropheryma whipplei (obr. 6) (178). K potvrzení etiologického agens se užívalo ultrastrukturálního průkazu těchto actinobakterií s charakteristickou trojvrstevnou stěnou (179). Dnes je za zlatý standard konfirmace Whippleovy choroby považována detekce sekvence DNA kódující bakteriální 16S rRNA (180, 181). Jsou sice k dispozici i protilátky k imunohistochemické detekci Tropheryma whipplei, které však nerozlišují mezi živými a mrtvými mikroorganismy (182). Vzácněji histiocyty při Whippleově chorobě netvoří difúzní infiltráty, ale nekaseifikující granulomy, zejména v extraintestinálních lokalizacích, což může vést k mylné diagnóze sarkoidózy (183,184). Další diagnostickou komplikací může být významná redukce počtu slizničních makrofágů, jejich PAS-pozitivity i IHC pozitivity způsobená antibiotickou terapií podávanou z jiného důvodu (182,185).
Obr. 6. Whippleova choroba. 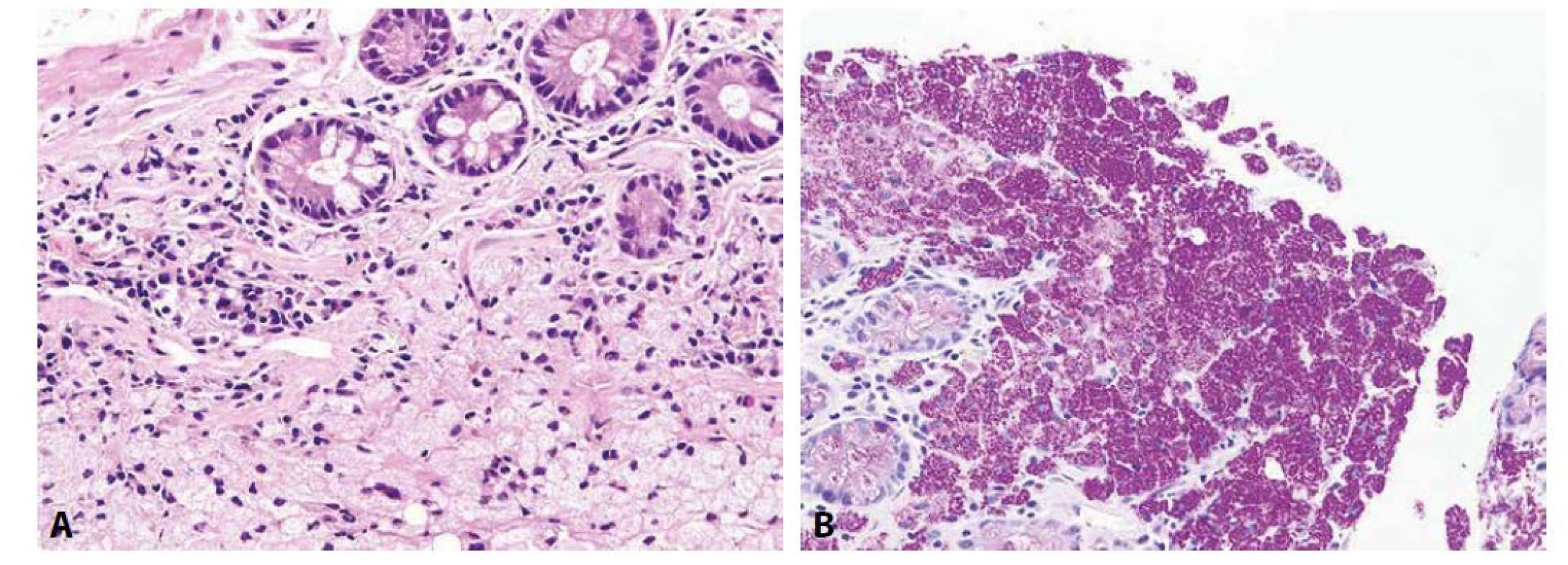
Lamina propria duodenální sliznice je rozsáhle prostoupena pěnitými makrofágy (A; HE, 200x). Cytoplazma těchto makrofágů je vyplněna PAS-pozitivními globulárními inkluzemi (B; PAS, 200x). Atypická mykobakterióza, kterou nejčastěji způsobuje Mycobacterium avium-intracellulare komplex, je u imunosuprimovaných pacientů také charakterizována plošnými infiltráty pěnitých PAS-pozitivních makrofágů, které jsou navíc (na rozdíl od Whippleovy choroby) také pozitivní v průkazu acidorezistentních bakterií barvením podle Ziehl-Neelsena (186).
Mezi další, vzácnější příčiny infiltrace intestinální sliznice makrofágy patří kromě infekčních onemocnění, jako je histoplazmóza (187), viscerální leishmanióza (188) nebo extrapulmonální pneumocystóza (189), také dědičné poruchy metabolismu, což je již téma zcela mimo rámec tohoto krátkého přehledu (190).
6. NEZÁNĚTLIVÁ ENTEROPATIE
Tento čistě popisný a ve svém širokém významovém smyslu málo specifický název byl zvolen pro skupinu kongenitálních enteropatií, které vznikají na genetickém podkladě, manifestují se chronickými a (běžnou léčbou) neovlivnitelnými průjmy, a to většinou již v prvních týdnech po narození, přičemž morfologické změny v konvenčním barvení mohou být minimální. Do této kategorie lze zařadit 3 patogenetické skupiny onemocnění: poruchy trávení, absorpce a dalšího transportu živin; poruchy diferenciace a polarizace enterocytů; a poruchy diferenciace enteroendokrinních buněk (191). Duodenální biopsie s využitím imunohistochemického panelu obsahujícího protilátky proti CD10, EpCAM a chromograninu se může významně uplatnit v diagnostice mikrovilózní inkluzní choroby, chomáčovité enteropatie a dysgeneze enteroendokrinních buněk (192).
Mikrovilózní inkluzní choroba (microvillous inclusion disease, MID) se v konvenčním histologickém barvení duodenální sliznice projevuje nespecifickým obrazem oploštění klků bez hyperplázie krypt a bez zánětlivé infiltrace. Imunohistochemický průkaz CD10 je charakteristický ztrátou kartáčového lemu, výraznějším zbarvením apikální cytoplazmy enterocytů a intracelulární akumulací inkluzních tělísek (193,194). Ultrastrukturálně je patrné narušení organizace mikroklků na povrchu enterocytů a přítomnost intracytoplazmatických vakuol obsahujících mikroklky (195). Molekulárně genetické vyšetření ve většině případů prokázalo mutaci MYO5B (196).
Chomáčovitá enteropatie (tufting enteropathy, intestinal epithelial dysplasia) má poněkud nápadnější obraz než MID. Je přítomna atrofie klků a hyperplázie krypt, přičemž ložiskově dochází k vzájemnému „namačkání“ enterocytů s apikálním vysunutím jejich jader, což vede k tvorbě drobných epitelových „chomáčků“ vyčnívajících ze slizničního povrchu. Zánětlivá celulizace opět chybí (197). Difúzní ztráta exprese proteinu EpCAM na membráně enterocytů při tomto onemocnění (192,198) odpovídá molekulárnímu podkladu chomáčovité enteropatie, mutaci genu EPCAM (199).
Dysgeneze enteroendokrinních buněk nevykazuje prakticky žádné histologické změny v základním barvení hematoxylinem a eozinem, imunohistochemický průkaz chromograninu však snadno ozřejmí přítomnou výraznou redukci až absenci enteroendokrinních buněk podmíněnou mutací NEUROG3 (200).
ZÁVĚR
Diferenciální diagnostice nenádorových onemocnění duodena v endoskopických biopsiích dominuje problematika celiakie. Nicméně i v případě histopatologického obrazu odpovídajícího gluten-senzitivní enteropatii je třeba mít na paměti jeho nízkou specificitu a vždy zohledňovat klinické informace a výsledky serologických, mikrobiologických a genetických vyšetření. Mezi nejvýznamnější stavy, které je třeba v první řadě zvažovat v případě zánětlivého postižení duodenální sliznice, patří kromě celiakie idiopatické střevní záněty, projevy imunodeficience a nežádoucí účinky farmakoterapie.
PODĚKOVÁNÍ
Tento výstup vznikl v rámci projektu Specifického vysokoškolského výzkumu 2020-2022 č. 260 539.
ACKNOWLEDGEMENT
The work was supported by the grant SVV–2020-2022 No 260 539.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i spoluautorů.
Adresa pro korespondenci:
prof. MUDr. Ondřej Daum, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Edvarda Beneše 1128/13, 305 99 Plzeň
tel.: 377 402 523
fax.: 377 402 634
email: DAUM@fnplzen.cz
Zdroje
1. Korn ER, Foroozan P. Endoscopic biopsies of normal duodenal mucosa. Gastrointest Endosc 1974; 21(2): 51-54.
2. Kreuning J, Bosman FT, Kuiper G, Wal AM, Lindeman J. Gastric and duodenal mucosa in ‘healthy’ individuals. An endoscopic and histopathological study of 50 volunteers. J Clin Pathol 1978; 31(1): 69-77.
3. Brown I, Bettington M, Rosty C. The role of histopathology in the diagnosis and management of coeliac disease and other malabsorptive conditions. Histopathology 2021; 78(1): 88-105.
4. Hayat M, Cairns A, Dixon MF, O’Mahony S. Quantitation of intraepithelial lymphocytes in human duodenum: what is normal? J Clin Pathol 2002; 55(5): 393-394.
5. Mahadeva S, Wyatt JI, Howdle PD. Is a raised intraepithelial lymphocyte count with normal duodenal villous architecture clinically relevant? J Clin Pathol 2002; 55(6): 424-428.
6. Biagi F, Luinetti O, Campanella J, et al. Intraepithelial lymphocytes in the villous tip: do they indicate potential coeliac disease? J Clin Pathol 2004; 57(8): 835-839.
7. Veress B, Franzen L, Bodin L, Borch K. Duodenal intraepithelial lymphocyte-count revisited. Scand J Gastroenterol 2004; 39(2): 138-144.
8. Pellegrino S, Villanacci V, Sansotta N, et al. Redefining the intraepithelial lymphocytes threshold to diagnose gluten sensitivity in patients with architecturally normal duodenal histology. Aliment Pharmacol Ther 2011; 33(6): 697-706.
9. Rostami K, Marsh MN, Johnson MW, et al. ROC-king onwards: intraepithelial lymphocyte counts, distribution & role in coeliac disease mucosal interpretation. Gut 2017; 66(12): 2080-2086.
10. Goldstein NS, Underhill J. Morphologic features suggestive of gluten sensitivity in architecturally normal duodenal biopsy specimens. Am J Clin Pathol 2001; 116(1): 63-71.
11. Ensari A. Gluten-sensitive enteropathy (celiac disease): controversies in diagnosis and classification. Arch Pathol Lab Med 2010; 134(6): 826-836.
12. Owen DR, Owen DA. Celiac disease and other causes of duodenitis. Arch Pathol Lab Med 2018; 142(1): 35-43.
13. Ferguson A, Murray D. Quantitation of intraepithelial lymphocytes in human jejunum. Gut 1971; 12(12): 988-994.
14. Ferguson A. Intraepithelial lymphocytes of the small intestine. Gut 1977; 18(11): 921-937.
15. Marsh MN. Gluten, major histocompatibility complex, and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity (‘celiac sprue’). Gastroenterology 1992; 102(1): 330-354.
16. Crowe PT, Marsh MN. Morphometric analysis of intestinal mucosa. VI--Principles in enumerating intra-epithelial lymphocytes. Virchows Arch 1994; 424(3): 301-306.
17. Jarvinen TT, Collin P, Rasmussen M, et al. Villous tip intraepithelial lymphocytes as markers of early-stage coeliac disease. Scand J Gastroenterol 2004; 39(5): 428-433.
18. Karabork BA, Yuksel S, Savas B, Ensari A. IEL counts and distribution in normal duodenum, non-GSE IELosis and GSE: Do we need a cut-off? Virchows Arch 2012; 461(Suppl. 1): S9.
19. Yantiss RK, Odze RD. Optimal approach to obtaining mucosal biopsies for assessment of inflammatory disorders of the gastrointestinal tract. Am J Gastroenterol 2009; 104(3): 774 - 783.
20. Sharaf RN, Shergill AK, Odze RD, et al. Endoscopic mucosal tissue sampling. Gastrointest Endosc 2013; 78(2): 216-224.
21. Rubio-Tapia A, Hill ID, Kelly CP, Calderwood AH, Murray JA. ACG clinical guidelines: diagnosis and management of celiac disease. Am J Gastroenterol 2013; 108(5): 656-676.
22. Ludvigsson JF, Bai JC, Biagi F, et al. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut 2014; 63(8): 1210-1228.
23. Allen JI, Katzka D, Robert M, Leontiadis GI. American Gastroenterological Association Institute technical review on the role of upper gastrointestinal biopsy to evaluate dyspepsia in the adult patient in the absence of visible mucosal lesions. Gastroenterology 2015; 149(4): 1088-1118.
24. Robert ME, Crowe SE, Burgart L, et al. Statement on best practices in the use of pathology as a diagnostic tool for celiac disease: a guide for clinicians and pathologists. Am J Surg Pathol 2018; 42(9): e44-e58.
25. Bonamico M, Mariani P, Thanasi E, et al. Patchy villous atrophy of the duodenum in childhood celiac disease. J Pediatr Gastroenterol Nutr 2004; 38(2): 204-207.
26. Drut R, Rua EC. Histopathologic diagnosis of celiac disease in children without clinical evidence of malabsorption. Int J Surg Pathol 2007; 15(4): 354-357.
27. Bonamico M, Thanasi E, Mariani P, et al. Duodenal bulb biopsies in celiac disease: a multicenter study. J Pediatr Gastroenterol Nutr 2008; 47(5): 618-622.
28. Gonzalez S, Gupta A, Cheng J, et al. Prospective study of the role of duodenal bulb biopsies in the diagnosis of celiac disease. Gastrointest Endosc 2010; 72(4): 758-765.
29. Evans KE, Aziz I, Cross SS, et al. A prospective study of duodenal bulb biopsy in newly diagnosed and established adult celiac disease. Am J Gastroenterol 2011; 106(10): 1837 - 1742.
30. Kurien M, Evans KE, Hopper AD, et al. Duodenal bulb biopsies for diagnosing adult celiac disease: is there an optimal biopsy site? Gastrointest Endosc 2012; 75(6): 1190-1196.
31. Mooney PD, Kurien M, Evans KE, et al. Clinical and immunologic features of ultra-short celiac disease. Gastroenterology 2016; 150(5): 1125-1134.
32. Taavela J, Popp A, Korponay-Szabo IR, et al. A prospective study on the usefulness of duodenal bulb biopsies in celiac disease diagnosis in children: urging caution. Am J Gastroenterol 2016; 111(1): 124-133.
33. McCarty TR, O’Brien CR, Gremida A, Ling C, Rustagi T. Efficacy of duodenal bulb biopsy for diagnosis of celiac disease: a systematic review and meta-analysis. Endosc Int Open 2018; 6(11): e1369-e1378.
34. Oberhuber G, Granditsch G, Vogelsang H. The histopathology of coeliac disease: time for a standardized report scheme for pathologists. Eur J Gastroenterol Hepatol 1999; 11(10): 1185-1194.
35. Corazza GR, Villanacci V, Zambelli C, et al. Comparison of the interobserver reproducibility with different histologic criteria used in celiac disease. Clin Gastroenterol Hepatol 2007; 5(7): 838-843.
36. Ozakinci H, Kirmizi A, Savas B, et al. Classification chaos in coeliac disease: Does it really matter? Pathol Res Pract 2016; 212(12): 1174 - 1178.
37. Daum O. Patologie GIT. In: Zámečník J, ed. Patologie (1 ed). Prague: LD, s.r.o. - PRAGER PUBLISHING; 2019 : 461-526.
38. Švajdler Jr. M, Bohuš P, Rychlý B. Histopatologická diagnóza a diferenciálna diagnóza céliakie: prehlad pre gastroenterológov. Čes a Slov Gastroent a Hepatol 2010; 64(3): 24-30.
39. Moran CJ, Kolman OK, Russell GJ, Brown IS, Mino-Kenudson M. Neutrophilic infiltration in gluten-sensitive enteropathy is neither uncommon nor insignificant: assessment of duodenal biopsies from 267 pediatric and adult patients. Am J Surg Pathol 2012; 36(9): 1339-1345.
40. Brown IS, Smith J, Rosty C. Gastrointestinal pathology in celiac disease: a case series of 150 consecutive newly diagnosed patients. Am J Clin Pathol 2012; 138(1): 42-49.
41. Wakim-Fleming J, Pagadala MR, Lemyre MS, et al. Diagnosis of celiac disease in adults based on serology test results, without small-bowel biopsy. Clin Gastroenterol Hepatol 2013; 11(5): 511-516.
42. Tursi A, Brandimarte G, Giorgetti G, et al. Low prevalence of antigliadin and anti-endomysium antibodies in subclinical/silent celiac disease. Am J Gastroenterol 2001; 96(5): 1507 - 1510.
43. Brown I, Mino-Kenudson M, Deshpande V, Lauwers GY. Intraepithelial lymphocytosis in architecturally preserved proximal small intestinal mucosa: an increasing diagnostic problem with a wide differential diagnosis. Arch Pathol Lab Med 2006; 130(7): 1020-1025.
44. Meini A, Pillan NM, Villanacci V, et al. Prevalence and diagnosis of celiac disease in IgA-deficient children. Ann Allergy Asthma Immunol 1996; 77(4): 333-336.
45. Cataldo F, Lio D, Marino V, et al. IgG(1) antiendomysium and IgG antitissue transglutaminase (anti-tTG) antibodies in coeliac patients with selective IgA deficiency. Working Groups on Celiac Disease of SIGEP and Club del Tenue. Gut 2000; 47(3): 366-369.
46. Hadithi M, von Blomberg BM, Crusius JB, et al. Accuracy of serologic tests and HLA-DQ typing for diagnosing celiac disease. Ann Intern Med 2007; 147(5): 294-302.
47. Wolters VM, Wijmenga C. Genetic background of celiac disease and its clinical implications. Am J Gastroenterol 2008; 103(1): 190 - 195.
48. Rishi AR, Rubio-Tapia A, Murray JA. Refractory celiac disease. Expert Rev Gastroenterol Hepatol 2016; 10(4): 537-546.
49. Malamut G, Cellier C. Refractory celiac disease. Gastroenterol Clin North Am 2019; 48(1): 137-144.
50. Abdulkarim AS, Burgart LJ, See J, Murray JA. Etiology of nonresponsive celiac disease: results of a systematic approach. Am J Gastroenterol 2002; 97(8): 2016-2021.
51. Cellier C, Patey N, Mauvieux L, et al. Abnormal intestinal intraepithelial lymphocytes in refractory sprue. Gastroenterology 1998; 114(3): 471-481.
52. Bagdi E, Diss TC, Munson P, Isaacson PG. Mucosal intra-epithelial lymphocytes in enteropathy - associated T-cell lymphoma, ulcerative jejunitis, and refractory celiac disease constitute a neoplastic population. Blood 1999; 94(1): 260-264.
53. Cellier C, Delabesse E, Helmer C, et al. Refractory sprue, coeliac disease, and enteropathy - associated T-cell lymphoma. French Coeliac Disease Study Group. Lancet 2000; 356(9225): 203-208.
54. Farstad IN, Lundin KE. Gastrointestinal intraepithelial lymphocytes and T cell lymphomas. Gut 2003; 52(2): 163-164.
55. Cellier C, Cerf-Bensussan N. Treatment of clonal refractory celiac disease or cryptic intraepithelial lymphoma: A long road from bench to bedside. Clin Gastroenterol Hepatol 2006; 4(11): 1320-1321.
56. O’Shea U, Abuzakouk M, O’Morain C, et al. Investigation of molecular markers in the diagnosis of refractory coeliac disease in a large patient cohort. J Clin Pathol 2008; 61(11): 1200-1202.
57. Celli R, Hui P, Triscott H, et al. Clinical insignificance of monoclonal T-cell populations and duodenal intraepithelial T-cell phenotypes in celiac and nonceliac patients. Am J Surg Pathol 2019; 43(2): 151-160.
58. Catassi C, Elli L, Bonaz B, et al. Diagnosis of non-celiac gluten sensitivity (NCGS): The Salerno experts’ criteria. Nutrients 2015; 7(6): 4966-4977.
59. Molina-Infante J, Carroccio A. Suspected nonceliac gluten sensitivity confirmed in few patients after gluten challenge in double - blind, placebo-controlled trials. Clin Gastroenterol Hepatol 2017; 15(3): 339-348.
60. Zanini B, Villanacci V, Marullo M, et al. Duodenal histological features in suspected non-celiac gluten sensitivity: new insights into a still undefined condition. Virchows Arch 2018; 473(2): 229-234.
61. Zanini B, Bozzola A, Villanacci V. Letter to the Editor. Virchows Arch 2019; 474(5): 639 - 640.
62. Kirmizi A, Ensari A. Morphologic spectrum of gluten-related disorders: how far to go? Virchows Arch 2019; 474(5): 641-642.
63. Memeo L, Jhang J, Hibshoosh H, et al. Duodenal intraepithelial lymphocytosis with normal villous architecture: common occurrence in H. pylori gastritis. Mod Pathol 2005; 18(8): 1134-1144.
64. Nahon S, Patey-Mariaud De Serre N, Lejeune O, et al. Duodenal intraepithelial lymphocytosis during Helicobacter pylori infection is reduced by antibiotic treatment. Histopathology 2006; 48(4): 417-423.
65. Bosch DE, Liu YJ, Truong CD, et al. Duodenal intraepithelial lymphocytosis in Helicobacter pylori gastritis: comparison before and after treatment. Virchows Arch 2021; 478(4): 805 - 809.
66. Aziz I, Evans KE, Hopper AD, Smillie DM, Sanders DS. A prospective study into the aetiology of lymphocytic duodenosis. Aliment Pharmacol Ther 2010; 32(11-12): 1392-1397.
67. Jenkins D, Goodall A, Gillet FR, Scott BB. Defining duodenitis: quantitative histological study of mucosal responses and their correlations. J Clin Pathol 1985; 38(10): 1119-1126.
68. Wyatt JI, Rathbone BJ, Dixon MF, Heatley RV. Campylobacter pyloridis and acid induced gastric metaplasia in the pathogenesis of duodenitis. J Clin Pathol 1987; 40(8): 841 - 848.
69. van de Bovenkamp JH, Mahdavi J, Korteland - Van Male AM, et al. The MUC5AC glycoprotein is the primary receptor for Helicobacter pylori in the human stomach. Helicobacter 2003; 8(5): 521-532.
70. Suriani R, Venturini I, Actis GC, et al. Effect of Helicobacter pylori eradication on bulbitis and duodenal gastric metaplasia. Hepatogastroenterology 2004; 51(55): 176-180.
71. Frezza M, Gorji N, Melato M. The histopathology of non-steroidal anti-inflammatory drug induced gastroduodenal damage: correlation with Helicobacter pylori, ulcers, and haemorrhagic events. J Clin Pathol 2001; 54(7): 521-525.
72. Kakar S, Nehra V, Murray JA, Dayharsh GA, Burgart LJ. Significance of intraepithelial lymphocytosis in small bowel biopsy samples with normal mucosal architecture. Am J Gastroenterol 2003; 98(9): 2027-2033.
73. Lanas A, Sopena F. Nonsteroidal anti-inflammatory drugs and lower gastrointestinal complications. Gastroenterol Clin North Am 2009; 38(2): 333-352.
74. Shmidt E, Smyrk TC, Boswell CL, Enders FT, Oxentenko AS. Increasing duodenal intraepithelial lymphocytosis found at upper endoscopy: time trends and associations. Gastrointest Endosc 2014; 80(1): 105-111.
75. Marthey L, Cadiot G, Seksik P, et al. Olmesartan - associated enteropathy: results of a national survey. Aliment Pharmacol Ther 2014; 40(9): 1103-1109.
76. Choi EY, McKenna BJ. Olmesartan-associated enteropathy: a review of clinical and histologic findings. Arch Pathol Lab Med 2015; 139(10): 1242-1247.
77. Burbure N, Lebwohl B, Arguelles-Grande C, et al. Olmesartan-associated sprue-like enteropathy: a systematic review with emphasis on histopathology. Hum Pathol 2016; 50 : 127 - 134.
78. Kamal A, Fain C, Park A, et al. Angiotensin II receptor blockers and gastrointestinal adverse events of resembling sprue-like enteropathy: a systematic review. Gastroenterol Rep (Oxf) 2019; 7(3): 162-167.
79. Rubio-Tapia A, Herman ML, Ludvigsson JF, et al. Severe spruelike enteropathy associated with olmesartan. Mayo Clin Proc 2012; 87(8): 732-738.
80. Oble DA, Mino-Kenudson M, Goldsmith J, et al. Alpha-CTLA-4 mAb-associated panenteritis: a histologic and immunohistochemical analysis. Am J Surg Pathol 2008; 32(8): 1130 - 1137.
81. Louie CY, DiMaio MA, Matsukuma KE, et al. Idelalisib-associated enterocolitis: clinicopathologic features and distinction from other enterocolitides. Am J Surg Pathol 2015; 39(12): 1653-1660.
82. Zhang ML, Neyaz A, Patil D, et al. Immune - related adverse events in the gastrointestinal tract: diagnostic utility of upper gastrointestinal biopsies. Histopathology 2020; 76(2): 233-243.
83. Gonzalez RS, Salaria SN, Bohannon CD, et al. PD-1 inhibitor gastroenterocolitis: case series and appraisal of ‘immunomodulatory gastroenterocolitis’. Histopathology 2017; 70(4): 558-567.
84. Cunningham-Rundles C, Bodian C. Common variable immunodeficiency: clinical and immunological features of 248 patients. Clin Immunol 1999; 92(1): 34-48.
85. Oksenhendler E, Gerard L, Fieschi C, et al. Infections in 252 patients with common variable immunodeficiency. Clin Infect Dis 2008; 46(10): 1547-1554.
86. Pikkarainen S, Martelius T, Ristimaki A, et al. A high prevalence of gastrointestinal manifestations in common variable immunodeficiency. Am J Gastroenterol 2019; 114(4): 648 - 655.
87. Hermans PE, Diaz-Buxo JA, Stobo JD. Idiopathic late-onset immunoglobulin deficiency. Clinical observations in 50 patients. Am J Med 1976; 61(2): 221-237.
88. Washington K, Stenzel TT, Buckley RH, Gottfried MR. Gastrointestinal pathology in patients with common variable immunodeficiency and X-linked agammaglobulinemia. Am J Surg Pathol 1996; 20(10): 1240-1252.
89. Daniels JA, Lederman HM, Maitra A, Montgomery EA. Gastrointestinal tract pathology in patients with common variable immunodeficiency (CVID): a clinicopathologic study and review. Am J Surg Pathol 2007; 31(12): 1800-1812.
90. Khodadad A, Aghamohammadi A, Parvaneh N, et al. Gastrointestinal manifestations in patients with common variable immunodeficiency. Dig Dis Sci 2007; 52(11): 2977-2983.
91. Malamut G, Verkarre V, Suarez F, et al. The enteropathy associated with common variable immunodeficiency: the delineated frontiers with celiac disease. Am J Gastroenterol 2010; 105(10): 2262-2275.
92. Resnick ES, Moshier EL, Godbold JH, Cunningham - Rundles C. Morbidity and mortality in common variable immune deficiency over 4 decades. Blood 2012; 119(7): 1650 - 1657.
93. Fontaine JL, Navarro J. Small intestinal biopsy in cows milk protein allergy in infancy. Arch Dis Child 1975; 50(5): 357-362.
94. Challacombe DN, Wheeler EE, Campbell PE. Morphometric studies and eosinophil cell counts in the duodenal mucosa of children with chronic nonspecific diarrhoea and cow’s milk allergy. J Pediatr Gastroenterol Nutr 1986; 5(6): 887-891.
95. Garcia-Careaga M, Jr., Kerner JA, Jr. Gastrointestinal manifestations of food allergies in pediatric patients. Nutr Clin Pract 2005; 20(5): 526-535.
96. Umetsu SE, Brown I, Langner C, Lauwers GY. Autoimmune enteropathies. Virchows Arch 2018; 472(1): 55-66.
97. Unsworth DJ, Walker-Smith JA. Autoimmunity in diarrhoeal disease. J Pediatr Gastroenterol Nutr 1985; 4(3): 375-380.
98. Akram S, Murray JA, Pardi DS, et al. Adult autoimmune enteropathy: Mayo Clinic Rochester experience. Clin Gastroenterol Hepatol 2007; 5(11): 1282-1290.
99. Singhi AD, Goyal A, Davison JM, et al. Pediatric autoimmune enteropathy: an entity frequently associated with immunodeficiency disorders. Mod Pathol 2014; 27(4): 543-553.
100. Masia R, Peyton S, Lauwers GY, Brown I. Gastrointestinal biopsy findings of autoimmune enteropathy: a review of 25 cases. Am J Surg Pathol 2014; 38(10): 1319-1329.
101. Biagi F, Bianchi PI, Trotta L, Corazza GR. Anti - goblet cell antibodies for the diagnosis of autoimmune enteropathy? Am J Gastroenterol 2009; 104(12): 3112.
102. Skogh T, Heuman R, Tagesson C. Anti-brush border antibodies (ABBA) in Crohn’s disease. J Clin Lab Immunol 1982; 9(3): 147-150.
103. Fiocchi C, Roche JK, Michener WM. High prevalence of antibodies to intestinal epithelial antigens in patients with inflammatory bowel disease and their relatives. Ann Intern Med 1989; 110(10): 786-794.
104. Martin-Villa JM, Camblor S, Costa R, Arnaiz - Villena A. Gut epithelial cell autoantibodies in AIDS pathogenesis. Lancet 1993; 342(8867): 380.
105. Saraswati R, Rodriguez-Justo M, Novelli M. The upper gastrointestinal tract in the immunosuppressed patient. Diagn Histopathol 2012; 18(10): 437-448.
106. Agus SG, Dolin R, Wyatt RG, Tousimis AJ, Northrup RS. Acute infectious nonbacterial gastroenteritis: intestinal histopathology. Histologic and enzymatic alterations during illness produced by the Norwalk agent in man. Ann Intern Med 1973; 79(1): 18-25.
107. Bishop RF, Davidson GP, Holmes IH, Ruck BJ. Virus particles in epithelial cells of duodenal mucosa from children with acute non-bacterial gastroenteritis. Lancet 1973; 2(7841): 1281-1283.
108. Barnes GL, Townley RR. Duodenal mucosal damage in 31 infants with gastroenteritis. Arch Dis Child 1973; 48(5): 343-349.
109. Brown IS, Bettington A, Bettington M, Rosty C. Self-limited coeliac-like enteropathy: a series of 18 cases highlighting another coeliac disease mimic. Histopathology 2016; 68(2): 254-261.
110. Bures J, Cyrany J, Kohoutova D, et al. Small intestinal bacterial overgrowth syndrome. World J Gastroenterol 2010; 16(24): 2978-2990.
111. Quigley EM, Abu-Shanab A. Small intestinal bacterial overgrowth. Infect Dis Clin North Am 2010; 24(4): 943-959.
112. Riordan SM, McIver CJ, Duncombe VM, et al. Small intestinal bacterial overgrowth and the irritable bowel syndrome. Am J Gastroenterol 2001; 96(8): 2506-2508.
113. Lappinga PJ, Abraham SC, Murray JA, et al. Small intestinal bacterial overgrowth: histopathologic features and clinical correlates in an underrecognized entity. Arch Pathol Lab Med 2010; 134(2): 264-270.
114. Hammer ST, Greenson JK. The clinical significance of duodenal lymphocytosis with normal villus architecture. Arch Pathol Lab Med 2013; 137(9): 1216-1219.
115. Tursi A, Brandimarte G, Giorgetti G. High prevalence of small intestinal bacterial overgrowth in celiac patients with persistence of gastrointestinal symptoms after gluten withdrawal. Am J Gastroenterol 2003; 98(4): 839 - 843.
116. Harrison E, Hayes S, Howell L, Lal S. All that glitters is not always gold. BMJ Case Rep 2014; 2014.
117. Baker SJ, Mathan VI. Syndrome of tropical sprue in South India. Am J Clin Nutr 1968; 21(9): 984-993.
118. Klipstein FA. Tropical sprue in travelers and expatriates living abroad. Gastroenterology 1981; 80(3): 590-600.
119. Nath SK. Tropical sprue. Curr Gastroenterol Rep 2005; 7(5): 343-349.
120. Batheja MJ, Leighton J, Azueta A, Heigh R. The face of tropical sprue in 2010. Case Rep Gastroenterol 2010; 4(2): 168-172.
121. Ramakrishna BS. Tropical sprue: a riddle wrapped in a mystery inside an enigma. Indian J Med Res 2013; 137(1): 12-14.
122. Swanson VL, Thomassen RW. Pathology of the jejunal mucosa in tropical sprue. Am J Pathol 1965; 46(4): 511-551.
123. Schenk EA, Samloff IM, Klipstein FA. Morphologic characteristics of jejunal biopsy in celiac disease and tropical sprue. Am J Pathol 1965; 47(5): 765-781.
124. Brown IS, Bettington A, Bettington M, Rosty C. Tropical sprue: revisiting an underrecognized disease. Am J Surg Pathol 2014; 38(5): 666-672.
125. Maguire AA, Greenson JK, Lauwers GY, et al. Collagenous sprue: a clinicopathologic study of 12 cases. Am J Surg Pathol 2009; 33(10): 1440-1449.
126. Vakiani E, Arguelles-Grande C, Mansukhani MM, et al. Collagenous sprue is not always associated with dismal outcomes: a clinicopathological study of 19 patients. Mod Pathol 2010; 23(1): 12-26.
127. Nielsen JA, Steephen A, Lewin M. Angiotensin - II inhibitor (olmesartan)-induced collagenous sprue with resolution following discontinuation of drug. World J Gastroenterol 2013; 19(40): 6928-6930.
128. Nielsen OH, Riis LB, Danese S, Bojesen RD, Soendergaard C. Proximal collagenous gastroenteritides: clinical management. A systematic review. Ann Med 2014; 46(5): 311-317.
129. Desruisseaux C, Bensoussan M, Desilets E, et al. Adding water to the mill: olmesartan - induced collagenous sprue-a case report and brief literature review. Can J Gastroenterol Hepatol 2016; 2016 : 4837270.
130. Mandaliya R, Burkart AL, DiMarino AJ, Rattan S, Cohen S. Association between common variable immunodeficiency and collagenous infiltrative disorders of the gastrointestinal tract: A series of four patients. Indian J Gastroenterol 2016; 35(2): 133-138.
131. Sonnenberg A, Melton SD, Genta RM. Frequent occurrence of gastritis and duodenitis in patients with inflammatory bowel disease. Inflamm Bowel Dis 2011; 17(1): 39-44.
132. Wright CL, Riddell RH. Histology of the stomach and duodenum in Crohn’s disease. Am J Surg Pathol 1998; 22(4): 383-390.
133. Valdez R, Appelman HD, Bronner MP, Greenson JK. Diffuse duodenitis associated with ulcerative colitis. Am J Surg Pathol 2000; 24(10): 1407-1413.
134. Lin J, McKenna BJ, Appelman HD. Morphologic findings in upper gastrointestinal biopsies of patients with ulcerative colitis: a controlled study. Am J Surg Pathol 2010; 34(11): 1672-1677.
135. Kreuning J, Val AMVD, Kuiper G, Lindeman J. Chronic nonspecific duodenitis. A multiple biopsy study of the duodenal bulb in health and disease. Scand J Gastroenterol 1989; 24(Suppl. 167): 16-20.
136. Bjarnason I, Zanelli G, Smith T, et al. Nonsteroidal antiinflammatory drug-induced intestinal inflammation in humans. Gastroenterology 1987; 93(3): 480-489.
137. Bjarnason I, Zanelli G, Prouse P, et al. Blood and protein loss via small-intestinal inflammation induced by non-steroidal anti-inflammatory drugs. Lancet 1987; 2(8561): 711-714.
138. Patey-Mariaud de Serre N, Canioni D, Ganousse S, et al. Digestive histopathological presentation of IPEX syndrome. Mod Pathol 2009; 22(1): 95-102.
139. Washington K, Jagasia M. Pathology of graft-versus-host disease in the gastrointestinal tract. Hum Pathol 2009; 40(7): 909-917.
140. Parfitt JR, Jayakumar S, Driman DK. Mycophenolate mofetil-related gastrointestinal mucosal injury: variable injury patterns, including graft-versus-host disease-like changes. Am J Surg Pathol 2008; 32(9): 1367-1372.
141. Cotter MB, AbuShanab A, Merriman R, Mc - Cormick A, Sheahan K. Coeliac-like duodenal pathology in orthotopic liver transplant patients on mycophenolic acid therapy. Histopathology 2015; 66(4): 500-507.
142. Ramachandran A, Madesh M, Balasubramanian KA. Apoptosis in the intestinal epithelium: its relevance in normal and pathophysiological conditions. J Gastroenterol Hepatol 2000; 15(2): 109-120.
143. Iqbal N, Salzman D, Lazenby AJ, Wilcox CM. Diagnosis of gastrointestinal graft-versushost disease. Am J Gastroenterol 2000; 95(11): 3034-3038.
144. Lee FD. Importance of apoptosis in the histopathology of drug related lesions in the large intestine. J Clin Pathol 1993; 46(2): 118-122.
145. Iwamoto M, Koji T, Makiyama K, Kobayashi N, Nakane PK. Apoptosis of crypt epithelial cells in ulcerative colitis. J Pathol 1996; 180(2): 152-159.
146. Lempinen M, Halme L, Sarkio S, et al. CMV findings in the gastrointestinal tract in kidney transplantation patients, patients with endstage kidney disease and immunocompetent patients. Nephrol Dial Transplant 2009; 24(11): 3533-3539.
147. Kaufman SS, Magid MS, Tschernia A, Le - Leiko NS, Fishbein TM. Discrimination between acute rejection and adenoviral enteritis in intestinal transplant recipients. Transplant Proc 2002; 34(3): 943-945.
148. Nguyen T, Park JY, Scudiere JR, Montgomery E. Mycophenolic acid (cellcept and myofortic) induced injury of the upper GI tract. Am J Surg Pathol 2009; 33(9): 1355-1363.
149. Coyne JD, Campbell F. Microscopic features associated with mycophenolate mofetil in gastric and colonic biopsies. Histopathology 2012; 61(5): 993-997.
150. Epstein RJ, McDonald GB, Sale GE, Shulman HM, Thomas ED. The diagnostic accuracy of the rectal biopsy in acute graft-versushost disease: a prospective study of thirteen patients. Gastroenterology 1980; 78(4): 764 - 771.
151. Lee EY, Clouse RE, Aliperti G, De - Schryver-Kecskemeti K. Small intestinal lesion resembling graft-vs-host disease. A case report in immunodeficiency and review of the literature. Arch Pathol Lab Med 1991; 115(5): 529-532.
152. Pascal RR, Gramlich TL, Parker KM, Gansler TS. Geographic variations in eosinophil concentration in normal colonic mucosa. Mod Pathol 1997; 10(4): 363-365.
153. DeBrosse CW, Case JW, Putnam PE, Collins MH, Rothenberg ME. Quantity and distribution of eosinophils in the gastrointestinal tract of children. Pediatr Dev Pathol 2006; 9(3): 210-218.
154. Polydorides AD, Banner BF, Hannaway PJ, Yantiss RK. Evaluation of site-specific and seasonal variation in colonic mucosal eosinophils. Hum Pathol 2008; 39(6): 832-836.
155. Matsushita T, Maruyama R, Ishikawa N, et al. The number and distribution of eosinophils in the adult human gastrointestinal tract: a study and comparison of racial and environmental factors. Am J Surg Pathol 2015; 39(4): 521-527.
156. Talley NJ, Walker MM, Aro P, et al. Non-ulcer dyspepsia and duodenal eosinophilia: an adult endoscopic population-based case-control study. Clin Gastroenterol Hepatol 2007; 5(10): 1175-1183.
157. Lowichik A, Weinberg AG. A quantitative evaluation of mucosal eosinophils in the pediatric gastrointestinal tract. Mod Pathol 1996; 9(2): 110-114.
158. Rothenberg ME. Eosinophilic gastrointestinal disorders (EGID). J Allergy Clin Immunol 2004; 113(1): 11-28.
159. Lee CM, Changchien CS, Chen PC, et al. Eosinophilic gastroenteritis: 10 years experience. Am J Gastroenterol 1993; 88(1): 70-74.
160. Chen MJ, Chu CH, Lin SC, Shih SC, Wang TE. Eosinophilic gastroenteritis: clinical experience with 15 patients. World J Gastroenterol 2003; 9(12): 2813-2816.
161. Hallgren R, Colombel JF, Dahl R, et al. Neutrophil and eosinophil involvement of the small bowel in patients with celiac disease and Crohn’s disease: studies on the secretion rate and immunohistochemical localization of granulocyte granule constituents. Am J Med 1989; 86(1): 56-64.
162. Lanham JG, Elkon KB, Pusey CD, Hughes GR. Systemic vasculitis with asthma and eosinophilia: a clinical approach to the Churg - Strauss syndrome. Medicine (Baltimore) 1984; 63(2): 65-81.
163. Barbie DA, Mangi AA, Lauwers GY. Eosinophilic gastroenteritis associated with systemic lupus erythematosus. J Clin Gastroenterol 2004; 38(10): 883-886.
164. Valent P, Klion AD, Horny HP, et al. Contemporary consensus proposal on criteria and classification of eosinophilic disorders and related syndromes. J Allergy Clin Immunol 2012; 130(3): 607-612.
165. Hahn HP, Hornick JL. Immunoreactivity for CD25 in gastrointestinal mucosal mast cells is specific for systemic mastocytosis. Am J Surg Pathol 2007; 31(11): 1669-1676.
166. Kirsch R, Geboes K, Shepherd NA, et al. Systemic mastocytosis involving the gastrointestinal tract: clinicopathologic and molecular study of five cases. Mod Pathol 2008; 21(12): 1508-1516.
167. Sokol H, Georgin-Lavialle S, Grandpeix - Guyodo C, et al. Gastrointestinal involvement and manifestations in systemic mastocytosis. Inflamm Bowel Dis 2010; 16(7): 1247-1253.
168. Doyle LA, Sepehr GJ, Hamilton MJ, et al. A clinicopathologic study of 24 cases of systemic mastocytosis involving the gastrointestinal tract and assessment of mucosal mast cell density in irritable bowel syndrome and asymptomatic patients. Am J Surg Pathol 2014; 38(6): 832-843.
169. Saeed SA, Integlia MJ, Pleskow RG, et al. Tacrolimus - associated eosinophilic gastroenterocolitis in pediatric liver transplant recipients: role of potential food allergies in pathogenesis. Pediatr Transplant 2006; 10(6): 730-735.
170. Barak N, Hart J, Sitrin MD. Enalapril-induced eosinophilic gastroenteritis. J Clin Gastroenterol 2001; 33(2): 157-158.
171. Martin DM, Goldman JA, Gilliam J, Nasrallah SM. Gold-induced eosinophilic enterocolitis: response to oral cromolyn sodium. Gastroenterology 1981; 80(6): 1567-1570.
172. Hurrell JM, Genta RM, Melton SD. Histopathologic diagnosis of eosinophilic conditions in the gastrointestinal tract. Adv Anat Pathol 2011; 18(5): 335-348.
173. Rivasi F, Pampiglione S, Boldorini R, Cardinale L. Histopathology of gastric and duodenal Strongyloides stercoralis locations in fifteen immunocompromised subjects. Arch Pathol Lab Med 2006; 130(12): 1792-1798.
174. Couture C, Measures L, Gagnon J, Desbiens C. Human intestinal anisakiosis due to consumption of raw salmon. Am J Surg Pathol 2003; 27(8): 1167-1172.
175. Oddo D, Mendez GP, Retamal Y, Oddo A. Intestinal isosporiasis in patients with acquired immunodeficiency syndrome (AIDS). Pathologic diagnosis in small intestinal mucosal biopsies. Ann Diagn Pathol 2018; 33): 17-22.
176. Croese J, Wood MJ, Melrose W, Speare R. Allergy controls the population density of Necator americanus in the small intestine. Gastroenterology 2006; 131(2): 402-409.
177. Hesdorffer CS, Ziady F. Eosinophilic gastro - enteritis - a complication of schistosomiasis and peripheral eosinophilia? A case report and review of the pathogenesis. S Afr Med J 1982; 61(16): 591-593.
178. Black-Schaffer B. The tinctoral demonstration of a glycoprotein in Whipple’s disease. Proc Soc Exp Biol Med 1949; 72(1): 225-227.
179. Chears WC, Jr., Ashworth CT. Electron microscopic study of the intestinal mucosa in Whipple’s disease. Demonstration of encapsulated bacilliform bodies in the lesion. Gastroenterology 1961; 41 : 129-138.
180. Relman DA, Schmidt TM, MacDermott RP, Falkow S. Identification of the uncultured bacillus of Whipple’s disease. N Engl J Med 1992; 327(5): 293-301.
181. Wilson KH, Blitchington R, Frothingham R, Wilson JA. Phylogeny of the Whipple’s-disease - associated bacterium. Lancet 1991; 338(8765): 474-475.
182. Baisden BL, Lepidi H, Raoult D, et al. Diagnosis of Whipple disease by immunohistochemical analysis: a sensitive and specific method for the detection of Tropheryma whipplei (the Whipple bacillus) in paraffin - embedded tissue. Am J Clin Pathol 2002; 118(5): 742-748.
183. Newman B, Pope RH. A case of intestinal lipodystrophy, Whipple’s disease, simulating Boeck’s sarcoid. Gastroenterology 1948; 11(1): 120-126.
184. Rodarte JR, Garrison CO, Holley KE, Fontana RS. Whipple’s disease simulating sarcoidosis. A case with unique clinical and histologic features. Arch Intern Med 1972; 129(3): 479-482.
185. Trier JS, Phelps PC, Eidelman S, Rubin CE. Whipple’s disease: light and electron microscope correlation of jejunal mucosal histology with antibiotic treatment and clinical status. Gastroenterology 1965; 48(6): 684-707.
186. Ramaiah C, Boynton RF. Whipple’s disease. Gastroenterol Clin North Am 1998; 27(3): 683 - 695.
187. Haggerty CM, Britton MC, Dorman JM, Marzoni FA, Jr. Gastrointestinal histoplasmosis in suspected acquired immunodeficiency syndrome. West J Med 1985; 143(2): 244-246.
188. Alvarez-Nebreda ML, Alvarez-Fernandez E, Rada S, et al. Unusual duodenal presentation of leishmaniasis. J Clin Pathol 2005; 58(12): 1321-1322.
189. Kinchen K, Kinchen TH, Inglesby T, Jr. Pneumocystis carinii infection of the small intestine. J Natl Med Assoc 1998; 90(10): 625-627.
190. Sagaert X, Tousseyn T, De Hertogh G, Geboes K. Macrophage-related diseases of the gut: a pathologist’s perspective. Virchows Arch 2012; 460(6): 555-567.
191. Canani RB, Terrin G. Recent progress in congenital diarrheal disorders. Curr Gastroenterol Rep 2011; 13(3): 257-264.
192. Martin BA, Kerner JA, Hazard FK, Longacre TA. Evaluation of intestinal biopsies for pediatric enteropathy: a proposed immunohistochemical panel approach. Am J Surg Pathol 2014; 38(10): 1387-1395.
193. Groisman GM, Amar M, Livne E. CD10: a valuable tool for the light microscopic diagnosis of microvillous inclusion disease (familial microvillous atrophy). Am J Surg Pathol 2002; 26(7): 902-907.
194. Ruemmele FM, Schmitz J, Goulet O. Microvillous inclusion disease (microvillous atrophy). Orphanet J Rare Dis 2006; 1 : 22.
195. Bell SW, Kerner JA, Jr., Sibley RK. Microvillous inclusion disease. The importance of electron microscopy for diagnosis. Am J Surg Pathol 1991; 15(12): 1157-1164.
196. van der Velde KJ, Dhekne HS, Swertz MA, et al. An overview and online registry of microvillus inclusion disease patients and their MYO5B mutations. Hum Mutat 2013; 34(12): 1597-1605.
197. Goulet O, Salomon J, Ruemmele F, de Serres NP, Brousse N. Intestinal epithelial dysplasia (tufting enteropathy). Orphanet J Rare Dis 2007; 2 : 20.
198. Schnell U, Kuipers J, Mueller JL, et al. Absence of cell-surface EpCAM in congenital tufting enteropathy. Hum Mol Genet 2013; 22(13): 2566-2571.
199. Sivagnanam M, Mueller JL, Lee H, et al. Identification of EpCAM as the gene for congenital tufting enteropathy. Gastroenterology 2008; 135(2): 429-437.
200. Cortina G, Smart CN, Farmer DG, et al. Enteroendocrine cell dysgenesis and malabsorption, a histopathologic and immunohistochemical characterization. Hum Pathol 2007; 38(4): 570-580.
Štítky
Patologie Soudní lékařství Toxikologie
Článek 'PULMOPATOLOGIEČlánek 'PATOLOGIE ORL OBLASTIČlánek 'UROPATOLOGIEČlánek 'PATOLOGIE GITČlánek 'PATOLOGIE CNSČlánek 'GYNEKOPATOLOGIEČlánek 'KARDIOPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'ORTOPEDICKÁ PATOLOGIEČlánek 'CYTODIAGNOSTIKAČlánek 'PATOLOGIE GITČlánek 'HISTORIE PATOLOGIEČlánek 'HEMATOPATOLOGIEČlánek Jaká je vaše diagnóza?
Článek vyšel v časopiseČesko-slovenská patologie

2022 Číslo 2-
Všechny články tohoto čísla
- Endoskopická diagnostika nejčastějších nenádorových onemocnění gastrointestinálního traktu v pediatrii
- Kribriformně – morulární tyreoidální karcinom: vzácná jednotka
- Jaká je vaše diagnóza?
- Je obezita rizikovým faktorem aterosklerózy?
- Jaká je vaše diagnóza? Odpověď: Metastáza benigního pleomorfního adenomu příušní slinné žlázy do jater
- Histopatologická diagnostika nenádorových onemocnění trávicího traktu – 2. část
- Rozhodnutí stát se patoložkou nelituji
- 'PULMOPATOLOGIE
- 'PATOLOGIE ORL OBLASTI
- 'UROPATOLOGIE
- 'PATOLOGIE GIT
- 'PATOLOGIE CNS
- 'GYNEKOPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEPATOPATOLOGIE
- 'ORTOPEDICKÁ PATOLOGIE
- 'CYTODIAGNOSTIKA
- 'PATOLOGIE GIT
- 'HISTORIE PATOLOGIE
- 'HEMATOPATOLOGIE
- Diferenciální diagnostika nenádorových onemocnění žaludku
- Diferenciální diagnostika nenádorových onemocnění duodena
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika nenádorových onemocnění duodena
- Diferenciální diagnostika nenádorových onemocnění žaludku
- Kribriformně – morulární tyreoidální karcinom: vzácná jednotka
- Endoskopická diagnostika nejčastějších nenádorových onemocnění gastrointestinálního traktu v pediatrii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



